Similar presentations:
Характеристика металла Магний
1. ХАРАКТЕРИСТИКА МЕТАЛЛА МАГНИЙ
РАБОТУ ВЫПОЛНЯЛИ :2. ПОЛОЖЕНИЕ В ПСХЭ:
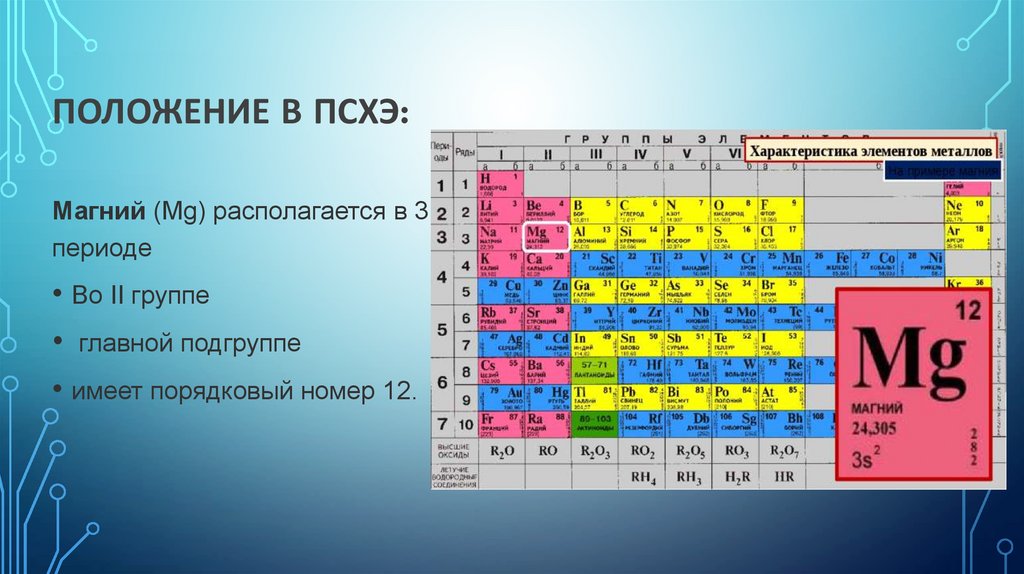
ПОЛОЖЕНИЕ В ПСХЭ:Магний (Mg) располагается в 3
периоде
• Во II группе
• главной подгруппе
• имеет порядковый номер 12.
3. СТРОЕНИЕ АТОМА МАГНИЯ
• Магний расположен в третьем периоде, значит, онимеет три оболочки, одна из которых внешняя,
содержащая валентные электроны. Атом магния
имеет положительно заряженное ядро (+12), в
котором имеется 12 протонов и 12 нейтронов
(разница между атомным весом и порядковым
номером). По орбитам вокруг ядра движутся 12
электронов.
• Электронную конфигурацию атома магния можно
записать двояко:
+12Mg)2)8)2;
1s22s22p63s2.
• Атомы магния в соединениях проявляют
валентность II.
• В соединениях магний проявляет степень
окисления +2.
4. ФИЗИЧЕСКИЕ СВОЙСТВА МАГНИЙ — ОЧЕНЬ ЛЕГКИЙ, ДОВОЛЬНО ХРУПКИЙ МЕТАЛЛ, ПОСТЕПЕННО ОКИСЛЯЕТСЯ НА ВОЗДУХЕ, ПРЕВРАЩАЯСЬ В БЕЛЫЙ ОКСИД
ФИЗИЧЕСКИЕ СВОЙСТВАМАГНИЙ — ОЧЕНЬ ЛЕГКИЙ, ДОВОЛЬНО ХРУПКИЙ МЕТАЛЛ, ПОСТЕПЕННО ОКИСЛЯЕТСЯ НА ВОЗДУХЕ,
ПРЕВРАЩАЯСЬ В БЕЛЫЙ ОКСИД МАГНИЯ. КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА Α-ФОРМЫ CA (УСТОЙЧИВОЙ ПРИ
ОБЫЧНОЙ ТЕМПЕРАТУРЕ) ГРАНЕЦЕНТРИРОВАННАЯ КУБИЧЕСКАЯ, А = 5,56Å. АТОМНЫЙ РАДИУС 1,97Å,
ИОННЫЙ РАДИУС CA2+, 1,04Å. ПЛОТНОСТЬ 1,74 Г/СМ³(20 °C). ВЫШЕ 464 °C УСТОЙЧИВА ГЕКСАГОНАЛЬНАЯ ΒФОРМА. TПЛ = 650 °C, TКИП = 1105 °C; ТЕМПЕРАТУРНЫЙ КОЭФФИЦИЕНТ ЛИНЕЙНОГО РАСШИРЕНИЯ 22•10-6 (0300 °C); ТЕПЛОПРОВОДНОСТЬ ПРИ 20 °C 125,6 ВТ/(М•К) ИЛИ 0,3 КАЛ/(СМ•СЕК•°C); УДЕЛЬНАЯ
ТЕПЛОЕМКОСТЬ (0-100 °C) 623,9 ДЖ/(КГ•К) ИЛИ 0,149 КАЛ/(Г•°C); УДЕЛЬНОЕ ЭЛЕКТРОСОПРОТИВЛЕНИЕ
ПРИ 20 °C 4,6•10-8 ОМ•М ИЛИ 4,6•10-6ОМ•СМ; ТЕМПЕРАТУРНЫЙ КОЭФФИЦИЕНТ
ЭЛЕКТРОСОПРОТИВЛЕНИЯ 4,57•10-3 (20 °C). МОДУЛЬ УПРУГОСТИ 26 ГН/М² (2600 КГС/ММ²); ПРЕДЕЛ
ПРОЧНОСТИ ПРИ РАСТЯЖЕНИИ 60 МН/М² (6 КГС/ММ²); ПРЕДЕЛ УПРУГОСТИ 4 МН/М² (0,4 КГС/ММ²), ПРЕДЕЛ
ТЕКУЧЕСТИ 38 МН/М² (3,8 КГС/ММ²); ОТНОСИТЕЛЬНОЕ УДЛИНЕНИЕ 50 %; ТВЕРДОСТЬ ПО БРИНЕЛЛЮ 200—
300 МН/М² (20-30 КГС/ММ²). МАГНИЙ ДОСТАТОЧНО ВЫСОКОЙ ЧИСТОТЫ ПЛАСТИЧЕН, ХОРОШО
ПРЕССУЕТСЯ, ПРОКАТЫВАЕТСЯ И ПОДДАЕТСЯ ОБРАБОТКЕ РЕЗАНИЕМ.
5. ПОЛУЧЕНИЕ :
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия
при 720–750°С: MgCl2–(эл.ток)à Mg + Cl2 или восстановлением прокаленного доломита в электропечах при
1200–1300°С: 2(CaO · MgO) + Si = 2Mg + Ca2SiO4. Кальций: минералы доломит CaCO3·MgCO3, кальцит
CaCO3, гипс CaSO4 · 2H2O.
6. ХИМИЧЕСКИЕ СВОЙСТВА МАГНИЯ:
1. Магний — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
2.При нагревании магний взаимодействует с галогенами с образованием галогенидов; при 500–600 oC
при взаимодействии с серой образуется MgS; при более высокой температуре возможно образование карбидов
MgC2 и Mg2C3, силицидов MgSi и Mg3Si2, фосфида Mg3P2. Нормальный электродный потенциал магния в
кислой среде составляет -2,37 в, в щелочной -2,69 в. Магний – сильный восстановитель, может вытеснить
большинство металлов из их солей, H2 из воды и кислот.
3.В результате взаимодействия магния с кислородом образуется окись магния MgO, которая имеет
кристаллическую структуру типа NaCl. Эта структура характеризуется сильной гетерополярной связью. Теплота
образования реакции равна 146,1 ккал/моль. He удивительно, что при такой высокой энергии образования
отсутствует растворимость кислорода в магнии.
4.При взаимодействии серы с металлами, например с магнием, образуется сульфид магния.
5.Реакция магния с водой протекает при обычных условиях. Mg + 2H2O → Mg(OH)2 + H2.
7.
6.Магнийреагирует
с
разбавленной
соляной
кислотой,
при
этом
образуются
хлорид
магния водород: Mg + 2HCl = MgCl2 + H2 ↑
6.1Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду: 4Mg
+ 10HNO3= 4Mg(NO3)2 + 2N2O↑ + 5H2O
6.2 В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид
магния и водород: Mg + H2S = MgS + H2
7.2Химические свойства солей магния. Большинство солей Магния хорошо растворимо в воде, например сульфат магния 2MgSO4
+ 2H2O = (MgOH)2SO4 + H2SO4 мало растворимы MgF2, MgCО3, Mg3(PO4)2 и некоторые двойные соли.
MgSO4+H2O=MgO+H2SO4 Комплексные соединения магния малоустойчивы и образуются обычно только в щелочной среде.
8.Магниетермия – это восстановление металлов из оксидов магнием. CuO + Mg = Cu + MgO.
8. СОЕДИНЕНИЯ МЕТАЛЛА
1)Оксиды:а) С холодной водой оксид магния реагирует очень медленно, но если реакцию
проводить с водяным паром, реакция пойдет быстрее.
MgO + H₂O (вода в виде горячего пара) → Mg(OH)₂
б) Растворение в кислотах: MgO + HCl (разб) → MgCl₂ + H₂O (для протекания
реакции нужны неконцентрированные кислоты)
MgO + H₂SO₄ → MgSO₄ + H₂O
В реакциях с кислотами MgO показывает общие войства окссидов (образуя соль
и воду).
9. СОЕДИНЕНИЯ МЕТАЛЛА
2)Гидроксиды:а) Гидроксид магния разлагается при температуре 350 — 480º С,
образуя на выходе оксид магния и воду:
Mg(OH)2 = MgO + H2O;
б) Гидроксид магния реагирует с кислотами:
Mg(OH)2 + 2HCl = MgCl2 + 2H2O .








 chemistry
chemistry








