Similar presentations:
Бериллий, магний, щелочноземельные металлы
1.
Бериллий, магний,щелочноземельные металлы
2.
Элементы IIA группыBe Mg Ca Sr Ba Ra
Щелочноземельные
металлы
Ra
― радиоактивный элемент
Радий-226 имеет период полураспада,
равный 1620 лет
3.
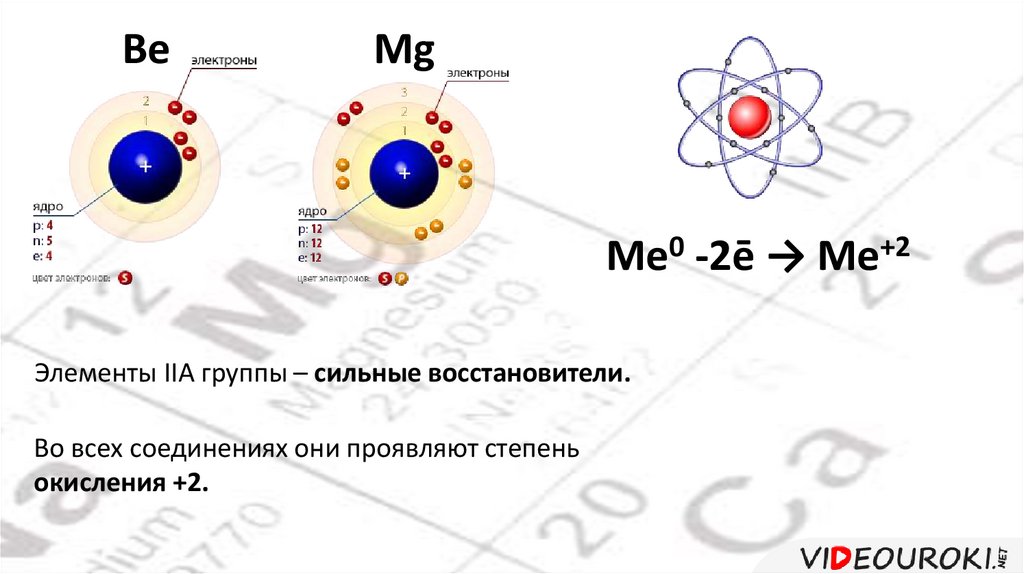
BeMg
Me0 -2ē → Me+2
Элементы IIA группы – сильные восстановители.
Во всех соединениях они проявляют степень
окисления +2.
4.
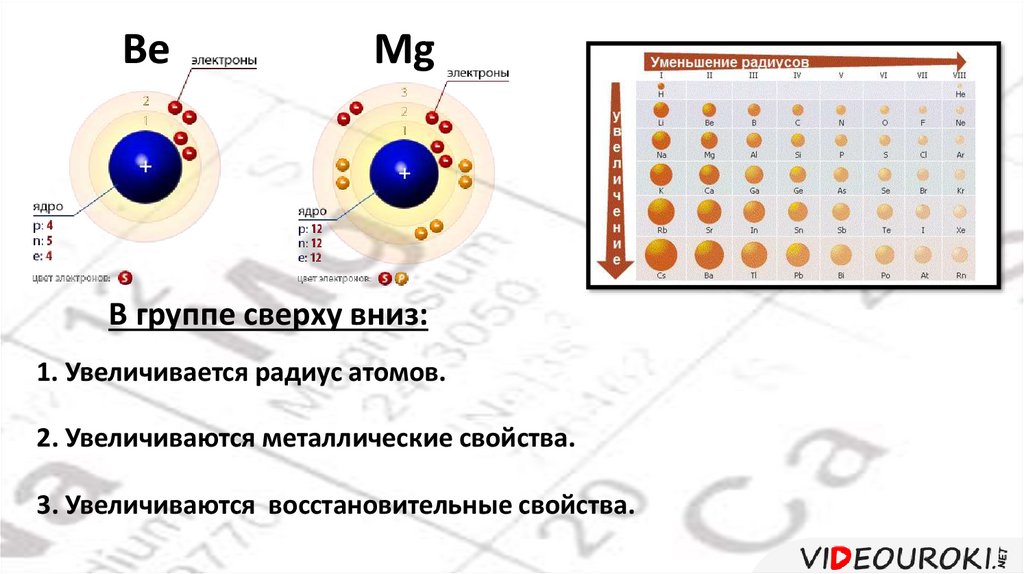
BeMg
В группе сверху вниз:
1. Увеличивается радиус атомов.
2. Увеличиваются металлические свойства.
3. Увеличиваются восстановительные свойства.
5.
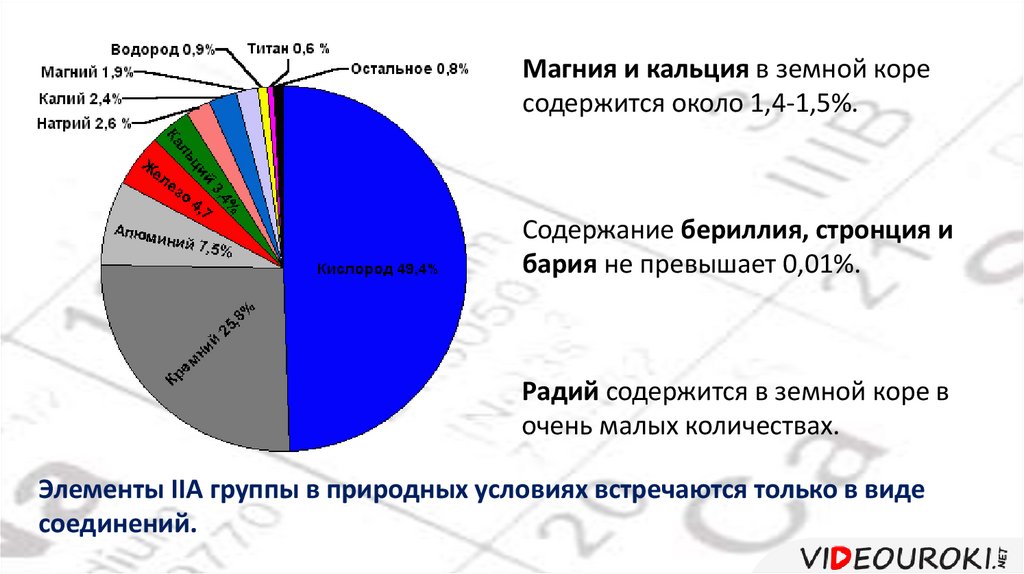
Магния и кальция в земной коресодержится около 1,4-1,5%.
Содержание бериллия, стронция и
бария не превышает 0,01%.
Радий содержится в земной коре в
очень малых количествах.
Элементы IIA группы в природных условиях встречаются только в виде
соединений.
6.
Физические свойства:Это типичные металлы с характерным металлическим блеском.
Представляют собой серебристо-белые металлы, а стронций имеет
золотистый оттенок.
Хорошо проводят теплоту и электрический ток.
Имеют довольно высокие температуры плавления.
Стронций твёрже бария, а барий по мягкости напоминает свинец.
7.
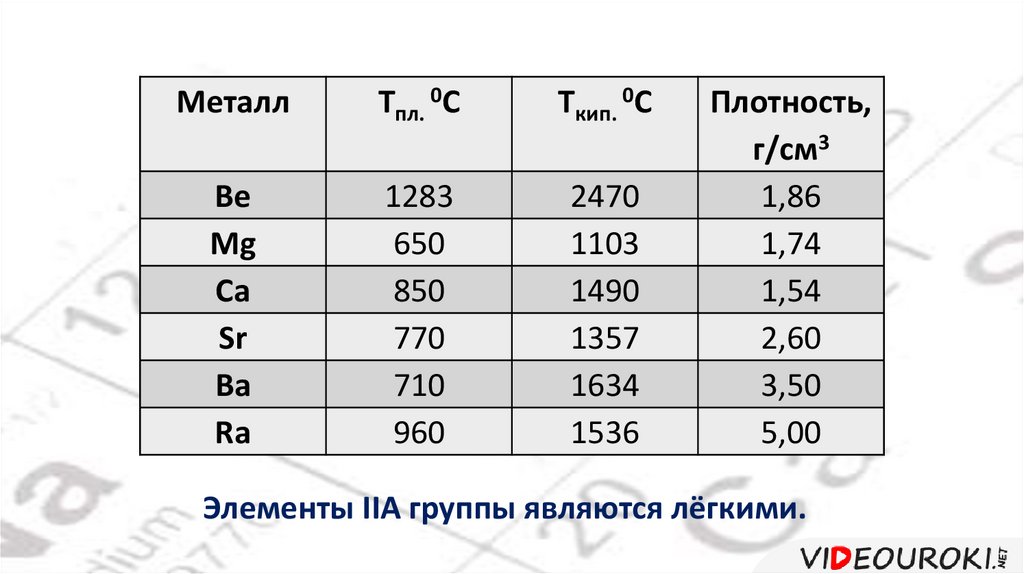
МеталлTпл. 0С
Tкип. 0С
Be
Mg
Ca
Sr
Ba
Ra
1283
650
850
770
710
960
2470
1103
1490
1357
1634
1536
Плотность,
г/см3
1,86
1,74
1,54
2,60
3,50
5,00
Элементы IIA группы являются лёгкими.
8.
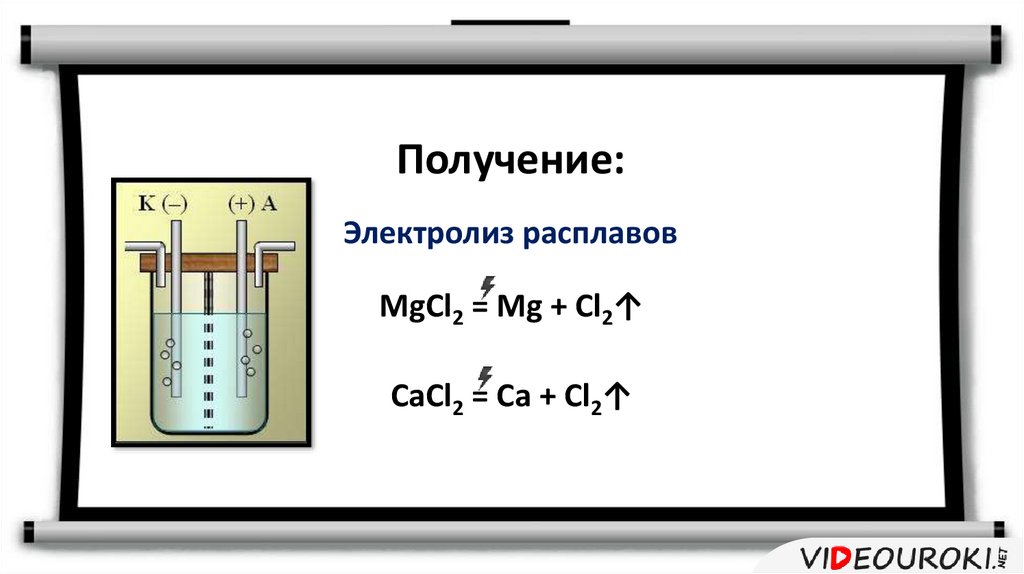
Получение:Электролиз расплавов
MgCl2 = Mg + Cl2↑
CaCl2 = Ca + Cl2↑
9.
Химические свойстваРеакции с кислородом
Be
+ O2 = Только при нагревании
Mg
0
0
t
+2 -2
2Ca + O2 = 2CaO
оксид
кальция
10.
Химические свойстваРеакции с азотом
Ra реагирует с азотом при комнатной
температуре.
0
0
t +2 -3
3Ba + N2 = Ba3N2
нитрид
бария
11.
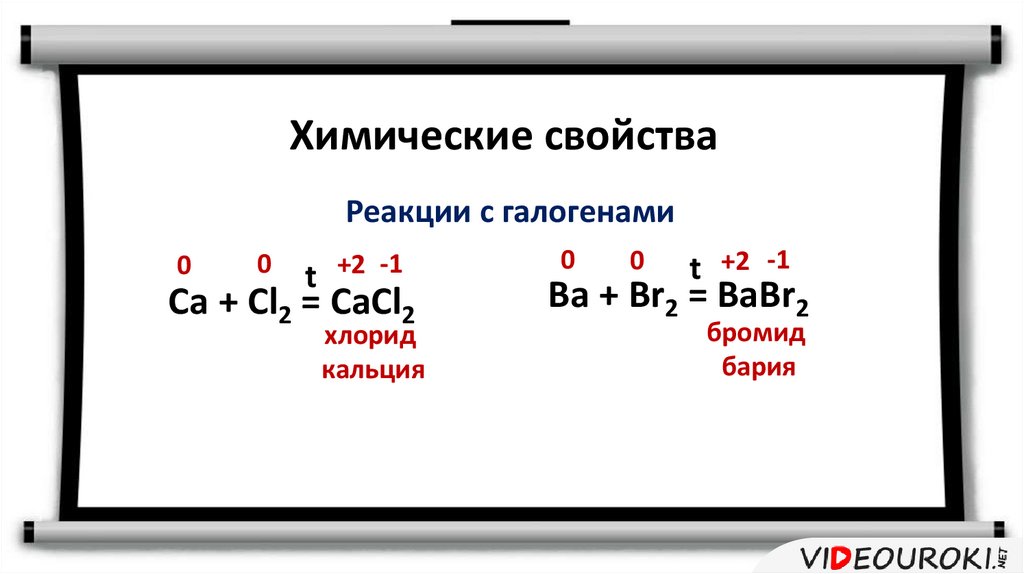
Химические свойстваРеакции с галогенами
0
0
t +2 -1
Ca + Cl2 = CaCl2
хлорид
кальция
0
0
t +2 -1
Ba + Br2 = BaBr2
бромид
бария
12.
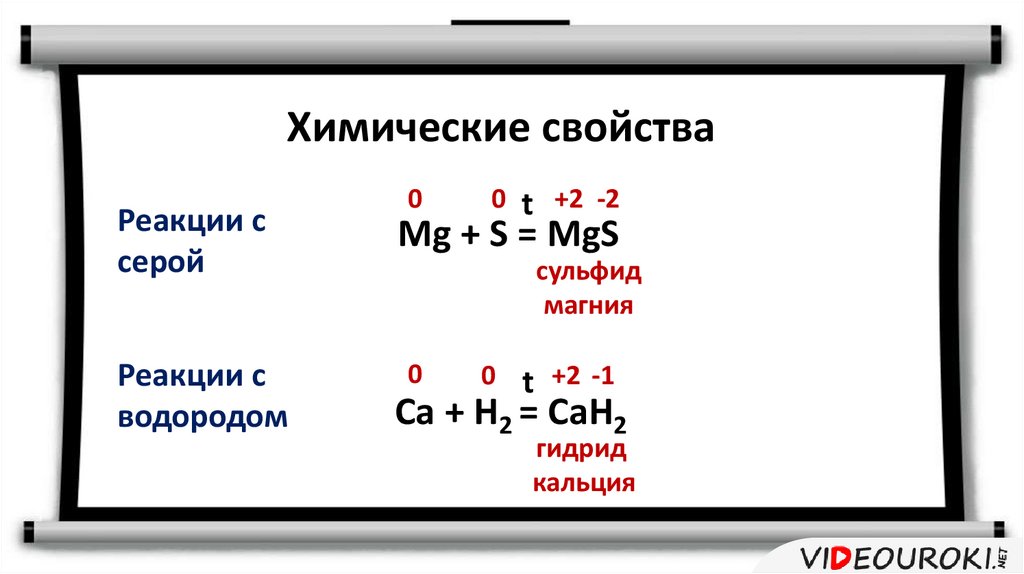
Химические свойстваРеакции с
серой
Реакции с
водородом
0
0 t +2 -2
Mg + S = MgS
сульфид
магния
0
0 t +2 -1
Ca + H2 = CaH2
гидрид
кальция
13.
Химические свойстваВе
Mg
Ca
Ba
Реакции с водой
Mg + 2H2O = Mg(OH)2 + H2↑
Sr
Ca + 2H2O = Ca(OH)2 + H2↑
Ba + 2H2O = Ba(OH)2 + H2↑
Sr + 2H2O = Sr(OH)2 + H2↑
14.
Химические свойстваРеакции с кислотами
Mg + HF ≠
Be + HNO3 ≠
Сa + H2SO4 = CaSO4 + H2↑
сульфат
кальция
Mg + 2HCl = MgCl2 + H2↑
хлорид
магния
15.
Химические свойстваРеакции с щелочами
Бериллий проявляет амфотерные свойства
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2↑
тетрагидроксобериллат
натрия
16.
Химические свойстваВосстановление металлов из их оксидов
Магниетермия
t
2Mg + TiO2 = 2MgO + Ti
Кальциетермия
t
5Ca + V2O5 = 5Ca + 2V
17.
Химические свойстваРеакции с растворами солей
Mg + FeSO4 = MgSO4 + Fe
18.
Нахождение в природеВ природе щелочноземельные металлы находятся только в виде
соединений.
Оксиды имеют состав MeO и гидроксиды состав Me(OH)2.
Основный характер оксидов и гидроксидов увеличивается в этой
группе сверху вниз.
Амфотерные BeO и Be(OH)2 → основные RaO и Ra(OH)2.
Гидроксиды бериллия и магния нерастворимы в воде, а гидроксиды
щелочноземельных металлов и радия являются щелочами.
19.
Оксиды элементов IIA группыОксиды их твёрдые, белые тугоплавкие вещества,
устойчивые к воздействию высоких температур.
MgO + H2O ≠
BaO + H2O = Ba(OH)2
гидроксид бария
CaO + H2O = Ca(OH)2
гидроксид кальция
Получение:
t
CaCO3 = CaO + CO2↑
t
MgCO3 = MgO + CO2↑
20.
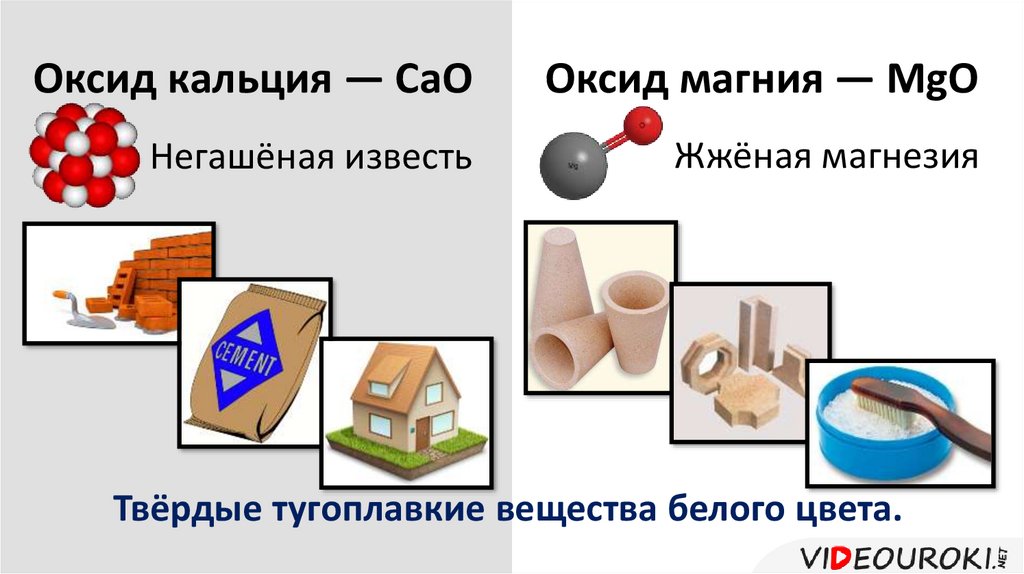
Оксид кальция ― СаООксид магния ― MgО
Негашёная известь
Жжёная магнезия
Твёрдые тугоплавкие вещества белого цвета.
21.
Химические свойства оксидовРеакции с
кислотами
MgO + 2HCl = MgCl2 + H2O
хлорид
магния
BeO + 2HCl = BeCl2 + H2O
хлорид
бериллия
Реакции со
щелочами
BeO + 2NaOH + H2O = Na2[Be(OH)4]
тетрагидроксобериллат
натрия
22.
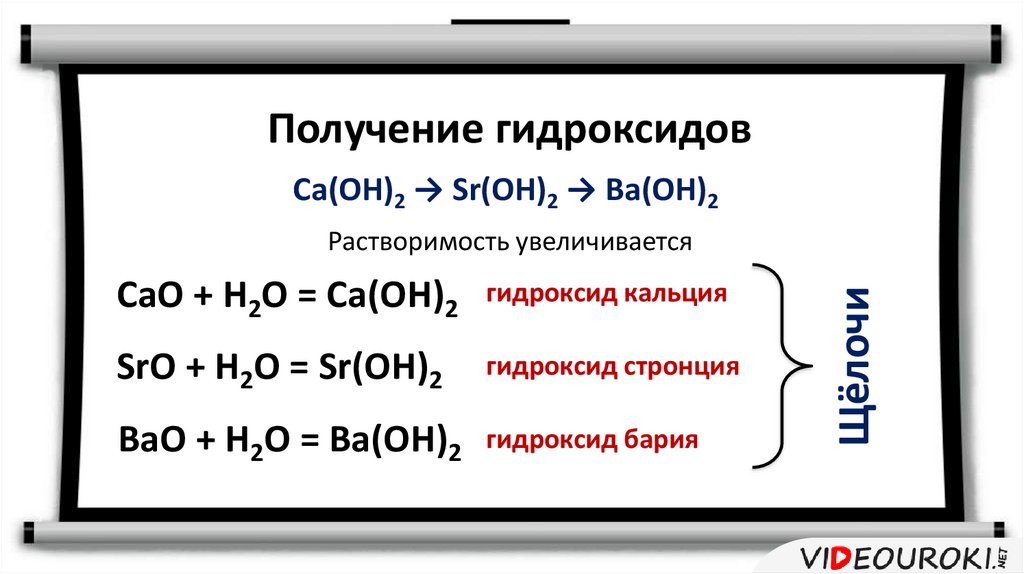
Получение гидроксидовCa(OH)2 → Sr(OH)2 → Ba(OH)2
CaO + H2O = Ca(OH)2
гидроксид кальция
SrO + H2O = Sr(OH)2
гидроксид стронция
BaO + H2O = Ba(OH)2
гидроксид бария
Щёлочи
Растворимость увеличивается
23.
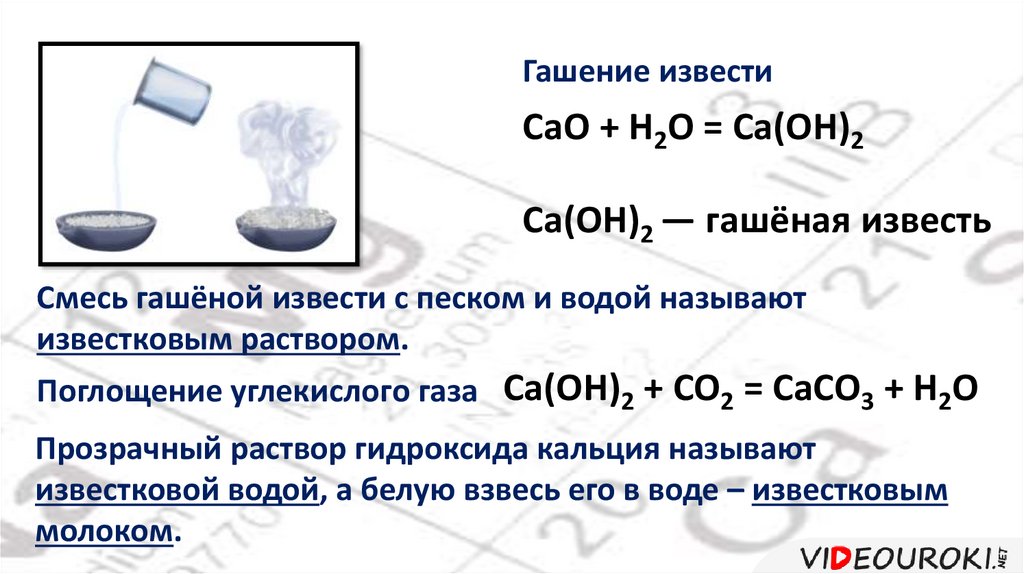
Гашение известиCaO + H2O = Ca(OH)2
Ca(OH)2 ― гашёная известь
Смесь гашёной извести с песком и водой называют
известковым раствором.
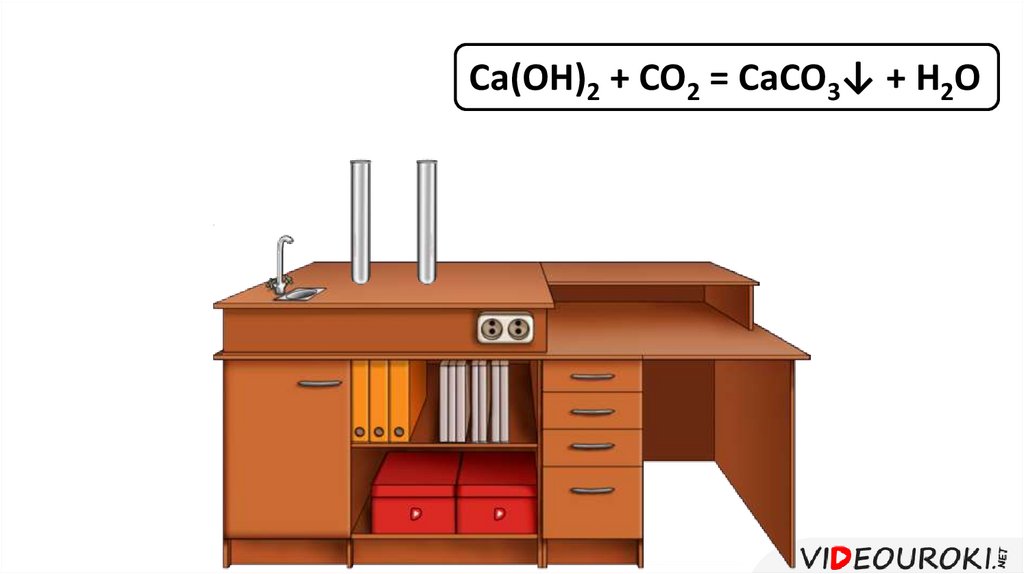
Поглощение углекислого газа Ca(OH)2 + CO2 = CaCO3 + H2O
Прозрачный раствор гидроксида кальция называют
известковой водой, а белую взвесь его в воде – известковым
молоком.
24.
Гашёная известьИзвестковое молоко
25.
CaO + H2O = Ca(OH)226.
27.
Ca(OH)2 + CO2 = CaCO3↓ + H2O28.
29.
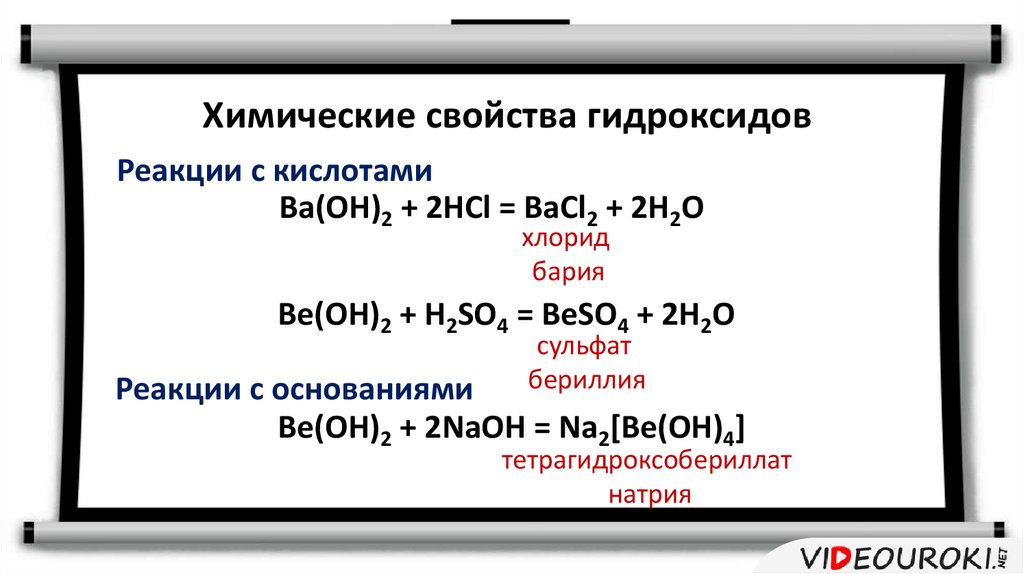
Химические свойства гидроксидовРеакции с кислотами
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
хлорид
бария
Be(OH)2 + H2SO4 = BeSO4 + 2H2O
сульфат
бериллия
Реакции с основаниями
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
тетрагидроксобериллат
натрия
30.
Соли бериллия, магния и щелочноземельных металловпредставляют собой белые кристаллические вещества, большинство
из них растворимы в воде.
Из сульфатов хорошо растворимы в воде только сульфаты бериллия и
магния.
Растворимость сульфатов уменьшается от BeSO4 к BaSO4.
Карбонаты этих металлов малорастворимы или нерастворимы в
воде.
Сульфиды щелочноземельных металлов, после предварительного
освещения начинают светиться различными цветами.
31.
32.
CaCO3 – карбонат кальцияМел, мрамор, известняк.
33.
34.
35.
36.
Известняк является прекрасным строительнымматериалом.
Известняк используется как сырьё для получения многих
материалов: цемента, гашёной и негашёной извести,
стекла.
Природный мел представляет собой остатки раковин
древних животных.
Мел используют при производстве школьных мелков,
зубной пасты, бумаги, резины и побелки.
37.
Карбонат магния – MgCO338.
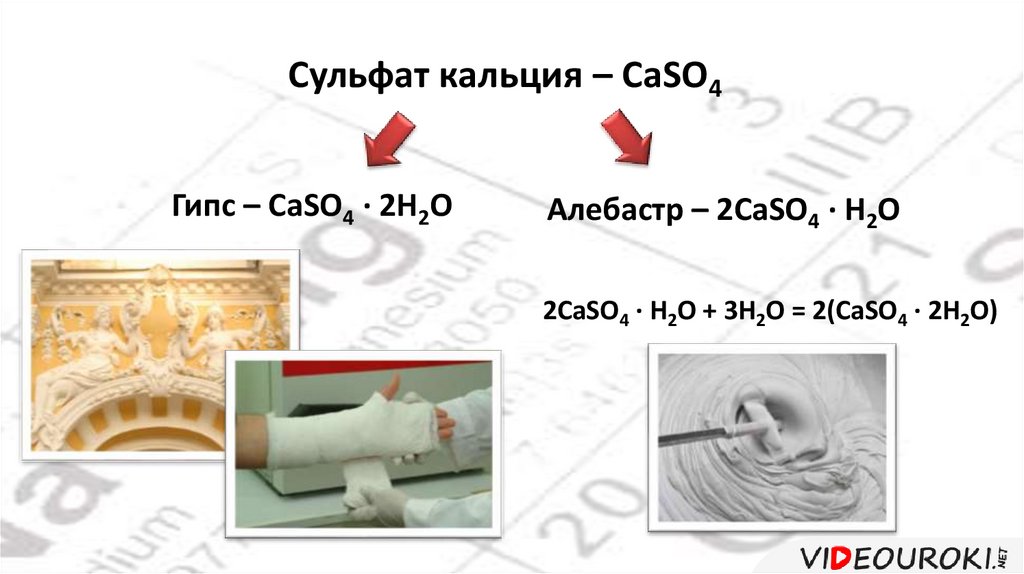
Сульфат кальция – CaSO4Гипс – CaSO4 · 2H2O
Алебастр – 2CaSO4 · H2O
2CaSO4 · H2O + 3H2O = 2(CaSO4 · 2H2O)
39.
Кристаллогидрат сульфата магния, горькая,или английская соль.
40.
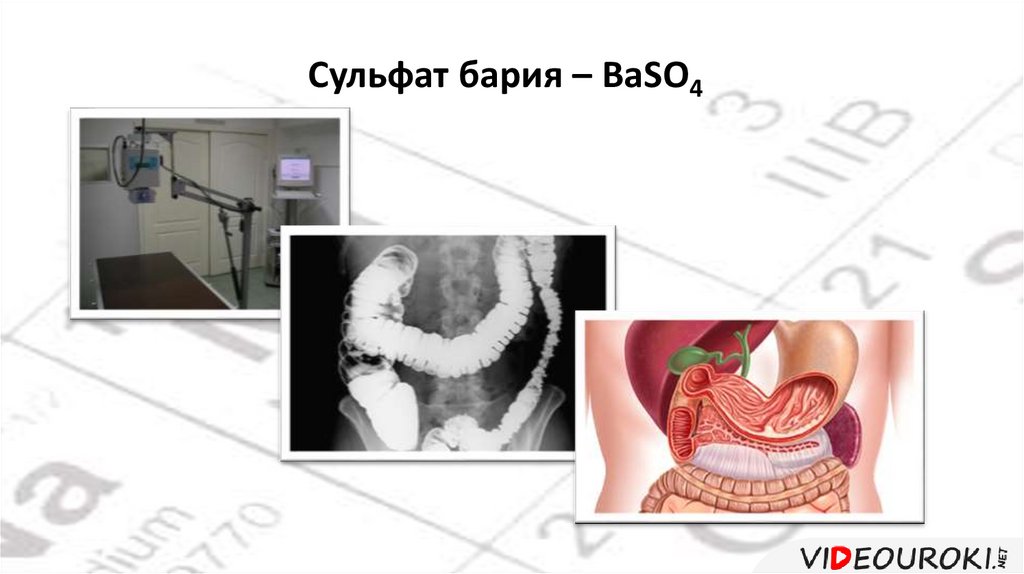
Сульфат бария – BaSO441.
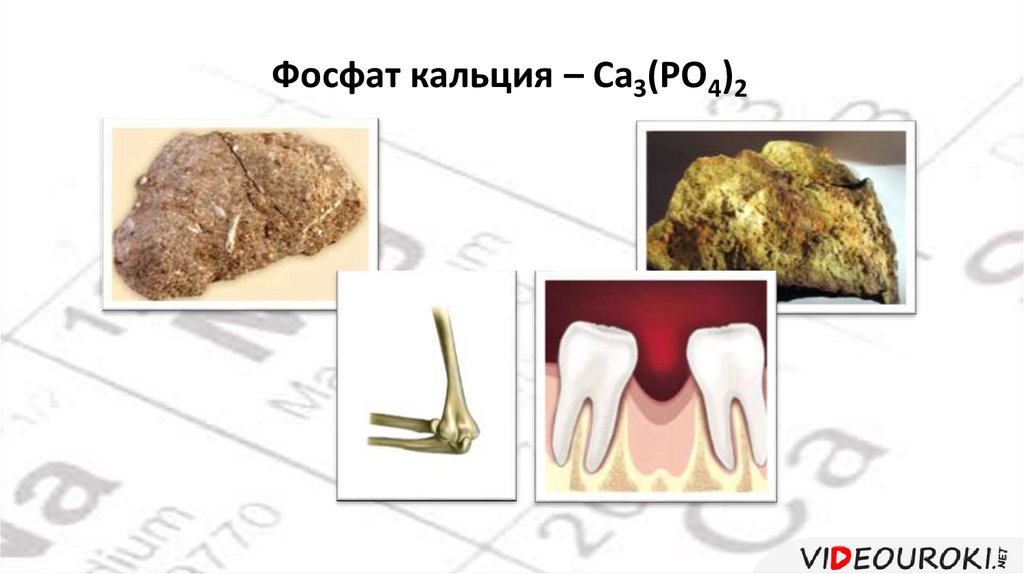
Фосфат кальция – Ca3(PO4)242.
• В организме человека содержится около 1 кг кальция в видефосфата кальция.
• Из кальция построен костный скелет.
• Ионы кальция необходимы для работы сердца, участвуют в
процессах свёртывания крови.
• На долю кальция приходится более
1,5% массы тела человека.
• 98% кальция содержится в костях,
который необходим и для работы
нервной системы.
43.
Человек должен получать в день 1,5 г кальция.44.
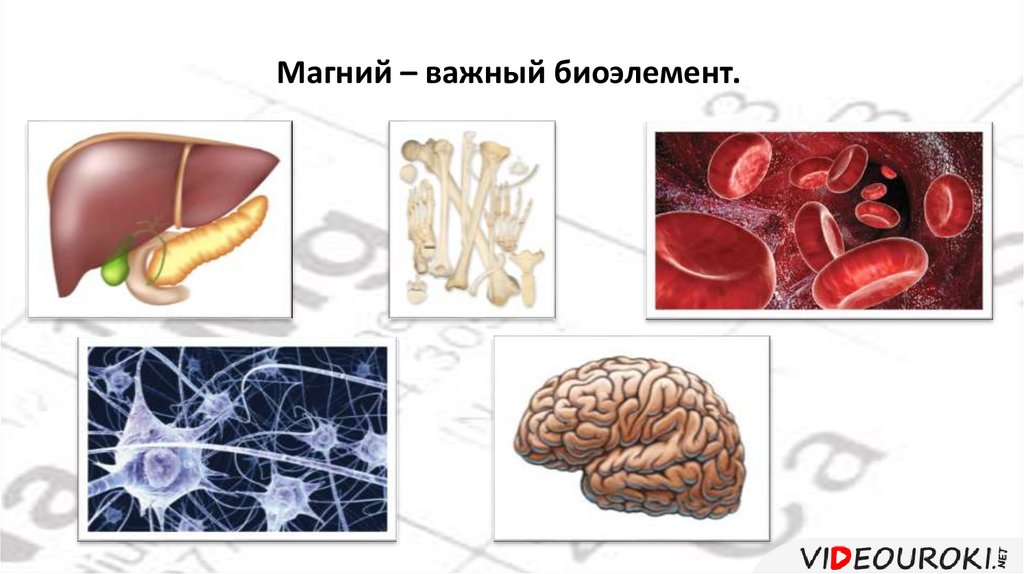
Магний – важный биоэлемент.45.
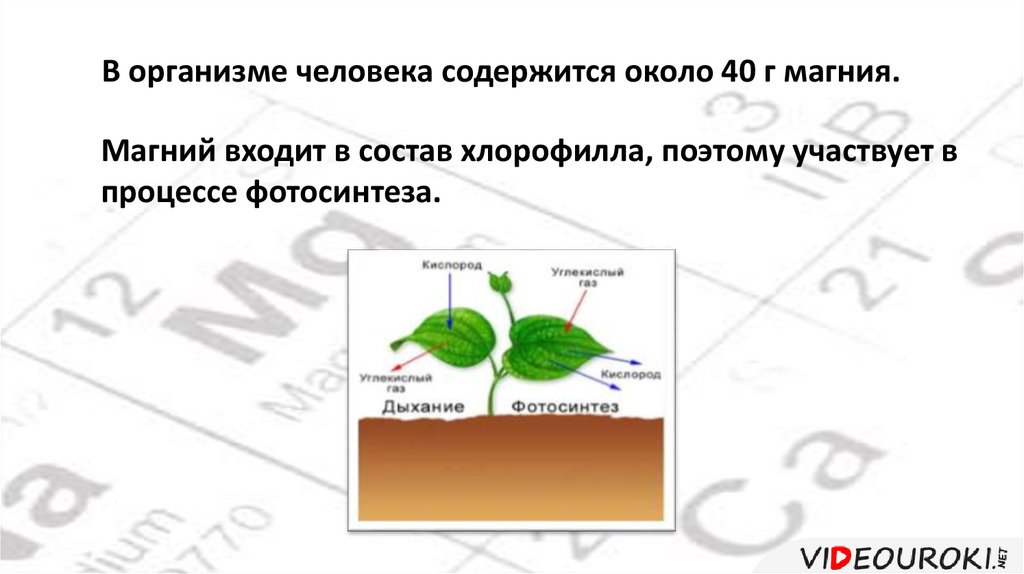
В организме человека содержится около 40 г магния.Магний входит в состав хлорофилла, поэтому участвует в
процессе фотосинтеза.
46.
Окраска пламени солямищелочноземельных металлов
Ca
Sr
Ba
47.
Магний был получен в 1808 г.из белой магнезии.
Чистый магний был получен в
1829 г. А. Бюсси.
Г. Дэви
48.
Кальций впервые был полученв 1808 г.
Название было дано от
латинского слова кальс, что
означает «известь, мягкий
камень».
Г. Дэви
49.
Элементы IIA группы имеют на внешнем энергетическомуровне два электрона.
Они являются восстановителями.
В соединениях они проявляют степень окисления, равную
+2.
В группе сверху вниз увеличиваются радиусы атомов,
восстановительные и металлические свойства.
Они обладают высокой химической активностью, поэтому
встречаются в природе в виде соединений.
50.
Для них характерны такие физические свойства, какметаллический блеск, тепло- и электропроводность, они
лёгкие, температуры плавления у них выше, чем у
щелочных металлов.
Они реагируют с неметаллами, водой, кислотами.
Наиболее распространённые их соединения – оксиды,
гидроксиды и соли.
51.
Оксид бериллия и его гидроксид обладает амфотернымисвойствами, оксид и гидроксид магния – слабыми
основными, у остальных оксидов и гидроксидов ярко
выражены основные свойства.
Соли этих элементов играют большое значение, такие как
карбонат кальция, сульфат магния, фосфат кальция,
сульфат бария и др.






























 chemistry
chemistry








