Similar presentations:
Щелочноземельные металлы. Металлы II А подгруппы
1.
Щелочноземельныеметаллы
Металлы II А погруппы
2.
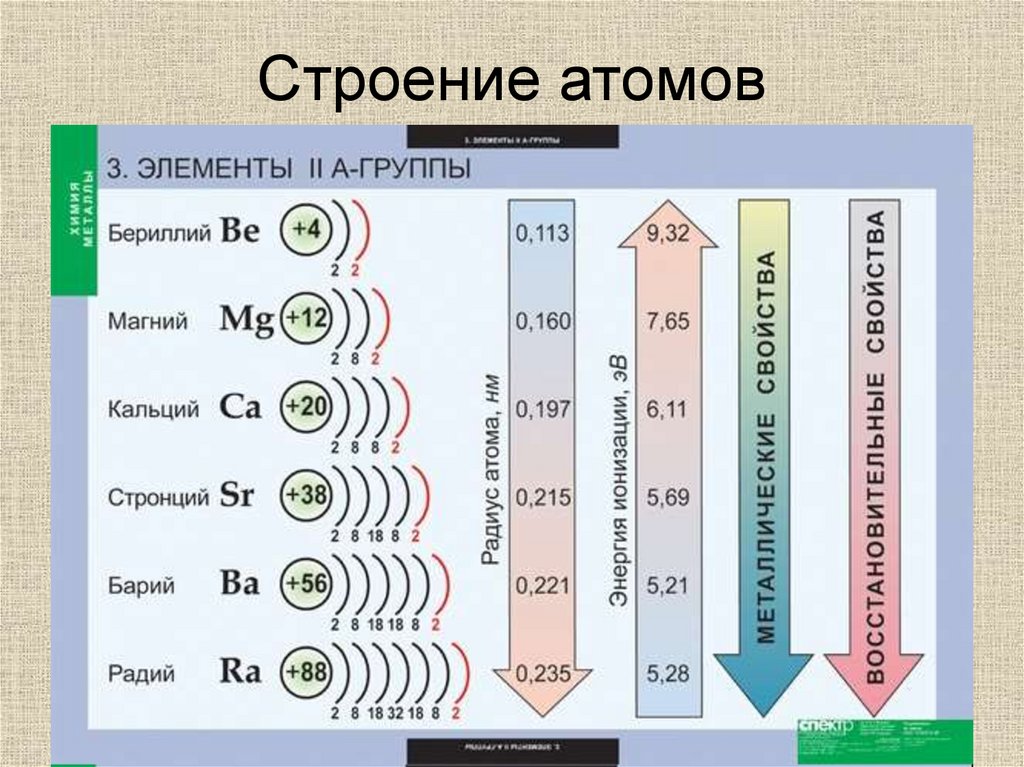
4Бериллий
Be
9,012
2s2
12
Магний
Строение атомов
• Общая электронная формула ns2
Mg
24,305
3s2
20
Кальций
Ca
• Валентность II
40,078
4s2
38
Стронций
• Степень окисления +2
Sr
87,62
5s2
56
Барий
Ba
• Восстановительные свойства
137,327
6s2
88
Радий
Ra
(226)
7s2
• Менее реакционно-способны, чем
щелочные металлы
3.
Строение атомов4.
Физические свойства• серебристо-белые блестящие металлы,
твердость значительно выше, чем у
щелочных металлов.
5.
Be• 3BeO • Al2O3 • 6SiO2 –
• берилл
6.
Mg• MgCO3 – магнезит
• CaCO3 • MgCO3 – доломит
• KCl • MgSO4 • 3H2O – каинит
• KCl • MgCl2 • 6H2O – карналлит
7.
Ca• CaCO3 – кальцит
• (известняк, мрамор и др.)
• Ca3(PO4)2 – апатит, фосфорит
• CaSO4 • 2H2O – гипс
• CaSO4 – ангидрит
• CaF2 – плавиковый шпат
• (флюорит)
8.
Sr, Ba и Ra• SrSO4 – целестин
• SrCO3 – стронцианит
• BaSO4 – барит
• BaCO3 – витерит
• во всём мире удалось
добыть всего 1,5 кг
чистого радия
9.
Химические свойства1. Все металлы образуют оксиды RO, барийпероксид – BaO2
2Me +O2 → 2MeO
2. Бериллий и магний сравнительно медленно
реагируют с неметаллами
Me +H2 → MeH2
Me +Cl2 → MeCl2
Me +S → MeS
10.
Химические свойства3. Растворяются в кислотах:
Me +2HCl → MeCl2 + H2
Бериллий растворяется в водных растворах
щелочей
4. В обычных условиях поверхность Be и Mg
покрыта инертной оксидной пленкой,
поэтому они устойчивы по отношению к
воде.
Ca, Sr и Ba растворяются в воде с
образованием гидроксидов Me +2HOH →
Me(OH)2 +Н2
11.
• Качественная реакция на катионыщелочноземельных металлов –
окрашивание пламени в следующие
цвета:
• Ca2+ - темно-оранжевый
• Sr2+- темно-красный
• Ba2+ - светло-зеленый
12.
13.
Соединениящелочноземельных
металлов
14.
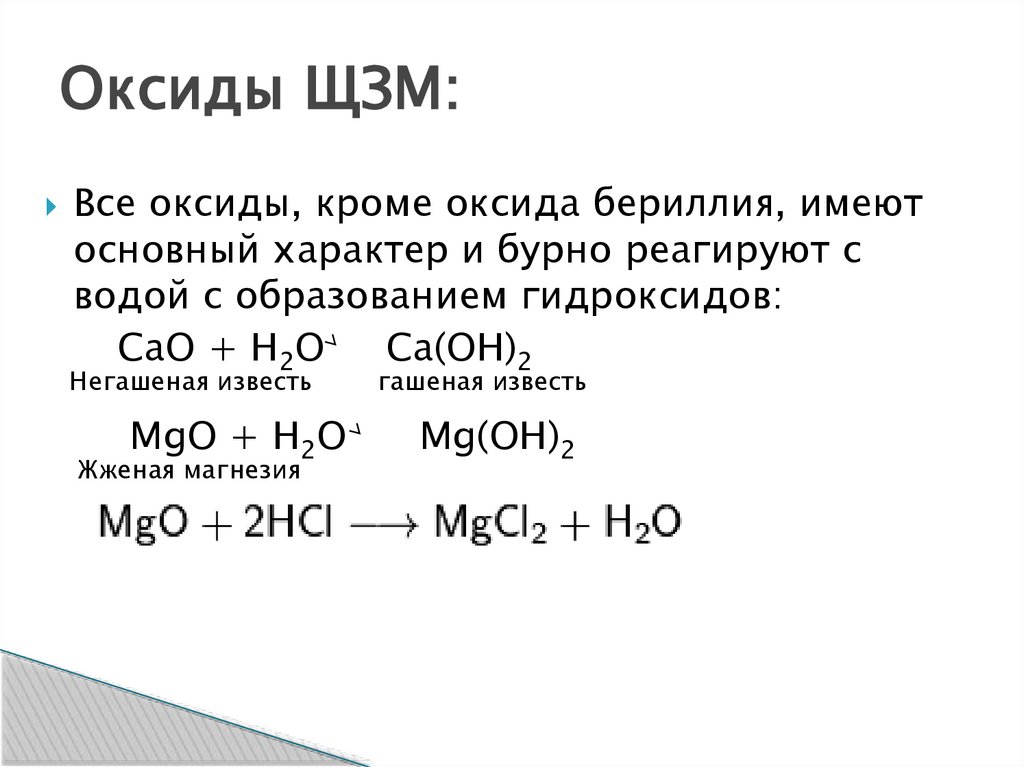
Оксиды ЩЗМ:Все оксиды, кроме оксида бериллия, имеют
основный характер и бурно реагируют с
водой с образованием гидроксидов:
CaO + H2O
Ca(OH)2
Негашеная известь
MgO + H2O
Жженая магнезия
гашеная известь
Mg(OH)2
15.
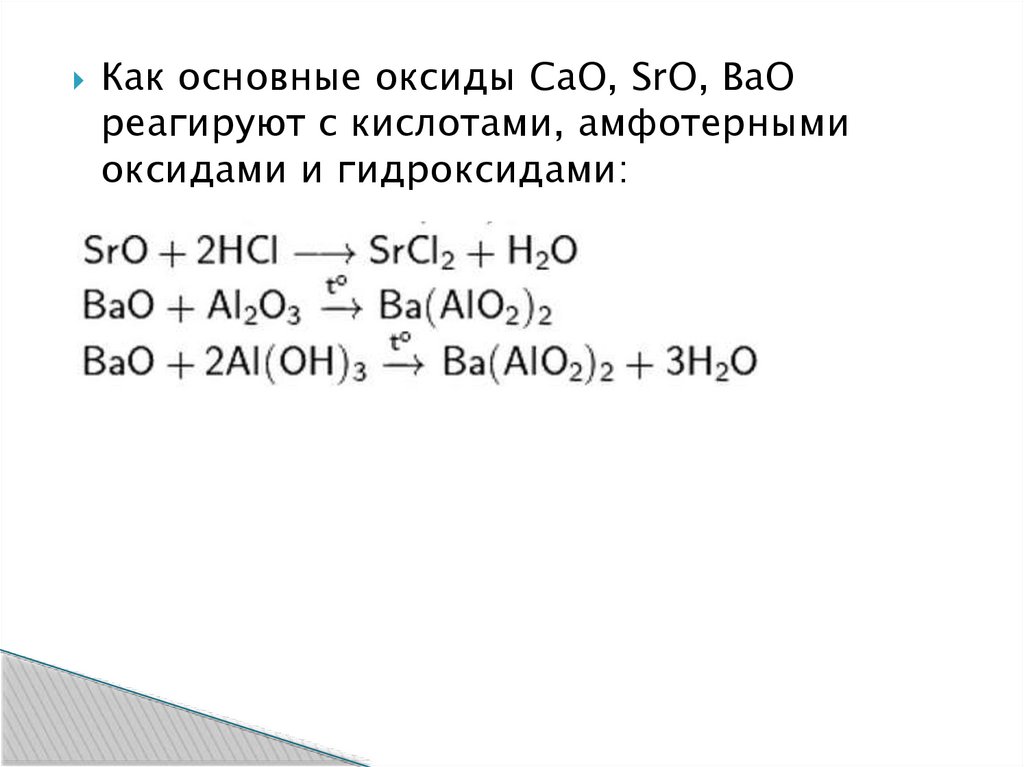
Как основные оксиды CaO, SrO, BaOреагируют с кислотами, амфотерными
оксидами и гидроксидами:
16.
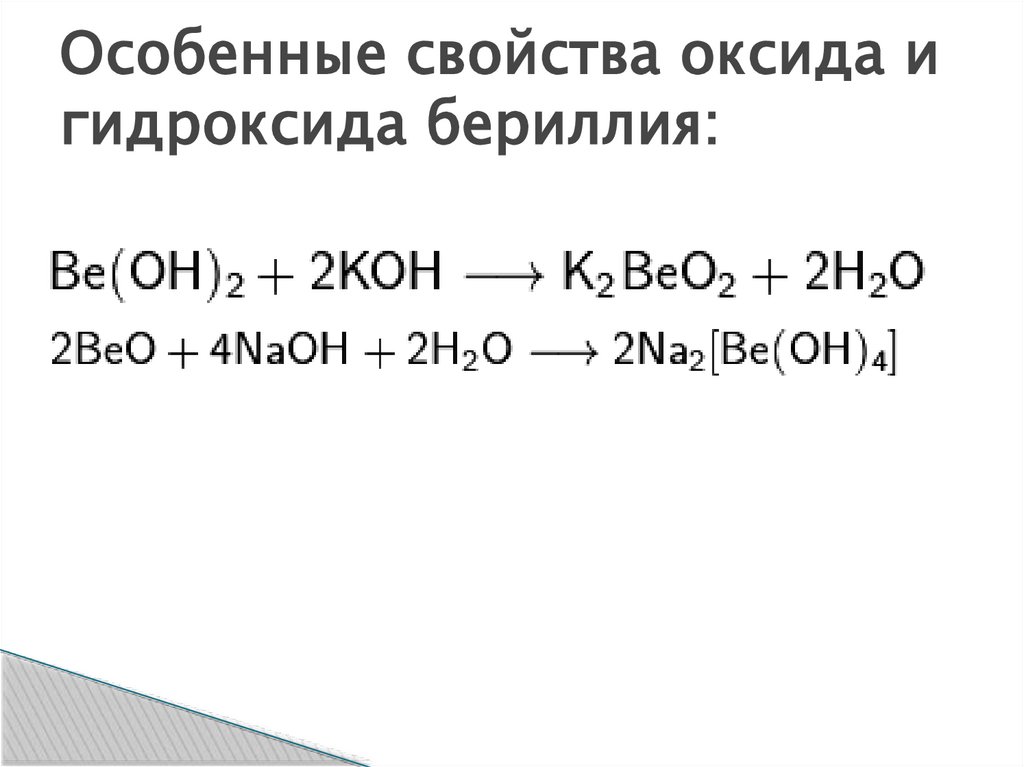
Особенные свойства оксида игидроксида бериллия:
17.
Гидроксиды магния, кальция, стронция, барияи радия — основания, сила увеличивается от
слабого Mg(OH)2 до очень сильного Ra(OH)2.
Хорошо растворяются в воде (кроме
гидроксидов магния и кальция). Для них
характерны реакции с кислотами и кислотными
оксидами и с амфотерными оксидами и
гидроксидами:
18.
Карбонат кальция (CaCO3)Известняк — широко распространённая
осадочная порода,
образующаяся
при участии живых
организмов в морских
бассейнах.
Применяется в качестве
строительного материала,
мелкозернистые
разновидности
используют для создания
скульптур. Обжиг известняка
даёт негашеную известь.
19.
Мрамор используется как камень дляпамятников, как штучный строительный
камень для наружной облицовки и
внутренней отделки зданий и в виде
дроблёного и молотого камня. Мраморная
Дева Мария из мрамора в
мука
исполнении Джованни
находит применение
в сельском
Страцца, середина
XIX
века.
хозяйстве.
20.
MgCO3 – карбонат магния.Основной карбонат
магния 3MgCO3·Mg(OH)2·3H2O (так
называемая белая магнезия) применяют как
наполнитель в резиновых смесях, для
изготовления теплоизоляционных материалов. В
медицине. В спорте используется для
подсушивания рук. Карбонат магния необходим
в производстве стекла, цемента, кирпича.
21.
Сульфат кальция (CaSO4) гипсИспользуют в строительстве, медицине, для
изготовления сувениров.
22.
Значение кальция для организмачеловека
Зубы и кости: главная функция
макроэлемента – функция структурного
материала, создание и поддержание
полноценных зубов и костей.
Сокращение мышечной ткани: кальций
оказывает влияние на сокращения мышц и,
действуя на сердечную мышцу,
координирует сердцебиение.
ЦНС: требуется для передачи нервных
импульсов.
Сердечно-сосудистая система: вместе
с магнием, калием, натрием кальций
регулирует давление крови.
Система крови: усиливает

















 chemistry
chemistry








