Similar presentations:
Реакционная способность аренов
1.
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯАКАДЕМИЯ
КАФЕДРА ОБЩЕЙ И БИООРГАНИЧЕСКОЙ ХИМИИ
ОРГАНИЧЕСКАЯ ХИМИЯ
Лекция 7
Реакционная способность аренов.
1. Классификация. Изомерия. Номенклатура.
2. Физические свойства.
3. Способы получения.
4. Химические свойства. Реакции SE
5. Правила ориентации в бензольном ядре.
6. Реакции присоединения. Реакции окисления.
7. Реакционная способность многоядерных аренов
Лектор: кандидат биологических наук, доцент
Атавина Ольга Васильевна
2. Классификация. Изомерия. Номенклатура
1. Арены. Классификация• Арены – это карбоциклические углеводороды, в
молекулах которых имеется особая циклическая
группировка из шести атомов углерода, называемая
бензольным или ароматическим ядром
3. Классификация. Изомерия. Номенклатура
• По числу бензольных колец в молекуле ареныподразделяются на моноядерные и многоядерные. К
моноядерным относятся соединения с одним бензольным кольцом в молекуле. У многоядерных аренов
бензольные кольца могут быть конденсированными
(как, например, в нафталине) или изолированными.
Изолированные кольца могут быть непосредственно
связаны друг с другом (бифенил) или разделены
атомами углерода (дифенилметан):
4. Классификация. Изомерия. Номенклатура
5. Классификация. Изомерия. Номенклатура
• Отдельную группу составляют небензоидныеароматические соединения, в которых эффект
сопряжения наблюдается в пяти- и семичленных
карбоциклах с числом π-электронов, соответствующим
правилу Хюккеля. К ним относятся углеводород азулен,
а также устойчивые ароматические ионы — циклопентадиенид-ион и тропилий-катион (сами
углеводороды — циклопентадиен-1,3 и
циклогептатриен-1,3,5 не являются ароматическими):
6. Классификация. Изомерия. Номенклатура
Номенклатура и изомерия аренов•Первым членом гомологического ряда аренов является
бензол, который при составлении названий по
заместительной номенклатуре принимается за
родоначальную структуру. Заместители обозначаются в
виде префиксов с указанием их месторасположения в
бензольном ядре. В ряду аренов сохранились и
тривиальные названия (приведены ниже в скобках).
7. Классификация. Изомерия. Номенклатура
• Положения заместителей указывают наименьшимицифрами (направление нумерации не имеет значения),
а для дизамещенных соединений в положениях 1,2-,
1,3- и 1,4- можно использовать обозначения о- (орто-),
м- (мета-) и п- (пара-) соответственно:
8. Классификация. Изомерия. Номенклатура
• Из более чем 30 родоначальных структурконденсированных аренов наиболее часто встречаются
четыре:
• Радикалы Аренов называются арильными радикалами.
Радикал бензола называют фенил С6Н5-, толуола –
толил СН3С6Н4-
9. Классификация. Изомерия. Номенклатура
• Изомерия монозамещенных аренов обусловленастроением углеродного скелета заместителя,
примерами являются пропилбензол и изопропилбензол
(кумол). У ди- и полизамещенных гомологов бензола
добавляется еще изомерия, вызванная различным
расположением заместителей в ядре. Ниже приведен
ряд изомерных ароматических углеводородов состава
С9Н12:
10. Физические свойства
2. Физические свойства моноциклических аренов.Отдельные представители и их применение
• Бензол и его ближайшие гомологи – бесцветные
жидкости со специфическим запахом. Ароматические
углеводороды легче воды и в ней не растворяются,
однако легко растворяются в органических
растворителях – спирте, эфире, ацетоне. Такие
константы, как плотность и показатель преломления, у
аренов выше, чем у алканов и алкенов. Температуры
кипения аренов закономерно возрастают с
увеличением молярной массы. Температуры плавления
в значительной степени зависят от симметричности
строения арена. Симметричные арены компактнее
упакованы в кристаллической решетке и имеют более
высокие температуры плавления.
11. Физические свойства
• Бензол С6Н6 — бесцветная жидкость с характернымзапахом, легче воды. Бензол широко используется в
промышленной органической химии в качестве
растворителя и сырья для синтеза красителей,
полимеров, взрывчатых веществ, поверхностноактивных веществ, лекарственных препаратов. Бензол
растворяет жиры, полимеры, нефтепродукты, масла,
лаки. Бензол токсичен, вдыхание его паров вызывает
острое отравление, приступы головокружения,
судороги. При хроническом отравлении бензол
поражает почки, печень, костный мозг, приводит к
уменьшению в крови эритроцитов.
12. Физические свойства
• Толуол С6Н5СН3 — бесцветная жидкость,нерастворимая в воде. Применяется в производстве
взрывчатых веществ (тринитротолуол), красителей, лекарственных веществ, бензойной кислоты, сахарина,
лаков, типографских красок. Толуол употребляется в
качестве добавки к моторному топливу как компонент
высокооктановых бензинов. Толуол примерно на два
порядка менее токсичен, чем бензол, вследствие того
что окисляется в организме в бензойную кислоту и
экскретируется из организма. Во всех случаях, где это
возможно, следует производить замену бензола на
толуол.
13. Физические свойства
• Кумол С6Н5СН(СН3)2 — важный промежуточныйпродукт в процессе получения фенола и ацетона из
бензола кумольным способом.
• Стирол С6Н5СН=СН2 — жидкость с приятным запахом.
Стирол легко по-лимеризуется с образованием
полистирола, применяющегося в качестве электроизоляционного материала. При сополимеризации с
бутадиеном получают некоторые виды синтетических
каучуков. Полистирольные полимеры, в бензольные
кольца которых введены различные функциональные
группы (—SO3H, —N(CH3)3+), используются в качестве
ионообменных смол.
14. Физические свойства
• Ксилолы (диметилбензолы) получают из продуктовсухой перегонки каменного угля в виде смеси орто-,
мета- и пара-ксилолов. Смесь ксилолов используют в
качестве компонента высокооктановых бензинов и
растворителей в лакокрасочной промышленности. Для
многих целей смесь ксилолов разделяют и используют
отдельные изомеры. Так, пара-ксилол окислением
превращают в терефталевую кислоту, применяемую
для получения полиэфиров.
15. Способы получения
3. Способы получения аренов• Известны следующие способы получения
ароматических углеводородов.
• 1) Каталитическая дегидроциклизация алканов, т.е.
отщепление водорода с одновременной циклизацией
(способ Б.А.Казанского и А.Ф.Платэ). Реакция
осуществляется при повышенной температуре с
использованием катализатора, например оксида хрома.
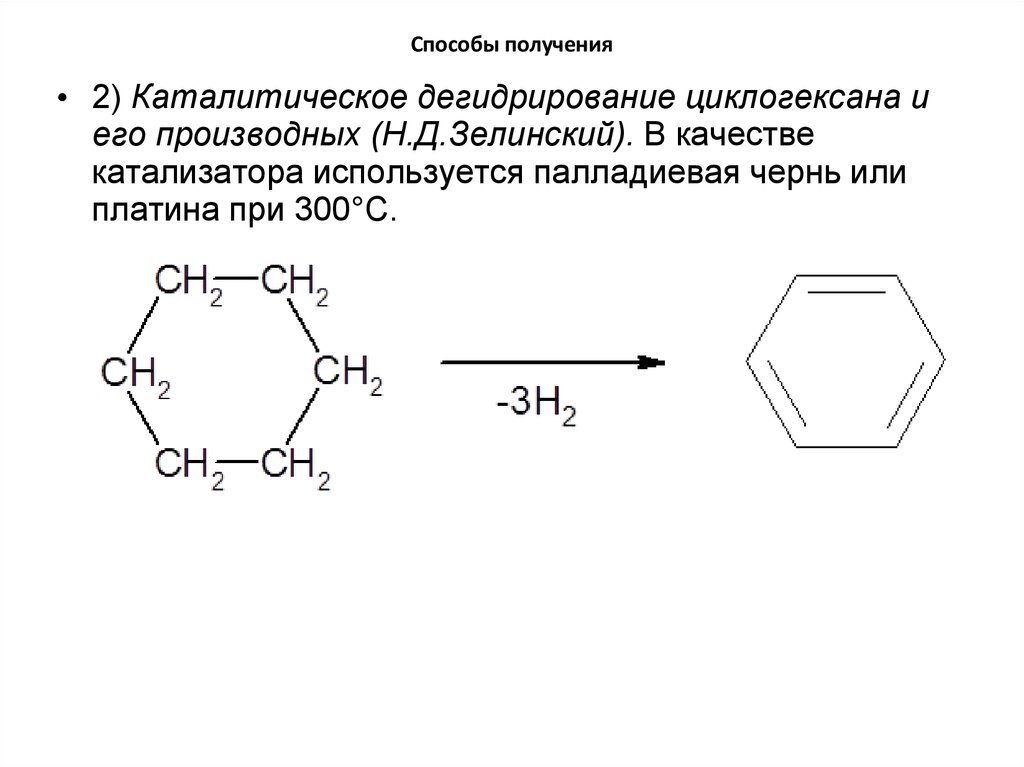
16. Способы получения
• 2) Каталитическое дегидрирование циклогексана иего производных (Н.Д.Зелинский). В качестве
катализатора используется палладиевая чернь или
платина при 300°C.
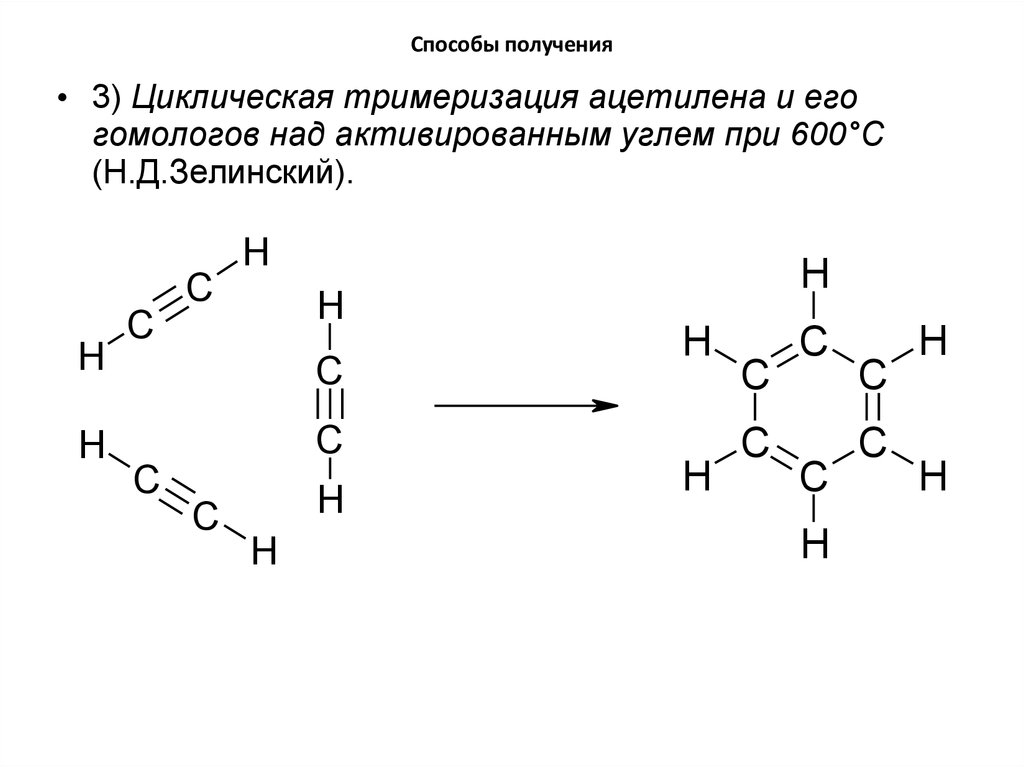
17. Способы получения
• 3) Циклическая тримеризация ацетилена и егогомологов над активированным углем при 600°C
(Н.Д.Зелинский).
H
C
H
H
H
C
C
C
C
C
H
H
H
H
H
C
C
C
C
H
C
C
H
H
18. Способы получения
• 4) Сплавление солей ароматических кислот сощелочью или натронной известью.
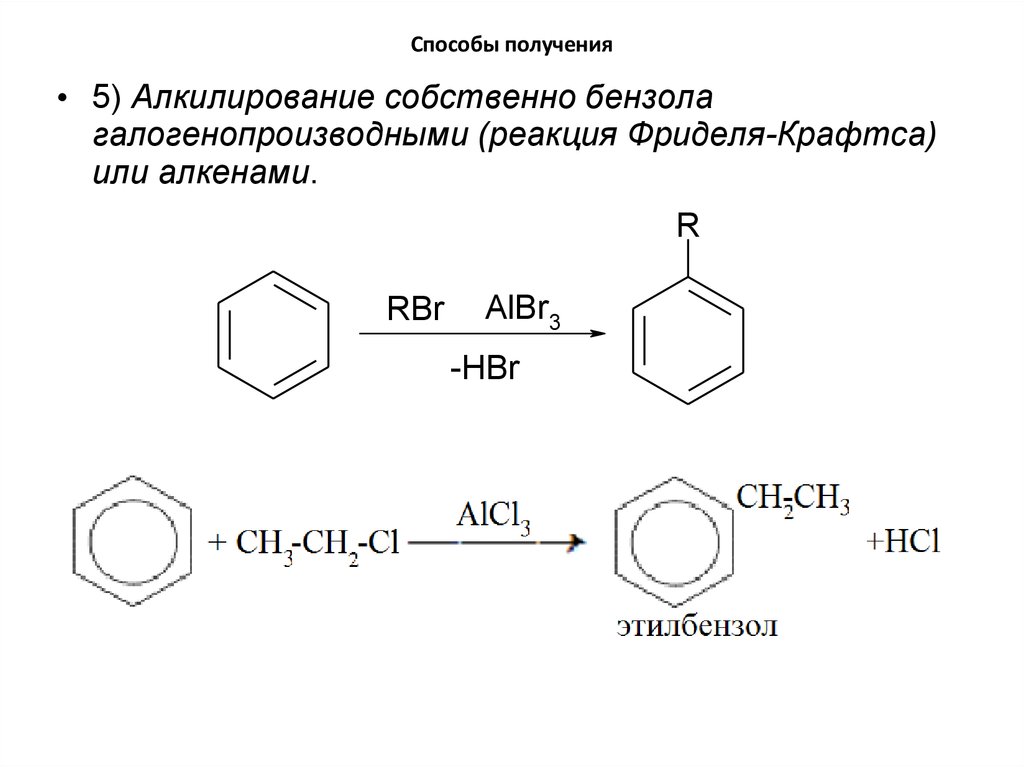
19. Способы получения
• 5) Алкилирование собственно бензолагалогенопроизводными (реакция Фриделя-Крафтса)
или алкенами.
R
RBr
AlBr3
-HBr
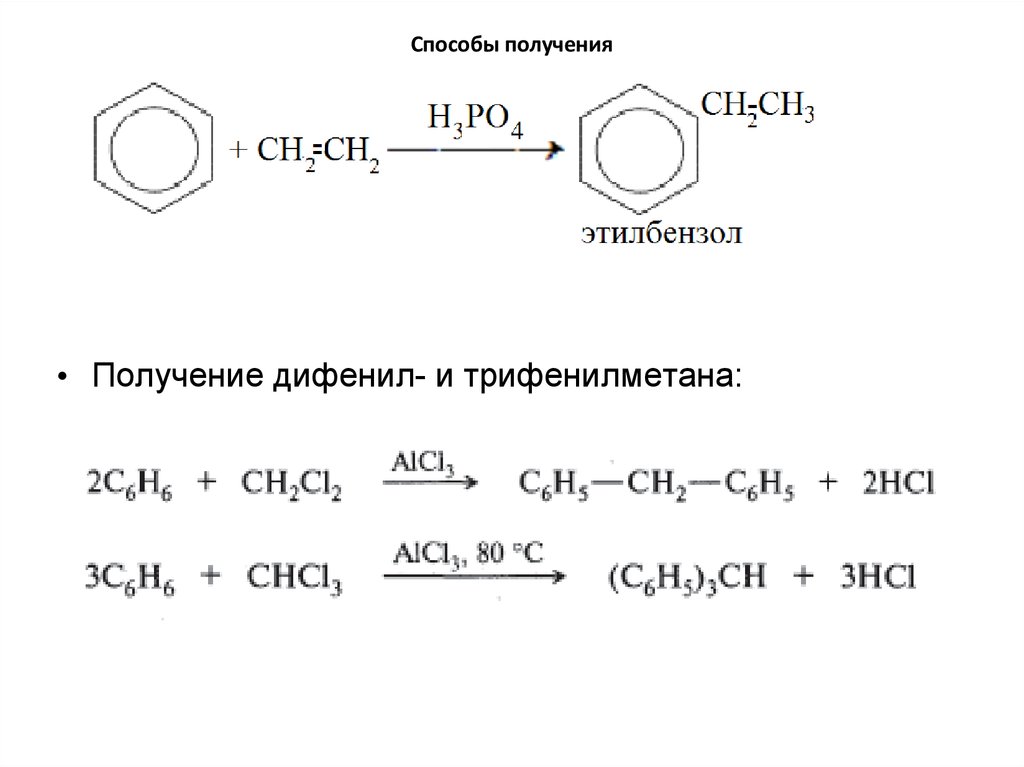
20. Способы получения
• Получение дифенил- и трифенилметана:21. Химические свойства. Реакции электрофильного замещения
4. Ароматические свойства. Реакцииэлектрофильного замещения в моноядерных
аренах
• Бензольное ядро обладает высокой прочностью, чем и
объясняется склонность ароматических
углеводородов к реакциям замещения(SЕ). В
отличие от алканов, которые также склонны к реакциям
замещения, ароматические углеводороды
характеризуются большой подвижностью атомов
водорода в ядре, поэтому реакции галогенирования,
нитрования, сульфирования и др. протекают в
значительно более мягких условиях, чем у алканов.
22. Химические свойства. Реакции электрофильного замещения
23. Химические свойства. Реакции электрофильного замещения
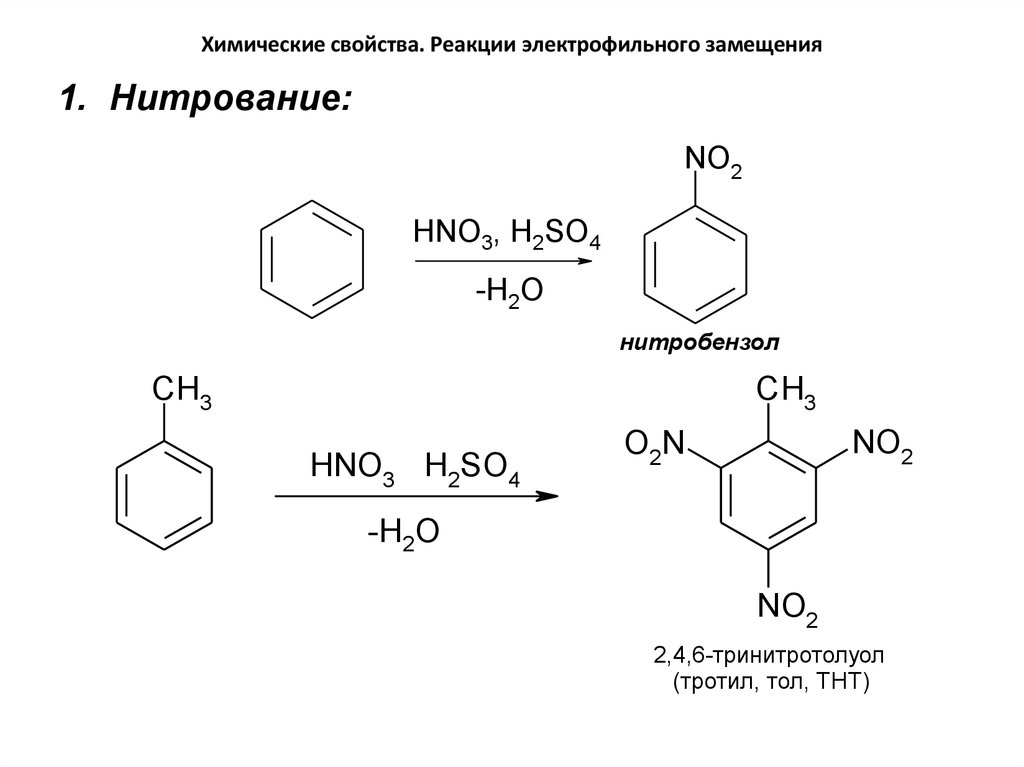
1. Нитрование:NO2
HNO3, H2SO4
-H2O
нитробензол
CH3
CH3
HNO3 H2SO4
NO2
O2N
-H2O
NO2
2,4,6-тринитротолуол
(тротил, тол, ТНТ)
24.
• Механизм реакции нитрованияМеханизм электрофильного замещения укладывается в такую схему:
Субстрат → p-комплекс → s-комплекс → продукт
Но для начала необходимо генерировать электрофил!
I. Генерирование электрофила.
O
O
H O N
+
H2SO4
+
H O N
O
H
+
H
H O
O
O
O
O
H O N
+
H
+
+
N
O
нитроний катион
HSO4
25.
II. Образование p-комплекса.+
O
+
N
O
+
NO2
III. Образование s-комплекса (комплекс Уиланда)
O
+
N
O
H
NO2
H
NO2
H
NO2
+
+
+
p-комплекс
s-комплекс
H
+
NO2
26.
IV. Выброс протонаH
NO2
+
s-комплекс
NO2
+
+
H
нитробензол
Протон присоединяется к гидросульфат-иону с
регенерированием катализатора – серной
кислоты
27.
2. ГалогенированиеCl
+
Cl2
AlCl3
+
хлорбензол
HCl
28.
• Механизм галогенирования.• I. Образование p-комплекса.
Cl
+
Cl2
Cl
29.
• II. Образование s-комплексаCl
H
Cl
Cl
+
+
p-комплекс
Cl-
s-комплекс
Cl
Cl
Cl
+
Al
Cl
H
Cl
Cl
Cl
+
+
Cl Al Cl
Cl
тройной комплекс
s-комплекс тетрахлороалюминатион
30.
III. Выброс протонаH
Cl
Cl
+
Cl
+
H
- H+
s-комплекс
p-комплекс
IV. Регенерация катализатора
H+ + AlCl4- → HAlCl4 → HCl + AlCl3
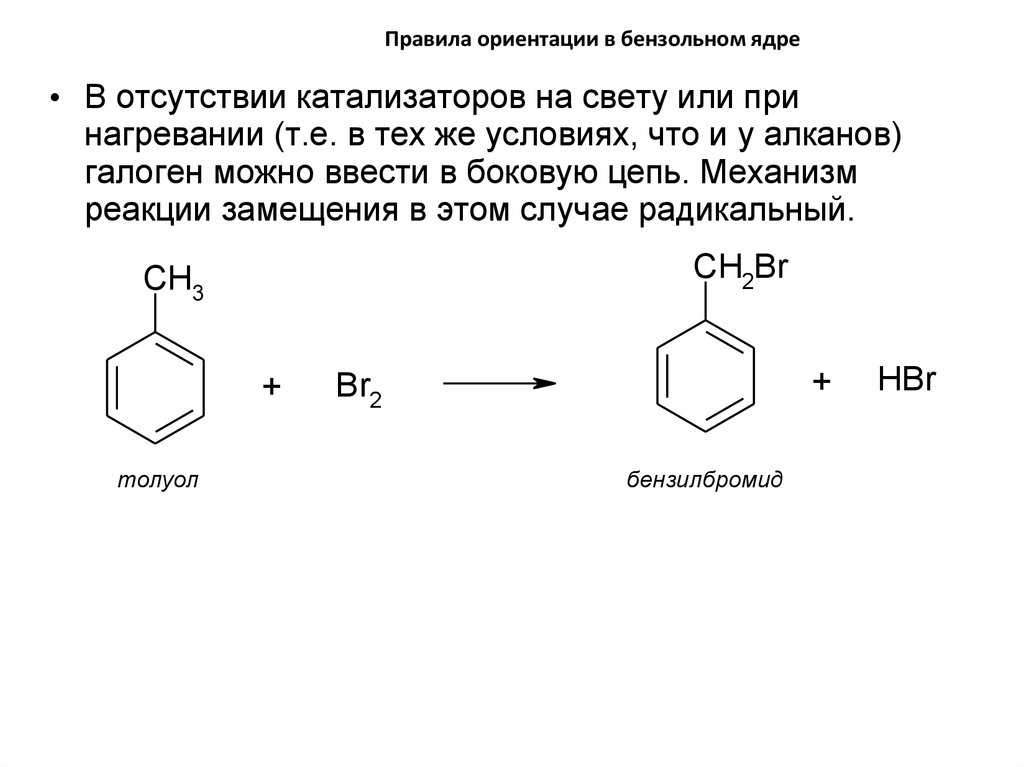
31. Правила ориентации в бензольном ядре
• В отсутствии катализаторов на свету или принагревании (т.е. в тех же условиях, что и у алканов)
галоген можно ввести в боковую цепь. Механизм
реакции замещения в этом случае радикальный.
CH2Br
CH3
+
толуол
+
Br2
бензилбромид
HBr
32.
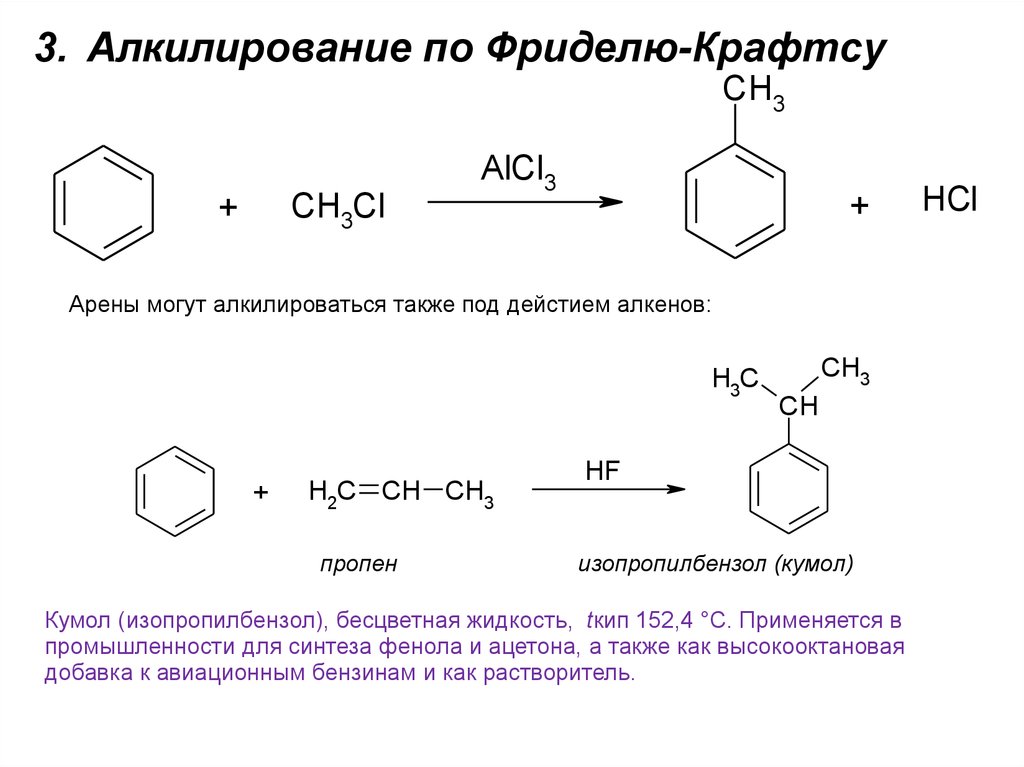
3. Алкилирование по Фриделю-КрафтсуCH3
CH3Cl
+
AlCl3
+
Арены могут алкилироваться также под дейстием алкенов:
H3C
+
H2C CH CH3
пропен
CH3
CH
HF
изопропилбензол (кумол)
Кумол (изопропилбензол), бесцветная жидкость, tкип 152,4 °С. Применяется в
промышленности для синтеза фенола и ацетона, а также как высокооктановая
добавка к авиационным бензинам и как растворитель.
HCl
33.
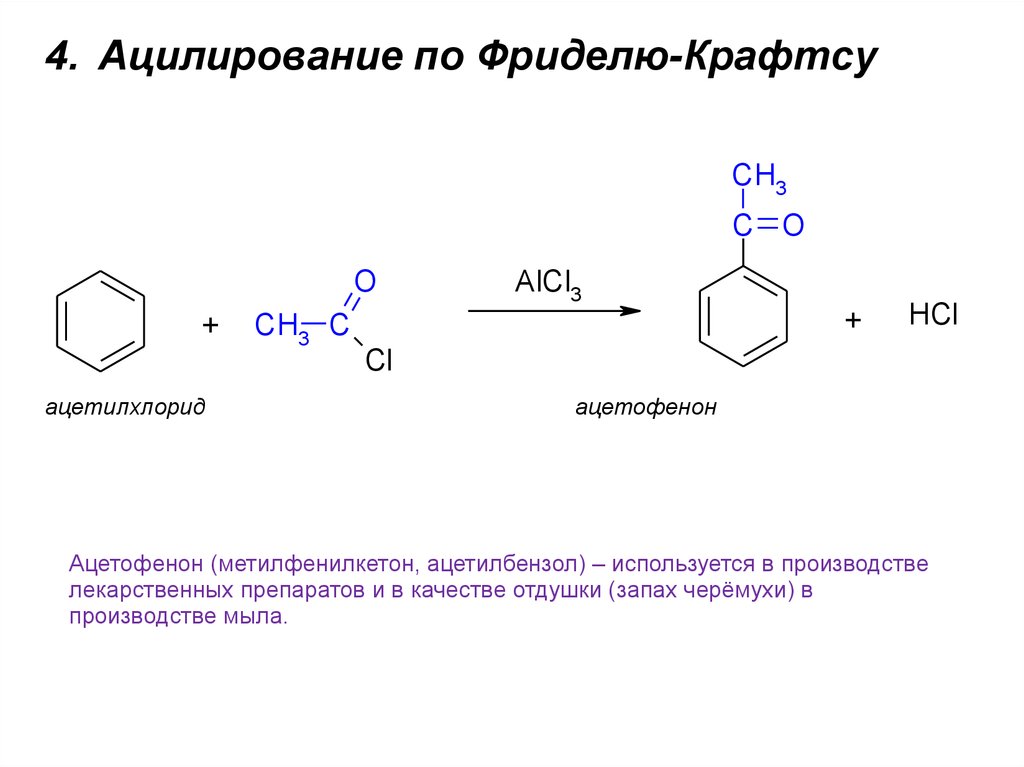
4. Ацилирование по Фриделю-КрафтсуCH3
C O
O
+
ацетилхлорид
CH3 C
AlCl3
+
HCl
Cl
ацетофенон
Ацетофенон (метилфенилкетон, ацетилбензол) – используется в производстве
лекарственных препаратов и в качестве отдушки (запах черёмухи) в
производстве мыла.
34.
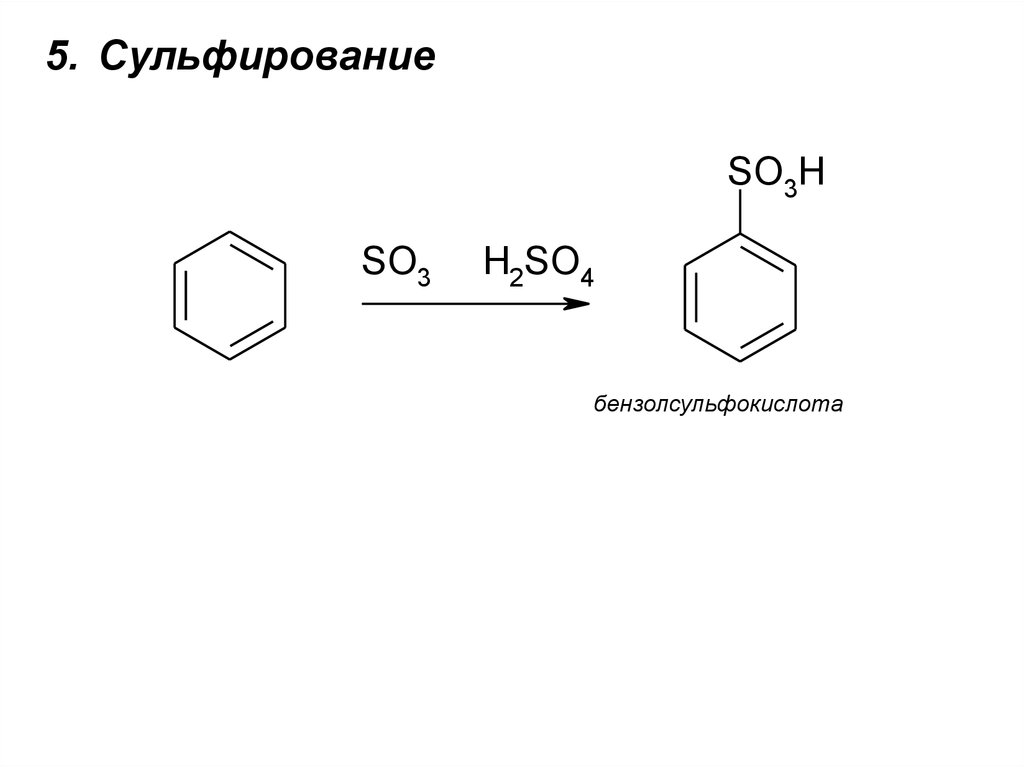
5. СульфированиеSO3H
SO3
H2SO4
бензолсульфокислота
35.
• Механизм сульфированияSO3
SO3
I. Образование p-комплекса
O
SO3
O
O S H
II. Превращение p-комплекса
+
в s-комплекс
O
III. Отщепление протона
O
O S H
+
O
O S OH
36. Правила ориентации в бензольном ядре
• 5. Правила ориентации в бензольном ядре• Гомологи бензола также вступают в реакцию
электрофильного замещения. Однако, существенной
особенностью этих реакций является то, что новые
заместители вступают в бензольное кольцо в
определенные положения по отношению к уже
имеющимся заместителям. Закономерности,
определяющие направление реакций замещения в
бензольном ядре, называются правилами
ориентации.
• Все заместители по характеру своего ориентирующего
действия делятся на две группы.
37. Правила ориентации в бензольном ядре
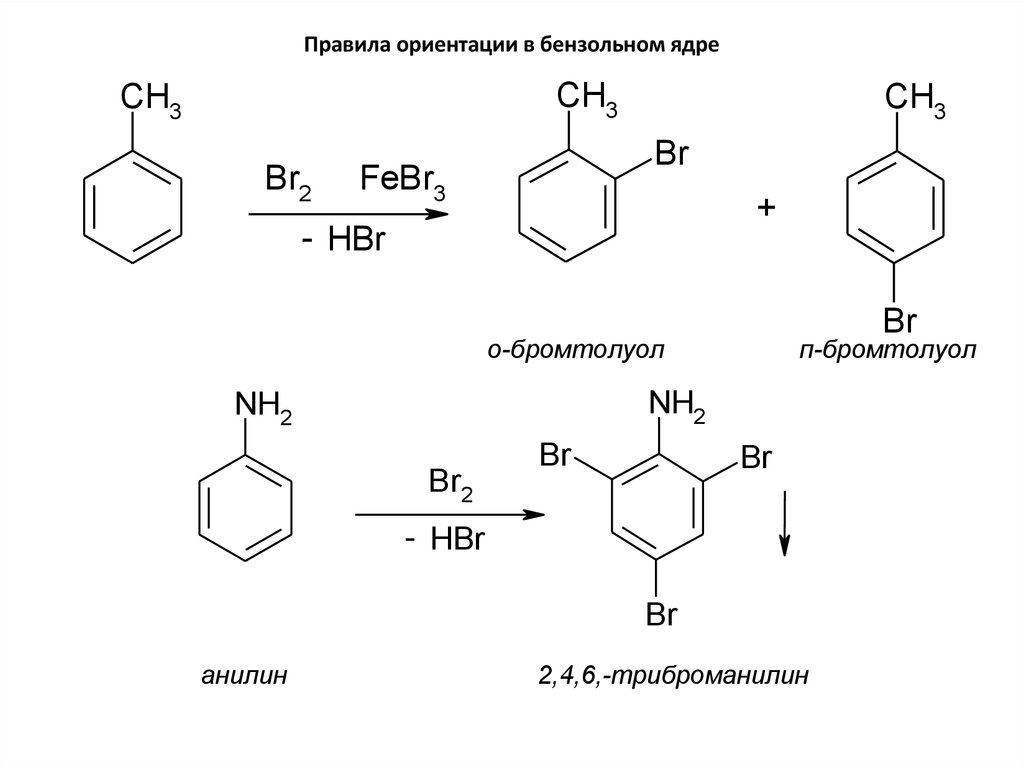
• Заместители первого рода (или орто-параориентанты) – это атомы или группы атомов,способные отдавать электроны (электронодонорные). К
ним относятся углеводородные радикалы, группы –OH
и –NH2, а также галогены. Перечисленные заместители
(кроме галогенов) увеличивают активность бензольного
ядра. Заместители первого рода ориентируют новый
заместитель преимущественно в орто- и параположение.
38. Правила ориентации в бензольном ядре
CH3CH3
Br2
CH3
Br
FeBr3
+
- HBr
Br
о-бромтолуол
п-бромтолуол
NH2
NH2
Br2
Br
Br
- HBr
Br
анилин
2,4,6,-триброманилин
39. Правила ориентации в бензольном ядре
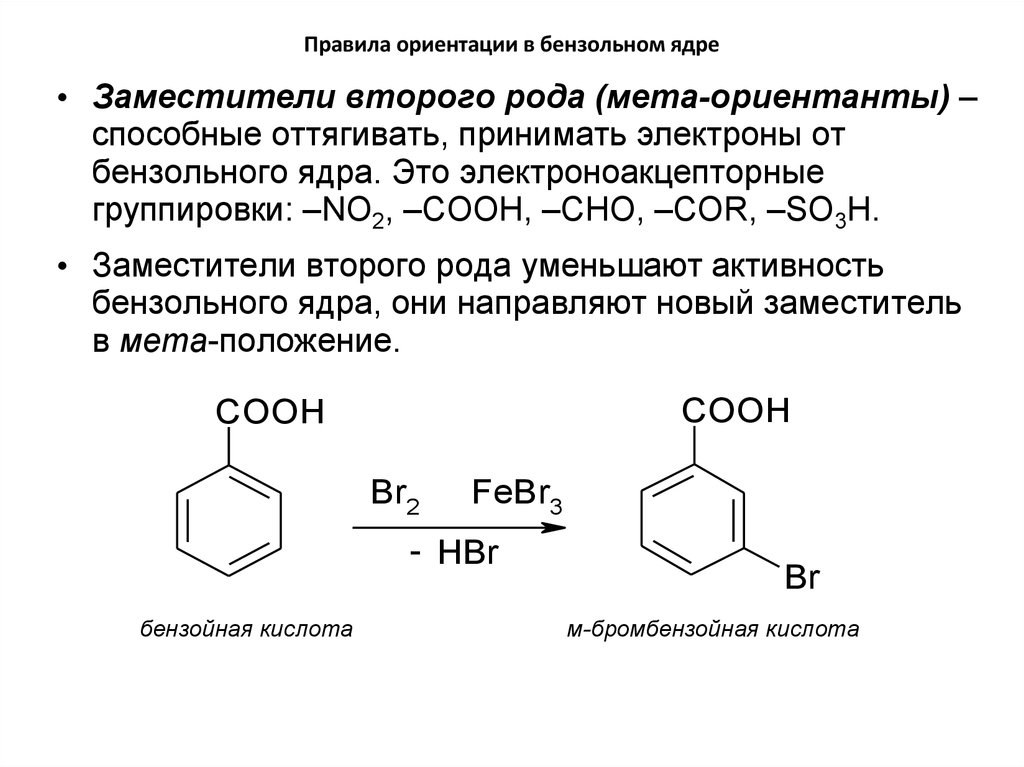
• Заместители второго рода (мета-ориентанты) –способные оттягивать, принимать электроны от
бензольного ядра. Это электроноакцепторные
группировки: –NO2, –COOH, –CHO, –COR, –SO3H.
• Заместители второго рода уменьшают активность
бензольного ядра, они направляют новый заместитель
в мета-положение.
COOH
COOH
Br2
FeBr3
- HBr
бензойная кислота
Br
м-бромбензойная кислота
40. Правила ориентации в бензольном ядре
• Влияние заместителей в ароматическом ядре на реакционнуюспособность и ориентацию электрофильного замещения.
41. Правила ориентации в бензольном ядре
• В дизамещенных производных аренов ориентирующеевлияние заместителей будет согласованным, если
заместители направляю электрофильный реагент в
одни и те же положения кольца.
42. Правила ориентации в бензольном ядре
• Примером согласованной ориентации являетсяреакция бромирования 4 –нитрофенола:
43. Правила ориентации в бензольном ядре
• Возможны случаи и несогласованной ориентации, когдаориентирующее влияние одного заместителя не
совпадает по направлению с влиянием другого
заместителя:
44. Правила ориентации в бензольном ядре
• При несогласованной ориентации заместителиконкурируют между собой, что приводит к образованию
смеси продуктов. Но в этих случаях можно предсказать
основное направление реакции пользуясь следующими
обобщениями:
• Если в бензольном кольце имеются сильная и слабая
активирующие группы, то ориентация в основном
определяется сильной группой.
• Если в бензольном кольце имеются активирующая и
дезактивирующая группы, то ориентация
электрофильного реагента определяется главным
образом активирующей группой.
45. Реакции присоединения. Реакции окисления
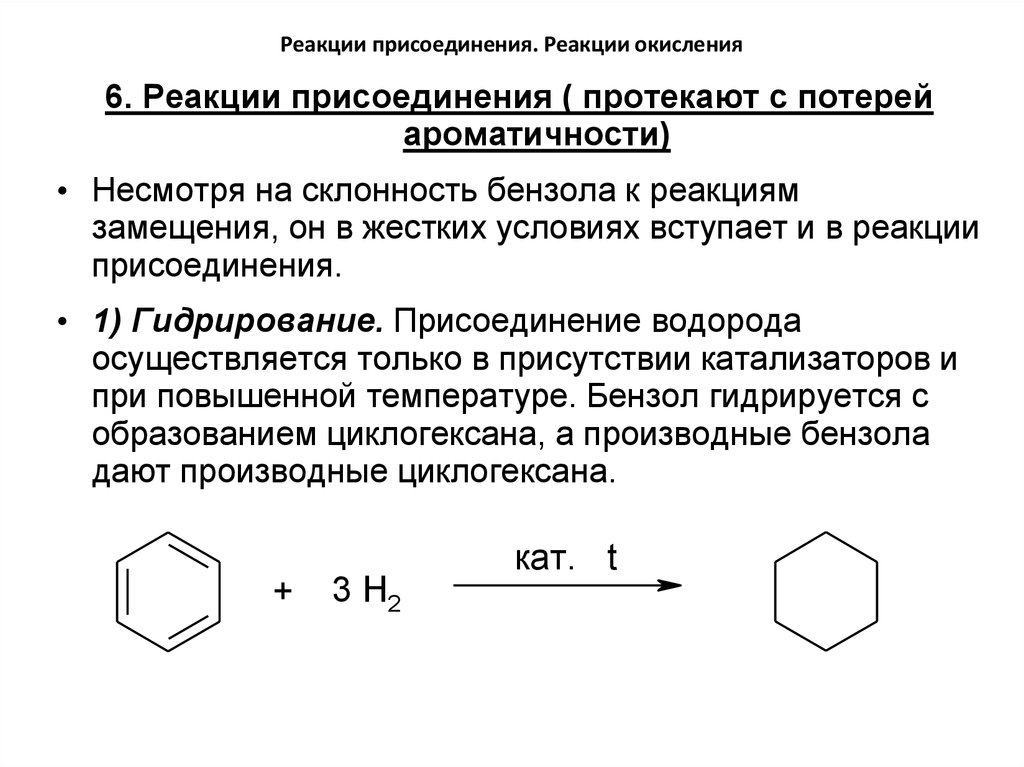
6. Реакции присоединения ( протекают с потерейароматичности)
• Несмотря на склонность бензола к реакциям
замещения, он в жестких условиях вступает и в реакции
присоединения.
• 1) Гидрирование. Присоединение водорода
осуществляется только в присутствии катализаторов и
при повышенной температуре. Бензол гидрируется с
образованием циклогексана, а производные бензола
дают производные циклогексана.
+
3 H2
кат. t
46. Реакции присоединения. Реакции окисления
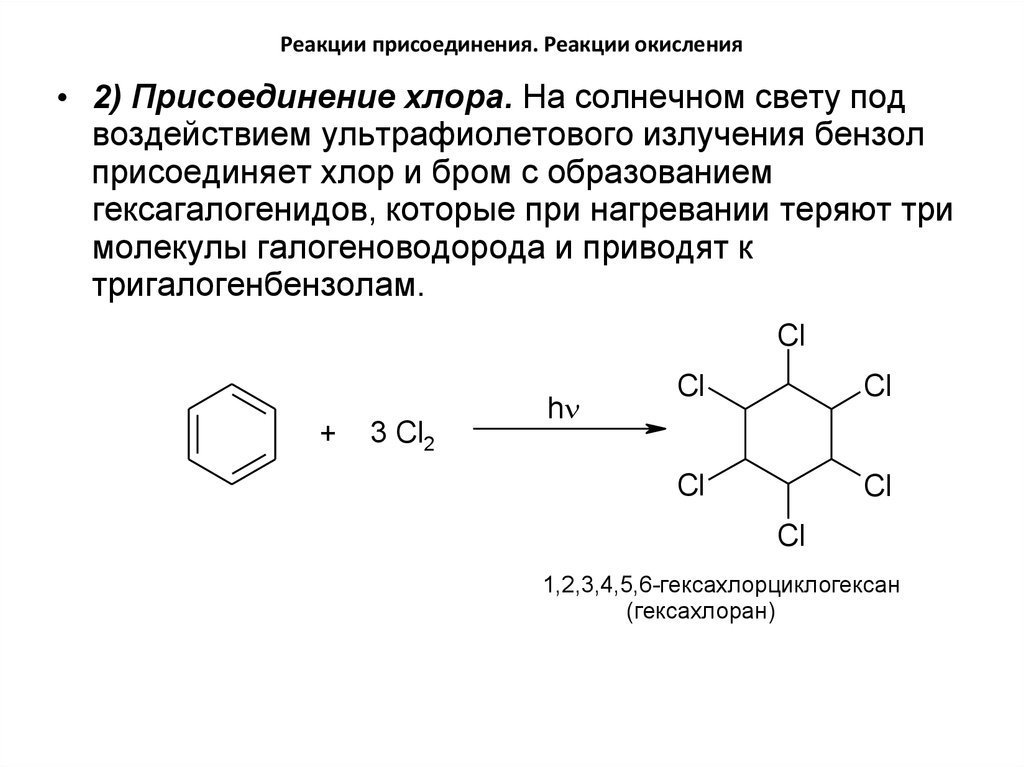
• 2) Присоединение хлора. На солнечном свету подвоздействием ультрафиолетового излучения бензол
присоединяет хлор и бром с образованием
гексагалогенидов, которые при нагревании теряют три
молекулы галогеноводорода и приводят к
тригалогенбензолам.
Cl
+
3 Cl2
h
Cl
Cl
Cl
Cl
Cl
1,2,3,4,5,6-гексахлорциклогексан
(гексахлоран)
47. Реакции присоединения. Реакции окисления
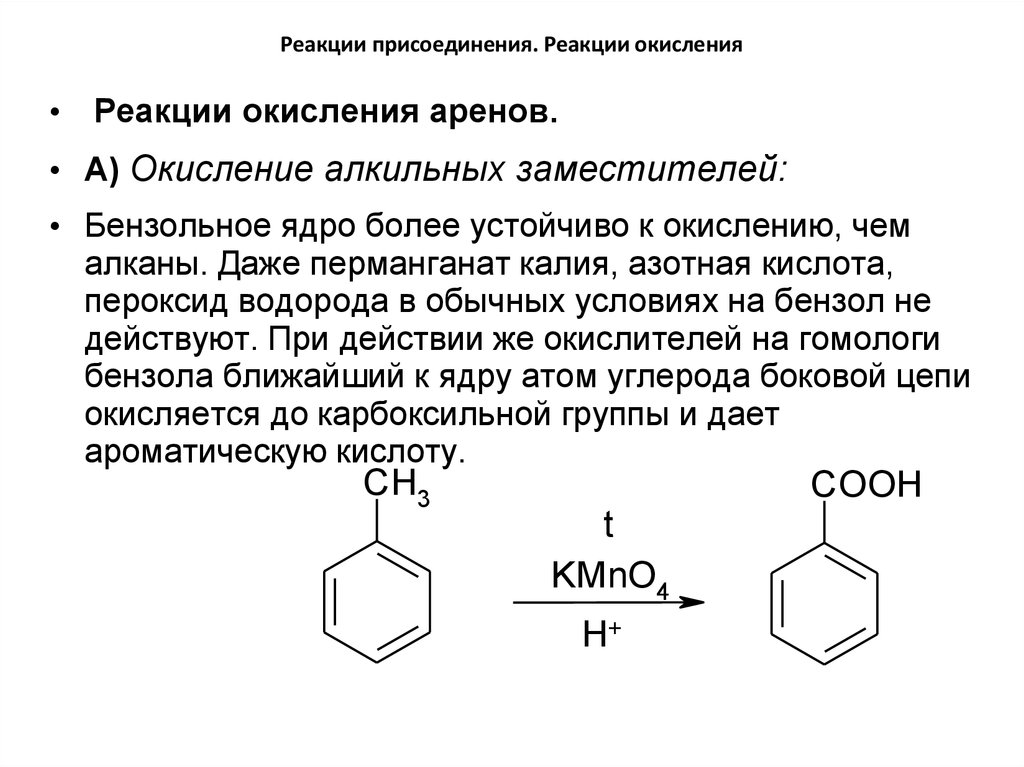
• Реакции окисления аренов.• А) Окисление алкильных заместителей:
• Бензольное ядро более устойчиво к окислению, чем
алканы. Даже перманганат калия, азотная кислота,
пероксид водорода в обычных условиях на бензол не
действуют. При действии же окислителей на гомологи
бензола ближайший к ядру атом углерода боковой цепи
окисляется до карбоксильной группы и дает
ароматическую кислоту.
CH3
COOH
t
KMnO4
H+
48. Реакции присоединения. Реакции окисления
49. Реакции присоединения. Реакции окисления
• При наличии в бензольном кольце несколькихзаместителей можно окислить последовательно все
имеющиеся цепи. Эта реакция применяется для
установления строения ароматических углеводородов.
50. Реакции окисления
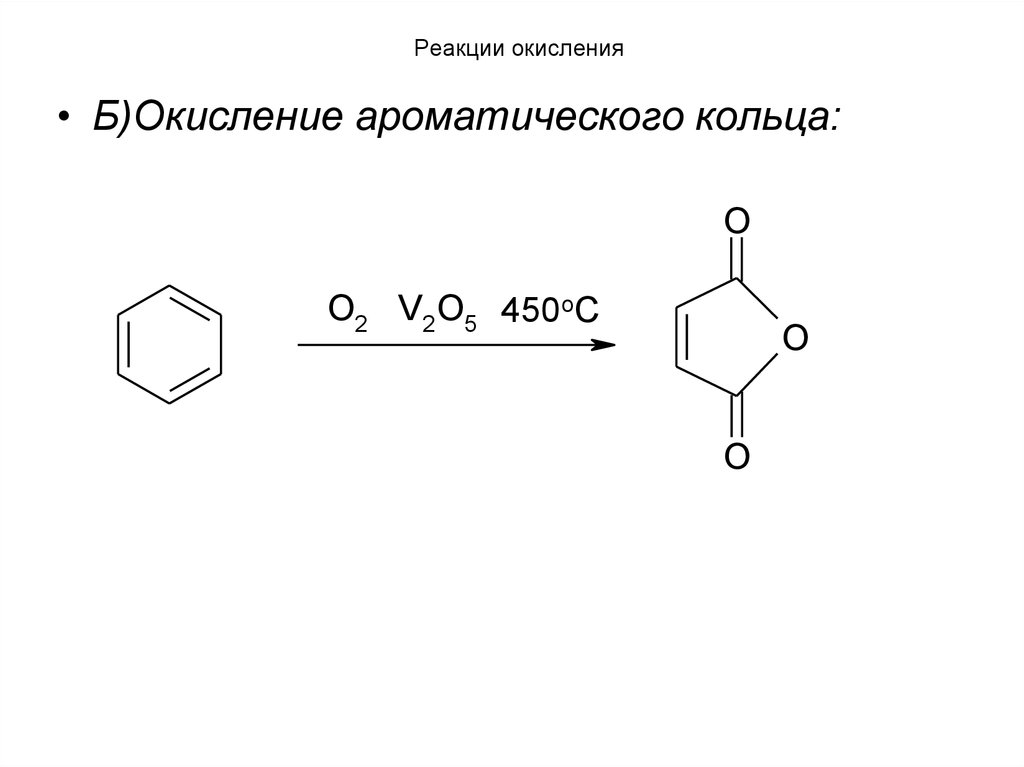
• Б)Окисление ароматического кольца:O
O2 V2O5 450oC
O
O
51. Реакционная способность многоядерных аренов
7. Реакционная способность многоядерных ареновI. Важнейшие реакции многоядерных аренов с
изолированными кольцами .
• Простейший представитель соединений с изолированными
бензольными ядрами является бифенил. Бифенил
содержит сопряженную систему, включающую два
бензольных кольца, и у него ярко выражена склонность к
реакциям электрофильного замещения. Электрофил
атакует бензольные кольца предпочтительно в параположения, где меньше сказываются пространственные
препятствия.
52. Реакционная способность многоядерных аренов
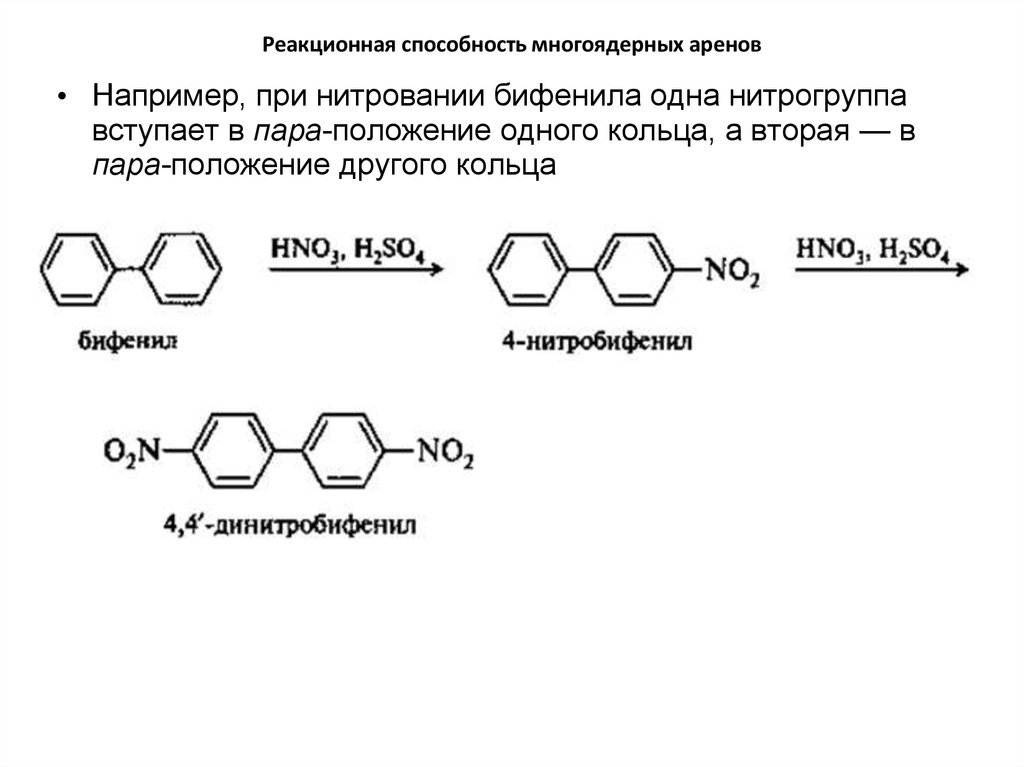
• Например, при нитровании бифенила одна нитрогруппавступает в пара-положение одного кольца, а вторая — в
пара-положение другого кольца
53. Реакционная способность многоядерных аренов
• В дифенилметане и трифенилметане бензольныекольца изолированы и между ними нет сопряжения. По
своей реакционной способности эти соединения
напоминают толуол. Для дифенилметана в основном, а
для трифенил-метана исключительно электрофильное
замещение осуществляется в пара-положение к
метиленовой или метиновой группе. Такая ориентация
электрофила определяется пространственными
факторами и является следствием экранированности
орто-положений соседними бензольными кольцами.
54. Реакционная способность многоядерных аренов
• Метиленовая группа в дифенилметане и метиновая втрифенилметане легко подвергаются реакциям
радикального галогенирования. Метиленовая группа
также легко окисляется в карбонильную с
образованием бензофенона:
55. Реакционная способность многоядерных аренов
• Трифенилметан обладает значительной реакционнойспособностью благодаря особой подвижности атома
водорода при третичном атоме углерода:
• Амино- и гидроксипроизводные трифенилметана
являются красителями.
56. Реакционная способность многоядерных аренов
II. Важнейшие реакции конденсированных аренов.• Наиболее важным представителем многоядерных
аренов с конденсированными бензольными ядрами
является нафталин. Это бесцветное кристаллическое
вещество с характерным запахом, легко возгоняется. В
отличии от бензола у нафталина нет полного
выравнивания электронной плотности, они менее
ароматичны. Как и для бензола для них характерны
реакции электрофильного замещения. Потеря
ароматичности одного из колец на стадии образования
σ-комплекса, требует меньших затрат энергии, чем для
бензола. Кроме того, нафталин легко вступает в
реакции окисления и присоединения. Реакции
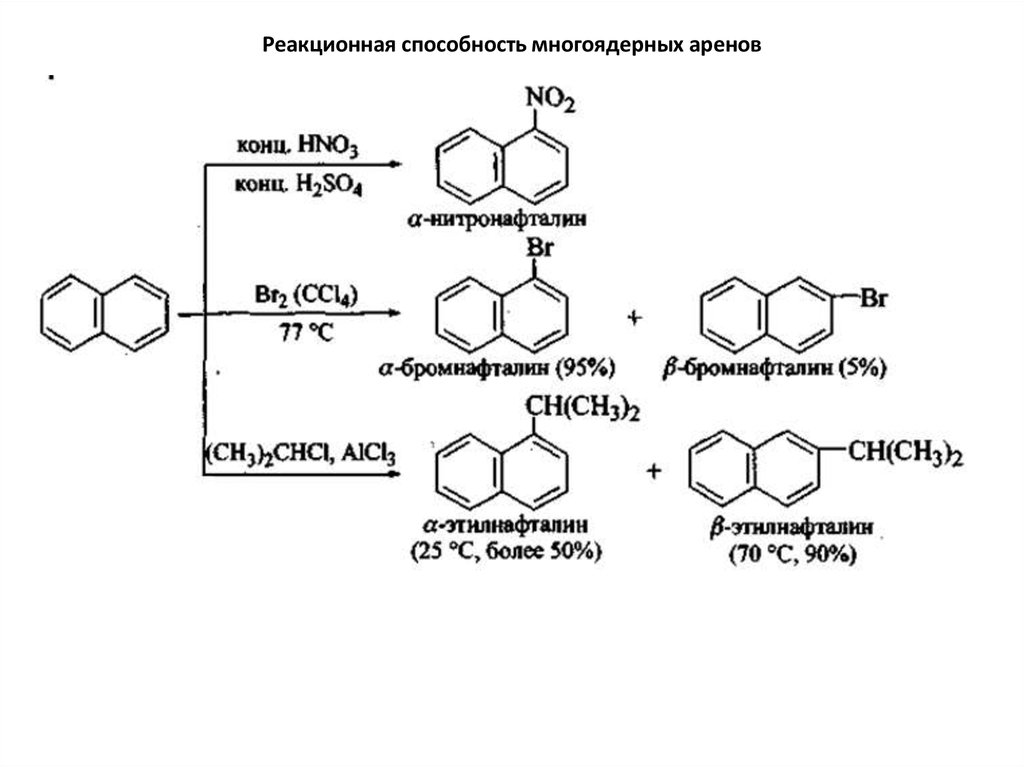
замещения идут легче в -положениях, чем в положениях. В некоторых случаях тип ориентации
может быть измнен условиями реакции.
57. Реакционная способность многоядерных аренов
58. Реакционная способность многоядерных аренов
59. Реакционная способность многоядерных аренов
• Реакции присоединения. Примером является реакциягидрирования нафталина. Нафталин легче, чем бензол,
вступает в реакцию с водородом, причем сначала
гидрируется одно ядро (160 °С, 3 МПа) и образуется
тетрагидронафталин — тетралин, конечный же продукт
гидрирования (200 °С, 20 МПа)—декагидронафталин —
декалин:
• Тетралин и декалин — высококипящие жидкости—
растворители смол, жиров, добавки к моторному
топливу.
60. Реакционная способность многоядерных аренов
• Окисление. Нафталин окисляется легче, чем бензол,при этом одно из бензольных ядер разрушается, а его углероды превращаются в карбоксильные группы,
взаимодействие которых может привести к получению
ангидрида:
61. Реакционная способность многоядерных аренов
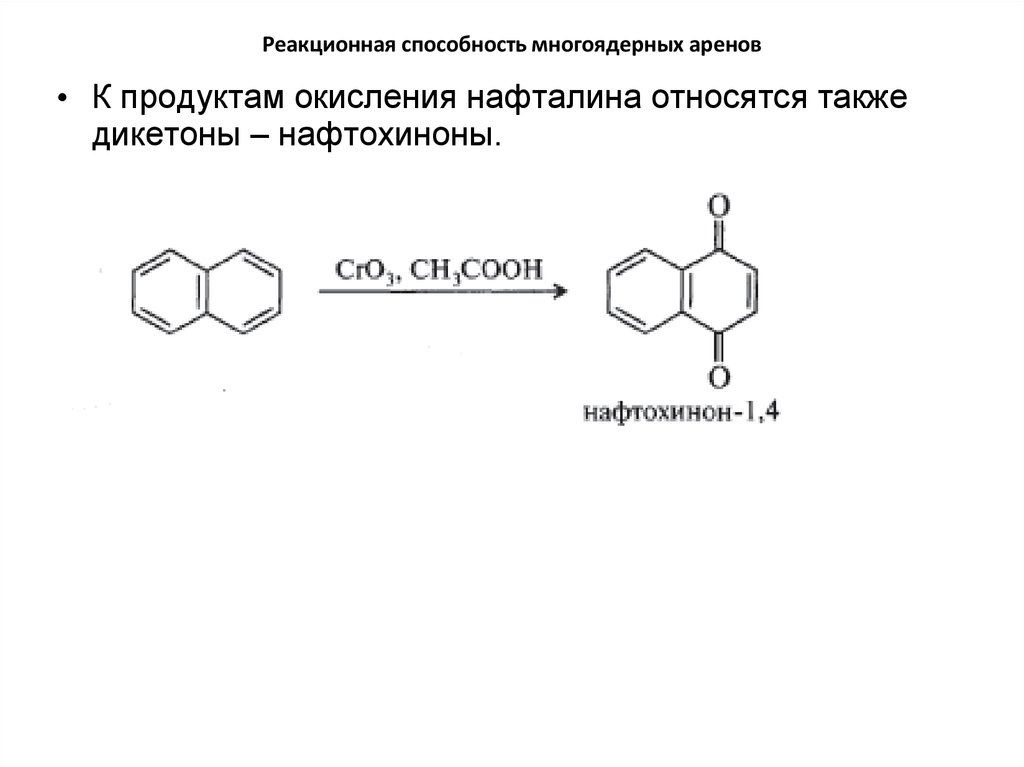
• К продуктам окисления нафталина относятся такжедикетоны – нафтохиноны.
62. Реакционная способность многоядерных аренов
• По химическим свойствам антрацен и фенантренсходны с нафталином. Эти соединения в реакциях
электрофильного замещения обладают высокой
реакционной способностью, чем нафталин. В
результате образуются продукты замещения в
положении 9 и 10 антрацена. Фенантрен менее
реакционноспособен.
63. Реакционная способность многоядерных аренов
64. Реакционная способность многоядерных аренов
• Антрацен и фенантрен легко восстанавливаются всоответствующие дигидропроизводные и легко
окисляются в соответствующие хиноны:
• Антрахинон является исходным сырьем для синтеза
антрахиноновых красителей. Один из важнейших
красителей – ализарин – известен с древних времен.
65. Реакционная способность многоядерных аренов
• Метилхолантрен – светло-желтое вещество, котороеможет быть получено из холестирина или холевой
кислоты. Бензопирен – светло-желтое вещество,
обнаруженное в табачном дыме. Они относятся к
сильным канцерогенам.















































 chemistry
chemistry








