Similar presentations:
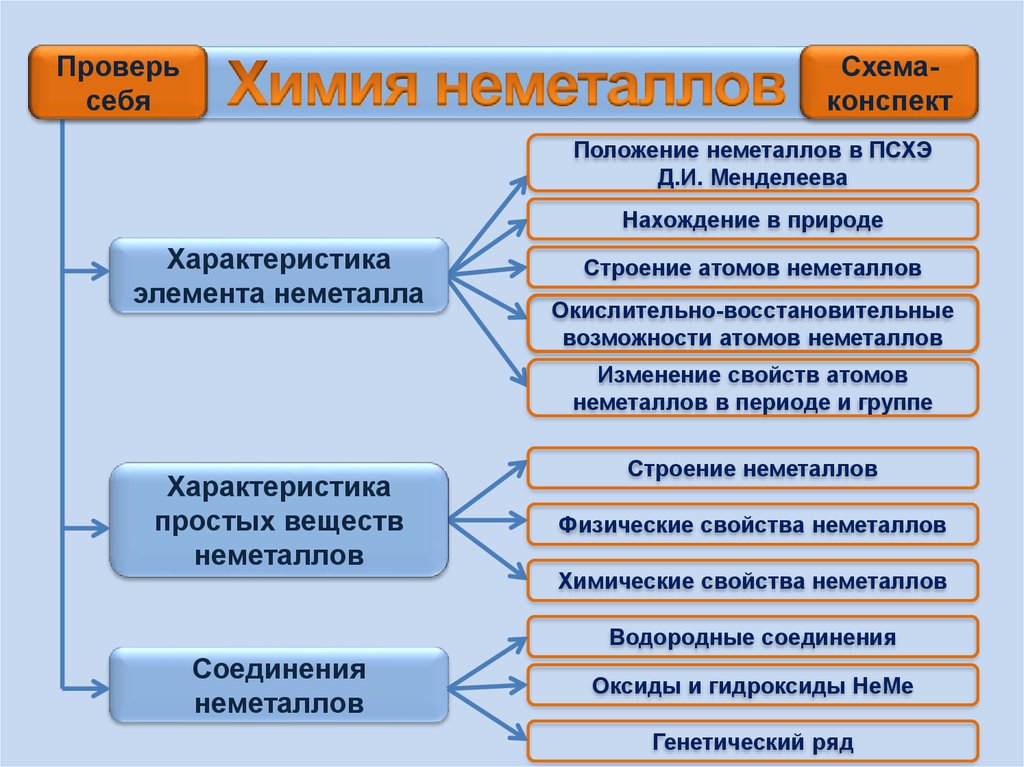
Химия неметаллов
1. Химия неметаллов
2.
Проверьсебя
Схемаконспект
Положение неметаллов в ПСХЭ
Д.И. Менделеева
Нахождение в природе
Характеристика
элемента неметалла
Строение атомов неметаллов
Окислительно-восстановительные
возможности атомов неметаллов
Изменение свойств атомов
неметаллов в периоде и группе
Характеристика
простых веществ
неметаллов
Строение неметаллов
Физические свойства неметаллов
Химические свойства неметаллов
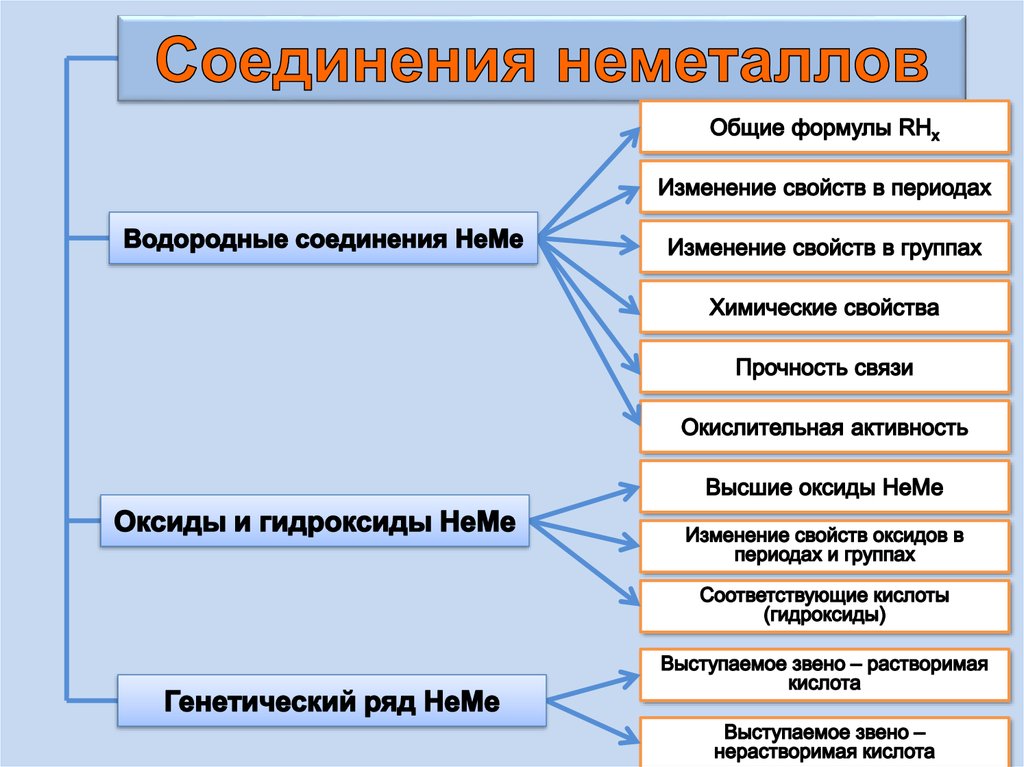
Водородные соединения
Соединения
неметаллов
Оксиды и гидроксиды НеМе
Генетический ряд
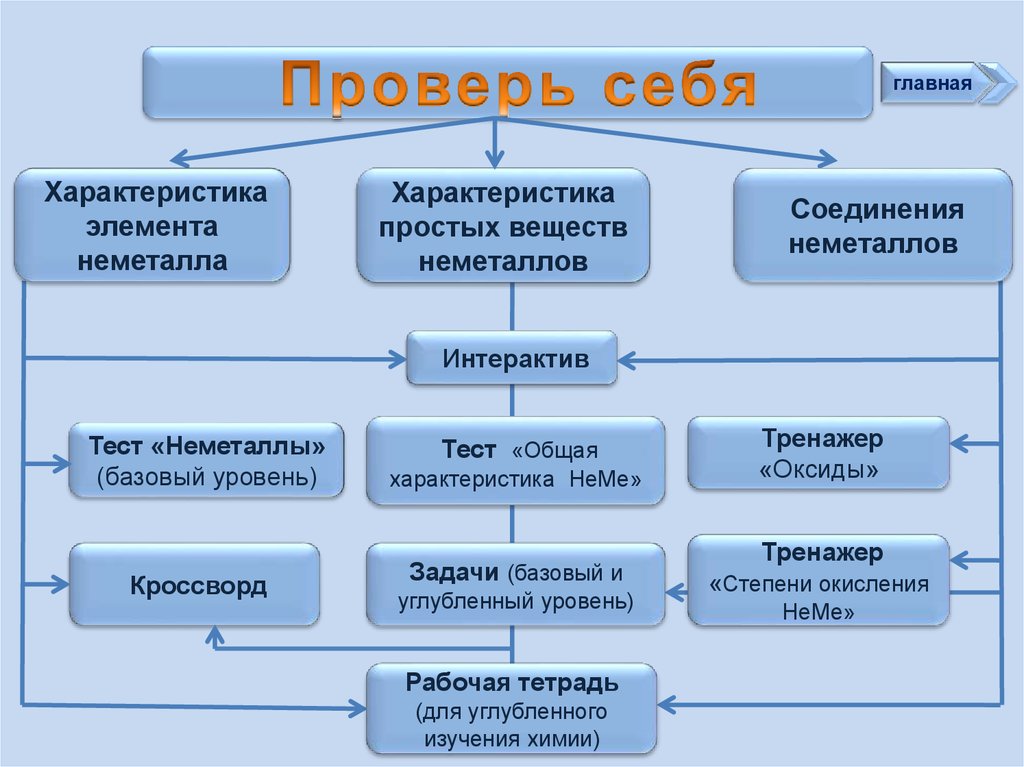
3.
главнаяХарактеристика
элемента
неметалла
Характеристика
простых веществ
неметаллов
Соединения
неметаллов
Интерактив
Тест «Неметаллы»
(базовый уровень)
Кроссворд
Тест «Общая
характеристика НеМе»
Задачи (базовый и
углубленный уровень)
Рабочая тетрадь
(для углубленного
изучения химии)
Тренажер
«Оксиды»
Тренажер
«Степени окисления
НеМе»
4.
Положение в ПСХЭ Д.И. Менделееваглавная
Гр у п п ы э л е м е н т о в
I
1
1 (H)
2
2
3
3
II
III
IV
V
VI
VII
Н
В
5
10,811
Бор
С
6
12,0112
Углерод
Водород
7
8
N 14,0067
O 15,9994
F
Азот
14 Р
Si 28,086
Кремний
1
1,00797
Кислород
15 S
30,9738
Фосфор
9
18,9984
Фтор
16 Cl
32,064
Сера
VIII
2
He 4,0026
Гелий
Ne 10
20,163
Неон
17 Ar 18
39,948
35,453
Хлор
Аргон
4
4
5
6
5
7
8
6
9
В ПСХЭ Д.И. Менделеева
граница, отделяющая
металлы от неметаллов,
проходит по следующим
неметаллам – элементам
главных подгрупп: B; Si;
As; Te; At. Неметаллы
располагаются правее и
выше этой границы.
33
34
35
36
Kr 83,80
As 74,9216
Se 78,96
Br 79,904
Мышьяк
Селен
Бром
Криптон
52
53 Xe 131,30
54
Te 127,60
I 126,904
Теллур
Иод
Ксенон
86
At 85
210 Rn [222]
Астат
Радон
7 10
Высшие
оксиды
ЛВС
R2O
RO
R2O 3
RO2
R2O 5
RO3
R 2O 7
RH4
RH3
H2R
HR
RO4
5.
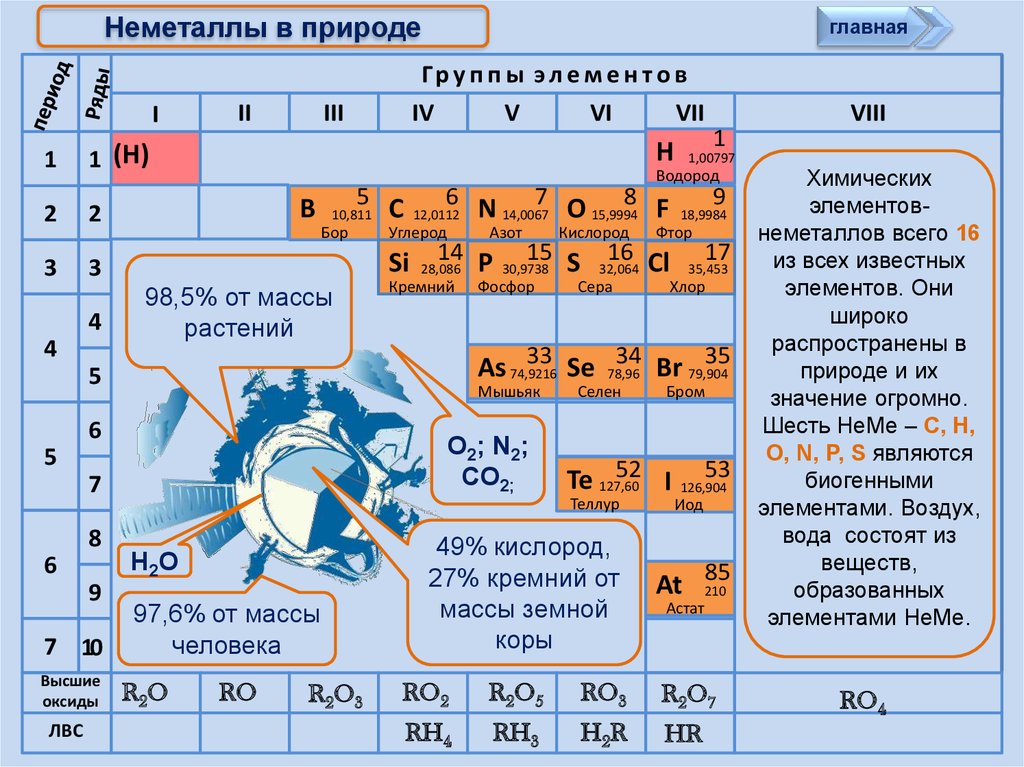
Неметаллы в природеглавная
Гр у п п ы э л е м е н т о в
I
1
1 (H)
2
2
3
3
4
4
II
III
IV
V
В
5
10,811
Бор
98,5% от массы
растений
С
6
12,0112
Углерод
Высшие
оксиды
ЛВС
Азот
Кислород
15 S
30,9738
Фосфор
O2; N2;
CO2;
7
7 10
7
8
N 14,0067
O 15,9994
F
Мышьяк
5
9
Водород
14 Р
Si 28,086
Кремний
1
1,00797
9
18,9984
Фтор
16 Cl
32,064
Сера
17
35,453
Хлор
33
34
35
As 74,9216
Se 78,96
Br 79,904
6
6
VII
Н
5
8
VI
Селен
52
53
Te 127,60
I 126,904
Теллур
Н2О
97,6% от массы
человека
R2O
RO
R2O 3
Бром
49% кислород,
27% кремний от
массы земной
коры
Иод
At 85
210
Астат
RO2
R2O 5
RO3
R 2O 7
RH4
RH3
H2R
HR
VIII
Химических
элементовнеметаллов всего 16
из всех известных
элементов. Они
широко
распространены в
природе и их
значение огромно.
Шесть НеМе – С, Н,
О, N, P, S являются
биогенными
элементами. Воздух,
вода состоят из
веществ,
образованных
элементами НеМе.
RO4
6.
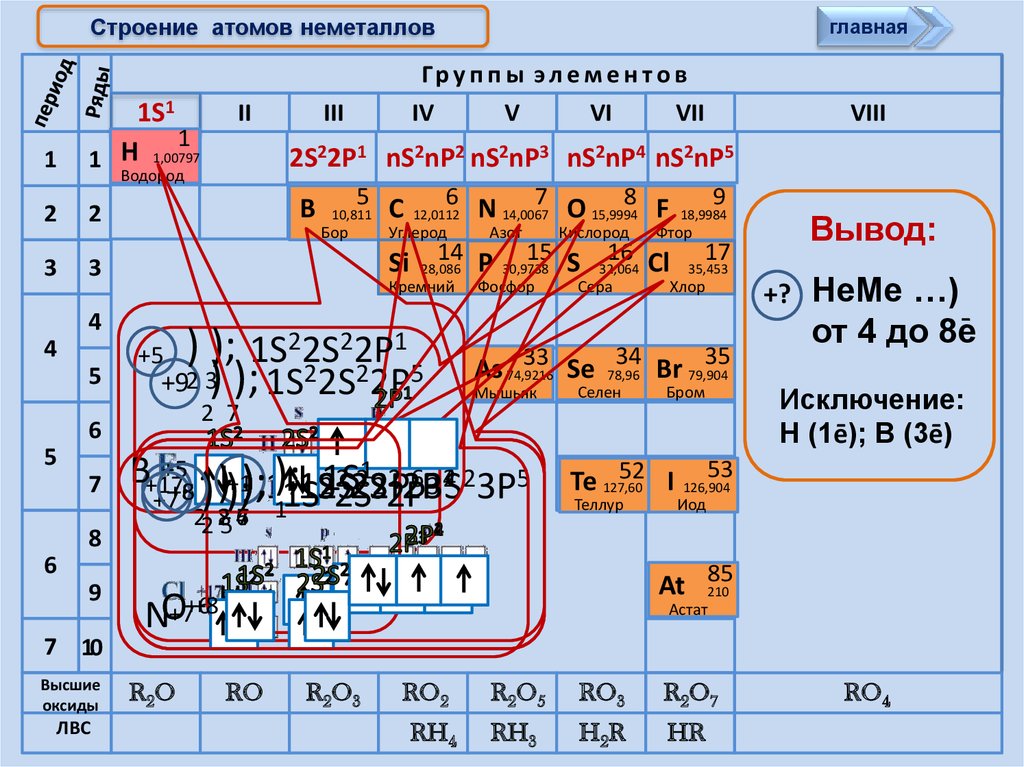
Cтроение атомов неметалловглавная
Гр у п п ы э л е м е н т о в
1
1S1
1
Н
1,00797
1
Водород
2
2
3
II
III
IV
4
5
В
5
10,811
Бор
5
7
8
С
6
12,0112
Азот
Кислород
Кремний
Фосфор
Сера
14 Р
Si 28,086
22P1
) ); 1S22S
+92 3) ); 1S22S22P5
2 7
15
30,9738 S
7 10
Высшие
оксиды
Мышьяк
25
Селен
ЛВС
Фтор
17
35,453
Хлор
Бром
Вывод:
+? НеМе …)
от 4 до 8e
Исключение:
Н (1ē); В (3ē)
52 I 53
Te 127,60
126,904
Теллур
Иод
At 85
210
+6
+8Н +1
O
C
+7
N
RO
9
34
35
33
Se 78,96
Br 79,904
As 74,9216
+5
В+17
22S
22S
212P
22P
63S
2 23P5
4
);
1S
+1
2
2
3
)
)
);
1S
1S
+6
+8
)
);
1S 2S 2P
+7
2 28 6
47 1
R2O
VIII
18,9984
16
32,064 Cl
6
9
VII
7
8
N 14,0067
O 15,9994
F
Углерод
+5
6
VI
2S22P1 nS2nP2 nS2nP3 nS2nP4 nS2nP5
3
4
V
Астат
R2O 3
RO2
RH4
R2O 5
RO3
R2O 7
RH3
H 2R
HR
RO4
7.
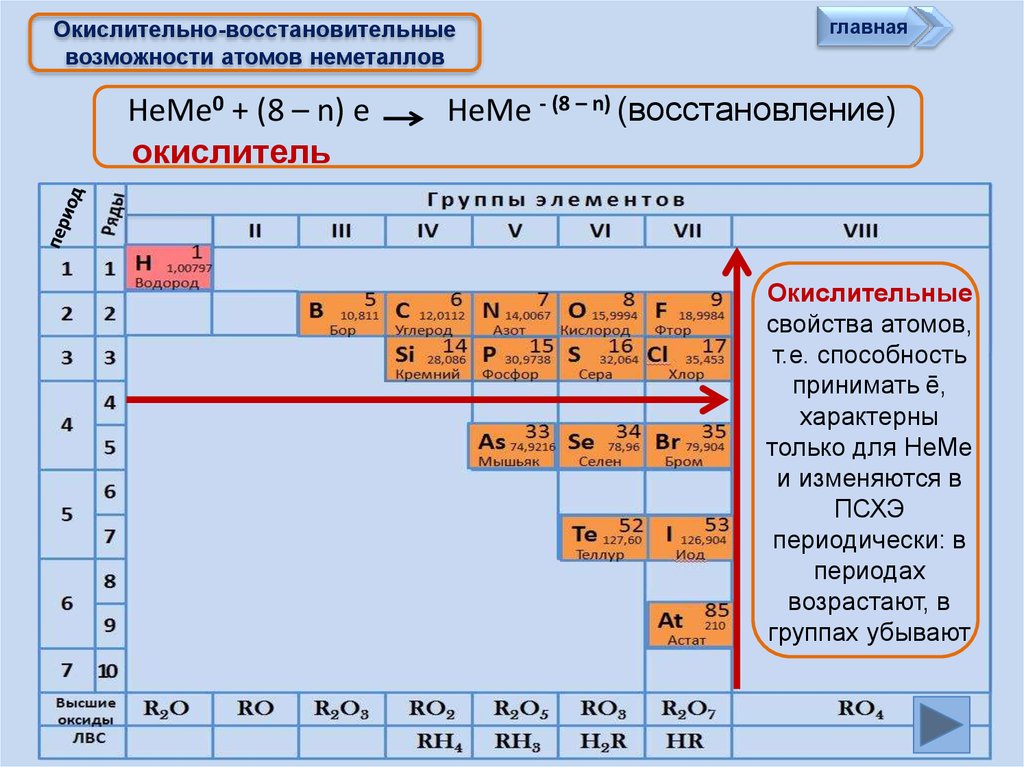
Окислительно-восстановительныевозможности атомов неметаллов
НеМе0 + (8 – n) e
окислитель
главная
НеМе - (8 – n) (восстановление)
Окислительные
свойства атомов,
т.е. способность
принимать ē,
характерны
только для НеМе
и изменяются в
ПСХЭ
периодически: в
периодах
возрастают, в
группах убывают
8.
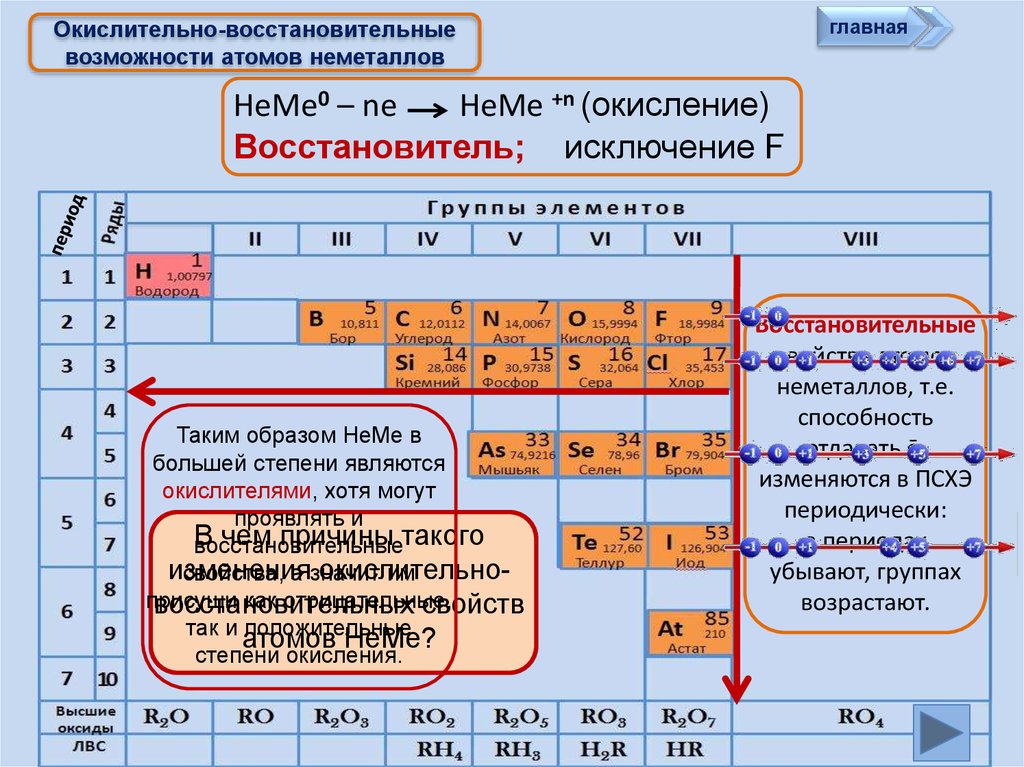
главнаяОкислительно-восстановительные
возможности атомов неметаллов
НеМе0 – ne
НеМе +n (окисление)
Восстановитель; исключение F
Таким образом НеМе в
большей степени являются
окислителями, хотя могут
проявлять и
В
чем
причины такого
восстановительные
изменения
окислительносвойства, а значит
им
присущи
как отрицательные,
восстановительных
свойств
так и положительные
атомов НеМе?
степени окисления.
Восстановительные
свойства атомов
неметаллов, т.е.
способность
отдавать ē,
изменяются в ПСХЭ
периодически:
в периодах
убывают, группах
возрастают.
9.
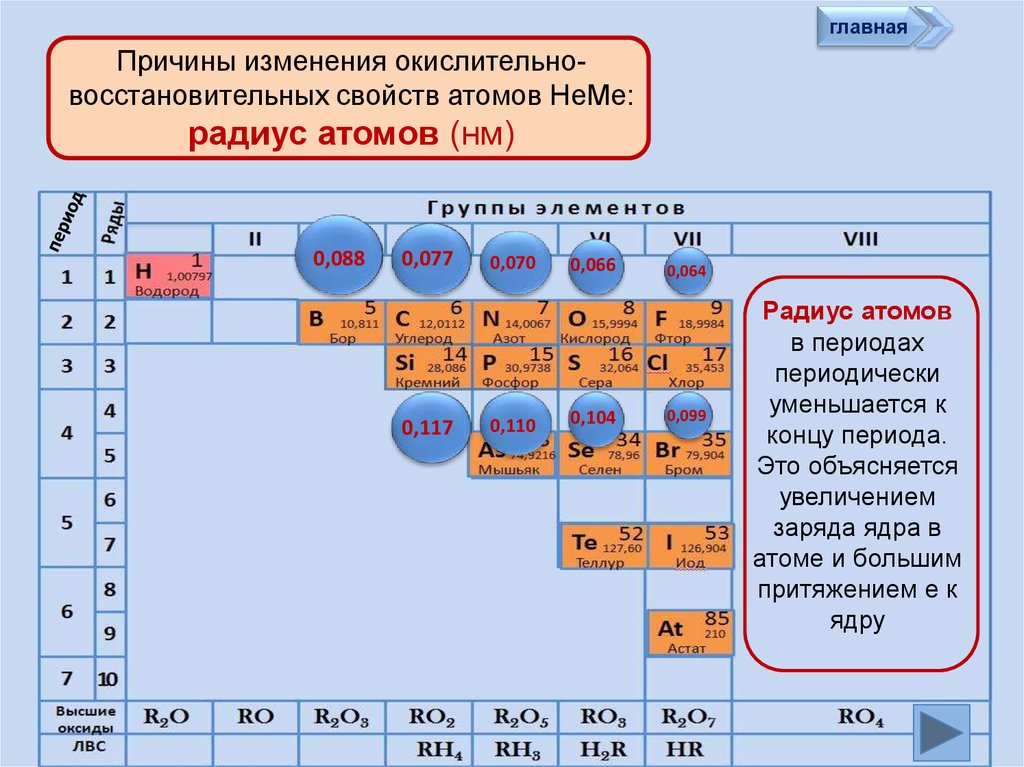
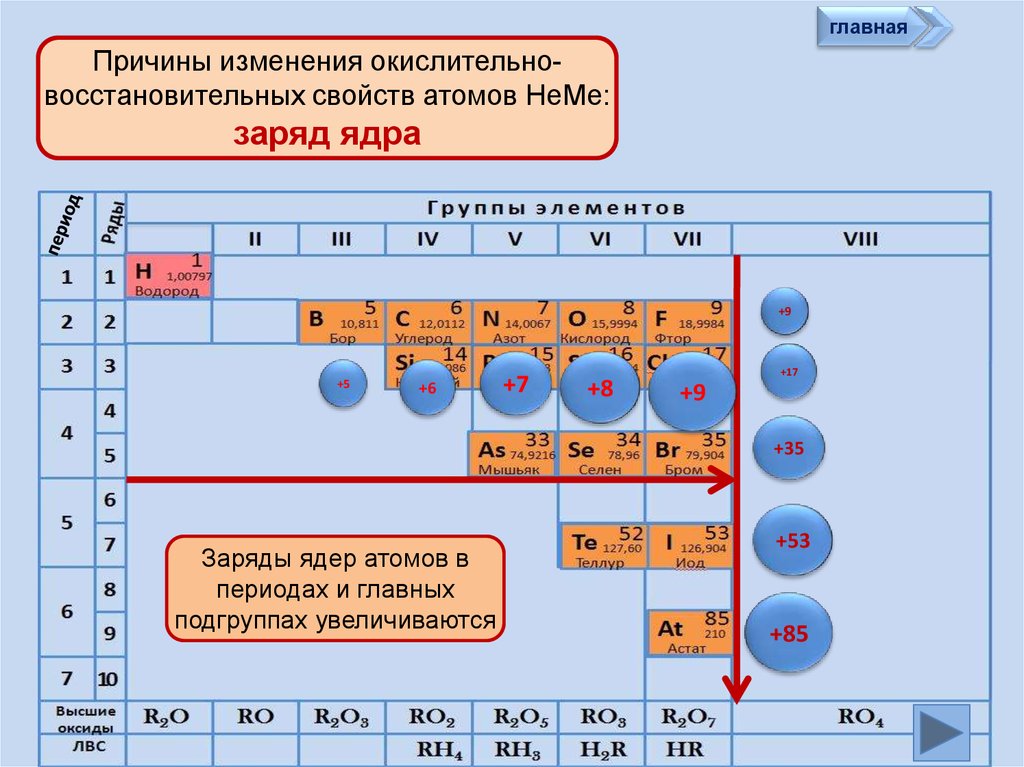
главнаяПричины изменения окислительновосстановительных свойств атомов НеМе:
радиус атомов (нм)
0,088
0,077
0,117
0,070
0,110
0,066
0,104
0,064
0,099
Радиус атомов
в периодах
периодически
уменьшается к
концу периода.
Это объясняется
увеличением
заряда ядра в
атоме и большим
притяжением е к
ядру
10.
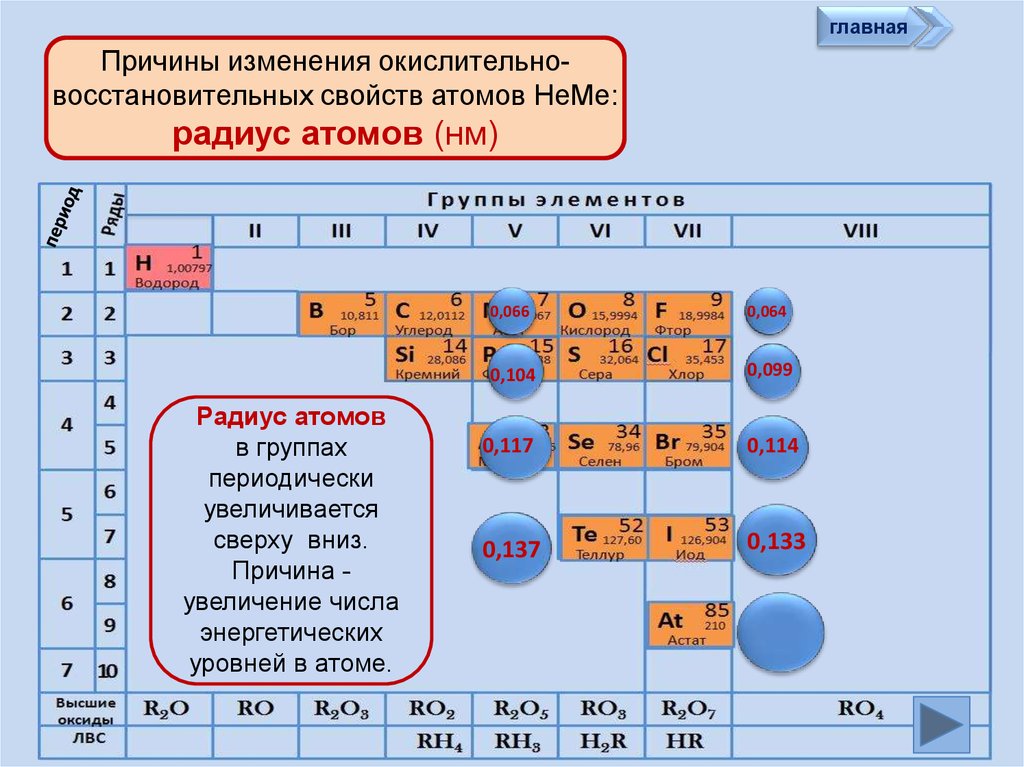
главнаяПричины изменения окислительновосстановительных свойств атомов НеМе:
радиус атомов (нм)
Радиус атомов
в группах
периодически
увеличивается
сверху вниз.
Причина увеличение числа
энергетических
уровней в атоме.
0,066
0,064
0,104
0,099
0,117
0,114
0,137
0,133
11.
главнаяПричины изменения окислительновосстановительных свойств атомов НеМе:
заряд ядра
+9
+5
+6
+7
+8
+17
+9
+35
Заряды ядер атомов в
периодах и главных
подгруппах увеличиваются
+53
+85
12.
главнаяПричины изменения окислительновосстановительных свойств атомов НеМе:
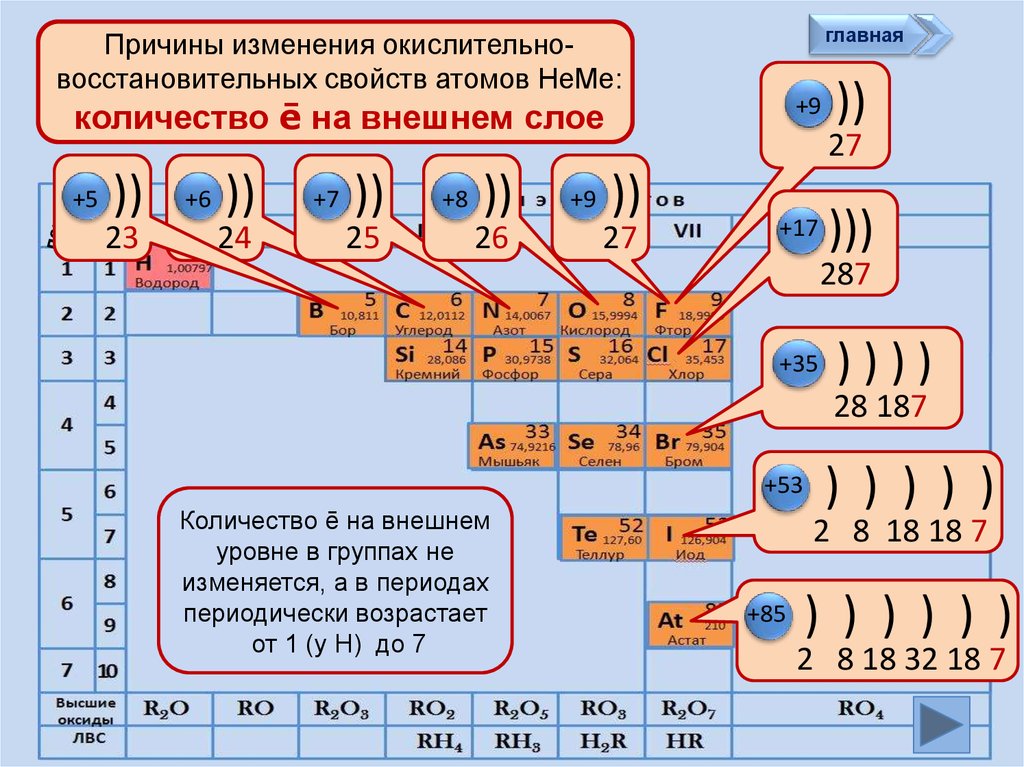
количество ē на внешнем слое
+5
))
23
+6
))
24
+7
))
25
+8
))
26
+9
+9
))
27
))
27
+17
)))
287
+35
))))
28 187
+53
Количество ē на внешнем
уровне в группах не
изменяется, а в периодах
периодически возрастает
от 1 (у Н) до 7
) ) ) ) )
2 8 18 18 7
+85
) ) ) ) ) )
2 8 18 32 18 7
13.
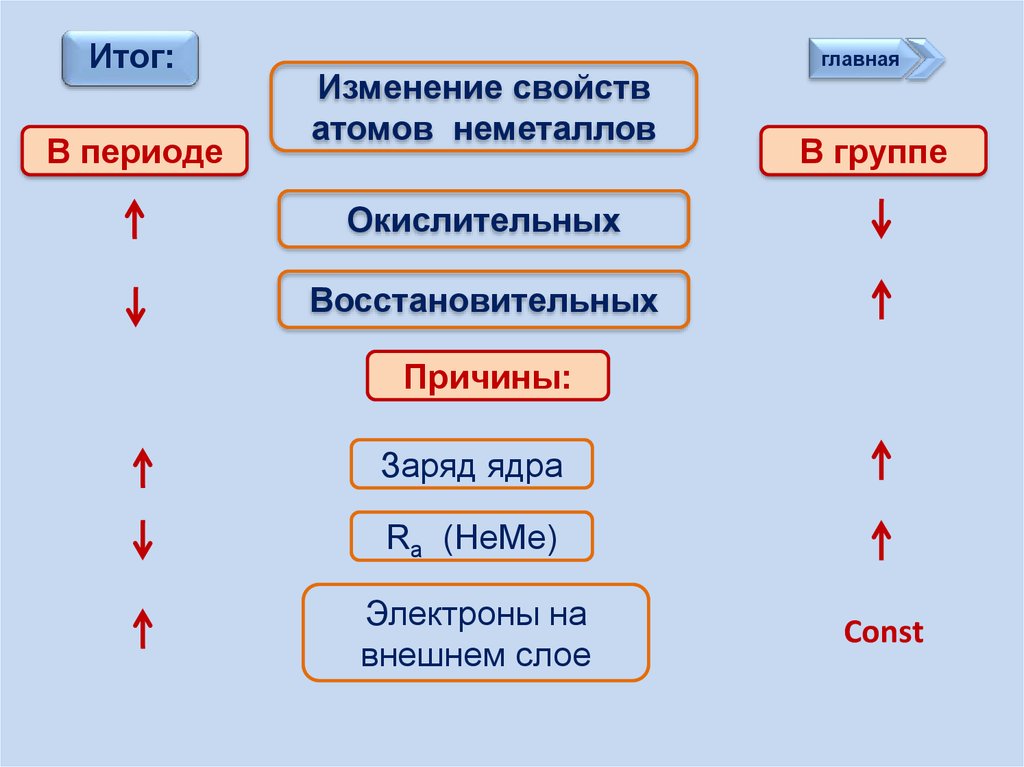
Итог:В периоде
Изменение свойств
атомов неметаллов
главная
В группе
Окислительных
Восстановительных
Причины:
Заряд ядра
Ra (НеМе)
Электроны на
внешнем слое
Const
14.
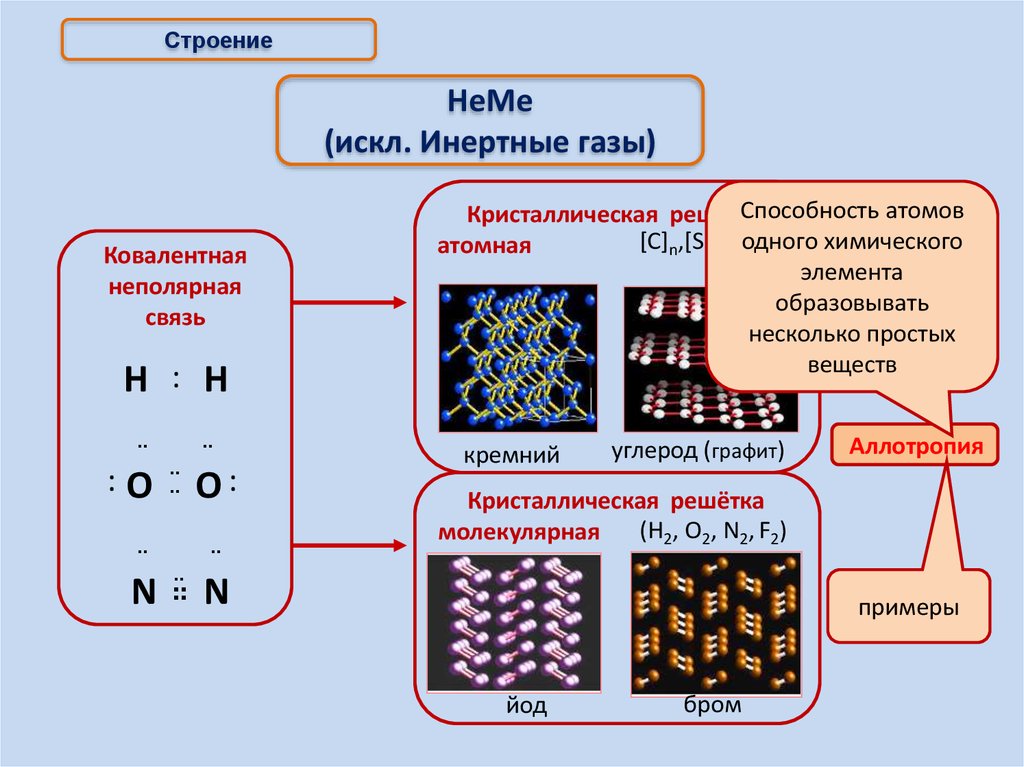
СтроениеНеМе
(искл. Инертные газы)
Ковалентная
неполярная
связь
H : H
¨
¨
: O ¨ O:
¨
¨
¨
Способность атомов
Кристаллическая решётка
одного
химического
[С]n,[Si]n, [S]
атомная
n
элемента
образовывать
несколько простых
веществ
кремний
углерод (графит)
Аллотропия
Кристаллическая решётка
(Н2, О2, N2, F2)
молекулярная
N ¨¨¨ N
примеры
йод
бром
15.
Аллотропияозон
главная
красный
кислород
[О]n м.кр.р.
графит
белый
желтый
[Р]n а.кр.р. [Р]4 м.кр.р. [Р]n а.кр.р.
алмаз
фуллерен
[С]n а.кр.р.
16.
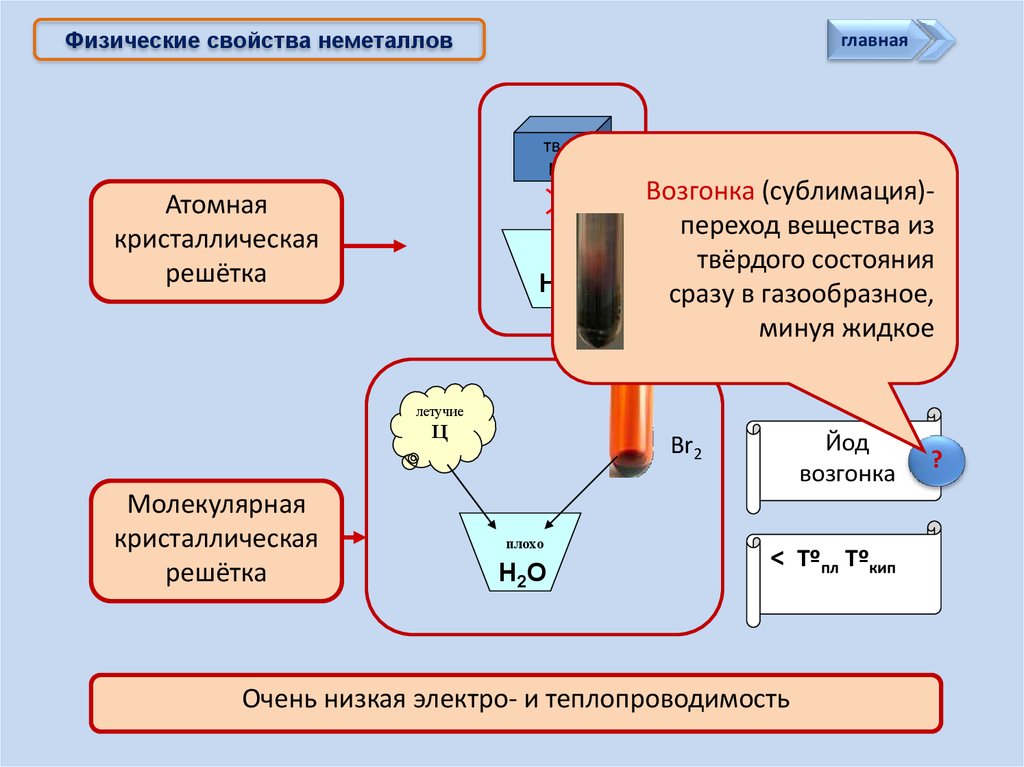
Физические свойства неметалловглавная
тв.
Ц
Атомная
кристаллическая
решётка
Н2О
Возгонка (сублимация)переход> вещества
Tºпл Tºкип из
твёрдого состояния
сразу в газообразное,
минуя жидкое
летучие
Ц
Молекулярная
кристаллическая
решётка
Йод
возгонка
Br2
плохо
Н2О
< Tºпл Tºкип
Очень низкая электро- и теплопроводимость
?
17.
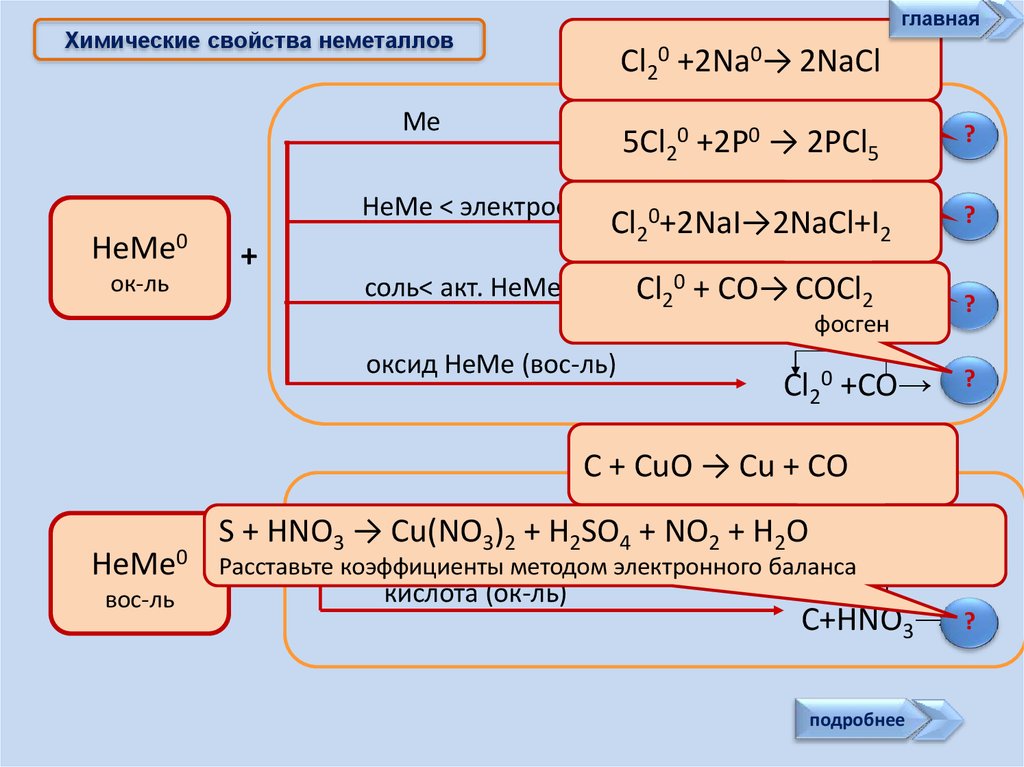
главнаяХимические свойства неметаллов
Cl20 +2Na0→ 2NaCl
Ме
0 +Na0→
Cl22PCl
5Cl20 +2P0 →
5
НеМе < электроотр.
НеМе0
ок-ль
+
0 +P0 →
0
Cl
Cl2 +2NaI→2NaCl+I
2
2
соль< акт. НеМе
?
Cl20 + CO→ClCOCl
0 +NaI→
2
?
Cl20 +CO→
?
2фосген
оксид НеМе (вос-ль)
?
C + CuO → Cu + CO
НеМе0
вос-ль
Ме) + H SO + NO + H O
S + HNO3 →оксид
Cu(NO
3 2
2
4
2
2 C +CuO→
Расставьте
коэффициенты методом электронного баланса
+
кислота (ок-ль)
C+HNO3→
подробнее
?
?
18.
Химические свойства неметалловглавная
Неметаллы могут:
окислять металлы (вещества более или менее склонные отдавать
электроны):
3F2 + 2Al = 2AlF3
S + Fe = FeS (tº)
O2 + 2Mg = 2MgO (с предв. tº)
2C + Ca = CaC2 (tº)
окислять другие неметаллы (менее склонные принимать электроны):
2F2 + C = CF4 (tº)
S + H2 = H2S (tº)
O2 + S = SO2 (с предв. tº)
окислять многие сложные вещества:
4F2 + CH4 = CF4 + 4HF
Cl2 + 2HBr = Br2 + 2HCl
3O2 + 4NH3 = 2N2 + 6H2O (tº)
вытеснять менее активные НеМе из солей:
Hal2 + F2 = 2НаlF ,где Наl = Сl, Вr, I
Cl2 + 2NaBr = Br2 + 2NaCl
19.
Химические свойства неметалловглавная
Неметаллы способны:
(особенно графит и водород)
проявлять восстановительные св-ва:
2С + MnO2 = Mn + 2CO
4H2 + Fe3O4 = 3Fe + 4H2O
См. окислять
другие
неметаллы
(менее
Хлор в левой
части
уравнения
имеетсклонные
степень
принимать
окисления электроны):
0. В результате реакции у одних атомов
как восстановители реагировать
с болееокисления
электротрицательными
хлора степень
стала -1 (в НСl), у других +1
неметаллами:
(в?хлорноватистой кислоте НОСl). Такая реакция —
Si + 2F2 = SiF4
C пример
+ O2 = COреакции
C + 2S = CS2
2
самоокислениясамовосстановления, или диспропорционирования
вступать в реакции самоокисления-самовосстановления
?
Сl2 + Н2О = НСl + НСlO - 25 кДж.
реакции самоокисления-самовосстановления со щелочами
Сl2 + 2NаОН = NаСl + NаСlO + Н2О (на холоде)
ЗСl2 + 6КОН = 2КСl + КClO3 + ЗН2О (при нагрев.)
20.
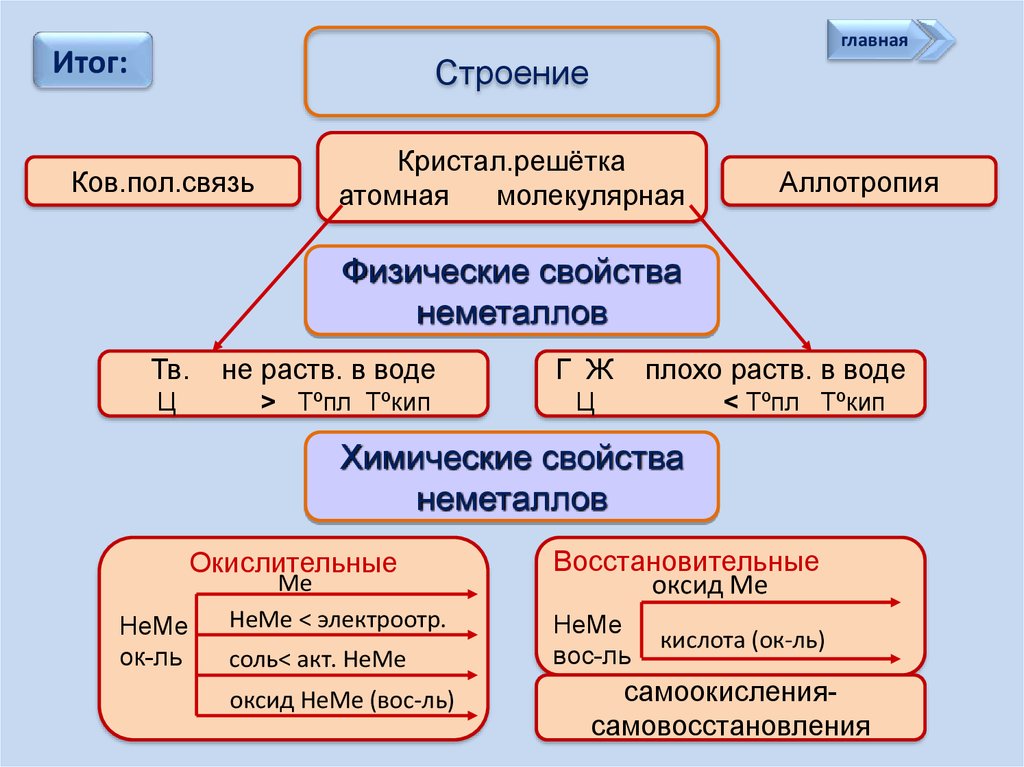
главнаяИтог:
Строение
Ков.пол.связь
Кристал.решётка
атомная
молекулярная
Аллотропия
Физические свойства
неметаллов
Тв.
Ц
не раств. в воде
> Tºпл Tºкип
Г Ж
плохо раств. в воде
Ц
< Tºпл Tºкип
Химические свойства
неметаллов
Окислительные
НеМе
ок-ль
Ме
НеМе < электроотр.
соль< акт. НеМе
оксид НеМе (вос-ль)
Восстановительные
оксид Ме
НеМе
вос-ль
кислота (ок-ль)
самоокислениясамовосстановления
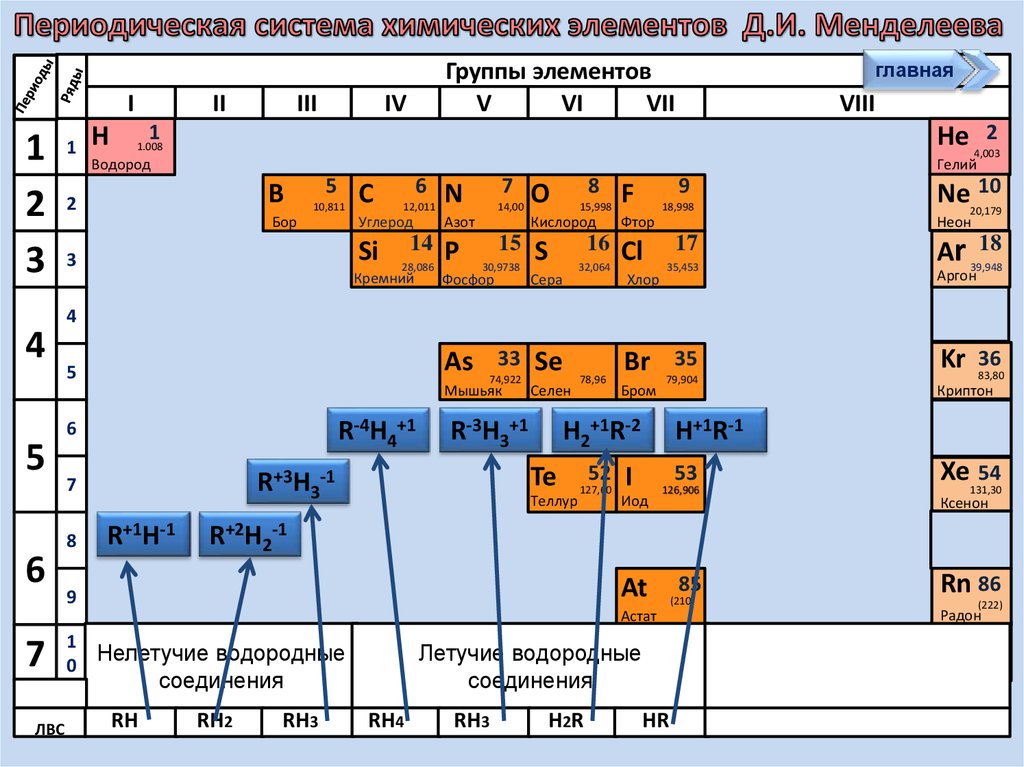
21. Водородные соединения НеМе
22.
I1
2
3
4
1
Н
II
III
IV
6
1
He 4,0032
Водород
Гелий
B
2
5
10,811
Бор
C
6
12,011
Углерод
Si
3
14,00
Азот
14
28,086
Кремний
7
N
Р
8
O
15,998
Кислород
15
30,9738
Фосфор
16
S
32,064
Сера
9
F
18,998
Фтор
Cl
Хлор
ЛВС
10
Ne20,179
Неон
17
35,453
18
Ar 39,948
Аргон
4
As
5
33
74,922
R-4Н4+1
6
8
R+1Н-1
Селен
R-3Н3+1
78,96
Br
Бром
35
79,904
Н2+1R-2
Te
R+3Н3-1
7
Se
Теллур
52
127,60
36
83,80
Криптон
126,906
Xe131,30
54
85
Rn 86
53
I
Иод
Ксенон
R+2Н2-1
At
9
1
Нелетучие водородные
0
Летучие водородные
соединения
соединения
RH
Kr
Н+1R-1
Астат
7
VIII
1.008
Мышьяк
5
главная
Группы элементов
V
VI
VII
RH2
RH3
RH4
RH3
H2 R
HR
(210)
(222)
Радон
23.
I1
2
3
4
5
6
7
ВО
ЛВС
1
Н
II
III
IV
1
NН3- основные свойства
1.008
Водород
B
2
5
10,811
Бор
C
6
12,011
Углерод
Si
3
14
28,086
Кремний
4
5
6
7
8
9
1
0
главная
Группы элементов
V
VI
VII
7
N
14,00
Азот
Р
8
O
15,998
Кислород
15
30,9738
Фосфор
16
S
Сера
32,064
VIII
НF- кислотные свойства
Гелий
F
9
10
Ne20,179
18,998
Фтор
Cl
Хлор
Неон
17
18
Ar 39,948
35,453
Аргон
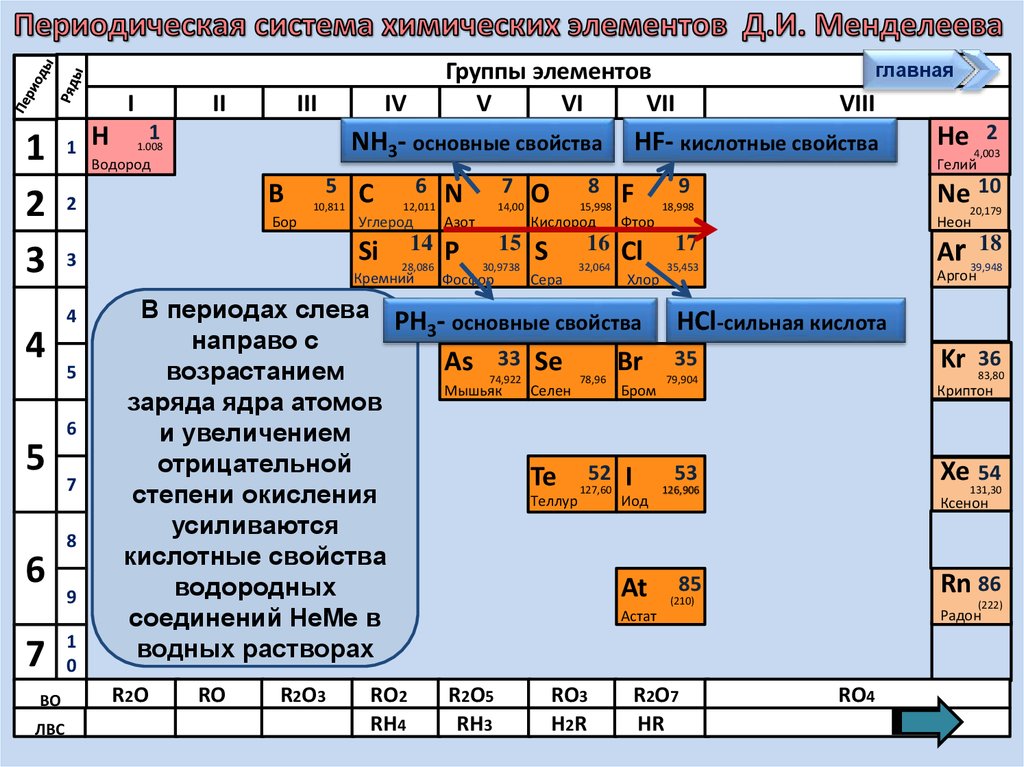
В периодах слева РН - основные свойства НCl-сильная кислота
3
направо с
33 Se
35
As 74,922
Br 79,904
возрастанием
78,96
Мышьяк
Селен
Бром
заряда ядра атомов
и увеличением
отрицательной
52 I
53
Te 127,60
126,906
степени окисления
Теллур
Иод
усиливаются
кислотные свойства
85
водородных
At (210)
Астат
соединений НеМе в
водных растворах
R2 O
RO
R 2 O3
RO2
RH4
R 2 O5
RH3
RO3
H2 R
He 4,0032
R 2 O7
HR
RO4
Kr
36
83,80
Криптон
Xe131,30
54
Ксенон
Rn 86
(222)
Радон
24.
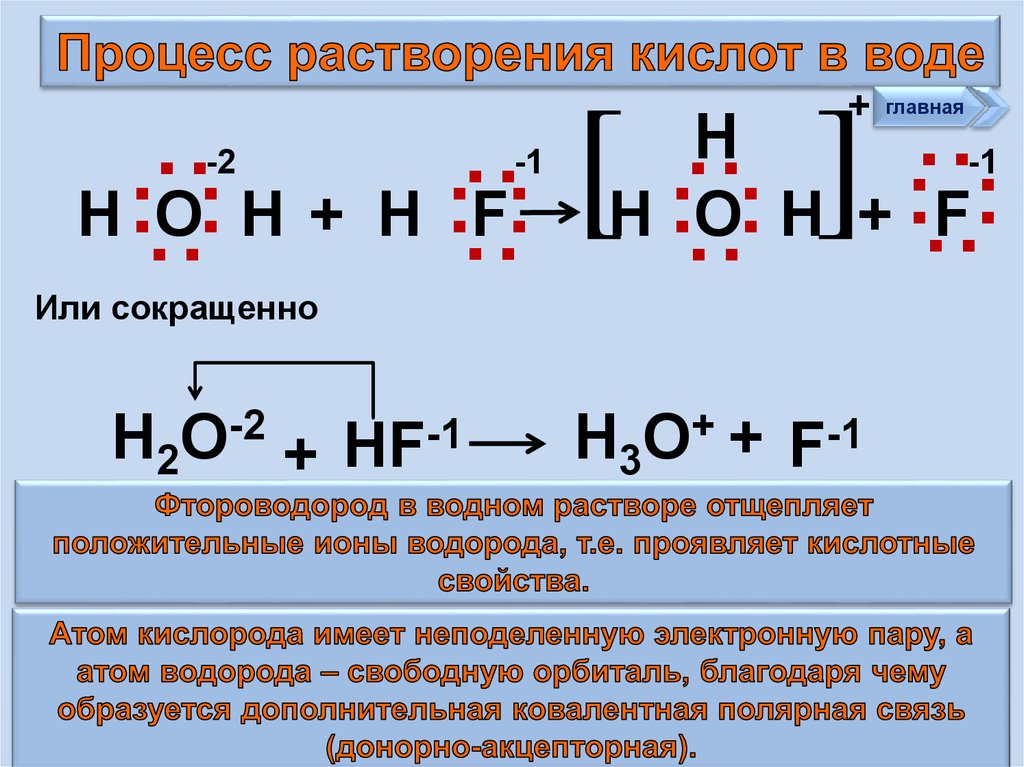
]Или сокращенно
Н2О-2 + НF-1
Н3О+ + F-1
:
:
:
[
:
Н :F:
главная
Н
-1
Н :O: Н + :F:
:
Н :О: Н +
-1
: :
:
-2
+
25.
I1
2
3
4
5
6
7
ВО
ЛВС
1
Н
II
III
IV
1
NН3- основные свойства
1.008
Водород
B
2
5
10,811
Бор
C
6
12,011
Углерод
Si
3
14
28,086
Кремний
4
5
6
7
8
9
7
N
14,00
Азот
Р
8
O
15,998
Кислород
15
30,9738
Фосфор
16
S
Сера
32,064
Мышьяк
Селен
Te
Теллур
52
He 4,0032
Гелий
F
9
10
Ne20,179
18,998
Фтор
Cl
Хлор
Бром
127,60
VIII
НF- слабая кислота
РН3- слабое основание
В группах сверху
33 Se
As 74,922
Br
78,96
вниз с увеличением
атомных радиусов
соответствующих
анионов кислотные
свойства
усиливаются, а
основные
ослабевают
главная
Группы элементов
V
VI
VII
Неон
17
18
Ar 39,948
35,453
Аргон
НCl-сильная кислота
Kr
35
79,904
Иод
At
126,906
Xe131,30
54
85
Rn 86
Ксенон
(210)
(222)
Радон
Астат
1
0
R2 O
RO
R 2 O3
RO2
RH4
R 2 O5
RH3
RO3
H2 R
83,80
Криптон
53
I
36
R 2 O7
HR
RO4
26.
-][ ]
:
:
:
Н2О-2 + Н3N-3
[
:
Н:О : Н + Н:N:Н
Или сокращенно Н
Н
Н:N: Н + :О:Н
Н
:
: :
:
-2
-3
+
главная
NН4+ + OH-
?
27.
I1
2
3
4
5
6
7
ВО
ЛВС
1
Н
II
III
IV
1
He 4,0032
Водород
Гелий
B
5
10,811
Бор
C
6
12,011
Углерод
Si
3
14
28,086
Кремний
5
6
VIII
1.008
2
4
главная
Группы элементов
V
VI
VII
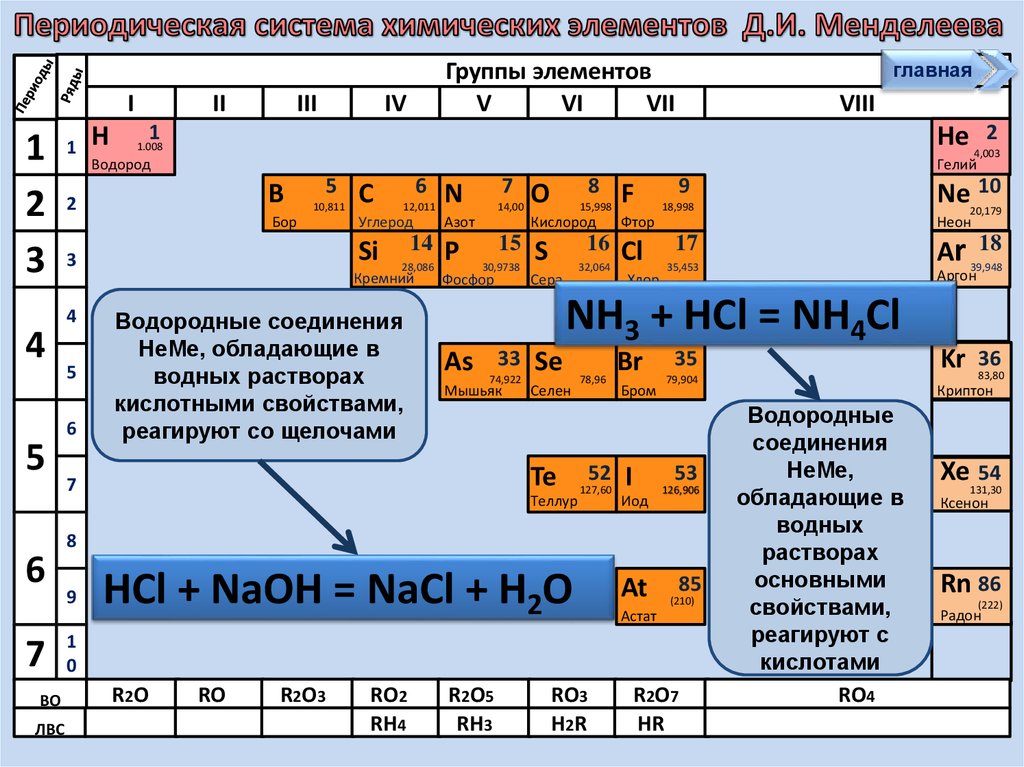
Водородные соединения
НеМе, обладающие в
водных растворах
кислотными свойствами,
реагируют со щелочами
7
N
14,00
Азот
Р
8
O
15,998
Кислород
15
30,9738
Фосфор
16
S
32,064
Сера
F
9
Фтор
Cl
Хлор
Неон
17
As
33
74,922
Мышьяк
Se
Селен
Te
Теллур
78,96
52
127,60
Br
HCl + NaOH = NaCl + H2O
Бром
35
53
I
Иод
126,906
At
85
(210)
Астат
1
0
RO
R 2 O3
RO2
RH4
Аргон
79,904
8
R2 O
18
Ar 39,948
35,453
NH3 + HCl = NH4Cl
7
9
10
Ne20,179
18,998
R 2 O5
RH3
RO3
H2 R
R 2 O7
HR
Kr
36
83,80
Криптон
Водородные
соединения
НеМе,
обладающие в
водных
растворах
основными
свойствами,
реагируют с
кислотами
RO4
Xe131,30
54
Ксенон
Rn 86
(222)
Радон
28.
I1
2
3
4
5
6
7
ВО
ЛВС
1
Н
II
III
IV
1
He 4,0032
Водород
Гелий
B
5
10,811
Бор
C
6
12,011
Углерод
Si
3
14
28,086
Кремний
5
6
7
8
9
VIII
1.008
2
4
главная
Группы элементов
V
VI
VII
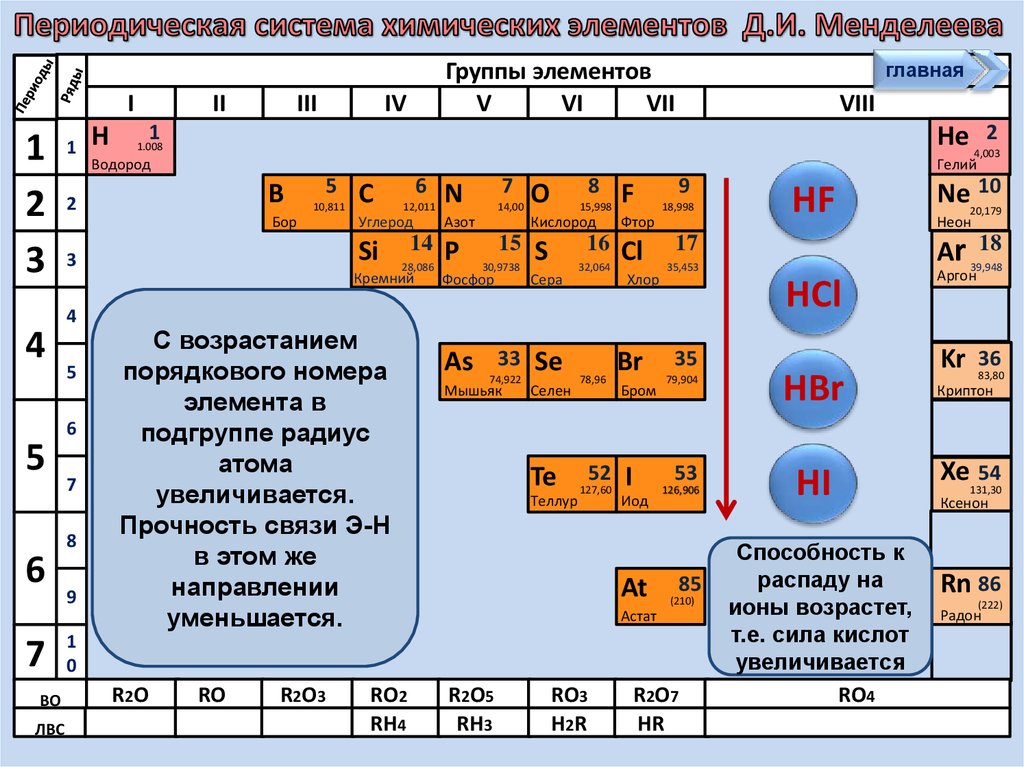
С возрастанием
порядкового номера
элемента в
подгруппе радиус
атома
увеличивается.
Прочность связи Э-Н
в этом же
направлении
уменьшается.
7
N
14,00
Азот
Р
15,998
Кислород
15
30,9738
Фосфор
As
8
O
33
74,922
Мышьяк
16
S
Сера
Se
Селен
Te
Теллур
32,064
78,96
52
127,60
F
9
18,998
Фтор
Cl
Хлор
Br
Бром
17
HCl
35
79,904
Иод
At
126,906
85
(210)
Астат
1
0
R2 O
RO
R 2 O3
RO2
RH4
R 2 O5
RH3
RO3
H2 R
R 2 O7
HR
10
Ne20,179
Неон
18
Ar 39,948
35,453
53
I
HF
HBr
HI
Способность к
распаду на
ионы возрастет,
т.е. сила кислот
увеличивается
RO4
Аргон
Kr
36
83,80
Криптон
Xe131,30
54
Ксенон
Rn 86
(222)
Радон
29.
I1
2
3
4
5
6
1
Н
II
III
IV
1
Гелий
B
5
10,811
C
6
12,011
Углерод
Si
3
14
28,086
Кремний
8
7
N
14,00
Азот
Р
8
O
15,998
Кислород
15
30,9738
Фосфор
16
S
Сера
32,064
F
9
18,998
Фтор
Cl
Хлор
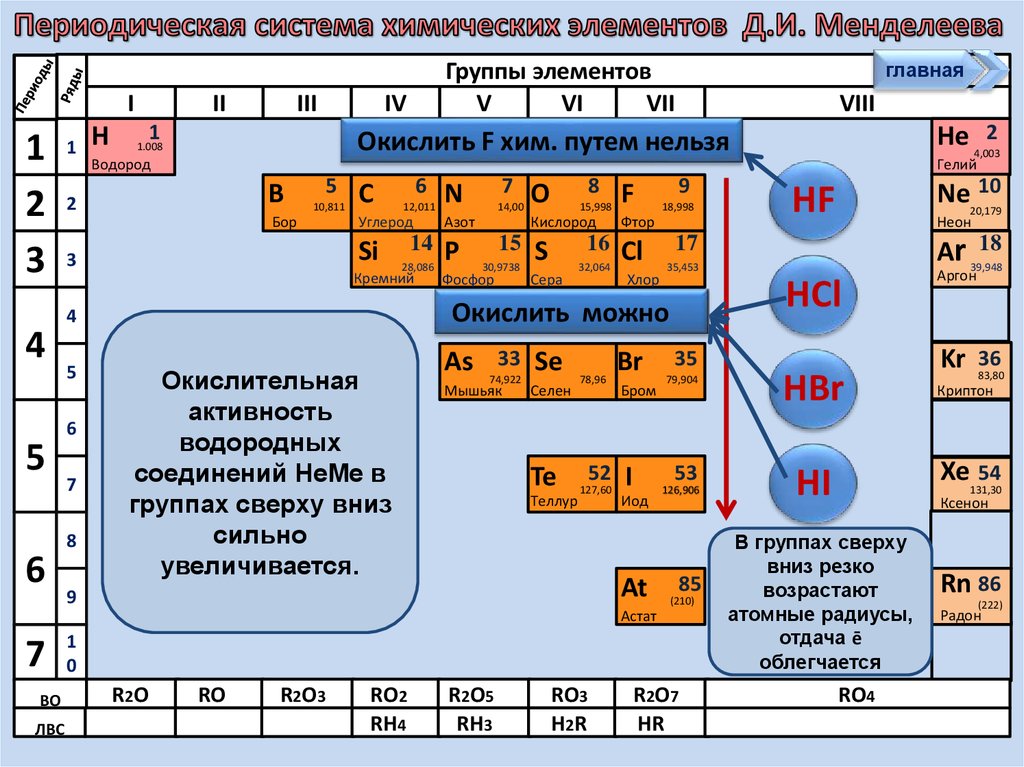
Окислительная
активность
водородных
соединений НеМе в
группах сверху вниз
сильно
увеличивается.
As
33
74,922
Мышьяк
Se
Селен
Te
Теллур
78,96
52
127,60
Br
Бром
Иод
At
9
ВО
35
79,904
126,906
85
(210)
ЛВС
1
0
R2 O
RO
R 2 O3
RO2
RH4
R 2 O5
RH3
RO3
H2 R
18
Ar 39,948
HCl
Астат
7
Неон
17
53
I
10
Ne20,179
HF
35,453
Окислить можно
4
7
He 4,0032
Водород
Бор
6
VIII
Окислить F хим. путем нельзя
1.008
2
5
главная
Группы элементов
V
VI
VII
R 2 O7
HR
HBr
Аргон
Kr
36
83,80
Криптон
Xe131,30
54
HI
Ксенон
В группах сверху
вниз резко
возрастают
атомные радиусы,
отдача ē
облегчается
RO4
Rn 86
(222)
Радон
30.
I1
2
3
4
1
Н
II
III
IV
1
He 4,0032
Водород
Гелий
B
5
10,811
Бор
C
Углерод
Si
3
6
12,011
14
28,086
Кремний
4
SiO2
14,00
Азот
Р
6
7
ВО
ЛВС
H2SiO3
15
30,9738
33
74,922
9
15,998
16
S
32,064
Сера
Se
Селен
52
Te
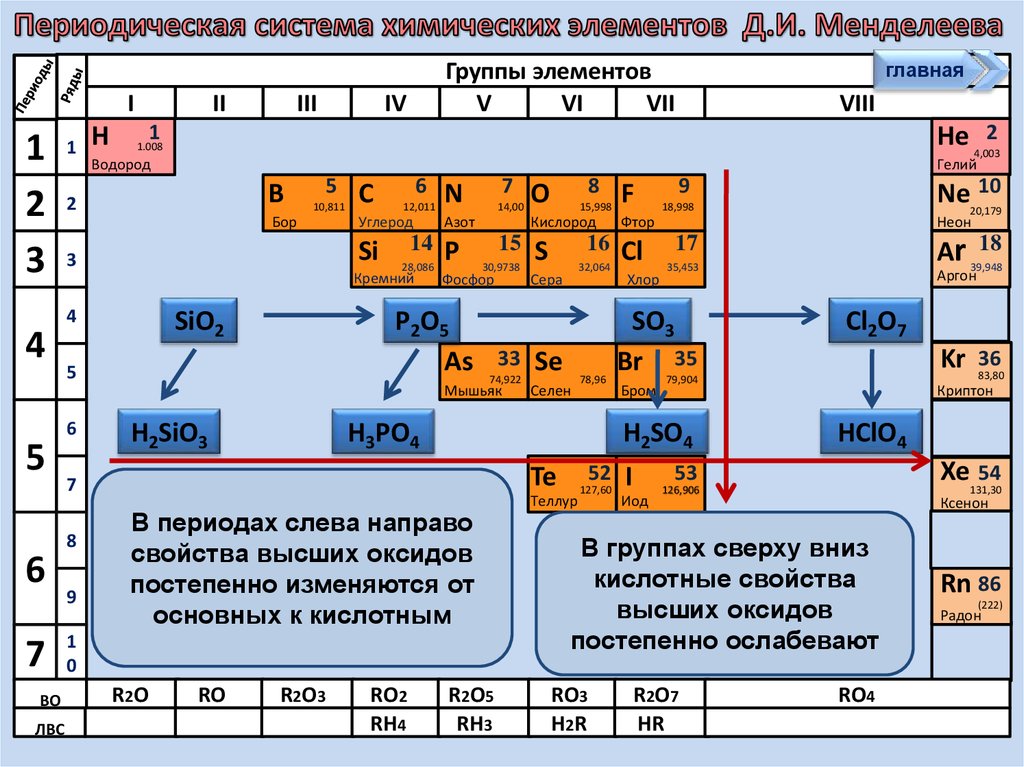
В периодах слева направо
свойства высших оксидов
постепенно изменяются от
основных к кислотным
1
0
R2 O
RO
78,96
H3PO4
7
8
8
O
Кислород
Фосфор
P2O5
As
5
7
N
Мышьяк
5
VIII
1.008
2
6
главная
Группы элементов
V
VI
VII
R 2 O3
RO2
RH4
R 2 O5
RH3
Теллур
127,60
F
9
10
Ne20,179
18,998
Фтор
Cl
Хлор
Неон
17
18
Ar 39,948
35,453
Аргон
SO3
35
Br 79,904
Cl2O7
H2SO4
HClO4
Kr
Бром
Иод
Xe131,30
54
126,906
Ксенон
В группах сверху вниз
кислотные
свойства
85
At (210)
высших
оксидов
Астат
постепенно ослабевают
RO3
H2 R
R 2 O7
HR
83,80
Криптон
53
I
36
RO4
Rn 86
(222)
Радон
31.
I1
2
3
4
1
Н
II
III
IV
6
VIII
1
1.008
Водород
B
2
5
10,811
Бор
C
Углерод
Si
3
6
12,011
14
28,086
Кремний
7
N
14,00
Азот
Р
8
O
15,998
Кислород
15
30,9738
Фосфор
16
S
Сера
32,064
F
9
18,998
Фтор
Cl
Хлор
17
35,453
4
As
5
33
74,922
Мышьяк
5
главная
Группы элементов
V
VI
VII
Селен
78,96
Br
Бром
35
79,904
R2+7O7-2
6
7
8
Se
R2+5O5-2
R+6O3-2
Te
Теллур
52
127,60
53
I
Иод
126,906
R+4O2-2
At
9
85
(210)
Астат
7
ВО
ЛВС
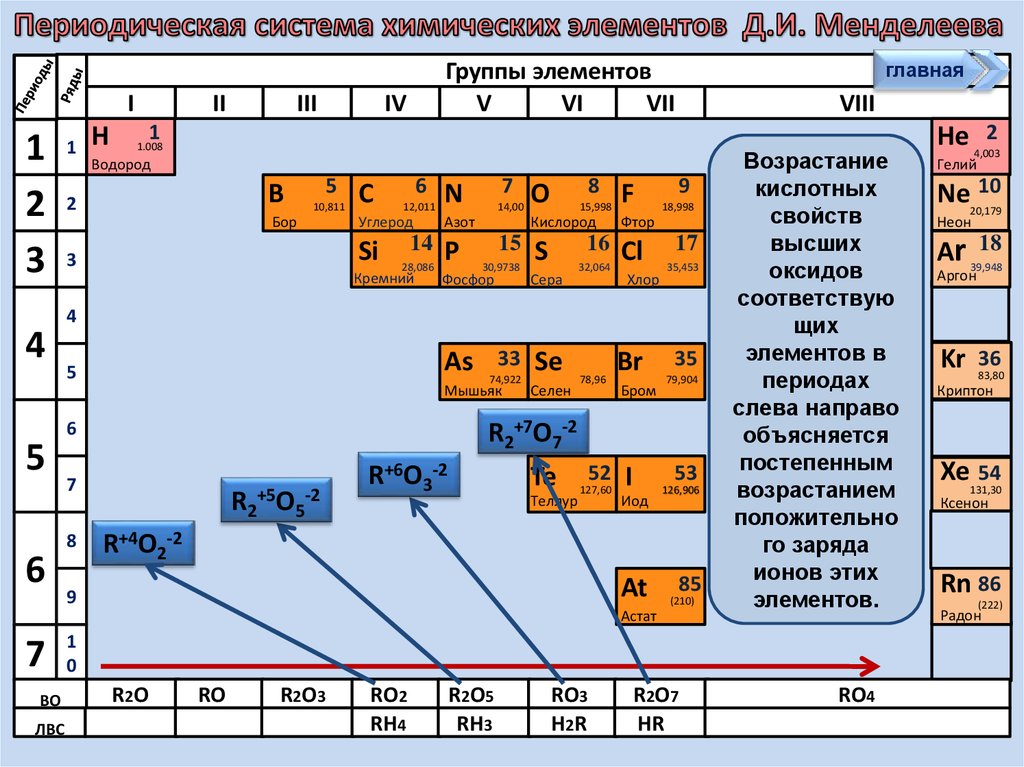
Возрастание
кислотных
свойств
высших
оксидов
соответствую
щих
элементов в
периодах
слева направо
объясняется
постепенным
возрастанием
положительно
го заряда
ионов этих
элементов.
1
0
R2 O
RO
R 2 O3
RO2
RH4
R 2 O5
RH3
RO3
H2 R
R 2 O7
HR
RO4
He 4,0032
Гелий
10
Ne20,179
Неон
18
Ar 39,948
Аргон
Kr
36
83,80
Криптон
Xe131,30
54
Ксенон
Rn 86
(222)
Радон
32.
I1
2
3
4
1
2
3
Н
II
III
6
7
ВО
ЛВС
IV
HNO2
SO2
B
B2O3
5
10,811
Бор
H3BO3
Si
7
N
14,00
Азот
14
28,086
Кремний
H2SO3 ClVIII
2O7
Гелий
9
HClO4
HClO3
Неон
Р
8
O
F
15,998
Кислород
15
30,9738
Фосфор
Фтор
16
S
Сера
H3PO4
HPO3
As2O5
H3AsO4
As
33
74,922
Мышьяк
TeO3
As2O3 H6TeO6
HAsO2
Cl
32,064
Хлор
Se
Селен
78,96
Br
17
35,453
SeO3
H2SeO4
R 2 O3
RO2
RH4
R 2 O5
RH3
35
79,904
10
Ne20,179
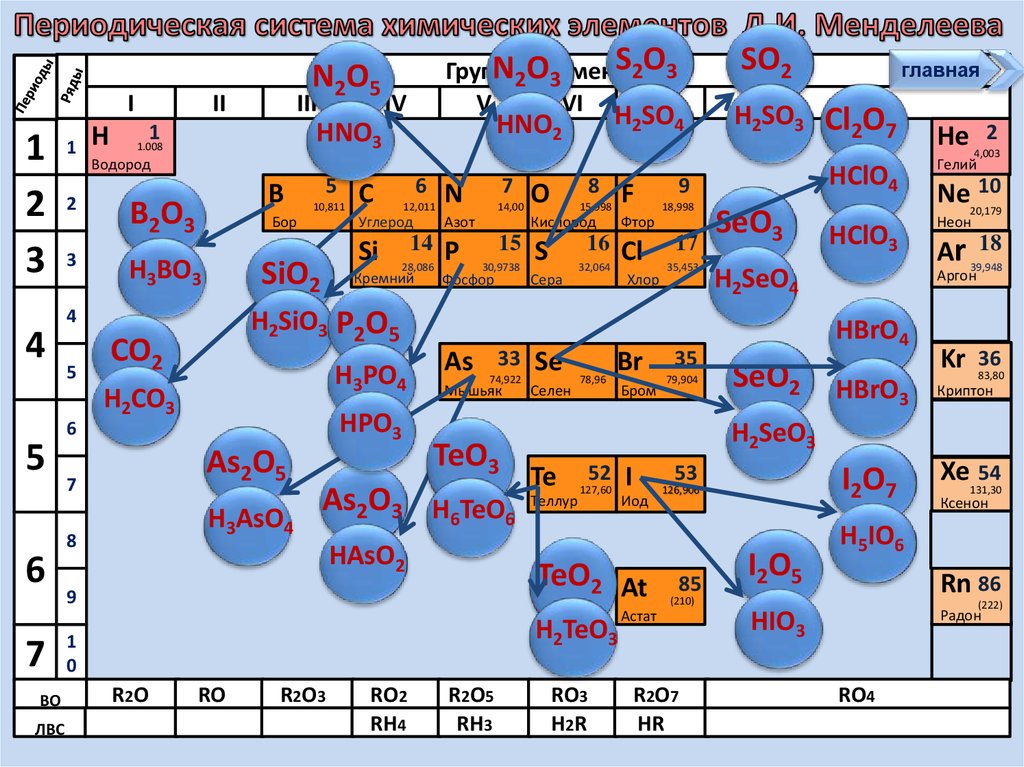
18
Ar 39,948
Аргон
HBrO4
SeO2
He 4,0032
HBrO3
Kr
36
83,80
Криптон
H2SeO3
Te
Теллур
52
127,60
H2TeO3
1
0
RO
Бром
53
I
Иод
TeO2 At
9
R2 O
18,998
H2SiO3 P2O5
6
8
6
12,011
Углерод
SiO2
CO2
7
C
главная
H2SO4
Водород
H2CO3
5
S2O3
N2Oэлементов
Группы
3
V
VI
VII
HNO3
1
1.008
4
5
N2O5
RO3
H2 R
I2O7
126,906
85
I2O5
R 2 O7
HR
Ксенон
H5IO6
Rn 86
(210)
Астат
Xe131,30
54
(222)
HIO3
Радон
RO4
33.
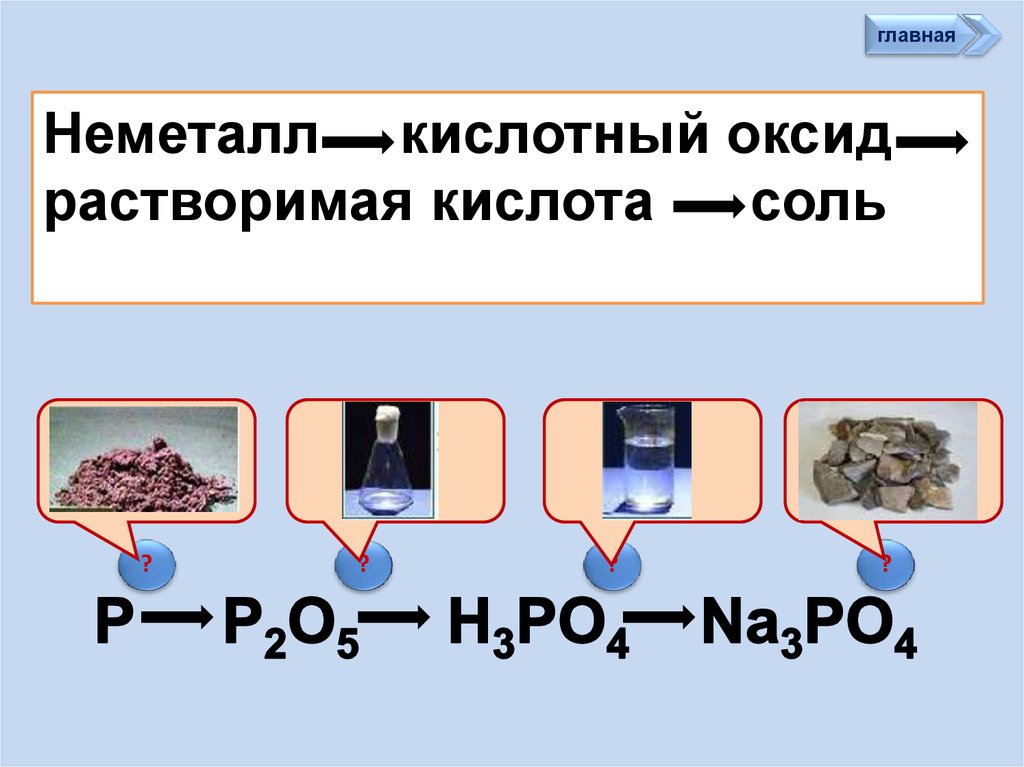
главнаяНеметалл кислотный оксид
растворимая кислота
cоль
?
?
?
?
34.
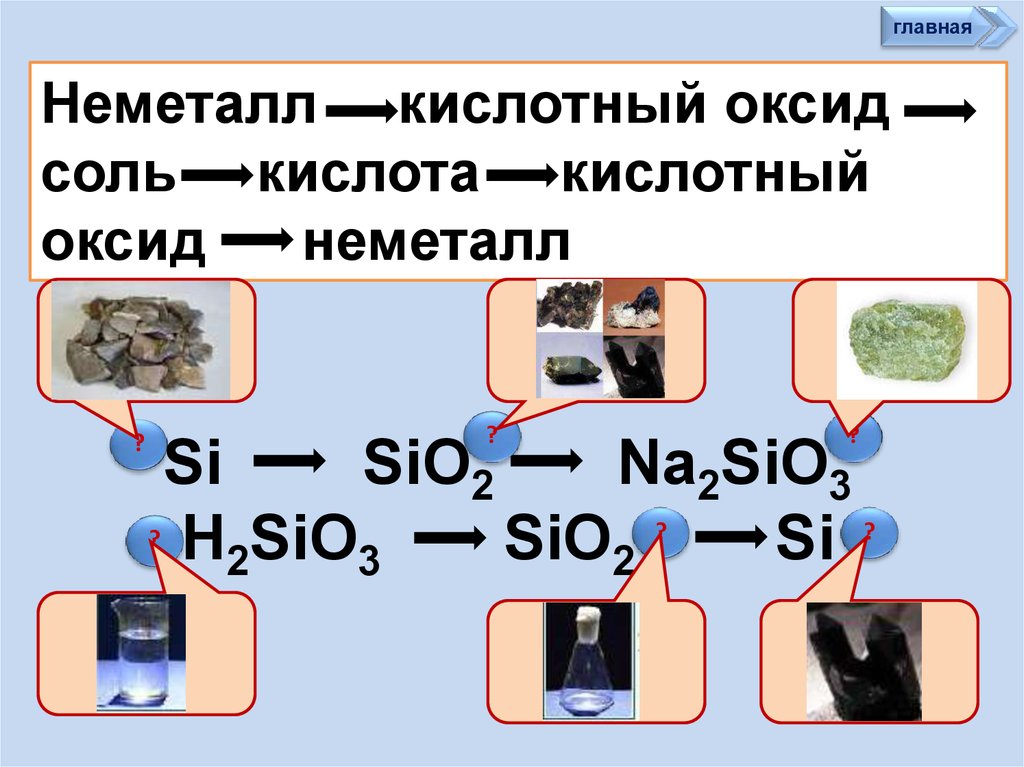
главнаяНеметалл кислотный оксид
соль кислота кислотный
оксид
неметалл
?
?
?
Si
SiO2
Na2SiO3
?
?
? H SiO
SiO2
Si
2
3
35.
Проверь себяглавная
Интерактив. Положение неметаллов в ПСХЭ Д.И. Менделеева:
http://school-collection.edu.ru/catalog/res/d77a57b7-8cff-11db-b606-0800200c9a66/view/
Интерактив. Особенности строения атомов неметаллов:
http://school-collection.edu.ru/catalog/res/d77a30ca-8cff-11db-b606-0800200c9a66/view/
Интерактив. Окислительные свойства неметаллов:
http://school-collection.edu.ru/catalog/res/d77a57b8-8cff-11db-b606-0800200c9a66/view/
Интерактив. Оксиды и гидроксиды неметаллов:
http://school-collection.edu.ru/catalog/res/d77a57ba-8cff-11db-b606-0800200c9a66/view/
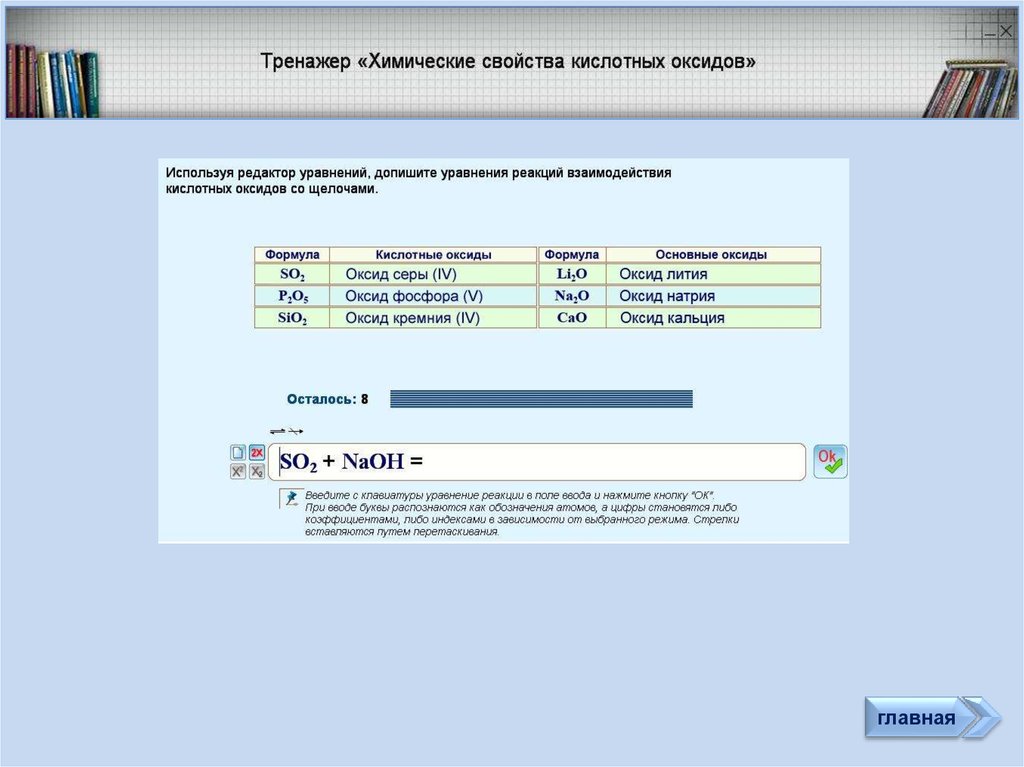
36.
Для удобства работы с электронными образовательными ресурсамирекомендуем вам обновить существующую версию плеера ОМС до
1.0.0.84.
Скачать дистрибутив плеера ОМС. ftp://ftp.fcior.edu.ru/oms/OMS.exe
главная
37.
главная38.
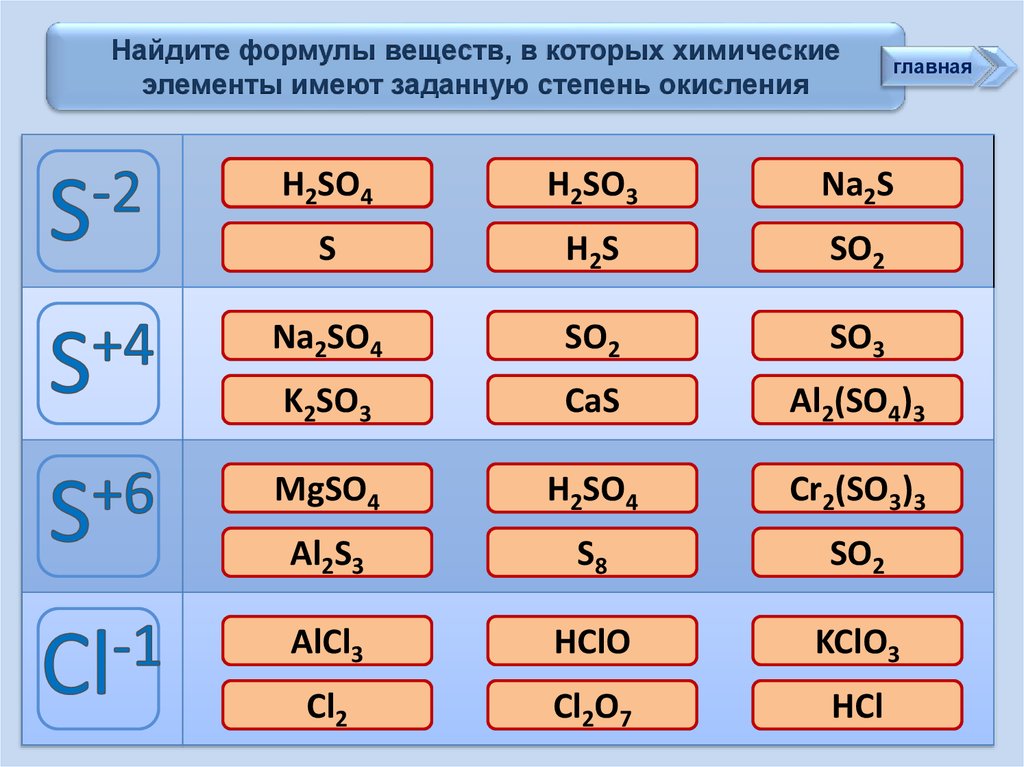
Найдите формулы веществ, в которых химическиеэлементы имеют заданную степень окисления
главная
H2SO4
H2SO3
Na2S
S
H2S
SO2
Na2SO4
SO2
SO3
K2SO3
CaS
Al2(SO4)3
MgSO4
H2SO4
Cr2(SO3)3
Al2S3
S8
SO2
AlCl3
HClO
KClO3
Cl2
Cl2O7
HCl
39.
Тестглавная
«Неметаллы»
Члены сообщества «Химоза»
Генералова Т.Я. Учитель химии высшей
квалификационной категории МОБУ
«СОШ №16» г. Минусинска;
Лебедева Л.В. Учитель химии высшей
квалификационной
категории МОУ «СОШ №3 с УИОП» г. Строитель;
Мидакова Н.В. Учитель химии первой
квалификационной категории МОУ «Красночетайская
СОШ» Красночетайского района Чувашской
Республики
27.08.2009
Совместное творчество











 chemistry
chemistry








