Similar presentations:
Оксиды неметаллов
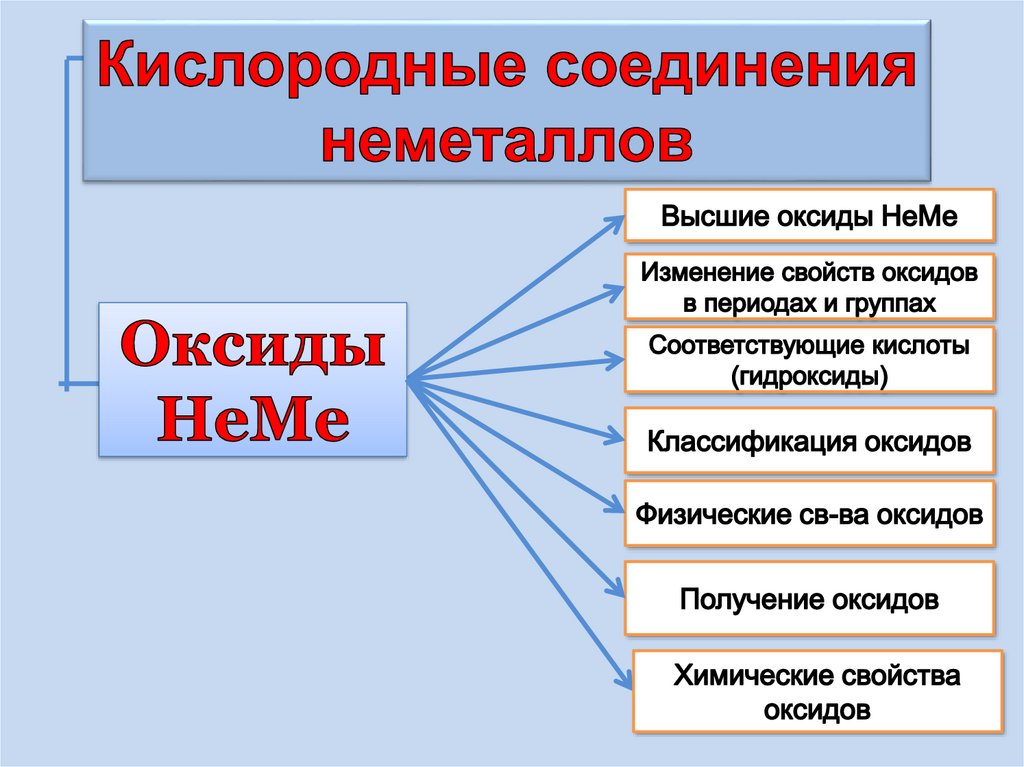
1. Оксиды неметаллов
«Если Вы работаете над поставленными целями,то эти цели будут работать на Вас!»
Дмим Рон
Ляскевич Л.Н.
преподаватель химии
высшей категории
2.
В результате изучения темы ,выбудете способны:
1. Рассматривать классификацию оксидов НеМе
2.Делать выводы по химической активности
оксидов НеМе
3.Рассматривать физические св-ва НеМеО
4. Рассматривать способы получения НеМеО
5.Писать уравнения реакций характеризующих
хим. св-ва оксидов НеМе
6.Осуществлять рефлексию учебной
деятельности
3.
4. SO
Оксиды неметалловIV
SO
IV
II
NO
CO
IV
V
PO
VI
IV
CO
SiO II
SO
NO
Составить формулы оксидов.
Определить класс оксидов.
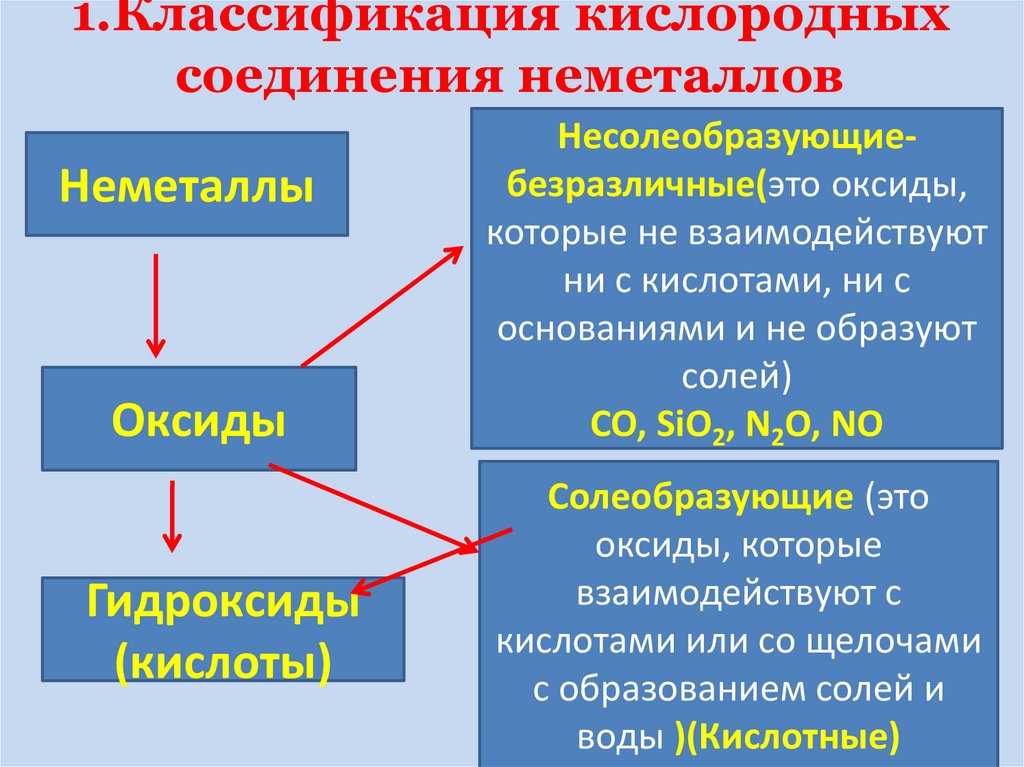
5. 1.Классификация кислородных соединения неметаллов
НеметаллыОксиды
Гидроксиды
(кислоты)
Несолеобразующиебезразличные(это оксиды,
которые не взаимодействуют
ни с кислотами, ни с
основаниями и не образуют
солей)
CO, SiO2, N2O, NO
Солеобразующие (это
оксиды, которые
взаимодействуют с
кислотами или со щелочами
с образованием солей и
воды )(Кислотные)
6.
NB!!! С повышением степени окисленияатомов элемента, образующего оксиды,
увеличиваются кислотные свойства его
оксидов и гидроксидов.
Неметаллы образуют кислотные оксиды
( исключение - несолеобразующие
оксиды).
Степени окисления НеМе
Характер оксидов
+1, +2
Основные оксиды
(исключение BeO,
ZnO, SnO, PbO
+3, +4
Амфотерные
оксиды и BeO, ZnO,
SnO, PbO
+5 и выше
Кислотные оксиды
7.
Как определить характер оксида:1. Определяем СО элемента, образующего
оксид.
1) Если СО элемента = +3 или более, то
оксид - кислотный
2) Если СО элемента = +1 или +2 , и
элемент – неметалл,- то оксид
безразличный (несолеобразующий)
8.
Задание 1.1. Из списка веществ выпишите
оксиды неметаллов
CO2, ZnO, Na2O, SO3, CaO, NO и
напишите соответствующие им
гидроксиды.
CO2→H2CO3
SO3→H2SO4
видеофрагмент
9. 2.Оксиды НеМе
1.Кристаллическая решетка:Преимущественно молекулярная,
SiO2 - атомная
2.Физические свойства:
газы(CO2, SO2, CO, NO2),
жидкости(H2O, N2O3, SO3 ),
твердые вещества(SiO2, P2O5, N2O5)
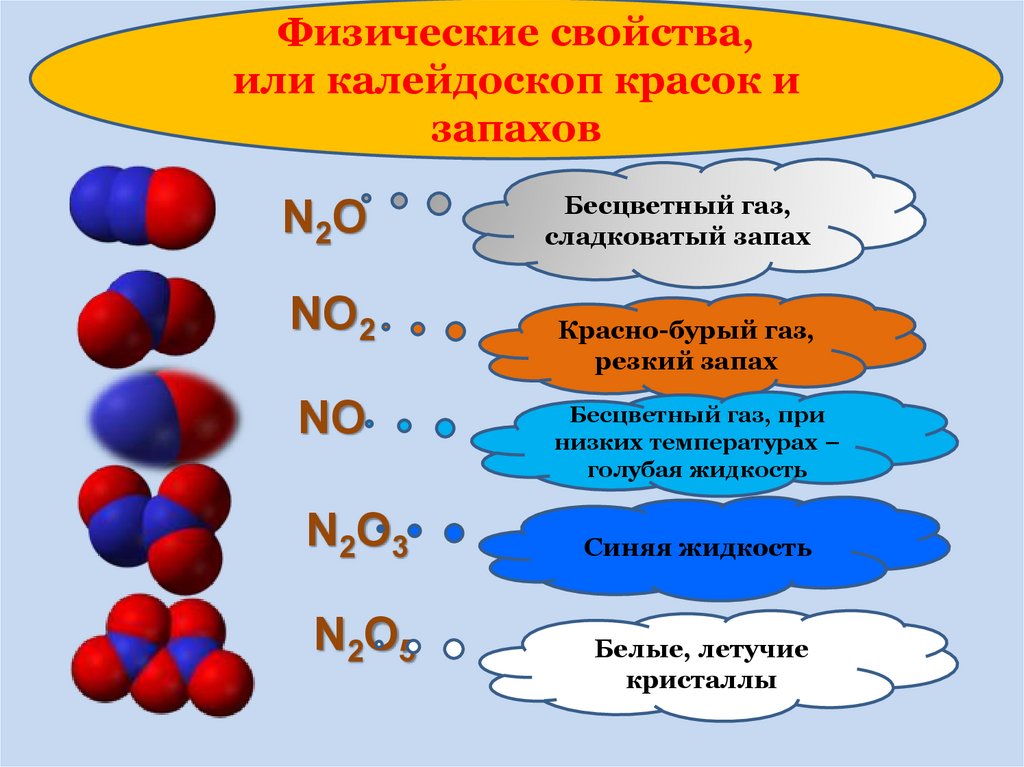
10.
Физические свойства,или калейдоскоп красок и
запахов
N 2O
NO2
NO
N 2O 3
N 2O 5
Бесцветный газ,
сладковатый запах
Красно-бурый газ,
резкий запах
Бесцветный газ, при
низких температурах –
голубая жидкость
Синяя жидкость
Белые, летучие
кристаллы
11.
I1
2
3
4
1
Н
II
III
IV
1
He 4,0032
Водород
Гелий
B
5
10,811
Бор
C
Углерод
Si
3
6
12,011
14
28,086
Кремний
4
SiO2
14,00
Азот
Р
6
7
ВО
ЛВС
H2SiO3
15
30,9738
33
74,922
9
15,998
16
S
32,064
Сера
Se
Селен
52
Te
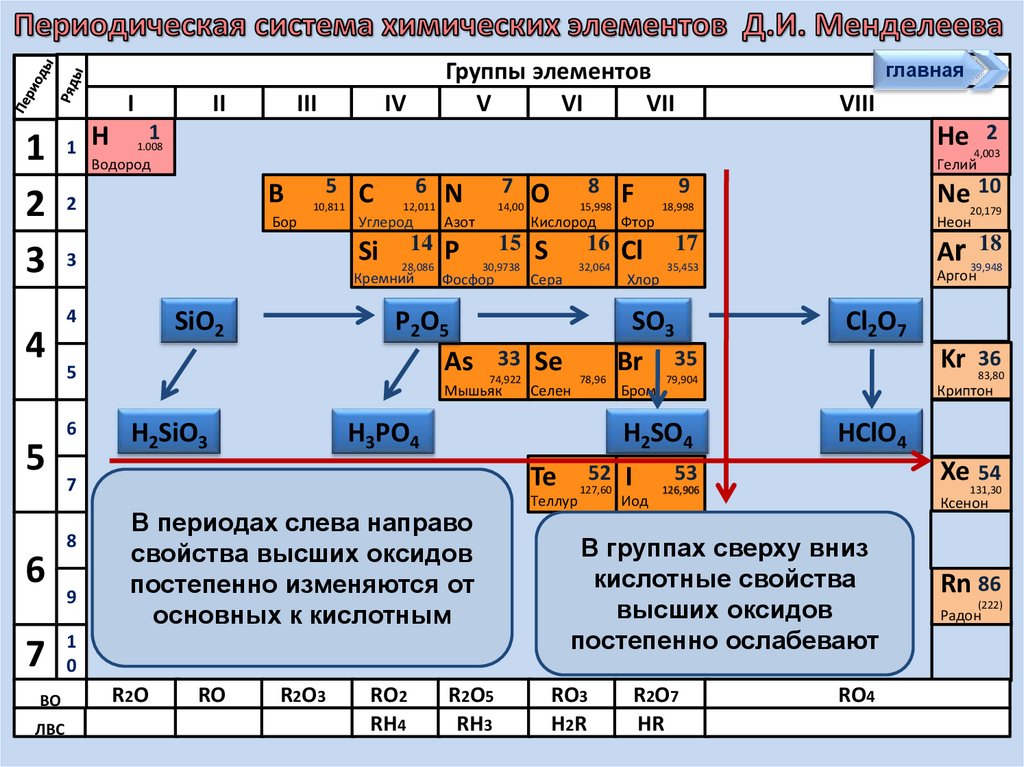
В периодах слева направо
свойства высших оксидов
постепенно изменяются от
основных к кислотным
1
0
R2 O
RO
78,96
H3PO4
7
8
8
O
Кислород
Фосфор
P2O5
As
5
7
N
Мышьяк
5
VIII
1.008
2
6
главная
Группы элементов
V
VI
VII
R 2 O3
RO2
RH4
R 2 O5
RH3
Теллур
127,60
F
9
10
Ne20,179
18,998
Фтор
Cl
Хлор
Неон
17
18
Ar 39,948
35,453
Аргон
SO3
35
Br 79,904
Cl2O7
H2SO4
HClO4
Kr
Бром
Иод
Xe131,30
54
126,906
Ксенон
В группах сверху вниз
кислотные
свойства
85
At (210)
высших
оксидов
Астат
постепенно ослабевают
RO3
H2 R
R 2 O7
HR
83,80
Криптон
53
I
36
RO4
Rn 86
(222)
Радон
12.
Задание 2.Расположите оксиды в порядке
возрастания кислотных свойств:
SiO2;P2O5
; Cl2O7
а) Cl2O7;
SiO2;;SO3
P2O5
; SO3
Задание 3.
Расположите оксиды в порядке
уменьшения кислотных свойств:
N2O5; As
P2O5;
а) N2O5;
P2O5As
; SiO2
2O5
2O5 ;SiO2;
13.
I1
2
3
4
1
Н
II
III
IV
6
VIII
1
1.008
Водород
B
2
5
10,811
Бор
C
Углерод
Si
3
6
12,011
14
28,086
Кремний
7
N
14,00
Азот
Р
8
O
15,998
Кислород
15
30,9738
Фосфор
16
S
Сера
32,064
F
9
18,998
Фтор
Cl
Хлор
17
35,453
4
As
5
33
74,922
Мышьяк
5
главная
Группы элементов
V
VI
VII
Селен
78,96
Br
Бром
35
79,904
R2+7O7-2
6
7
8
Se
R2+5O5-2
R+6O3-2
Te
Теллур
52
127,60
53
I
Иод
126,906
R+4O2-2
At
9
85
(210)
Астат
7
ВО
ЛВС
Возрастание
кислотных
свойств
высших
оксидов
соответствую
щих
элементов в
периодах
слева направо
объясняется
постепенным
возрастанием
положительно
го заряда
ионов этих
элементов.
1
0
R2 O
RO
R 2 O3
RO2
RH4
R 2 O5
RH3
RO3
H2 R
R 2 O7
HR
RO4
He 4,0032
Гелий
10
Ne20,179
Неон
18
Ar 39,948
Аргон
Kr
36
83,80
Криптон
Xe131,30
54
Ксенон
Rn 86
(222)
Радон
14.
I1
2
3
4
1
2
3
Н
II
III
6
7
ВО
ЛВС
IV
HNO2
SO2
H2SO4
H2SO3 ClVIII
2O7
Гелий
9
HClO4
HClO3
Неон
Водород
B
B2O3
5
10,811
Бор
H3BO3
Si
SiO2
7
N
14,00
Азот
14
28,086
Кремний
H3PO4
HPO3
6
As2O5
H3AsO4
8
6
12,011
Р
8
O
F
15,998
Кислород
15
30,9738
Фосфор
Фтор
16
S
Сера
As
33
74,922
Мышьяк
TeO3
As2O3 H6TeO6
HAsO2
Cl
32,064
Хлор
Se
Селен
78,96
Br
17
35,453
SeO3
H2SeO4
R 2 O3
RO2
RH4
R 2 O5
RH3
35
79,904
10
Ne20,179
18
Ar 39,948
Аргон
HBrO4
SeO2
He 4,0032
HBrO3
Kr
36
83,80
Криптон
H2SeO3
Te
Теллур
52
127,60
H2TeO3
1
0
RO
Бром
53
I
Иод
TeO2 At
9
R2 O
18,998
H2SiO3 P2O5
CO2
7
C
Углерод
H2CO3
5
SO3
N2Oэлементов
Группы
3
V
VI
VII
HNO3
1
1.008
4
5
N2O5
RO3
H2 R
I2O7
126,906
85
I2O5
R 2 O7
HR
Ксенон
H5IO6
Rn 86
(210)
Астат
Xe131,30
54
(222)
HIO3
Радон
RO4
15.
16.
3.Получение оксидов НеМеЗадание 4.Написать
уравнения р-ций
Сжиганием
простых в-в
Взаимодейств
ием солей
неустойчивых
кислот с МеО
Разложением
при
прокаливании
солей
Сжиганием
или
окислением
сложных в-в
Обжигом
твердых
сложных
в-в
НеМеО
!!! учебник , стр.196-197
17.
4.Химические свойства оксидов НеМеВзаимодейс
твие со
щелочами
Взаимодейс
твие с
основными
оксидами
Менее летучие
кислотные оксиды
вытесняют более
летучие кислотные
оксиды из их солей.
Взаимодействие
с кислородом
(если возможно
повышение степени
окисления)
Взаимоде
йствие с
водой
18.
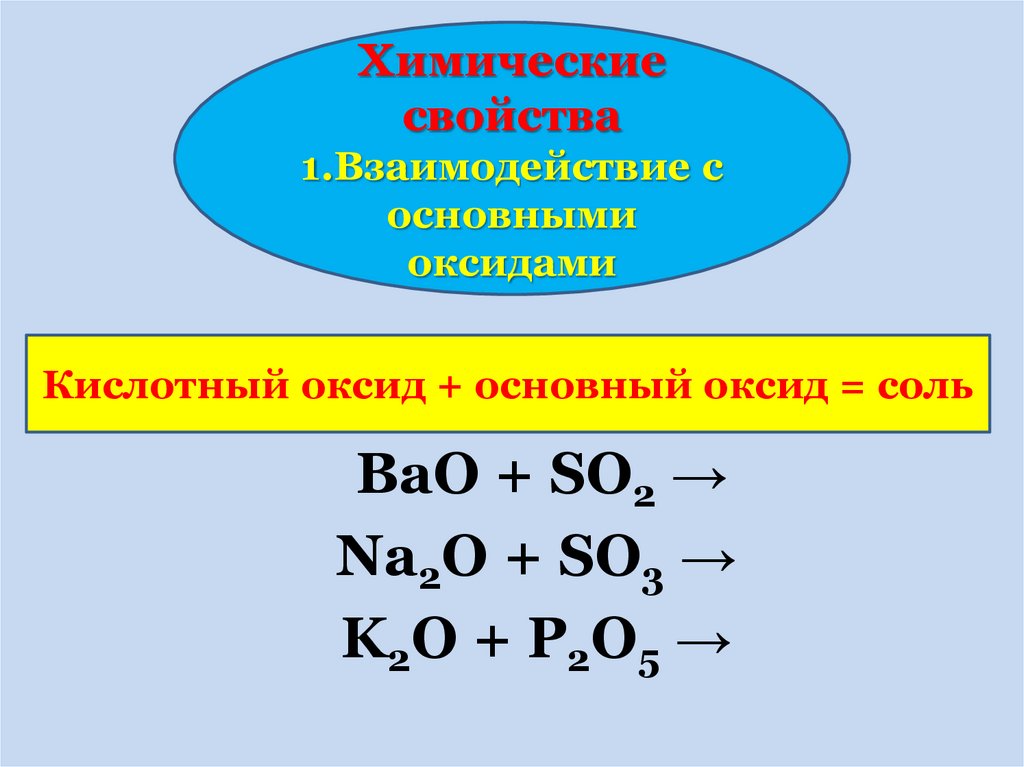
Химическиесвойства
1.Взаимодействие с
основными
оксидами
Кислотный оксид + основный оксид = соль
BaO + SO2 →
Na2O + SO3 →
K 2O + P 2O 5 →
19.
2.Взаимодействиесо щелочами
Кислотный оксид + щелочь = соль и вода
P2O5 + LiOH →
SO3 + Ba(OH)2 →
CO2 + NaOH →
20.
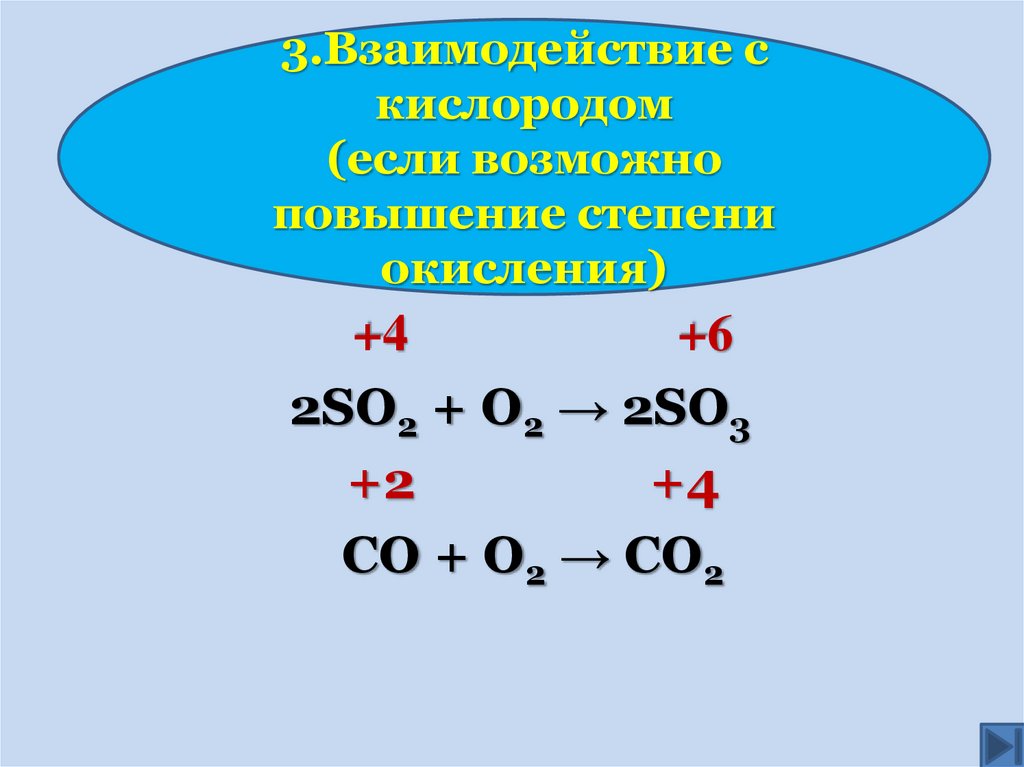
3.Взаимодействие скислородом
(если возможно
повышение степени
окисления)
+4
+6
2SO2 + O2 → 2SO3
+2
+4
СО + О2 → СО2
21.
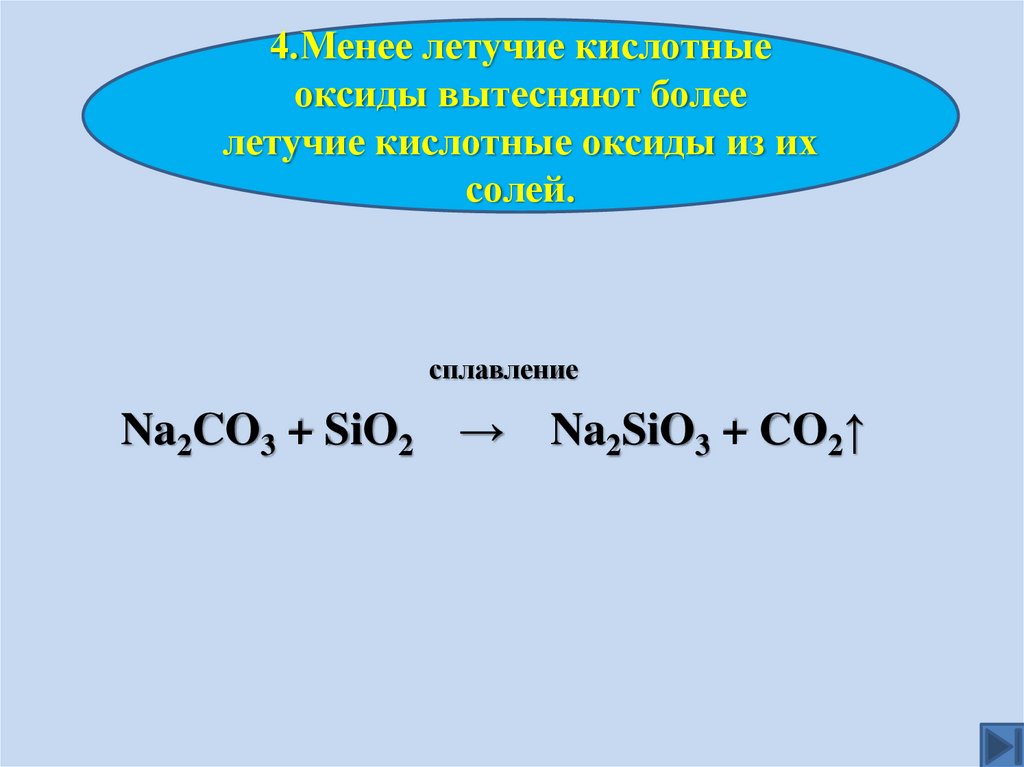
4.Менее летучие кислотныеоксиды вытесняют более
летучие кислотные оксиды из их
солей.
сплавление
Na2CO3 + SiO2 → Na2SiO3 + CO2↑
22.
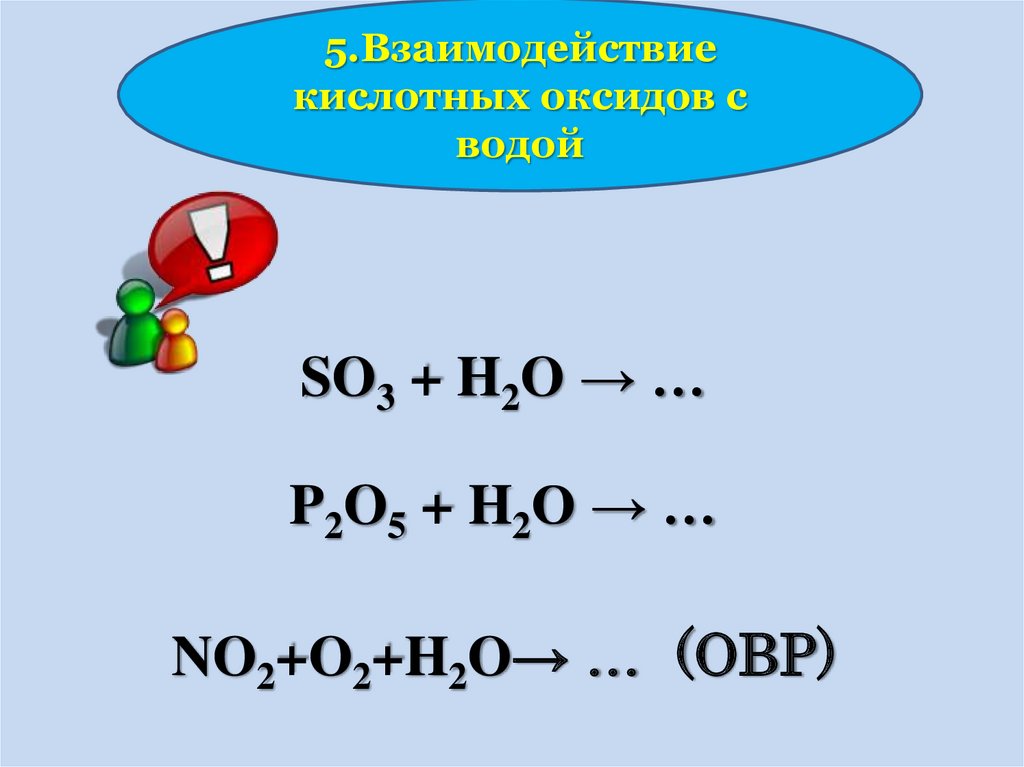
5.Взаимодействиекислотных оксидов с
водой
SO3 + H2O → …
P2O5 + H2O → …
NO2+O2+H2O→ … (ОВР)
23. Кислотным оксидам соответствуют кислоты
SO2 → H2SO3SO3 → H2SO4
CO2 → H2CO3
P2O5 → H3PO4
N2O5 → HNO3
видеофрагмент
24. Кислотные дожди
Чемопасны?
Здоровье
человека
Откуда
берутся?
«+»
кислотн
ых
дождей?
25.
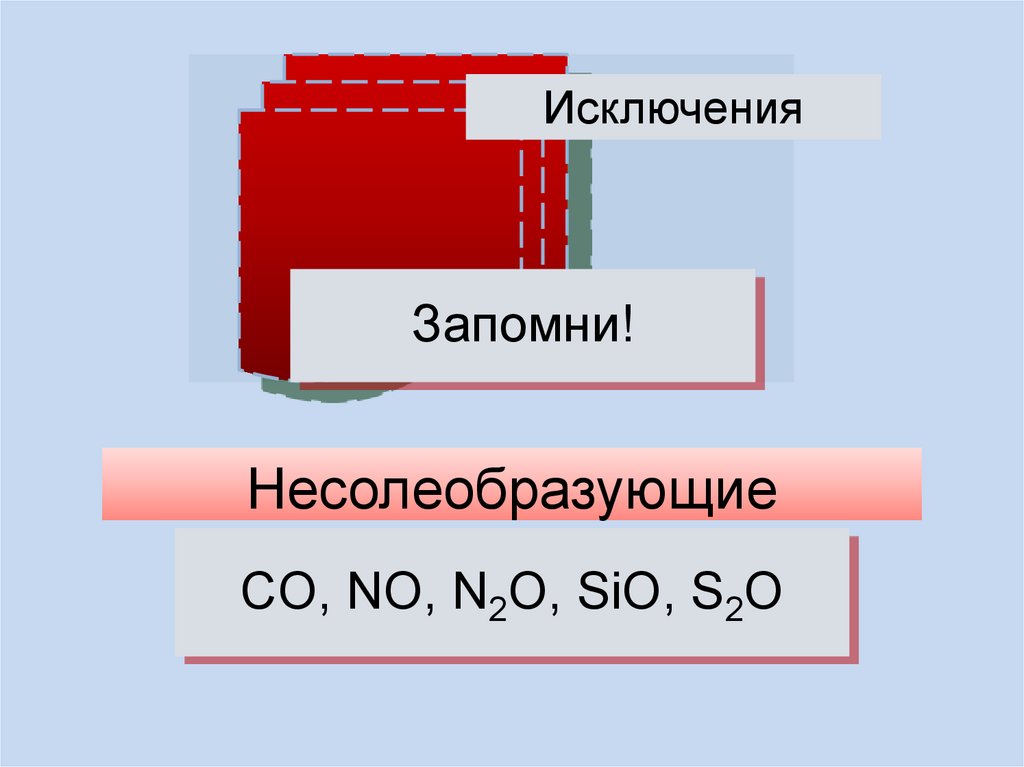
ИсключенияЗапомни!
Несолеобразующие
CO, NO, N2O, SiO, S2O
26.
Окисление безразличныхнесолеобразующих оксидовдо кислотных
2NO+O2↔2NO2
2CO+O2↔2CO2
Восстановление Ме
с помощью безразличныхнесолеобразующих оксидов
CO+O3↔2CO2
27.
Окисление безразличныхнесолеобразующих оксидовдо кислотных
2NO+O2↔2NO2
2CO+O2↔2CO2
Восстановление Ме
с помощью безразличныхнесолеобразующих оксидов
t
CO+Fe2O3↔2FeO+CO2↑
t
CO+FeO↔Fe+CO2↑
28.
Углекислый газСО2
Оксид углерода (IV), диоксид
углерода
Содержание углекислого газа в атмосфере
0,04—0,03%.
Растения, благодаря фотосинтезу,
усваивают углекислый газ из атмосферы,
превращая минеральные вещества в
органические - глюкозу, крахмал и
кислород.
Образуется углекислый газ при дыхании
и сгорании топлива, при тлении и
гниении органических веществ,
содержится в вулканических газах.
Минеральные источники содержат
углекислый газ.
Продукты в углекислом газе не
плесневеют, не гниют
«Сухой лёд»
29.
Угарный газ СООксид углерода (II)
Образуется при неполном
сгорании топлива, в выхлопных
газах.
Очень опасен для здоровья,
загрязняет атмосферу.
Используется в металлургии для
восстановления металлов из их
оксидов.
СО используют при обработке
мяса животных и рыбы для
придания им цвета.
30.
Оксид кремния (IV)SiO2
Кварцевый песок, кремнезём,
горный хрусталь, кварц, яшма,
кремень, аметист, опал
Оксиды кремния и алюминия
составляют основную массу
земной коры – литосферы, это
многочисленные минералы и
горные породы.
Изделия
31.
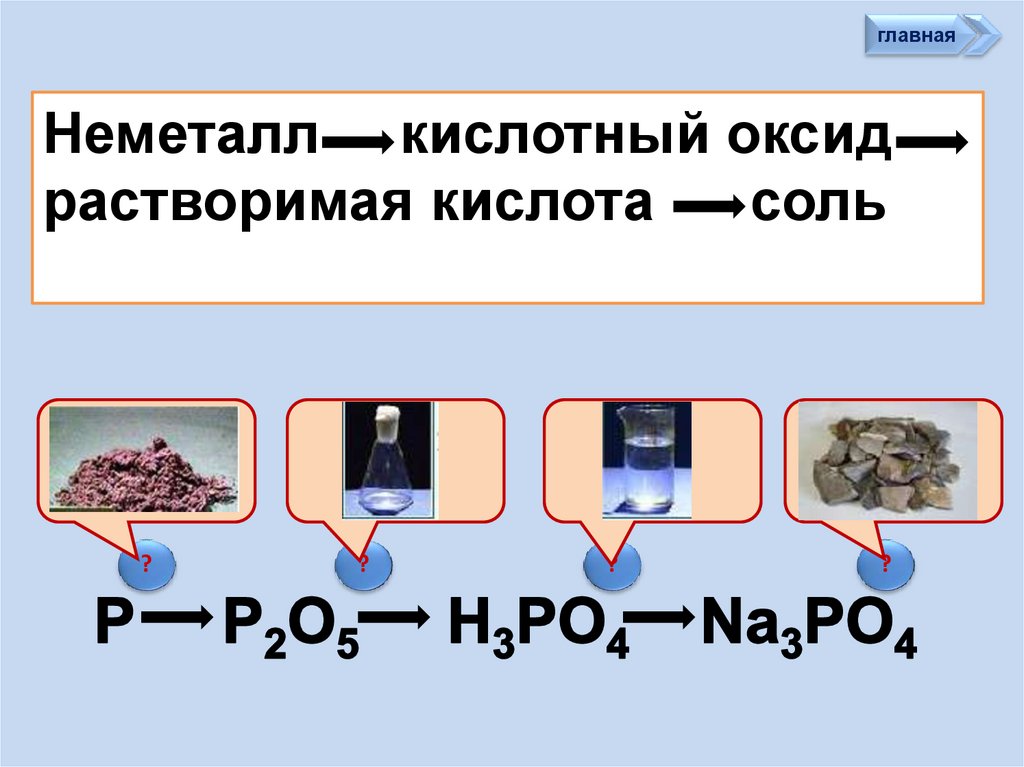
главнаяНеметалл кислотный оксид
растворимая кислота
cоль
?
?
?
?
32.
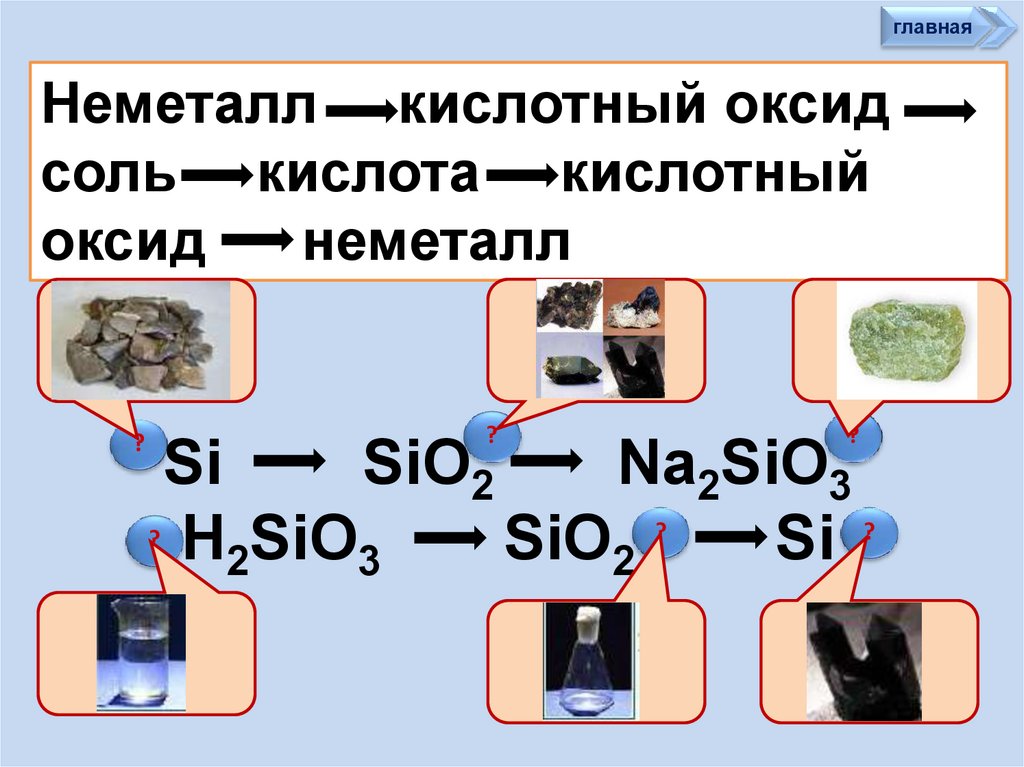
главнаяНеметалл кислотный оксид
соль кислота кислотный
оксид
неметалл
?
?
?
Si
SiO2
Na2SiO3
?
?
? H SiO
SiO2
Si
2
3
33.
Домашнее заданиеЗадание 1.
1. Кислотным и основным оксидом являются соответственно: 1) SO2 и MgO;
2) CO2 и Al2O3; 3) Na2O и FeO; 4) ZnO и SO2.
2. Степень окисления хлора в HСlO4: 1) +1; 2) +3; 3) +5; 4) +7.
3. Оксиды с общей формулой R2O3 и R2O5 образуют элементы подгруппы:
1) углерода; 2) азота; 3) серы; 4) фтора.
4. Установите соответствие между формулой вещества 1) Ва(ОН)2; 2) HClO4;
3) NH4H2PO4; 4) Mn2O7 и классом неорганических соединений: А) кислотный
оксид; Б) бескислородная кислота; В) кислая соль; Г) основный оксид; Д)
кислородсодержащая кислота; Е) основание.
5. Осуществите цепочку превращений: SiO2→K2SiO3→ Н2SiO3
34.
Задание 2.С какими из следующих веществ будет
реагировать CO2 , написать возможные
реакции:
CO2 + CaO →
CO2 + P2O5 →
CO2 + NaOH→
CO2 + Na2SO4 →
CO2 + H2O→
35.
«Острова»о. Грусти
о.Тревоги
о.Просветления
о.Бермудский
треугольник
36.
БЛАГАДАРЮЗА
УРОК!!!























 chemistry
chemistry








