Similar presentations:
Оксиды
1. ОКСИДЫ
2. Что такое оксиды?
Оксиды – это сложные вещества,состоящие из двух элементов, один
из которых кислород, со степенью
окисления -2
Общая формула:
ЭO
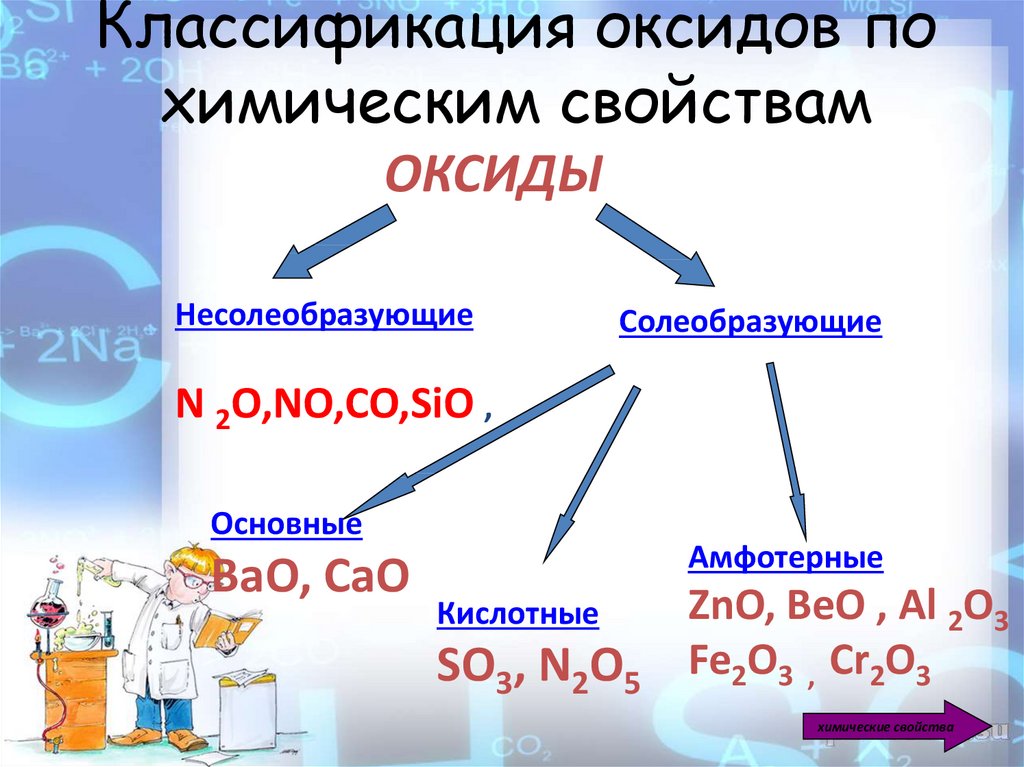
3. Классификация оксидов по химическим свойствам
ОКСИДЫНесолеобразующие
Солеобразующие
N 2O,NO,CO,SiO ,
Основные
ВаО, СаО
Амфотерные
Кислотные
SO3, N2O5
ZnO, BeO , Al 2O3
Fe2O3 , Cr2O3
химические свойства
4. Какие элементы образуют кислотные и основные оксиды?
Основные оксиды образуют металлы,которые проявляют валентность I, II,
Примеры: Na2O, MgO, CaO, CuO, K2O, FeO.
Кислотные оксиды образуют неметаллы и
металлы, которые проявляют валентность
больше IV (например Мn2O7, СrO3).
SO2, P2O5, CO2, SiO2, N2O5
5. Химические свойства оксидов
1 правило:О+О #
К+К #
О+К =
2 правило: При реакции двух оксидов
образуется 1 продукт (реакция
соединения)
3правило: Кислотный оксид
переходит в кислотный
остаток.
6. Химические свойства основных оксидов
1.Взаимодействие с водой- 8 шт. :Правило: при взаимодействии
основных оксидов с водой образуются
растворимые основания (щелочи).
Примеры: Li2O + H2O = 2LiOH
Na2O + H2O = 2NaOH
K2O + H2O = 2KOH
BaO + H2O = Ba(OH)2
7. Химические свойства основных оксидов
Обратите внимание! С водойвзаимодействуют только оксиды активных
металлов 8штук (лития, натрия, калия,
рубидия, цезия, кальция, стронция, бария)!
CuO + H2O # Cu(OH)2
нерастворимое
8. Химические свойства основных оксидов
2. Взаимодействие с кислотнымиоксидами:
Примеры: СаО + N2O5 = Ca(NO3)2
о.о.
к.о.
Соль
Na2O + SO3 = Na2SO4
о.о.
к.о.
соль
9. Химические свойства основных оксидов
3. Взаимодействие с кислотамиПравило: При взаимодействии основных
оксидов с кислотами образуются соль и
вода.
Примеры ВаО + 2HNO3 = Ва(NO3)2 + H2O
о.о.
к-та
соль
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
о.о.
к-та
соль
10. Химические свойства кислотных оксидов
1. Взаимодействие с водойПравило: Все кислотные оксиды с
водой образуют кислоты (кроме
песка – оксида кремния SiO2)
SiO2 + H2O # H2SiO3
нерастворима
11. Химические свойства кислотных оксидов
1. Взаимодействие с водойПравило: Все кислотные оксиды с водой
образуют кислоты, кислотный оксид
переходит в кислотный остаток
Примеры: SO3 + H2O = H2SO4
SO2 + H2O = H2SO3
СО2 + Н2О = Н2СО3
P2O5 +3H2O =2 H3PO4
12. Химические свойства кислотных оксидов
2. Взаимодействие кислотных оксидов сосновными оксидами (см. выше)
СО2 + Na2О = Na2СО3
к.о.
о.о.
Соль
P2O5 +3K2O =2 K3PO4
к.о.
о.о.
соль
13. Химические свойства кислотных оксидов
3. Взаимодействие с основаниями, нотолько растворимыми (с щелочами) !!!
Правило: образуются соль и вода, а
кислотный оксид переходит в
кислотный остаток.
SO2 + 2NaOH =Na2SO3 + H2O
К.О.
основание (Р)
соль
14. Химические свойства кислотных оксидов
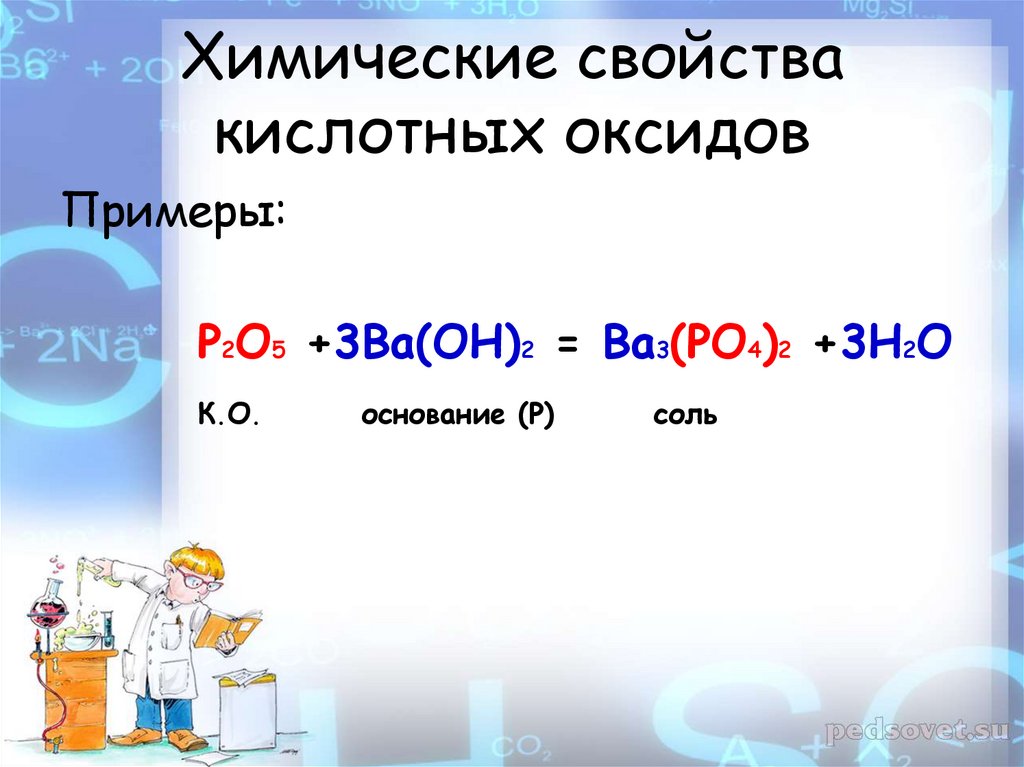
Примеры:P2O5 +3Ba(OH)2 = Ba3(PO4)2 +3H2O
К.О.
основание (Р)
соль
15. Закрепление пройденного материала
16.
CaOHCl
SO3
HNO3
H2SO4
Na2O
Fe2O3
Выбери
оксиды
MgCl2
Zn
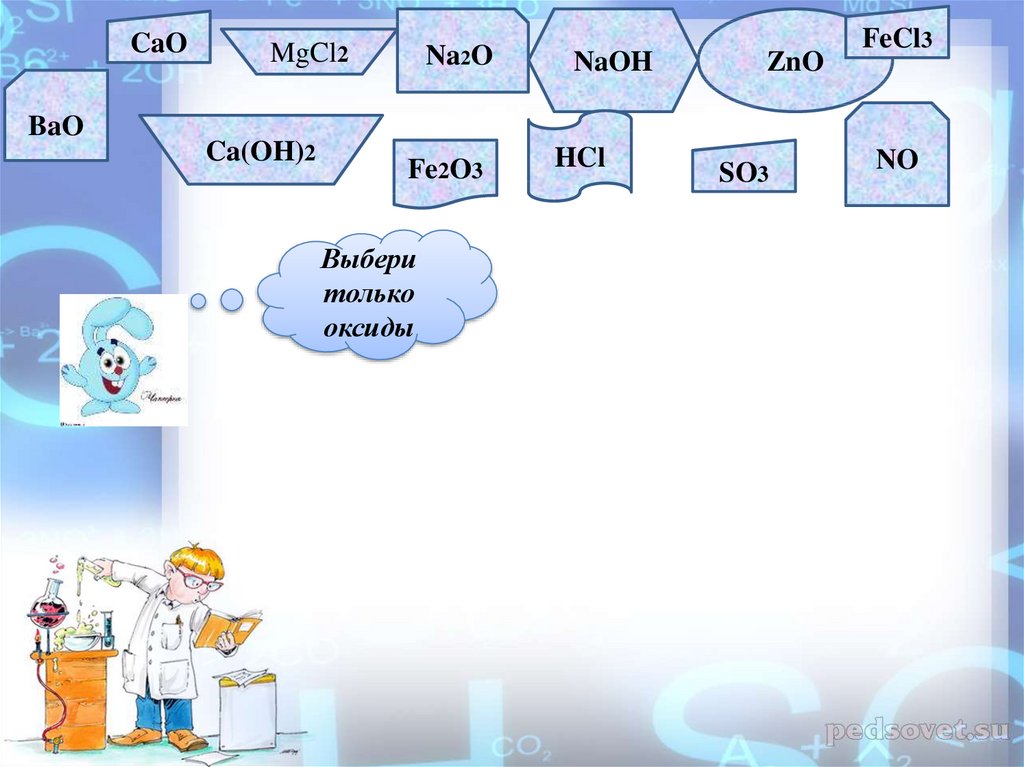
17.
CaOBaO
MgCl2
Ca(OH)2
Na2O
Fe2O3
Выбери
только
оксиды
NaOH
HCl
ZnO
SO3
FeCl3
NO
18. Составьте формулы оксидов
МагнияКалия
Фосфора (V)
Хлора (VII )
Железа (II)
Углерода (IV)
Серы (VI)
Меди(I)
Марганца (VII)
Выпишите в два столбика
кислотные и основные оксиды
19. Напишите уравнения реакций получения оксидов:
Оксида кальцияОксида алюминия
Оксида серы (IV)
Оксида фосфора (V)
Оксида углерода (IV)
20. 4. Написать формулы оснований и кислот , которые соответствуют данным оксидам:
• SO3 ,• N 2 O5 ,
• Al2O3 ,
• CO2,
• BaO,
• CaO
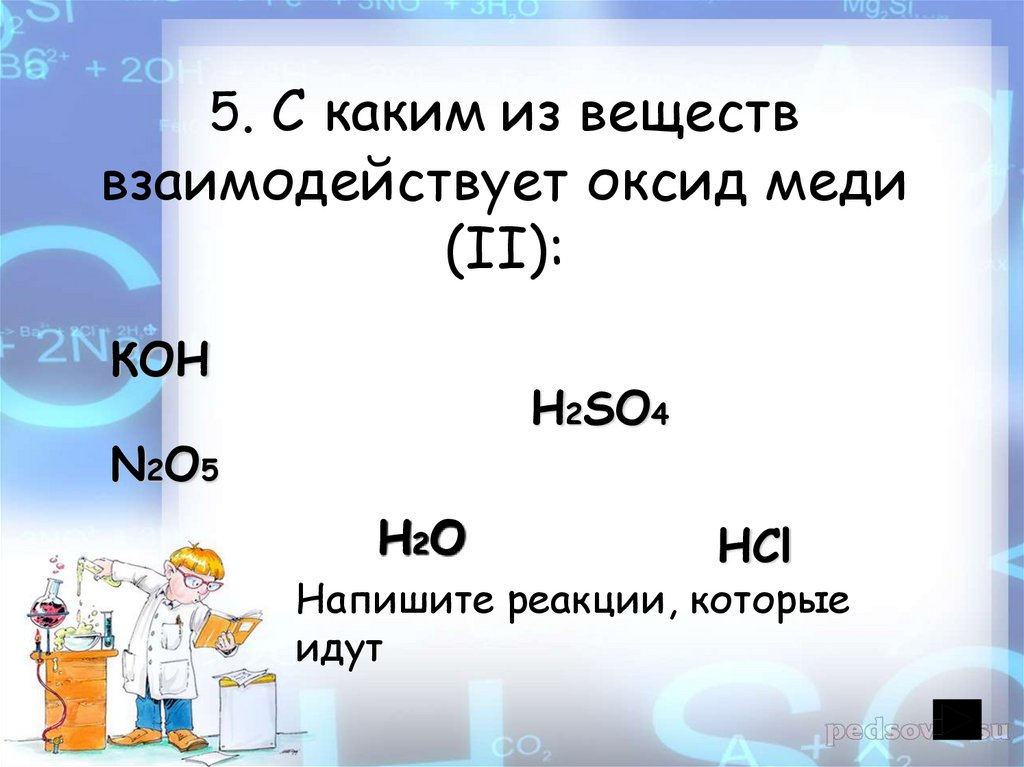
21. 5. С каким из веществ взаимодействует оксид меди (II):
КОНH2SO4
N2O5
H2O
HCl
Напишите реакции, которые
идут
22. 6. Закончите уравнения реакций которые могут протекать и расставьте коэффициенты
FeO + H2O =CO2 + H2O =
SO2 + Na2O =
Ва(OH)2 + N2O5 =
H3PO4 + CaO =
Al2O3 + HCl =
KOH + SO3 =
SiO2 + H2O =


















 chemistry
chemistry