Similar presentations:
Классификация и свойства оксидов
1. Классификация и свойства оксидов
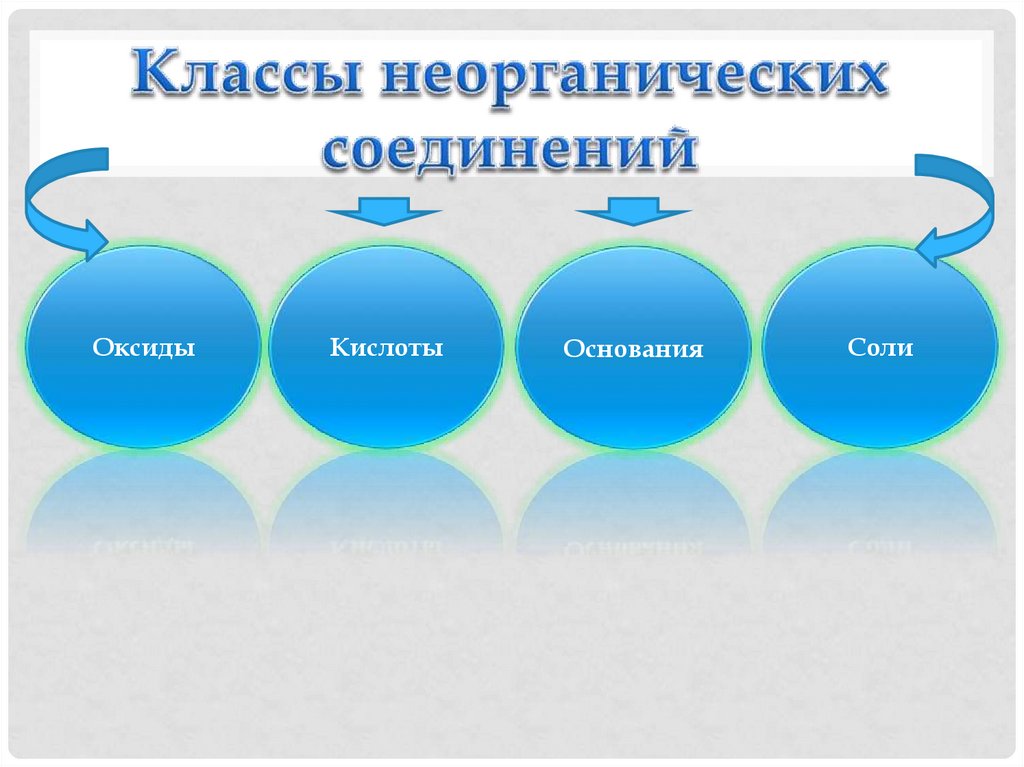
2. Классы неорганических соединений
ОксидыКислоты
Основания
Соли
3. оксиды
Бинарные соединения,состоящие из двух
элементов, одним из
которых является
кислород
4. Классификация оксидов
СолеобразующиеНесолеобразующие
Это оксиды, которые
взаимодействуют с
кислотами или со щелочами
с образованием солей и воды:
N2O5, CO2, CaO, Na2O
Это оксиды, которые не
взаимодействуют ни с
кислотами, ни с основаниями и
не образуют солей. Оксиды
образованы атомами
неметаллов:
CO, NO, N2O, SiO2
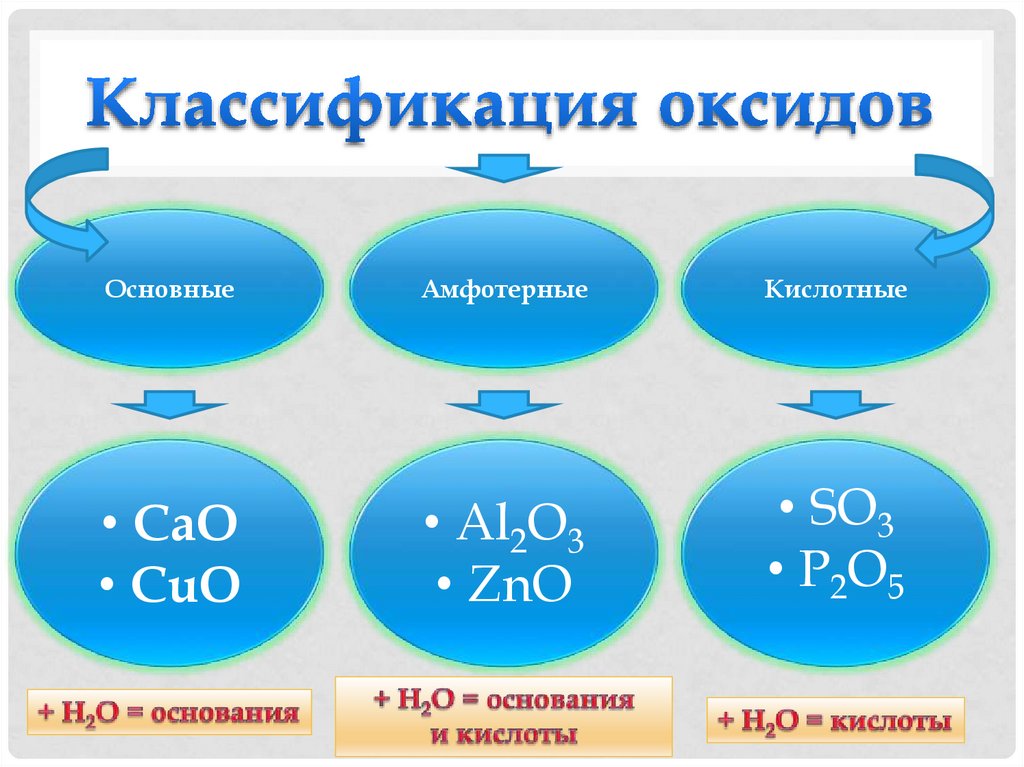
5. Классификация оксидов
ОсновныеАмфотерные
Кислотные
• CaO
• CuO
• Al2O3
• ZnO
• SO3
• P2O5
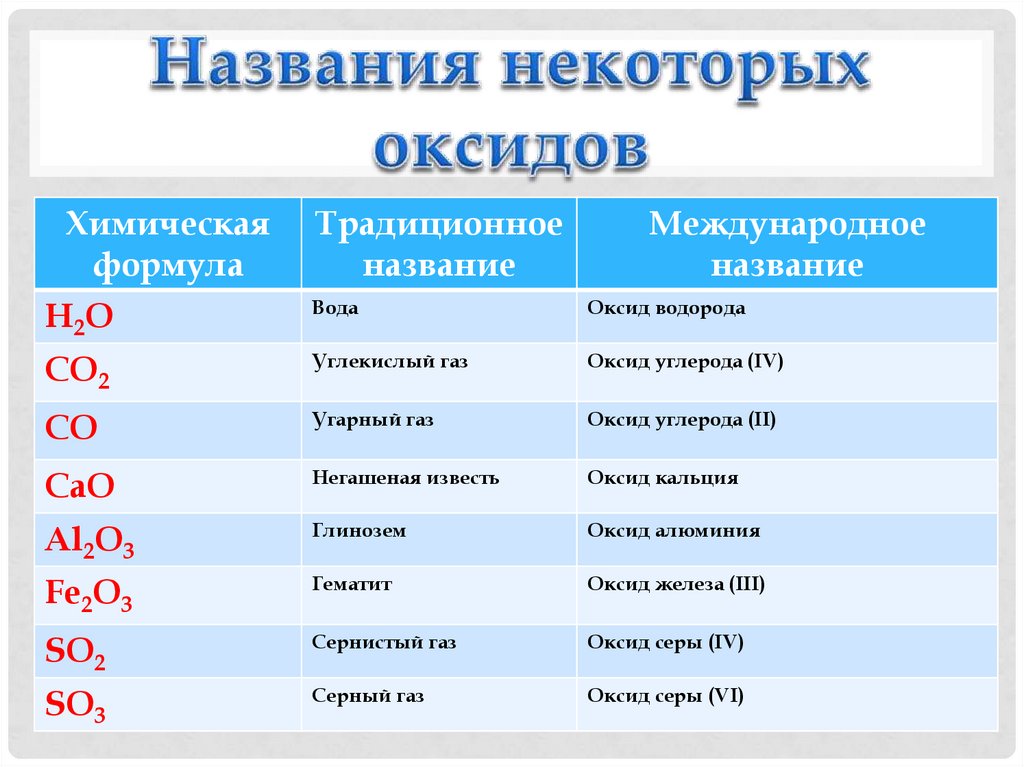
6. Названия некоторых оксидов
Химическаяформула
Н2О
Традиционное
название
Международное
название
Вода
Оксид водорода
CO2
Углекислый газ
Оксид углерода (IV)
CO
Угарный газ
Оксид углерода (II)
CaO
Негашеная известь
Оксид кальция
Al2O3
Глинозем
Оксид алюминия
Fe2O3
Гематит
Оксид железа (III)
SO2
Сернистый газ
Оксид серы (IV)
SO3
Серный газ
Оксид серы (VI)
7. Получение оксидов 1. Взаимодействие простых веществ с кислородом:
С + O2 = CO22 Cu + O2 =2 CuO
2 Ca + O2 =2 CaO
8. Получение оксидов 2. Окисление оксидов:
Получение оксидов4FeO + O2 =2 Fe2O3
2 CO + O2 =2 CO2
9. Получение оксидов 3. Разложение нерастворимых оснований при нагревании:
Получение оксидовMg(OH)2 = MgO + H2O
2Fe(OH)3 = Fe2O3 +3 H2O
10. Получение оксидов 4. Разложение солей:
Получение оксидовCaCO3 = CaO + CO2
CaSO4 = CaO + SO3
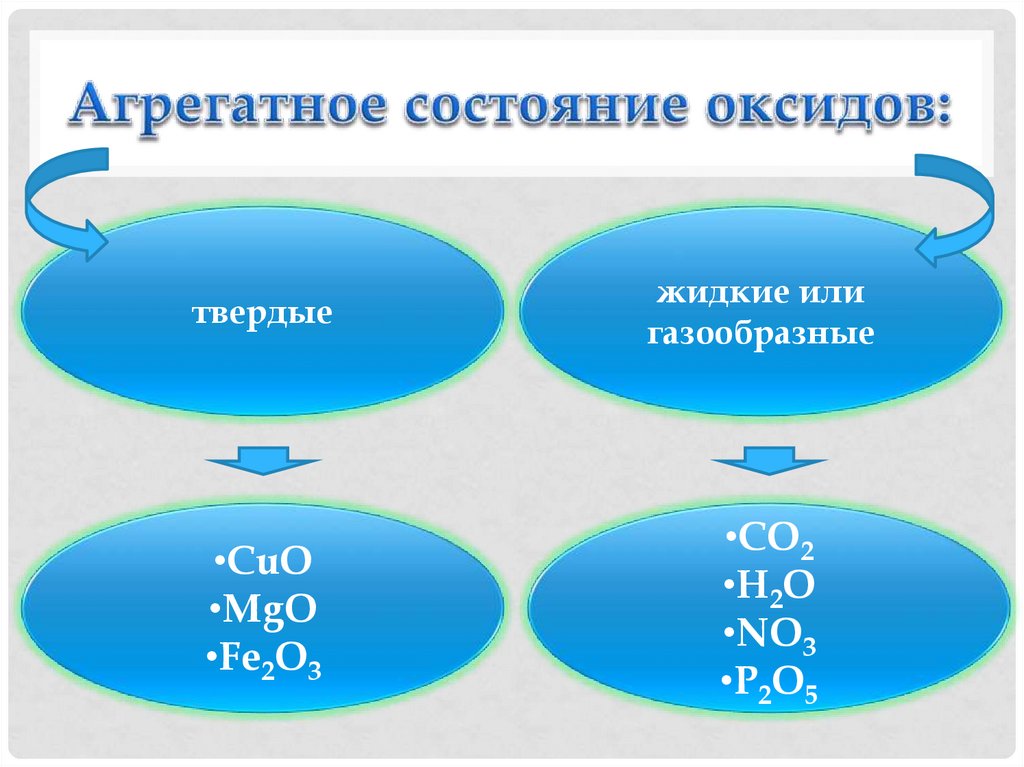
11. Агрегатное состояние оксидов:
твердыежидкие или
газообразные
•CuO
•MgO
•Fe2O3
•CO2
•H2O
•NO3
•P2O5
12. Химические свойства основных оксидов
Na2O + H2O =2NaOHCaO + H2O =Ca(OH)2
13. Химические свойства основных оксидов
MgO + H2SO4 = MgSO4+ H2OBaO +2HCL = BaCL2 + H2O
14. Химические свойства основных оксидов
CaO + CO2 = CaCO3BaO + SiO2 = BaSiO3
15. Химические свойства кислотных оксидов
SO3 + H2O = H2SO4P2O5 +3 H2O =2H3PO4
16. Химические свойства кислотных оксидов
2 NaOH + SO2 = Na2SO3 + H2OCa(OH)2 + CO2 = CaCO3 + H2O
17. Химические свойства кислотных оксидов
SiO2 + CaO = CaSiO318. Характерные химические свойства оксидов
+Основной
оксид
+
Вода
=
Щелочь
Сильная
кислота
=
Соль
+
Кислотный
оксид
+
Вода
+
Вода
Соль
+
Вода
=
Кислота
+
Щелочь
=
Соль
19. Химические свойства амфотерных оксидов
Основные свойстваZnO + H2SO4 = ZnSO4 + H2O
Кислотные свойства
ZnO +2NaOH = Na2ZnO2 + H2O
Цинкат
натрия
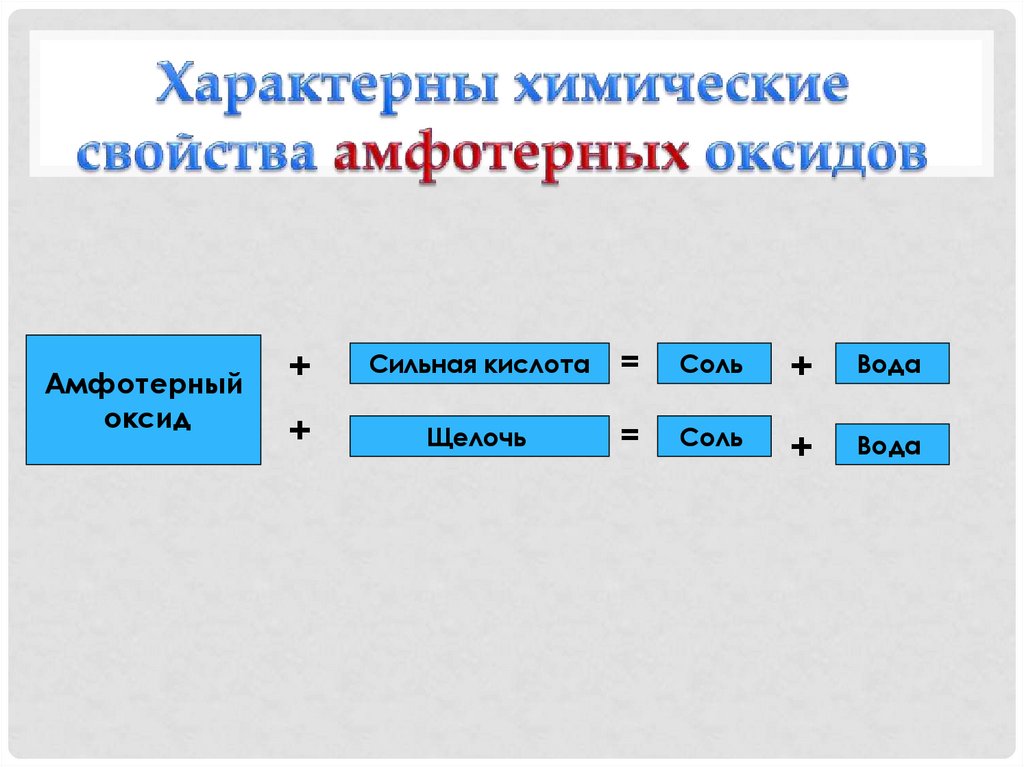
20. Характерны химические свойства амфотерных оксидов
Амфотерныйоксид
+
Сильная кислота
=
Соль
+
Вода
+
Щелочь
=
Соль
+
Вода
21. Домашнее задание
•§ 23 прочитать;•задания 4,5(в,г) письменно
стр. 105
















 chemistry
chemistry








