Similar presentations:
Оксиды. Классификация оксидов
1. ОКСИДЫ
2. Загадка
Их получают путем горения,Или сложных веществ разложением.
В них два элемента, один – кислород.
Я отнесу к ним и известь и лед.
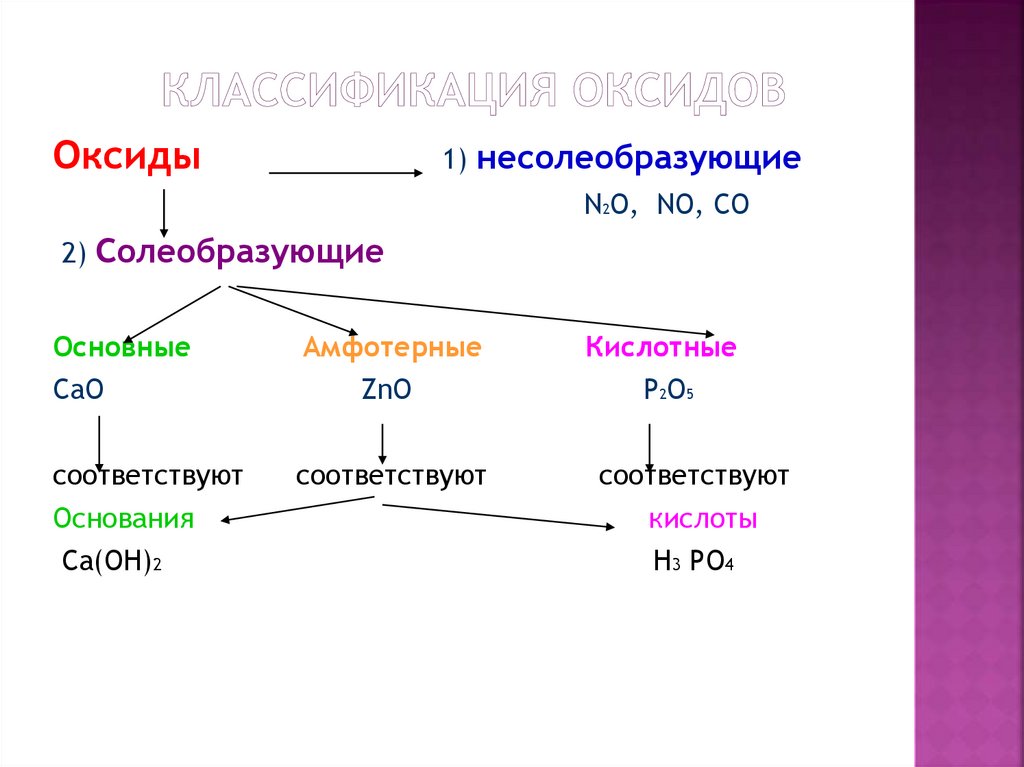
3. КЛАССИФИКАЦИЯ ОКСИДОВ
Оксиды1) несолеобразующие
N2O, NO, CO
2) Солеобразующие
Основные
CaO
Амфотерные
ZnO
Кислотные
P2O5
соответствуют
Основания
Ca(OH)2
соответствуют
соответствуют
кислоты
H3 PO4
4. ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ
Основными называются оксиды, которыеобразуют соли при взаимодействии с
кислотами или кислотными оксидами.
Кислотными называются оксиды, которые
образуют соли при взаимодействии с
основаниями или основными оксидами.
Амфотерными оксидами, называют оксиды
которые проявляют свойства как кислот, так и
оснований.
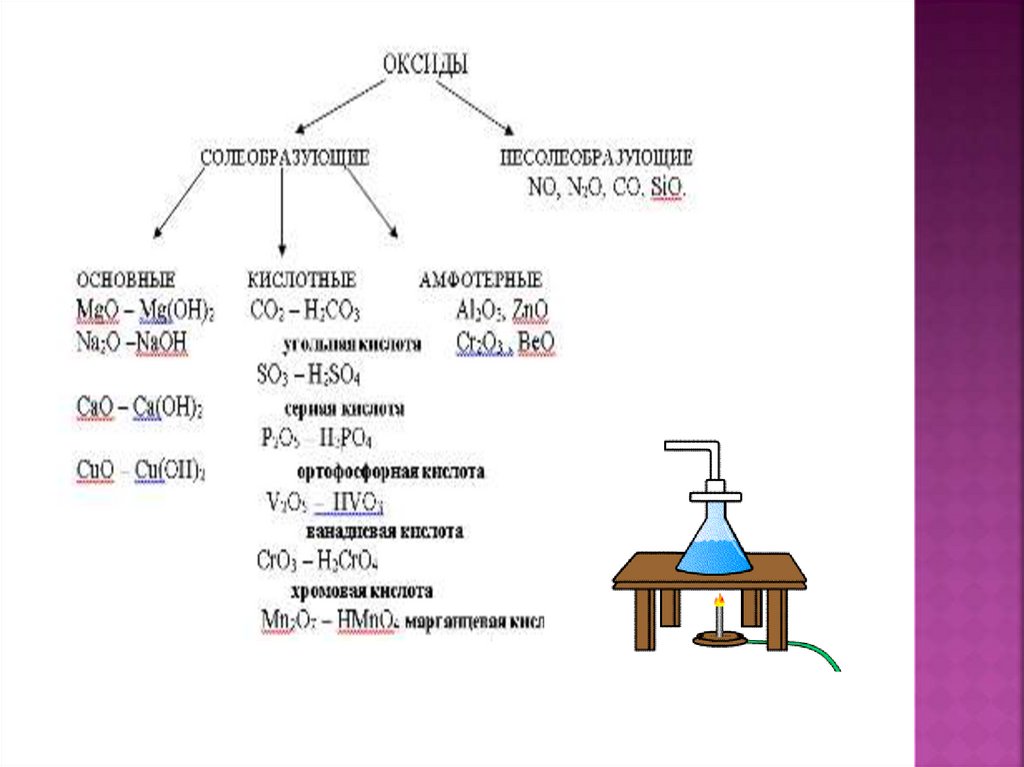
5. Основные оксиды (напиши формулы)
Примеры основныхоксидов:
Оксид кальция ;
Оксид магния ;
Оксид бария ;
Оксид меди(II) ;
Оксид ртути(II) ;
Оксид калия ;
Оксид натрия ;
Оксид лития ;
6. Примеры кислотных оксидов:
Оксид серы(IV) ;Оксид серы(VI) ;
Оксид углерода(IV) ;
Оксид кремния(IV) ;
Оксид фосфора(V) ;
Оксид азота(V) ;
Оксид хлора(VII) ;
Оксид марганца(VII)
7. Примеры амфотерных оксидов:
Оксид цинка ;Оксид бериллия ;
Оксид свинца(II) ;
Оксид олова(II) ;
Оксид алюминия ;
Оксид хрома(III) ;
Оксид железа (III) ;
Оксид ванадия(V) .
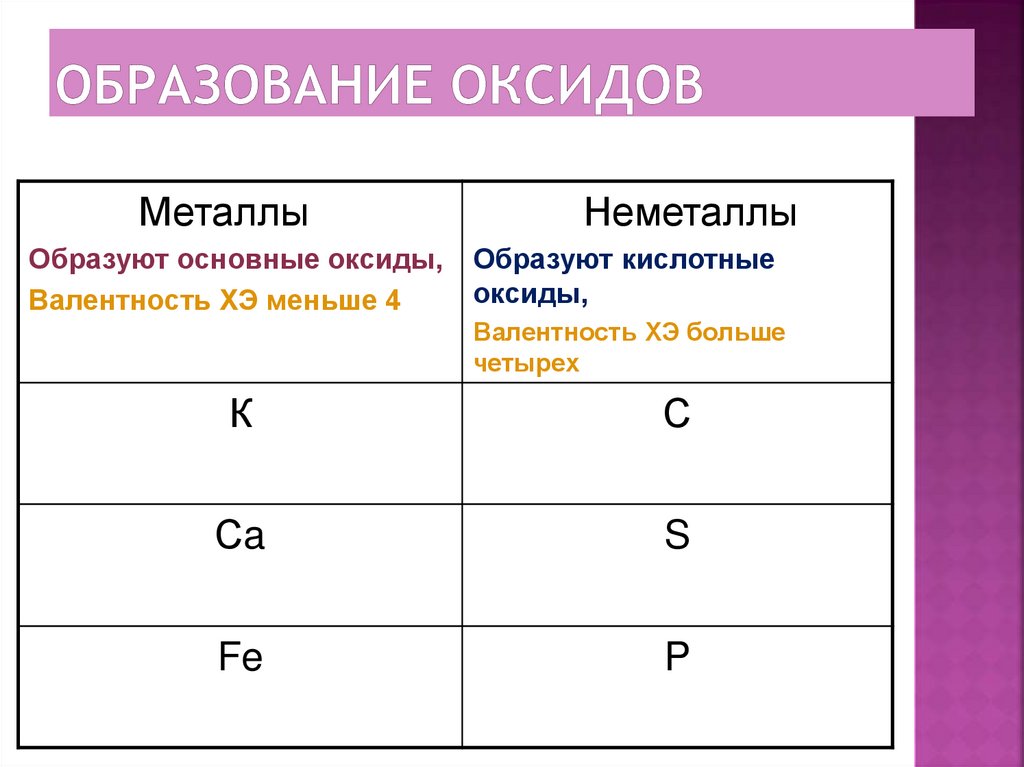
8. Образование оксидов
МеталлыОбразуют основные оксиды,
Валентность ХЭ меньше 4
Неметаллы
Образуют кислотные
оксиды,
Валентность ХЭ больше
четырех
К
С
Сa
S
Fe
P
9.
10.
11.
12.
13.
14. ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
Приведите примерыФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
ТВЕРДЫЕ
ЖИДКИЕ
ГАЗООБРАЗНЫЕ
15. Ответь на вопросы
1Ряд веществ, являющихся оксидамиА) Na2O, Na2O2, CuO, Cu2S
Б) FeO, Fe2O3, Fe3O4, FeCl2
B) CO2, Cu2O, MgO, OF2
Г ) Li2O, SO3, BeO, Cl2O7.
2Ряд основных оксидов.
.
А) ZnO, BeO, Al2O3, Cr2O3
Б ) ZnO, BeO, K2O, MgO
B) CO2, Cu2O, BaO, Al2O3
Г ) CrO3, MnO, FeO, Na2O.
3 Ряд амфотерных оксидов:
А) SO2, SO3, V2O5, CuO
Б ) CaO, K2O, MgO, Li2O
B) ZnO, Mn2O7, MnO, Al2O3
Г) P2O5, BeO, BaO, CO2.
16. Ответь на вопросы
4 Ряд кислотных оксидов:А) Al2O3 , SO3, BeO, Cl2O7
Б) P2O5, Cl2O7, CrO3 , Mn2O7
B) Li2O, SO3, BeO, Cl2O7
Г) SO2, SO3, CuO, Mn2O3.
5 Ряд несолеобразующих оксидов:
А) Li2O, SO3, BeO, Cl2O7.
Б) ZnO, Mn2O7, MnO, Al2O3
В) CO, N2O, NO, SiO
Г) CrO3, MnO, FeO, Na2O.
17. Установите соответствие между формулами оксидов и характером их свойств.
Формулы оксидов1) P2O5 и SO3
2) ZnO и SO2
3) CO2 и CO
4) СаО и FеО
Характер свойств оксидов
А) кислотный и кислотный
Б) основный и основный
В) амфотерный и кислотный
Г) амфотерный и основный
Д) солеобразующий и несолеобразующий
18. Проверь себя
1-Г2-Б
3-А
4-Б
5-В
6
1А 2В 3Д 4Б
19. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.)
1) О.О. + кислота =соль + вода (реакция обмена)CaO + H2 SO4 → CaSO4 + H2O
2) О.О. + кислотный оксид = соль
(реакция соединения)
СaO + SiO2 = CaSiO3
3) О.О.(раств) + вода = основание (щелочь)
(реакция соединения)
Na2O + H2O → 2NaOH
20. Химические свойства кислотных оксидов (К.О.)
1) К.О. + основание = соль + вода (реакция обмена)SO3 + 2NaOH → Na2SO4 + H2O
2) К.О. +О.О. = СОЛЬ (реакция соединения)
SO3 + Na2O → Na2SO4.
3) К.О. + вода = кислота (кроме SiO2 )
(реакция соединения)
P2O5 + 3H2O → 2H3PO4
21. Амфотерные оксиды
1) с кислотами как основныеZnO + 2HCl = ZnCl2 + H2O
2) с основаниями как кислотные
ZnO + 2NaOH = Na2ZnO + H2O
(цинкат натрия)
22. ДОМАШНЯЯ РАБОТА
Составьте уравнения реакций – примерыхимических свойств оксидов, не менее 6
уравнений


















 chemistry
chemistry