Similar presentations:
Кислород
1.
16.01.20251
2.
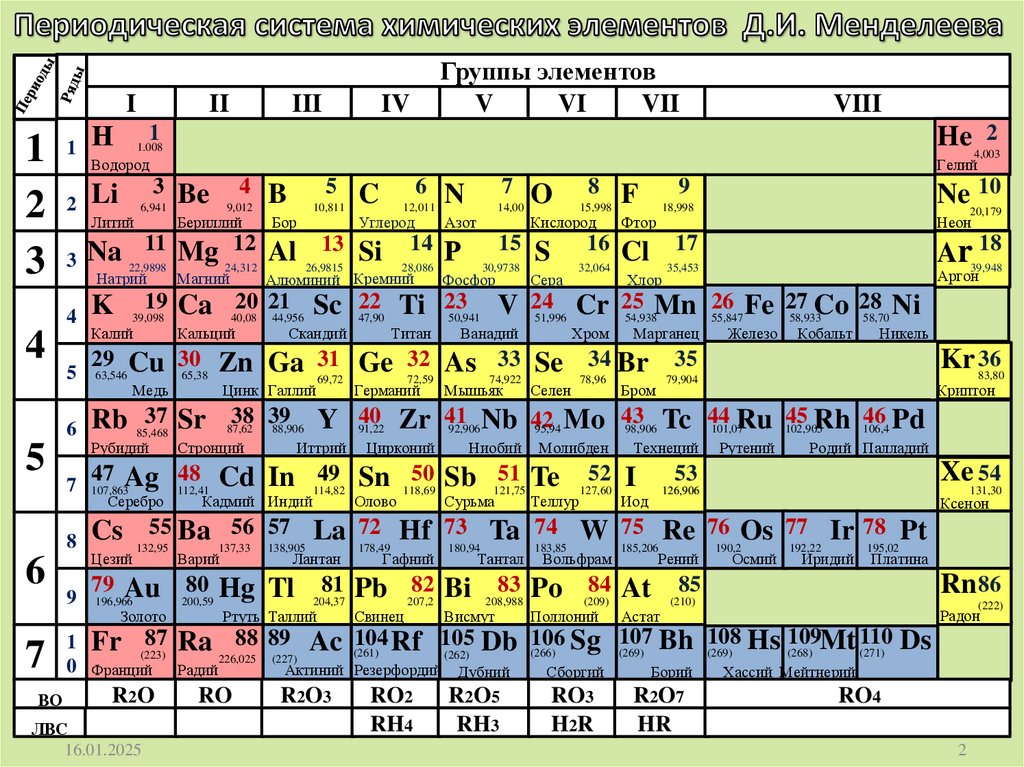
IН
II
III
Группы элементов
V
VI
VII
IV
1
He 4,0032
1
Li 3 Be 4 B 5 C 6 N
2
2
11 Mg 12 Al 13 Si 14 Р
Na
3
3
1
1.008
Водород
6,941
Литий
22,9898
Натрий
4
5
6
7
ВО
VIII
9,012
Бериллий
24,312
Магний
10,811
Бор
Гелий
7
12,011
Углерод
26,9815
28,086
Алюминий Кремний
14,00
Азот
8
O
15,998
Кислород
15 S
30,9738
Фосфор
9
F
Фтор
Неон
16 Cl
Сера
32,064
10
Ne20,179
18,998
17
Хлор
18
Ar39,948
35,453
Аргон
4
19 Ca 20 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni
K 39,098
40,08 44,956
47,90
50,941
51,996
54,938
55,847
58,933
58,70
5
29 Cu 30
6
37 Sr
Rb 85,468
7
47 Ag 48
8
55 Ba 56 57 La 72 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt
Cs 132,95
137,33
138,905
178,49
180,94
183,85
185,206
190,2
192,22
195,02
Цезий
Варий
9
79 Au
200,59
1
0
87 Ra 88 89 Ac 104 Rf 105 Db 106 Sg 107 Bh 108 Hs 109Mt 110 Ds
Fr (223)
(261)
(266)
(269)
(269)
(268)
(271)
(262)
226,025 (227)
Калий
63,546
Кальций
65,38
Медь
Рубидий
107,863
Серебро
196,966
R2O
ЛВС
16.01.2025
Ванадий
Хром
Марганец
Железо
Кобальт
Никель
Kr 36
83,80
Германий
Мышьяк
Селен
Бром
Криптон
38 39
40
41
43
44
Ru 45
Rh 46
88,906 Y
91,22 Zr
92,906 Nb 42
95,94 Mo
98,906 Tc
101,07
102,905
106,4 Pd
87,62
Стронций
112,41
Титан
33 Se 34 Br 35
Zn Ga 31
Ge 32
As 74,922
69,72
72,59
78,96
79,904
Цинк Галлий
Иттрий
Цирконий
Ниобий
Молибден
49 Sn 50 Sb 51 Te
Cd In 114,82
118,69
121,75
Кадмий Индий
Олово
Лантан
80 Hg Tl
Золото
Франций
Скандий
Радий
RO
Гафний
81 Pb
204,37
Ртуть Таллий
Сурьма
Тантал
82 Bi
207,2
Свинец
Теллур
Висмут
52 I
127,60
Иод
Рений
84 At
Xe131,30
54
Ксенон
Осмий
Иридий
Платина
Rn 86
85
(210)
(222)
Радон
Астат
Актиний Резерфордий
Дубний
Сборгий
Борий
R2O3
R2O5
RH3
RO3
H2R
R2O7
HR
RO2
RH4
Родий Палладий
53
(209)
Поллоний
Рутений
126,906
Вольфрам
83 Po
208,988
Технеций
Хассий Мейтнерий
RO4
2
3.
III
III
IV
1 1
2 2
3 3
Группы элементов
V
VI
VII
Характеристика элемента
6
2
1 2 период VIA группа
2 Аллотропное видоизменение:
кислород – О2 ; Озон - О3;
тетракислород – О4
4
4
5
3 Типичная СО в соединениях: --2
( валентность II) ; -1
(валентность I)
6
5
6
7
ВО
Подробнее
VIII
7
4 ЭО = 3,5 (по Полингу)
8
5 Член семейства халькогенов
6 Химическая формула О2
9
7 Относительная молекулярная
масса Мr = 32
1
0
R2O
ЛВС
16.01.2025
RO
R2O3
RO2
RH4
R2O5
RH3
RO3
H2R
R2O7
HR
RO4
3
4.
ГлавнаяПервые сведения найдены в Европе из китайских рукописей 8 в;
В начале 16 в. Леонардо да Винчи опубликовал данные, связанные с
химией кислорода, не зная еще, что кислород – элемент;
Реакции присоединения кислорода описаны в научных трудах
С.Гейлса (1731) и П.Байена (1774);
К.Шееле в 1771–1773 занимался исследованиями взаимодействия
металлов и фосфора с кислородом;
Дж.Пристли сообщил об открытии кислорода как элемента в 1774,
спустя несколько месяцев после сообщения Байена о реакциях с
воздухом;
Название oxygenium («кислород») дано этому элементу вскоре после
его открытия Пристли и происходит от греческих слов,
обозначающих «рождающий кислоту»;
А.Лавуазье (1777) принадлежит объяснение роли кислорода в
процессах дыхания и горения
16.01.2025
4
5.
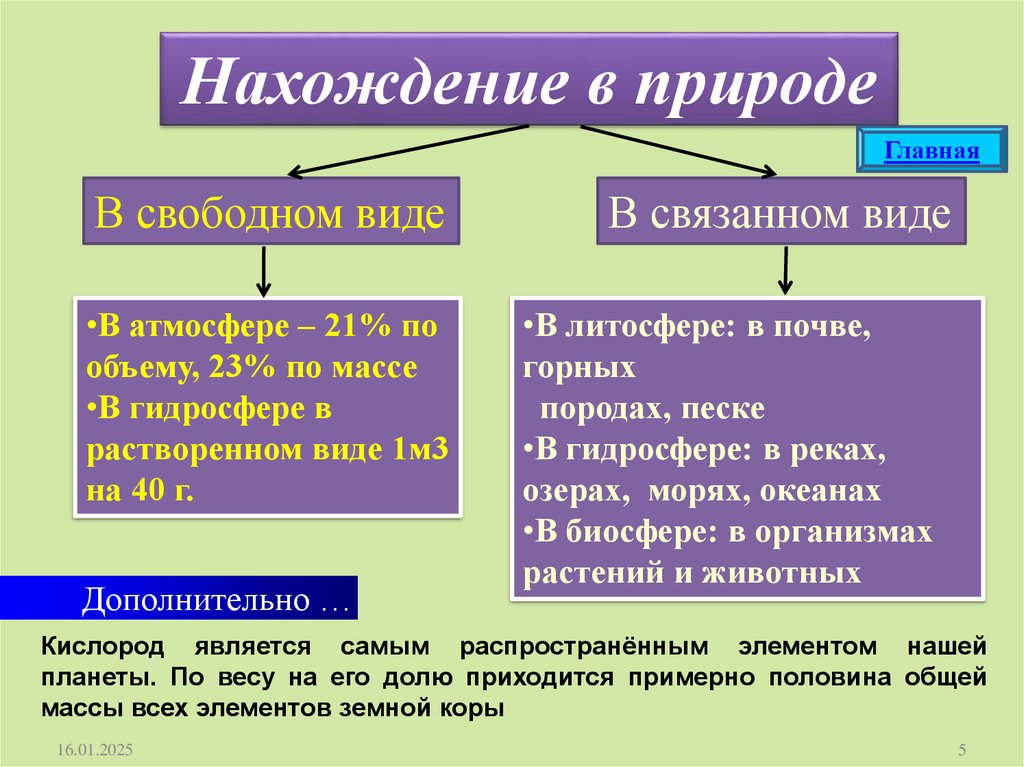
Нахождение в природеГлавная
В свободном виде
В связанном виде
•В атмосфере – 21% по
объему, 23% по массе
•В гидросфере в
растворенном виде 1м3
на 40 г.
•В литосфере: в почве,
горных
породах, песке
•В гидросфере: в реках,
озерах, морях, океанах
•В биосфере: в организмах
растений и животных
Дополнительно …
Кислород является самым распространённым элементом нашей
планеты. По весу на его долю приходится примерно половина общей
массы всех элементов земной коры
16.01.2025
5
6.
ГлавнаяЭлектронное строение
16
Валентные возможности
0
+8
Порядок заполнения
О
2
6
2р4
2s2
Валентность II
1s2
Краткая электронная запись 16.01.2025
6
7.
Природный содержит триизотопа:
Главная
168 О(99,76%; 8 p и 8 n )
178 О(0,04%; 8 p и 9 n )
18 О(0,20%; 8 p и 10 n )
8
16.01.2025
7
8.
Главная1. В лаборатории: а) 2KMnO4 t K2MnO4 + MnO2 + O2
б) 2Н2О2 MnO2 2Н2О + О2
в) 2NaNO3 600 С 2NaNO2 + О2
г) 2KClO3 t 2KCl + 3О2
д) 4К2Сr2О7 → 4К2CrO4 + 2Сr2О3 + O2↑
Катализатор — вещество, ускоряющее реакцию, но не входящее в состав
продуктов реакции
В замкнутых помещениях :
а) 2Na2O2 + 2CO2
2Na2CO3 + O2
б) 4КО2 + 2СО2
2К2СО3 + 3О2
Подумайте …
Как проверить, собрался ли кислород в сосуде?
16.01.2025
8
9.
Главная2. В промышленности:
1) фракционной перегонкой жидкого воздуха, основанную на разных
температурах кипения компонентов воздуха. Воздух охлаждают
примерно до -200 °С и затем медленно нагревают. При достижении
температуры -183 °С из жидкого воздуха улетучивается кислород,
остальные компоненты сжиженного воздуха при этой температуре
остаются в жидком агрегатном состоянии;
2) электролизом воды. Ежегодно во всем мире получают свыше 80
млн. т кислорода
3. В атмосфере:
2Н2О электролиз 2Н2 + О2
Кислород атмосферы имеет биологическое происхождение и
образуется в зеленых растениях из воды при фотосинтезе с участием
хлорофилла и энзимов:
12Н2О + 6СО2 = 6О2 + С6Н12О6 + 6Н2О
16.01.2025
9
10.
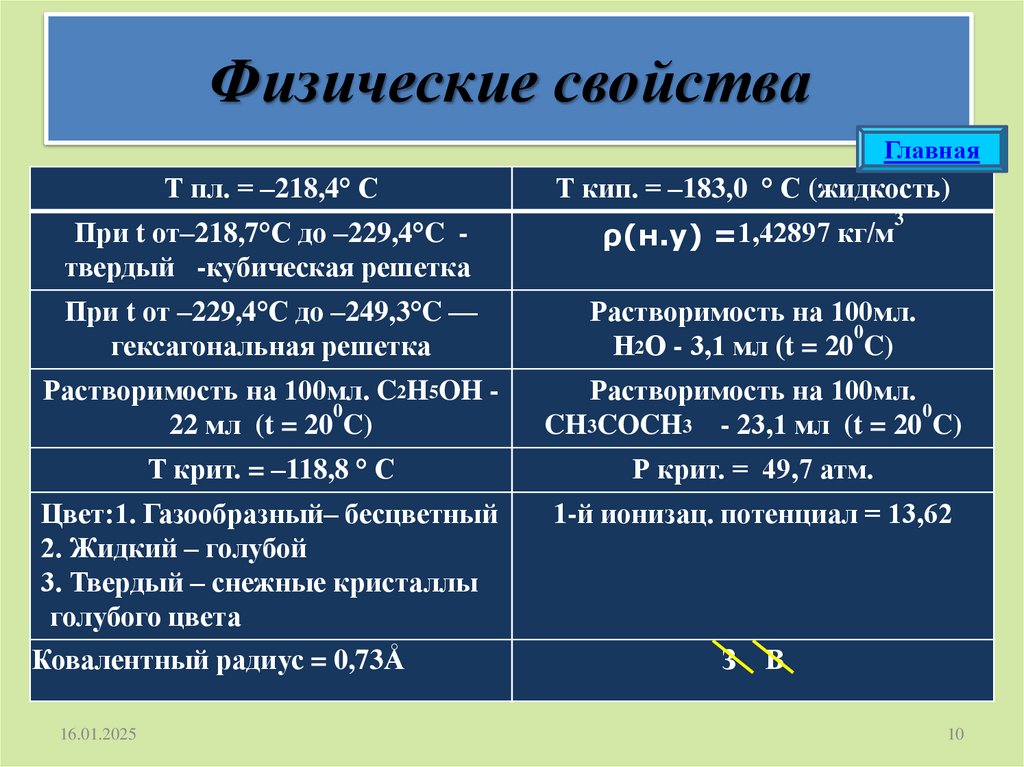
Физические свойстваГлавная
Т пл. = –218,4° С
Т кип. = –183,0 ° С (жидкость)
При t от–218,7°C до –229,4°C твердый -кубическая решетка
ρ(н.у) =1,42897 кг/м
При t от –229,4°C до –249,3°C —
гексагональная решетка
Растворимость на 100мл.
0
Н2О - 3,1 мл (t = 20 C)
Растворимость на 100мл. C2H5OH 0
22 мл (t = 20 C)
Растворимость на 100мл.
0
CH3COCH3 - 23,1 мл (t = 20 C)
Т крит. = –118,8 ° С
Р крит. = 49,7 атм.
Цвет:1. Газообразный– бесцветный
2. Жидкий – голубой
3. Твердый – снежные кристаллы
голубого цвета
1-й ионизац. потенциал = 13,62
Ковалентный радиус = 0,73Å
16.01.2025
3
З В
10
11.
ГлавнаяКислород-второй по электроотрицательности элемент после фтора ,и поэтому он
проявляет сильные окислительные свойства
1. С молекулами простых веществ:
Подумайте!
0
S+O2=SO2 (t=250 C);
С+О2=СО2(t=7000C);
N2+O2=2NO-Q(t=12000C);
2. Со многими сложными соединениями:
2NO+O2=2NO2;
С какими еще веществами
2Н2S + О2 = 2S + 2Н2О;
кислород может вступать в реакцию ?
2Н2S + ЗО2 = 2SО2 + 2Н2О ;
3. Еще более сильным окислителем, чем кислород О2, является
озон О3. Он образуется в атмосфере при грозовых разрядах
ЗО2 = 2О3 - 284 кДж
2КI + О3 + Н2О = I2 + 2КОН + О2
16.01.2025
11
12.
ГлавнаяКислород
Озон
Общие признаки
1.
2.
3.
Простые вещества, которые образованы одним и тем же элементом –
кислородом, т.е. являются его аллотропными модификациями.
При обычных условиях газы.
Сильные окислители.
Отличительные признаки
Молекула состоит из 2 атомов
Молекула состоит из 3 атомов
При н.у. без цвета и запаха, жидкий –
голубой, твердый – синие кристаллы.
Мало растворим в воде. У.Ф. лучи не
задерживает.
Синий газ, запах резкий. В воде
растворяется в 10 раз лучше, чем
кислород. У.Ф. лучи задерживает.
Не ядовит. Необходим для аэробного
дыхания
В больших дозах ядовит. Сильно
раздражает глаза и дыхательные пути.
Бактерициден.
16.01.2025
12
13.
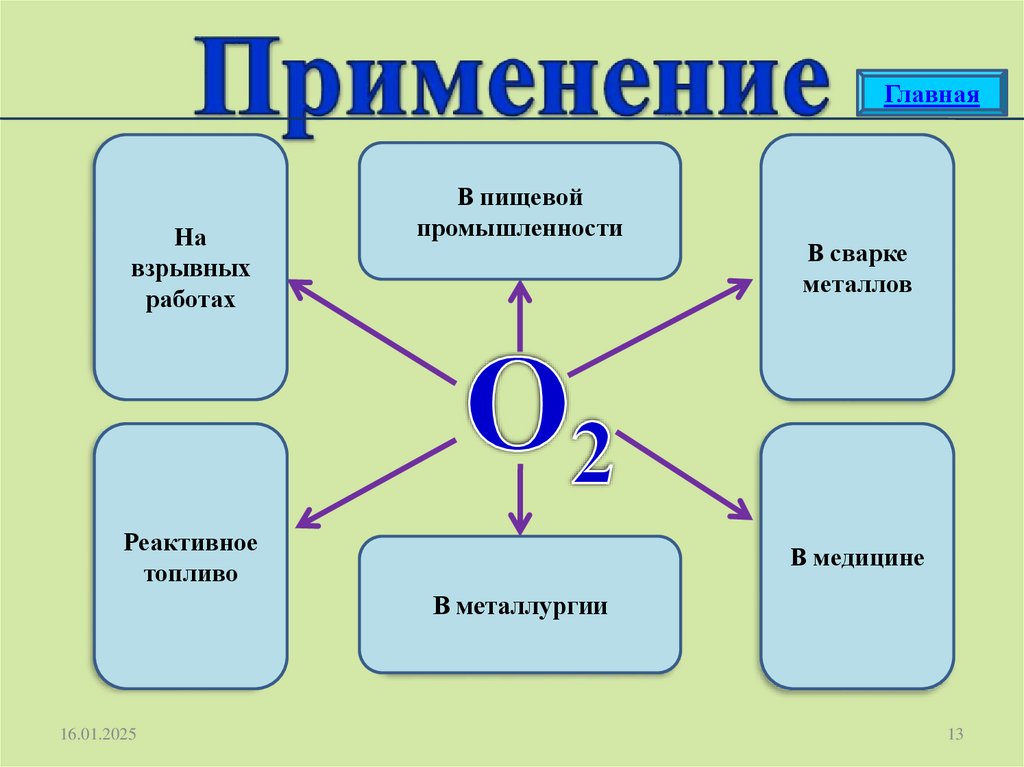
ГлавнаяНа
взрывных
работах
В пищевой
промышленности
Реактивное
топливо
В сварке
металлов
В медицине
В металлургии
16.01.2025
13
14.
(Новые термины)Главная
Горение –это химическая реакция, при которой
происходит окисление веществ с
выделением теплоты и света.
Оксид – сложные вещества, состоящие из двух
элементов, одним из которых является
кислород.
Изотоп – разновидности атомов (и ядер) одного
химического элемента с разным
количеством нейтронов в ядре.
Катализатор -вещество, ускоряющее реакцию, но не
входящее в состав продуктов реакции
16.01.2025
?
?
?
?
14
15.
Проверка знанийГлавная
Относительная
Сколько
Количество
процентов
молекулярная
электронов
кислорода
намасса
внешнем
содержится
кислорода
Количество
Аллотропное
нейтронов
видоизменение
у атомакислорода
кислорода
энергетическом уровне
в равна
воздухе
у атома кислорода
Вопрос 1
Вопрос 2
А
В
Молодец
Ошибка
озон
16
23
12
8
Б
Молодец
Ошибка
алмаз
32
25
6
Молодец
Ошибка
воздух
20
21
16
8
Г
Ошибка
оксид
31
28
10
16
Вопрос 3
Вопрос 4
Вопрос 5
16.01.2025
15
16.
Проверка знанийГлавная
Заполни пропуски
1. Катализатор – это вещество, ускоряющие реакцию, но не
входящее в состав продуктов реакции.
3. Валентность кислорода равна двум.
4. При нормальных условиях имеет газообразное агрегатное
состояние.
5. Оксиды – это сложные вещества, состоящие из двух
элементов, одним из которых является кислород
16.01.2025
16
17.
Проверка знанийГлавная
Допишите уравнения реакции
2Н2О2 MnO2
2KClO3
t
2Н2О электр-з
2NaNO3 600 С
16.01.2025
17













 chemistry
chemistry








