Similar presentations:
Техническая термодинамика. Законы термодинамики
1. Техническая термодинамика
Законы термодинамики2. ПАРАМЕТРЫ СОСТОЯНИЯ
Свойства веществ бывают интенсивные иэкстенсивные.
Интенсивные – не зависят от количества вещества
(температура, плотность и т.д.)
Экстенсивные – зависят от количества вещества
(масса, объём, вес, теплоёмкость, внутренняя
энергия и т.д.)
Экстенсивные свойства, отнесённые к количеству
вещества, становятся интенсивными ( удельный
вес, удельный объем, удельная теплоёмкость,
удельная внутренняя энергия и т.д.)
3. ПАРАМЕТРЫ СОСТОЯНИЯ
Интенсивные свойства, определяющиесостояние вещества, называются
параметрами состояния.
Основные параметры состояния:
а) температура T , К (t , oC ) характеризует
тепловое состояние вещества;
б) давление ( p=N/F, Па ) – это отношение
силы N, действующей по нормали к
поверхности F, к площади этой поверхности
кГс
1бар 10 Па 750, 24 мм. рт.ст. 1, 02 2
в) удельный объем ( v ) – это отношение см
объема тела к его массе, м3 / кг
,
5
4. ПАРАМЕТРЫ СОСТОЯНИЯ
Состояние любого вещества однозначноопределяется любой парой параметров состояния:
p, v , p, t , t, v
Для каждого вещества существует функция
состояния, которая называется уравнением
состояния данного вещества:
График этой функции – термодинамическая
поверхность.
F p, v, t 0
5. ТЕРМОДИНОМИЧЕСКИЙ ПРОЦЕСС
Термодинамическая система – это тело илисовокупность тел, взаимодействующих между
собой и окружающей средой.
Термодинамический процесс – это такой процесс,
при котором изменяется хотя бы один из
параметров состояния термодинамической
системы.
Термодинамические процессы бывают
равновесными и неравновесными.
В равновесных термодинамических процессах во
всех точках термодинамической системы
параметры состояния одинаковые.
6. ТЕРМОДИНОМИЧЕСКИЙ ПРОЦЕСС
Частные случаи термодинамическогопроцесса:
p=const – изобарный процесс;
v=const – изохорный процесс;
T=const – изотермический процесс;
q=0 – адиабатный процесс.
7. ТЕПЛОЁМКОСТЬ
Теплоёмкость – это количество теплоты,которое нужно подвести к телу для того,
чтобы нагреть его на 1K.
Теплоёмкость – это экстенсивное свойство.
Теплоёмкость, отнесённая к количеству
вещества, называется удельной
теплоёмкостью.
Дж
c
,
кгК
Удельная массовая теплоемкость
Удельная объемная теплоемкость Дж
c`, 3
м К
8. ТЕПЛОЁМКОСТЬ
Средняя теплоёмкость – это теплоёмкость,измеренная в интервале температур.
c1 2
q
q1 2
,
T2 T1
где 1 2 - это количество теплоты, которое нужно
подвести к 1 кг тела для того, чтобы нагреть его от
.
Т до
1
Т2
9. ТЕПЛОЁМКОСТЬ
Истинная теплоемкость это теплоёмкость приконкретном значении температуры .
q , x const
cx
T x
где x - индекс процесса.
Изобарная:
Изохорная:
q
cv
T v
q
cp
T p
10. ТЕПЛОЁМКОСТЬ
Для газов справедливо:cp
cv
k,
где k -показатель адиабаты.
k=1,4 для двухатомных газов ( H , N , O , воздух)
2
2
2
Уравнение Майера :
c p cv R,
где R- газовая постоянная для данного вещества.
Для твердых и жидких тел c p cv (не зависит от
вида процесса).
11. ВНУТРЕННЯЯ ЭНЕРГИЯ
Внутренняя энергия включает в себя:• энергию поступательного и вращательного
движения молекул,
• внутримолекулярную энергию,
• энергию взаимодействия между молекулами,
• внутриатомную и внутриядерную энергию.
В теплотехнических расчетах используют не
абсолютное значение внутренней энергии, а
величину её изменения в конкретном процессе.
Внутренняя энергия U, Дж
Удельная внутренняя энергия u U , Дж
G кг
12. ВНУТРЕННЯЯ ЭНЕРГИЯ
Внутренняя энергия – это функция состояния, т.е. еёизменение не зависит от пути процесса, а
определяется лишь начальным и конечным
состоянием тела.
Внутренняя энергия определяется однозначно любой
парой параметров состояния:
u p, v
u p, t
u v, t
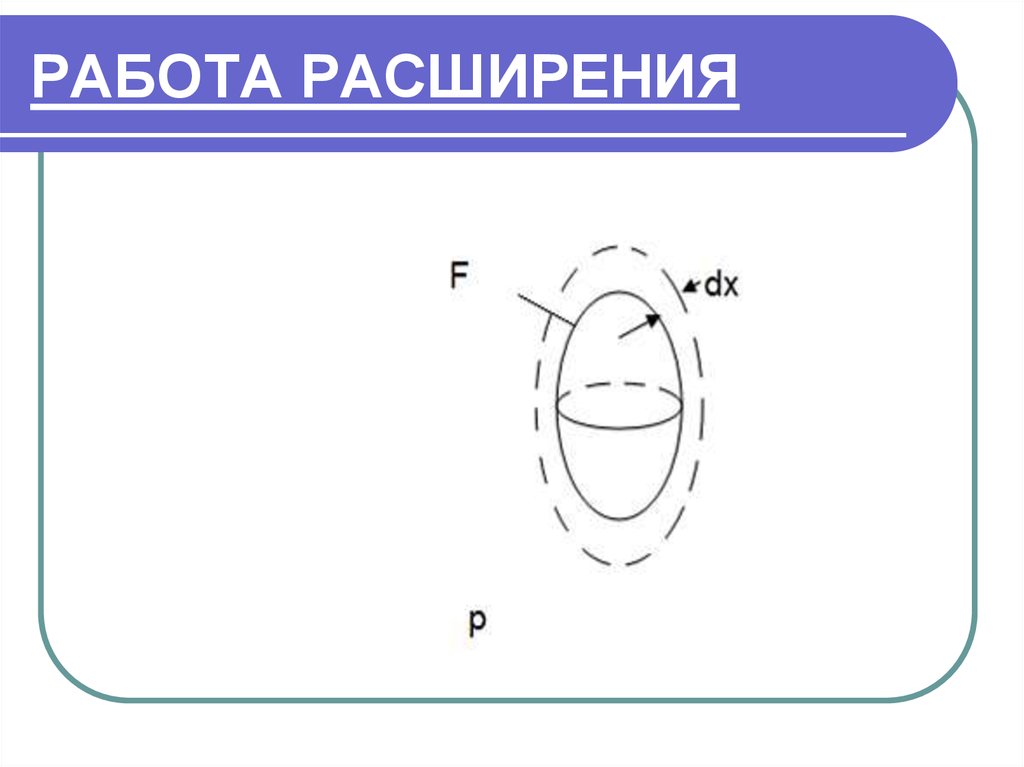
13. РАБОТА РАСШИРЕНИЯ
14. РАБОТА РАСШИРЕНИЯ
F-площадь поверхности данного тела.Тело помещено в среду с давлением р. Преодолевая
это давление, тело расширяется на величину dx.
При этом тело совершило работу расширения:
dL Ndx pFdx pdV , Дж
Удельная работа расширения:
dL pdV
Дж
dl
pdv,
G
G
кг
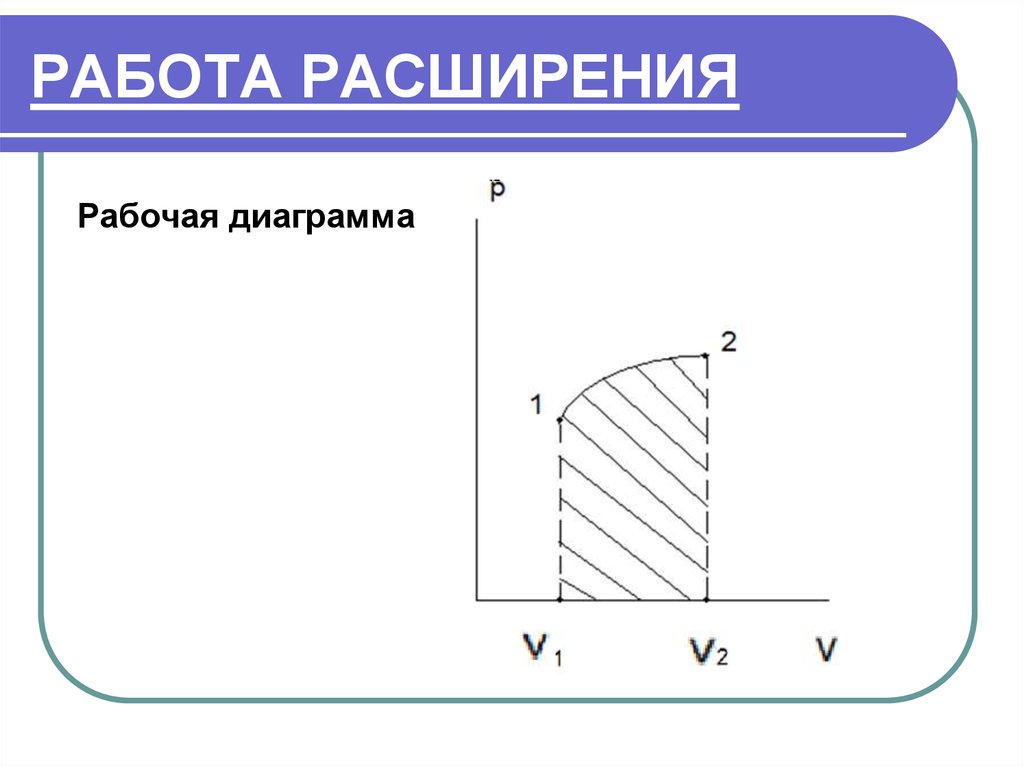
15. РАБОТА РАСШИРЕНИЯ
Рабочая диаграмма16. РАБОТА РАСШИРЕНИЯ
Тело переходит из состояния 1 в состояние 2.При этом тело совершает работу расширения
l
v2
dl pdv
1 2
v1
17. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
ФОРМУЛИРОВКА ПЕРВОГО ЗАКОНАТЕРМОДИНАМИКИ:
Теплота, подведенная к телу, расходуется на
изменение его внутренней энергии и на
совершение работы.
(1)
1 2
1 2
1 2
где Q1 2- количество теплоты, подведённой к телу;
Q
U
L ,
U1 2 - изменение внутренней энергии тела;
L1 2
- работа, совершенная телом
18. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Правило знаков :«+» - теплота поводится к телу;
«- » - теплота отводится от тела;
«+» - работа, совершаемая телом;
«- » - работа, совершаемая над телом.
19. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Запишем уравнение (1) первого законатермодинамики:
в удельной форме:
q1 2 u1 2 l1 2
(2)
в дифференциальной форме:
dQ dU dL
(3)
уравнение (2) в дифференциальной форме
(уравнение (3) в удельной форме) :
dq du dl
(4)
20. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Если единственным видом работы является работарасширения, то уравнение (4) примет вид:
dq du pdv
при изохорном процессе (dv=0)
dq du,
т.е. в изохорном процессе вся теплота, подведенная
к телу, расходуется на изменение его внутренней
энергии. Тогда:
q u
cv
T v T v
21. ЭНТАЛЬПИЯ
Энтальпия – это функция состояния, определяемаяуравнением:
I U pV , Дж
Удельная энтальпия:
Дж
i u pv,
кг
Величина изменения энтальпии не зависит от пути
процесса, т.к. она функция состояния. Ее величина
определяется начальным и конечным состоянием
тела. Значение энтальпии однозначно
определяется любой парой параметров
состояния:
i p, v , i p, T , i v, T
22. ЭНТАЛЬПИЯ
Выведем уравнение первого закона термодинамикичерез энтальпию. dq du dl du pdv,
d pv pdv vdp
pdv d pv vdp
Тогда:
dq du d pv vdp
dq d u pv vdp di vdp
уравнение первого закона термодинамики,
выраженное через энтальпию:
dq di vdp
23. ЭНТАЛЬПИЯ
Если изобарный процесс (dp=0), то :dq di,
т.е. вся теплота, подведённая к телу,
расходуется на изменение его
энтальпии. Тогда:
q i
cp
T p T p
24. Второй закон термодинамики
Обратимыми называются такие процессы, при совершениикоторых как в прямом, так и в обратном направлении не
происходит ни каких остаточных изменений, как в самой
системе, так и в окружающей среде, в противном случае
процесс будет необратимый.
Формулировка второго закона термодинамики в наиболее
общей форме:
Все реальные самопроизвольные процессы являются
необратимыми.
Частная формулировка Клаузиуса:
Теплота не может самопроизвольно переходить от более
холодного тела к более нагретому.
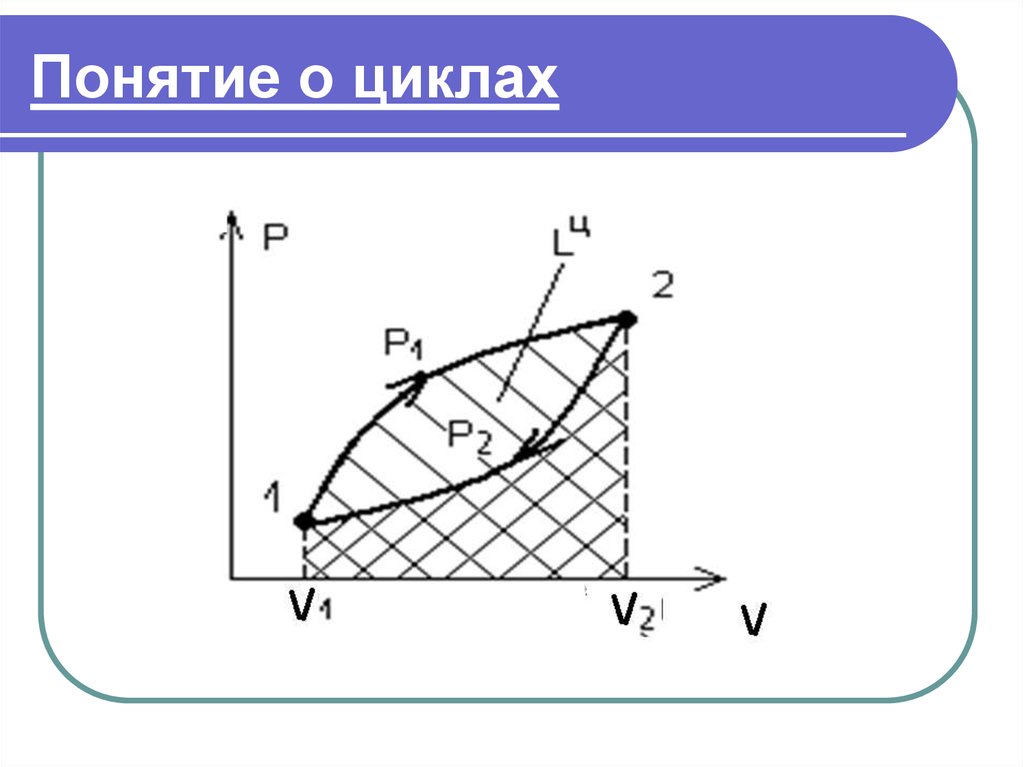
25. Понятие о циклах
26. Понятие о циклах
Тело переходит из состояния 1 всостояние 2. При этом совершается
работа расширения, затем тело
возвращается в исходное состояние.
Таким образом тело совершает
круговой процесс - цикл.
27. Понятие о циклах
V2Работа расширения:
L1P 2 PdV
V1
V1
Работа сжатия:
Работа цикла:
Lц L1P 2 LC2 1
LС2 1 PdV
V2
V2
V1
V2
V2
V1
V2
V1
V1
pdV pdV pdV pdV 0
Уравнение второго закона термодинамики для цикла:
Q
U L Q L
ц
ц
0
ц
ц
ц
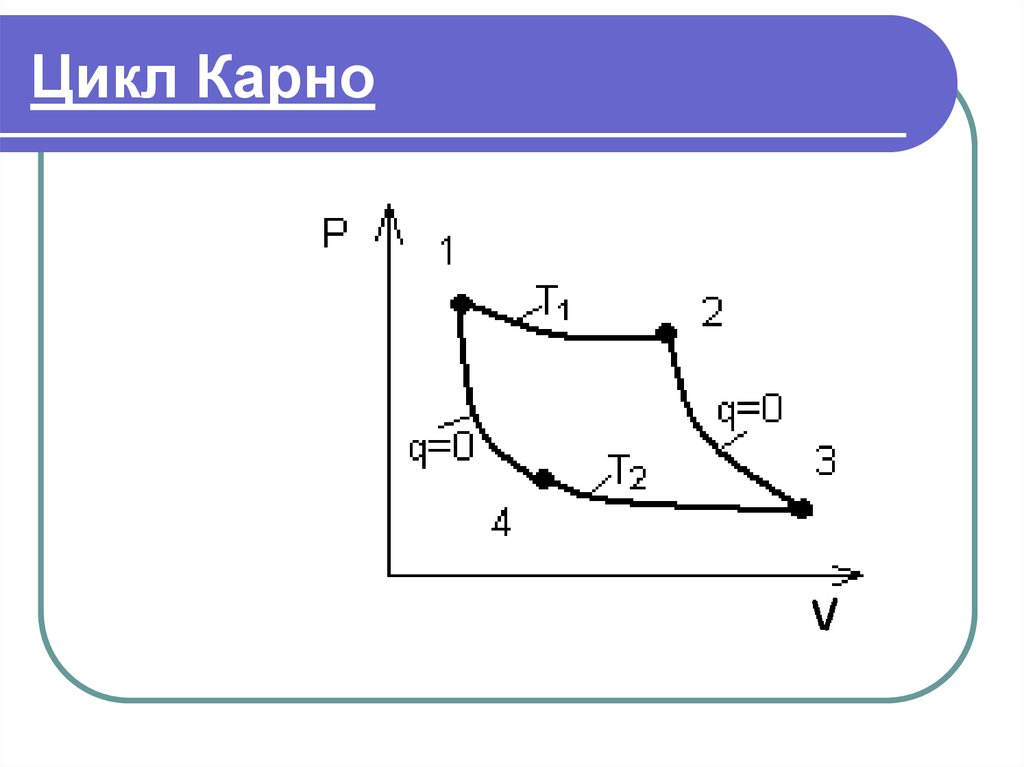
28. Цикл Карно
29. Цикл Карно
Процессы: 1-2, 3-4 - изотермические,2-3;4-1 - адиабатные;
1-2 - расширение тела в изотермическом режиме при
T1,при этом к телу от горячего источника
подводится теплота Q1, в соответствии со вторым
законом термодинамики (Тг > Т1);
2-3 - расширение тела в адиабатном режиме;
3-4 - сжатие тела в изотермическом режиме, при этом
от тела к холодному источнику отводится теплота
Q2 , в соответствии со вторым законом
термодинамики (Тх < Т2);
4-1 - сжатие тела в адиабатном режиме.
30. Цикл Карно
Рассмотрим осуществление цикла Карно в обратномнаправлении.
Процессы:
1-4 - возможен;
4-3 - невозможен, т.к. противоречит второму закону
термодинамики, в формулировке Клаузиуса;
3-2- возможен;
2-1- невозможен т.к. противоречит второму закону
термодинамики, в формулировке Клаузиуса;
Таким образом цикл Карно в данной постановке
является необратимым.
31. Цикл Карно
Обратимый цикл Карно.Пусть в процессе 1-2: Т
Г
Т1 dT
TГ Т 1
0
- второму закону термодинамики процесс не
противоречит.
При совершении процесса 3-4:
Т х Т 2 dT
Tх Т 2
0
- второму закону термодинамики процесс не
противоречит.
32. Цикл Карно
Пусть при совершении цикла в обратномнаправлении:
Т х Т 2 dT
Tх Т 2
0
Т Г Т1 dT
TГ Т 1
0
Таким образом процессы 2-1 и 4-3 уже не
противоречат второму закону термодинамики.
33. Энтропия
Термический КПД цикла определяется формулой:Q1 Q2
,
Q1
Т
(1)
где Q1 и Q2 – количество теплоты, подведенной к телу
за время цикла и отведенной от него
соответственно.
34. Энтропия
Можно доказать, что для обратимого цикла Карнотермический КПД определяется по формуле:
Т1 Т 2
,
Т1
Т
(2)
где Т1 и Т2 –температура тела, при изотермическом
расширении и изотермическом сжатии.
35. Энтропия
Формула (1) справедлива для любого циклаИз (1) и (2) получим:
Q1 Q2 Т1 Т 2
Q1
Т1
Эта формула справедлива только для обратимого
цикла Карно.
36. Энтропия
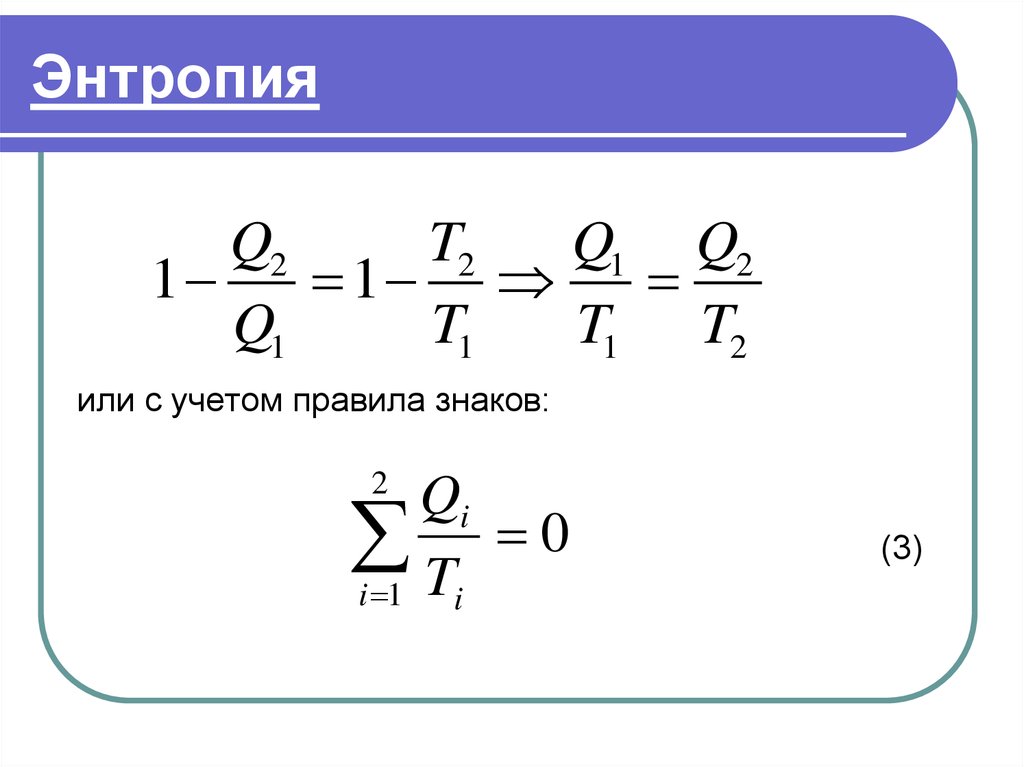
Q2T2
Q1 Q2
1
1
Q1
T1
T1 T2
или с учетом правила знаков:
2
Qi
0
i 1 Ti
(3)
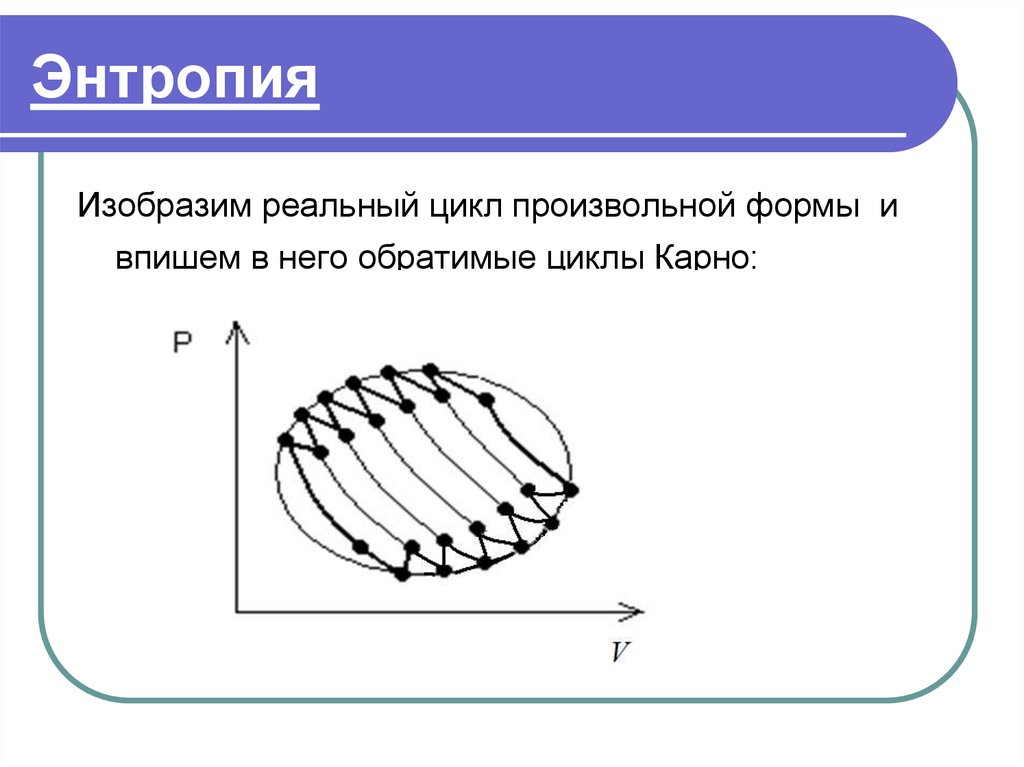
37. Энтропия
Изобразим реальный цикл произвольной формы ивпишем в него обратимые циклы Карно:
38. Энтропия
В реальный цикл произвольной формы вписали nобратимых циклов Карно с n пар тепловых
источников.
Тогда формула (3) примет вид:
Qi
0
i 1 Ti
n
Чем больше количество вписанных обратимых
циклов Карно, тем в большей степени они
заменяют реальный цикл.
(4)
39. Энтропия
Пустьn
, тогда формула (4) примет вид:
Qi
0,
im
n i 1 Ti
n
(5)
т.е. интеграл по замкнутой кривой:
dQ
T 0
(6)
40. Энтропия
Тогда для любого реального цикласправедлива формула (6). Обозначим
подынтегральное выражение:
dQ
dS
,
T
где S- энтропия , Дж/К
41. Энтропия
dQT
- интеграл Клаузиуса.
1
T
- интегрирующий множитель, он превращает функцию
процесса в функцию состояния.
Удельная энтропия:
dq
ds
dq Tds
T
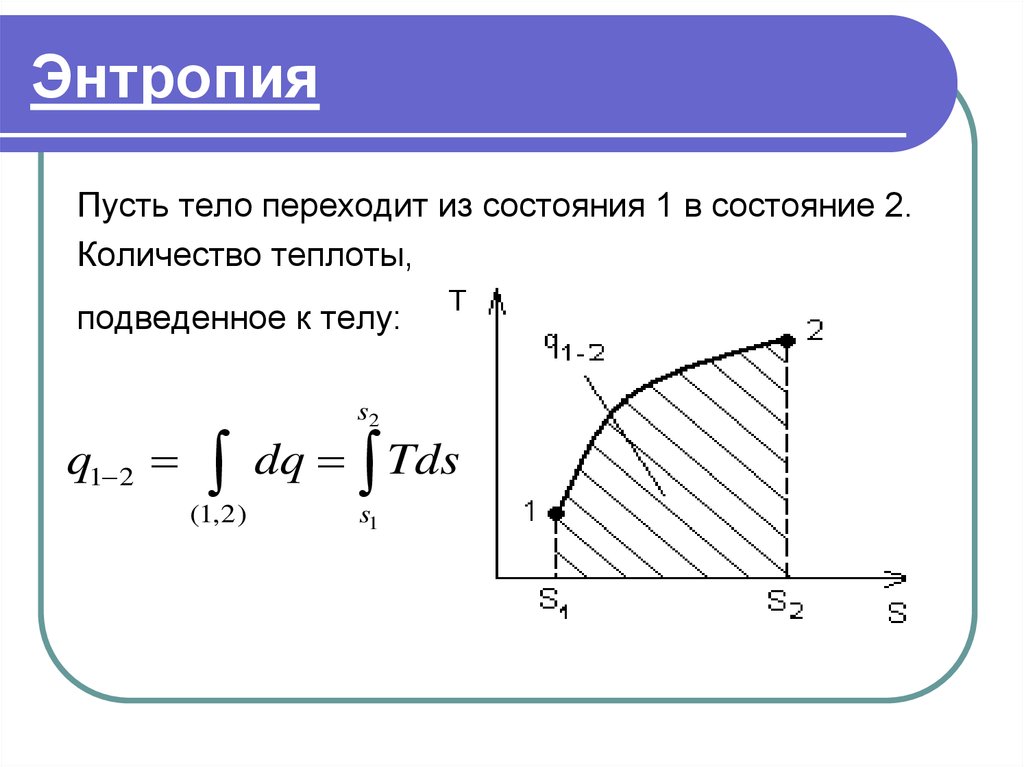
42. Энтропия
Пусть тело переходит из состояния 1 в состояние 2.Количество теплоты,
подведенное к телу:
q1 2
(1,2)
s2
dq Tds
s1
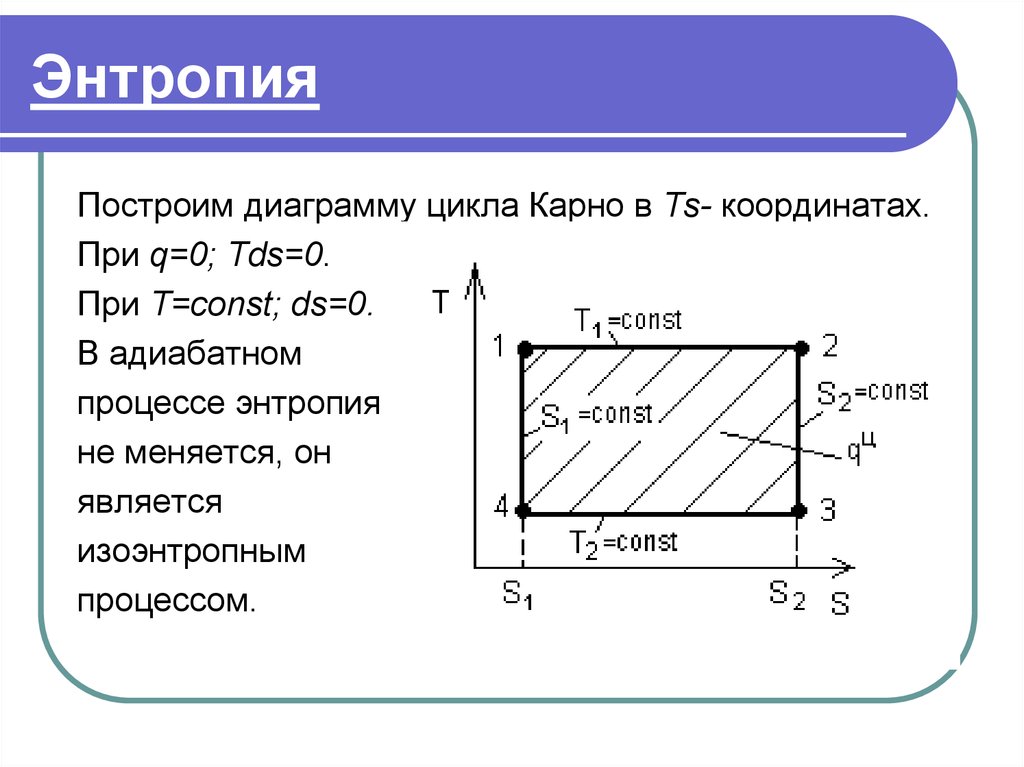
43. Энтропия
Построим диаграмму цикла Карно в Тs- координатах.При q=0; Тds=0.
При T=const; ds=0.
В адиабатном
процессе энтропия
не меняется, он
является
изоэнтропным
процессом.
44. ЭКСЕРГИЯ
Основываясьна
втором
начале
термодинамики, установим количественное
соотношение между работой, которая могла бы
быть совершена системой при данных внешних
условиях в случае протекания в ней равновесных
процессов, и действительной работой,
производимой в тех же условиях, при
неравновесных процессах.
Рассмотрим изолированную систему, состоящую из
горячего источника с температурой Т1, холодного
источника (окружающей среды)
с температурой
То и рабочего тела, совершающего цикл.
45. ЭКСЕРГИЯ
Работоспособностью(и л и
э к с е р г и е й) т е л л о т ы
Qi,
отбираемой от горячего источника с
температурой Ti, называется максимальная
полезная работа , которая может быть
получена за счет этой теплоты при условии,
что холодным источником является
окружающая среда с температурой То.
46. ЭКСЕРГИЯ
Из предыдущего ясно, что максимальнаяполезная работа теплоты
Q,
представляет собой работу равновесного
цикла Кapнo, осуществляемого в
диапазоне температур Ti — To:
LI макс t Q1 ,
где
t 1 T0 / T1
47. ЭКСЕРГИЯ
Таким образом, эксергия теплоты Q1:L макс Q1 (1 T0 / T1 ),
I
т. е работоспособность теплоты тем
больше, чем меньше отношение То/Т1.
При Т1= То она равна нулю.
48. ЭКСЕРГИЯ
Полезнуюработу, полученную за
счет теплоты
Q1 горячего
источника, можно представить в
виде:
L1 = Q1 - Q2,
где Q2 — теплота, отдаваемая в цикле
холодному источнику (окружающей
среде) с температурой То.
49. ЭКСЕРГИЯ
S хол обозначить приращениеЕсли через
энтропии холодного источника, то
Q2 T0 S хол ,
тогда
L Q1 T0 S хол
I
50. ЭКСЕРГИЯ
Если бы в рассматриваемой изолированнойсистеме протекали только равновесные
процессы, то энтропия системы оставалась
бы неизменной, а увеличение энтропии
холодного источника равнялось бы
уменьшению энтропии горячего. В этом
случае за счет теплоты Q1 можно было бы
получить максимальную полезную работу:
L макс Q1 T0 Sгор
I
51. ЭКСЕРГИЯ
ВеличинаL L макс L
I
I
определяет п о т е р ю
р а б от ы,
обусловленную рассеиванием
энергии вследствие неравновесности
протекающих в системе процессов.
Чем больше неравновесность процессов,
мерой которой, является увеличение
энтропии изолированной системы, тем
меньше производимая системой работа.











































 physics
physics








