Similar presentations:
Молекулярно-кінетична теорія газу (2)
1.
ФізикаЛектор: доцент Білоус Оксана
Іванівна
1
2.
Теорія, яка ґрунтується на статистичному методі дослідженняназивається кінетичною теорією.
1.
2.
3.
4.
Кінетична теорія ґрунтується на наступних загальних
положеннях класичної статистичної фізики:
В системі частинок виконуються закони збереження
імпульсу, моменту імпульсу, енергії, електричного заряду
(для систем заряджених частинок) і числа частинок.
Всі частинки системи вважаються міченими, тобто
передбачається можливість відрізняти одну від одної
тотожні частинки.
Всі фізичні процеси в системі протікають у просторі і часі
неперервно.
Кожна частинка системи може мати довільні значення
координат (в межах об’єму системи) та компонент
швидкості незалежно від того, які значення цих
характеристик у інших частинок системи.
Фізика
Лектор: доцент Білоус Оксана Іванівна
2
3.
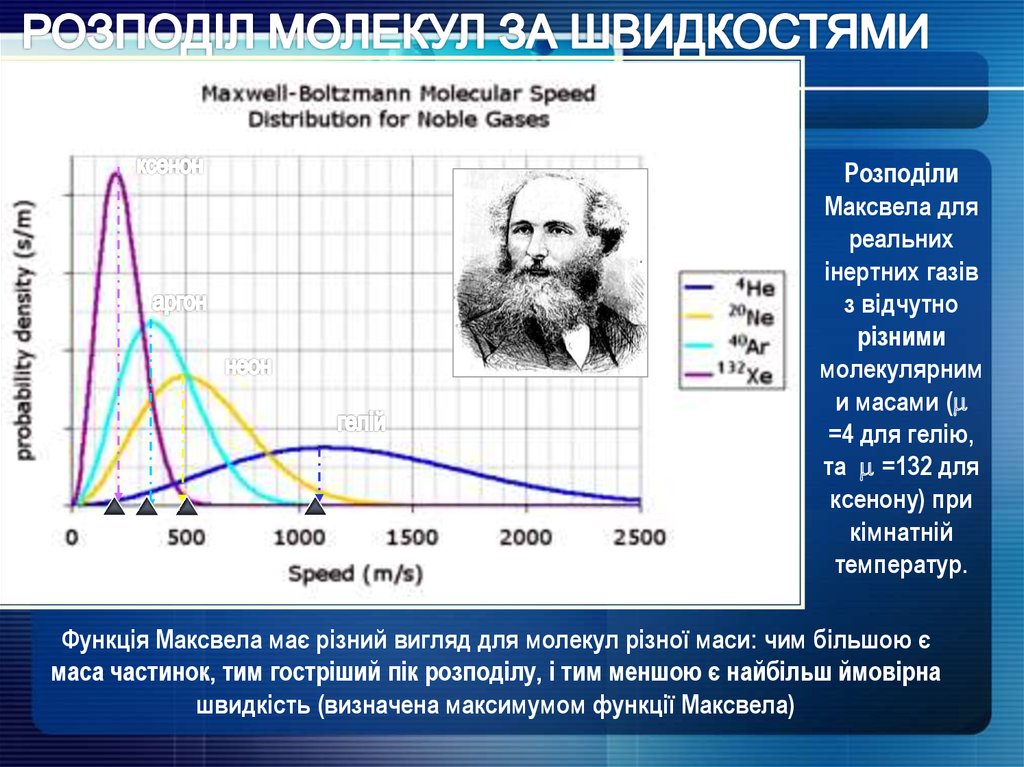
РозподілиМаксвела для
реальних
інертних газів
з відчутно
різними
молекулярним
и масами (
=4 для гелію,
та =132 для
ксенону) при
кімнатній
температур.
Функція Максвела має різний вигляд для молекул різної маси: чим більшою є
маса частинок, тим гостріший пік розподілу, і тим меншою є найбільш ймовірна
швидкість (визначена максимумом функції Максвела)
4.
dnUz
dU
Ux
Uy
-кількість молекул в одиниці об’єму газу,
модулі швидкостей яких знаходяться в
межах від U до U dU
кінці векторів швидкостей цих молекул
мають лежати у просторі швидкостей
всередині колового шару. Об’єм цього
шару d
4 u 2 du
Під час теплового руху з причини його безладності всі
напрямки швидкостей молекул рівно вірогідні. Тому число
dn n0 f u 4 u 2 du n0 F u du
dn
F u
f u 4 u 2
n0 du
Фізика
- функція розподілу Максвелла
Лектор: доцент Білоус Оксана
Іванівна
4
5.
f(v)Розподіли молекул ідеального
газу по швидкостям (розподіли
Максвела) для трьох різних
температур.
T1<T2<T3
Функція Максвела f(v) показує
ймовірність того, що швидкість
молекули потряпляє у певний
інтервал швидкостей від v до
v+dv.
v
Повільна молекула
v v+dv
Вісь швидкостей
Швидша молекула
Молекули мають різні за напрямом та модулем
швидкості, як видно з рисунку. Втім більшість молекул
мають швидкості не дуже відмінні від деякої середньої
швидкості. Дуже швидких та дуже повільних молекул
відносно небагато.
Фізика
Лектор: доцент Білоус Оксана
Іванівна
5
6.
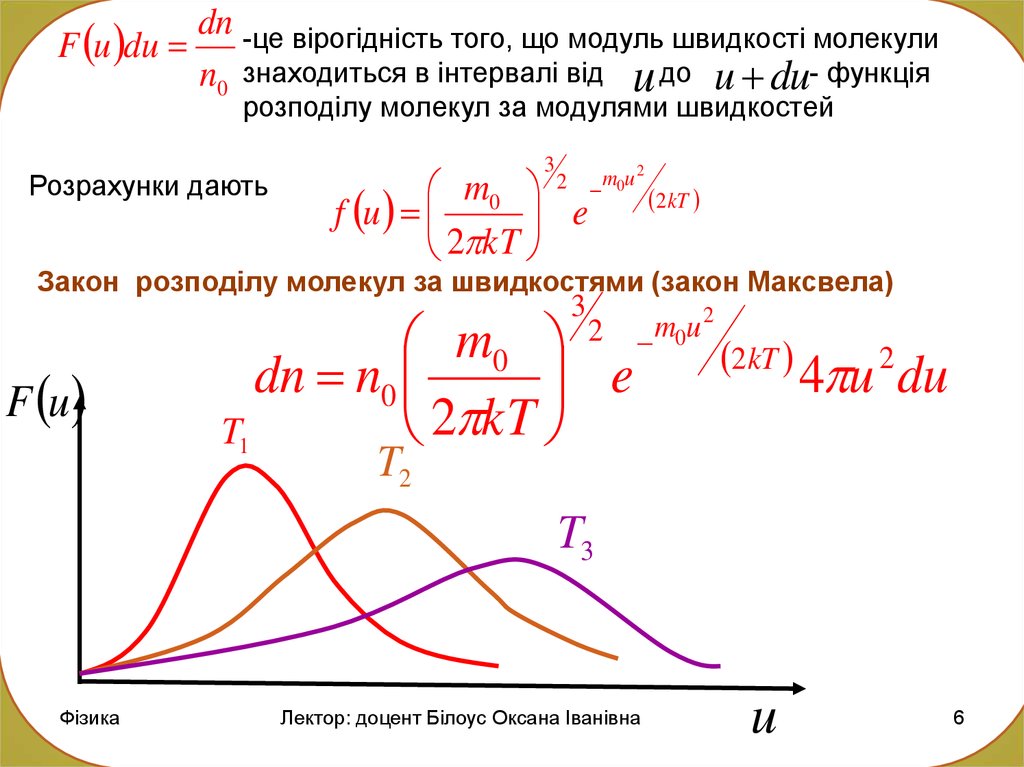
dn -це вірогідність того, що модуль швидкості молекулиF u du
n0 знаходиться в інтервалі від u до u du- функція
розподілу молекул за модулями швидкостей
Розрахунки дають
3
m0
f u
e
2 kT
2
m0u 2
2 kT
Закон розподілу молекул за швидкостями (закон Максвела)
3
F u
m0 2
dn n0
e
2 kT
T1
m0u 2
2 kT
4 u du
2
T2
T3
Фізика
Лектор: доцент Білоус Оксана Іванівна
u
6
7.
ФізикаЛектор: доцент Білоус Оксана
Іванівна
7
8.
dn( )dS
n
f
й сер сер.кв
d
ФІЗИКА
Лектор: доц.Білоус Оксана
Іванівна
8
9.
Найбільш вірогідна швидкість відповідає максимумуфункції розподілу Максвелла:
d
e
du
m0u 2
2 kT
2
4 u
0
u uB
2kT
2 RT
2
uB
vкв
m0
M
3
де
Фізика
3kT
vкв
m
Лектор: доцент Білоус Оксана Іванівна
9
10.
Розподіл Максвела дозволяє визначити середню арифметичнушвидкість поступального руху молекул ідеального газу:
n0
u uF u du
0
Середнє значення будь-якої фізичної величини з урахуванням закону
розподілу молекул за швидкостями в класичній статистичній фізиці
визначається за формулою:
n0
x xF u du
0
m0
u n0 4
2 kT
3
2
3
u e
m0u 2
2 kT
u 2 du
0
Після інтегрування отримаємо:
Фізика
8kT
8RT
4
8
u
uB
vкв
m0
M
3
10
11.
BM lДослід Штерна (1920)
N М
u
B
А
С
t
Схема приладу Штерна для визначення
швидкості молекул парів металу. Якщо
прилад обертається за годинниковою
стрілкою, то наліт срібла опиниться в
точці N.
Обчислимо довжину дуги MN. Вона
дорівнює шляху, який проходить точка
циліндру за час польоту молекули від B
до циліндра, тобто
ul
ul
l s
v
v
v
s
Фізика
s ut
v 650 м с
Лектор: доцент Білоус Оксана
Іванівна
11
12.
За допомогою закону розподілу молекул за швидкостями можназнайти розподіл молекул ідеального газу за кінетичними
енергіями їх теплового руху. Цей розподіл встановлює частку
dnWK
2
молекул
, кінетичні енергії WK 1 m0 u яких знаходяться в
2
n0
інтервалі від WK до W dW В законі:
K
3
m0
dn n0
e
2 kT
2
m0u 2
K
2 kT
4 u 2 du
Перейдемо від швидкості до енергії за формулами:
u
2WK
dnWK n0
Фізика
1
2
K
W
du
m0
2
kT
3
2
e
WK
kT
Лектор: доцент Білоус Оксана
Іванівна
dWK
2m0
WK dWK
12
13.
dnWKn0
F2 WK dWK
3 WK
2
F2 WK kT 2 e kT WK
- функція розподілу молекул
ідеального газу за кінетичними
енергіями.
Середня кінетична енергія молекули ідеального газу:
WK WK F2 WK dWK 0
0
2
kT 2
3
WK e
W
K
0
kT
3
WK dWK kT
2
3
WK kT
2
Фізика
Лектор: доцент Білоус Оксана
Іванівна
13
14.
Знайдемо закон зміни тиску ідеального газу з висотою воднорідному полі тяжіння. Будемо вважати, що газ знаходиться в
стані термодинамічної рівноваги, так що його температура всюди
однакова. Виділимо на висоті
стовп abcd газу висотою dh і
площею основи, яка дорівнює одиниці. Різниця тисків p i p dp
h
на нижню і верхню основи виділеного стовпа, тобто на висотах
h i h dh
h
h dh
h
дорівнює гідростатичному тиску
dp gdh
Знайдемо густину із рівняння Менделєєва –
Клапейрона:
m
m
pM
pV RT p
RT RT
M
VM
M
RT
pM
dp
gM
dp
gdh,
dh
RT
p
RT
15.
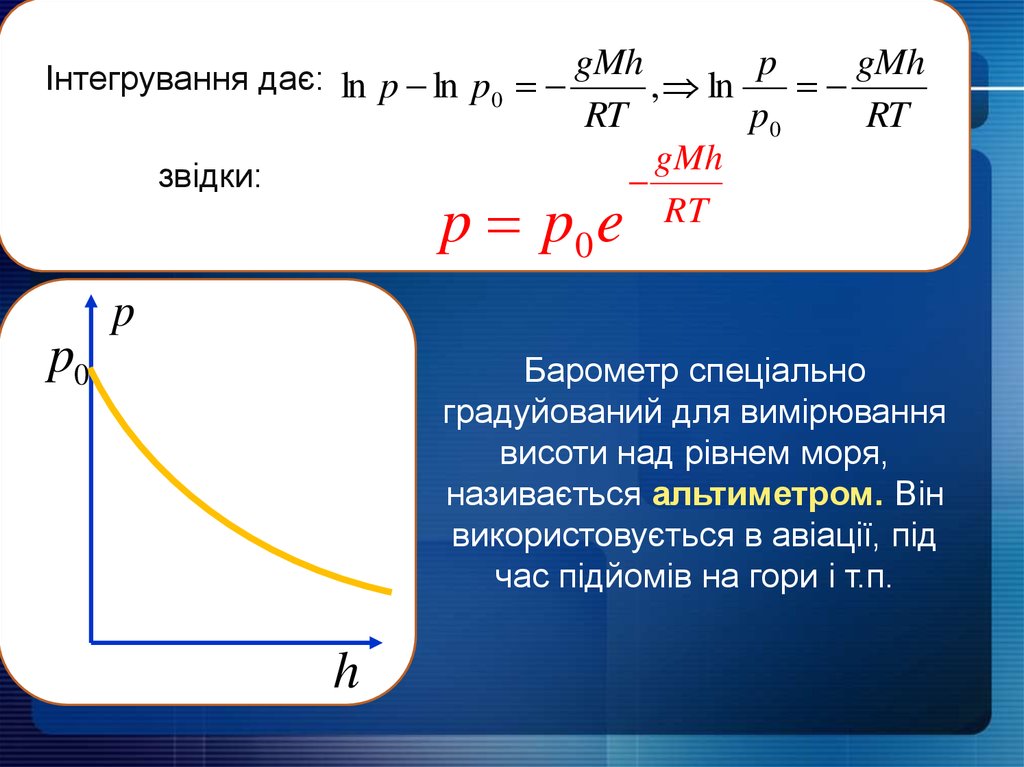
Інтегрування дає: ln p ln p0 gMh , ln p , gMhRT
звідки:
p p0 e
p0
RT
gMh
RT
p
p0
Барометр спеціально
градуйований для вимірювання
висоти над рівнем моря,
називається альтиметром. Він
використовується в авіації, під
час підйомів на гори і т.п.
h
16.
p p0 egMh
RT
Барометрична формула дозволяє отримати співвідношення між
концентрацією газу на різній висоті. Візьмемо рівняння стану
ідеального газу у вигляді
p nkT
n n0 e
gMh
RT
mgh WП
n n0 e
WK
kT
Врахуємо, що
R
k
M m0
тоді
n n0 e
m0 gh
kT
- потенціальна енергія молекули в однорідному
полі тяжіння поблизу поверхні Землі
ЗАКОН БОЛЬЦМАНА ДЛЯ РОЗПОДІЛУ ЧАСТИНОК
У ЗОВНІШНЬОМУ ПОТЕНЦІАЛЬНОМУ ПОЛІ
Закон Больцмана є справедливим для будь-якого потенціального
поля незалежно від його фізичної природи.
16
Фізика
Лектор: доцент Білоус Оксана Іванівна
17.
yy4
y3
y2
y1
x
Ілюстрація розподілу молекул у полі сил земного тяжіння –
розподілу Больцмана.
Чим вище – тим менша концентрація молекул
Фізика
Лектор: доцент Білоус Оксана
Іванівна
17
18.
ГоверлаФізика
Залежність тиску
повітря від висоти
над рівнем моря
і температури
Лектор: доцент Білоус Оксана
Іванівна
18
19.
Експериментальний спосіб вивченнярозподілу Максвела. Молекулярний
промінь проходить крізь зміщені прорізи в
дисках, які обертаються з частотою . Ця
частота підібрана так, аби за час
проходження молекул поміж дисками для
них відкрився шлях на детектор. Отже, на
детектор потрапляють лише молекули
певної швидкості : v = L/ . Міняючи
частоту обертання дисків можна вивчити
розподіл молекул по швидкостях.
= t
L=vt
Шлях , пройдений молекулою поміж двома послідовними
зіткненнями, є випадковим: 0 . Існує два різних
способи визначення його середнього значення :
Усереднити шляхи пробігу однієї молекули за великий
проміжок часу: t ;
Усереднити шляхи пробігу багатьох молекул за t t ;
1
Обидва способи дають однаковий результат
(так стверджує так звана ергодична гіпотеза).
2 nd 2
Фізика
Лектор: доцент Білоус Оксана
Іванівна
19
20.
ФізикаЛектор: доцент Білоус Оксана
Іванівна
20
















 physics
physics








