Similar presentations:
Термодинаміка. Перший закон термодинаміки
1.
Лекція № 11?Температура
полум'я
?Температура
сірника
Фізика
?Температура
магми
Лектор: доцент Білоус Оксана
Іванівна
1
2.
Теплота,робота та внутрішня енергія
термодинамічної системи.
Повна і питома теплоємності.
Перший закон термодинаміки.
Застосування першого закону термодинаміка
до ізопроцесів.
Формула Маєра.
Адіабатичний процес. Формула Пуасона.
Політропний процес, показник політропи.
Значення показника політропи для різних
ізопроцесів.
Фізика
Лектор: доцент Білоус Оксана
Іванівна
2
3.
Внутрішньою енергією тіла називають енергію цьоготіла без урахування кінетичної енергії тіла, як цілого і
потенціальної енергії тіла у зовнішньому полі сил. Таким
чином, внутрішня енергія - це кінетична енергія
хаотичного руху молекул, потенціальна енергія їх
взаємодії, а також, енергія атомного ядра і т.п.
Внутрішня енергія є функцією стану системи. Це
означає, що кожного разу, коли система опиняється в
певному стані, її внутрішня енергія має таке саме
значення внутрішньої енергії незалежно від попередньої
історії системи. Таким чином, зміна внутрішньої енергії
при переході системи з одного стану в інший завжди
дорівнює різниці значень внутрішньої енергії в цих
станах, незалежно від шляху, яким виконувався перехід.
Внутрішня енергія - це адитивна величина, тобто
внутрішня енергія системи дорівнює сумі
енергій
частинок, з яких складається тіло.
Фізика
Лектор: доцент Білоус Оксана
Іванівна
3
4.
Внутрішня енергія ідеального газу є сумоюкінетичних енергій всіх його молекул (або
атомів)
U N
i
U N kT
2
i m
U
RT
2M
Дж
R 8,31
К моль
кiн
m
N NA
M
- молярна газова стала
Фізика
Лектор: доцент Білоус Оксана
Іванівна
4
5.
F pSdA Fdl pSdl pdV
dA pdV
dl
p
l1
l2
Робота у загальному випадку:
A
V2
pdV
V1
Фізика
Лектор: доцент Білоус Оксана
Іванівна
5
6.
Ap const
V const
Фізика
pdV p V
2
V1
V1
A
T const
V2
V2
V1
V2
V2
m
dV m
pdV
RT
RT ln
M
V
M
V1
V1
A
V2
pdV 0
V1
Лектор: доцент Білоус Оксана
Іванівна
6
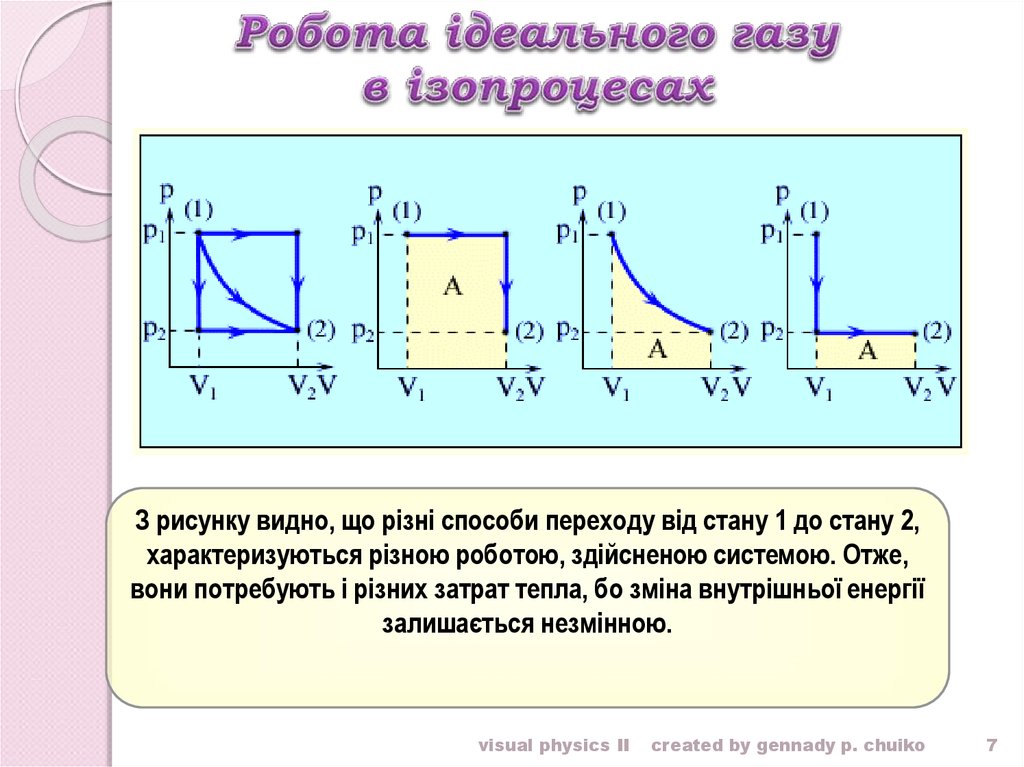
7.
З рисунку видно, що різні способи переходу від стану 1 до стану 2,характеризуються різною роботою, здійсненою системою. Отже,
вони потребують і різних затрат тепла, бо зміна внутрішньої енергії
залишається незмінною.
visual physics II
created by gennady p. chuiko
7
8.
Це енергія, яка передається тілу в процесітеплопередачі ззовні. Теплопередача – це
такий процес, при якому внутрішня енергія
одних тіл зменшується, а інших – відповідно
збільшується, причому механічна енергія тіл
не змінюється і робота не виконується.
Кількість теплоти, яку потрібно надати будьякому тілу, щоб підвищити його температуру
на 1 К, називається теплоємністю цього тіла.
dQ
C
dT
Дж
[C ]
.
К
Фізика
Лектор: доцент Білоус Оксана
Іванівна
8
9.
Питома теплоємність - це фізичнавеличина, що показує, яку кількість теплоти
потрібно затратити, щоб нагріти одиницю
маси речовини на один Кельвін:
dQ
c
m dT
Дж
[с ]
.
кг К
Кількість теплоти, яку потрібно надати
одному молю речовини, щоб підвищити його
температуру на один Кельвін називається
молярною теплоємністю
CM
dQ
dT
Дж
[C м ]
.
моль К
Фізика
Лектор: доцент Білоус Оксана
Іванівна
9
10.
Перший закон термодинаміки є законом збереженняенергії, який сформульований у вигляді, зручному для
розгляду теплових процесів: кількість теплоти, надана
системі, йде на зміну внутрішньої енергії системи і
здійснення системою роботи:
i
Q dU A, dQ RdT pdV
2
де dU - повний диференціал, Q та A – варіації. Різниця
між варіацією та повним диференціалом полягає у тому,
що dU характеризує внутрішній стан системи і не
залежить від шляху системи, а Q та A залежать від
шляху, тобто послідовності станів системи.
Фізика
Лектор: доцент Білоус Оксана
Іванівна
10
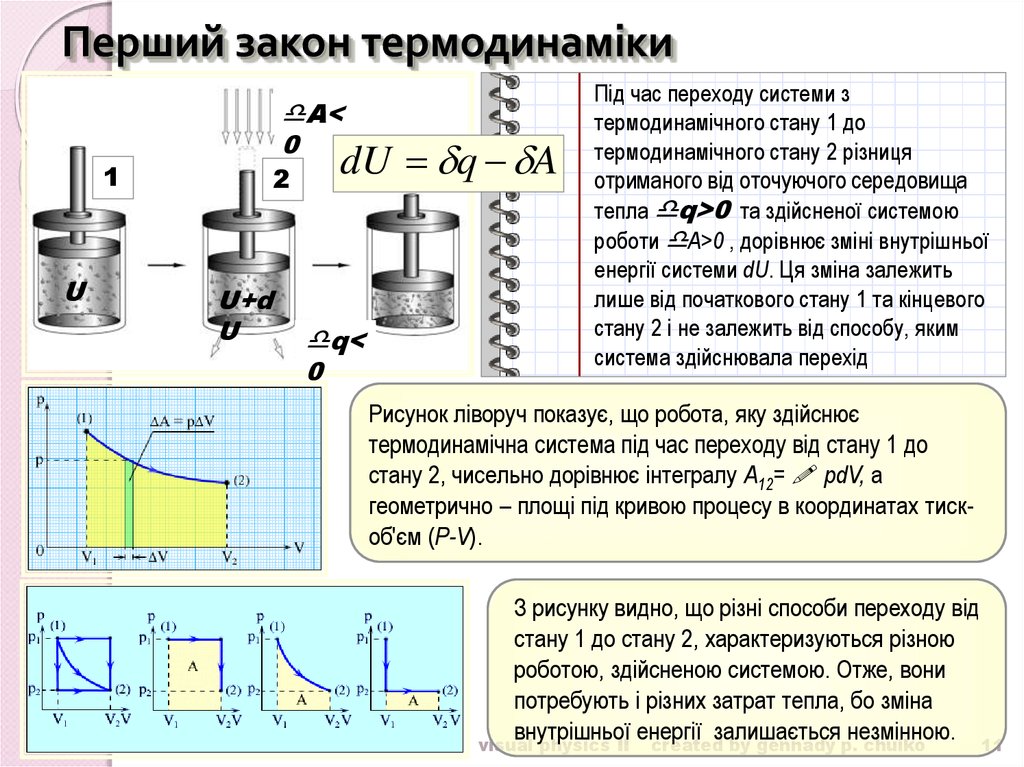
11. Перший закон термодинаміки
A<0
1
U
2
U+d
U
dU q A
q<
0
Під час переходу системи з
термодинамічного стану 1 до
термодинамічного стану 2 різниця
отриманого від оточуючого середовища
тепла q>0 та здійсненої системою
роботи А>0 , дорівнює зміні внутрішньої
енергії системи dU. Ця зміна залежить
лише від початкового стану 1 та кінцевого
стану 2 і не залежить від способу, яким
система здійснювала перехід
Рисунок ліворуч показує, що робота, яку здійснює
термодинамічна система під час переходу від стану 1 до
стану 2, чисельно дорівнює інтегралу A12= pdV, а
геометрично – площі під кривою процесу в координатах тискоб'єм (P-V).
З рисунку видно, що різні способи переходу від
стану 1 до стану 2, характеризуються різною
роботою, здійсненою системою. Отже, вони
потребують і різних затрат тепла, бо зміна
внутрішньої енергії залишається незмінною. 11
visual physics II created by gennady p. chuiko
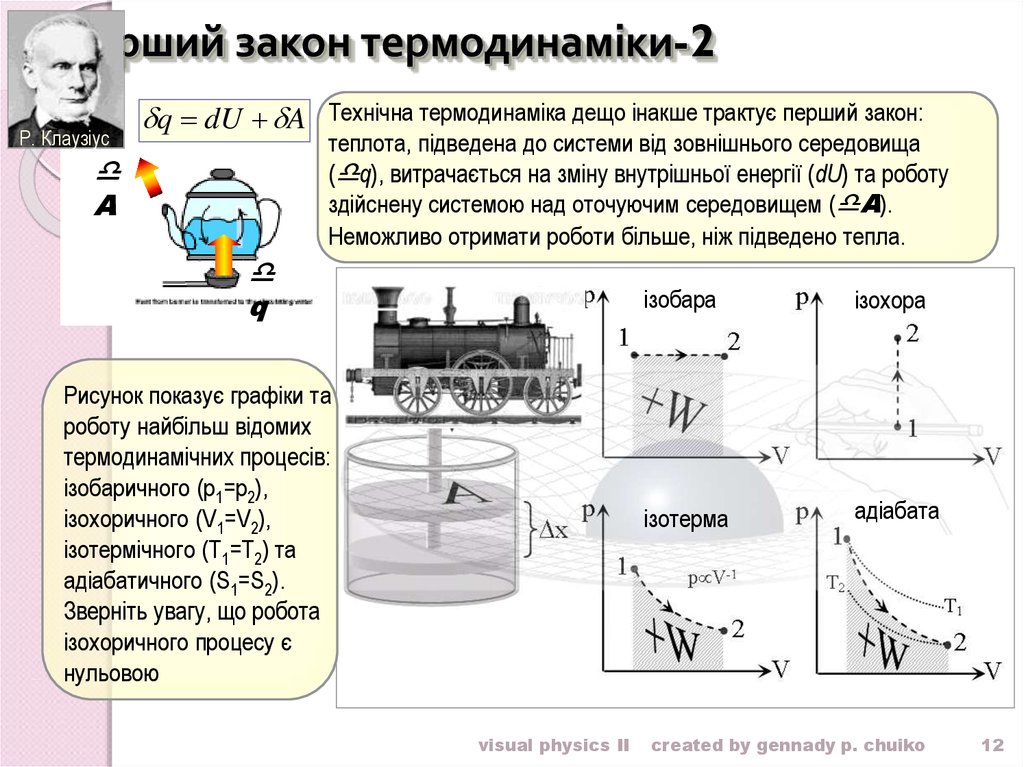
12. Перший закон термодинаміки-2
Р. Клаузіусq dU A Технічна термодинаміка дещо інакше трактує перший закон:
теплота, підведена до системи від зовнішнього середовища
( q), витрачається на зміну внутрішньої енергії (dU) та роботу
здійснену системою над оточуючим середовищем ( A).
Неможливо отримати роботи більше, ніж підведено тепла.
A
q
Рисунок показує графіки та
роботу найбільш відомих
термодинамічних процесів:
ізобаричного (p1=p2),
ізохоричного (V1=V2),
ізотермічного (T1=T2) та
адіабатичного (S1=S2).
Зверніть увагу, що робота
ізохоричного процесу є
нульовою
visual physics II
ізобара
ізохора
ізотерма
адіабата
created by gennady p. chuiko
12
13.
Інше формулювання: неможливо створеннявічного двигуна першого роду, тобто двигуна в
якому вся енергія перетворювалася б на роботу.
Фізика
Лектор: доцент Білоус Оксана
Іванівна
13
14.
idQ RdT pdV
2
i
i 2
i 2
Q R T p V
R T
p V
2
2
2
dQ
i 2
Cp
R
dT
2
Фізика
Лектор: доцент Білоус Оксана
Іванівна
14
15.
dT 0 dU 0 mdQ dA
V2
Q
RT ln
pdV
M
V1
CT
dV 0 dA 0
i
i m
dQ dU
RdT Q U R T
2
2M
i
CV
Рівняння Маєра:
2
R
C p CV R
Фізика
Лектор: доцент Білоус Оксана
Іванівна
15
16.
Адіабатним називається процес, якийпротікає без теплообміну dQ 0 із зовнішнім
середовищем
Рівняння Маєра:
Сp
СV
С p СV R
- показник Пуассона
Сp
R
1
СV
СV
R
1
СV
Перший закон термодинаміки:
i m
m
dQ
RdT pdV CV
dT pdV 0
2M
M
m
1
p RT
M
V
рівняння Мендєлєєва – Клапейрона
Фізика
Лектор: доцент Білоус Оксана
Іванівна
16
17.
mm RT
RT
СV dT
dV 0 СV dT
dV 0 : TCV
M
M V
V
dT R dV
0
T CV V
ln T
або
R
ln V const
СV
R
d ln T
ln V 0
СV
ln T 1 ln V const ,
ln T ln V 1 const ln T V 1 const T V 1 const
T V 1 const - рівняння адіабати
M pV
З рівняння Менделєєва
T
Клапейрона:
m R
M pV
mRconst
1
1
V
const pV V
pV const
m R
M
Фізика
Лектор: доцент Білоус Оксана
Іванівна
17
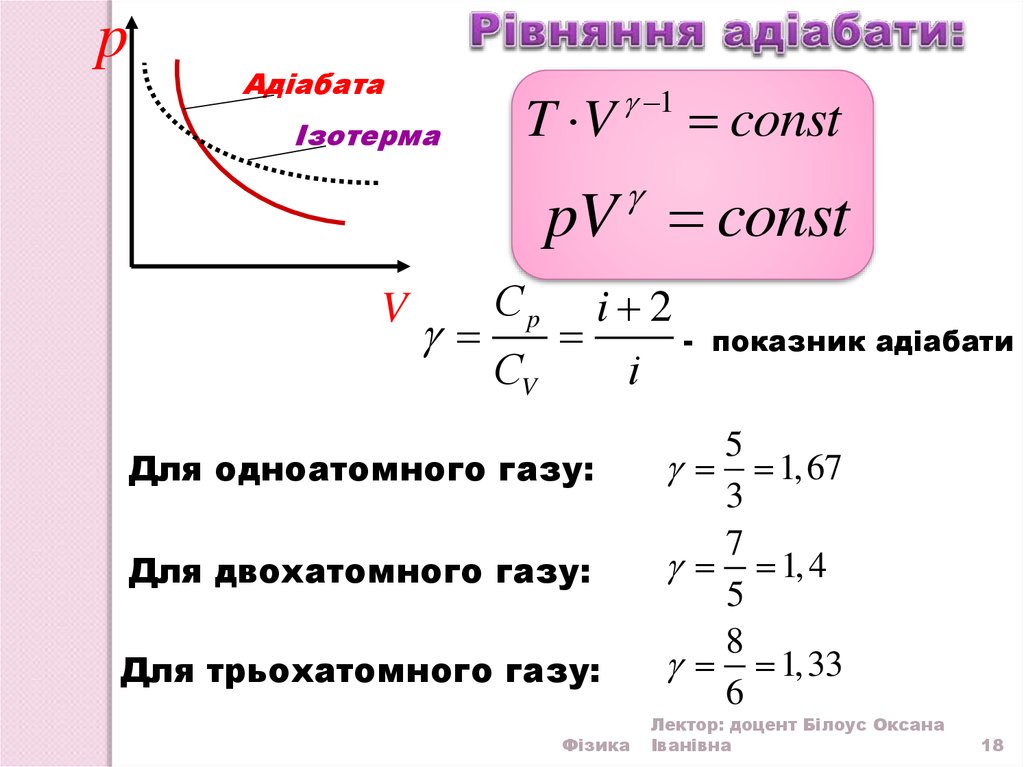
18.
pАдіабата
Ізотерма
T V
1
const
pV const
V
Сp
i 2
СV
i
Для одноатомного газу:
Для двохатомного газу:
Для трьохатомного газу:
Фізика
показник адіабати
5
1, 67
3
7
1, 4
5
8
1,33
6
Лектор: доцент Білоус Оксана
Іванівна
18
19.
Політропними називають процеси, в якихтеплоємність тіла залишається сталою C const
Запишемо рівняння І закону термодинаміки для одного
моля газу:
m
1
M
dQ CdT
CdT СV dT pdV
та врахуємо, що
Рівняння Менделєєва – Клапейрона для одного моля має
вигляд :
pV RT
Продиференціюємо це рівняння:
pdV Vdp RdT
Фізика
Лектор: доцент Білоус Оксана
Іванівна
19
20.
pdV VdpdT
R
pdV Vdp
pdV Vdp
C
СV
pdV C pdV Vdp СV pdV Vdp RpdV
R
R
C СV R pdV C СV Vdp 0
Виконаємо заміну: С p СV R , та розділимо рівняння на:
pV
C C dV C С dp 0 C C ln V C С ln p const
p
V
V
Розділимо це
співвідношення на:
p
C СV
C Cp
n
C CV
C Cp
p
V
Це можливо за умови:
C СV
ln V ln p const ln pV n const
C CV
pV const - рівняння політропного процесу
n
Фізика
Лектор: доцент Білоус Оксана
Іванівна
20
21.
Усі ізопроцеси та адіабатний процес – це політропніпроцеси з різними показниками політропи.
C Cp n 0
Для ізобарного процесу
Для ізотермічного процесу
n 1
C CV n
Для ізохорного процесу
n
Для адіабатного процесу
Теплоємність ідеального газу для політропного процесу
C
nCV C p
n 1
n 1
V1
p1V1
1
A
n 1 V2
Робота при політропному процесі
для:
n 1
Фізика
Лектор: доцент Білоус Оксана
Іванівна
21
22.
ФізикаЛектор: доцент Білоус Оксана
Іванівна
22
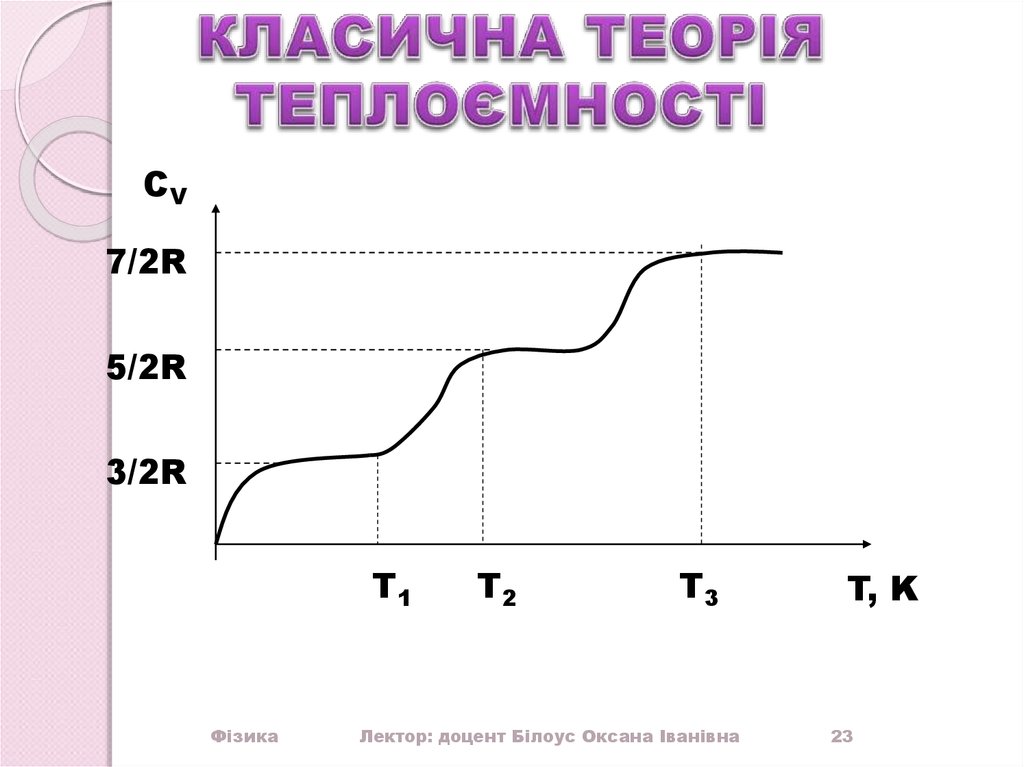
23.
СV7/2R
5/2R
3/2R
T1
Фізика
T2
T3
Лектор: доцент Білоус Оксана Іванівна
T, K
23
24.
1. Навести приклади того, як можна отримати опік долоньвід тіл температура яких є нижчою.
2. Де варто зберігати молоко для ефективного утворення
вершків.
3. Напрямок дії гравітаційної сили збігається з напрямком
сили тяжіння?
Фізика
Лектор: доцент Білоус Оксана Іванівна
24


















 physics
physics








