Similar presentations:
Основи МКТ. Вступ до термодинаміки
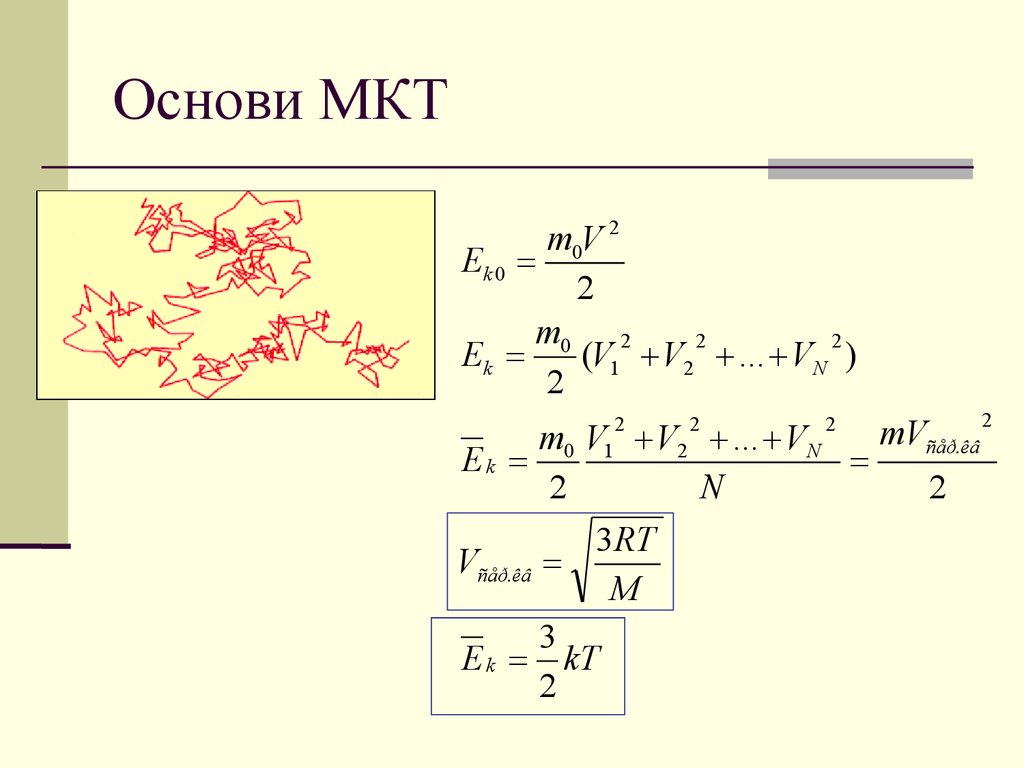
1. Основи МКТ Вступ до термодинаміки
Зінчук В.М.2. Основи МКТ
m0V 2Ek 0
2
m0 2
2
2
Ek
(V1 V2 ... VN )
2
2
2
2
mVñåð.êâ
m0 V1 V2 ... VN
Ek
2
N
2
3RT
Vñåð.êâ
M
3
E k kT
2
2
3. Принципи вимірювання температури
Типи температурних шкалАбсолютна: Т, K
Цельсія: t, 0C
Т= t+273,15
273,15
0
-273,15
0
Плавлення льоду
Припинення теплового
руху молекул
(абсолютний нуль)
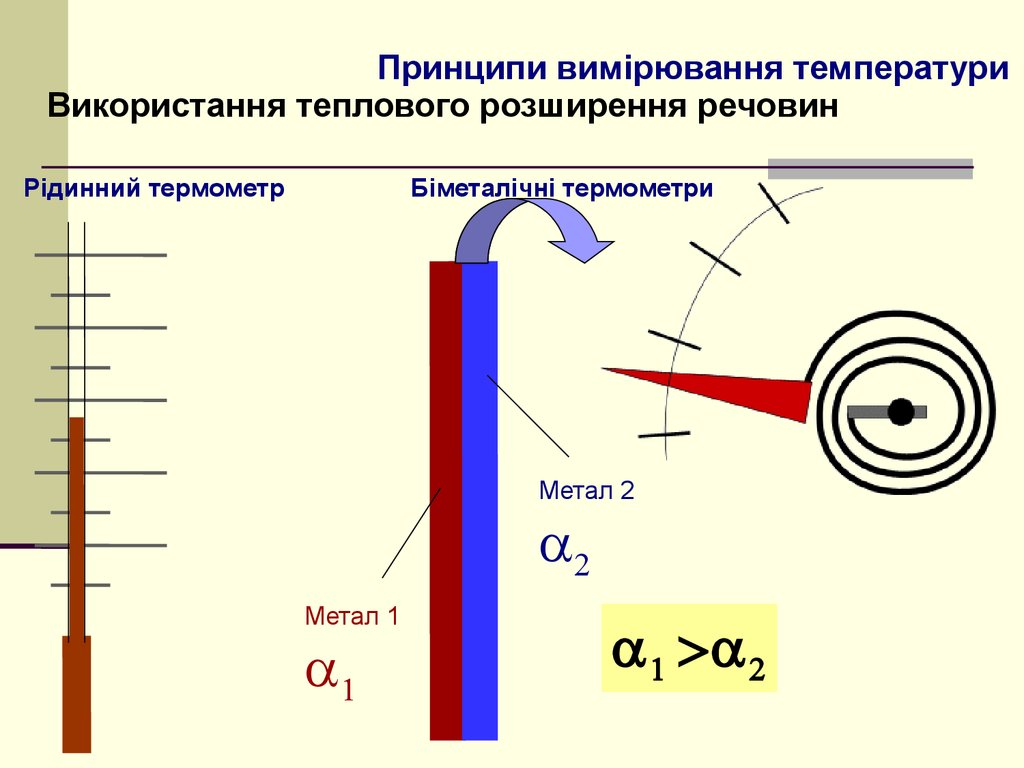
4. Принципи вимірювання температури
Використання теплового розширення речовинРідинний термометр
Біметалічні термометри
Метал 2
Метал 1
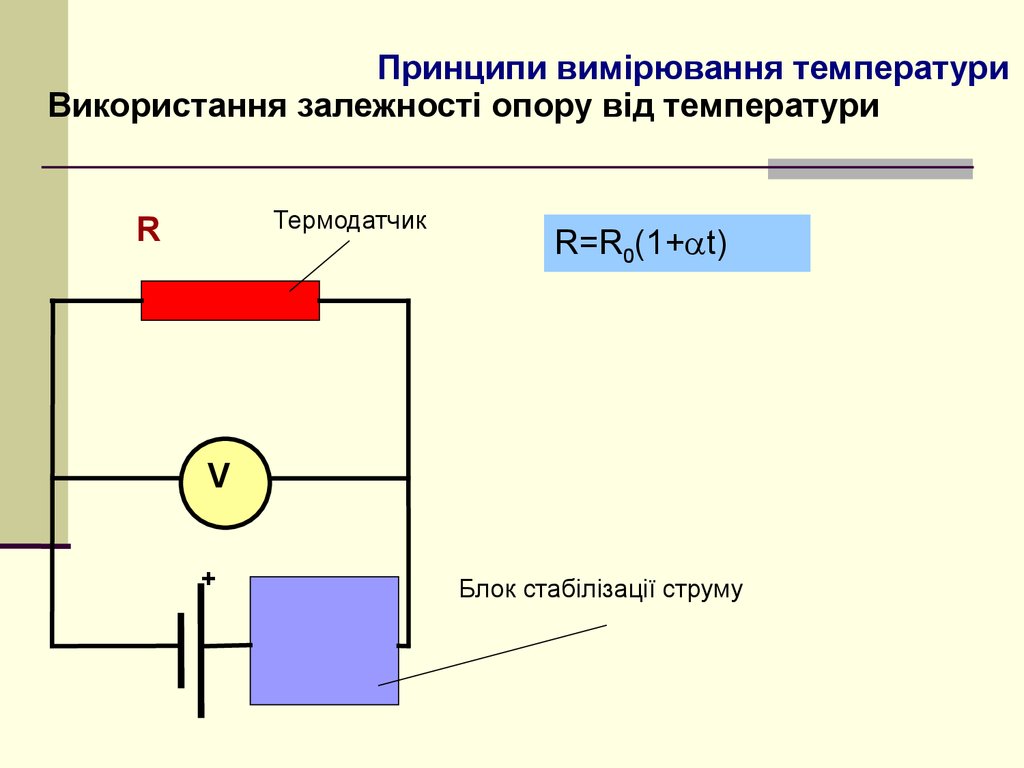
5. Принципи вимірювання температури
Використання залежності опору від температуриТермодатчик
R
R=R0(1+ t)
V
+
Блок стабілізації струму
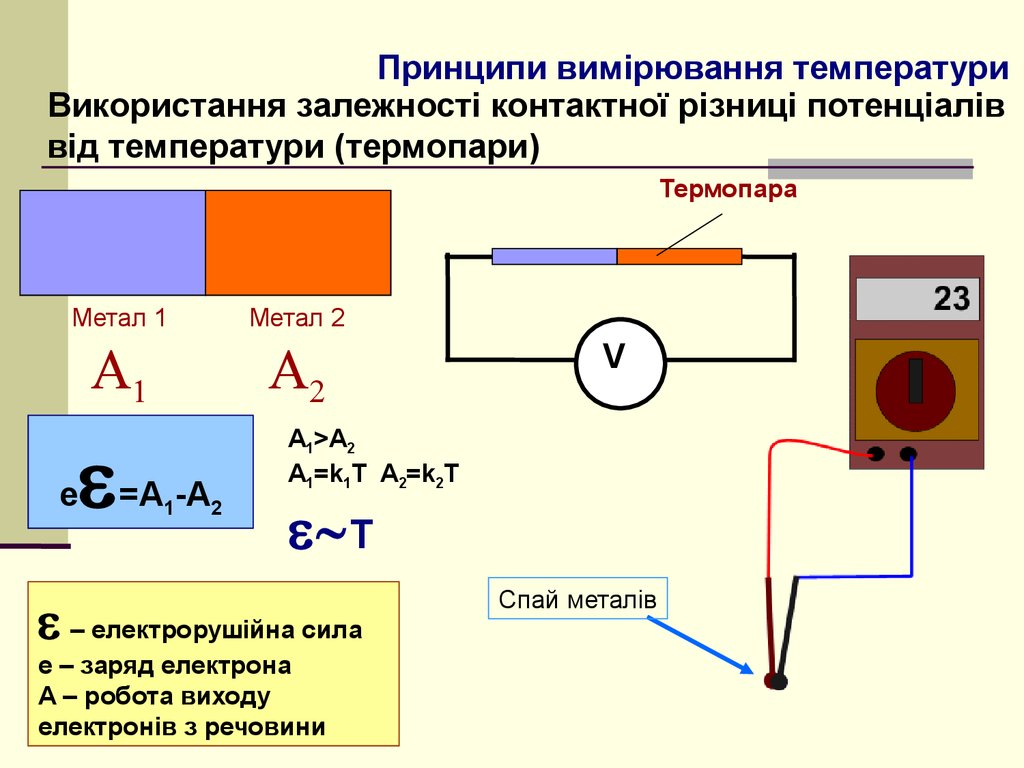
6. Принципи вимірювання температури
Використання залежності контактної різниці потенціаліввід температури (термопари)
Термопара
Метал 1
e
=A1-A2
Метал 2
V
A1>A2
A1=k1T A2=k2T
T
– електрорушійна сила
e – заряд електрона
A – робота виходу
електронів з речовини
Спай металів
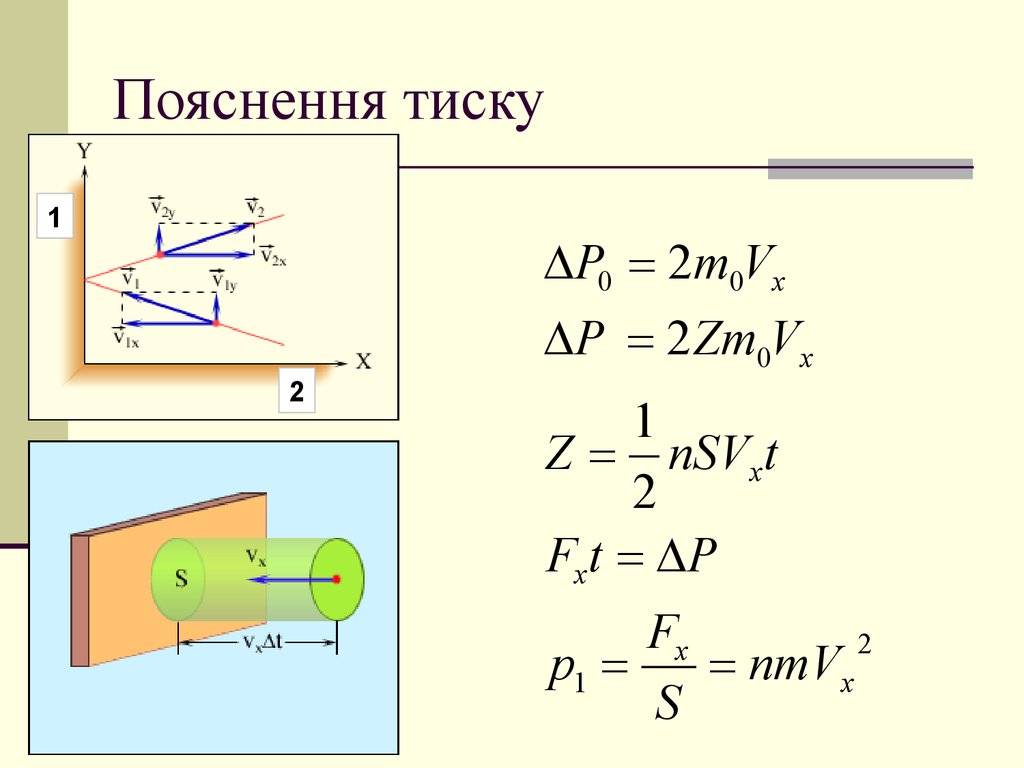
7. Пояснення тиску
1P0 2m0Vx
P 2 Zm0Vx
2
1
Z nSVx t
2
Fx t P
Fx
2
p1
nmVx
S
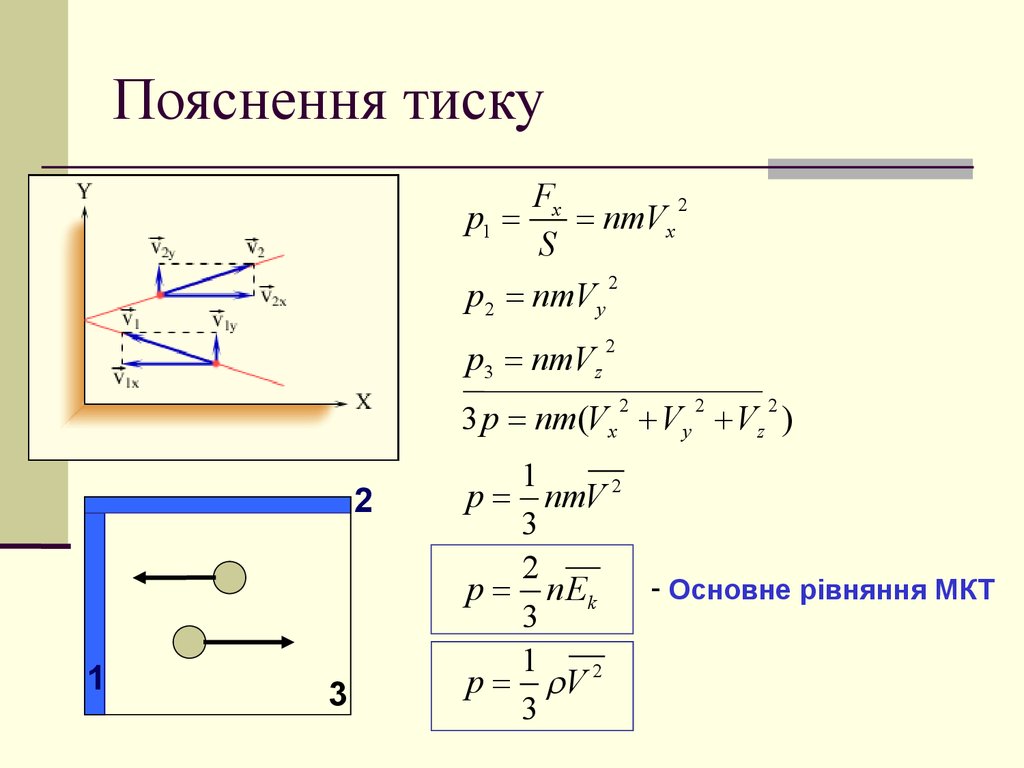
8. Пояснення тиску
Fx2
p1
nmVx
S
2
p2 nmV y
p3 nmVz
2
2
2
2
3 p nm(Vx V y Vz )
2
1
3
1
p nmV 2
3
2
- Основне рівняння МКТ
p n Ek
3
1
p V 2
3
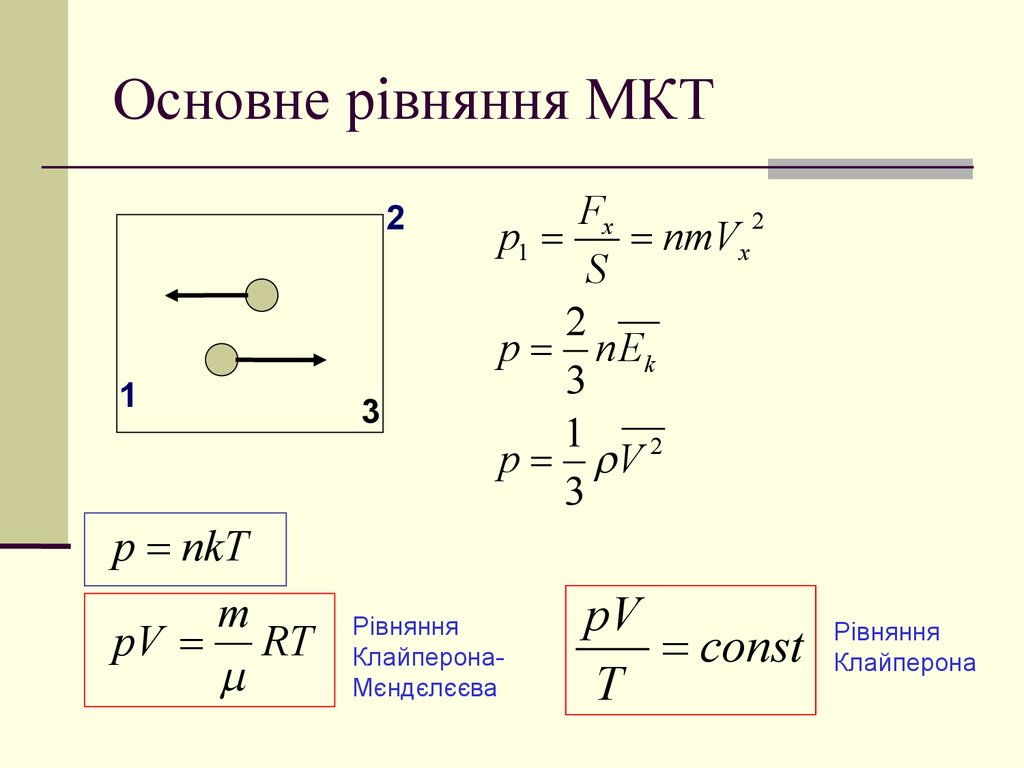
9. Основне рівняння МКТ
21
p nkT
m
pV RT
3
Fx
2
p1
nmVx
S
2
p n Ek
3
1
2
p V
3
Рівняння
КлайперонаМєндєлєєва
pV
const
T
Рівняння
Клайперона
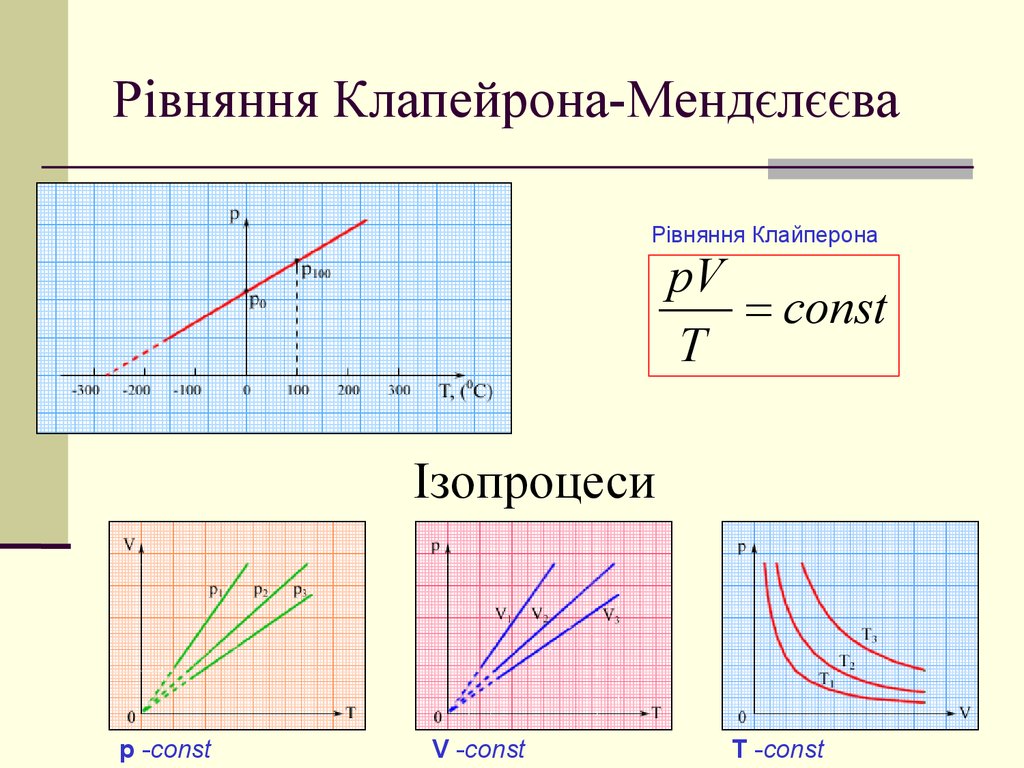
10. Рівняння Клапейрона-Мендєлєєва
Рівняння КлайперонаpV
const
T
Ізопроцеси
p -const
V -const
T -const
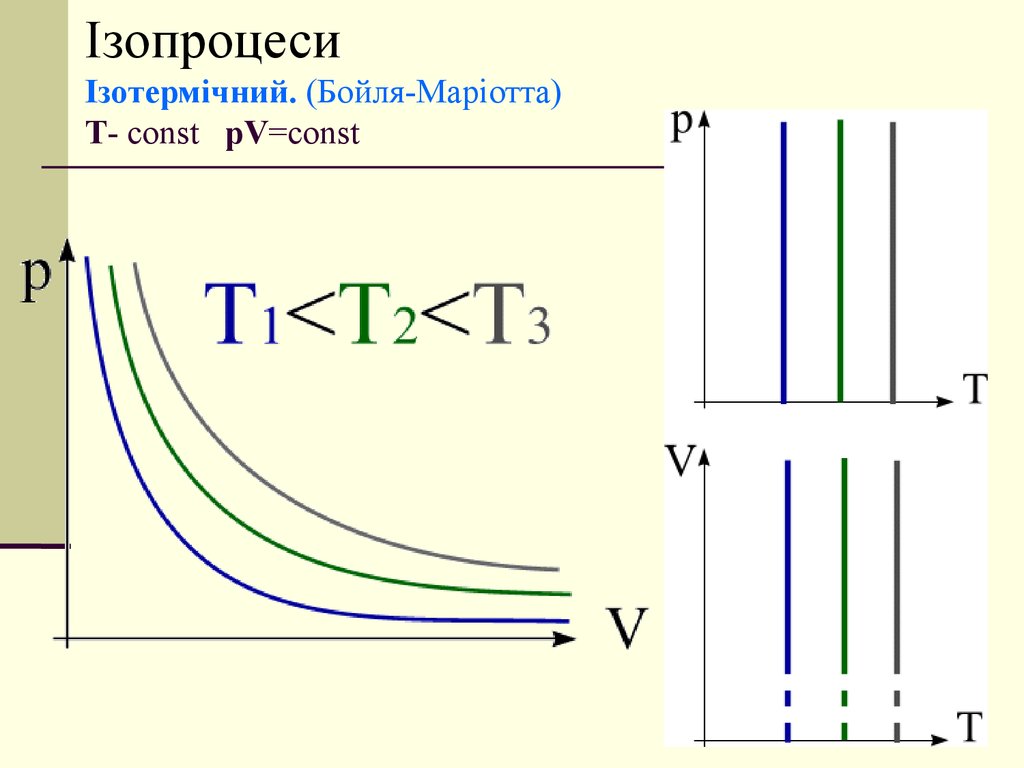
11. Ізопроцеси Ізотермічний. (Бойля-Маріотта) T- const pV=const
12.
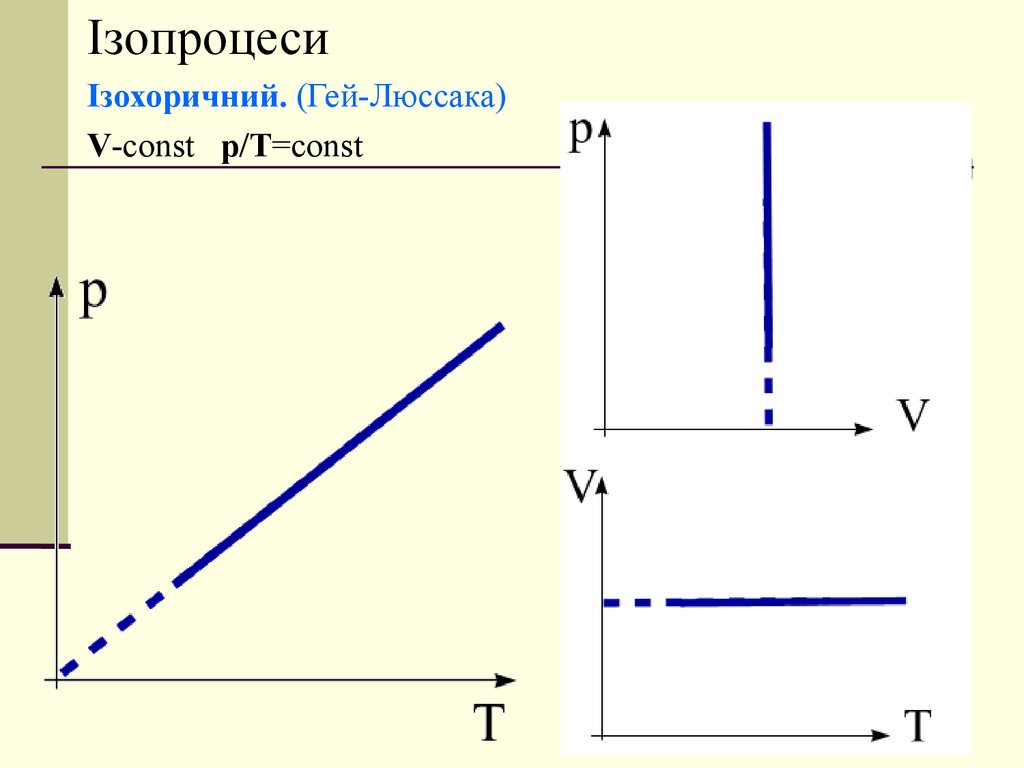
ІзопроцесиІзохоричний. (Гей-Люссака)
V-const p/T=const
13.
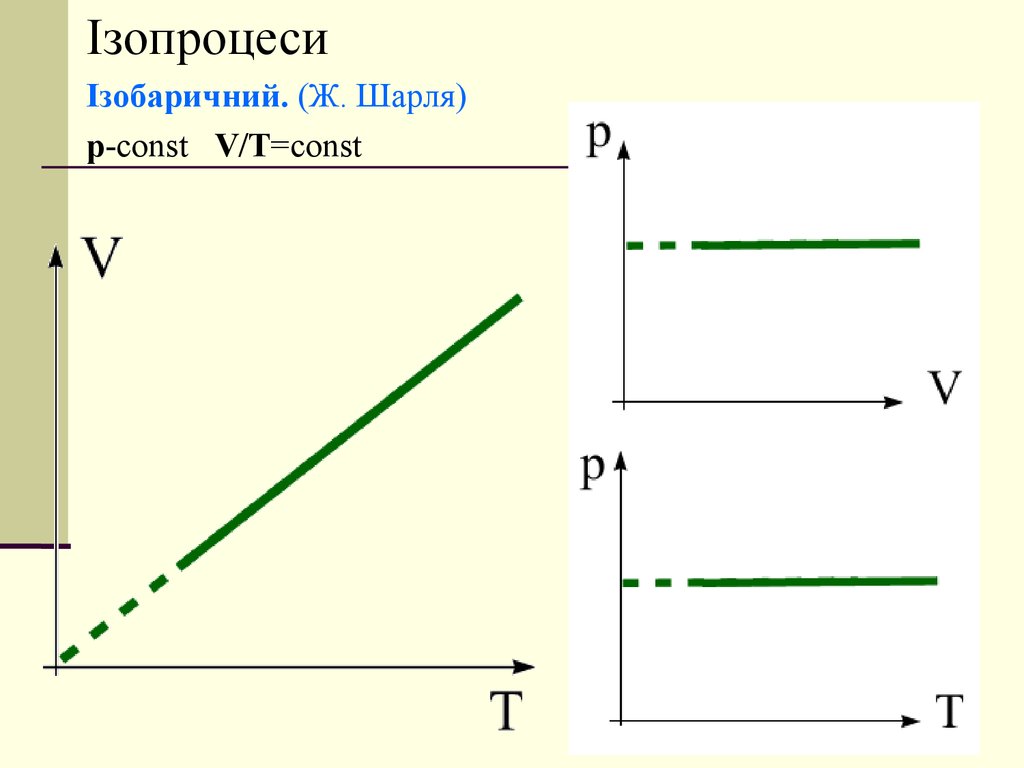
ІзопроцесиІзобаричний. (Ж. Шарля)
p-const V/T=const
14. Реальні гази
Ідеальний газ:рівняння
Клапейрона-Мендєлєєва
Рівняння
Ван-дер-Ваальса
(1873)
m
pV RT
( p a 2 )(V b) RT
V
a
( p 2 )(V b) RT
V
2
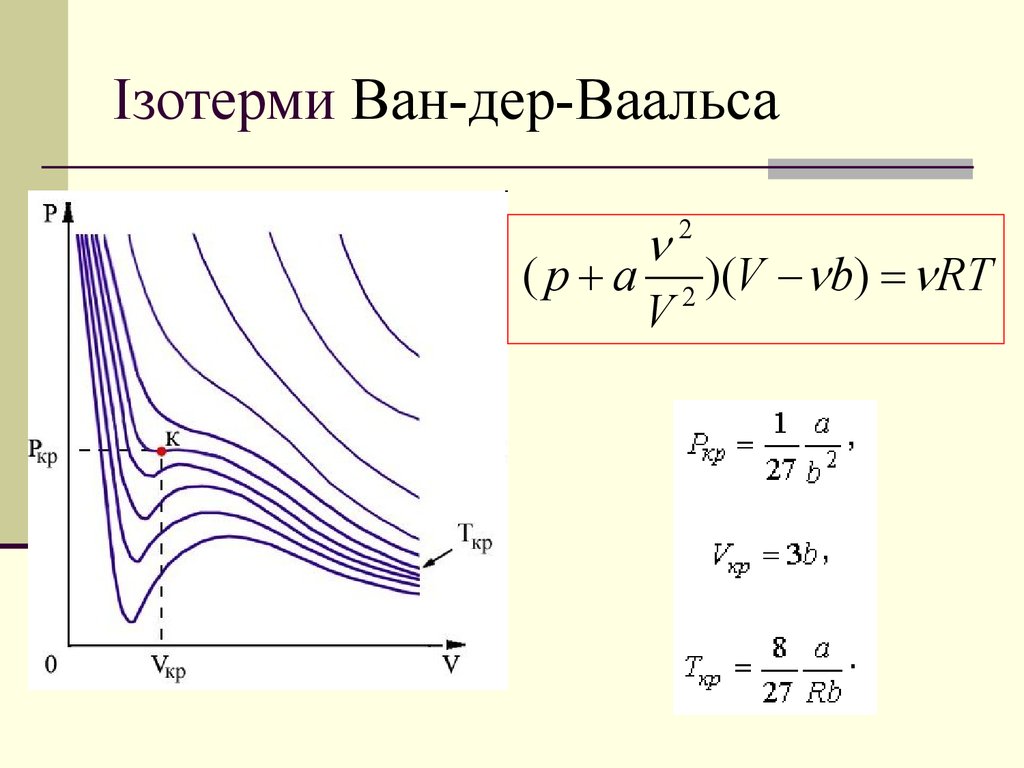
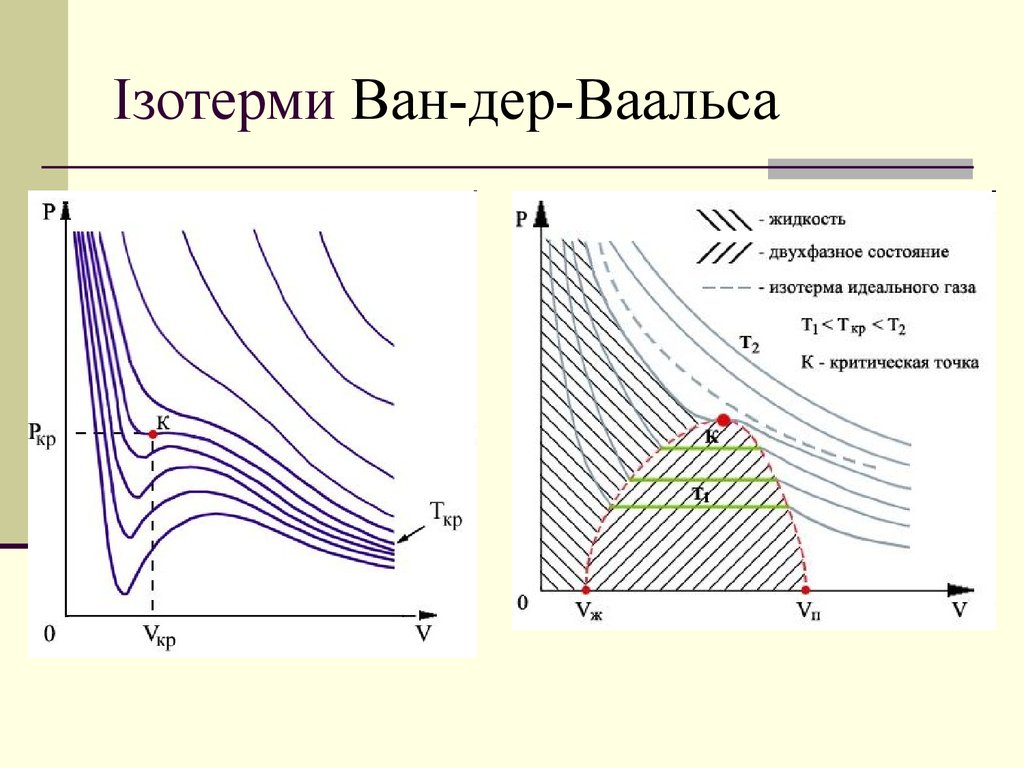
15. Ізотерми Ван-дер-Ваальса
( p a 2 )(V b) RTV
2
2
( p a 2 )(V b) RT
V
16. Ізотерми Ван-дер-Ваальса
2( p a 2 )(V b) RT
V
17. Термодинаміка
Внутрішня енергія тіла - сума всіх кінетичних та потенціальних енергійвзаємодії між собою молекул тіла.
Температура - фізична величина, що є мірою внутрішньої енергії тіла.
Змінити внутрішню енергію тіла можна:
•виконанням над тілом роботи;
•теплопередачею.
Кількість теплоти – енергія, яка передається тілу за допомогою
теплопередачі.
Види теплопередачі:
•теплопровідність: передача внутрішньої енергії від більш нагрітих
ділянок тіла до менш нагрітих за рахунок співударянь молекул речовини;
•конвекція: перемішування теплих та холодних шарів рідини або газу за
рахунок різниці їх густин;
•випромінювання: передача енергії за допомогою електромагнітних
хвиль (світла, зокрема).
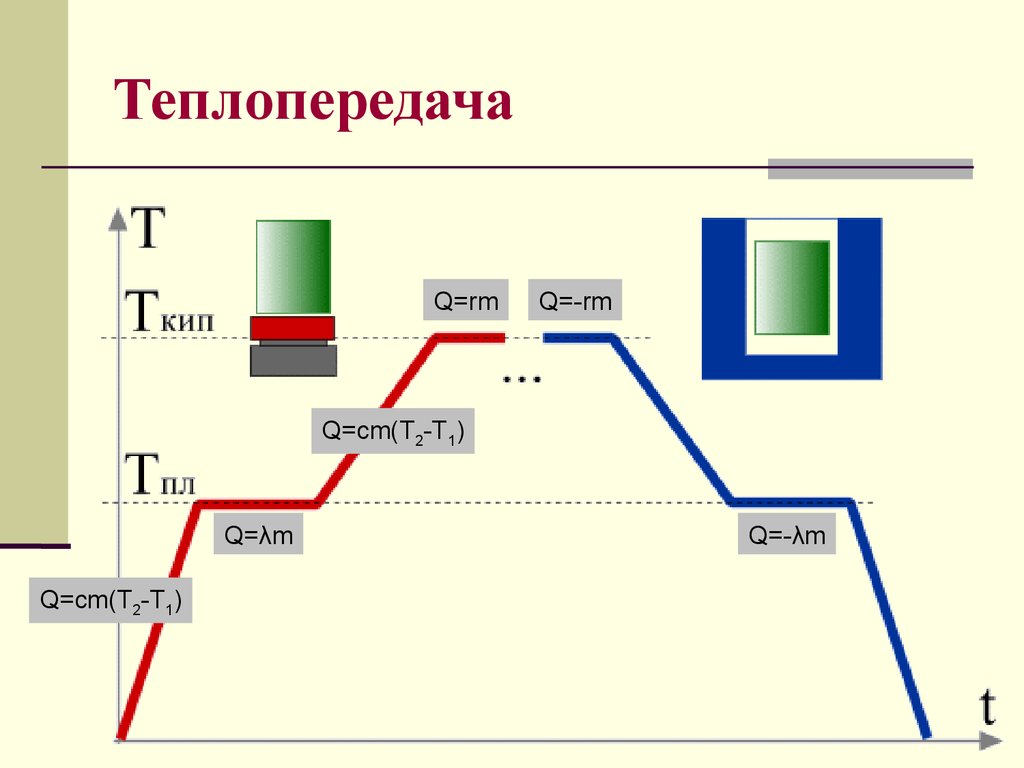
18. Теплопередача
Q=rmQ=-rm
Q=cm(T2-T1)
Q=λm
Q=cm(T2-T1)
Q=-λm
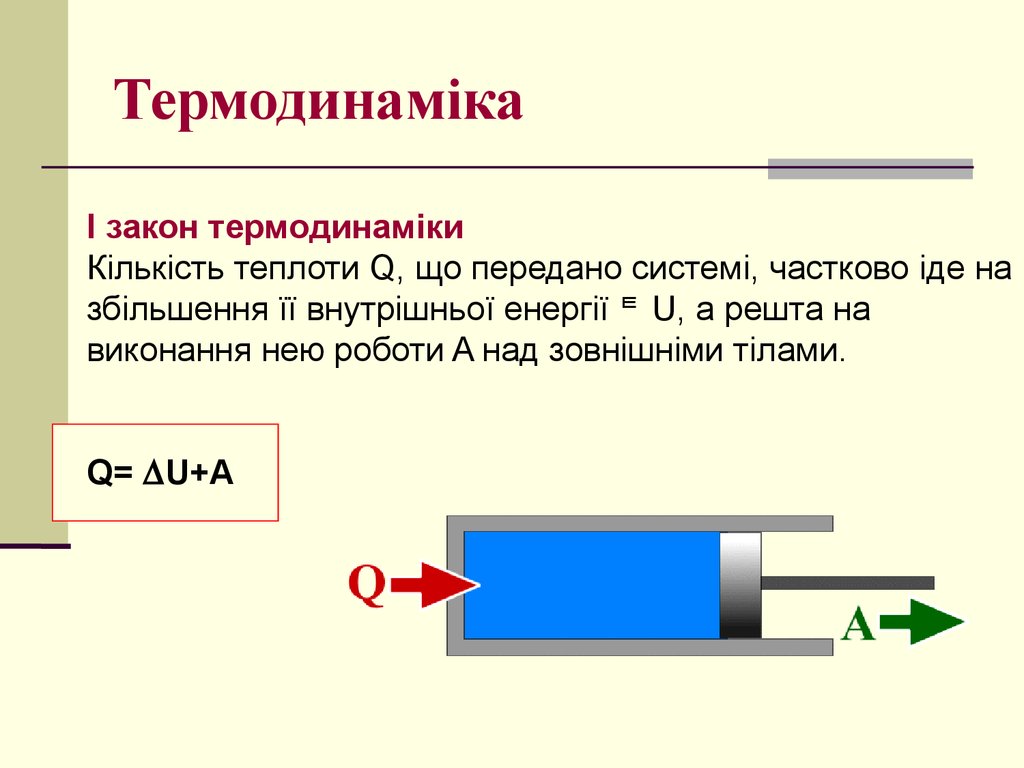
19. Термодинаміка
I закон термодинамікиКількість теплоти Q, що передано системі, частково іде на
збільшення її внутрішньої енергії U, а решта на
виконання нею роботи A над зовнішніми тілами.
Q= U+A
20. Внутрішня енергія
iU RT
2
і - найменше число незалежних координат, що визначають
положення та конфігурацію молекули в просторі.
одноатомний газ: i=3
двоатомний газ: i=5
Теорема про рівномірний розподіл енергії за ступенями вільності:
Якщо система перебуває у тепловій рівновазі при температурі Т, то середня
кінетична енергія молекули рівномірно розподілена між всіма ступенями вільності і
дорівнює:
1
kT
2
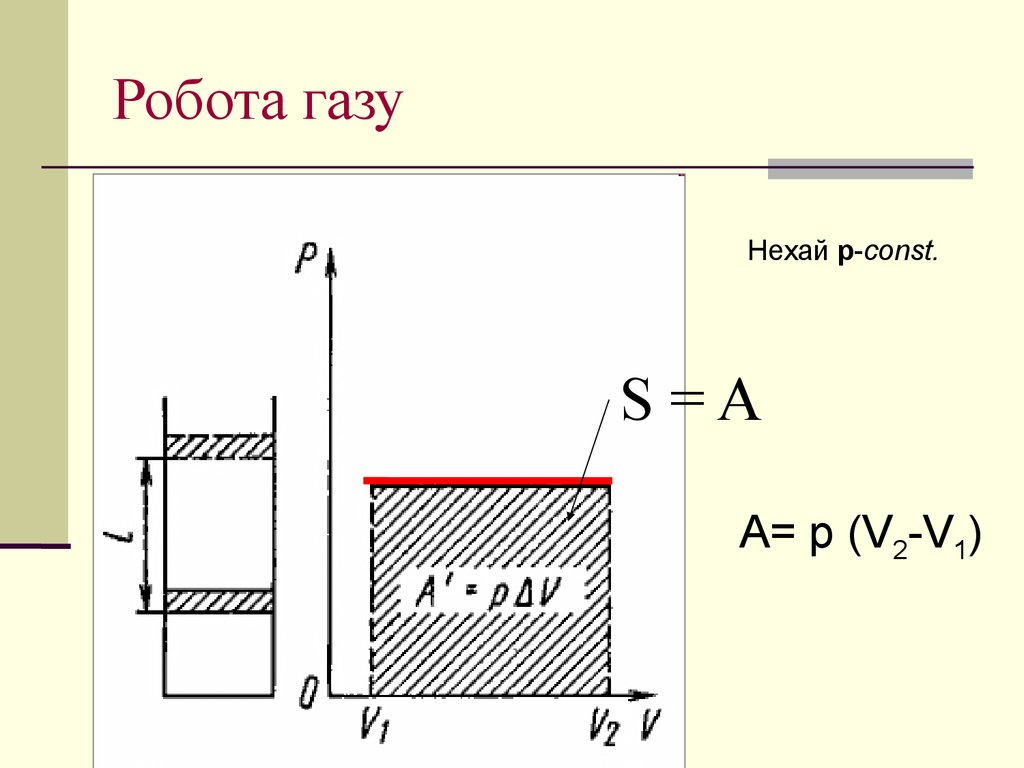
21. Робота газу
Нехай р-const.S=A
A= p (V2-V1)
22. Термодинаміка
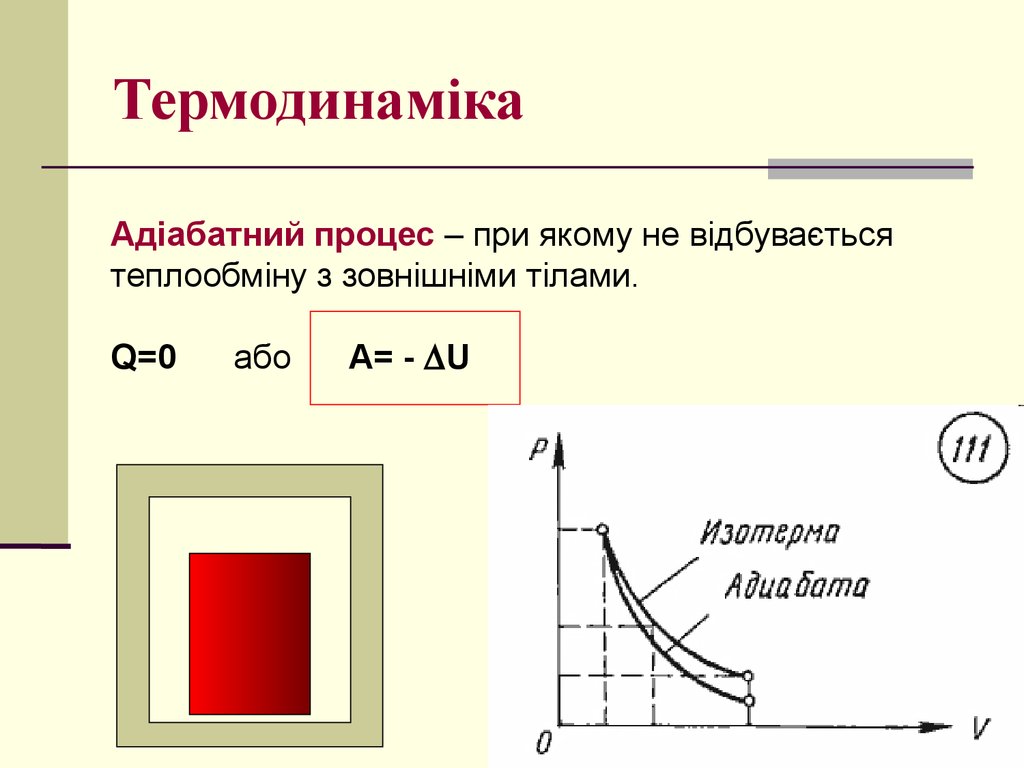
Адіабатний процес – при якому не відбуваєтьсятеплообміну з зовнішніми тілами.
Q=0
або
A= - U
23. Термодинаміка
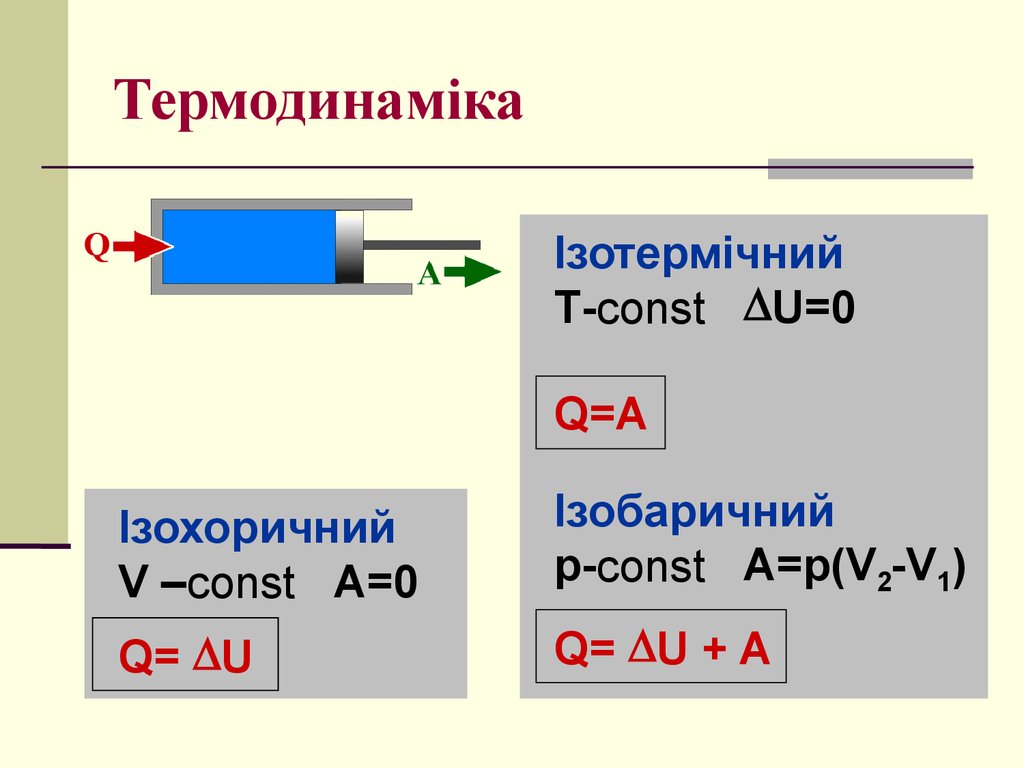
ІзотермічнийT-const U=0
Q=A
Ізохоричний
V –const A=0
Ізобаричний
p-const A=p(V2-V1)
Q= U
Q= U + A
24. Теплоємність газів
Q C (T2 T1 )p const , Q U p V
V const , Q U
C p Cv R
- співвідношення Майєра:
25. Термодинаміка
Процес наз. оборотним, якщо він допускаєможливіість повернення системи до початкового стану
без будь-яких змін у навколишньому середовищі
Необоротні процеси:
•розширення газу у вакуум
•перехід при дії сили тертя мех. енергії у внутрішню
26. Термодинаміка
II закон термодинамікиПроцес, при якому теплота передається від менш
нагрітих тіл до більш нагрітих без виконання роботи
ззовні – неможливий.
Клаузиус Рудольф: 1850
27. II закон термодинаміки
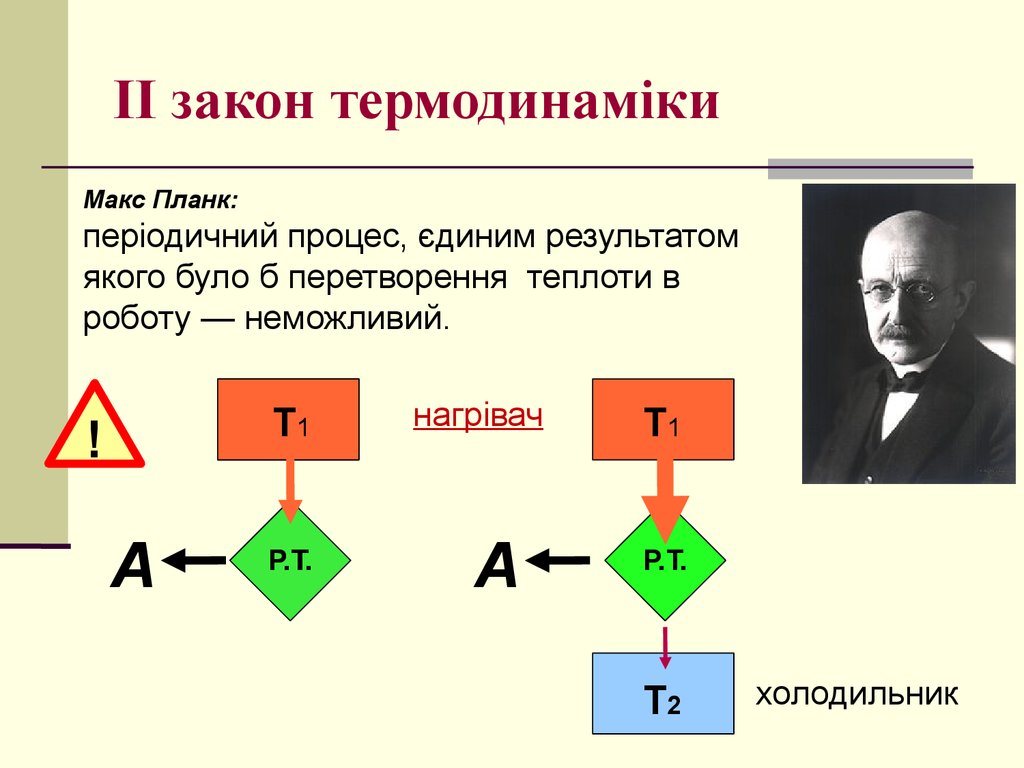
Макс Планк:періодичний процес, єдиним результатом
якого було б перетворення теплоти в
роботу — неможливий.
Т1
!
А
Р.Т.
нагрівач
А
Т1
Р.Т.
Т2
холодильник
28. II закон термодинаміки
Уільям Тоомсон, лорд КеольвінНеможливо побудувати теплову машину,
яка б виконувала роботу за рахунок
внутрішньої енергії найбільш холодного тіла
в системі.
// Вічний двигун 2-го роду - неможливий
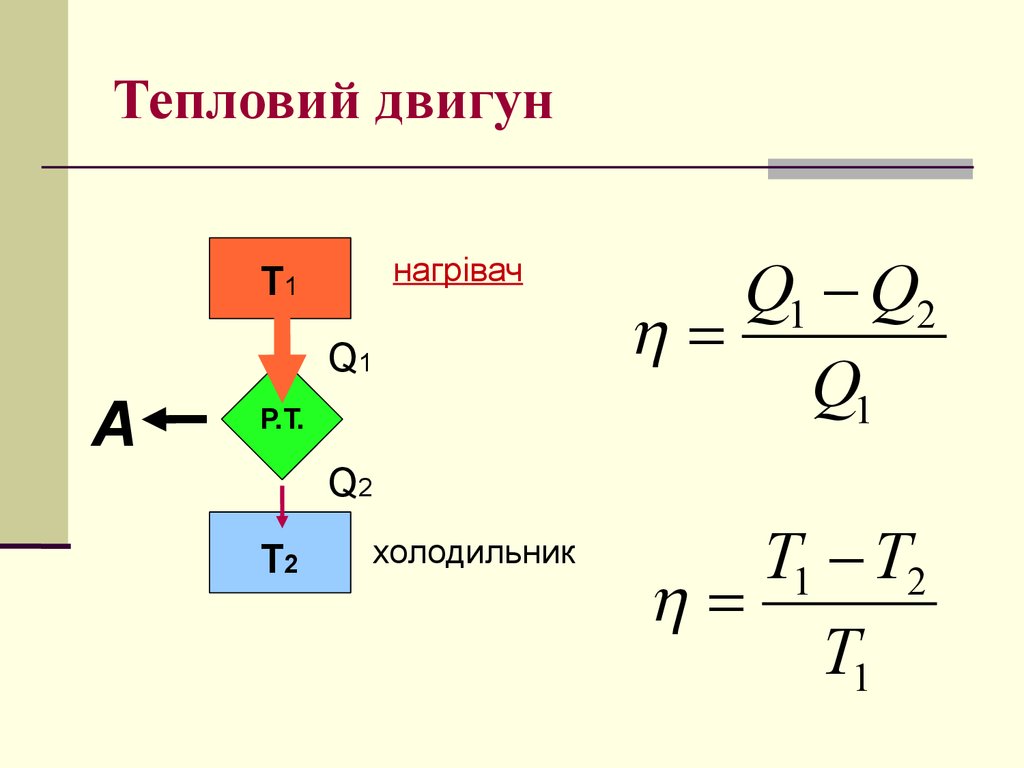
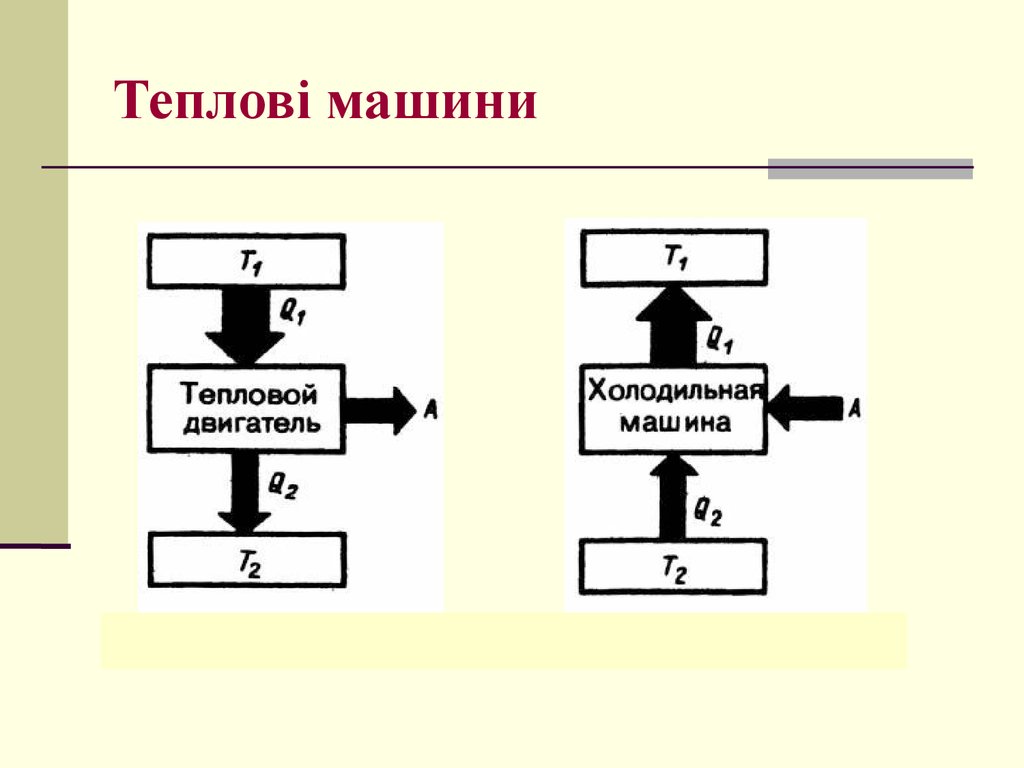
29. Тепловий двигун
нагрівачТ1
Q1
А
Р.Т.
Q1 Q2
Q1
Q2
Т2
холодильник
T1 T2
T1
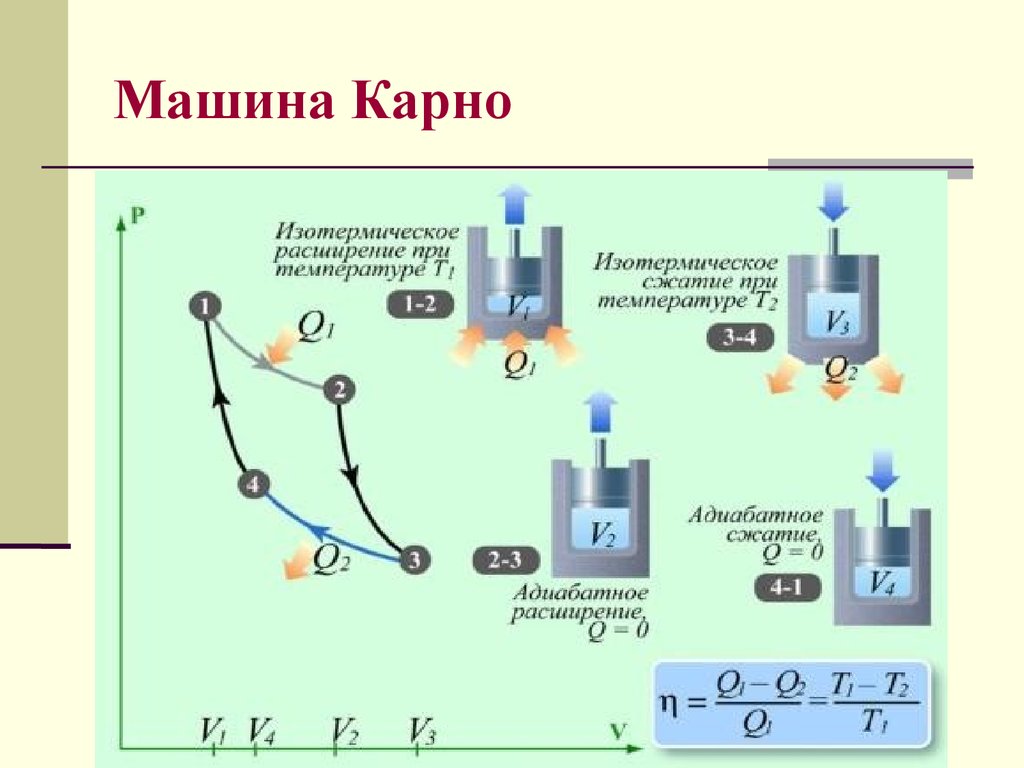
30. Машина Карно
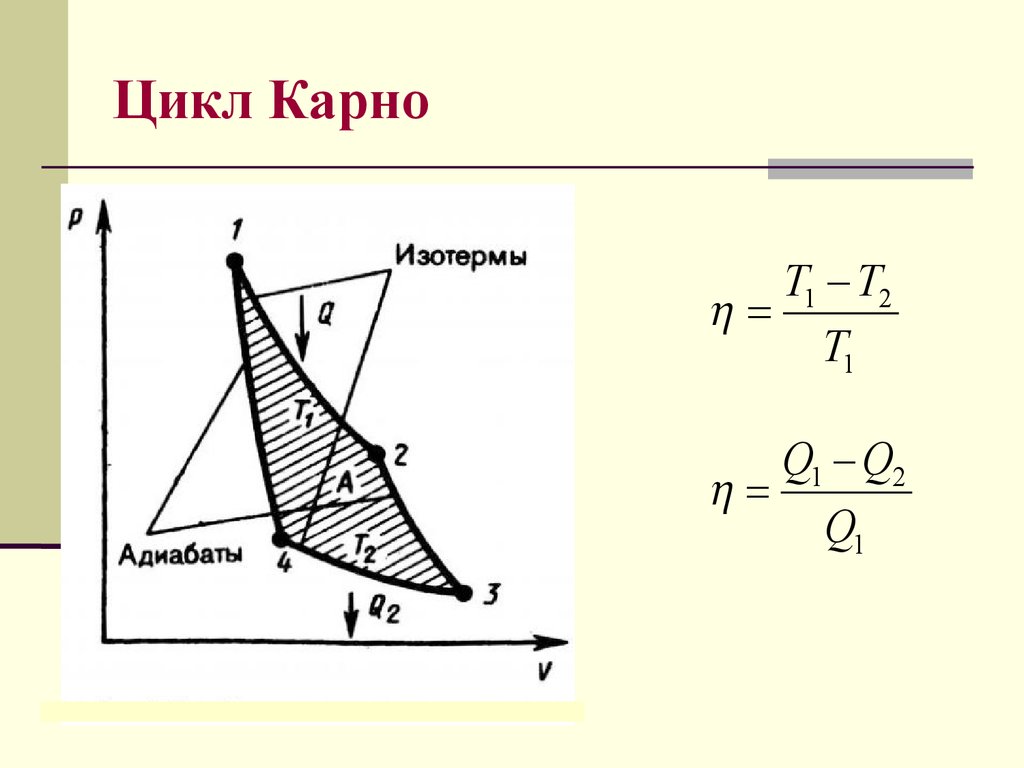
31. Цикл Карно
T1 T2T1
Q1 Q2
Q1










 physics
physics








