Similar presentations:
Термодинаміка. Адіабатний процес. Рівняння Пуассона
1. Термодинаміка
2. План лекції
Адіабатний процес. Рівняння Пуассона.
Оборотні і необоротні процеси. Коловий процес (цикл).
Теплові двигуни і холодильні машини.
Цикл Карно та його коефіцієнт корисної дії для
ідеального газу.
• Ентропія і її властивості.
• Другий закон термодинаміки. Статистичний зміст
другого закону термодинаміки.
• Теорема Нернста (третій закон термодинаміки).
3.
Адіабатним називається процес, який протікає безтеплообміну dQ 0 із зовнішнім середовищем
Рівняння Маєра:
Сp
СV
С p СV R
- показник Пуассона
Сp
R
1
СV
СV
R
1
СV
Перший закон термодинаміки:
i m
m
dQ
RdT pdV CV
dT pdV 0
2M
M
m
1
p RT
M
V
з рівняння Мендєлєєва – Клапейрона
3
4.
mm RT
RT
СV dT
dV 0 СV dT
dV 0 : TCV
M
M V
V
dT R dV
0
T CV V
ln T
або
R
ln V const
СV
R
d ln T
ln V 0
СV
ln T 1 ln V const ,
ln T ln V 1 const ln T V 1 const T V 1 const
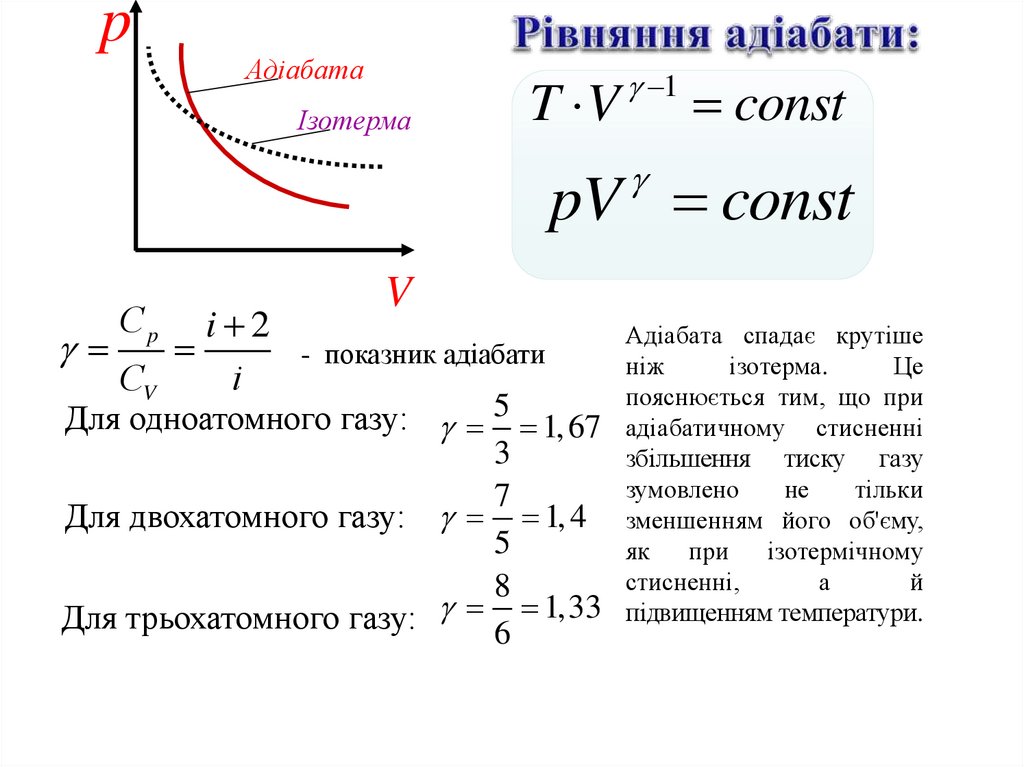
T V 1 const - рівняння адіабати
M pV
З рівняння Менделєєва Клапейрона:
T
m R
M pV
mRconst
1
1
V
const pV V
pV const
m R
M
5.
pАдіабата
Ізотерма
T V
1
const
pV const
Сp
i 2
СV
i
V
- показник адіабати
Для одноатомного газу: 5 1, 67
3
7
Для двохатомного газу: 1, 4
5
8
Для трьохатомного газу: 6 1,33
Адіабата спадає крутіше
ніж
ізотерма.
Це
пояснюється тим, що при
адіабатичному стисненні
збільшення тиску газу
зумовлено
не
тільки
зменшенням його об'єму,
як
при ізотермічному
стисненні,
а
й
підвищенням температури.
6. Перший і другий закони термодинаміки
Інше формулювання першого законутермодинаміки: неможливо створення вічного
двигуна першого роду, тобто двигуна в якому
вся енергія перетворювалася б на роботу.
Якщо перший закон термодинаміки – це одна з форм запису закону
збереження енергії, то другий закон термодинаміки встановлює
напрямок перебігу і характер процесів, що відбуваються у природі.
7.
У термодинаміці важливе значення мають такі процеси, коли термодинамічнасистема після проходження ряду станів повертається до початкового стану
(P1,V1,T1) (P2,V2,T2). Такі процеси називаються коловими процесами або
циклами.
Колові процеси, при яких виконується корисна робота теплового двигуна,
називають прямими, а ті, при яких відбувається охолодження робочих тіл до
температур, нижчих за температуру навколишнього середовища, - зворотними.
За зворотним циклом працює холодильна машина.
Процес називається оборотним, якщо він допускає можливість повернення
системи до початкового стану без будь-яких змін у навколишньому середовищі
1. В кожному напрямку система проходить через одні і ті ж проміжні стани в
двох зворотних напрямках
2. Система повертається в початковий стан
Якщо не виконується один з пунктів - процес необоротний
Необоротні процеси:
•розширення газу у вакуум
•перехід при дії сили тертя мех. енергії у внутрішню
•дифузія
•теплообмін
8.
II закон термодинамікиПроцес, при якому теплота передається від менш
нагрітих тіл до більш нагрітих без виконання роботи
ззовні – неможливий.
Клаузиус Рудольф: 1850
Періодичний процес, єдиним результатом якого було б
перетворення теплоти в роботу — неможливий.
Макс Планк
Неможливо побудувати теплову машину, яка б виконувала
роботу за рахунок внутрішньої енергії найбільш холодного
тіла в системі. Вічний двигун 2-го роду – неможливий.
Уільям То́мсон, лорд Ке́львін
9.
Тепловий двигун – машина, що перетворює внутрішню енергію палива на
механічну енергію
Три основних частини двигуна:
1 нагрівач (Т1) – джерело внутрішньої енергії
2 робоче тіло (газ або пара), що виконує механічну роботу за рахунок внутрішньої
енергії, отриманої від нагрівача
3 холодильник (Т2 менше Т1) – забезпечує природний процес передачі теплоти від
більш нагрітого тіла до холоднішого, чим здійснює компенсацію процесу
перетворення теплової енергії на механічну.
нагрівач
А
Т1
Р.Т.
Т2
холодильник
10.
Прямий цикл Карно складається з двох ізотерм: 1 2 затемператури Т1 і 3 4 за температури Т2 та двох адіабат:
2 3 і 4 1.
В ізотермічному процесі 1 2 робоче тіло
знаходиться в прямому контакті з нагрівачем за
температури Т1 та забирає від нього кількість теплоти
Q1. В точці 2 припиняється тепловий контакт з
нагрівачем, робоче тіло ізолюється і в адіабатичному
розширенні робочого тіла продовжує виконуватись
робота за рахунок запасеної внутрішньої енергії
робочого тіла. В точці 3 робоче тіло знову приводиться в
прямий тепловий контакт але уже з холодильником за
температури Т2. В ізотермічному процесі 3 4
холодильник відбирає від робочого тіла кількість
теплоти Q2. В точці 4 припиняється тепловий контакт з
холодильником, робоче тіло знову ізолюється і в
адіабатичному процесі 4 1 виконується робота
стискування робочого тіла. При цьому температура
робочого тіла зростає і в точці 1 робоче тіло знову
матиме температуру Т1. Цикл закінчено, робоче тіло
знову ізолюється і приводиться в контакт з нагрівачем –
цикл може повторюватись.
p
P
1
Q1
1
2
P
T1
2
P
4
4
3 T2
P
3
V1 V4 Q2 V2
A=Q1-Q2
V3
V
11.
ККД теплової машини• Термодинамічний ККД
теплового двигуна
Q1 Q2
Q1
• ККД ідеальної теплової
машини
T1 T2
T1
нагрівач
Т1
Q1
А
Р.Т.
Q2
Т2
холодильник
12.
Цикл ОттоЦикл Дизеля
Q1
p
p
3
3
2
Q1
2
4
4
1
Q2
V
1-2 адіабатний стиск робочого тіла
2-3 ізохорне підведення теплоти
3-4 адіабатне розширення робочого тіла
4-1 ізохорне відведення теплоти від
робочого тіла до холодильника
1
Q2
V
1-2 адіабатний стиск робочого тіла
2-3 ізобарне підведення теплоти
3-4 адіабатне розширення робочого
тіла
4-1 ізохорне відведення теплоти від
робочого тіла до холодильника
13.
Теплові машини14.
Стан макроскопічної системи (тіла)• Макростани – задаються інтегральними
параметрами (P, V, T, U).
• Мікростани – стан макросистеми, описаний
настільки детально, що враховує стан кожної
молекули.
• Число мікростанів, що відповідає певному
макростану (число мікроспособів, якими може
бути
представлений
макростан)
–
статистична
вага,
або
термодинамічна
вірогідність .
15.
ЕнтропіяХарактеристика макростану газу –
кількість молекул в лівій /правій
частині
2
3
1
Стан
(кількість
молекул
справазліва)
0
4
1
3
4
n
N-n
2
2
Ентропія – функція стану системи 3
4
1
0
Способи
реалізації
стану (№
молекул)
1
2
3
4
1,2
1,3
1,4
2,3
2,4
3,4
Число
способів
реалізації
стану
1,2,3,4 1
2,3,4
4
1,3,4
1,2,4
1,2,3
3,4
6
2,4
2,3
1,4
1,3
1,2
4
1
16.
Розрахунок зміни ентропії в різних процесахdS
1) T=const
Q dU PdV
dS
Q
T
(2)
dU PdV
T
dU T 0 ,
(3)
nRT
P
V
(4)
dV
dS nR
nRd ln V
V
2
2
1
1
(1)
(5)
dS nR d ln V
V2
P1
S nR ln
nR ln
,
V1
P2
P1V1 P2V2
(6)
17.
Розрахунок зміни ентропії в різних процесахdS
2) V=const
QV dU CV dT
dS
T
T
T
dU CV dT
2
2
dS
1
а) СV=const
S CV ln
S
1
C P dT
1 T
2
а) СР=const
T2
T1
S C P ln
б) СV, СР= f (T) ,
2
T
3) P=const
QP dH C P dT
dS
T
T
T
dH C P dT
CV dT
dS
1
1 T
2
Q
a bT cT
2
T
c T 2 dT
T2
T1
C = a + bT + cT2 + c T-2
T2
c 2
c 1
1
2
a ln b T2 T1 T2 T1 2 2
T1
2
2 T2 T 1
18.
Ентропія. Другий законтермодинаміки
Ентропія – міра безладу в системі
Ентропія ізольованої системи при
необоротньому процесі зростає
Ентропія системи в рівноважному
стані – максимальна.
Закон зростання ентропії
(ІІ закон термодинаміки)
оборотні процеси
Необоротні процеси
При абсолютному нулі Т=0
=1
Теорема Нернста (3-й закон термодинаміки) – неможливо досягти абсолютного
нуля температур
















 physics
physics








