Similar presentations:
Изомерия биоорганических соединений. Структура и функции биолекул
1.
ИЗОМЕРИЯ БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙСТРУКТУРА И ФУНКЦИИ БИОЛЕКУЛ. ЛЕКЦИЯ 6.
2.
План1.
2.
2
3.
Строение органических соединений3
4.
Строение органических соединений4
5.
1. Изомерия. Типы изомерии5
6.
1. Изомерия. Типы изомерииСтруктурная изомерия
6
7.
1. Изомерия. Типы изомерииСтруктурная изомерия
1. Изомерия углеродного скелета
Алкан состава С13Н28 имеет 802 изомера.
Изомеризация углеродного скелета и превращение нелинейного соединения в
линейное возможно в весьма ограниченном круге биохимических реакций, в
которых обязательно участвует витамин В 12.
Важным биохимическим превращением
является реакция изомеризации
активной формы ( тиоэфира ) метилмалоновой кислоты
в активную форму
сукцинилКоА (тиоэфир янтарной кислоты ) - макроэргическое соединение
СН 3 — СН –СООН
|
СО SKoA
метилмалонил-Коэнзим А
7
—>
НООС-СН2 –СН2 -СО SKoA
сукцинил-Коэнзим А
8.
1. Изомерия. Типы изомерииСтруктурная изомерия
2. Изомерия положения
Этот вид изомерии важен для понимания свойств биоорганических соединений, создания
лекарственных препаратов, которые могут выполнять роль синергистов или антагонистов
по отношению к природным соединениям.
Синергисты - действуют в одном направлении( например, возмещают недостаток природного
биологически активного соединения ), активируют биологические процессы.
Антагонисты (или антиметаболиты) – действуют в противоположном направлении, тормозят
биологические процессы.
В составе белка находятся только природные аминокислот, у которых аминогруппа находится
в положении 2 (так называемое α -положение).
а – положение
СН3 - СН - COOH
|
NH2
2-аминопропановая кислота
входит в состав белка
( -аланин )
СН 2 - СН 2- COOH
|
NH2
3-аминопропановая кислота
не входит в состав белка
( ß -аланин)
Природная ненасыщенная олеиновая кислота С17Н35 СООН содержит двойную связь
между атомами 9,10.
Ее изомеры, отличающиеся расположением двойной связи,
не
образуются в природных условиях, in vivo .
8
9.
1. Изомерия. Типы изомерииСтруктурная изомерия. Таутомерия
4. Динамическая изомерия – таутомерия - обратимая изомерия, при которой
изомеры отличаются функциональными группами, легко переходящими друг в
друга.
Наиболее распространенным видом таутомерии явлется прототропная таутомерия, при
которой превращение осуществляется в результате перехода атома водорода ( в виде
протона ) внутри молекулы.
Для понимания направления биохимических реакций, строения биологически активных
веществ (например, нуклеиновых кислот, моносахаров) важны кето-енольная и лактимлактамная таутомерия.
9
10.
1. Изомерия. Типы изомерииСтруктурная изомерия. Таутомерия
Кето-энольная таутомерия
Наиболее важное значение в биологических процессах имеет кето-енольная таутомерия
оксокислот: пировиноградной, щавелевоуксусной, ацетоуксусной.
3
СН3 —С —СООН
||
О
пируват (кето-форма)
2
1
СН2 = С — С=О
|
|
НО
ОН
пируват( енольная форма) -цепь сопряжения
охватывает всю молекулу, включая атом
кислорода карбоксильной группы до атома С3
3-оксобутановой ( ацетоуксусная) кислота может образовать две формы
( цепи сопряжения в енольных формах выделены выделены красным цветом)
СН3 —С — СН2 —С ООН
||
О
СН2 = С — СН2 —С ООН
|
ОН
менее устойчивая форма
короче цепь сопряжения
10
ацетоуксусная кислота
СН2 — С = СН —СООН
|
ОН
более устойчивая форма
длиннее цепь сопряжения
11.
1. Изомерия. Типы изомерииСтруктурная изомерия. Таутомерия
Кето-энольная таутомерия
Енольная форма пировиноградной кислоты в растительных и животных клетках образует
фосфорный эфир - фосфоенолпируват,
который является высокоэнергетическим
(макроэргическим) соединением. Энергия макроэргической связи в нем
выше по
сравнению с АТФ. Это соединение служит для образования АТФ, реакция относится к
необратимым.
СООН
|
+ АДФ —> АТФ + СН 3— С — СООН
C ~ ОРО3Н2
||
||
О пировиноградная кислота
СН2
фосфоенолпируват (~ обозначение макроэргической связи)
название значка «тильда»
11
12.
1. Изомерия. Типы изомерииСтруктурная изомерия. Таутомерия
Лактим-лактамная таутомерия
Соединение (обычно понятие применяется к циклическим системам) может существовать в
двух формах: лактимной и лактамной.
— С — NH —
||
О
лактамная форма
( атом Н связан с азотом,
как в аммиаке)
— С = N—
|
ОН
лактимная форма
( им- обозначает азот с двойной связью )
Образование лактимной формы связано с перемещением атома водорода из соседнего NНкислотного центра к более электроотрицательному атому кислорода.
12
13.
1. Изомерия. Типы изомерииСтруктурная изомерия. Таутомерия
Лактим-лактамная таутомерия
Для образования комплементарных пар азотистых оснований: аденин - тимин, гуанин –
цитозин соединения ( Г, Ц, Т ) должны иметь лактамное строение
O
NH 2
O
H3C
NH
N
H
Тимин
13
N
O
N
H
Цитозин
N
HN
O
H2N
N
Гуанин
N
H
14.
1. Изомерия. Типы изомерииПространственная изомерия
Пространственная
пространственным
связывания.
изомерия (стереоизомерия)
расположением атомов при
обусловлена различным
одинаковом порядке их
Все биологически активные классы природных соединений - аминокислоты, белки,
углеводы, гидроксикислоты,
липиды - имеют определенную пространственную
организацию. От нее зависит способность этих веществ связываться с рецепторами,
превращаться
в
биохимических
реакциях
с
участием
белков-ферментов,
транспортироваться через мембраны.
Различают 2 формы стереоизомерии
- геометрическая изомерия
- оптическая изомерия
14
15.
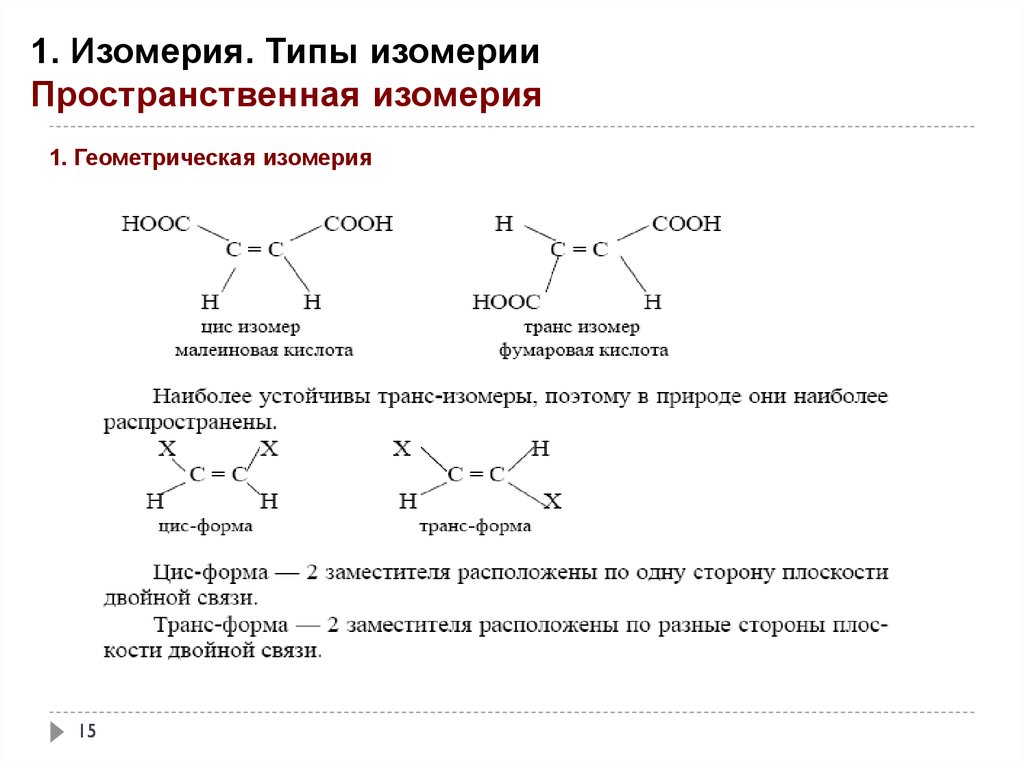
1. Изомерия. Типы изомерииПространственная изомерия
1. Геометрическая изомерия
15
16.
1. Изомерия. Типы изомерииПространственная изомерия
1. Геометрическая изомерия
Биологическая активность природных соединений и лекарственных препаратов зависит от их
пространственной конфигурации.
1. Полиненасыщенные кислоты – олеиновая, линолевая, линоленовая,
арахидоновая
присутствуют в составе липидов в цис-форме, которая является энергетически менее устойчивой,
Соединения
обладают дополнительным запасом энергии по сравнению с транс–изомерной
формой .
Под влиянием УФ-излучения, свободных радикалов ( кислорода, оксида NO) изменяется
пространственное строение , цис-форма
превращается в более устойчивую транс-форму,
коренным образом изменяется биологическая активность органической молекулы.
2. Из двух возможных изомеров бутендиовой кислоты в клетках растений и животных образуется
только транс-бутендиовая кислота (фумаровая) , а цис-изомер (малеиновая кислота) является
для человека и животных токсическим соединением.
HOOC
H
COOH
H
Малеиновая кислота ( цис )
16
H
HOOC
COOH
H
Фумаровая кислота ( транс)
17.
2. Конфигурация и конформация соединенийКонфигурация создается благодаря направленному расположению орбиталей валентных
электронов атомов.
Гибридизация sp3 , угол между связями 1090 28’ , тетраэдрическое направление связей.
Гибридизация sp2 , угол между связями 1200 , тригональное плоскостное направление
связей.
17
18.
2. Конфигурация и конформация соединений19.
2. Конфигурация и конформация соединений19
20.
2. Конфигурация и конформация соединений20
21.
2. Конфигурация и конформация соединений21
22.
2. Конфигурация и конформация соединений22
23.
3. Оптическая изомерия23
24.
3. Оптическая изомерияУсловием хиральности и образования оптических изомеров
является наличие в молекуле атомов углерода в sp3 гибридном состоянии, которые связаны с 4 различными
заместителями.
В этом
случае
молекула не обладает плоскостью
симметрии и она не совместима со своим зеркальным
отражением.
Такое
вещество обладает оптической
изомеры называются оптическими.
активностью,
Атом углерода, связанный с 4 различными заместителями
(обозначают С*), принято называть асимметричным,
оптически активным, хиральным.
А
|
В— С*— D
|
E
А
|
D — C*— В
|
E
зеркальная плоскость
24
оптические изомеры(энантиомеры)
в плоскостном изображении
( плоскостные проекции
Фишера)
25.
3. Оптическая изомерияЭнантиомеры
25
26.
3. Оптическая изомерияЭнантиомеры
Если в молекуле один хиральный атом, то два стереоизомера изомера всегда являются
энантиомерами.
Общее количество изомеров у молекулы, содержащей несколько асимметрических
атомов углерода, зависит от числа хиральных атомов( хиральных центров):
N = 2n
( N - общее количество изомеров, n – число хиральных атомов в молекуле)
26
27.
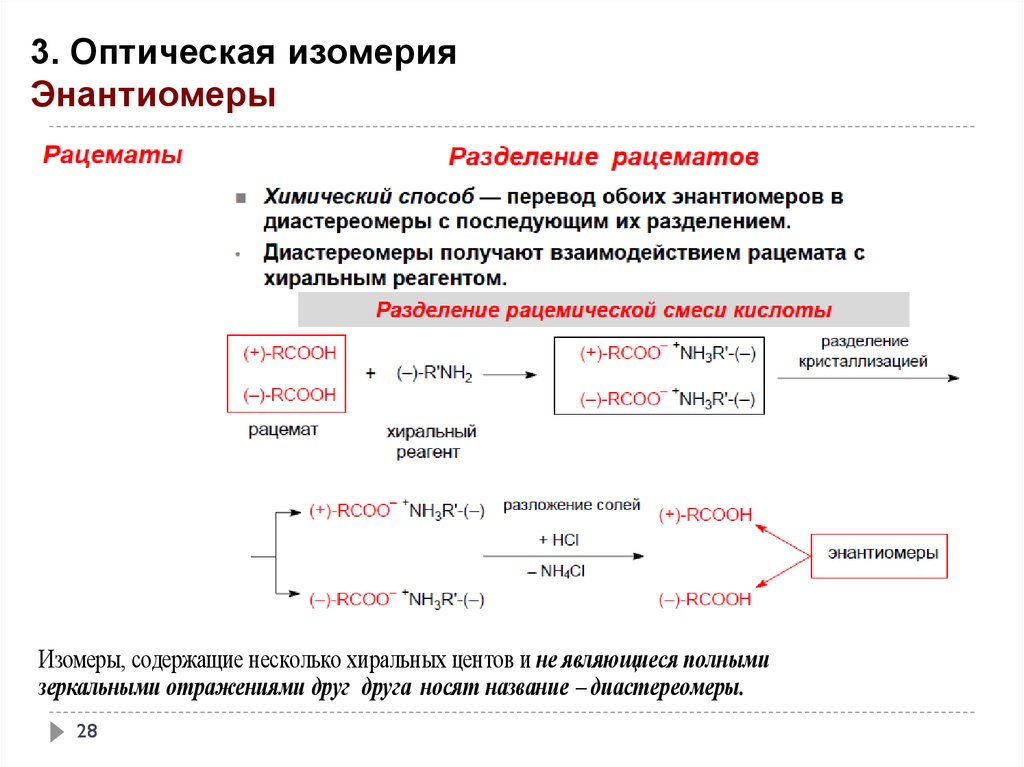
3. Оптическая изомерияЭнантиомеры
27
28.
3. Оптическая изомерияЭнантиомеры
Изомеры, содержащие несколько хиральных центов и не являющиеся полными
зеркальными отражениями друг друга носят название – диастереомеры.
28
29.
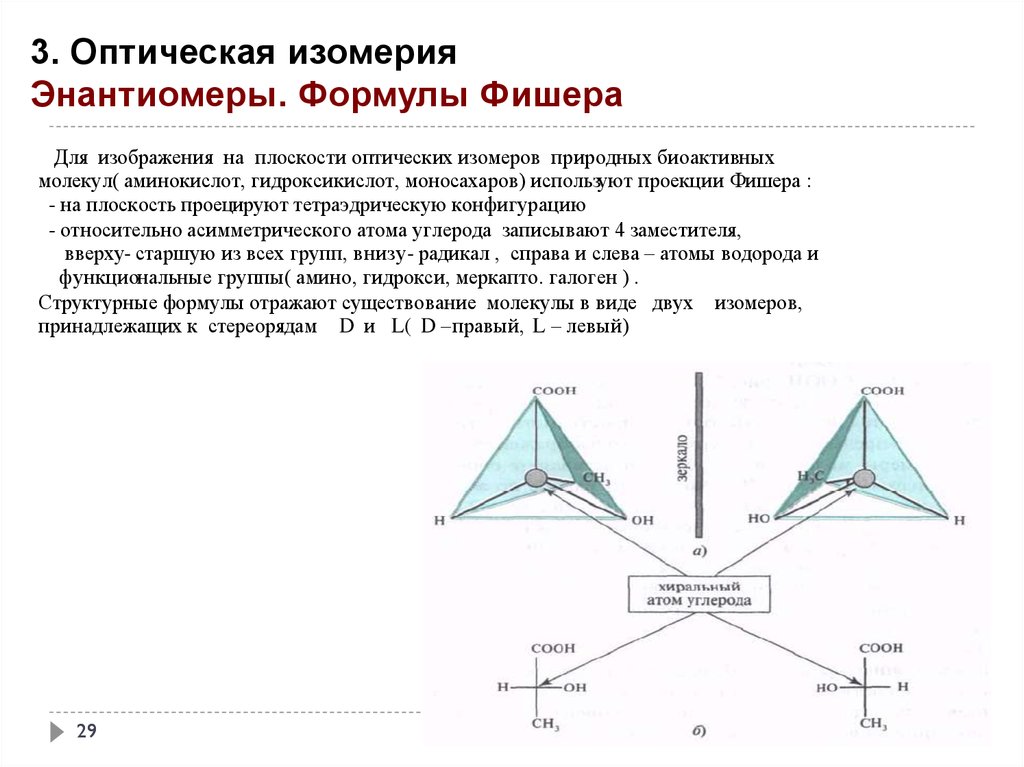
3. Оптическая изомерияЭнантиомеры. Формулы Фишера
Для изображения на плоскости оптических изомеров природных биоактивных
молекул( аминокислот, гидроксикислот, моносахаров) используют проекции Фишера :
- на плоскость проецируют тетраэдрическую конфигурацию
- относительно асимметрического атома углерода записывают 4 заместителя,
вверху- старшую из всех групп, внизу- радикал , справа и слева – атомы водорода и
функциональные группы( амино, гидрокси, меркапто. галоген ) .
Структурные формулы отражают существование молекулы в виде двух изомеров,
принадлежащих к стереорядам D и L( D –правый, L – левый)
29
30.
3. Оптическая изомерияЭнантиомеры. Формулы Фишера
30
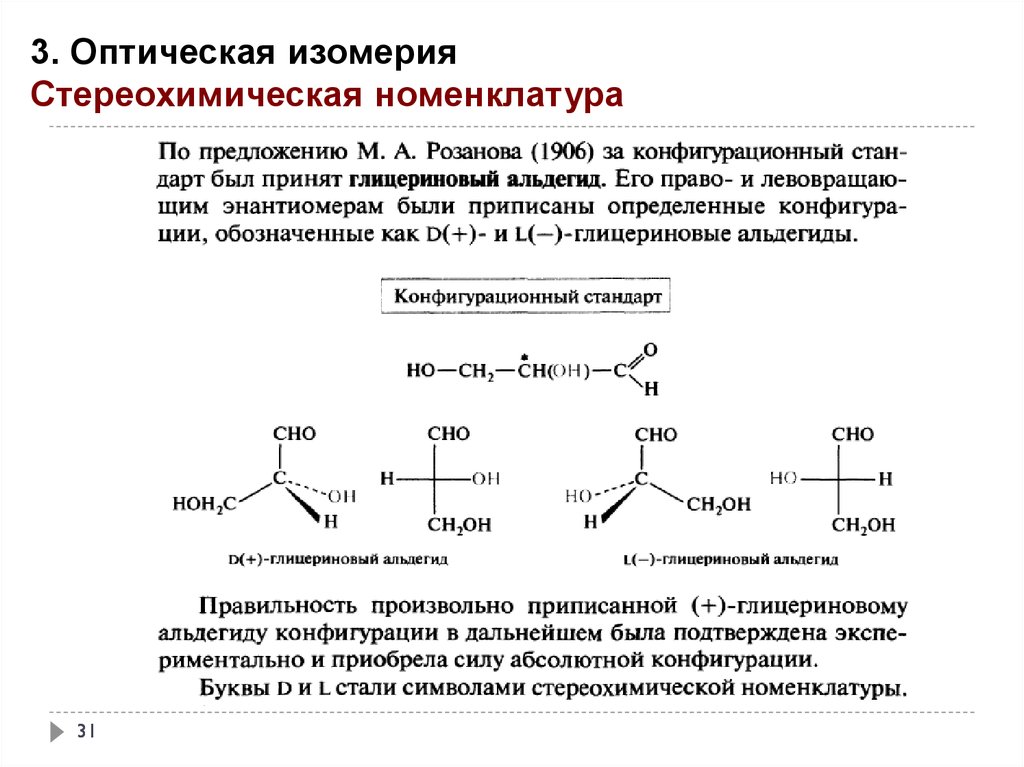
Вещество относится к D -ряду, если переход от атома водорода к гидроксигруппе( или
любой функциональной ) через старшую группусовпадает с движением стрелки на
часах.
Вещество относится к L -ряду, если переход от атома водорода к гидроксигруппе( или
любой функциональной ) через старшую группу осуществляется против движения
стрелки на часах.
31.
3. Оптическая изомерияСтереохимическая номенклатура
31
32.
3. Оптическая изомерияСтереохимическая номенклатура
32
33.
3. Оптическая изомерияСтереохимическая номенклатура
33
34.
3. Оптическая изомерияСтереохимическая номенклатура
34
35.
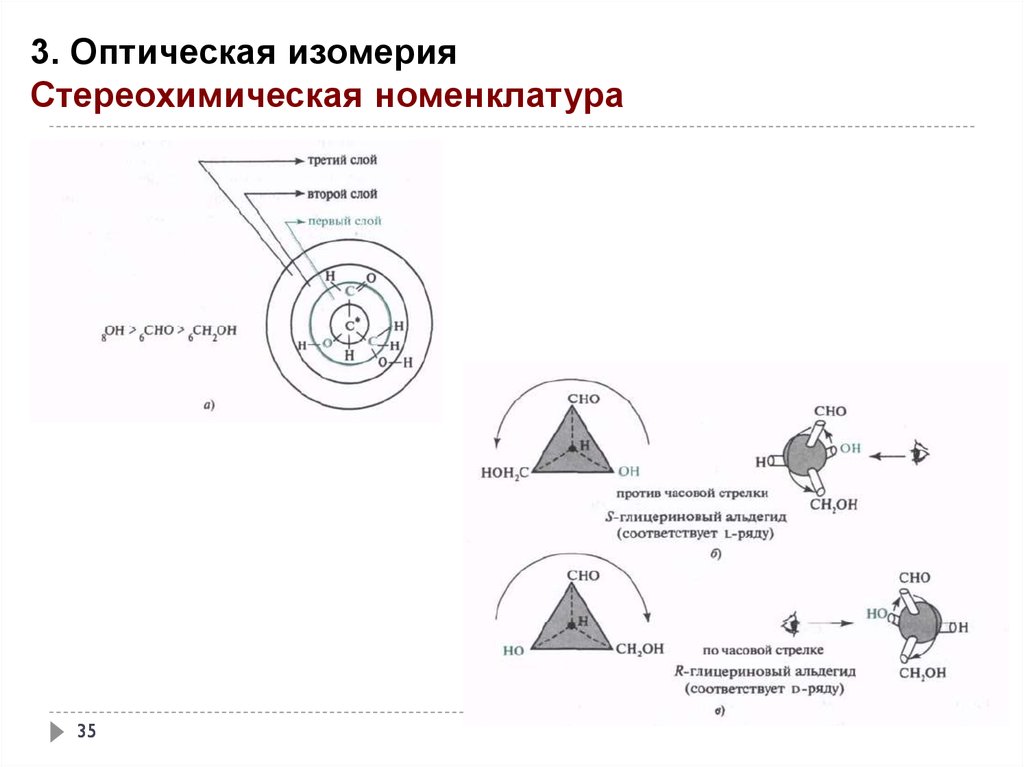
3. Оптическая изомерияСтереохимическая номенклатура
35
36.
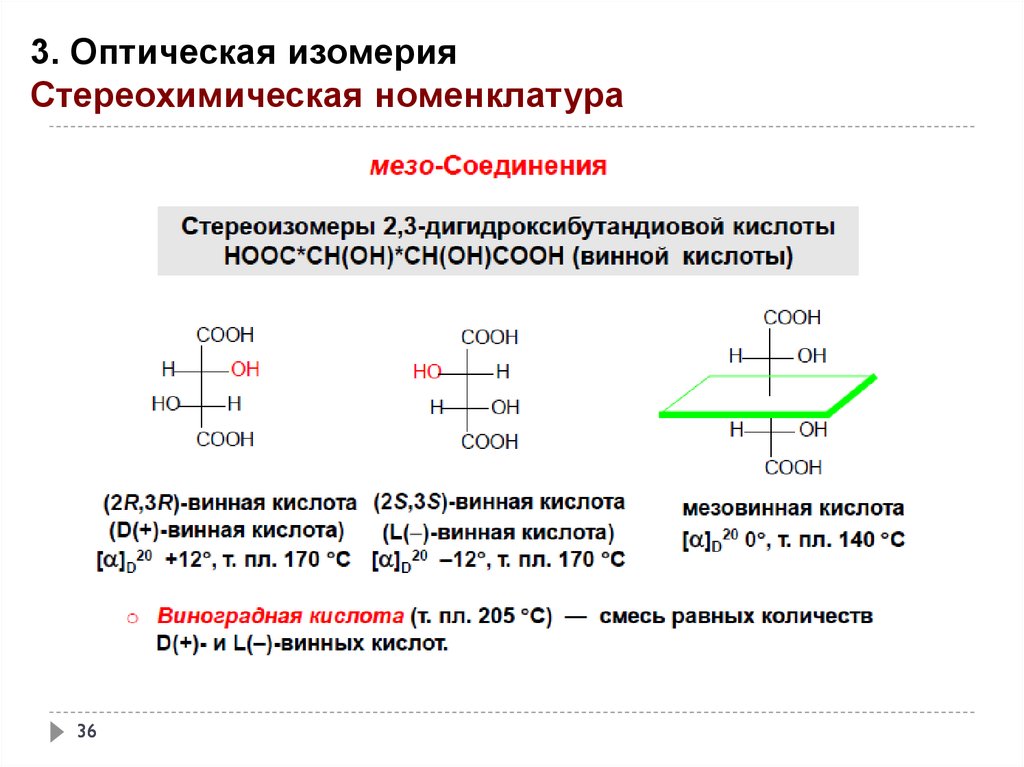
3. Оптическая изомерияСтереохимическая номенклатура
36
37.
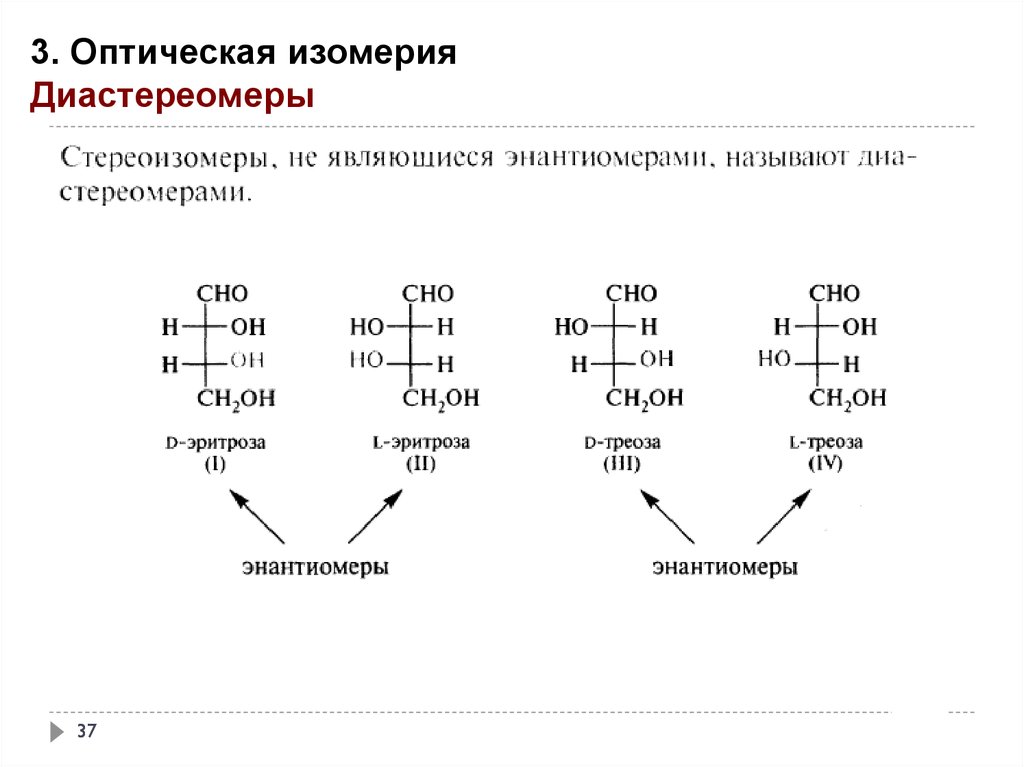
3. Оптическая изомерияДиастереомеры
37
38.
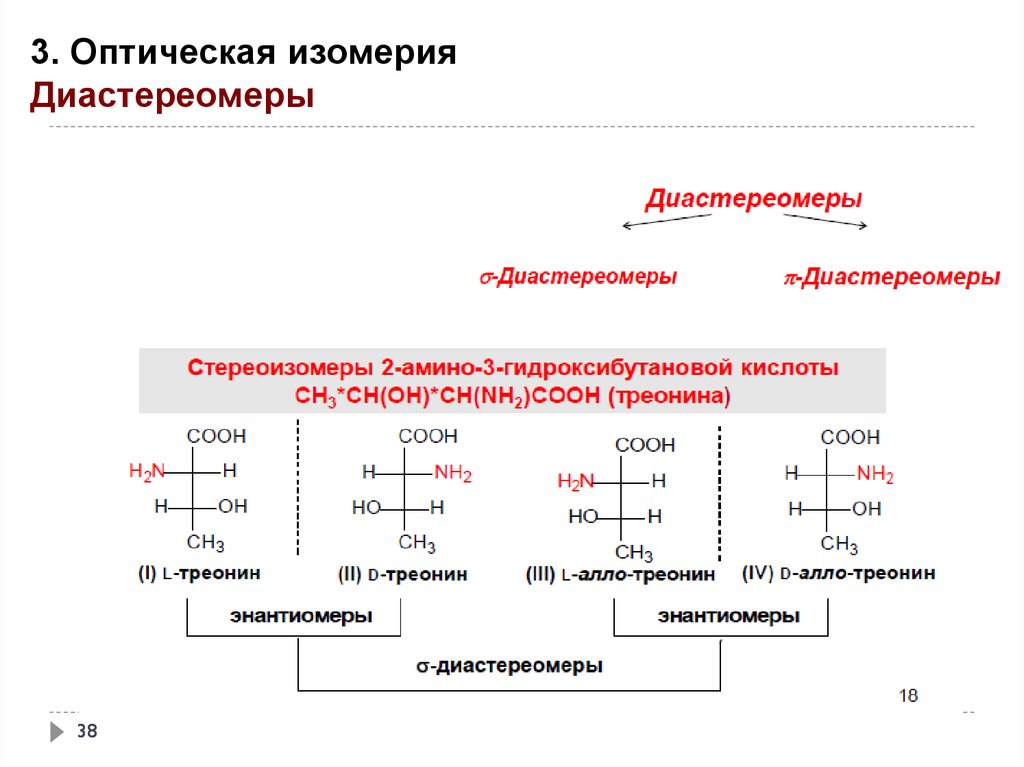
3. Оптическая изомерияДиастереомеры
38
39.
3. Оптическая изомерияДиастереомеры
39
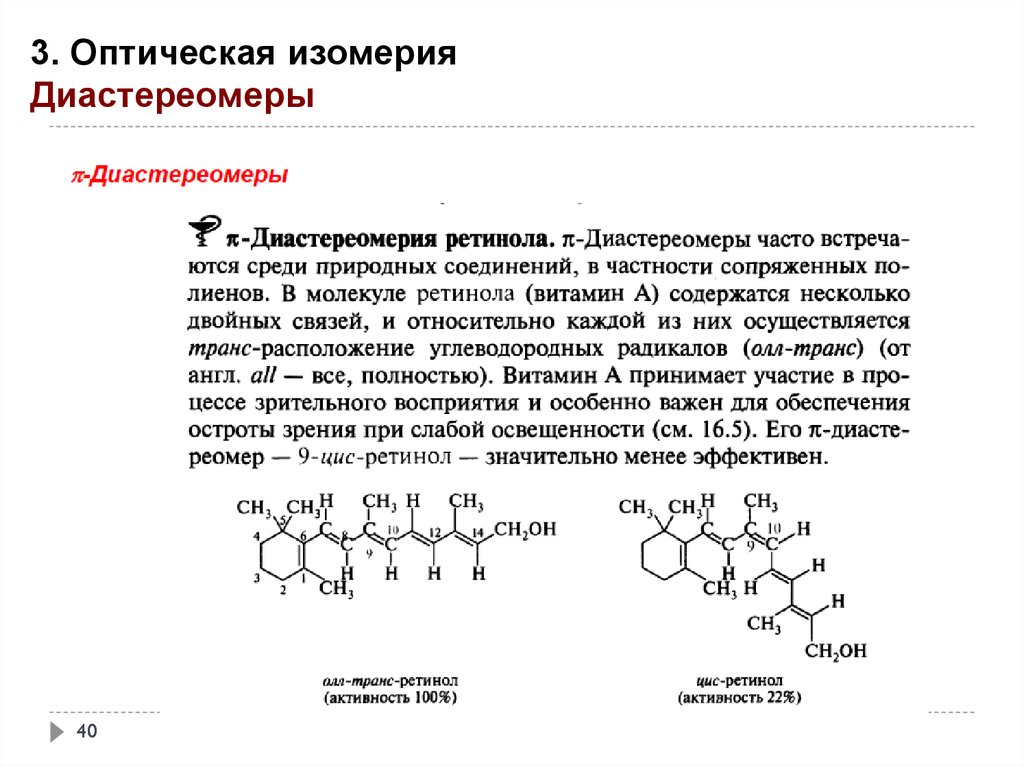
40.
3. Оптическая изомерияДиастереомеры
40
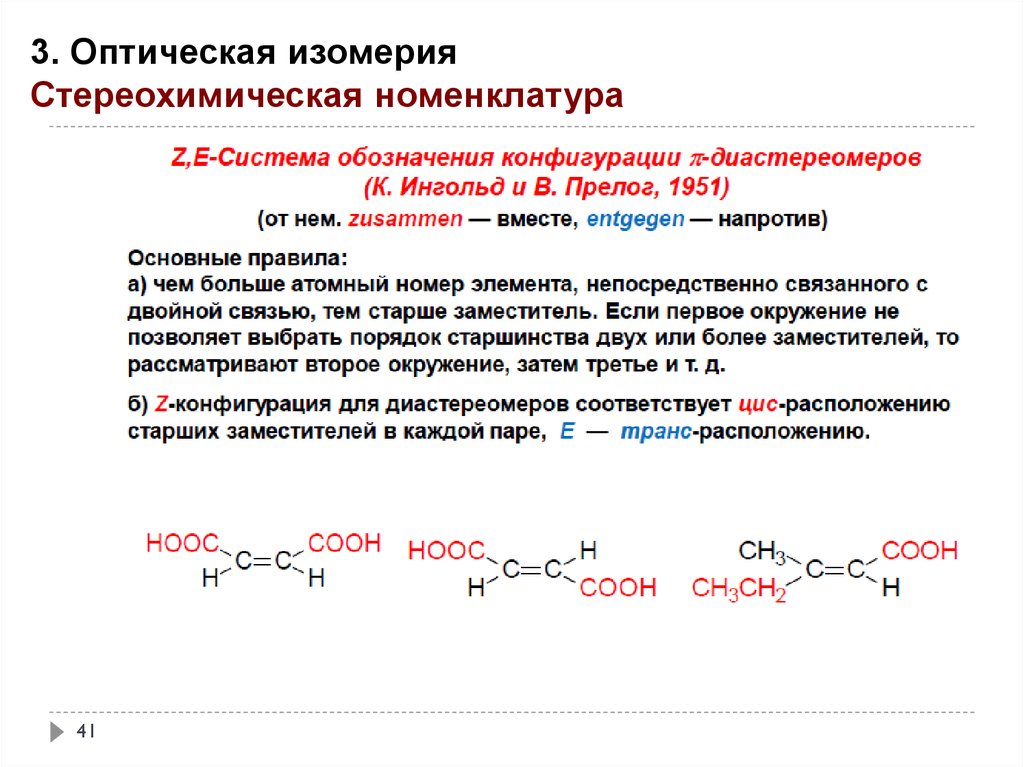
41.
3. Оптическая изомерияСтереохимическая номенклатура
41
42.
3. Оптическая изомерияСтереохимическая номенклатура
42
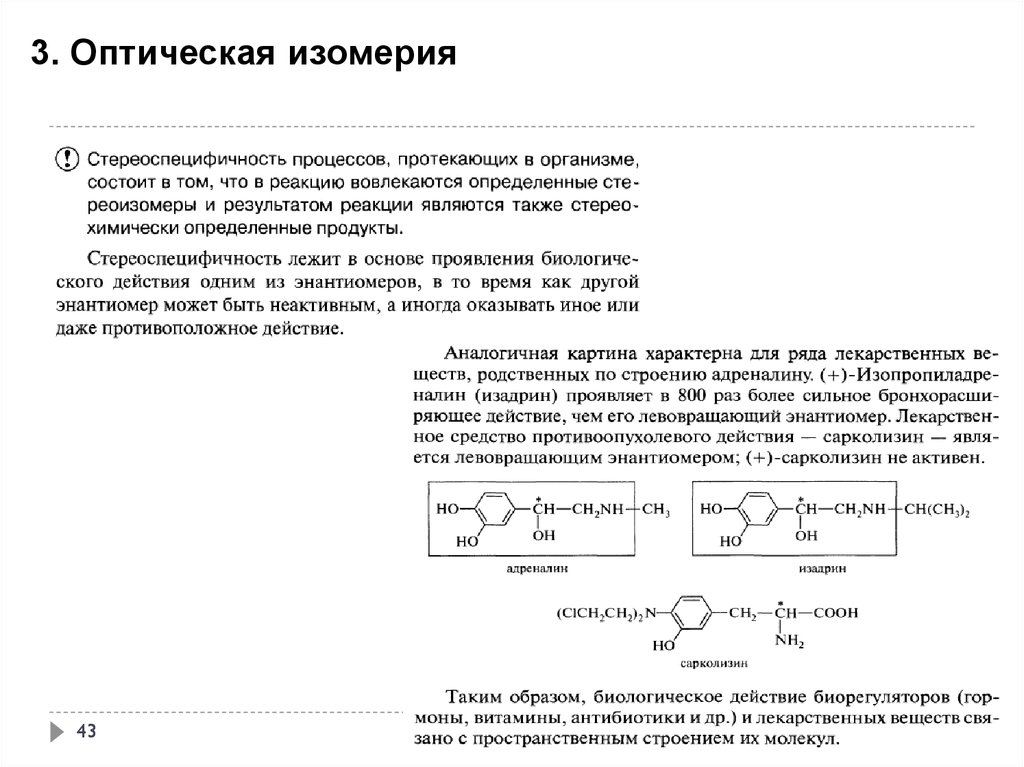
43.
3. Оптическая изомерия43
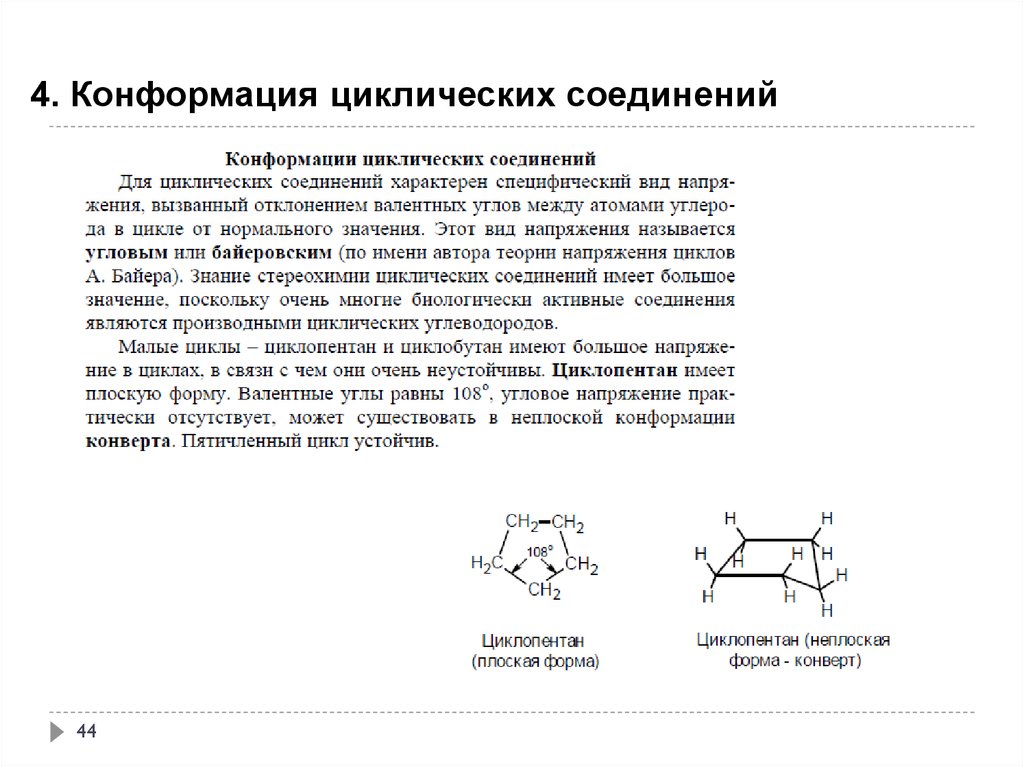
44.
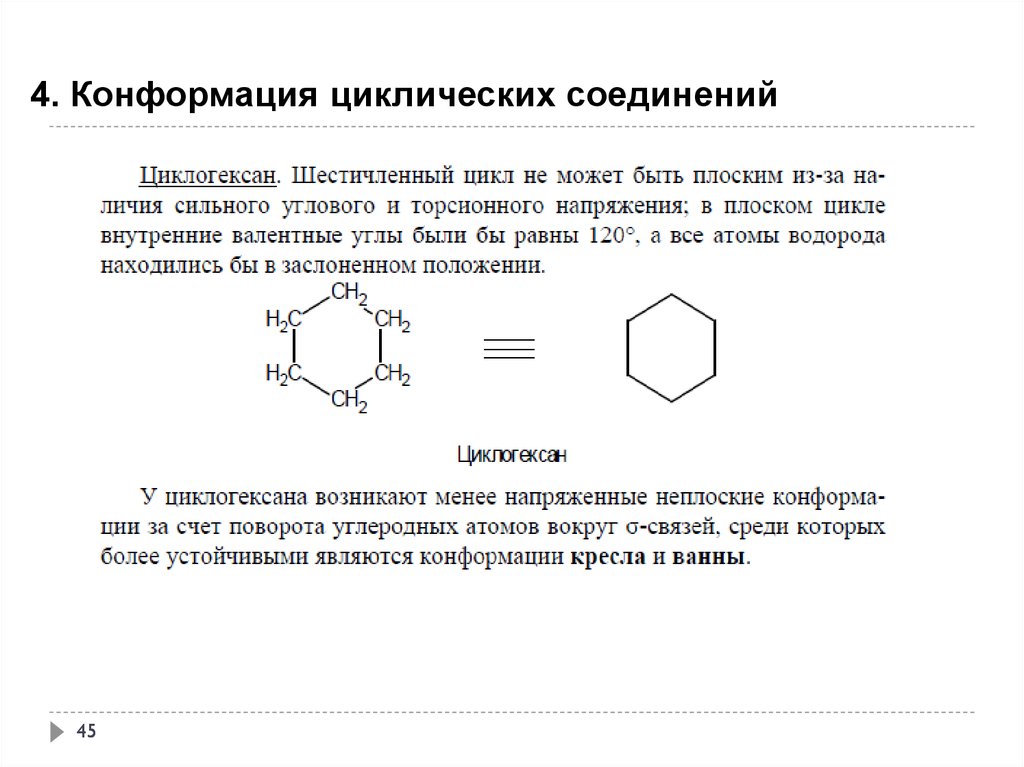
4. Конформация циклических соединений44
45.
4. Конформация циклических соединений45
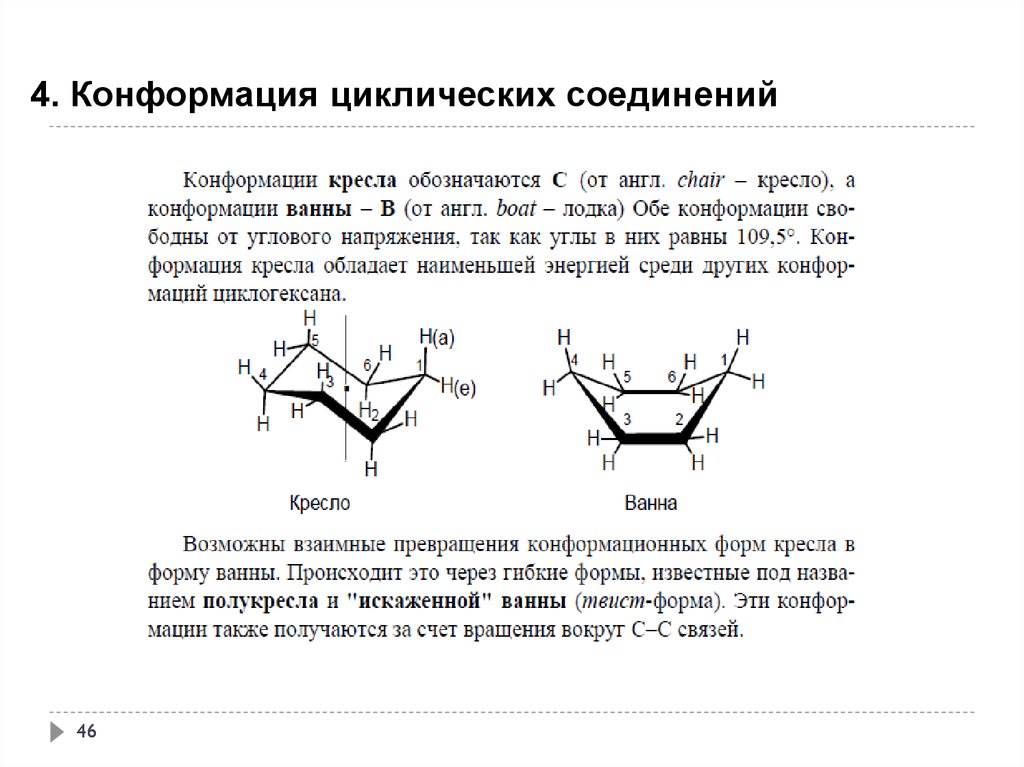
46.
4. Конформация циклических соединений46
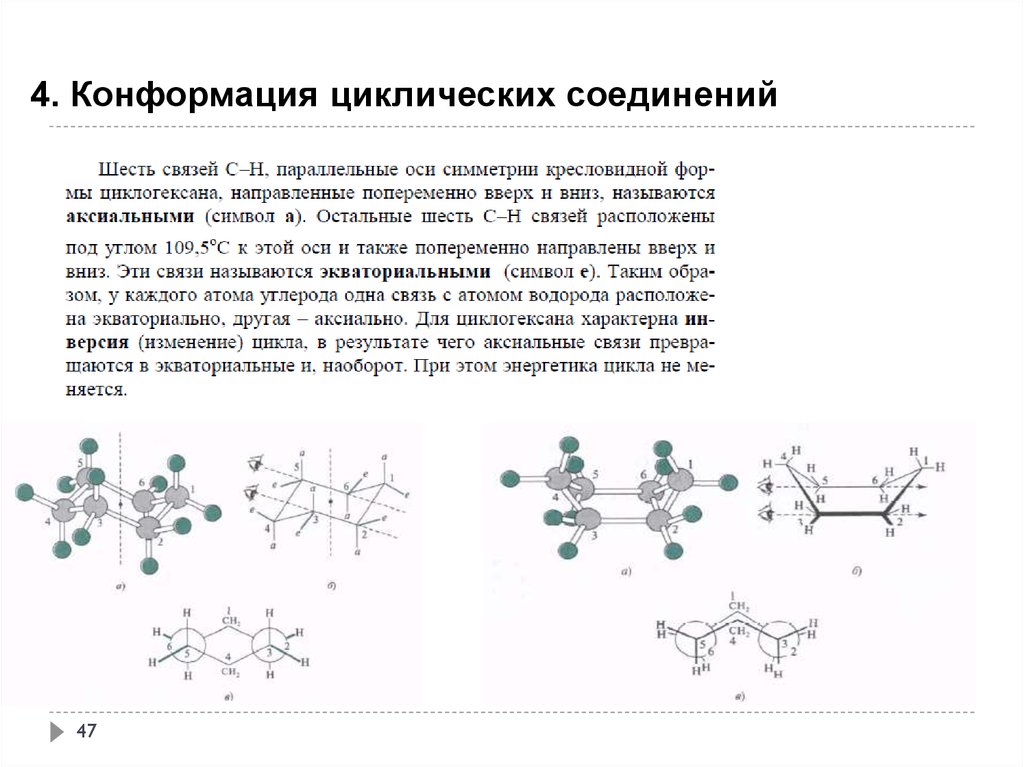
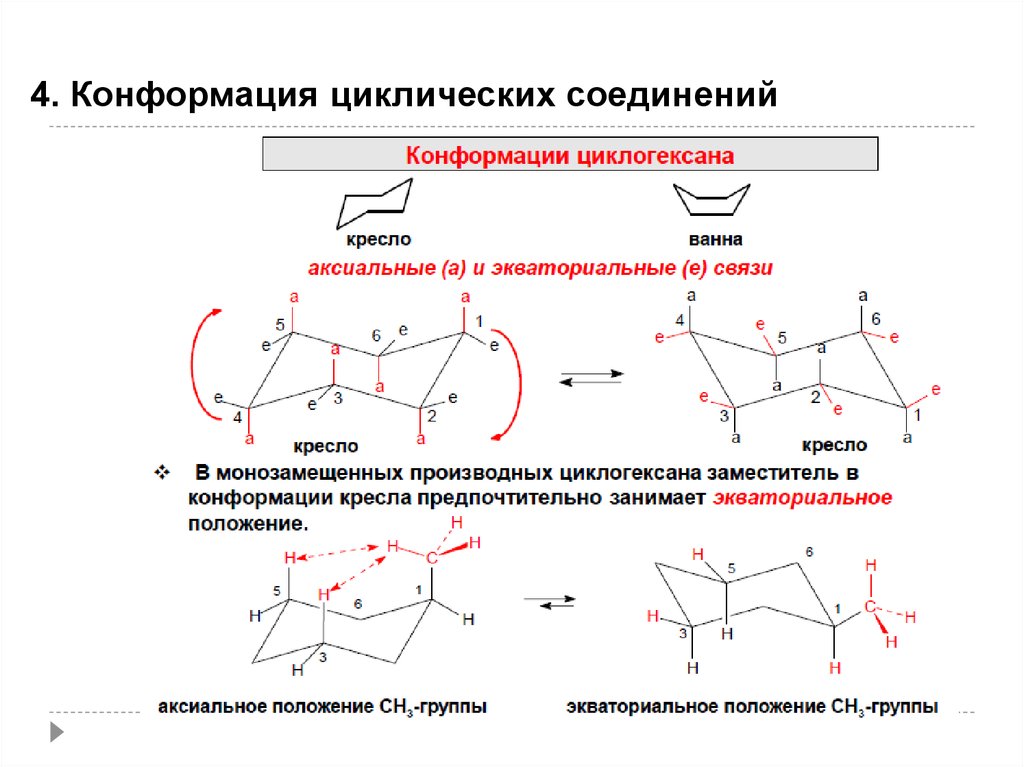
47.
4. Конформация циклических соединений47
































 chemistry
chemistry








