Similar presentations:
Теория химического строения А. М. Бутлерова. Часть III
1. ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ ЦЕНТР ДОВУЗОВСКОЙ ПОДГОТОВКИ И ПРОФОРИЕНТАЦИИ КАФЕДРА ХИМИИ
Теория химического строенияА. М. Бутлерова. Часть III
1. Третье положение теории
А. М.
Бутлерова.
2.Заместительная номенклатура ИЮПАК.
3.Механизмы химических реакций.
Составитель: доктор биологических наук, профессор,
зав. кафедрой химии
Степанова Ирина Петровна
2.
Третье положение теорииА. М. Бутлерова
Атомы или группы атомов, входящие в
состав молекулы, взаимно влияют друг на
друга, что сказывается на реакционной
способности молекулы в целом.
Взаимное влияние атомов обусловлено
смещением электронной плотности от одних
атомов к другим. При этом на атомах
появляется частичный заряд: d- или d+
(дельта минус или дельта плюс).
3.
Основные положения теории А. М. БутлероваВзаимное влияние может осуществляться по
системе s-связей (индуктивный эффект), по системе
p-связей (мезомерный эффект).
Индуктивный эффект (I-эффект) – смещение
электронной плотности по цепи s-связей,
которое обусловлено различиями в
электроотрицательностях атомов:
H3C
CH2
ddd dd
CH2 CH2
d
CH2
d
F
4.
Основные положения теории А. М. Бутлерова–I эффект проявляют заместители, которые
содержат атомы с большей ЭО, чем у
углерода: -F, -Cl, -Br, -OH, -NH2,
-NO2, >C=O, COOH и др.
+I эффект проявляют заместители,
содержащие атомы с низкой
электроотрицательностью: металлы (-Mg, -Li);
насыщенные углеводородные радикалы (-CH3,
-C2H5) и т.п.
5.
Основные положения теории А. М. БутлероваМезомерный
эффект
–
смещение
электронной плотности по цепи сопряженных
p-связей. Возникает только при наличии
сопряжения связей.
Сопряжение связей – взаимодействие
между орбиталями отдельных фрагментов
молекулы.
6.
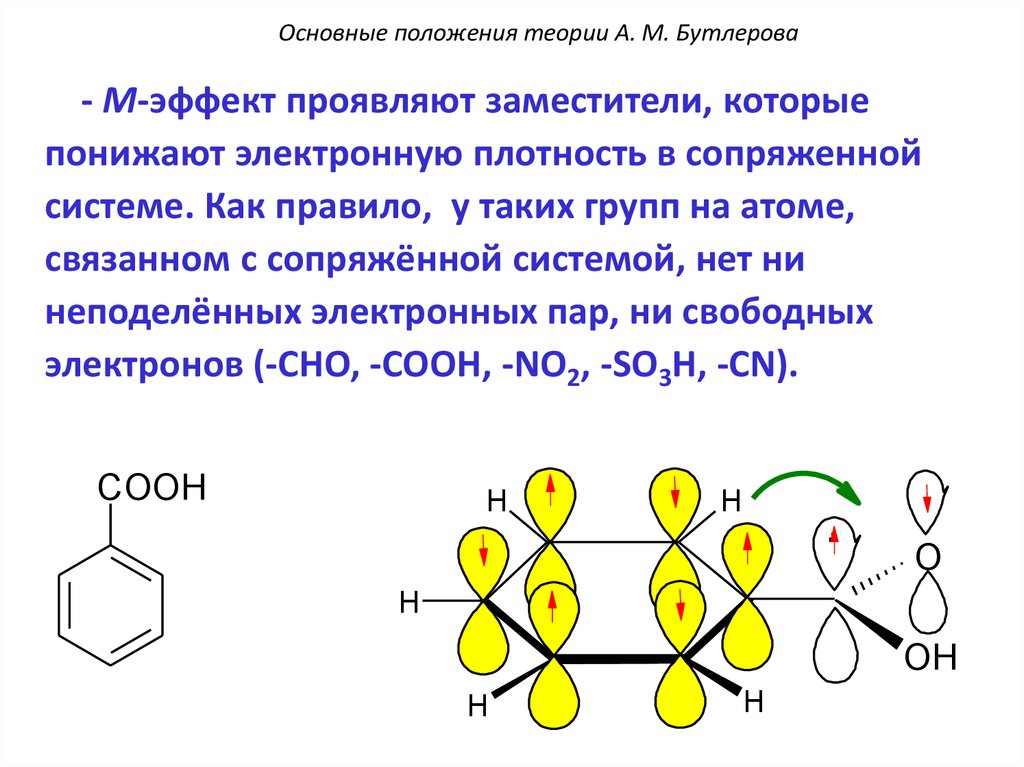
Основные положения теории А. М. Бутлерова- М-эффект проявляют заместители, которые
понижают электронную плотность в сопряженной
системе. Как правило, у таких групп на атоме,
связанном с сопряжённой системой, нет ни
неподелённых электронных пар, ни свободных
электронов (-CHO, -COOH, -NO2, -SO3H, -CN).
COOH
H
H
.
O
H
OH
H
H
7.
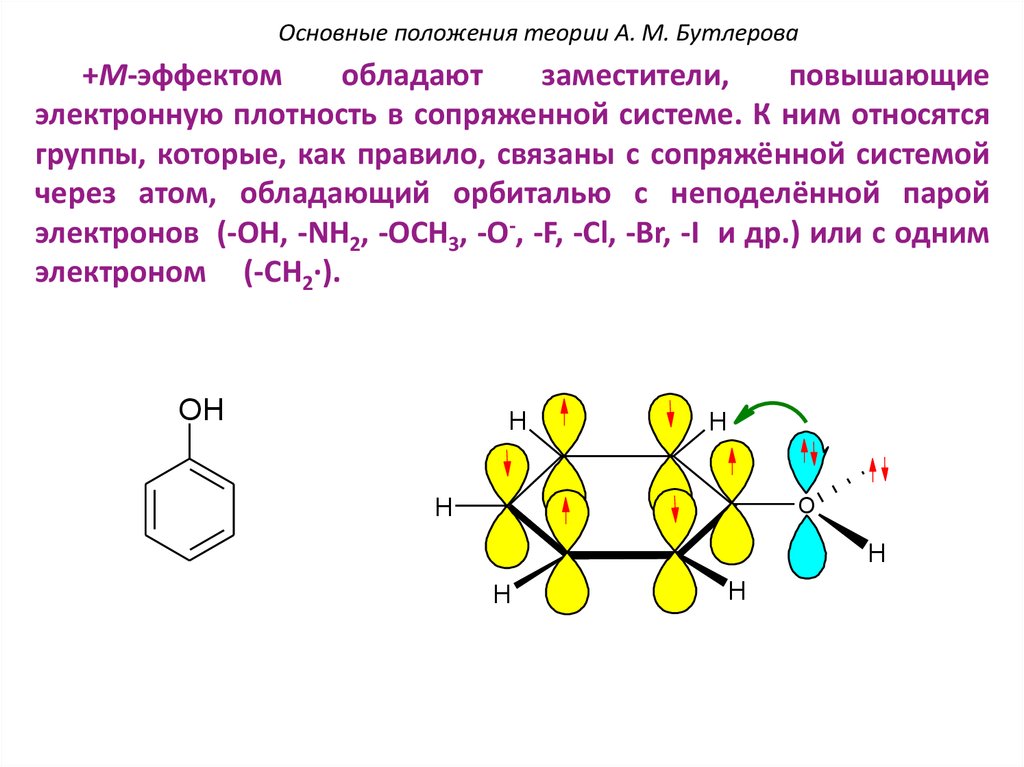
Основные положения теории А. М. Бутлерова+М-эффектом
обладают
заместители,
повышающие
электронную плотность в сопряженной системе. К ним относятся
группы, которые, как правило, связаны с сопряжённой системой
через атом, обладающий орбиталью с неподелённой парой
электронов (-OH, -NH2, -OCH3, -O-, -F, -Cl, -Br, -I и др.) или с одним
электроном (-CH2∙).
OH
H
H
.
O
H
H
H
H
8.
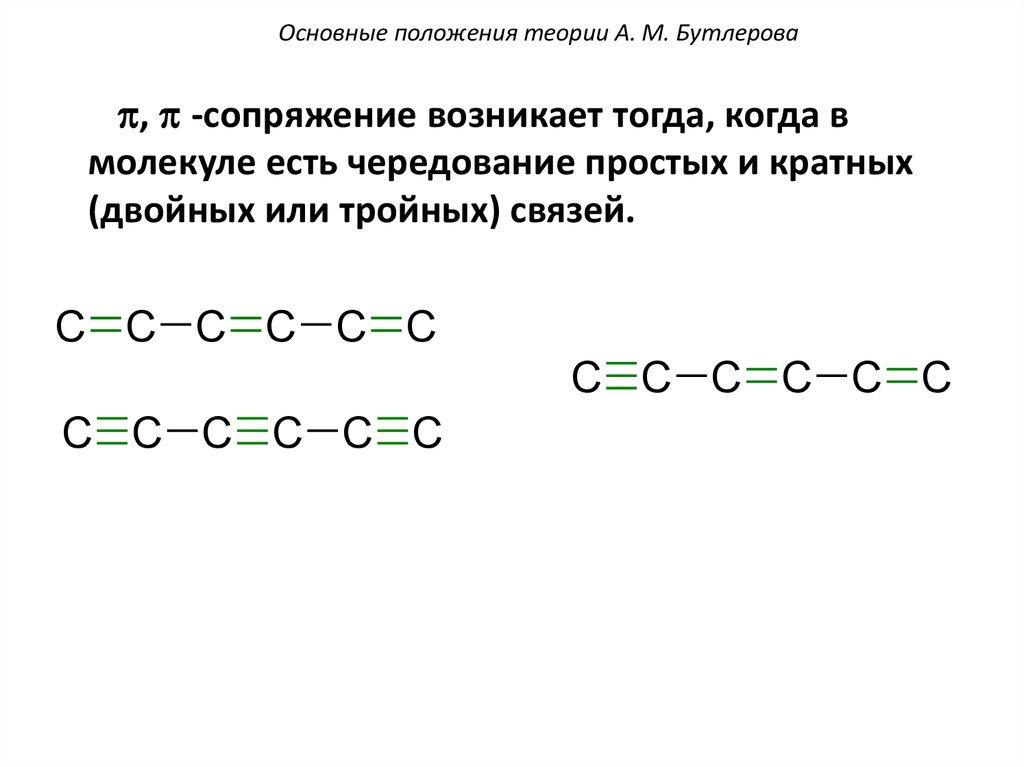
Основные положения теории А. М. Бутлероваp, p -сопряжение возникает тогда, когда в
молекуле есть чередование простых и кратных
(двойных или тройных) связей.
C C C C C C
C C C C C C
C C C C C C
9.
Основные положения теории А. М. Бутлероваp, p сопряжение в бутадиене:
H2C
H
H
C
H
H
H
H
C
CH2
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
10.
Основные положения теории А. М. БутлероваРаспределение
электронной плотности
в молекуле фенола:
11.
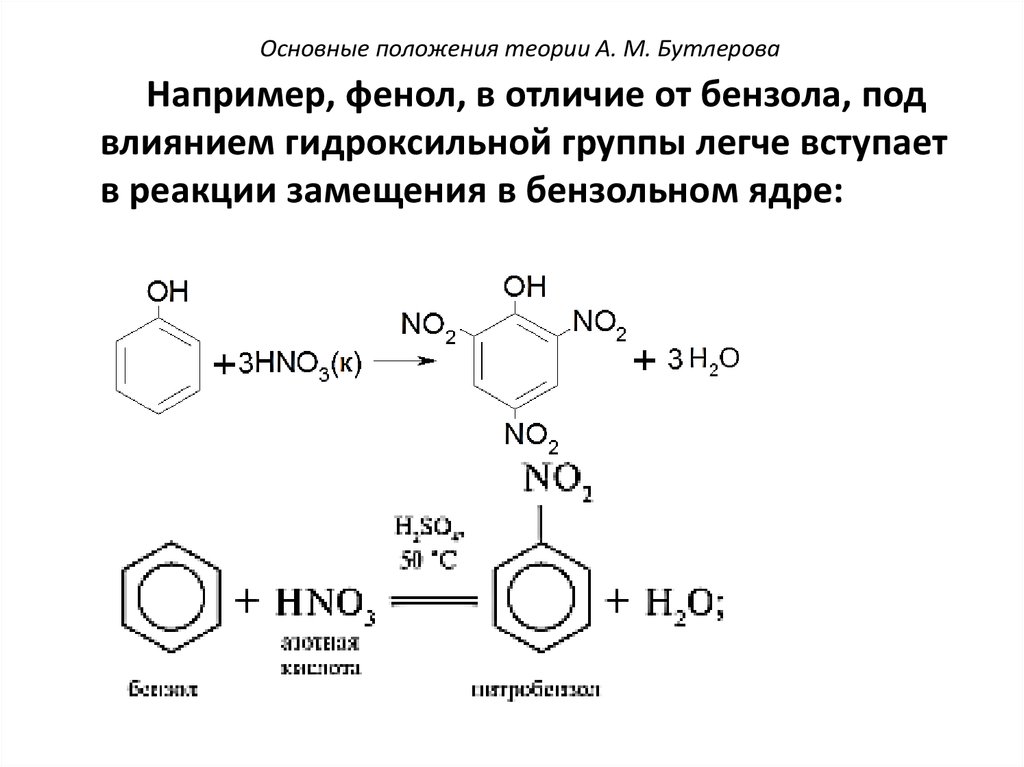
Основные положения теории А. М. БутлероваНапример, фенол, в отличие от бензола, под
влиянием гидроксильной группы легче вступает
в реакции замещения в бензольном ядре:
12.
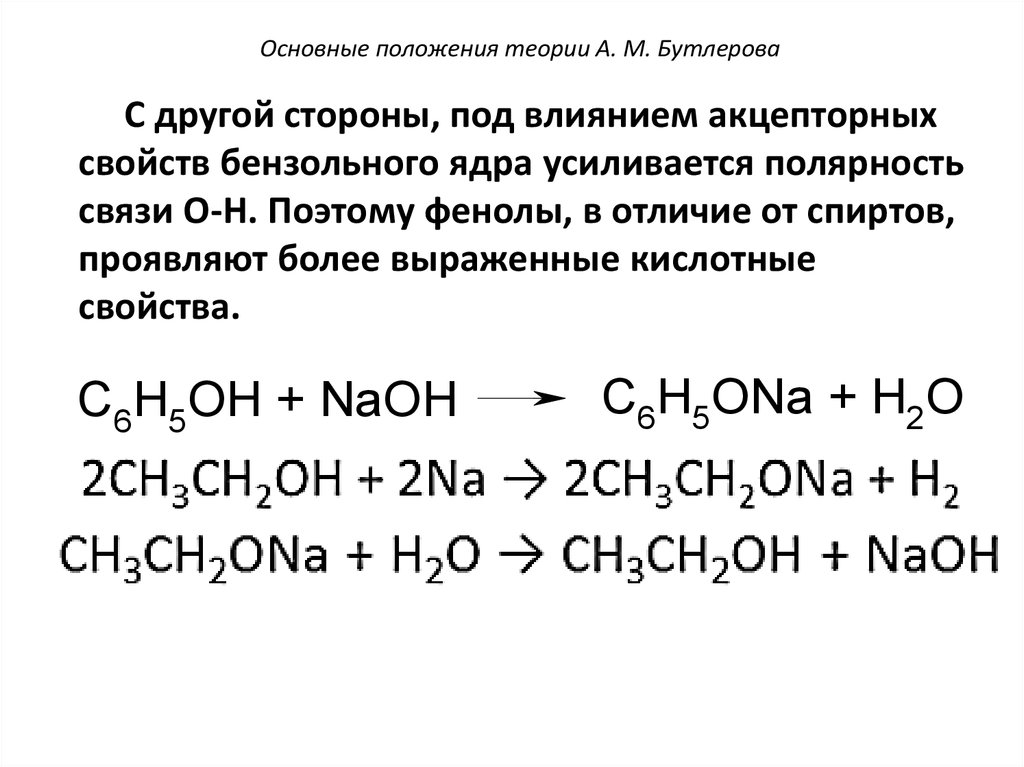
Основные положения теории А. М. БутлероваС другой стороны, под влиянием акцепторных
свойств бензольного ядра усиливается полярность
связи O-H. Поэтому фенолы, в отличие от спиртов,
проявляют более выраженные кислотные
свойства.
C6H5OH + NaOH
C6H5ONa + H2O
13.
Основные положения теории А. М. БутлероваТеория строения органических соединений:
объяснила неясности и противоречия в знаниях об
органических веществах,
творчески обобщила достижения в области химии,
определила качественно новый подход к пониманию
строения соединений,
стала основой для объяснения и прогнозирования
свойств органических веществ,
открыла путь для синтеза новых органических
соединений.
14.
Заместительная номенклатура ИЮПАКI.Выбор главной углеродной цепи
(родоначальной структуры).
II.Нумерация цепи.
III.Составление названия.
Характеристическая (функциональная) группа – атомы
или группы атомов, определяющие химические свойства
соединения и принадлежность его к определенному
классу.
15.
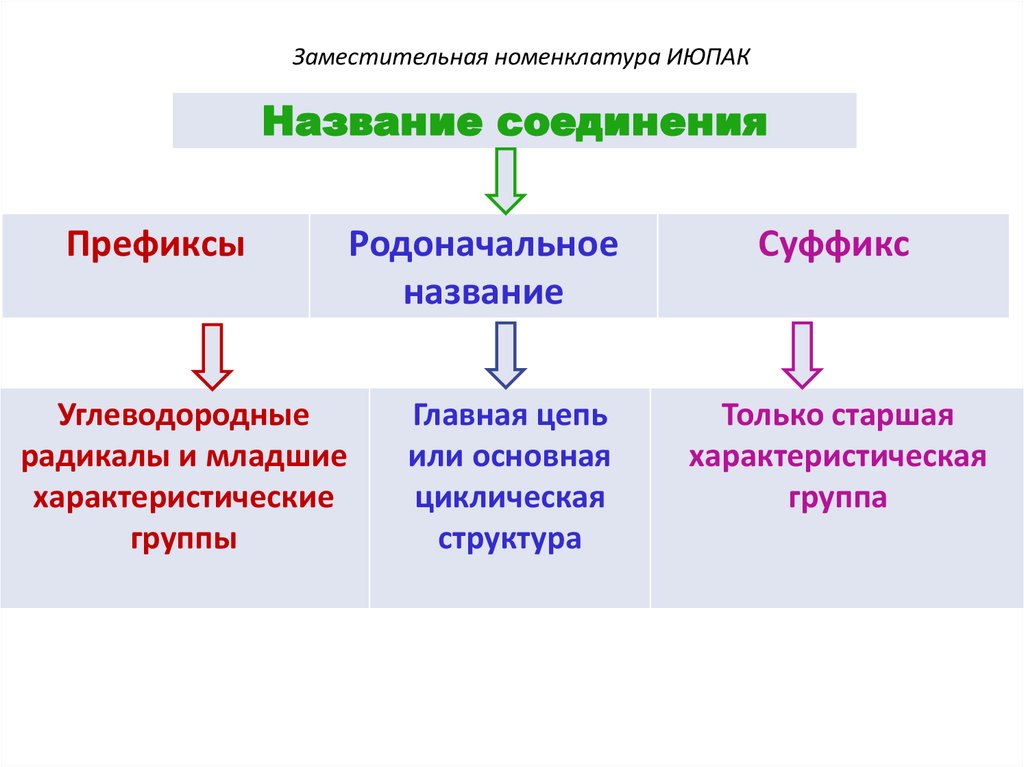
Заместительная номенклатура ИЮПАКНазвание соединения
Префиксы
Углеводородные
радикалы и младшие
характеристические
группы
Родоначальное
название
Главная цепь
или основная
циклическая
структура
Суффикс
Только старшая
характеристическая
группа
16.
Префиксы и суффиксы применяемые дляобозначения важнейших характеристических групп
(в порядке падения старшинства)
Класс
соединения
Характеристическая группа
Формула
Название
префикса
суффикса
Карбоновые
кислоты
-COOH
-
-овая кислота
Альдегиды
-CHO
оксо-
-аль
Кетоны
=CO
оксо-
-он
Спирты
-OH
гидрокси-
-ол
Амины
-NH2
амино-
-амин
17.
Заместительная номенклатура ИЮПАКНазвания важнейших углеводородных
радикалов:
18.
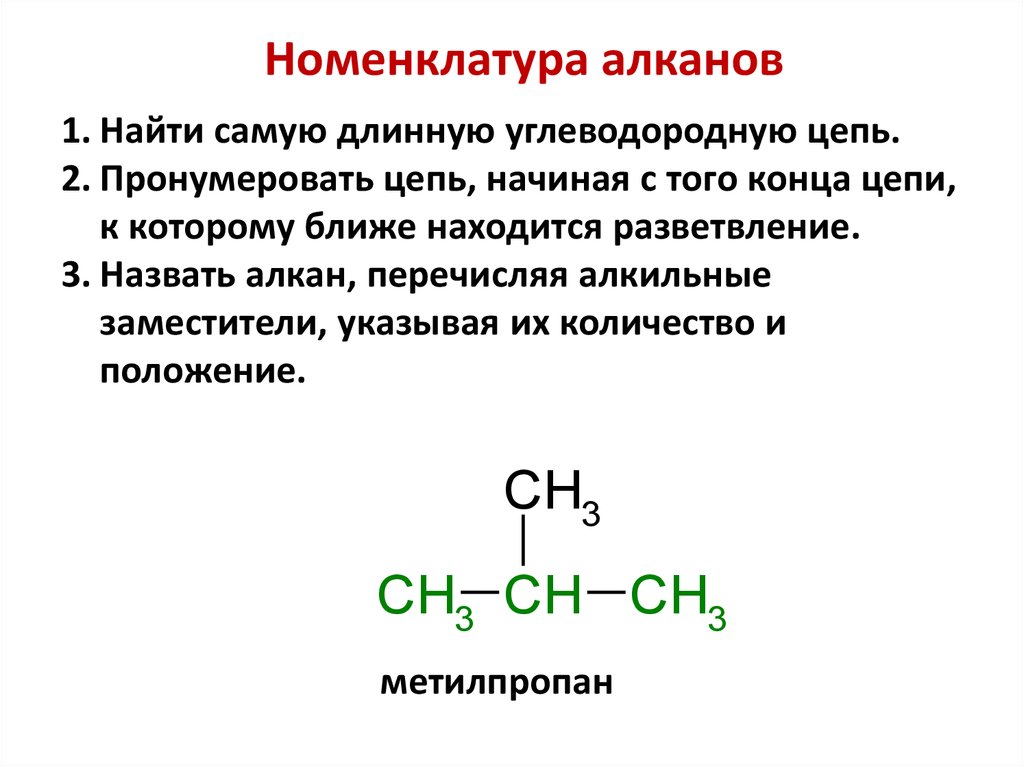
Номенклатура алканов1. Найти самую длинную углеводородную цепь.
2. Пронумеровать цепь, начиная с того конца цепи,
к которому ближе находится разветвление.
3. Назвать алкан, перечисляя алкильные
заместители, указывая их количество и
положение.
CH3
CH3 CH CH3
метилпропан
19.
Заместительная номенклатура ИЮПАКмeтилы
1
CH3
2
3
4
CH3
5
6
CH3 CH CH CH2 CH CH3
CH2
CH3
этил
2,5-димeтил-3-этилгeксан
20. Номенклатура алкенов
этан → этен (этилен)пропан → пропен (пропилен)
1. Главная цепь обязательно должна включать в
себя двойную связь, поэтому она может быть и не
самой длинной.
2.Нумерацию начинают с того конца цепи,
который ближе к двойной связи. Цифра,
обозначающая положение двойной связи, ставится
после суффикса -ен.
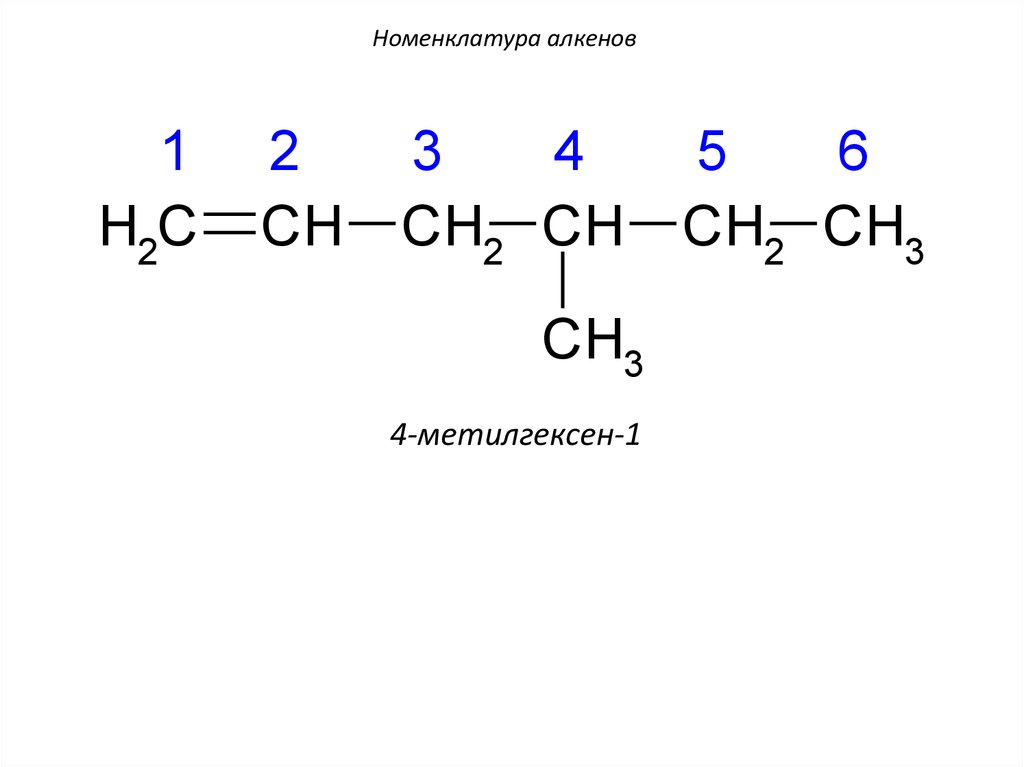
21. Номенклатура алкенов
1H2C
2
CH
3
4
CH2 CH
CH3
4-метилгексен-1
5
6
CH2 CH3
22.
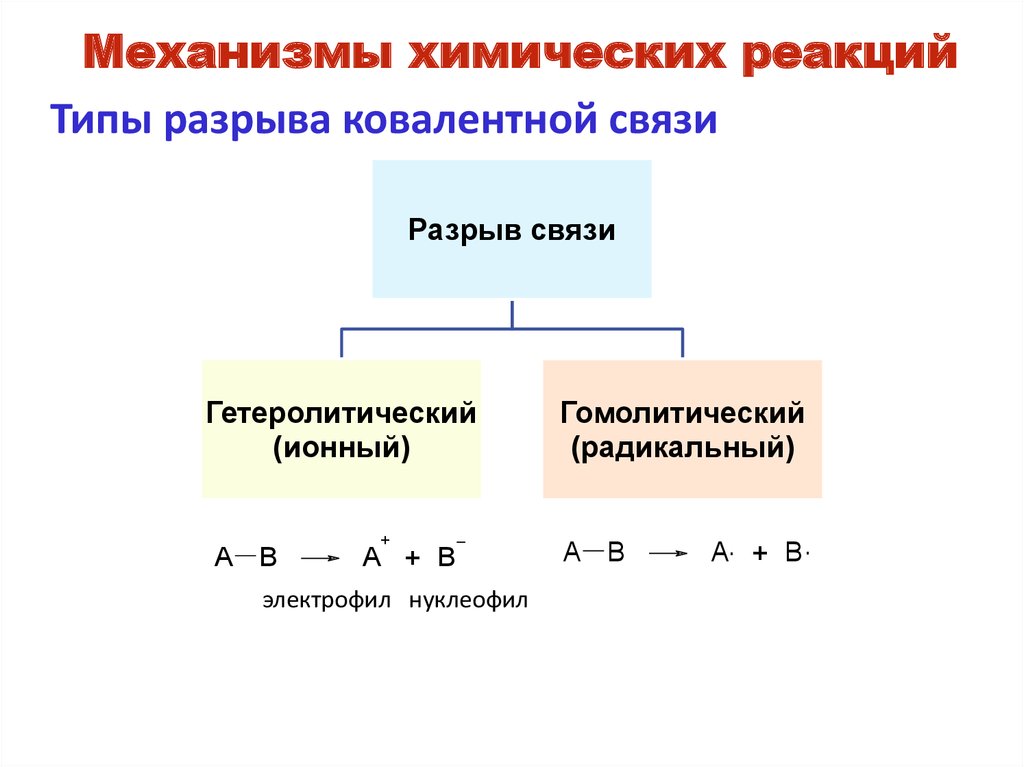
Механизмы химических реакцийТипы разрыва ковалентной связи
Разрыв связи
Гетеролитический
(ионный)
A B
+
A + B
электрофил нуклеофил
Гомолитический
(радикальный)
A B
A. + B .
23.
Механизмы химических реакций24. Способ разрыва ковалентной связи с образованием свободных радикалов называется
ТестыСпособ разрыва ковалентной связи с
образованием свободных радикалов
называется
1) гомолитическим
3) гетеролитическим
2) ионным
4) гетерогенным
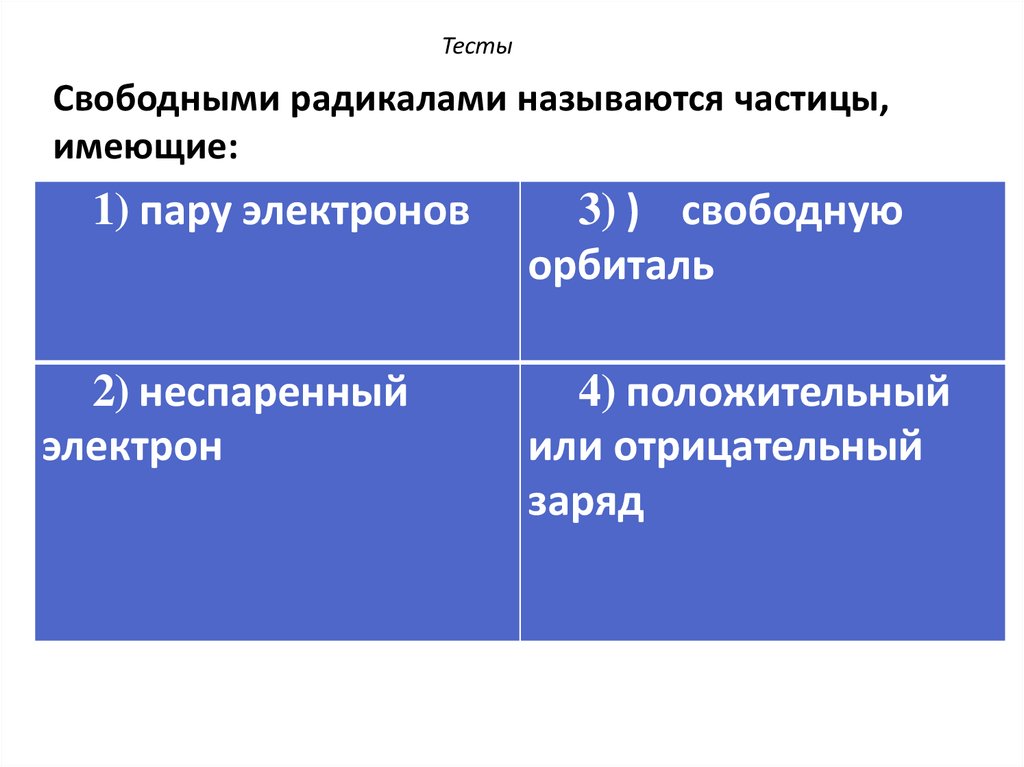
25. Свободными радикалами называются частицы, имеющие:
ТестыСвободными радикалами называются частицы,
имеющие:
1) пару электронов
2) неспаренный
электрон
3) ) свободную
орбиталь
4) положительный
или отрицательный
заряд
26.
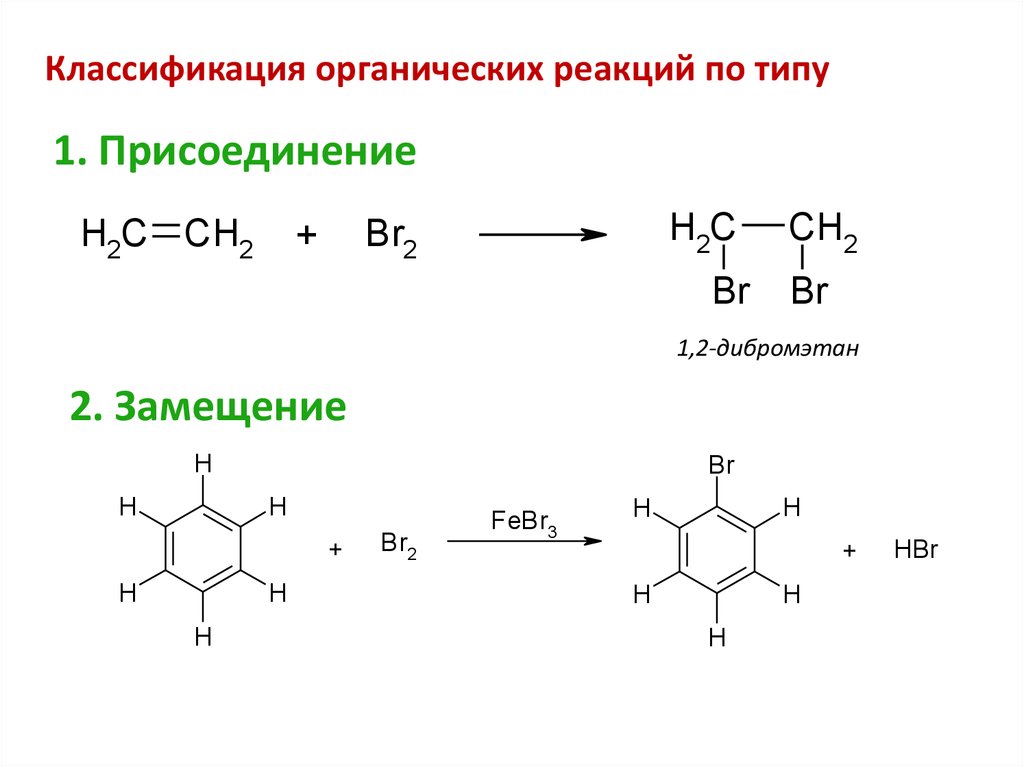
Классификация органических реакций по типу1. Присоединение
H2C CH2
H2C
Br2
+
Br
CH2
Br
1,2-дибромэтан
2. Замещение
H
Br
H
H
+
H
H
H
Br2
FeBr3
H
H
+
H
H
H
HBr
27.
Классификация органических реакций по типу3. Элиминирование (отщепление)
CH3 CH2 CH CH3
OH
бутанол-2
H2SO4
CH3 CH CH CH3
-H2O
бутен-2
4. Изомеризация
CH3 CH2 CH2 CH2 CH3
AlCl3, 100o
CH3 CH CH2 CH3
CH3
28. Реакция отщепления водорода называется:
ТестыРеакция отщепления водорода называется:
1) дегидрирование
3) гидратация
2) дегидратация
4) гидролиз
29.
СПАСИБО ЗАВАШЕ
ВНИМАНИЕ!


















 chemistry
chemistry








