Similar presentations:
Деструкция углеводородов
1.
ДЕСТРУКЦИЯ УГЛЕВОДОРОДОВ1. ТЕРМИЧЕСКАЯ
2. БИОХИМИЧЕСКАЯ
3. ХИМИЧЕСКАЯ
ПОД ДЕЙСТВИЕМ:
1.КАТАЛИЗАТОРОВ
2.ИНИЦИАТОРОВ
3.ФЕРМЕНТОВ (КОФЕРМЕНТОВ, БИОКАТАЛИЗАТОРОВ)
4. РЕАГЕНТОВ
НО ПРИ ЭТОМ РАЗРЫВ СВЯЗИ МОЖЕТ ПРОИСХОДИТЬ
ТОЛЬКО ПО ГОМОЛИТИЧЕСКОМУ ЛИБО ГЕТЕРОЛИТИЧЕСКОМУ
МЕХАНИЗМУ С ОБРАЗОВАНИЕМ РАДИКАЛОВ ЛИБО ИОНОВ
2.
ЭНЕРГИЯ, НЕОБХОДИМАЯ ДЛЯ ГОМОЛИТИЧЕСКОГО РАЗРЫВА СВЯЗИНАЗЫВАЕТСЯ ЭНЕРГИЕЙ ДИССОЦИАЦИИ
(ОНА ОТЛИЧНА ОТ ЭНЕРГИИ СВЯЗИ)
Например: Эн разр С-Н в молекуле метана
средняя эн связей
428 кДж/моль
415 кДж/моль
При диссоциации происходит изменение геометрии системы
и валентного состояния атома
ЭНЕРГИЯ ГЕТЕРОЛИТИЧЕСКОГО РАЗРЫВА ЗНАЧИТ. ВЫШЕ,
ЧЕМ ГОМОЛИТИЧЕСКОГО.
МОЖЕТ БЫТЬ ВЫЧИСЛЕНА НА ОСНОВАНИИ ДАННЫХ ПО
ПОТЕНЦИАЛАМ ИОНИЗАЦИИ
ЭКСПЕРИМЕНТАЛЬНО (МЕТОД ЭЛ. УДАРА)
3.
ТЕРМИЧЕСКАЯ СТАБИЛЬНОСТЬ УГЛЕВОДОРОДОВОпределяется энергией Гиббса образования углеводородов
из простых веществ (кДж/моль)
Зависимость от температуры:
î áð
GÒ
À + ÂÒ
Коэффициенты можно найти, если известна
энергия Гиббса при при темп. 298 и 700К
4.
Например:Зная уравнение зависимости энергии Гиббса реакции крекинга какого-либо
углеводорода от температуры можно найти Т при который возможен
крекиннг этого углеводорода
Крекинг пентана с обр. метана и бутена
_
_
CH3-CH2-CH2 CH2 CH3
CH4 + CH2=CH-CH2-CH3
î áð
GÒ
À + ÂÒ
(1)
В справочнике находим Эн.Г образования всех 3 веществ при Т 298 и 700К
Это +29485 и – 28743 кДж/моль, соответственно
Решаем систему уравнений
G298 = A +B298
G 700 = A + B700
Находим А = 72621, В = 144,8
Подставляем в уравнение (1)
Следовательно, при G = 0, температура выше которой возможно протекание
реакции крекинга в данном направлении равна 510 К
5.
Химизм и механизм термических превращенийуглеводородов и других компонентов нефти и газа
ОСНОВНЫЕ ПРОЦЕССЫ ТЕРМИЧЕСКОЙ
ПЕРЕРАБОТКИ НЕФТЯНОГО СЫРЬЯ:
1. ТЕРМИЧЕСКИЙ КРЕКИНГ
2. КОКСОВАНИЕ
3. ПИРОЛИЗ
ТЕРМИЧЕСКИЙ КРЕКИНГ
Устаревший процесс - Т.КР. мазута под давлением с
образованием бензина.
Сейчас Т.КР. тяжелых очищенных дистиллятов нефти главная
цель получение не бензина, а крекинг-остатка с низким
содержанием асфальтенов, и далее игольчатого кокса
(высок. степ. чистоты и механич. прочности)
6.
Легкий крекинг гудрона (висбрекинг)Т 450-480оС Р 0.2 МПа малое время контакта
– получение
Небольшого кол-ва газа
бензина,
дизельной фракции
Котельного топлива
20%
80%
7.
КоксованиеУсловия
450-550оС небольшое давление, близкое к атмосферному
Процессы коксования нефтяных остатков
Получение
Электродного кокса (выход 10-40%)
Газ (10-20%0
Дистилляты коксования (50-70%)
8.
ПИРОЛИЗУсловия:
Т 700-900 оС Р ~ 0.1 МПа
Сырье:
бензин прямой перегонки
Керосино-газойлевые фракции,
Природные и попутные газы
Получение газообразных олефинов (гл.о этилена)
9.
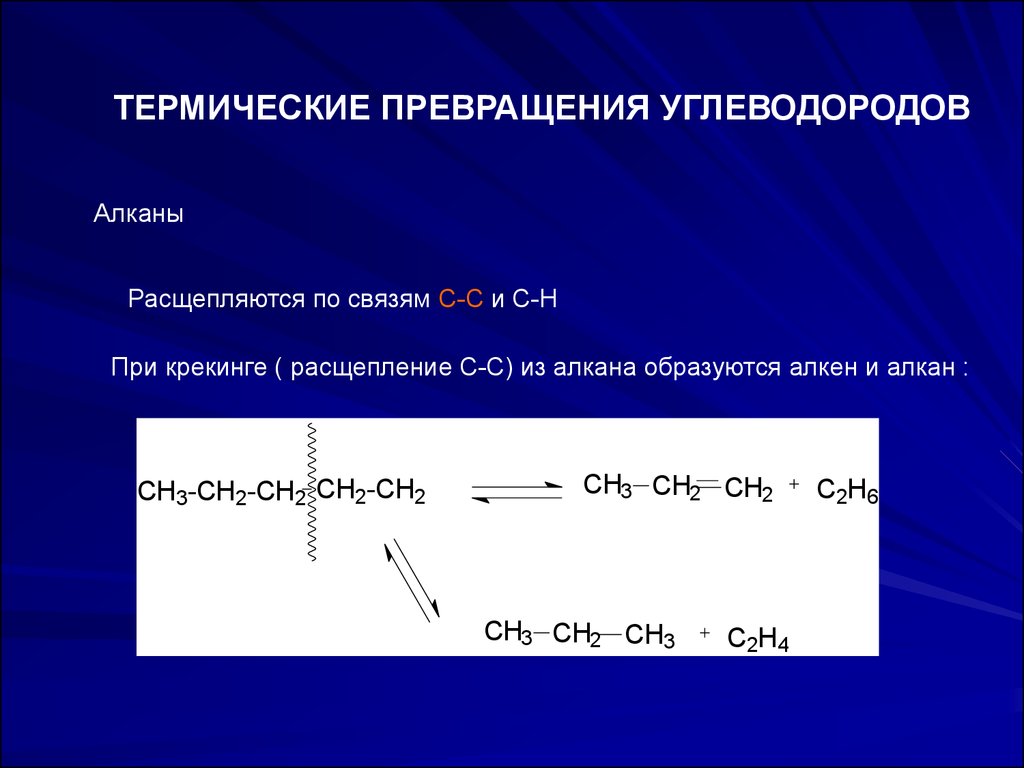
ТЕРМИЧЕСКИЕ ПРЕВРАЩЕНИЯ УГЛЕВОДОРОДОВАлканы
Расщепляются по связям С-С и С-Н
При крекинге ( расщепление С-С) из алкана образуются алкен и алкан :
CH3-CH2-CH2 CH2-CH2
CH3 CH2 CH2
CH3 CH2 CH3
C2H4
C2H6
10.
При С-Н распаде идет реакция дегидрированияCH3 CH2 CH2
CH3 CH2 CH3
H2
Для низших алканов дегидрирование доминирует
Для высших алканов преобладает реакция крекинга.
Наиболее термически устойчив метан Твыше 560оС (900оС)
Этан Тдестр. более 500оС (800 оптим). Основная реакция - дегидрирование
CH2 CH2
CH3 CH3
H2
Пропан расщепляется легче, чем метан и этан по С-С (450оС0
1
C3H6
C3H7
H2
2
C2H4
CH4
11.
Начиная с пентана расщепление по С-С становится преобладающимОтносительная скорость крекинга:
Число ат С
V
5
6
7
8
10
12
20
1
4
9
10
32
46
120
Уменьшается энергия диссоциации C-C с ростом числа атомов углерода
Место разрыва определяется энергиями связей, энергиями
переходных состояний, изомерией молекулы, условиями процесса
12.
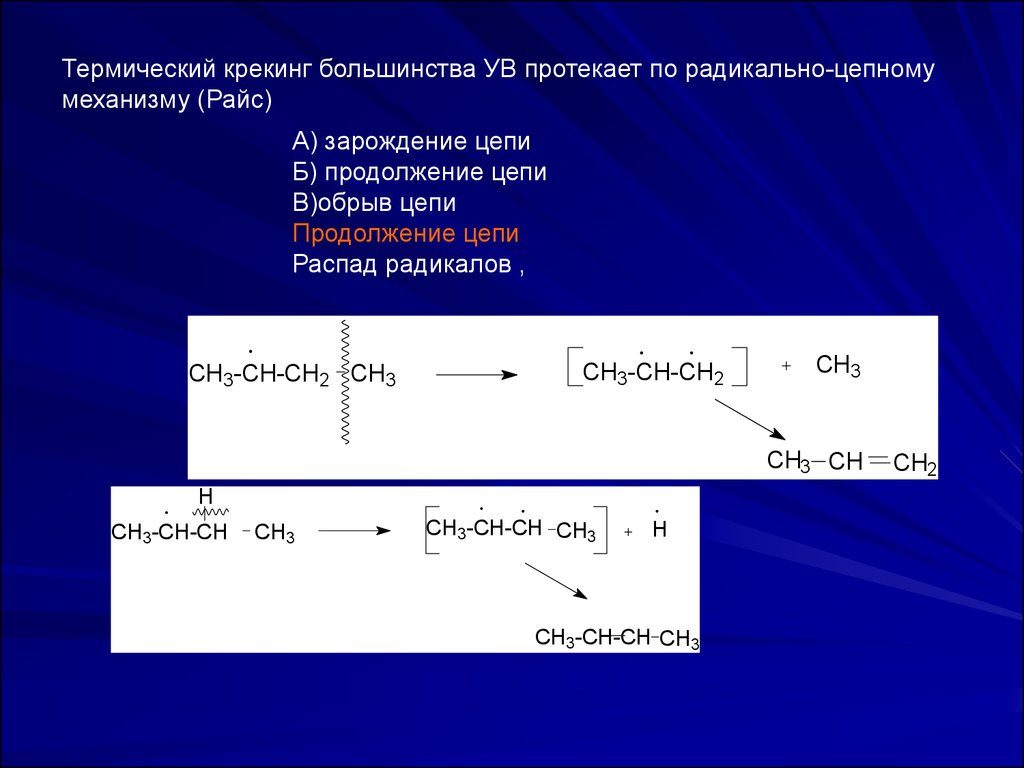
Термический крекинг большинства УВ протекает по радикально-цепномумеханизму (Райс)
А) зарождение цепи
Б) продолжение цепи
В)обрыв цепи
Продолжение цепи
Распад радикалов ,
CH3-CH-CH2 CH3
CH3-CH-CH2
CH3
CH3 CH
H
CH3-CH-CH
CH3
CH3-CH-CH CH3
H
CH3-CH-CH CH3
CH2
13.
Изомеризация радикаловПервичные изомеризуются в более стабильные вторичные.
Внутримолекулярная миграция ат Н
Реакции радикалов с молекулами УВ – передача цепи
R + H2
RH + H
RH + CH3
R
+ CH4
Относительные скорости отрыва ат Н от первичного, втор. и третичного
атомов С при 600оС находятся в соотношении 1 : 2 :10
14.
-Cпер-Н + .RCвт-Н + .R
Cтр-H + .R
-C.пер + RH
C.вт + RH
C.тр +RH
Легкость разрыва связей С-Н при соударении с радикалом
характеризуются константами скоростей соответствующих реакций
Êï åð=àï åðå-Åï åð/RT;
Êâò=àâòå-Åâò/RT;
Êòð=àòðå-Åòð/RT;
К- константы скорости образования
а – предэкспоненциальные множители
апер≈ авт≈ атр
Е – энергии активации реакции отрыва ат Н
15.
Энергии активации можно вычислить по ур-ю Семенова-Полянидля экзотермических еакций
Е=11,5-0,25Q
Q - тепловой эффект реакции
Вычислив энергии активации можно найти отношения констант скоростей
отрыва ат Н и найти относительные скорости отрыва соответствующих атомо
Кпер :Квт :Ктр = Vпер :Vвт :Vтр
Относительные скорости отрыва ат Н от первичного, втор. и третичного
атомов С при 600оС находятся в соотношении 1 : 2 :10 (по Райсу, велико влияние Т)
Пример: Рассмотрим расчет относит. Скоростей отрыва первичных,
вторичных и третичн. ат.Н при 600оС (873К). Сравним с данными Райса
Известно:
Qï åð=21êÄæ/ ì î ëü
Qâò =42 êÄæ/ì î ëü
Qòð = 57 êÄæ/ì î ëü
16.
Расчитанные по формуле Семенова-Поляни значения энергий активации:Åï åð = 43 êÄæ/ì î ëü
Åâò = 38 êÄæ/ì î ëü
Åòð = 33 êÄæ/ì î ëü
Находим отношения констант скоростей реакции, которые равны отношению
скоростей отрыва ат Н
Vâò /Vï åð =Êâò /Êï åð=åÅï åð-Åâò/RT=
=10(43000-38000/19,11 õ873)=2
Vòð /Vï åð =Êòð /Êï åð=åÅï åð-Åòð/RT=
=10(43000-33000/19,11 õ873)=4
Сравним: по Райсу 1 : 2 :10, т.е. отношения третичного с первичным не совпадает. Он
использовал эн. Диссоциации (это неточно), а мы энергии активации.
17.
Зная относительные скорости отрыва различных атомов водорода можнорассчитать относительные вероятности их отрыва и, следовательно
относительные вероятности образования соответствующих радикалов
Wï åð =Vï åð õ nï åð
Wâò =Vâò õ nâò
Wòð =Vòð õ nòð
W - î òí î ñèò.âåðî ÿòí î ñòè î áðàçî âàí èÿ
V - î òí î ñèò ñêî ðî ñòè î áðàçî âàí èÿ
n -÷èñëî ñî î òâåòñòâóþ ù èõ àòî ì î â âî äî ðî äà
Зная относительные вероятности можно рассчитать состав продуктов
термического крекинга алканов. Расчетные данные хорошо коррелируют
с экспериментом
18.
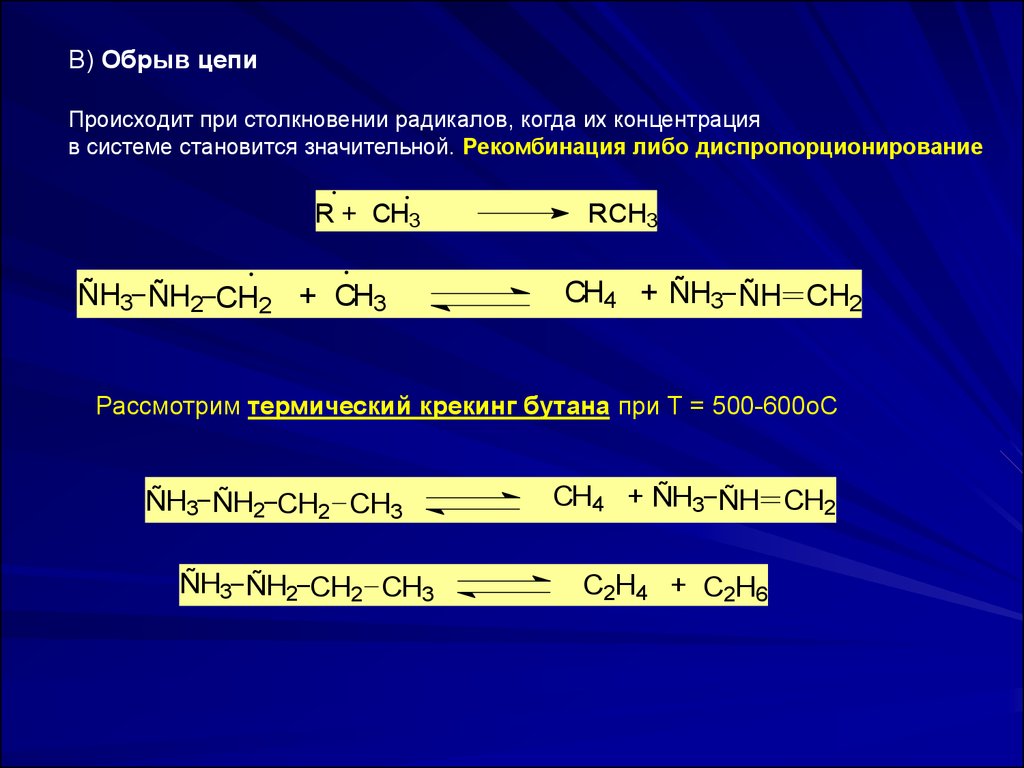
В) Обрыв цепиПроисходит при столкновении радикалов, когда их концентрация
в системе становится значительной. Рекомбинация либо диспропорционирование
R + CH3
ÑH3_ ÑH2_CH2 + CH3
R 3
RCH
CH4 + ÑH3_ ÑH CH2
Рассмотрим термический крекинг бутана при Т = 500-600оС
ÑH3_ ÑH2_CH2 CH3
ÑH3_ ÑH2_CH2 CH3
CH4 + ÑH3_ ÑH CH2
C2H4 + C2H6
19.
Зарождение цепи:ÑH3_ ÑH2_CH2 CH3
ÑH3_ ÑH2_CH2 CH3
2 ÑH3_ CH2
_
CH3 + ÑH3 ÑH2_CH2
Столкновение свободных радикалов с молекулами бутана – развитие цепи
ÑH3_ ÑH2_CH2 CH3 + CH3
CH4 + ÑH3_ ÑH2_CH2 CH2
I í àï ðàâëåí èå
ÑH3_ ÑH2_CH2 CH3 + CH3
CH4 + ÑH3_ ÑH2_ CH CH3
II í àï ðàâëåí èå
20.
Первичный бутил распадается с образованием этилена и этанаÑH3_ ÑH2_CH2 CH2
C2H5 + C4H10
C2H4 + C2H5
C2H6 + C4H9
Вторичный бутил распадается с образованием пропилена и метана
ÑH3_ ÑH2_ CH CH3
CH3 + C4H10
CH3 + ÑH3_ ÑH CH2
CH4 + C4H9
21.
Соотношение между продуктами распада бутила и втор-бутилаопределяется соотношением вероятностей их образования
Wâò.áóòèë
Vâò õ nâò
2 õ4
8
Wáóòèë
Vï åð õ nï åð
1 õ6
6
Из 14 мол бутана 8 превращаются во втор.бутил и дают пропилен и метан ,
А 6 мол превращаются в н-бутил и затем в этилен и этан:
14C4H10
8 Ñ3H6 + 8CH4
28%
28%
+
6 C2H4
21%
+ 6 C2H6
21%
22.
Радикальный механизм термического расщепления углеводородовРаспад радикалов по бета-связи)
объясняет преобладание этилена в газообразных продуктах пиролиза
RÑH2_CH2 CH2
R C2H4 + C2H4
R + C2H4
Выход этилена значительно меньше расчетного, т.к.
Незначительно идет изомеризация первичных радикалов во вторичные





















 physics
physics chemistry
chemistry








