Similar presentations:
Предельные углеводороды (алканы)
1.
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ(АЛКАНЫ)
Предельные углеводороды –
соединения с открытой цепью,
содержащие в молекулах только
атомы углерода и водорода.
Название по номенклатуре IUPAC –
АЛКАНЫ.
Общая формула
СnH2n+2
2.
• Простейшим представитель - метанСН4. Последующие члены получаются добавление группы –СН2(гомологической разницы) к каждому
новому члену гомологического ряда
алканов для получения следующего
за ним члена ряда.
• Алканы могут иметь
неразветвленную цепь атомов
углерода (нормальные алканы или налканы) и разветвленную
(изоалканы, разветвленные алканы).
3.
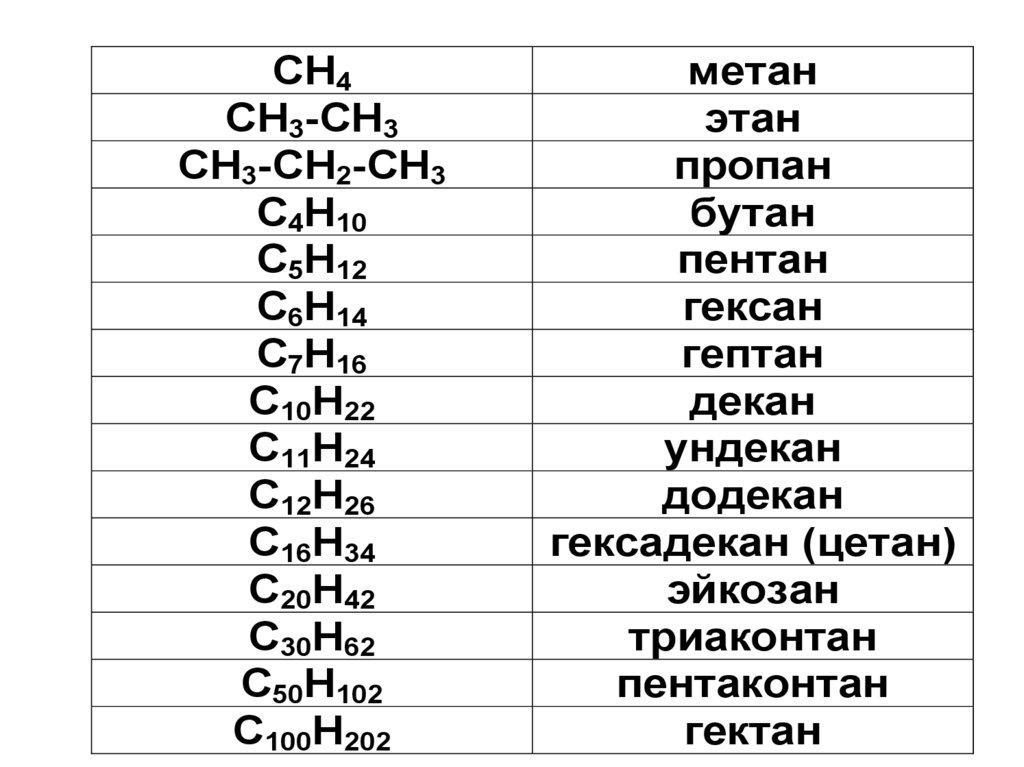
СН4СН3-СН3
СН3-СН2-СН3
С4Н10
С5Н12
С6Н14
С7Н16
С10Н22
С11Н24
С12Н26
С16Н34
С20Н42
С30Н62
С50Н102
С100Н202
метан
этан
пропан
бутан
пентан
гексан
гептан
декан
ундекан
додекан
гексадекан (цетан)
эйкозан
триаконтан
пентаконтан
гектан
4.
• Начиная с бутана возможнаструктурная изомерия
бутан
2-метилпропан
(изобутан)
5.
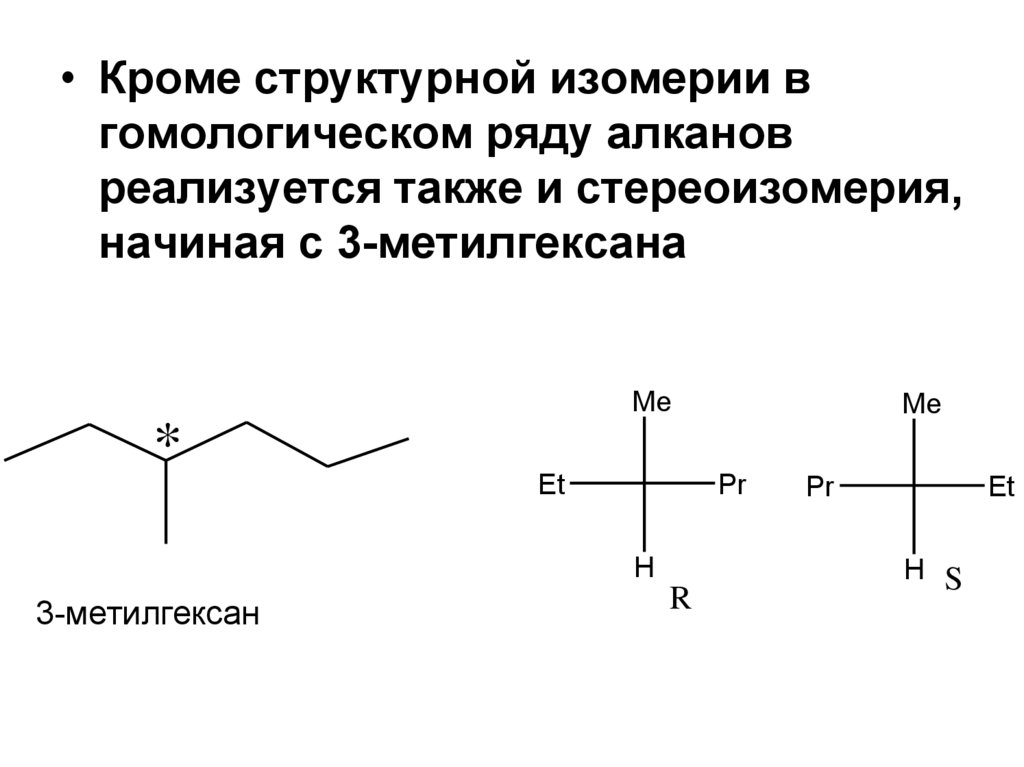
• Кроме структурной изомерии вгомологическом ряду алканов
реализуется также и стереоизомерия,
начиная с 3-метилгексана
Me
*
Et
Pr
H
3-метилгексан
Me
R
Pr
Et
H S
6.
• Наиболее вероятным является гомолизсвязей алканов.
• ПОЧЕМУ?
• Если от молекулы алкана таким
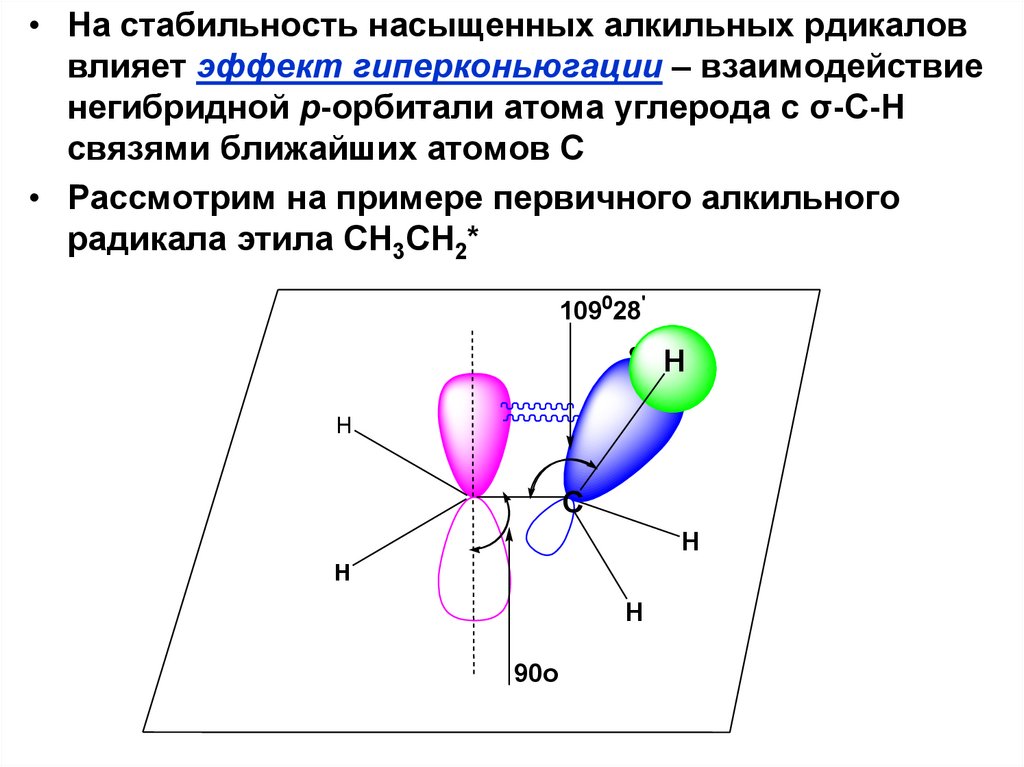
способом оторвать один атом водорода
образуется одновалентный алкильный
радикал – частица с атомом углерода,
имеющим неспаренный электрон. Общее
название – АЛКИЛЫ.
• Называются алкильные радикалы в
соответствии со схемой
АЛКАН
АН
+
ИЛ
=
АЛКИЛ
Например: этил, метил, пропил, бутил, амил и т.д.
7.
• При отщеплении двух атомов Н двухвалентные алкильные остатки,названия которых получают
изменением суффикса -ан на
суффикс –илиден или –ен, в
зависимости от того, у одного и того
же или у разных атомов С имеются
свободные валентности
8.
метилиден (метилен)H2 C
H3C
этилиден
HC
CH2-CH2
H3C H2C
HC
CH2-CH2-CH2
CH2-CH-CH3
H3C
C
CH3
этилен
пропилиден
1,3-пропен (1,3пропилен)
1,2-пропен (1,2пропилен)
изопропилиден
9.
• Существуют и соответствующиедвухвалентные радикалы –
бирадикалы. Когда оба электрона
бирадикала находятся у одного и
того же атома С – карбены
CH2
H3C
H3C
HC
C
CH3
карбен (метилен)
метилкарбен
диметилкарбен
10.
ПРИРОДНЫЕ ИСТОЧНИКИ АЛКАНОВ.ПРОМЫШЛЕННЫЕ И ЛАБОРАТОРНЫЕ
МЕТОДЫ СИНТЕЗА
НЕФТЬ
ПРИРОДНЫЙ
ГАЗ (80-90 % МЕТАН, А ТАКЖЕ ЭТАН,
ПРОПАН, БУТАН)
ПОПУТНЫЙ ГАЗ
БОЛОТНЫЙ ГАЗ
11.
• В ПРИРОДЕ АЛКАНЫ МОЖНО ОБНАРУЖИТЬ ВВЫСОКООРГАНИЗОВАННОЙ МАТЕРИИ
Н-ГЕПТАН
СМОЛА СОСЕН
С27Н56 – С37Н76
(С НЕЧЕТНЫМ
ЧЕСТВОМ С)
ПРИРОДНЫЕ ВОСКИ
КОЛИ-
Н-НОНАКОЗАН (С29Н60)
ЛИСТЬЯ КАПУСТЫ
С27Н56 И С29Н60
КОЖУРА ЯБЛОК
С27Н56 И С31Н62
ПЧЕЛИНЫЙ ВОСК
12.
СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ• 1. АЛКАНЫ В СМЕСИ С ЦИКЛОАЛКАНАМИ
ПОЛУЧАЮТ ГИДРИРОВАНИЕМ УГЛЯ (БИРГИУС,
1925 Г.).
ТОНКОДИСПЕРГИРОВАННЫЙ УГОЛЬ
(КАМЕННЫЙ ИЛИ ДРЕВЕСНЫЙ) ТЩАТЕЛЬНО
ПЕРЕМЕШИВАЮТ С КАТАЛИЗАТОРОМ (ОКСИДЫ
FE, MO, W, NI) И ПРИ ВЫСОКОЙ Т-РЕ ~ 450-470 0С И
ДАВЛЕНИИ ДО 300 АТМ НАСЫЩАЮТ ВОДОРОДОМ.
• ЕСЛИ К СМЕСИ УГЛЯ И КАТАЛИЗАТОРА
ДОБАВЛЯЮТ МАЗУТ – «СЖИЖЕНИЕ
(ГИДРОГЕНИЗАЦИЯ) УГЛЯ».
13.
• 2. М-Д ФИШЕРА-ТРОПША.• КАТАЛИТИЧЕСКОЕ ГИДРИРОВАНИЕ СО И
СО2, В ПРИСУТСТВИИ КАТАЛИЗАТОРОВ
(ТОНКОИЗМЕЛЬЧЕННЫЙ Ni).
4000C
СO2 + 4H2
СO + 2H2
Ni
CH4 + 2H2O
3000C
Ni
CH4 + H2O
МОЖНО ПОЛУЧАТЬ И ДРУГИЕ АЛКАНЫ ПРИ ПОДБОРЕ КАТАЛИЗАТОРОВ
И УСЛОВИЙ ПРОВЕДЕНИЯ РЕАКЦИИ ГИДРИРОВАНИЯ ( Т-РА,
ДАВЛЕНИЕ).
14.
ЛАБОРАТОРНЫЕ СПОСОБЫ ПОЛУЧЕНИЯАЛКАНОВ
• А.СПОСОБЫ ПОЛУЧЕНИЯ, НЕ
СОПРОВОЖДАЮЩИЕСЯ
ИЗМЕНЕНИЕМ СОДЕРЖАНИЯ С В
ПРОДУКТЕ РЕАКЦИИ В СРАВНЕНИИ
С ИСХОДНЫМ СУБСТРАТОМ
15.
1.РЕАКЦИИ МЕТАЛЛООРГАНИЧЕСКИХСОЕДИНЕНИЙ С ВОДОЙ
СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ СВЯЗЬ С-М,
ЛЕГКО РЕАГИРУЮТ С ВОДОЙ, ОБРАЗУЯ
УГЛЕВОДОРОДЫ
Al4C3 + 12H2O
3CH4 + 4Al(OH)3
метан
RM + H2O
RH
+ MOH
алкан
R-MgX + H2O
реактив
Гриньяра
RH
+ Mg(OH)X
алкан
16.
• 2) РЕАКЦИИ ГИДРИРОВАНИЯ ИВОССТАНОВЛЕНИЯ ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
• А) ГИДРИРОВАНИЕ АЛКЕНОВ, АЛКИНОВ,
ДИЕНОВ
H2, t0C
R'
R
Ni
R'
R
алкан
алкен
2H2, t0C
R
R'
Ni
алкин
R'
R
алкан
17.
• Б) ВОССТАНОВЛЕНИЕ ПРОИЗВОДНЫХУГЛЕВОДОРОДОВ
H2
R-CH2X
галогеналкан,
Х= Cl, Br, I
R-CH2X
галогеналкан,
Х= Cl, Br, I
kat
2HI, t0C
R-CH3 + HX
алкан
R-CH3 + HX + I2
алкан
18.
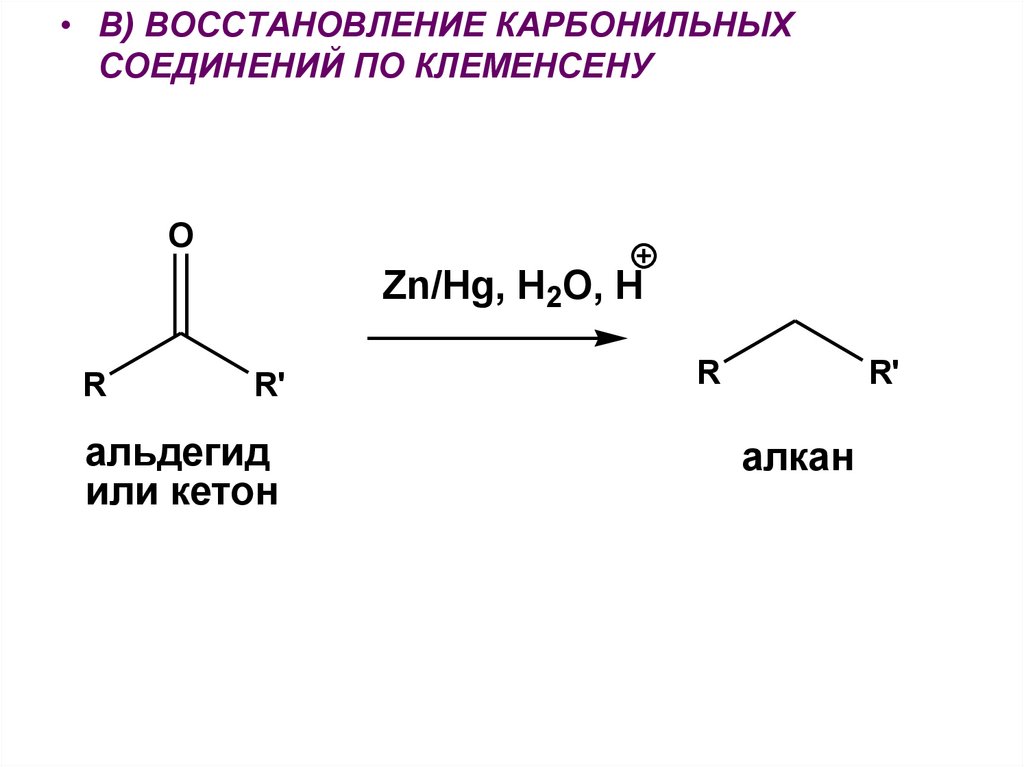
• В) ВОССТАНОВЛЕНИЕ КАРБОНИЛЬНЫХСОЕДИНЕНИЙ ПО КЛЕМЕНСЕНУ
O
Zn/Hg, H2O, H
R
R'
альдегид
или кетон
R
R'
алкан
19.
• Б. СПОСОБЫ ПОЛУЧЕНИЯ, ПОЗВОЛЯЮЩИЕУВЕЛИЧИТЬ СОДЕРЖАНИЕ С В ПРОДУКТЕ
РЕАКЦИИ В СРАВНЕНИИ С ИСХОДНЫМ
СУБСТРАТОМ
• 1) РЕАКЦИЯ ГАЛОГЕНАЛКАНОВ С МЕТАЛЛИЧЕСКИМ
НАТРИЕМ (СИНТЕЗ ВЮРЦА (1855 Г.)
• СИММЕТРИЧНЫЙ СИНТЕЗ:
2R-X
+ 2Na
галогеналкан,
Х= Cl, Br, I
R-R
алкан
+ 2NaX
20.
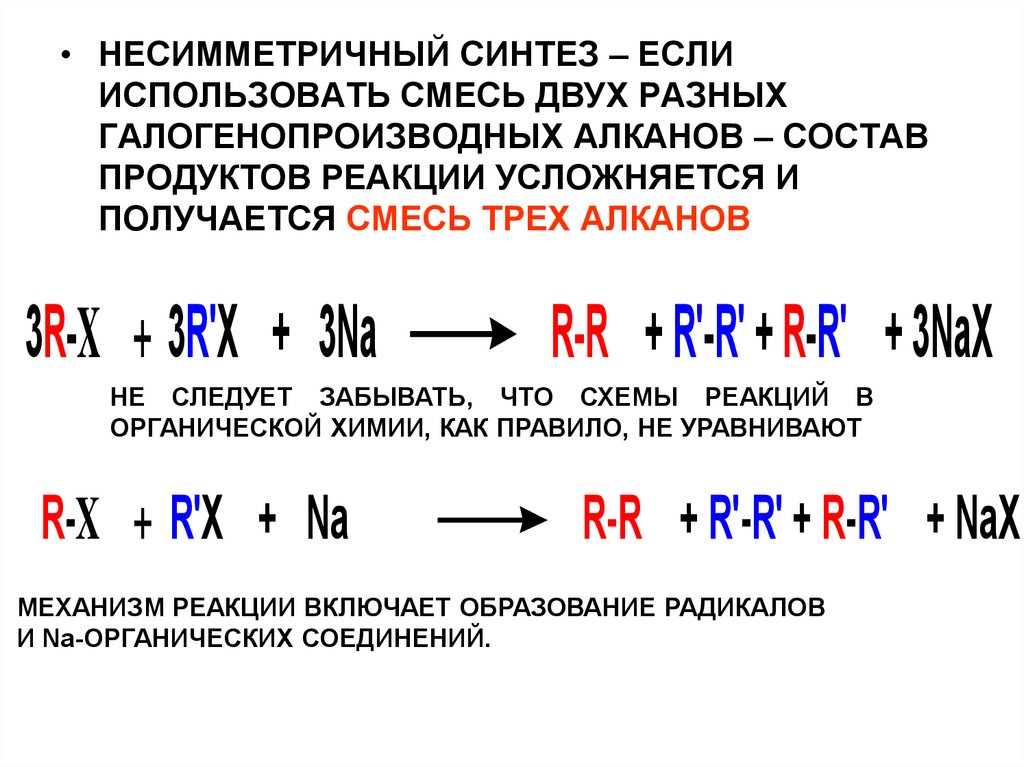
• НЕСИММЕТРИЧНЫЙ СИНТЕЗ – ЕСЛИИСПОЛЬЗОВАТЬ СМЕСЬ ДВУХ РАЗНЫХ
ГАЛОГЕНОПРОИЗВОДНЫХ АЛКАНОВ – СОСТАВ
ПРОДУКТОВ РЕАКЦИИ УСЛОЖНЯЕТСЯ И
ПОЛУЧАЕТСЯ СМЕСЬ ТРЕХ АЛКАНОВ
3R-X + 3R'X + 3Na
R-R + R'-R' + R-R' + 3NaX
НЕ СЛЕДУЕТ ЗАБЫВАТЬ, ЧТО СХЕМЫ РЕАКЦИЙ В
ОРГАНИЧЕСКОЙ ХИМИИ, КАК ПРАВИЛО, НЕ УРАВНИВАЮТ
R-X + R'X + Na
R-R + R'-R' + R-R' + NaX
МЕХАНИЗМ РЕАКЦИИ ВКЛЮЧАЕТ ОБРАЗОВАНИЕ РАДИКАЛОВ
И Na-ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
21.
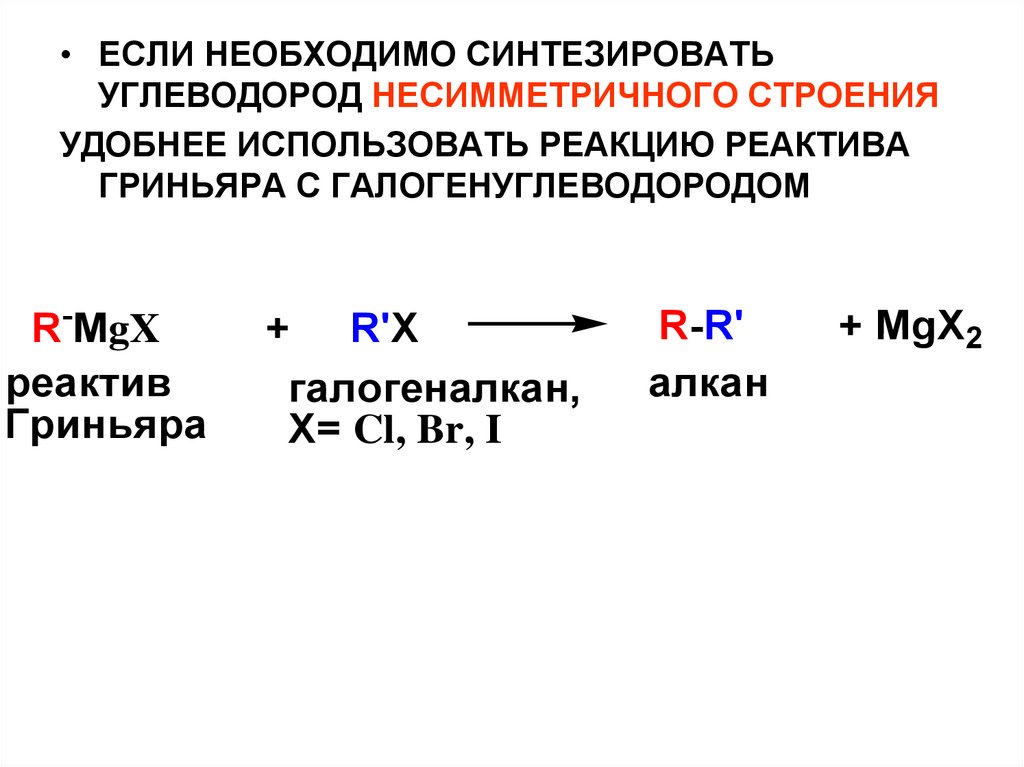
• ЕСЛИ НЕОБХОДИМО СИНТЕЗИРОВАТЬУГЛЕВОДОРОД НЕСИММЕТРИЧНОГО СТРОЕНИЯ
УДОБНЕЕ ИСПОЛЬЗОВАТЬ РЕАКЦИЮ РЕАКТИВА
ГРИНЬЯРА С ГАЛОГЕНУГЛЕВОДОРОДОМ
R-MgX
реактив
Гриньяра
+ R'X
галогеналкан,
Х= Cl, Br, I
R-R'
алкан
+ MgX2
22.
• 2) ЭЛЕКТРОЛИЗ СОЛЕЙ КАРБОНОВЫХ КИСЛОТ(РЕАКЦИЯ КОЛЬБЕ, 1849 Г.)
2R-COO Na + H2O
2R-COOH
электролиз
R-R
- CO2, NaOH
R-R
- CO2
МЕХАНИЗМ:
2R-COO - 2 e
2R-COO
2R-COO
2R
- CO2
R-R
23.
24.
• В. РЕАКЦИЯ, ПОЗВОЛЯЮЩАЯ СОКРАТИТЬСОДЕРЖАНИЕ УГЛЕРОДА В ПРОДУКТЕ РЕАКЦИИ
НА ОДИН АТОМ
• СПЛАВЛЕНИЕ СОЛЕЙ КАРБОНОВЫХ КИСЛОТ СО
ЩЕЛОЧЬЮ
250-300 0C
R
COO Na + NaOH
R H + Na2CO3
алкан
соль карбоновой
кислоты
25.
ФИЗИЧЕСКИЕ СВОЙСТВА И СРОЕНИЕАЛКАНОВ
АЛКАН
Т кип., Т пл., С
4
0
d20
0
метан
этан
пропан
н-бутан
н-пентан
н-гексан
н-гептан
н-октан
н-нонан
н-декан
н-ундекан
н-додекан
н-тридекан
н-тетрадекан
нпентадекан
н-эйкозан
нтриаконтан
С
-161,7
-88,6
-42,1
-0,5
36,1
68,7
98,4
125,7
-182,5
-183,3
-187,7
-138,7
-129,8
-95,3
-90,6
-56,8
150,8
174,0
195,8
216,3
235,4
253,7
270,6
-53,5
-29,7
-25,6
-9,6
-5,5
5,9
10,0
343,0
449,7
36,8
65,8
0,5572
0,6603
0,6837
0,7026
0,7177
0,7299
0,7402
0,7487
0,7564
0,7628
0,7685
26.
• Разветвления углеродной цеписущественно снижают Ткип. алкана.
Ткип. 36 0С
Ткип. 28 0С
Ткип.9 0С
27.
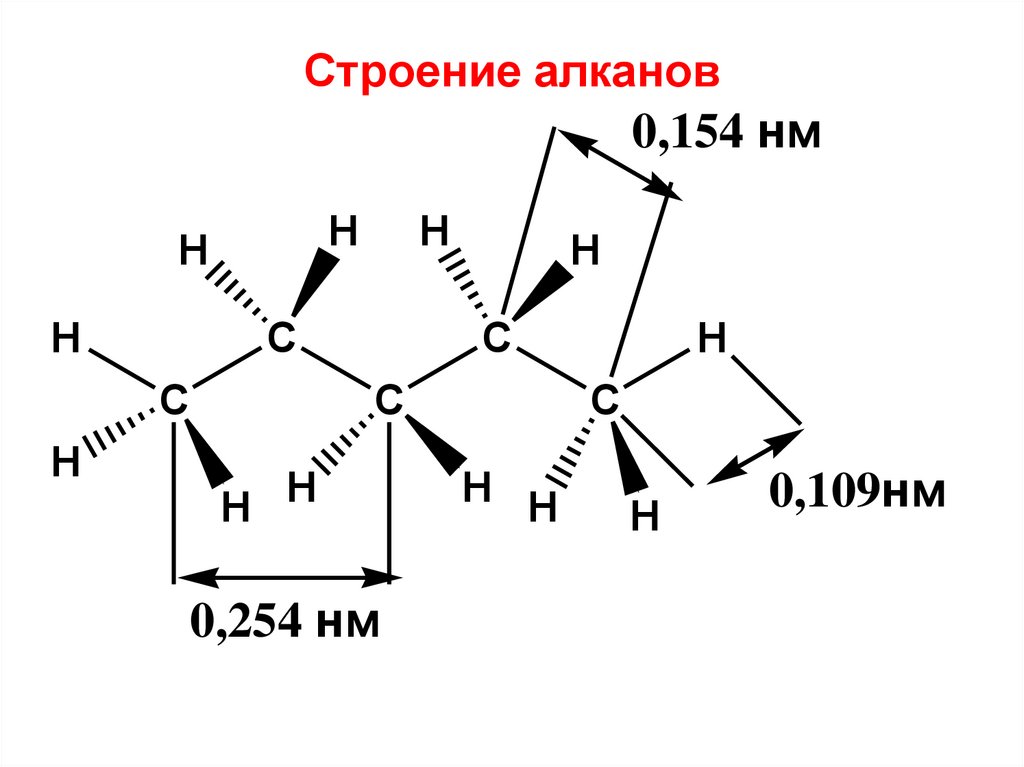
Строение алканов0,154 нм
H
H
H
C
C
H
H
H
C
C
H H
0,254 нм
H
C
H H
H
0,109нм
28.
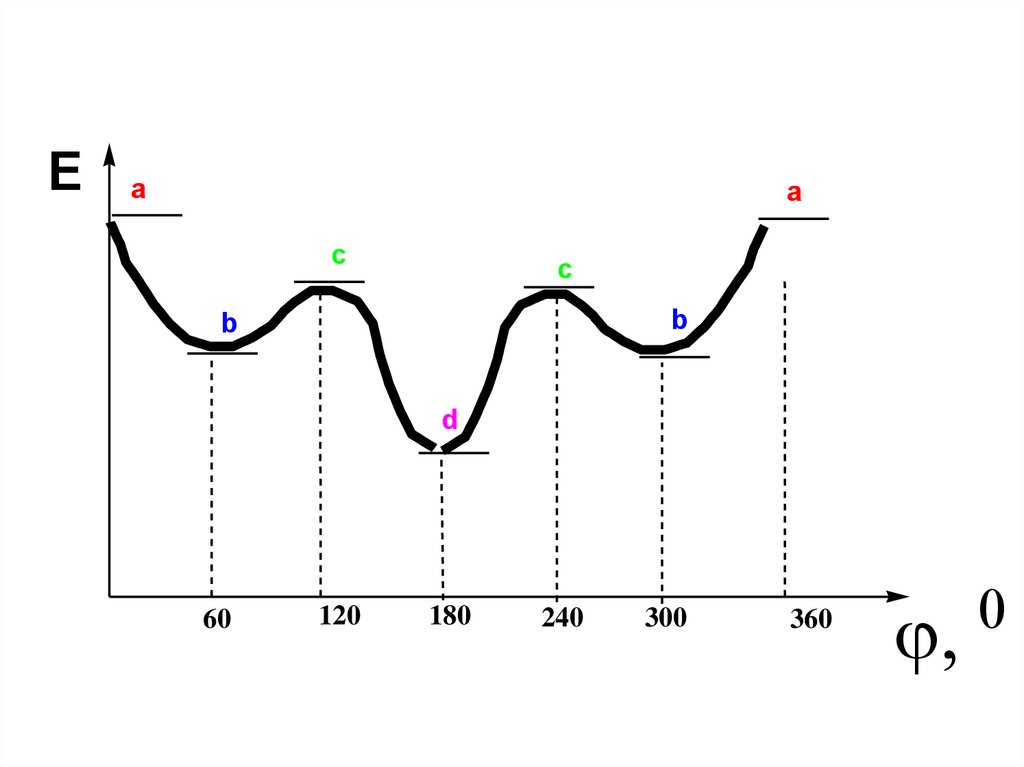
Конформационная изомерия29.
Ea
a
c
c
b
b
d
60
120
180
240
300
360
30.
• Конформация d - обозначается анти-(точнее,антиперипланарная), имеет наименьшую
энергию среди всех конформаций бутана;
• a- син (точнее, синперипланарная), имеет,
напротив, самую большую энергию
(вследствие взаимного отталкивания
сравнительно близко расположенных
метальных групп, связанных с атомами С(2) и
С(3);
b - гош или синклинальная конформация. Ей
соответствует промежуточное значение
энергии.
31.
Если применить аналогичные рассуждения кструктуре высших ациклических углеводородов с
неразветвленной цепью, то мы придем к выводу, что
наиболее вероятной (т.е. имеющей наименьшую
энергию) будет конформация, для которой
расположение атомов углерода соответствует
конформации бутана- анга -зигзагообразная
конформация
32.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ• Алканы построены только за счет σсвязей – σС-Н и σС-С
• Алканы – парафины
(«малодеятельные» - лат.).
Следовательно, они достаточно
инертны, что подтверждается тем, что
они, как правило, не
взаимодействуют с обычными
кислотами, щелочами, окислителями
33.
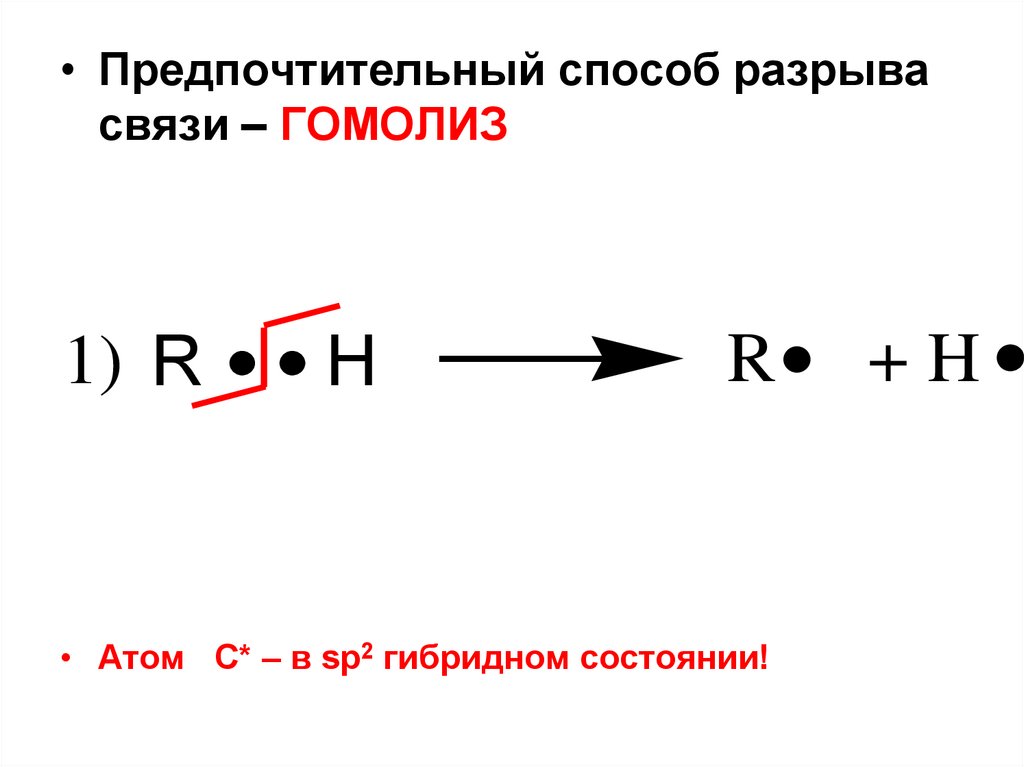
• Предпочтительный способ разрывасвязи – ГОМОЛИЗ
1) R
H
R
• Атом С* – в sp2 гибридном состоянии!
+H
34.
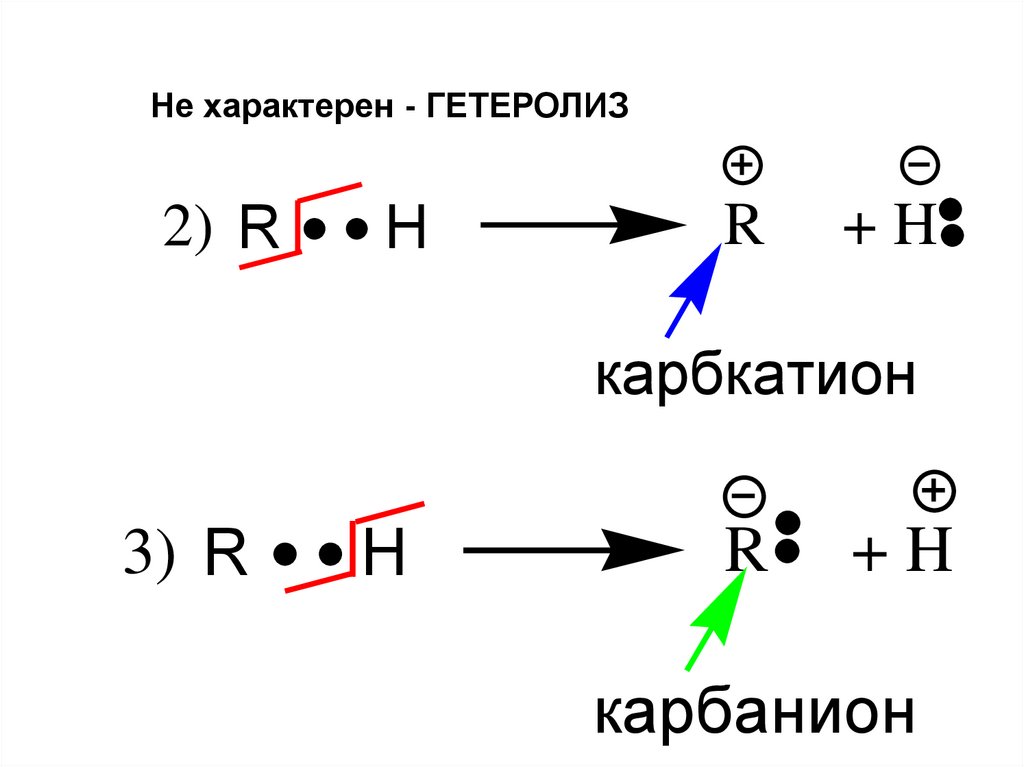
Не характерен - ГЕТЕРОЛИЗ2) R
H
R
+H
карбкатион
3) R
H
R
+H
карбанион
35.
ОБЩАЯ СХЕМА ПРЕВРАЩЕНИЙ АЛКАНОВH
H
H
R
R
термическое
дегидрирование и H
расщепление
H2
H
ие
н
ще
е
м
за
C
R
H
X
H
изом
е
риза
ц
ия
+
+ R
R
H
АЛКАН
R
C
R
H
R-H
R
R
H
C
R
C
R
CH3
36.
I. РЕАКЦИИ РАДИКАЛЬНОГОЗАМЕЩЕНИЯ
(SR)
Суть реакции – разрыв
s-связи С-Н
и
замещение атома Н на атом Cl
(монохлорирование) или Br
(монобромирование)
37.
38.
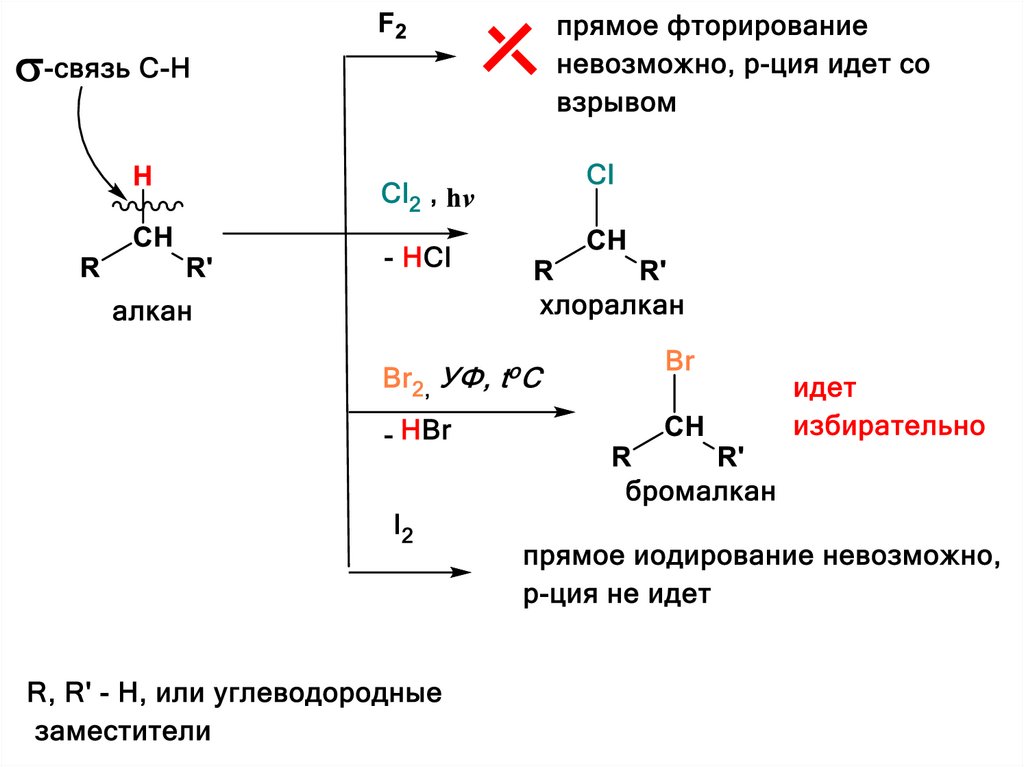
• ХЛОРИРОВАНИЕВ ТЕМНОТЕ АЛКАНЫ С ХЛОРОМ НЕ РЕАГИРУЮТ.
НА СВЕТУ (ОСОБЕННО ПРИ ОБЛУЧЕНИИ УФСВЕТОМ) РЕАКЦИЯ ИДЕТ БЫСТРО (ВОЗМОЖЕН
ВЗРЫВ).
Монохлорирование алканов приводит к
замещению 1 атома Н в молекуле на 1
атом Cl и выделению HCl.
В ОБЩЕМ ВИДЕ:
R H
алкан
Cl2
h
R Cl
хлоралкан
HCl
39.
• Все SR –РЕАКЦИИ ЯВЛЯЮТСЯРАДИКАЛЬНО-ЦЕПНЫМИ И ВКЛЮЧАЮТ 3
СТАДИИ:
• 1)ИНИЦИИРОВАНИЕ (ЗАРОЖДЕНИЕ РАДИКАЛОВ)
ГОМОЛИЗ CВЯЗИ Cl-Cl И ОБРАЗОВАНИЕ
РАДИКАЛОВ (АТОМОВ) ХЛОРА
Cl Cl
h
2Cl
40.
• 2) РОСТ ЦЕПИ (ВСЕ СТАДИИ ВЕДУТ КПОЯВЛЕНИЮ РАДИКАЛЬНЫХ ЧАСТИЦ)
R H
R
алкильный
радикал
Cl
Cl Cl
R
H
алкильный
радикал
Cl
R Cl
хлоралкан
Cl
41.
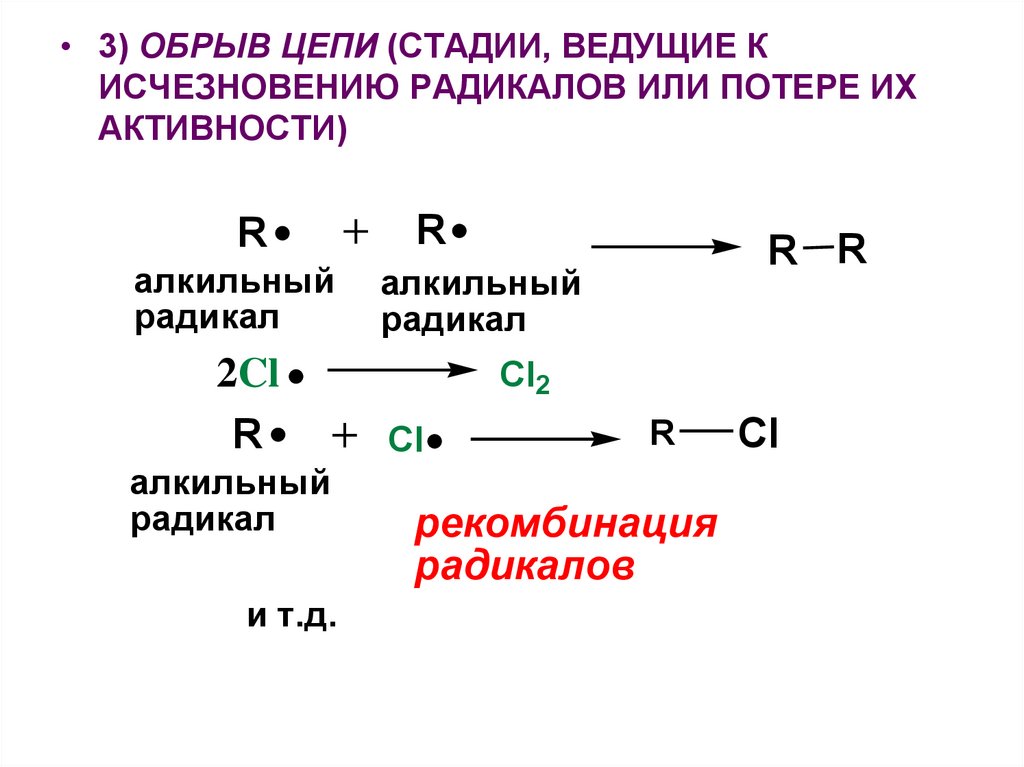
• 3) ОБРЫВ ЦЕПИ (СТАДИИ, ВЕДУЩИЕ КИСЧЕЗНОВЕНИЮ РАДИКАЛОВ ИЛИ ПОТЕРЕ ИХ
АКТИВНОСТИ)
R
алкильный
радикал
2Cl
R
алкильный
радикал
и т.д.
R
R R
алкильный
радикал
Cl2
Cl
R
рекомбинация
радикалов
Cl
42.
• РЕАКЦИЯ ХЛОРИРОВАНИЯ АЛКАНОВ –НЕИЗБИРАТЕЛЬНАЯ, Т.Е. ЗАМЕЩЕНИЕ ВОДОРОДА
ПРОИСХОДИТ ПРАКТИЧЕСКИ С ОДИНАКОВОЙ
СКОРОСТЬЮ ДЛЯ РАЗНЫХ (ПЕРВИЧ., ВТОРИЧ. ИЛИ
ТРЕТИЧ.) АТОМОВ C, ЧТО ПРИВОДИТ К ПОЛУЧЕНИЮ
СМЕСИ ХЛОРПРОИЗВОДЫХ АЛКАНА.
• НАПРИМЕР:
третичный
первичные
(одинаковые)
вторичный
первичный
2-метилбутан
43.
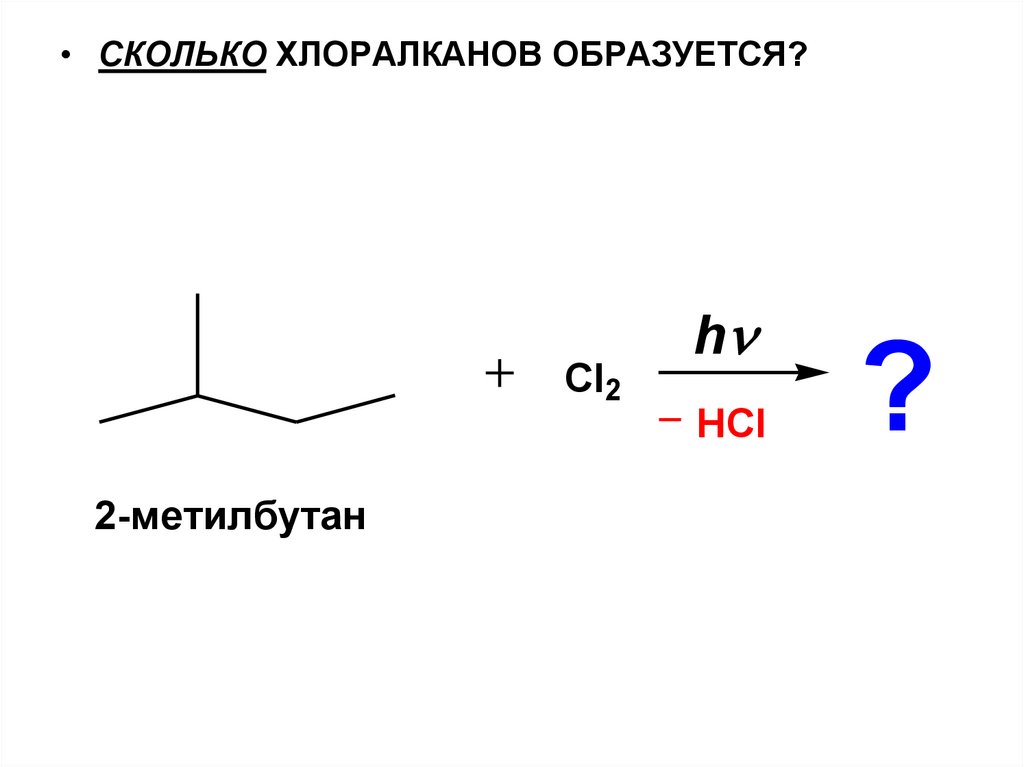
• СКОЛЬКО ХЛОРАЛКАНОВ ОБРАЗУЕТСЯ?Cl2
h
HCl
2-метилбутан
?
44.
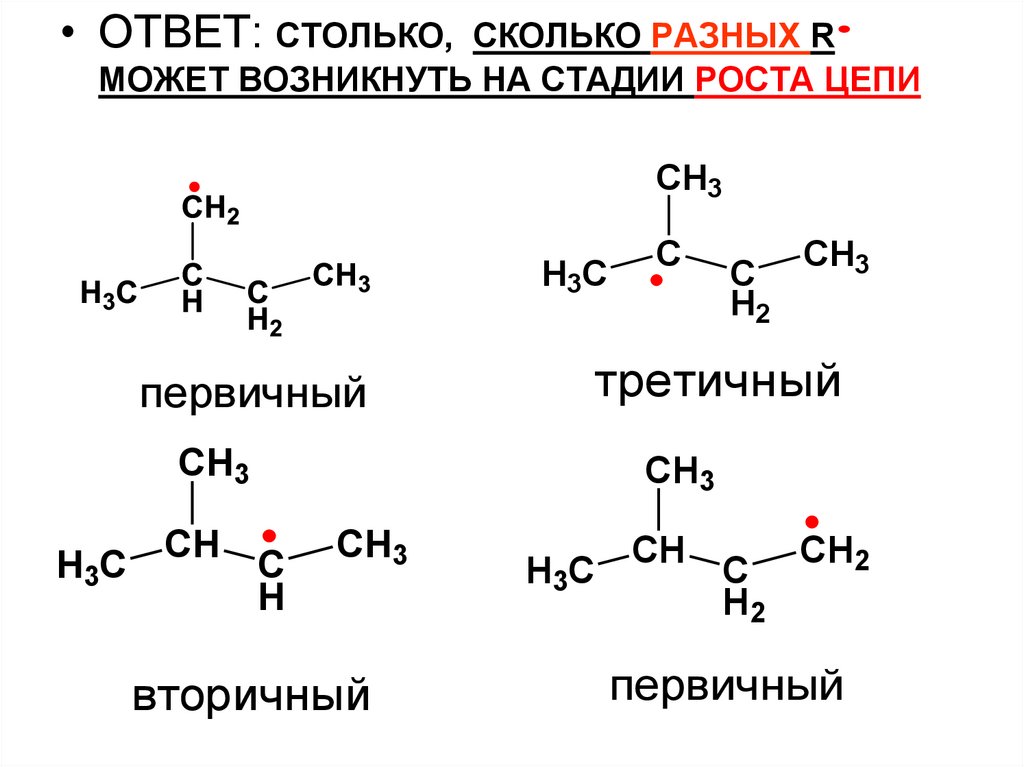
• ОТВЕТ: СТОЛЬКО,СКОЛЬКО РАЗНЫХ R
МОЖЕТ ВОЗНИКНУТЬ НА СТАДИИ РОСТА ЦЕПИ
CH3
H3C
первичный
H3C
C
H2
CH3
третичный
CH3
CH
C
CH3
C
H
CH3
вторичный
H3C
CH
C
H2
CH2
первичный
45.
ClCl2
h
HCl
2-метил-1-хлорбутан
2-метилбутан
Cl
Cl
2-метил-2-хлорбутан
Cl
2-метил-3-хлорбутан
2-метил-4-хлорбутан
46.
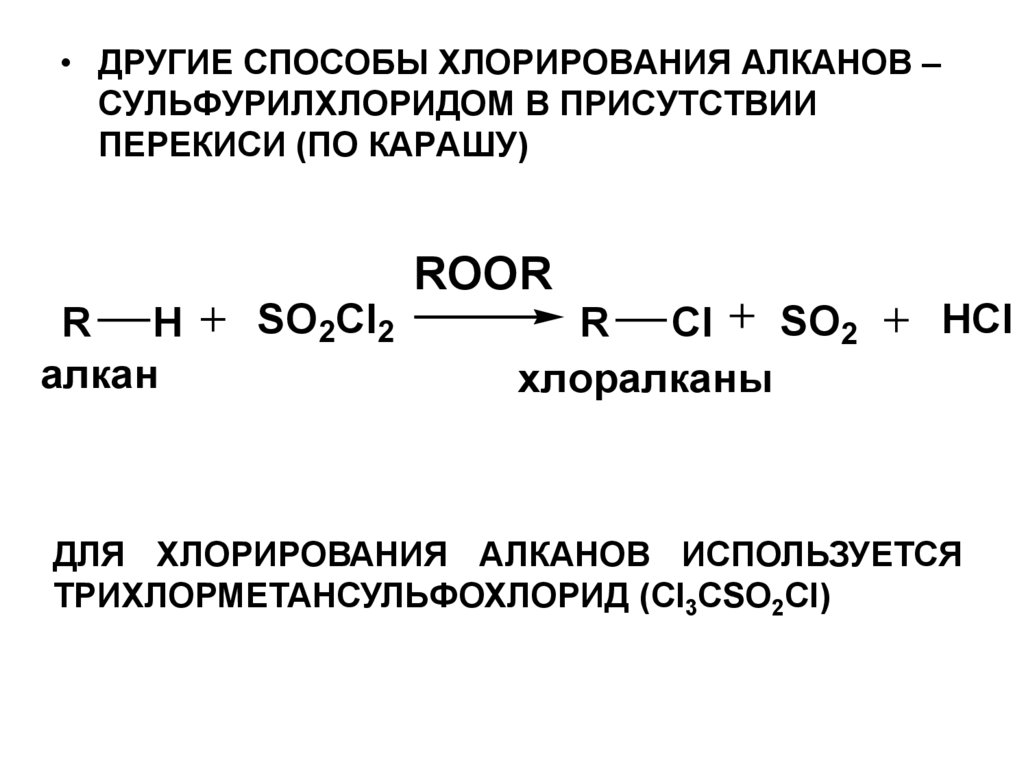
• ДРУГИЕ СПОСОБЫ ХЛОРИРОВАНИЯ АЛКАНОВ –СУЛЬФУРИЛХЛОРИДОМ В ПРИСУТСТВИИ
ПЕРЕКИСИ (ПО КАРАШУ)
ROOR
R H
алкан
SO2Cl2
SO2
R Cl
хлоралканы
HCl
ДЛЯ ХЛОРИРОВАНИЯ АЛКАНОВ ИСПОЛЬЗУЕТСЯ
ТРИХЛОРМЕТАНСУЛЬФОХЛОРИД (Cl3CSO2Cl)
47.
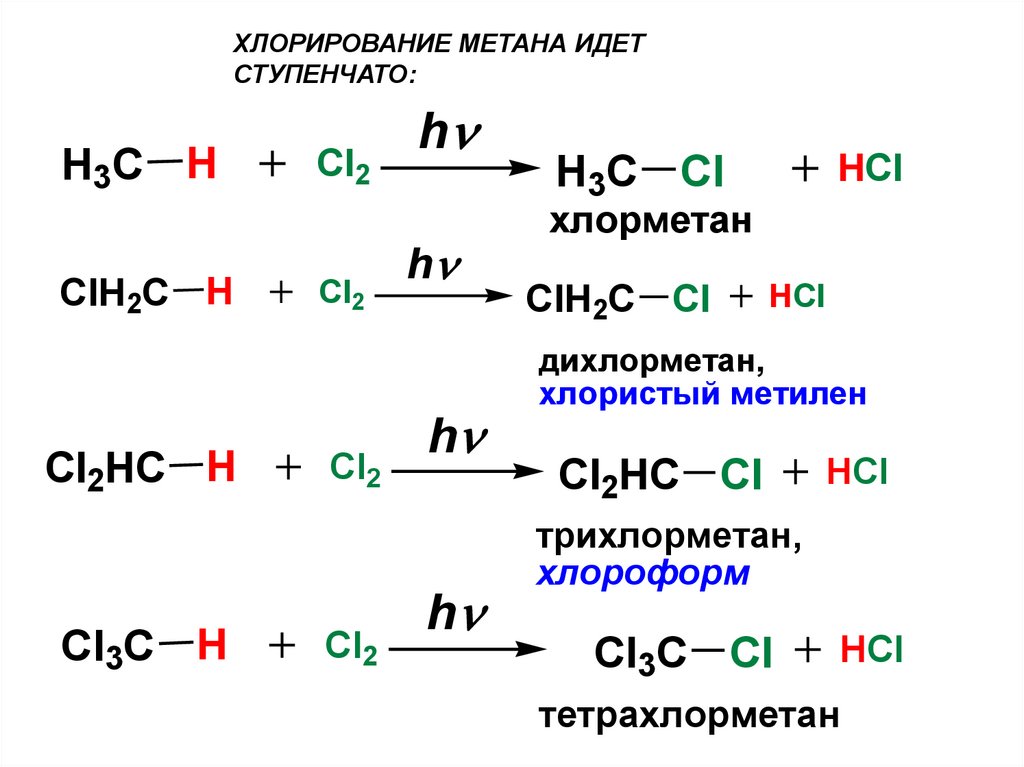
ХЛОРИРОВАНИЕ МЕТАНА ИДЕТСТУПЕНЧАТО:
H3C H
ClH2C H
Cl2HC H
Cl3C H
Cl2
Cl2
Cl2
Cl2
h
h
h
h
HCl
H3C Cl
хлорметан
ClH2C Cl
HCl
дихлорметан,
хлористый метилен
Cl2HC Cl
HCl
трихлорметан,
хлороформ
Cl3C Cl
HCl
тетрахлорметан
48.
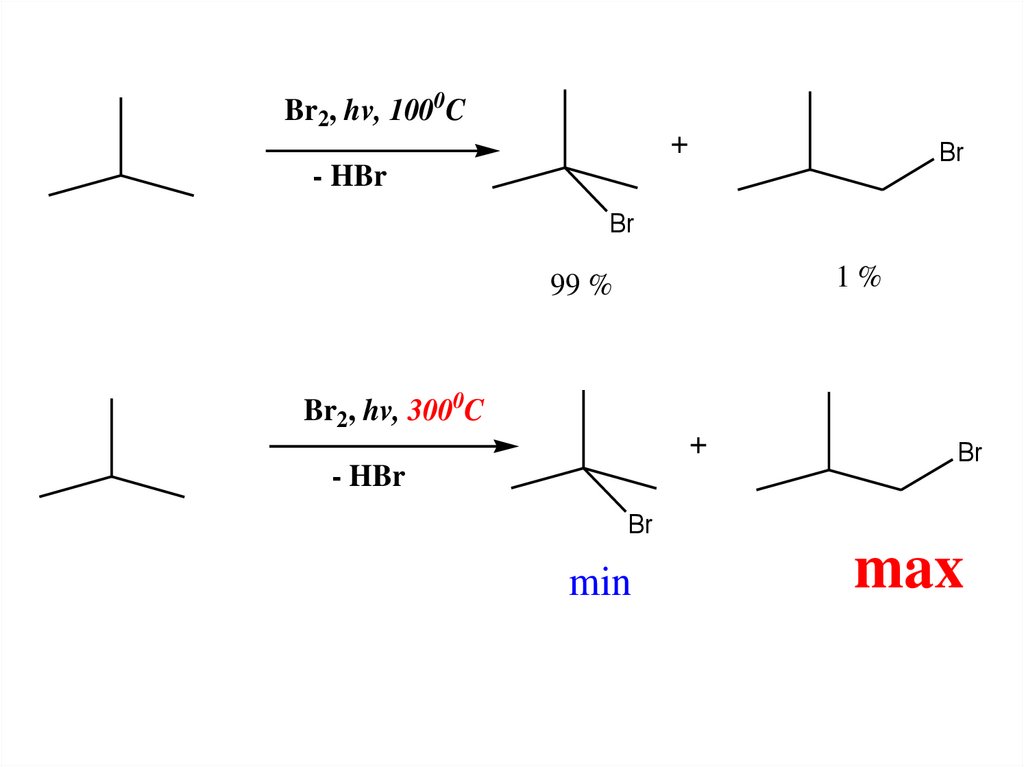
• БРОМИРОВАНИЕ.• ИДЕТ ТОЛЬКО ПРИ ОБЛУЧЕНИИ И НАГРЕВАНИИ.
БРОМИРОВАНИЕ ПРИ Т-РЕ ~ 1000C –
ИЗБИРАТЕЛЬНАЯ РЕАКЦИЯ.
• ЭТО ЗНАЧИТ, ЧТО В РЕАКЦИИ
ПРЕИМУЩЕСТВЕННО ОБРАЗУЕТСЯ ТАКОЙ
ПРОДУКТ БРОМИРОВАНИЯ АЛКАНА,
ОБРАЗОВАНИЮ КОТОРОГО СООТВЕТСТВУЕТ R ,
САМЫЙ СТАБИЛЬНЫЙ ИЗ ВСЕХ ВОЗМОЖНЫХ
• РЯД СТАБИЛЬНОСТИ РАДИКАЛОВ
• RТРЕТИЧНЫЙ > RВТОРИЧНЫЙ > RПЕРВИЧНЫЙ
49.
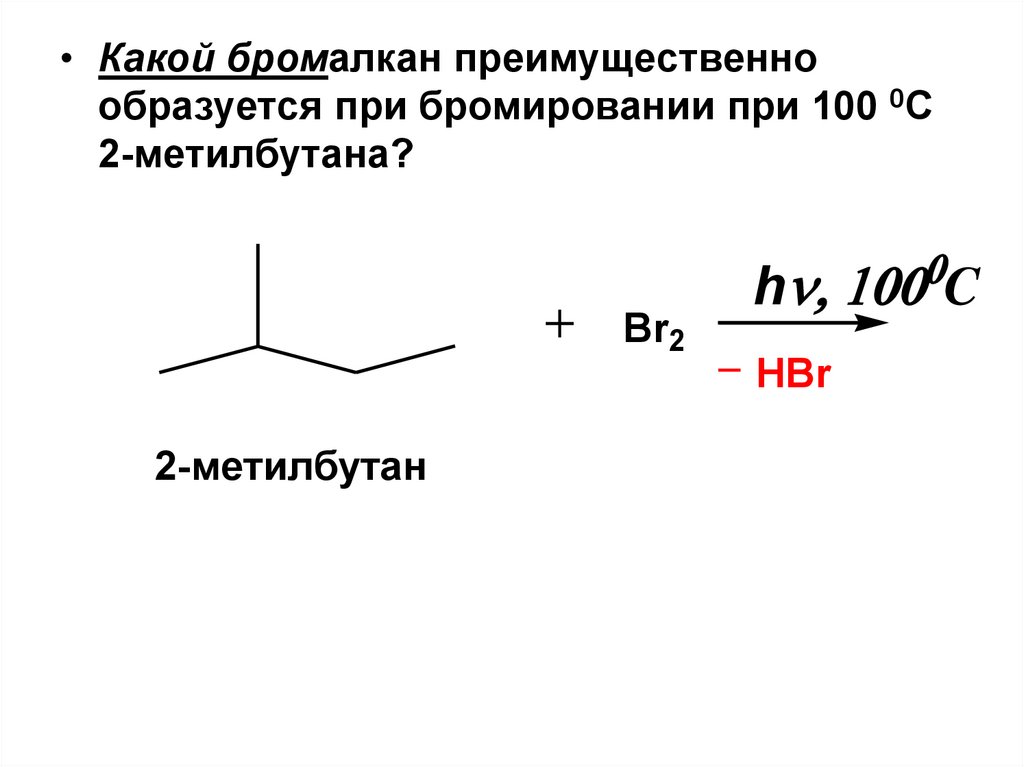
• Какой бромалкан преимущественнообразуется при бромировании при 100 0С
2-метилбутана?
Br2
h C
HBr
2-метилбутан
50.
• Самый стабильный из всехвозможных радикалов, которые
могут образоваться из 2метилбутана – третичный радикал
CH3
H3C
C
C
H2
CH3
51.
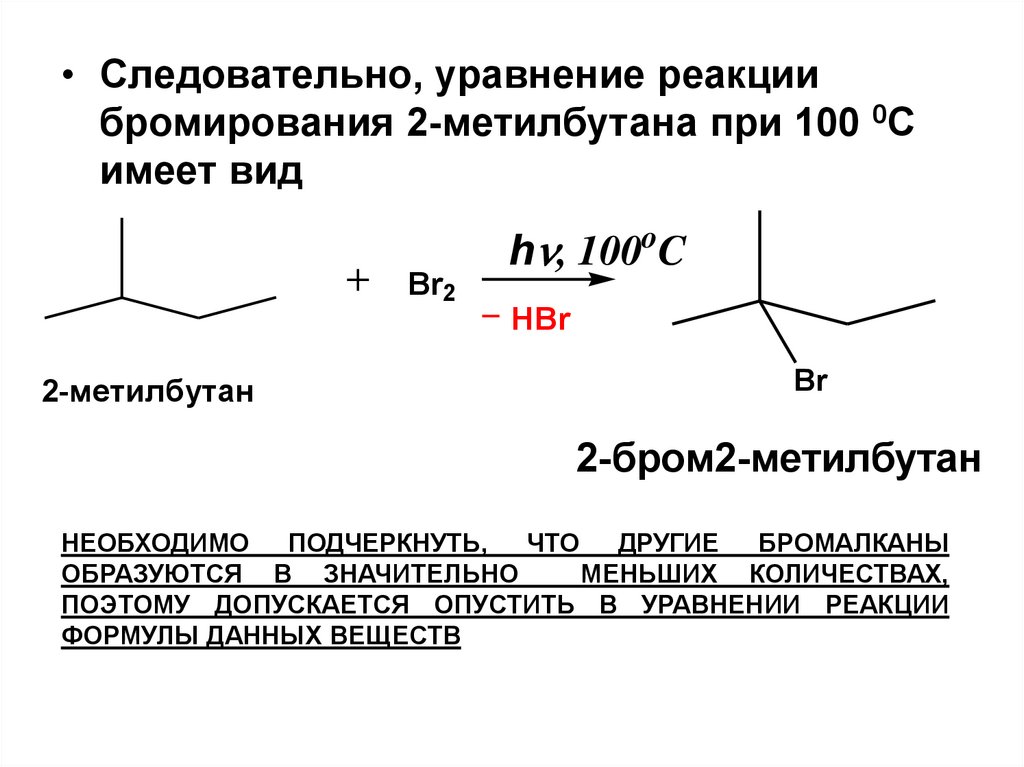
• Следовательно, уравнение реакциибромирования 2-метилбутана при 100 0С
имеет вид
Br2
h , 100oC
HBr
2-метилбутан
Br
2-бром2-метилбутан
НЕОБХОДИМО
ПОДЧЕРКНУТЬ,
ЧТО ДРУГИЕ
БРОМАЛКАНЫ
ОБРАЗУЮТСЯ В ЗНАЧИТЕЛЬНО
МЕНЬШИХ КОЛИЧЕСТВАХ,
ПОЭТОМУ ДОПУСКАЕТСЯ ОПУСТИТЬ В УРАВНЕНИИ РЕАКЦИИ
ФОРМУЛЫ ДАННЫХ ВЕЩЕСТВ
52.
• ОДНАКО, ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ ПРОВЕДЕНИЯРЕАКЦИИ НИВЕЛИРУЕТ РАЗНИЦУ В РЕАКЦИОННОЙ
СПОСОБНОСТИ С-Н СВЯЗЕЙ АЛКАНОВ И СОСТАВ И
СООТНОШЕНИЕ КОЛИЧЕСВА ОБРАЗОВАВШИХСЯ В
РЕАКЦИИ ПРОДУКТОВ ИЗМЕНЯЕТСЯ И СТАНОВИТСЯ
АНАЛОГИЧНЫМ РЕАКЦИИ ХЛОРИРОВАНИЯ.
• РЕАКЦИЯ СТАНОВИТСЯ НЕИЗБИРАТЕЛЬНОЙ.
БОЛЕЕ ТОГО, ПРЕИМУЩЕСТВЕННЫМ
ОКАЗЫВАЕТСЯ ОБРАЗОВАНИЕ ТАКИХ
ПРОДУКТОВ РЕАКЦИИ, КОТОРЫЕ
СООТВЕТСТВУЮТ МАКСИМАЛЬНОМУ (В
СТАТИСТИЧЕСКОМ СМЫСЛЕ) КОЛИЧЕСТВУ
СООВЕТСТВУЮЩИХ С-Н-СВЯЗЕЙ В
ИСХОДНОМ АЛКАНЕ.
53.
Br2, hv, 1000CBr
- HBr
Br
1%
99 %
Br2, hv, 3000C
Br
- HBr
Br
min
max
54.
Б) СУЛЬФОХЛОРИРОВАНИЕ АЛКАНОВ• АЛКАНЫ ПРИ ВЗАИМОДЕЙСТВИИ С SO2 И Cl2 ПРИ
ОБЛУЧЕНИИ УФ-СВЕТОМ ОБРАЗУЮТ
АЛКАНСУЛЬФОХЛОРИДЫ.
• РЕАКЦИЯ ИДЕТ ПО SR- МЕХАНИЗМУ.
АЛКАНСУЛЬФОХЛОРИДЫ ЯВЛЯЮТСЯ ХЛОРАНГИДРИДАМИ
АЛКАНСУЛЬФОНОВЫХ КИСЛОТ, NA-СОЛИ КОТОРЫХ ШИРОКО
ИСПОЛЬЗУЮТСЯ В КАЧЕСТВЕ МОЮЩИХ СРЕДСТВ: ЛАУРИЛСУЛЬФАТ
Na, ПАЛЬМИТИЛСУЛЬФАТ Nа И Т.Д.
55.
• В) СУЛЬФООКИСЛЕНИЕ АЛКАНОВ• РЕАКЦИЯ АЛКАНОВ С SO2 И O2,
ИНИЦИИРУЕМАЯ УФ-СВЕТОМ ПРИВОДИТ К
ОБРАЗОВАНИЮ АЛКАНСУЛЬФОКИСЛОТ
R H
алкан
SO2, O2, hv
- H2O
R SO2ОH
алкансульфокислота
56.
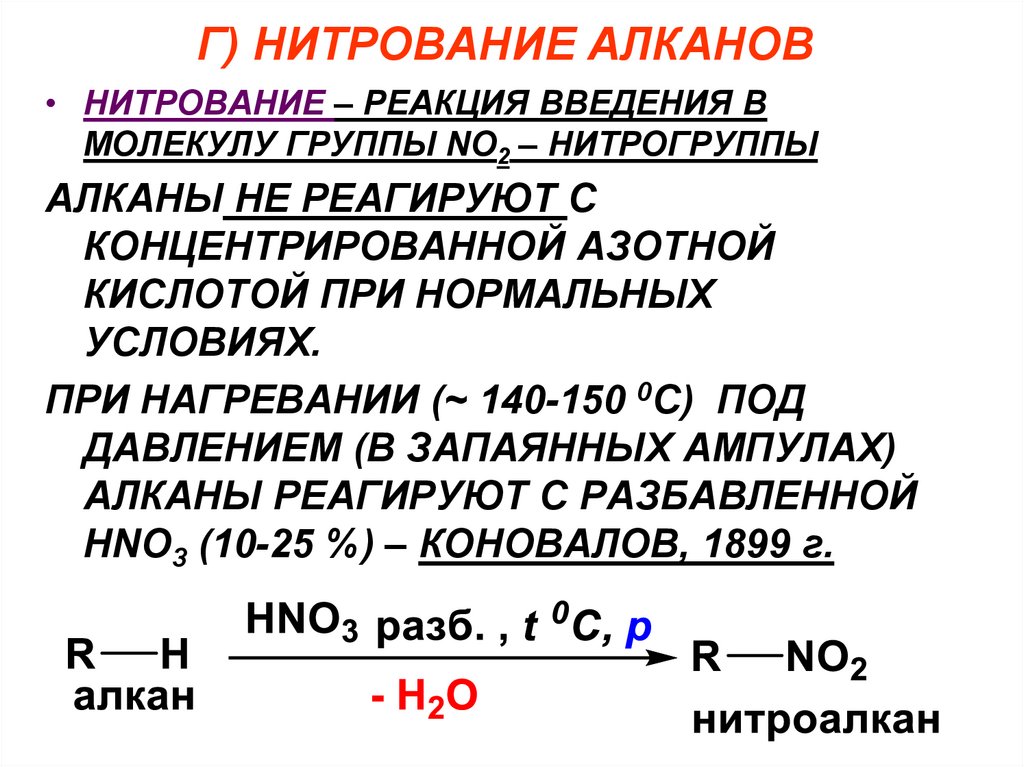
Г) НИТРОВАНИЕ АЛКАНОВ• НИТРОВАНИЕ – РЕАКЦИЯ ВВЕДЕНИЯ В
МОЛЕКУЛУ ГРУППЫ NO2 – НИТРОГРУППЫ
АЛКАНЫ НЕ РЕАГИРУЮТ С
КОНЦЕНТРИРОВАННОЙ АЗОТНОЙ
КИСЛОТОЙ ПРИ НОРМАЛЬНЫХ
УСЛОВИЯХ.
ПРИ НАГРЕВАНИИ (~ 140-150 0C) ПОД
ДАВЛЕНИЕМ (В ЗАПАЯННЫХ АМПУЛАХ)
АЛКАНЫ РЕАГИРУЮТ С РАЗБАВЛЕННОЙ
HNO3 (10-25 %) – КОНОВАЛОВ, 1899 г.
57.
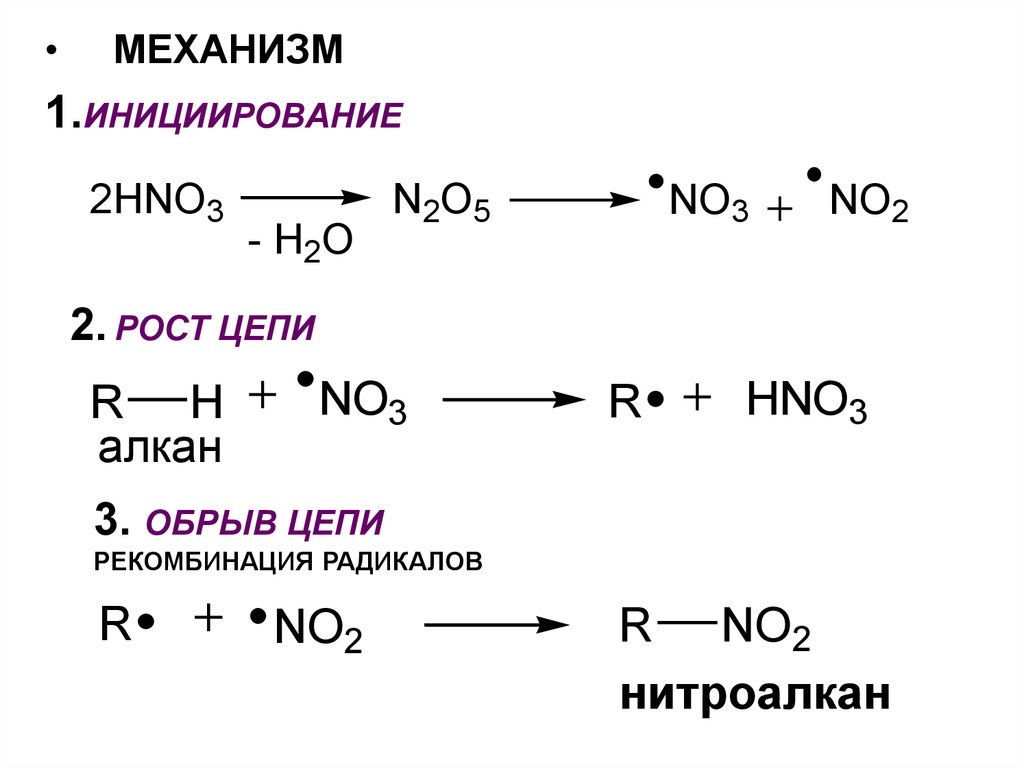
МЕХАНИЗМ
1.ИНИЦИИРОВАНИЕ
2HNO3
- H2O
N2O5
NO3
NO2
2. РОСТ ЦЕПИ
R H
алкан
NO3
R
HNO3
3. ОБРЫВ ЦЕПИ
РЕКОМБИНАЦИЯ РАДИКАЛОВ
R
NO2
R NO2
нитроалкан
58.
• Преимущественно в реакцииКоновалова образуются третичные
нитропроизводные.
• При отсутствии третичный атомов С –
вторичные и менее
реакционоспособными являются
первичные С-Н связи
59.
• ВМЕСТО HNO3 МОГУТ БЫТЬИСПОЛЬЗОВАНЫ NO, NO2, N2O3, N2O5, N2O4
• НИТРОВАНИЕ МОЖЕТ БЫТЬ
ОСУЩЕСТВЛЕНО В ГАЗОВОЙ ФАЗЕ
(ГЕСС, 1930 Г.) – РЕАКЦИЯ ПРОВОДИТСЯ
В РЕАКТОРЕ ПРИ 420-480 0С, ВРЕМЯ
КОНТАКТА РЕАГЕНТА С СУБСТРАТОМ –
0,2-2 С, ЗАТЕМ РЕЗКОЕ ОХЛАЖДЕНИЕ
ПРОДУКТОВ. ПРИ ЭТОМ ОБРАЗУЕТСЯ
СМЕСЬ НИТРОАЛКАНОВ РАЗЛИЧНОГО
СТРОЕНИЯ И СОСТАВА С ДРУГИМИ
ПРОИЗВОДНЫМИ АЛКАНОВ, Т.К.
ПРОИСХОДИТ ДЕГРАДАЦИЯ И
ОКИСЛЕНИЕ АЛКАНОВ.
60.
Д) ОКИСЛЕНИЕ АЛКАНОВ• ИСЧЕРПЫВАЮЩЕЕ ОКИСЛЕНИЕ
АЛКАНОВ – ГОРЕНИЕ – ПРИВОДИТ
ОБРАЗОВАНИЮ CO2 И Н2О С
ВЫДЕЛЕНИЕМ БОЛЬШОГО КОЛИЧЕСТВА
ТЕПЛА.
• НЕПОЛНОЕ СГОРАНИЕ АЛКАНОВ
ПРИВОДИТ К ПОЛУЧЕНИЮ СО, СН2О,
ДРУГИХ АЛЬДЕГИДОВ, КАРБОНОВЫХ
КИСЛОТ.
• СМЕСИ АЛКАНОВ С ВОЗДУХОМ ИЛИ О2
ВЗРЫВООПАСНЫ.
61.
II. РЕАКЦИИ ТЕРМИЧЕСКОГОРАСЩЕПЛЕНИЯ И ДЕГИДРИРОВАНИЯ
• При т-ре > 500 0С алканы способны
претерпевать расщепление с разрывом связей
С-Н и С-С.
• Высшие алканы более легко подвержены этой
реакции, которая называется крекингом.
• Различают крекинг – термический и
каталитический
• Каталитический крекинг осуществляется при
более низкой т-ре.
• Используется крекинг в промышленности для
производства моторных топлив.
• Крекинг СН4 происходит при т-ре 800-1000 0С и
применяется для получения ацетилена
62.
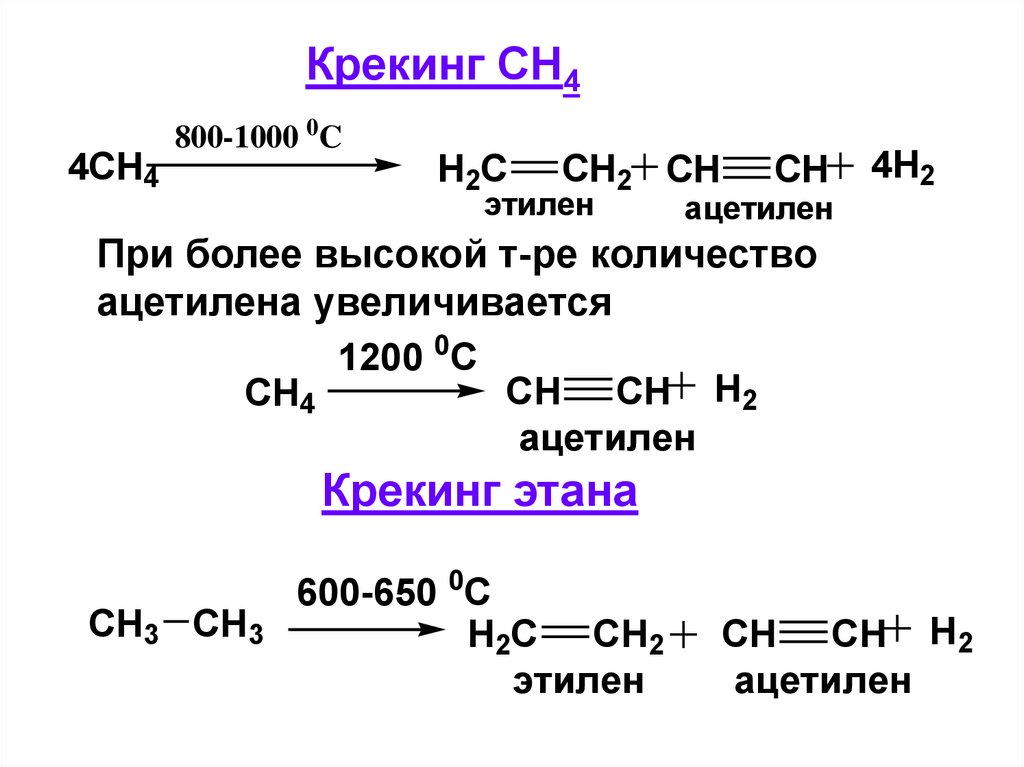
Крекинг СН44CH4
800-1000 0C
H2C
CH2 CH
этилен
CH
ацетилен
4H2
При более высокой т-ре количество
ацетилена увеличивается
1200 0C
CH CH H2
CH4
ацетилен
Крекинг этана
CH3 CH3
600-650 0C
H2C CH2
этилен
CH CH H2
ацетилен
63.
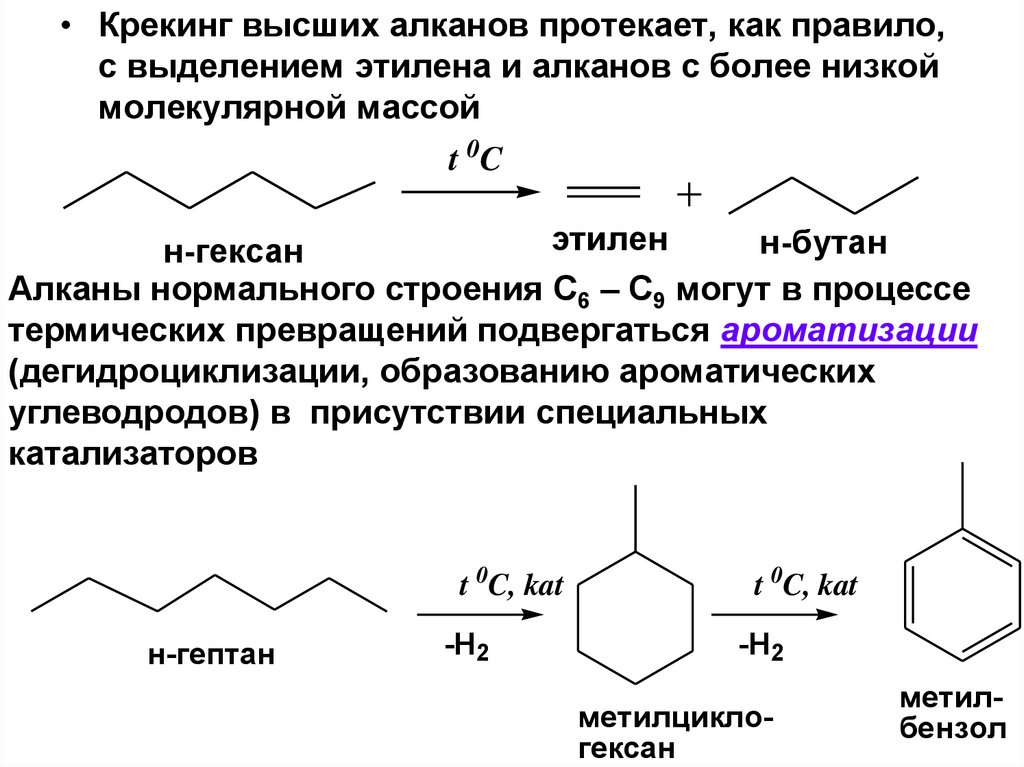
• Крекинг высших алканов протекает, как правило,с выделением этилена и алканов с более низкой
молекулярной массой
t 0C
этилен
н-бутан
н-гексан
Алканы нормального строения С6 – С9 могут в процессе
термических превращений подвергаться ароматизации
(дегидроциклизации, образованию ароматических
углеводродов) в присутствии специальных
катализаторов
t 0C, kat
н-гептан
-H2
t 0C, kat
-H2
метилциклогексан
метилбензол
64.
• Термические некаталитические процессы протекают порадикальному механизму, которые могут подвергать
радикалы таким дальнейшим превращениям как:
• 1) β-распад – гомолиз С-С связи после
β-атома
гомолиз С-С связи после атома
H2
C
R
CH2
R
этилен
65.
2. Диспропорционирование радикалов –процесс с участием 2-х радикалов
атом
H
H
CH
C
R
H
R
CH2
R
CH2
R
алкен
алкан
66.
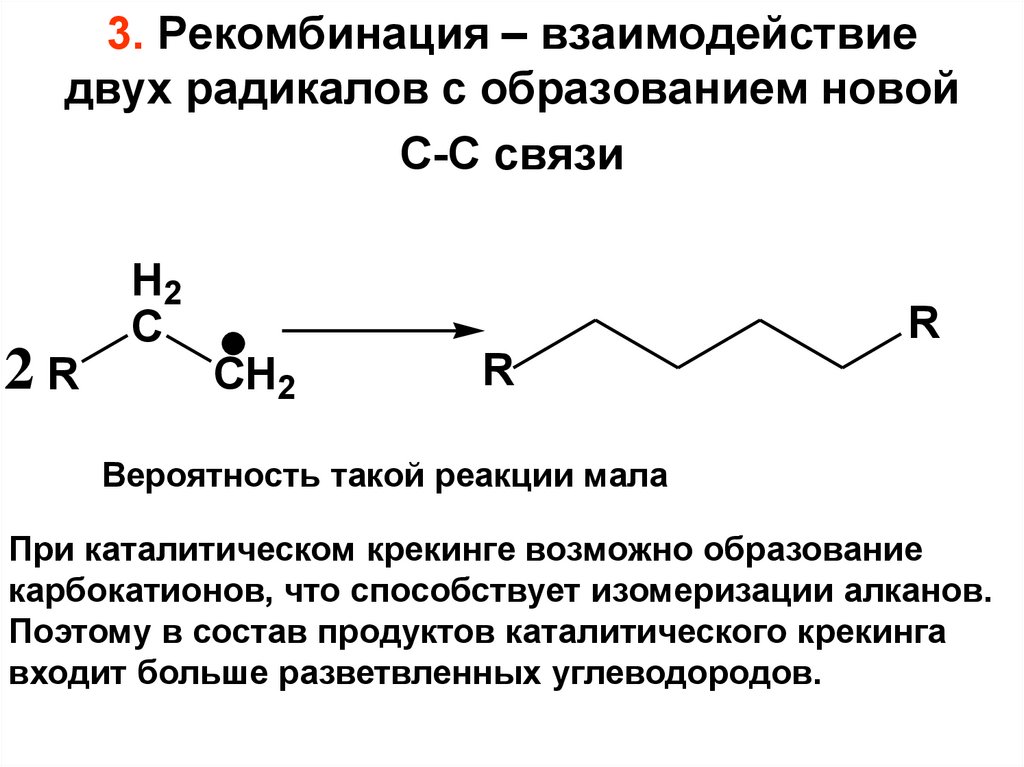
3. Рекомбинация – взаимодействиедвух радикалов с образованием новой
С-С связи
2R
H2
C
R
CH2
R
Вероятность такой реакции мала
При каталитическом крекинге возможно образование
карбокатионов, что способствует изомеризации алканов.
Поэтому в состав продуктов каталитического крекинга
входит больше разветвленных углеводородов.
67.
III. Реакции изомеризации алканов• Изомеризация – процесс превращения
нормальных алканов в разветвленные алканы
• Изомеризация алканов может протекать в
газовой фазе на кислотных катализаторах.
Более эффективно – в растворах в
присутствии сильных электрофильных
реагентов (в «суперкислых средах»).
н-Алкан
A
изо-Алкан
68.
• Кислоты А – кислоты Льюиса - AlCl3,AlBr3, BF3, а также суперкислоты SbF5 +
HF, SbF5 + HSO3F, BF3+HF, SO3+HF+SbF5
• Процесс идет тем легче, чем > С в алкане
69.
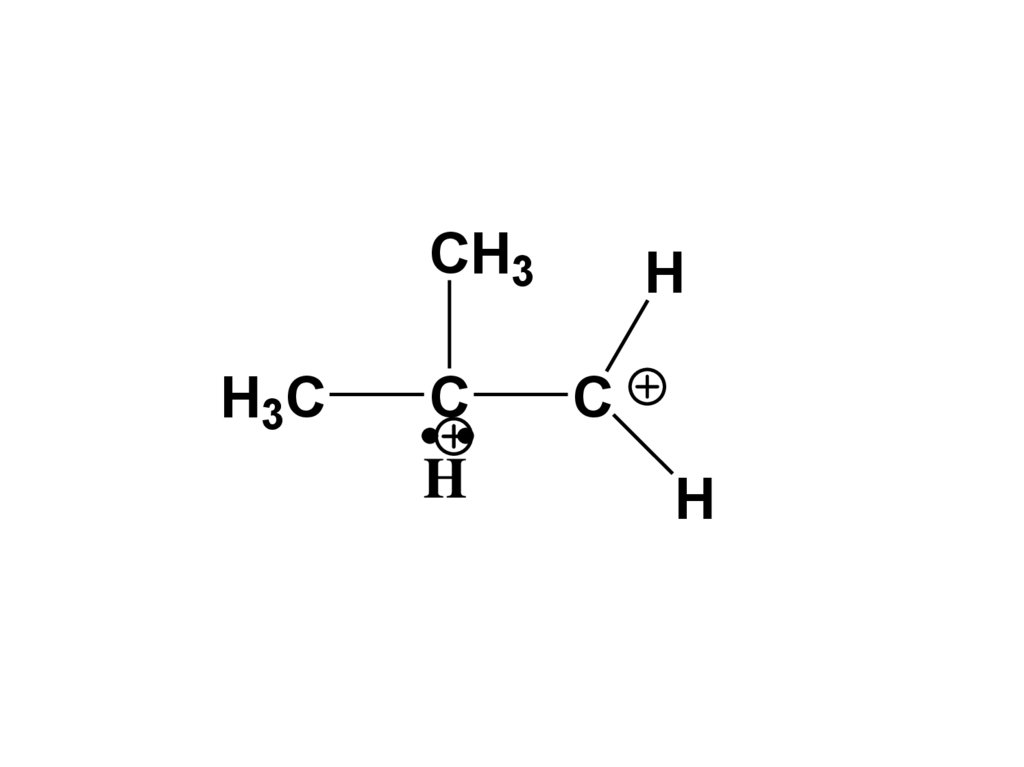
• Предполагается, что происходитобразование в качестве промежуточной
частицы 3-х центровой 2-х электронной
связи с пентакоординированным атомом
С, которая ведет к получению
карбокатионов.
H
R
CH3
H
R
H
R
CH2
C
H
H
R
CH4
H2
70.
•Перегруппировка карбокатионов ведет к получениюразветвленных алканов
CH3
H3C
C
H
C
CH3
H
H3C
H
C
H
H
H
H3C
C
C
H
H3C
CH3
H3C
C
H
C
H
H
C
H
H
и т.д.
71.
CH3H3C
C
H
H
C
H
72.
СВЯЗЬ РЕАКЦИОННОЙ СПОСОБНОСТИ
АЛКАНОВ СО СТРОЕНИЕМ И
ОТНОСИТЕЛЬНОЙ СТАБИЛЬНОСТЬЮ
АЛКИЛЬНЫХ РАДИКАЛОВ
1) Реакционная способность алканов
увеличивается при переходе от алканов
нормального строения к изоалканам и алканам
с большей молекулярной массой.
Две причины:
а). Увеличение числа σ-связей в молекуле
приводит к усилению электронодонорных
свойств
б). Уменьшение энергии С-С и С-Н связей в
зависимости от числа С-С связей и
разветвленности углеродного скелета
73.
СоединениеH3 C
H
ED,
Eср,
Соединение
кДж/ кДж/
моль моль
427,4
H3C CH3
H3C CH H
CH3
372,9
CH3
356,1
H3C C H
CH3
H2C HC H2C
H3C
HC CH3
322,6
310,0
CH3
415
251,4
(CH3)3C
H
ED,
Eср,
кДж/ кДж/
моль моль
347,8
C(CH3)3
338
74.
• 2. Реакционная способность к разрывуС-Н связей изменяется в зависимости от
стабильности УВ радикалов,
образующихся на стадиях роста цепи при
гомолитическом разрыве.
• Рассмотрим строение радикалов
sp2
R
C
R
R
75.
• На стабильность насыщенных алкильных рдикаловвлияет эффект гиперконьюгации – взаимодействие
негибридной р-орбитали атома углерода с σ-С-Н
связями ближайших атомов С
• Рассмотрим на примере первичного алкильного
радикала этила СН3СН2*
109028'
H
H
C
H
H
H
90o
76.
• Эффект гиперконьюгации обозначаетсяH
H
C
H
CH2
77.
• Чем с большим числом С-Н связейвозможно сопряжение неспаренного
электрона радикальной частицы, тем
стабильнее становится такой радикал.
• Максимально данный эффект оказывает
стабилизирующее влияние в случае
вторичных и, тем более, третичных
радикалах в сравнении с первичным.
78.
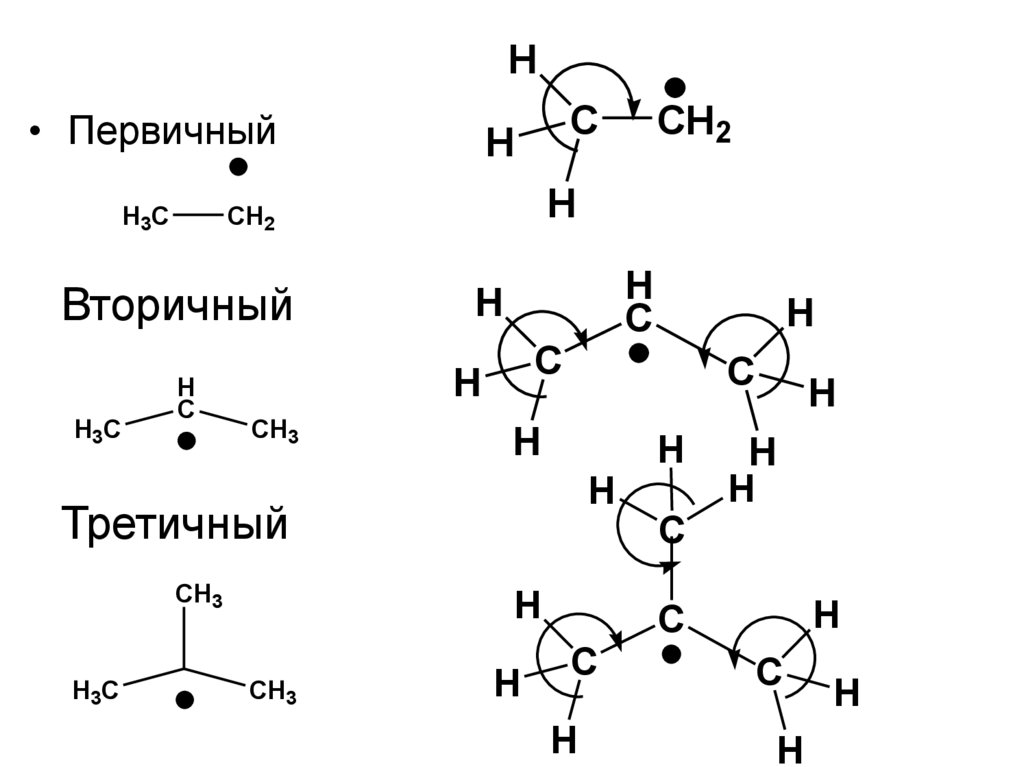
H• Первичный
H3C
H
H
C
H
C
H
C
H
H
H
Третичный
CH3
H3C
H
H
H
C
H
CH3
H
C
H
CH3
CH2
H
CH2
Вторичный
H3C
C
H
H
C
C
H
C
H
H
79.
• Поэтому РЯД СТАБИЛЬНОСТИ АЛКИЛЬНЫХРАДИКАЛОВ
• RПЕРВИЧ. < RВТОРИЧ. < RТРЕТИЧ.
Относительную реакционную способность связи С-Н при
бромировании (реакция избирательная!) можно оценить при
сравнении скорость замещения Н на Br
Rпервич.
Rвторич.
1
32
Rтретич
1600
.
80.
• ЕЩЕ БОЛЕЕ СТАБИЛЬНЫМИ ЯВЛЯЮТСЯРАДИКАЛЫ, КОТОРЫЕ ОБРАЗУЮТСЯ ЗА СЧЕТ
α
ГОМОЛИЗА С-Н СВЯЗЕЙ В -ПОЛОЖЕНИЯХ ПО
ОТНОШЕНИЮ К КРАТНОЙ СВЯЗИ ИЛИ
АРОМАТИЧЕСКОМУ ФРАГМЕНТУ МОЛЕКУЛЫ
(АЛЛИЛЬНЫЕ, БЕНЗИЛЬНЫЕ И
ПРОПАРГИЛЬНЫЕ РАДИКАЛЫ).
• В ТАКОМ СЛУЧАЕ НА СТАБИЛЬНОСТЬ
РАДИКАЛЬНЫХ ЧАСТИЦ БОЛЬШОЕ ВЛИЯНИЕ
ОКАЗЫВАЕТ ТО, ЧТО ОНИ ЯВЛЯЮТСЯ
СОПРЯЖЕННЫМИ ЧАСТИЦАМИ.
81.
H2CC
H
CH2
аллильный
sp2
H
H
C
H
H
H
82.
RC
C
CH2
пропаргильный
83.
• ЗАПОМНИТЬ: СОПРЯЖЕНИЕ ВСЕГДАНАИБОЛЕЕ ЭФФЕКТИВНО ВЛИЯЕТ
НА СТАБИЛИЗАЦИЮ ЧАСТИЦЫ
(РАДИКАЛА, КАРБОКАТИОНА И ДР.)!
84.
• C УЧЕТОМ СОПРЯЖЕННЫХ ЧАСТИЦВЕСЬ РЯД СТАБИЛЬНОСТИ
РАДИКАЛОВ
• RПЕРВИЧ.< RВТОРИЧ. < RТРЕТИЧ. < RАЛЛИЛЬН.
< RБЕНЗИЛЬН.
85.
• Почему не избирательна реакцияхлорирования алканов?
• В радикальных реакциях
избирательность (региоселективность)
сильно зависит от активности реагента.
Поэтому реакциях с очень активными
радикалами (F, Cl) результат реакции не
зависит от стабильности промежуточнообразующих алкильных радикалов
86.
СТЕРЕОХИМИЧЕСКИЙ РЕЗУЛЬТАТ РЕАКЦИЙРАДИКАЛЬНОГО ЗАМЕЩЕНИЯ
• Ещё раз о строении радикала. Атом С,
несущий неспаренный электрон, находится
в sp2 –гибридном состоянии
R
C
R''
R'
R R'
R''
87.
RR R'
X
X
R'
R''
R''
88.
RR R'
X
X
R'
R''
R''
89.
HX2
H
R
R'
-HX
X
X
R
R'
H
R
R'
R
H
S
90.
• ВЫВОД:• если в результате SR реакции
происходит образование
асимметрического атома углерода,
то продукт реакции будет
представлять собой рацемическую
смесь (эквимолярную смесь обоих
энантиомеров)
91.
ПРИМЕНЕНИЕ АЛКАНОВФракция
Температура, 0С
Газовая
До 40
бензин
40 -180
керосин
180 -230
Дизтопливо (солярка) 230 -305
Остаток (мазут)
>300
Соляровое масло
(тяжёлый газойль)
405-515
Смазочные масла
Вазелин, парафин,
асфальт
Состав
фракции
С1 – С5
С6 – С10
С11 – С12
С13 – С17
С18 – С25
С28 – С38


































































 chemistry
chemistry








