Similar presentations:
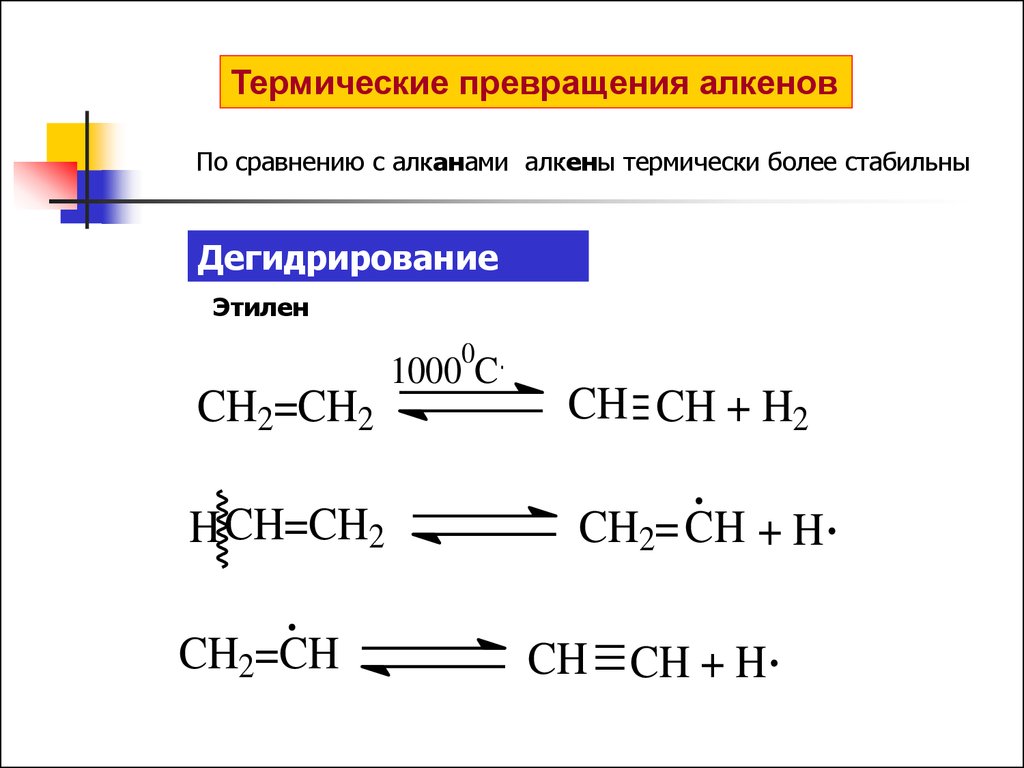
Термические превращения алкенов
1.
Термические превращения алкеновПо сравнению с алканами алкены термически более стабильны
Дегидрирование
Этилен
0
CH2=CH2
H CH=CH2
CH2=CH
1000 C
CH CH + H2
CH2= CH + H
CH CH + H
2.
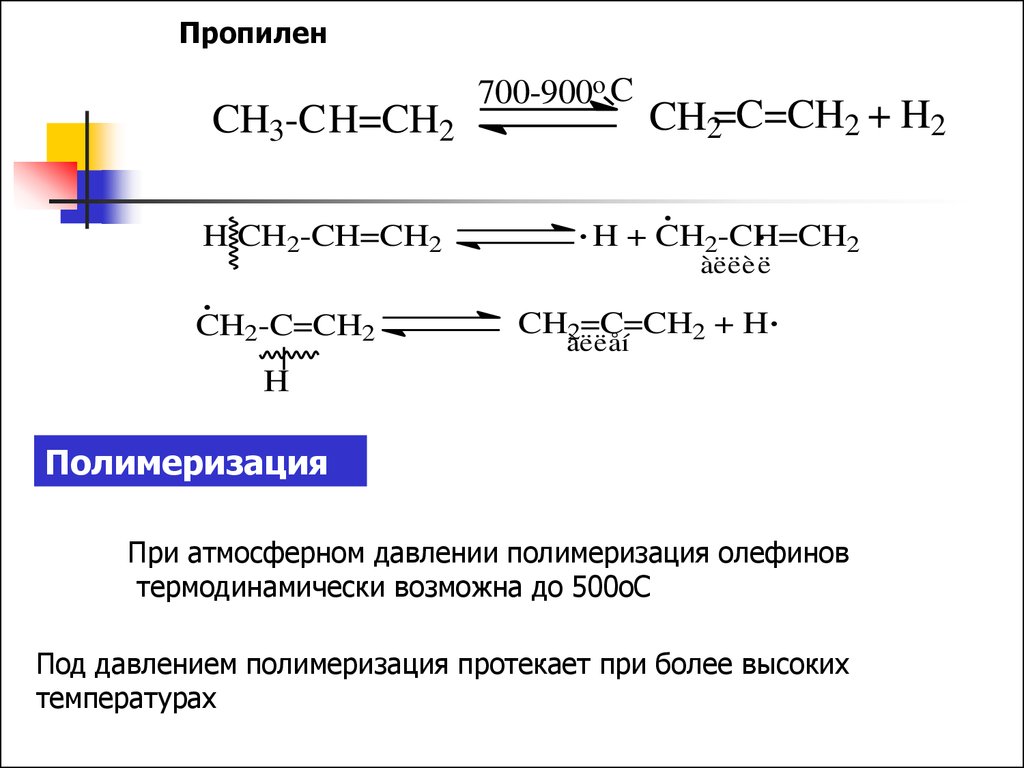
ПропиленCH3-CH=CH2
H CH2-CH=CH2
CH2-C=CH2
700-900o C
CH2=C=CH2 + H2
H + CH2-CH=CH2
àëëèë
CH2=C=CH2 + H
àëëåí
H
Полимеризация
При атмосферном давлении полимеризация олефинов
термодинамически возможна до 500оС
Под давлением полимеризация протекает при более высоких
температурах
3.
Полимеризация2CH2=CH2
CH2=CH2
CH2=CH-CH2-CH3
CH2-CH2
Полимеризация протекает через стадию образования
бирадикала, который затем взаимодействует с олефином
CH2-CH2 + H2C=CH2
CH2-CH2-CH2-CH2
CH2=CH-CH2-CH3
1,3-èçî ì åðèçàöèÿ
4.
Дегидроконденсация2ÑÍ 2=ÑÍ
7000C
2
ÑÍ 2=ÑH2-CH2=CH2 + H2
Механизм:
H2C=CH H
H. + CH=CH2
âèí èë-ðàäèêàë
-H
CH2=CH + H2C=CH2
CH2=CH-CH2-CH2
H2C=CH-CH=CH2
5.
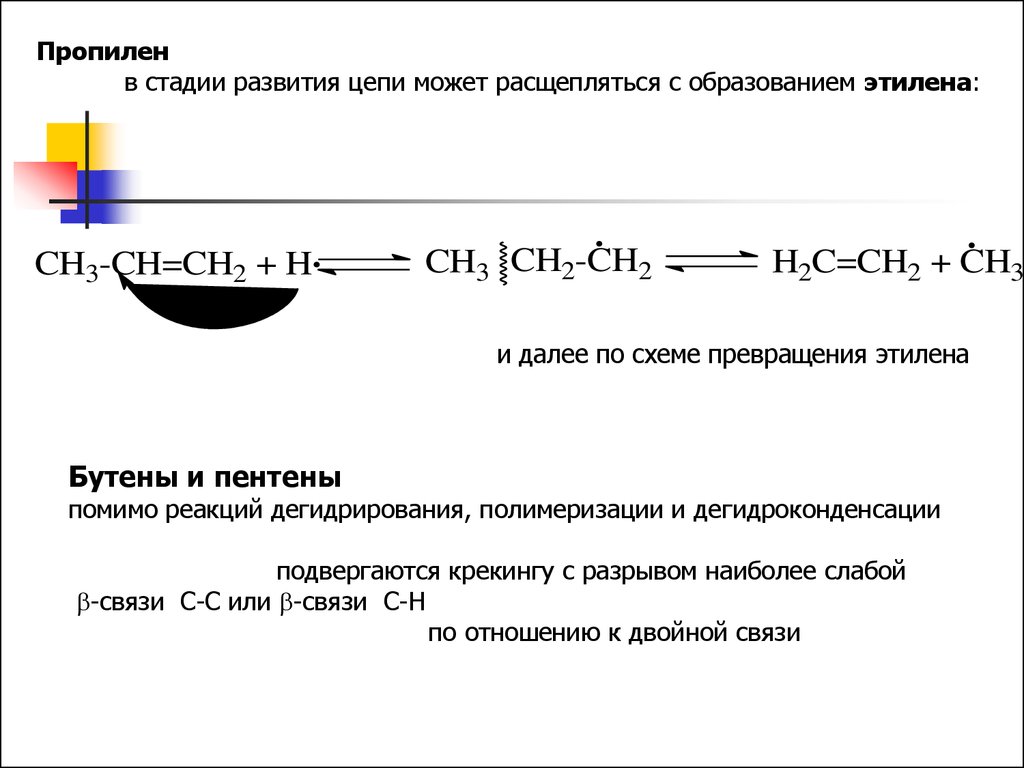
Пропиленв стадии развития цепи может расщепляться с образованием этилена:
CH3-CH=CH2 + H
CH3 CH2-CH2
H2C=CH2 + CH3
и далее по схеме превращения этилена
Бутены и пентены
помимо реакций дегидрирования, полимеризации и дегидроконденсации
подвергаются крекингу с разрывом наиболее слабой
-связи С-С или -связи С-Н
по отношению к двойной связи
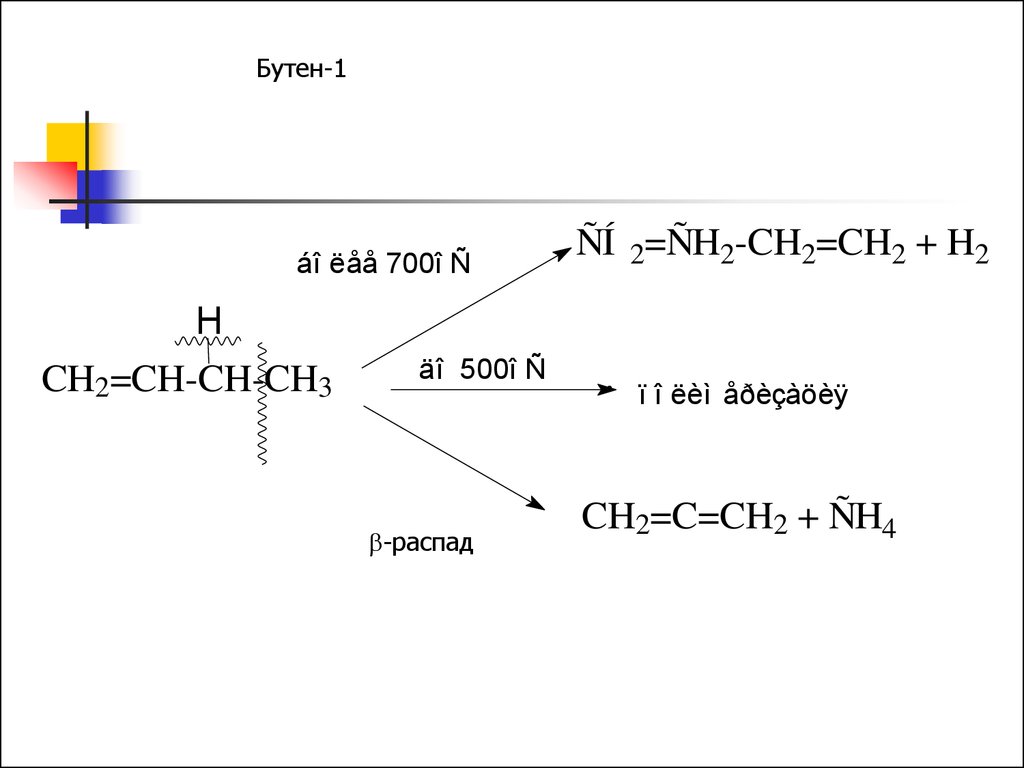
6.
Бутен-1áî ëåå 700î Ñ
H
CH2=CH-CH-CH3
äî 500î Ñ
-распад
ÑÍ 2=ÑH2-CH2=CH2 + H2
ï î ëèì åðèçàöèÿ
CH2=C=CH2 + ÑH4
7.
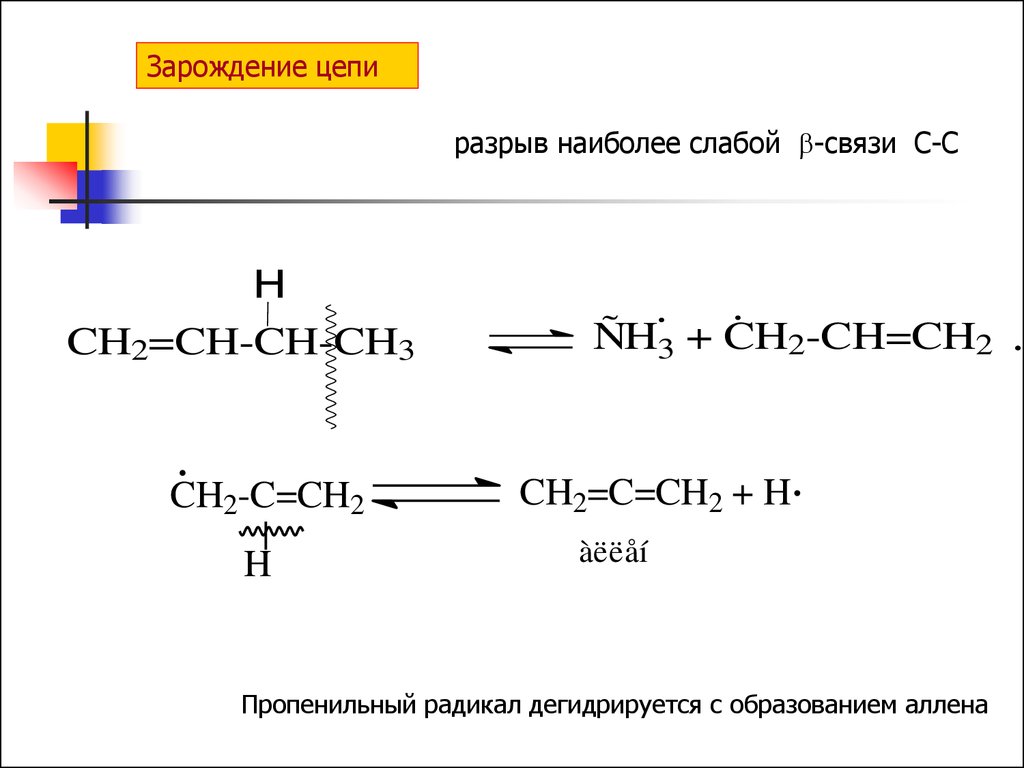
Зарождение цепиразрыв наиболее слабой -связи С-С
H
CH2=CH-CH-CH3
CH2-C=CH2
H
ÑH3 + CH2-CH=CH2
CH2=C=CH2 + H
àëëåí
Пропенильный радикал дегидрируется с образованием аллена
8.
А что происходит с метильным радикалом?H
CH2=CH-CH-CH3 + СH3
CH2=CH-CH-CH3
CH4 + CH2=CH-CH-CH3
H2C=CH-CH=CH2
áóòàäèåí
+ H
9.
Высшие алкены при 400-450оСв основном распадаются по -связи С-С
Образуя олефины меньшей М.М.
либо алкан и диен
RCH=CH2 + CH3-CH=CH2
CH2=CH-CH2-CH2 CH2 R
RCH2CH3
+
CH2=C=CH2
10.
Энергии диссоциации связей:CH2=CH-CH2-CH2 CH2 R
связь
Е кДж/моль
- С-С
260
наиболее слаб. связь
- С-Н
370
- С-С
373
- С-Н
Аллильный ат. Н
323
=С-Н
427
Энергии диссоциации связей
определяют общую схему
термического крекинга алкенов
11.
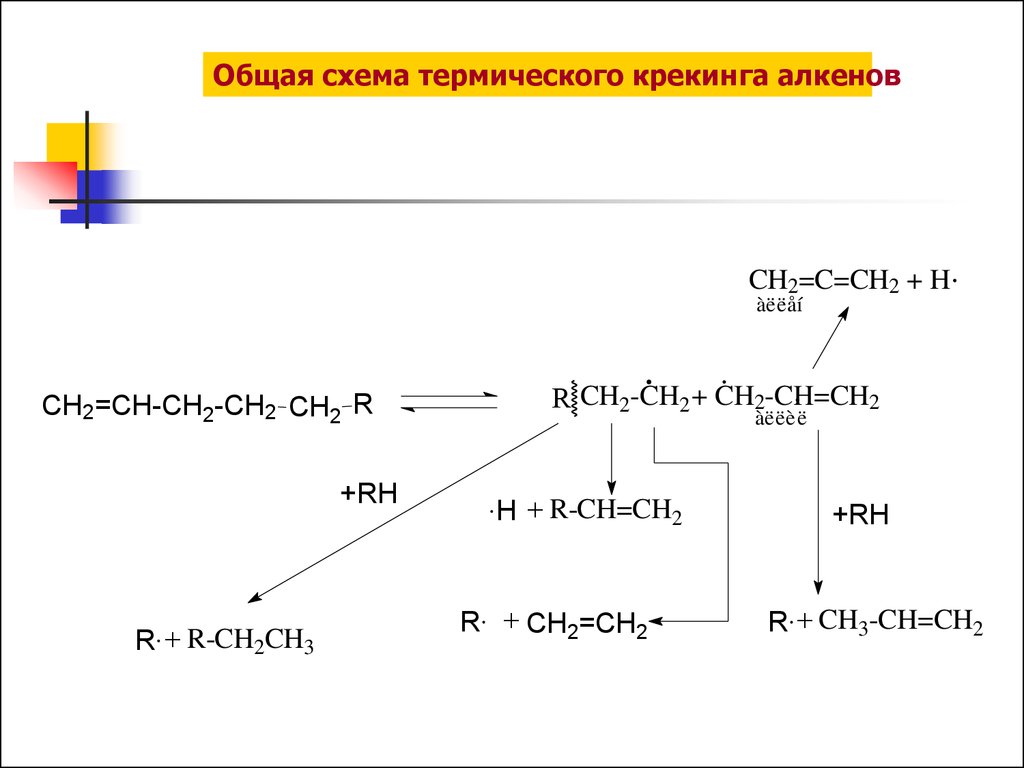
Общая схема термического крекинга алкеновCH2=C=CH2 + H
àëëåí
CH2=CH-CH2-CH2 CH2 R
+RH
R + R-CH2CH3
R CH2-CH2 + CH2-CH=CH2
àëëèë
H + R-CH=CH2
R + CH2=CH2
+RH
R + CH3-CH=CH2
12.
При взаимодействии свободных радикаловс молекулой олефина отщепляется аллильный атом водорода
H
CH2=CH-CH-CH2 CH2R
CH4
+
CH2=CH-CH-CH2 CH2R
H2C=CH-CH=CH2
+
RCH2
Образующиеся при распаде олефинов диены при температуре ниже
700оС (особенно под Р)
могут вступать в реакцию диенового синтеза с образованием
ароматических УВ.
13.
Реакция диенового синтеза+ 2H2
+
CH3
+
+
CH3
+ 2H2
14.
Некоторые исследователи предлагают молекулярный механизмтермического крекинга альфа-алкенов через стадию
6-центрового переходного состояния
CH3
CH2
HC
H2C
H
CH2
HC
CHR
H2C
H2C
+
HC
R
15.
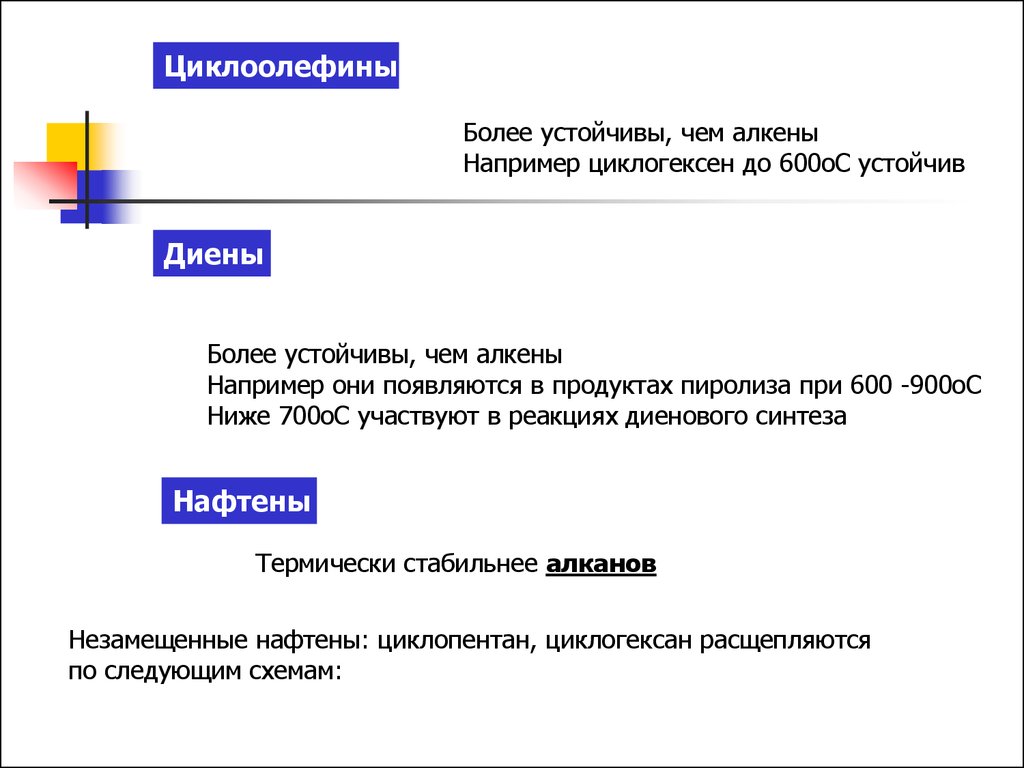
ЦиклоолефиныБолее устойчивы, чем алкены
Например циклогексен до 600оС устойчив
Диены
Более устойчивы, чем алкены
Например они появляются в продуктах пиролиза при 600 -900оС
Ниже 700оС участвуют в реакциях диенового синтеза
Нафтены
Термически стабильнее алканов
Незамещенные нафтены: циклопентан, циклогексан расщепляются
по следующим схемам:
16.
НафтеныÑÍ 2=ÑÍ
2
+ CH3-CH=CH2
CH2=CH-CH2-CH2 CH3
-H2
-H2










 physics
physics chemistry
chemistry








