Similar presentations:
Энергетика химических реакций
1.
Энергетикахимических реакций
1
2.
Термодинамикасистема
- открытая
- закрытая
- изолированная
2
3.
Тепловая энергия Q, [Дж]Параметры состояния:
P, T, V, состав системы
3
4.
Функции состояния:Внутренняя энергия U,
Энтальпия H,
Энтропия S,
Энергия Гиббса (изобарноизотермический потенциал) G.
4
5.
Первый закон термодинамикиQ = U + A
U = U2 – U1,
U2 и U1 – внутренняя энергия
системы в состоянии 2 и 1
соответственно.
A = p(V2–V1) = p△V
5
6.
Изохорный процесс:V=const, V = 0, А = 0, тогда
QV = U
Изобарный процесс:
Р=const
V = V2 – V1,
А = р V
Qp = U + р V
Qp = (U2 + рV2) – (U1 + рV1)
6
7.
H = U + рV,Отсюда:
Qp = Н2 – Н1 = Н
Энтальпия, H [кДж/моль]
H 0 – эндотермический процесс
H 0 – экзотермический процесс
7
8.
H обр или fH 298 , [кДж/моль]H2(г) + 1/2О2(г) H2O(ж);
при 25 С и 101 кПа
0
=
rH298
–285,84 кДж
rН 0, реакция экзотермическая
8
9.
fH 298(O2) = 0,fH 298(C(графит)) = 0,
Однако:
fH 298(O3) = 142,3 кДж/моль,
fH 298(C(алмаз)) = 1,828 кДж/моль
9
10.
Закон Лавуазье-Лапласа1/2H2 (г) + 1/2Сl2(г) HCl(г);
rH 298(HCl) = –92 кДж
HCl(г) 1/2H2 (г) + 1/2Сl2(г);
rH 298 = +92 кДж
10
11.
Закон ГессаC + ½O2 = CO
CO + ½O2 = CO2
C + O2 = CO2
12.
Следствие из закона Гесса:H = f H(продуктов) - f Н(реагентов)
Для реакции в общем виде:
аА + bB cC + dD
H = [c Hобр(C) + d Hобр(D)] –
– [a Hобр(A) + b Hобр(B)]
12
13.
Пример: Вычислить тепловой эффект реакциигорения бензола по стандартным энтальпиям
образования
fH 298
С6Н6(ж) + 7/2О2(г) = 6СО2(г) + 3Н2О(ж)
40,6
0
– 394,7
– 286
Воспользуемся следствием из закона Гесса:
rH = 6 H (СО2(г)) + 3 H ( Н2О(ж)) – H ( С6Н6(ж)),
rH = 6(– 394,7) +3 (– 286) – (+ 40,6) = – 3186,8 кДж.
14.
Энтропия, S [Дж/(моль К)]Процессы, для которых S 0:
1) расширение газов;
2)
Sтв Sжид Sгаз
SН2О(пар) = 183 Дж/(моль К)
SН2О(жидк.) = 69 Дж/(моль К)
SН2О(лед) = 43,89 Дж/(моль К)
3) растворение кристаллических веществ.
SCo(алмаз) = 2,38 Дж/моль К
SCo(графит) = 5,74 Дж/моль К
15.
Процессы, для которых S 0:1) сжатие газов;
2) конденсация и кристаллизация
веществ.
Рассчитывается по следствию из
закона Гесса:
S
о
298
=
o
S298 (продуктов)
о
S298 (реагентов)
16.
NH4NO2(к) = N2О(г) + 2H2О(г)V1
V1 < V 2
V2
△S > 0
2H2S(г) + 3O2(г)= 2H2О(к) + SО2(г)
V1
V1 > V 2
V2
△S<0
17.
Энергия Гиббса, G, [кДж/моль]G = Н – Т S
o
G298
о
о
Gпродуктов G реагентов
18.
G 0 – процесс термодинамическивозможен (реакция идет
самопроизвольно);
G 0 – процесс термодинамически
невозможен (реакция не идет);
G = 0 – система находится в
состоянии химического равновесия.
19.
Возможность протекания реакцииG = Н – Т S
Реакция экзотермическая
Н 0, S > 0,
то всегда G 0, т.е. реакция
протекает при всех t.
Н < 0, S < 0,
то реакция протекает при низких t (т.е. должно
выполняться условие │ H│>│T S│) ( G 0).
20.
G = Н – Т SРеакция эндотермическая
Н > 0, S < 0,
то всегда G > 0 , т.е. реакция не
протекает.
Н > 0, S > 0,
то реакция протекает при высоких t (т.е. должно
выполняться условие │ H│<│T S│) ( G 0).
21.
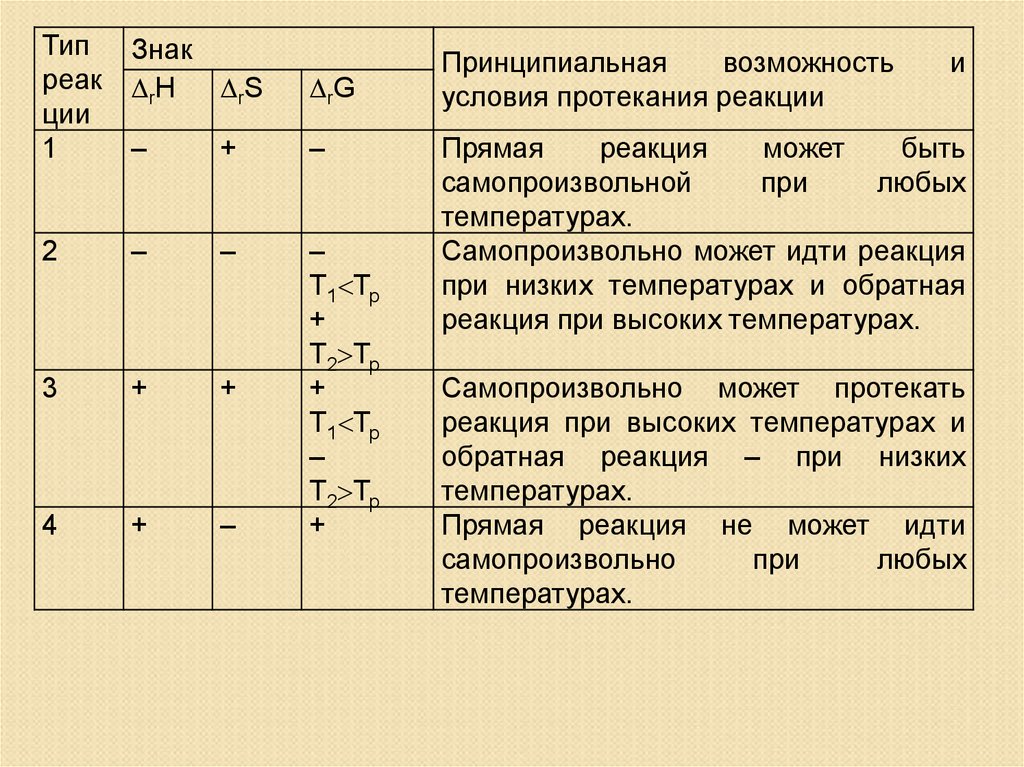
Типреак
ции
1
Знак
rН
rS
rG
–
+
–
2
–
–
3
+
+
4
+
–
–
Т1 Тр
+
Т2 Тр
+
Т1 Тр
–
Т2 Тр
+
Принципиальная
возможность
условия протекания реакции
и
Прямая
реакция
может
быть
самопроизвольной
при
любых
температурах.
Самопроизвольно может идти реакция
при низких температурах и обратная
реакция при высоких температурах.
Самопроизвольно может протекать
реакция при высоких температурах и
обратная реакция – при низких
температурах.
Прямая реакция не может идти
самопроизвольно
при
любых
температурах.
22.
NH3(г) + HCl(г) = NH4Сl(к) при 298 КrН = ?
rS = ?
rG = ?
Выписываем из справочных данных:
Вещество
Н , кДж/моль
S , Дж/моль К
NH3(г)
–46,19
192,50
HCl(г) NH4Сl(к)
–92,3 –315,39
186,7
94,56
23.
Из з-на Гесса энтальпия реакции:rН = Н (NH4Сl(к)) – Н (NH3(г)) – Н (HCl(г))
= –315,39 – (–46,19 – 92,3) = –176,9 кДж.
Изменение энтропии реакции:
rS = S (NH4Сl(к)) – S (NH3(г)) – S (HCl(г)) =
= 94,56 – 192,50 – 186,70 = –284,64Дж/моль К.
Используем ур-е Гиббса:
rG = rН – Т rS
rG = – 176,9 + 284,64 10–3 303 = –90,55 кДж.
rG 0, реакция идет
24.
Энтальпия сгорания этанаfHо298 = -1560 кДж/моль
Вычислить энтальпию образования этана
C2H6(г) + 31/2O2(г) = 2CO2(г) + 3H2O(ж)
Х
0
-393,5 -286,2
rHо298= 2 fHо298CO2 + 3 fHо298H2O –
- fHо298(C2H6)
-1560 = 2(-393,5) + 3(-286,2)-X
X = -85,6 кДж/моль
24















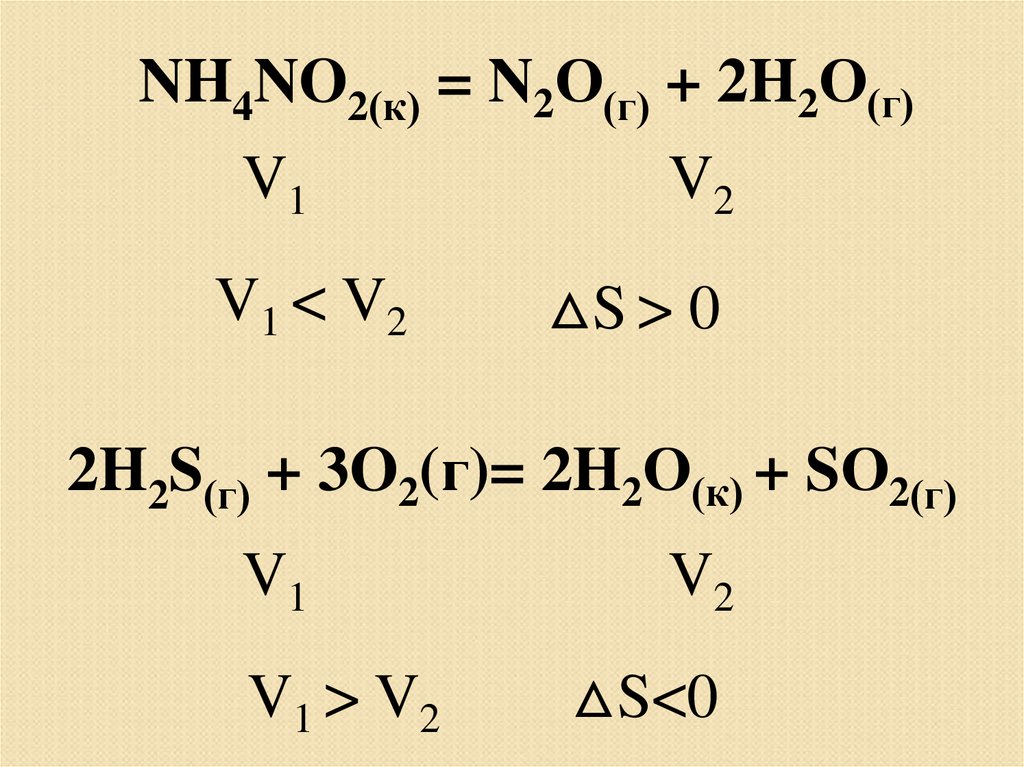







 chemistry
chemistry








