Similar presentations:
Химическая термодинамика. Экзаменационные вопросы
1.
Экзаменационные вопросы4. Химическая термодинамика
1. Основные понятия. Термодинамическая система, параметры и функции состояния.
Термодинамический процесс. Обратимый (равновесный) и необратимый (неравновесный)
процессы.
2. Первое начало термодинамики. Внутренняя энергия и энтальпия.
3. Тепловой эффект химической реакции. Закон Гесса и его следствия. Стандартная (молярная)
энтальпия образования вещества. Термохимические расчеты.
4. Температурная зависимость энтальпии (теплового эффекта).
5. Энтропия. Второе начало термодинамики. Связь энтропии и термодинамической вероятности
системы. Уравнение Больцмана. Формулировка второго и третьего начала термодинамики.
Факторы, влияющие на величину энтропии.
6. Энергия Гиббса. Направление протекания химического процесса. Термодинамическое условие
равновесия. Стандартная энергия Гиббса (образования) вещества.
7. Температурная зависимость величины энергии Гиббса. Энтальпийный и энтропийный
факторы. Оценка термодинамической возможности протекания химической реакции.
8. Энергия Гиббса в нестандартных условиях. Концентрационная зависимость энергии Гиббса.
Активность и фугитивность.
2.
4. Химическая термодинамика (т/д)УП 1 с.129-164; УП 4 с.3-23
В своём развитии пришла к основным обобщениям – началам (законам) т/д.
Всё остальное содержание т/д – есть следствие из них. Её отличают
логичность,
последовательность,
согласованность
количественных
результатов, высокая степень формализма. Законы т/д выведены для
абстрактных систем и столь общи, что широко используются в физике,
биологии, геологии, астрономии, математике, химии.
т/д изучает
•Энергетические эффекты, сопровождающие физические и
химические процессы; превращения (переходы) энергии из одной
формы в другую, от одной части системы к другой
•Возможность (направление) самопроизвольного протекания
процессов
Химическая термодинамика - термодинамика хим. процессов.
Описывает статистически значимые процессы (большое число
частиц или случаев)
3.
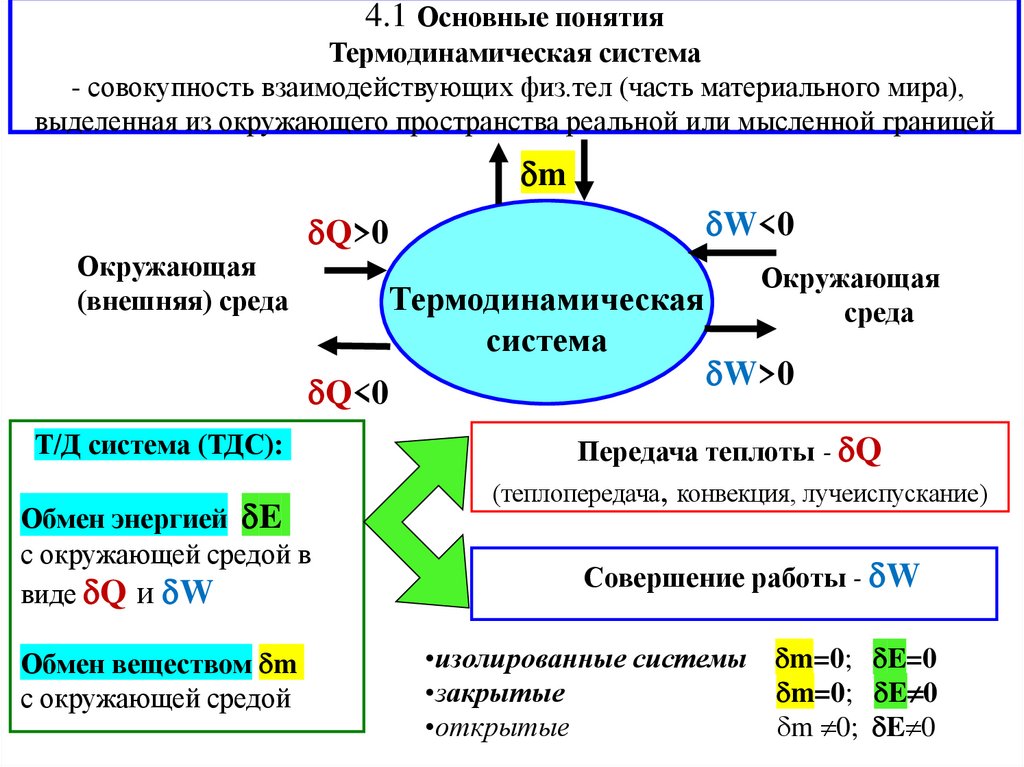
4.1 Основные понятияТермодинамическая система
- совокупность взаимодействующих физ.тел (часть материального мира),
выделенная из окружающего пространства реальной или мысленной границей
m
Окружающая
(внешняя) среда
Термодинамическая
система
Q<0
Т/Д система (ТДС):
Обмен энергией E
с окружающей средой в
виде Q и W
Обмен веществом m
с окружающей средой
W<0
Q>0
Окружающая
среда
W>0
Передача теплоты - Q с окру
(теплопередача, конвекция, лучеиспускание)
жающей средой
Совершение работы - W
•изолированные системы m=0; E=0
•закрытые
m=0; E 0
•открытые
m 0; E 0
4.
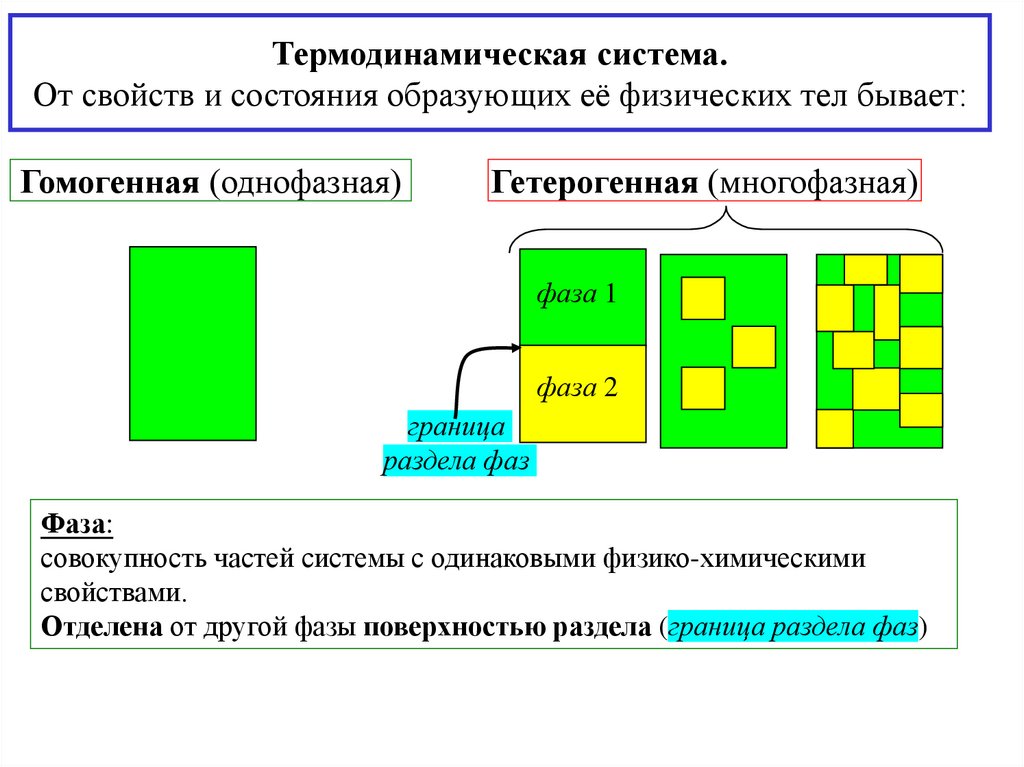
Термодинамическая система.От свойств и состояния образующих её физических тел бывает:
Гомогенная (однофазная)
Гетерогенная (многофазная)
фаза 1
фаза 2
граница
раздела фаз
Фаза:
совокупность частей системы с одинаковыми физико-химическими
свойствами.
Отделена от другой фазы поверхностью раздела (граница раздела фаз)
5.
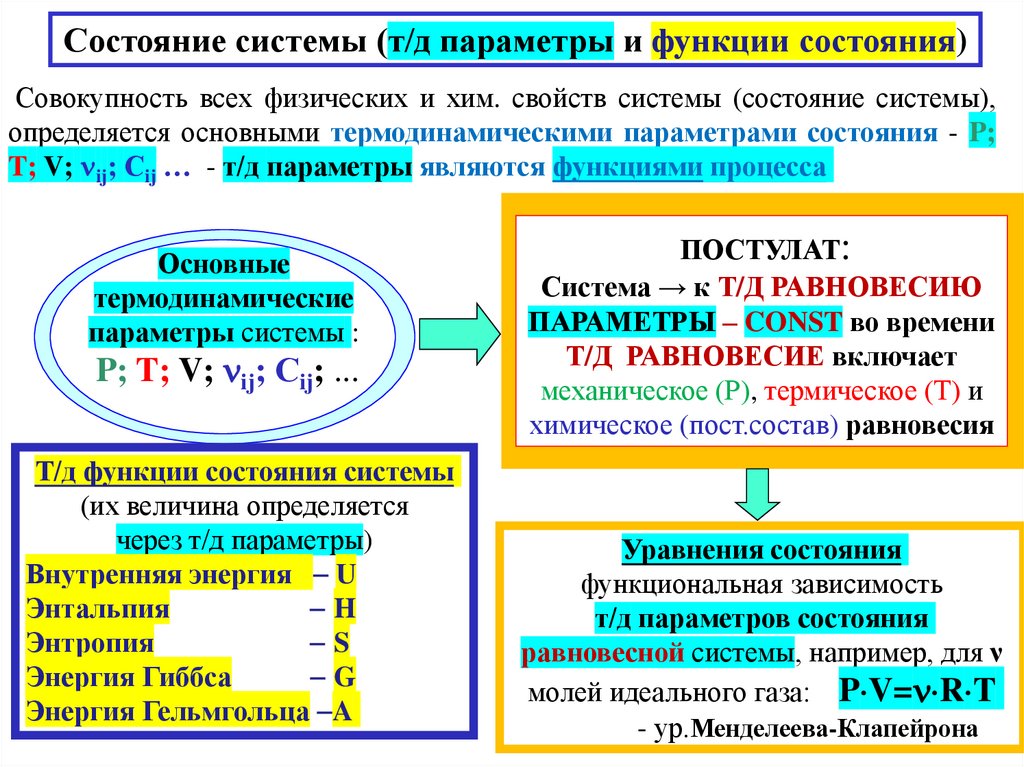
Состояние системы (т/д параметры и функции состояния)Совокупность всех физических и хим. свойств системы (состояние системы),
определяется основными термодинамическими параметрами состояния - P;
T; V; ij; Сij … - т/д параметры являются функциями процесса
Основные
термодинамические
параметры системы :
P; T; V; ij; Сij; ...
Т/д функции состояния системы
(их величина определяется
через т/д параметры)
Внутренняя энергия U
Энтальпия
H
Энтропия
S
Энергия Гиббса
G
Энергия Гельмгольца A
ПОСТУЛАТ:
Система → к Т/Д РАВНОВЕСИЮ
ПАРАМЕТРЫ – CONST во времени
Т/Д РАВНОВЕСИЕ включает
механическое (Р), термическое (Т) и
химическое (пост.состав) равновесия
Уравнения состояния
функциональная зависимость
т/д параметров состояния
равновесной системы, например, для ν
молей идеального газа: P V= R T
- ур.Менделеева-Клапейрона
6.
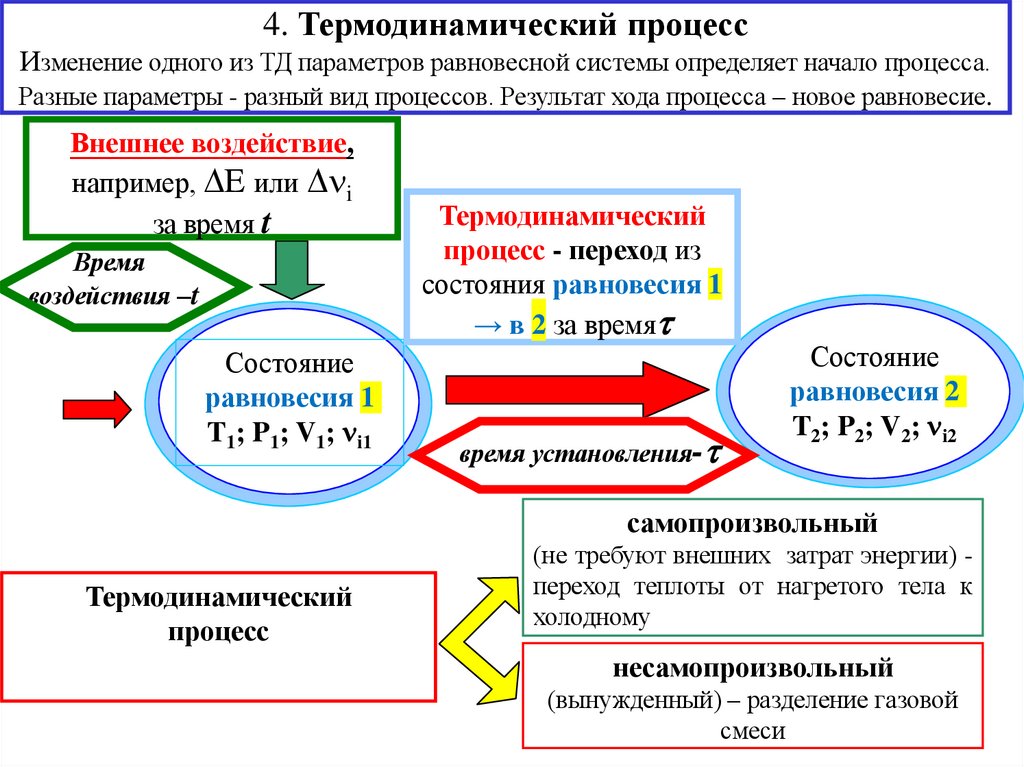
4. Термодинамический процессИзменение одного из ТД параметров равновесной системы определяет начало процесса.
Разные параметры - разный вид процессов. Результат хода процесса – новое равновесие.
Внешнее воздействие,
например, E или i
за время t
Время
воздействия –t
Состояние
равновесия 1
T1; P1; V1; i1
Термодинамический
процесс - переход из
состояния равновесия 1
→ в 2 за время
время установления-
Состояние
равновесия 2
T2; P2; V2; i2
самопроизвольный
Термодинамический
процесс
(не требуют внешних затрат энергии) переход теплоты от нагретого тела к
холодному
несамопроизвольный
(вынужденный) – разделение газовой
смеси
7.
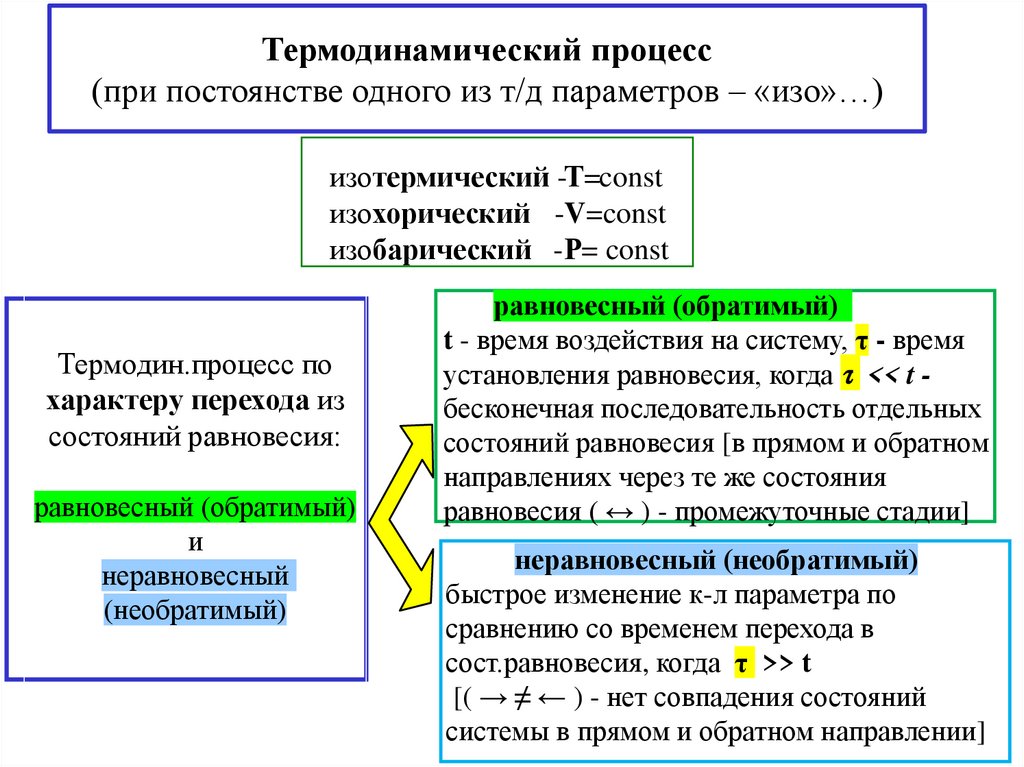
Термодинамический процесс(при постоянстве одного из т/д параметров – «изо»…)
изотермический -Т=const
изохорический -V=const
изобарический -Р= const
Термодин.процесс по
характеру перехода из
состояний равновесия:
равновесный (обратимый)
и
неравновесный
(необратимый)
равновесный (обратимый)
t - время воздействия на систему, τ - время
установления равновесия, когда << t бесконечная последовательность отдельных
состояний равновесия [в прямом и обратном
направлениях через те же состояния
равновесия ( ↔ ) - промежуточные стадии]
неравновесный (необратимый)
быстрое изменение к-л параметра по
сравнению со временем перехода в
сост.равновесия, когда τ >> t
[( → ≠ ← ) - нет совпадения состояний
системы в прямом и обратном направлении]
8.
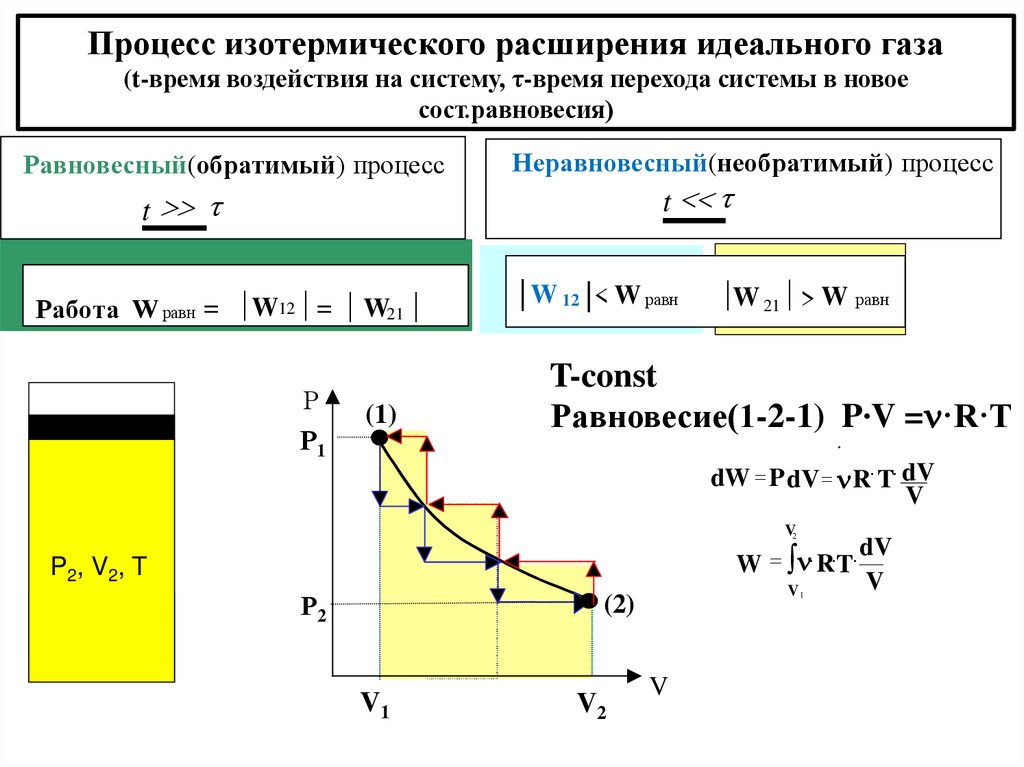
Процесс изотермического расширения идеального газа(t-время воздействия на систему, τ-время перехода системы в новое
сост.равновесия)
Равновесный(обратимый) процесс
Неравновесный(необратимый) процесс
t
t
Работа W равн = W12 = W21
Р
Р1
(1)
W 12 < W равн
W 21 > W равн
T-const
Равновесие(1-2-1) P∙V = ·R·T
dW P dV R T dV
V
mg
V2
W R T
Р2
V
(2)
P1, V1, T
V1
V2
V
1
P2, V2, T
dV
V
9.
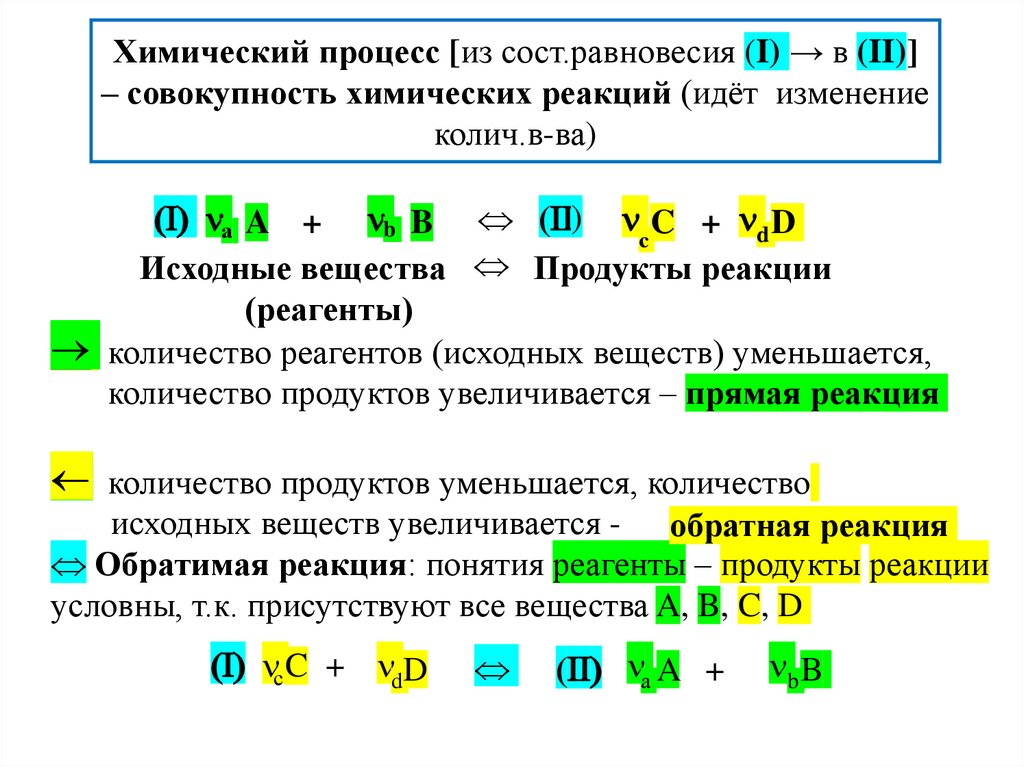
Химический процесс [из сост.равновесия (I) → в (II)]– совокупность химических реакций (идёт изменение
колич.в-ва)
(I) а A + b B (II) C + d D
с
Исходные вещества Продукты реакции
(реагенты)
количество реагентов (исходных веществ) уменьшается,
количество продуктов увеличивается – прямая реакция
количество продуктов уменьшается, количество
исходных веществ увеличивается - обратная реакция
Обратимая реакция: понятия реагенты – продукты реакции
условны, т.к. присутствуют все вещества A, B, C, D
(I) с C + dD
(II) а A +
b B
10.
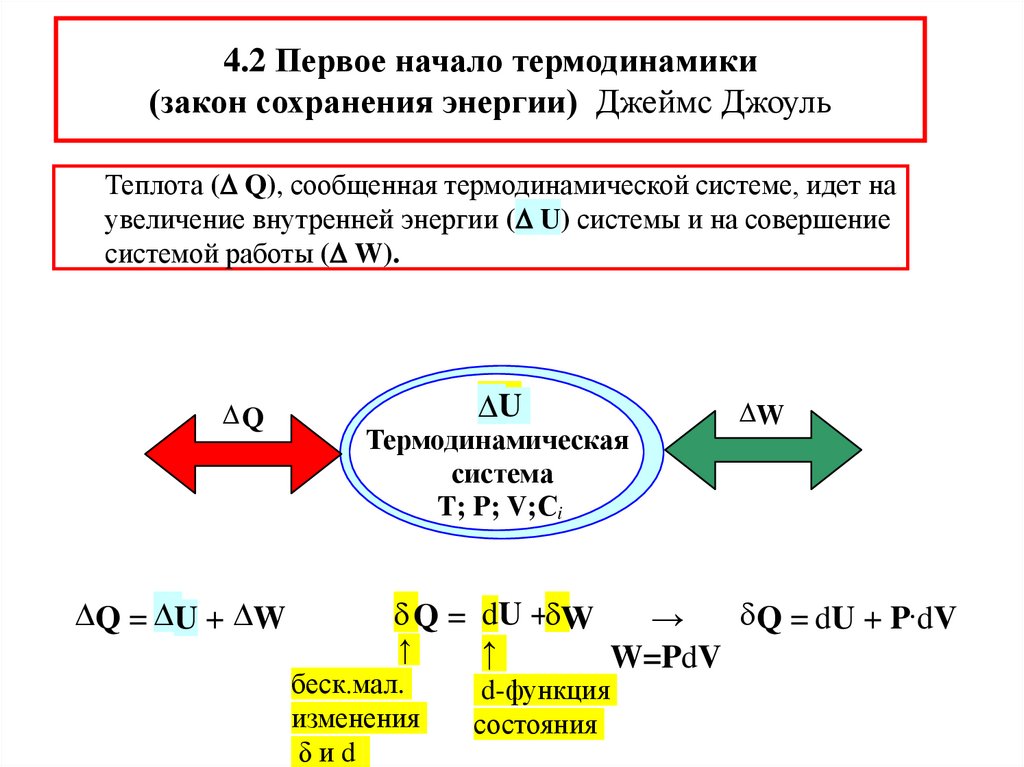
4.2 Первое начало термодинамики(закон сохранения энергии) Джеймс Джоуль
Теплота ( Q), сообщенная термодинамической системе, идет на
увеличение внутренней энергии ( U) системы и на совершение
системой работы ( W).
Q
Q = U + W
U
Термодинамическая
система
T; P; V;Сi
W
Q = dU + W
Q = dU + P dV
→
↑
↑
W=PdV
беск.мал.
изменения
δиd
d-функция
состояния
11.
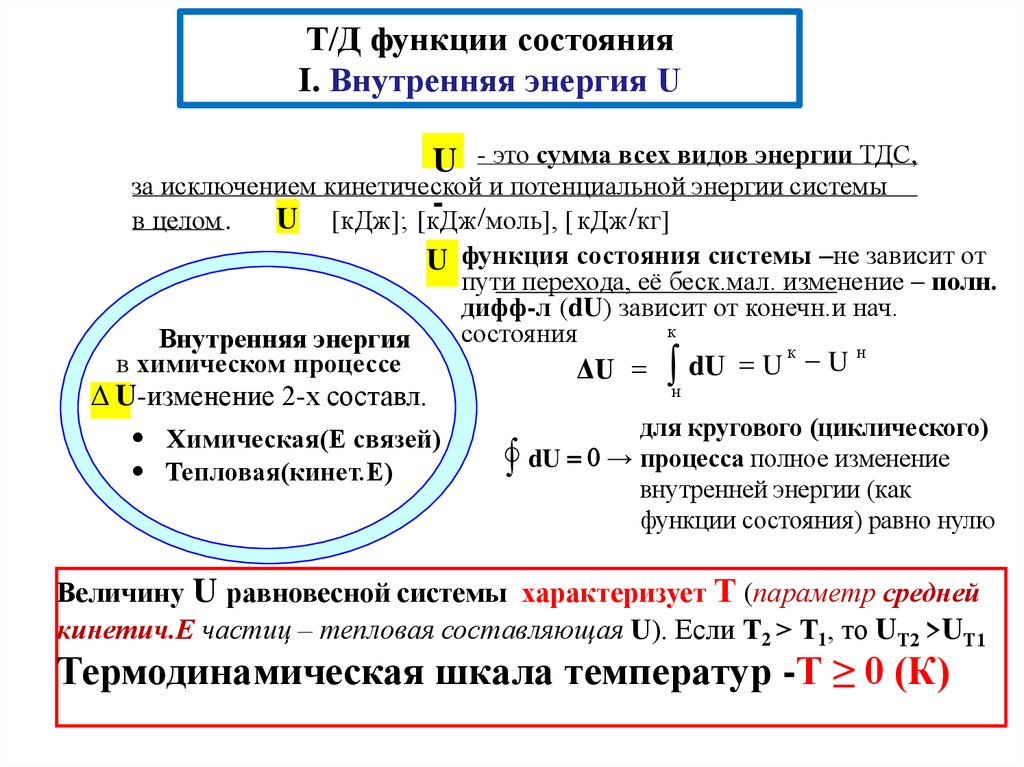
Т/Д функции состоянияI. Внутренняя энергия U
U - это сумма всех видов энергии ТДС,
за исключением кинетической и потенциальной энергии системы
U [кДж]; [кДж моль], [ кДж кг]
в целом .
U функция состояния системы –не зависит от
U-изменение 2-х составл.
Химическая(Е связей)
Тепловая(кинет.Е)
к
н
U
U
ΔU dU
н
Внутренняя энергия
в химическом процессе
пути перехода, её беск.мал. изменение – полн.
дифф-л (dU) зависит от конечн.и нач.
к
состояния
для кругового (циклического)
dU 0 → процесса полное изменение
внутренней энергии (как
функции состояния) равно нулю
Величину U равновесной системы характеризует Т (параметр средней
кинетич.Е частиц – тепловая составляющая U). Если Т2 > Т1, то UТ2 >UТ1
Термодинамическая шкала температур -Т ≥ 0 (К)
12.
II. Энтальпия (теплосодержание системы)Q = dU + P dV
1-е начало
V =const (dV = 0) из 1-го начала → Q V = U или Q V = dU
P= const
QP = U+ P V → QP = dU + P dV
Н= U + P V → QP = d(U + P V) = dH
– энтальпия
Q P = dН или ∆QP=∆H
[кДж]; [ кДж моль], [ кДж/кг] - размерность ∆Н
∆Н зависит от количества вещества (экстенсивная величина) → моль-1, кг -1
Изменение энтальпии ∆H соответствует тепловому эффекту ∆QP хим. реакции.
Физич.смысл ∆H – количество энергии, которое можно превратить в тепло
(это внутр.энергия U и/или работа W). Поэтому энтальпию ∆H – часто называют
теплосодержанием системы.
13.
Термохимия –указан тепловой эффект Q
химической реакции
aA + bB = dD + eE +Q (-∆rН)
- это количество теплоты Q
реакции при условии
процесс необратим при
P = сonst или V= сonst
∆rН – изменение энтальпии
системы (при хим.реакции)
экзо термические
±Q
Химическая реакция
эндотермические
Изохорный т епловой эффект химической реакции изменение внутр. энергии
Изобарный тепловой эффект химической реакции -
QV = rU
rr Н
QP = ∆
r Н 0 - экзотермические реакции (+Q) - окруж.среда получает Q, система теряет Q
r Н 0 - эндотермические реакции (-Q) - окруж.среда отдает Q, система получает Q
→
Q = - rН
14.
Закон Гесса«тепловой эффект реакции зависит только от вида и состояния
исходных веществ и конечных продуктов и не зависит от пути
(числа промежуточных стадий) превращения одних веществ в другие»
rН , кДж
C; O 2
C + O 2 = CO 2
rН 1 = -393.51 кДж
2. C + 0.5O 2 = CO
rН 2 = -110.53 кДж
CO + 0.5O 2 = CO 2
rН 3 = -282.98 кДж
1.
CO
rН 2
rН 1
rН 3
CO 2
r Н 1 = r Н 2 + rН 3
15.
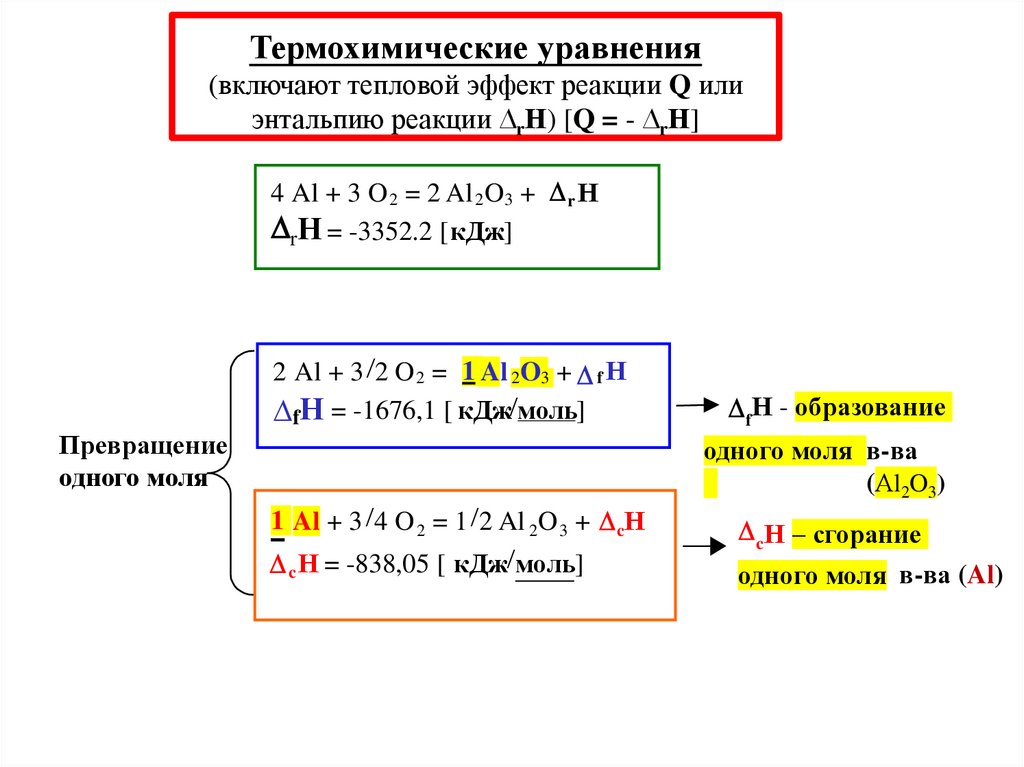
Термохимические уравнения(включают тепловой эффект реакции Q или
энтальпию реакции ∆rН) [Q = - ∆rН]
4 Al + 3 O 2 = 2 Al 2O3 + r Н
rН = -3352.2 [кДж]
l2O3
2 Al + 3 2 O 2 = 1 Al 2O3 + f Н
fН = -1676,1 [ кДж моль]
Превращение
одного моля
1 Al + 3 4 O 2 = 1 2 Al 2O 3 + cН
c Н = -838,05 [ кДж моль]
fН - образование
одного моля в-ва
(Аl2O3)
cН – сгорание
одного моля в-ва (Al)
16.
Стандартная (молярная) энтальпия образования fН0298(тепловой эффект образования 1 моля сложного вещества из простых в
стандартных условиях)
• Стандартные условия:
fН0298 –Стандартная энтальпия
образования моля сложных веществ:
Р0 = 1,013 105 Па
1. простые в-ва (Н2, О2, С, Ме …)
Т0 = 298,15 К
fН0298= 0 кДж/моль
С0 = 1моль/л
2. сложные в-ва (АВ)
rН0298 – стандартная
fН0298= ± QР [кДж/моль] из простых в-в А2, В2
энтальпия (тепловой
эффект ± QР) хим.реакции
1/2 А2 + 1/2 В2 = АВ ± fН0298 (или ± fН0АВ )
[кДж]
1. 1. Газообразный водород
fН0298= 0 кДж/моль.
2. Ртуть жидкость
fН0298= 0 кДж/моль.
3.Углерод твердый
графит fН0298 = 0 кДж/моль,
алмаз fН0298 = 1,83кДж/моль
2. При сгорании сложных веществ – продукты окисления:
СО2 , Н 2О, H-Hal, N2, MexOy
17.
4.3 Термохимические расчеты (расчет тепловых эффектовреакций). Следствие из закона Гесса:
rН0298 = ( i fН0i)продукты – ( j fН0i)исходные вещества
Для реакции
аA + bB = сC + dD
rН0298 = ( c fН0C + d fН0D ) – ( a fН0A + b fН0B)
Пример.
Реакция :
fН0298, кДж/моль
CH4 (газ) + CO2 (газ) = 2 CO (газ) + 2H2 (газ)
–74,85
–393,51
–110,5
0
Расчет теплового эффекта реакции Q хим.реакц - (величина экстенсивная):
1. Определение энтальпии реакции rН0298:
rН0298 = [2 (–110,5) + 2 0] – [(–74,85) + (–393,51)] = 247,36 [кДж/моль]
2. Q хим.реакц. = - rН0298‧ n = - 247,36 [кДж], где n - число молей; n = 1{т.к.
величина энтальпии хим.реакции rН0298 отнесена к 1 молю - [кДж/моль]}.
Внимание на знак и размерность величин в п.1 [кДж/моль] и п.2 [кДж] !!!
18.
4.4 Зависимость теплового эффекта реакции от температурыcp – молярная изобарная
теплоемкость [Дж/мольК]
cр =
T
0
298 р
c
dT
fH
T
fH
298
Q р
dT
=
dH
dT
T
0
298 р
c
dT
fH
T
fH
298
Если в интервале Т1 - Т2 фазовые переходы: плавление Тпл, кипение Ткип
Т
пл
Т
T
кип
2
0
0
T
2 T
1 рт
m
р
ж v
рп
T
Т
Т
1
пл
кип
H
H
c
dT
H
c
dT
H
c
d
mН0 [кДж/моль] – энтальпия плавления
vН0 [кДж/моль] – энтальпия испарения
ср - const
HТ2 – HТ1 = ср (T2 – T1), (∆Т - не слишком широкий интервал)
cp(Т) = а + b Т + c Т2 +…- точное значение из полиномов (справочники)
19.
пример - Н2ОfHT
(cp) пар
vH
(cp) жидкость
fH0
(cp) лед
T1
mH
273
298
373
T2
Т, К
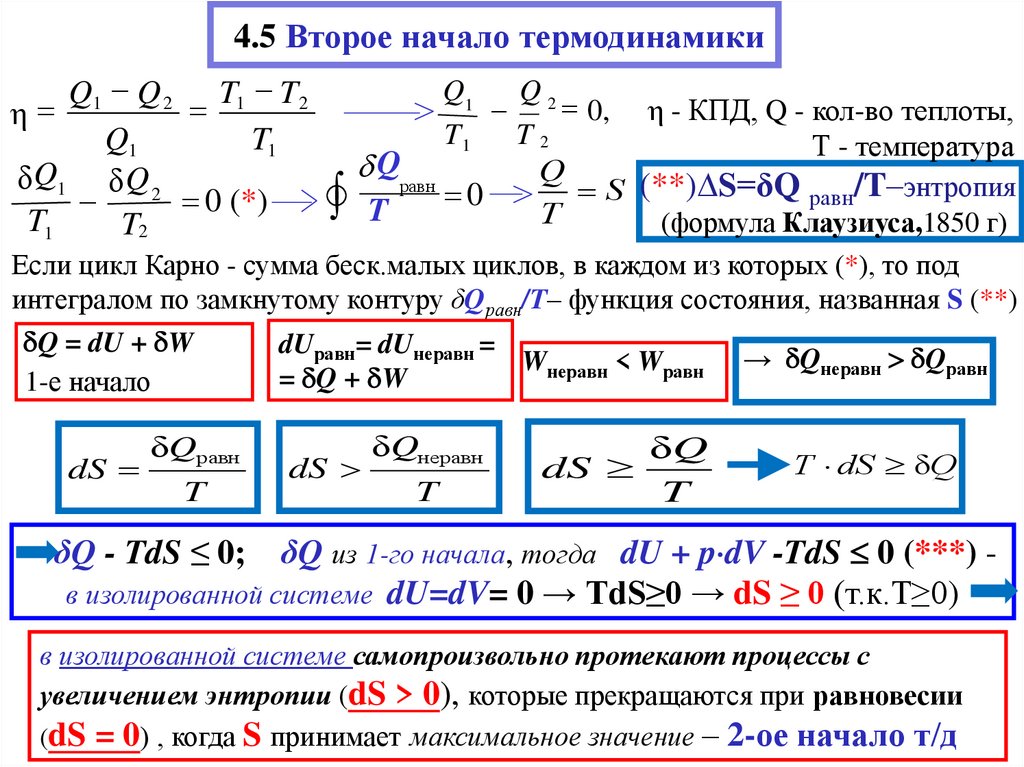
20. 4.5 Второе начало термодинамики
Q1Q2
Q1 Q 2 T1 T2
0, η - КПД, Q - кол-во теплоты,
η
T1
T2
Q1
T1
Т - температура
Q
равн
Q
δ Q1 δ Q 2
S (**)∆S=δQ равн/T–энтропия
0
0 (*)
T
T
T1
(формула Клаузиуса,1850 г)
T2
Если цикл Карно - сумма беск.малых циклов, в каждом из которых (*), то под
интегралом по замкнутому контуру δQравн/T– функция состояния, названная S (**)
Q = dU + W
dUравн= dUнеравн =
Wнеравн < Wравн → Qнеравн Qравн
= Q + W
1-е начало
dS
δQравн
T
dS
δQнеравн
T
dS
δQ
T
T dS δQ
δQ из 1-го начала, тогда dU + p dV -TdS 0 (***) в изолированной системе dU=dV= 0 → TdS≥0 → dS ≥ 0 (т.к.T≥0)
δQ - TdS ≤ 0;
в изолированной системе самопроизвольно протекают процессы с
увеличением энтропии (dS > 0), которые прекращаются при равновесии
(dS = 0) , когда S принимает максимальное значение – 2-ое начало т/д
21.
III. Энтропия и т/д вероятность1
W1= 1
2
W2= 4
3
W3= 6
1 – 5 варианты распределения по двум половинам сосуда 4-х частиц(макросостояния
системы)
Wi – число способов (микросостояний)
реализации макросостояний 1-5 системы
при размещении 4-х частиц (с № 1,2,3 и 4)
ΣWi=16 - всего способов размещения в 1-5
P=6/16 математическая вероятность Max
W3=6 макс.(для выравнивания конц.)
Wi – термодинамическая вероятность
4
W4= 4
5
W5= 1
0≤P≤1
1≤W≤∞
22.
Энтропия. Уравнение БольцманаS = k lnW
k = 1,38 10-23Дж К – постоянная Больцмана (k = R/NА)
W – термодинамическая вероятность данного состояния число возможных микросостояний системы (W 1), которые обеспечивают
параметры данного макросостояния.
Уравнение Больцмана - связь энтропии S по Клаузиусу с вероятностным
подходом, трактовкой хаотичности, как объективного качества окруж. мира)
Второе начало термодинамики. Вероятностный подход
В изолированной системе самопроизвольно идут только процессы в
которых реализуется более вероятное состояние системы, т.е. процессы
сопровождающиеся увеличением термодинамической вероятности W и
следовательно энтропии S.
Т.о. в изолированной системе для самопроизвольного процесса
изменение энтропии
ΔS>0
23.
Второе начало термодинамики(ещё одна из формулировок )
В изолированной системе самопроизвольно будут протекать процессы с
увеличением термодинамической вероятности, а состояние равновесия
соответствует состоянию с максимальной вероятностью.
Третье начало термодинамики
(теорема В.Нернста 1906 г. и постулат М.Планка 1911 г.)
*Энтропия идеального кристалла при 0 К равна нулю.
(поэтому энтропия любого вeщества абсолютна и положительна)
2-е начало т/д описывает системы:
• число частиц должно быть велико, статистически значимо(>1012-1014)
• число частиц – конечно
•не распространяется на неограниченную(бесконечную) систему [W
становится неопределенной(бесконечное число состояний)]
24.
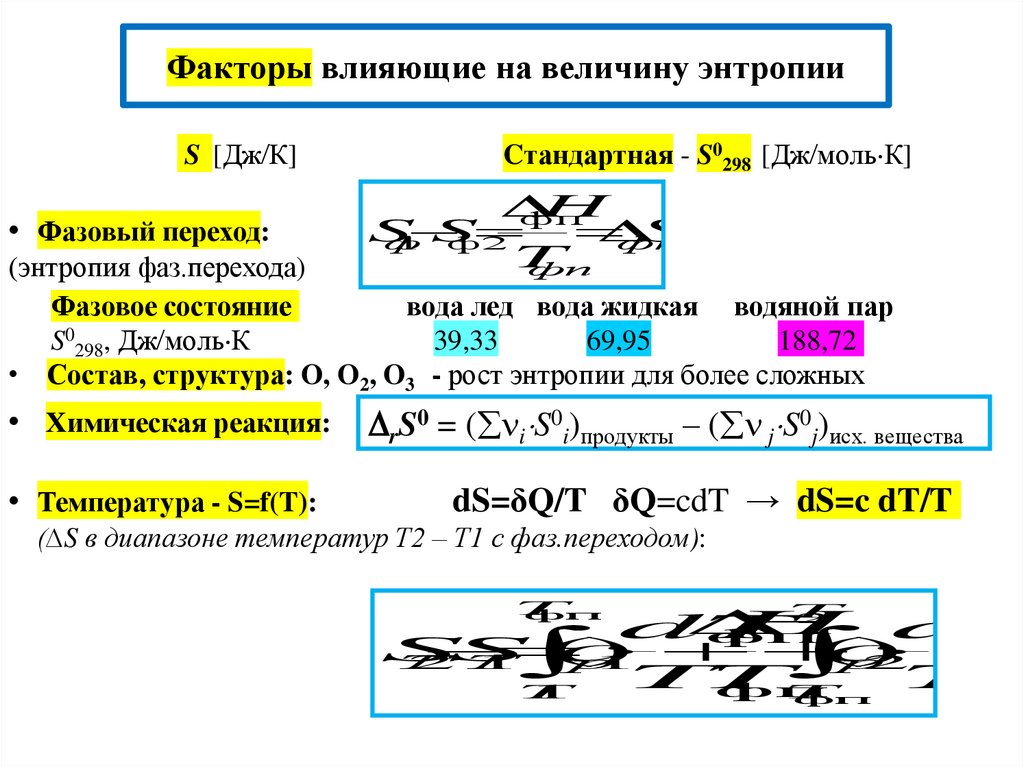
Факторы влияющие на величину энтропииS [Дж К]
• Фазовый переход:
Cтандартная - S0298 [Дж моль К]
H
фп
S
S
S
ф
1
ф2
фп
T
фп
(энтропия фаз.перехода)
Фазовое состояние
вода лед вода жидкая водяной пар
S0298, Дж моль К
39,33
69,95
188,72
• Состав, структура: O, O2, O3 - рост энтропии для более сложных
• Химическая реакция:
rS0 = ( i S0i)продукты – ( j S0j)исх. вещества
• Температура - S=f(T):
dS=δQ/T δQ=cdT → dS=c dT/T
(∆S в диапазоне температур Т2 – Т1 с фаз.переходом):
T
2
H
dT
dT
фп
S
S
(
c
)
(
c
)
Т
2Т
1
р
1
р
2
T
T
T
фп
T
1
T
фп
T
фп
25.
4.6 Энергия Гиббса (изобарно-изотермический потенциал)Направление химического процесса
T dS δQ = dU + p dV
(v) dU + p dV -T dS 0
[см. (***) слайд 20]
dU + p dV - T dS < 0 - самопроизвольн.
процесс
dU + p dV - T dS =0 - т/д равновесие
δQ
T dS δQ
δQ - TdS ≤ 0, т.к. из 2-го начала т/д → dS
T
• Изобарно-изотермический процесс (p–const, Т–const) (v)
(v) dU + p dV - T dS 0 →dH – T dS =d(H – T S) 0=>dG 0, где
G H – T S - энергия Гиббса (изоб.-изотерм.пот-л.) [кДж; кДж моль] =>
rG(T) = rH(T) – T rS(T) = 0 - условие термодинамического равновесия !!!
rG(T) = rH(T) – T rS(T) < 0 - условие самопроизвольного процесса !!!
ЗНАТЬ НАИЗУСТЬ условия т/д равновесия и протекания процесса!!!
• Изохорно-изотермический процесс (V–const, Т–const)
dU - T dS = d(U – T S) = dА 0
A U – T S - энергия Гельмгольца
[кДж; кДж моль]
26.
Стандартная энергия Гиббса (энергия образования) веществаfG0298 (в таблицах т/д величин)
Энергия Гиббса хим.реакции rG0298
rG0298 = ( i fG0i)продукты – ( i fG0i)исходные вещества
r G r G
(*) аA + bB = сC + dD - для хим.реакции (*):
rG0298 = ( c fG0C + d fG0D) – ( a fG0A + b fG0B)
Если даны (известны) fH0i и S0i реагентов и продуктов реакции, тогда
rG0298= rH0i – 298 rS0i
rG0 298 = [ i ( fH0i – 298 S0i)]продукты –[ i( fH0i – 298 S0i)]исходные вещества=
= [( i fН0i)прод.–( i fН0i)исх. в.]–298 [( i S0i)прод.– ( i S0i)исх. в.], т.о.
))) rG0298 = rH0i – 298 rS0i
27.
4.7 Температурная зависимость rG(Т)Направление протекания химической реакции
rG(T) = rH(T) – T rS(T)
rG(T) rH0 – T rS0
rG 0 – самопроизвольный процесс rG rH0 – T rS0 0
Вклад энтальпийного ∆Н и энтропийного ∆S
факторов на величину rG в зависимости от Т
Направление протекания химической реакции
rH0 0
Экзотерм.
rH0 0
Эндотерм.
rS0 0
rG 0 при любой Т
rG 0 при
rH0
T
rS0
rS0 0
rG 0 при
rH0
T
rS0
rS0 0
rG 0 при любой Т
rS0 0
28.
4.8 Энергия Гиббса реакции в нестандартных условияхХим.реакция: аA + bB = сC + dD
Станд.усл.: С0 =1 моль/л, Т=298К
rG0 = ( c fG0C + d fG0D ) - ( a fG0A + b fG0B )
Нестанд.услов.: Ci С0,Т 298K
rGi = rG0i + R T lnCi
p
с
i
i
С
X
– безразмерная концентрация
i
i
0
0
p с
i
Xi
Сi – [ моль/л ]
i – мольная доля;
pi
– относительное парциальное давление [атм], p0 =1,013.105 Па
0
p
rG = ( c fG0C+ d fG0D ) – ( a fG0A+ b fG0B) + R T ( c lnСC+ d lnCD– a lnCA–
b lnCB)
c
d
С
С
0
C D
G
G
R
T
ln
r
r
v
v
a
b
С
С
A B
v
v
















 chemistry
chemistry








