Similar presentations:
Термодинамика. Первое и второе начало термодинамики
1. Термодинамика
наука, изучающая• превращения (переходы) энергии из одной формы в
другую, от одной части системы к другой,
•энергетические эффекты, сопровождающие физические и
химические процессы,
•возможность, направления и предел самопроизвольного
протекания процессов.
Химическая термодинамика термодинамика химических процессов.
2.
Термодинамика• не рассматривает внутреннее строение тел и
механизм протекающих в них процессов;
• изучает только макроскопические системы (порядка
моля вещества);
• отсутствует понятие "время".
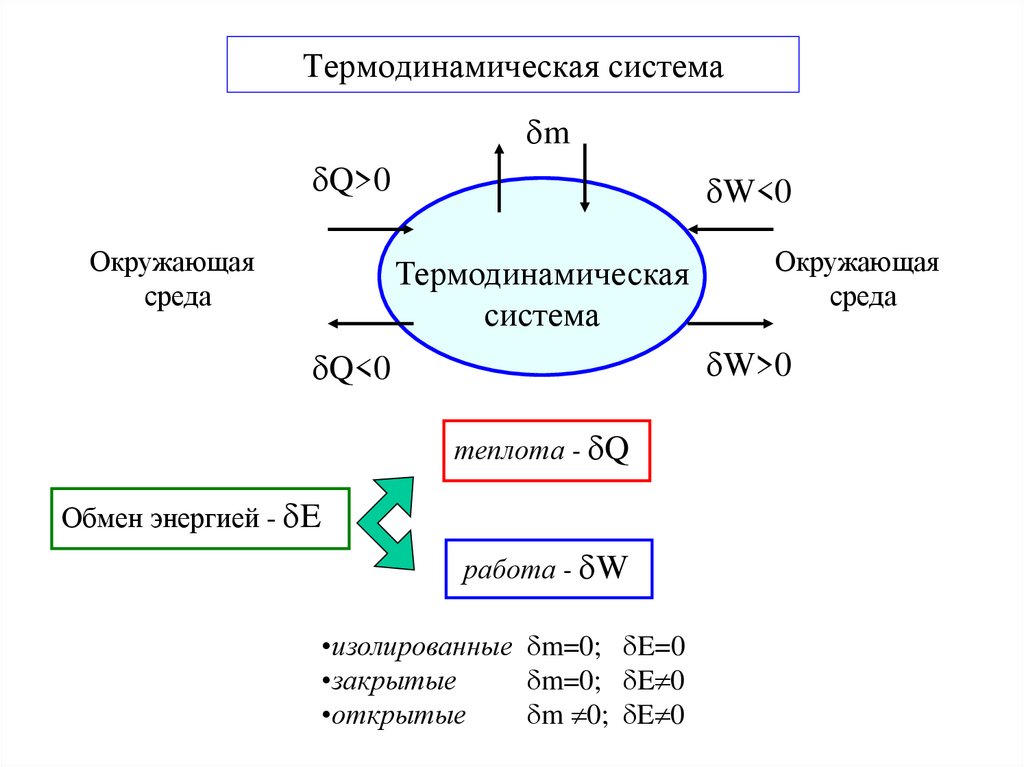
3. Термодинамическая система
mQ>0
Окружающая
среда
W<0
Термодинамическая
система
Окружающая
среда
W>0
Q<0
теплота - Q
Обмен энергией - E
работа - W
•изолированные m=0; E=0
•закрытые
m=0; E 0
•открытые
m 0; E 0
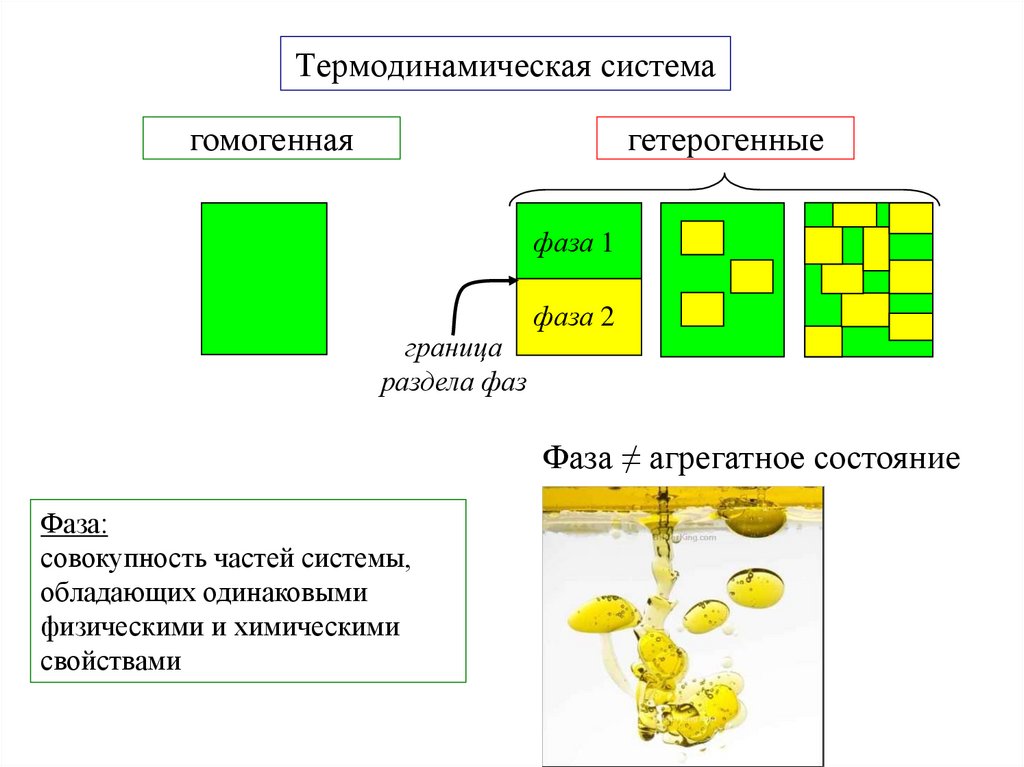
4. Термодинамическая система
гомогеннаягетерогенные
фаза 1
граница
раздела фаз
фаза 2
Фаза ≠ агрегатное состояние
Фаза:
совокупность частей системы,
обладающих одинаковыми
физическими и химическими
свойствами
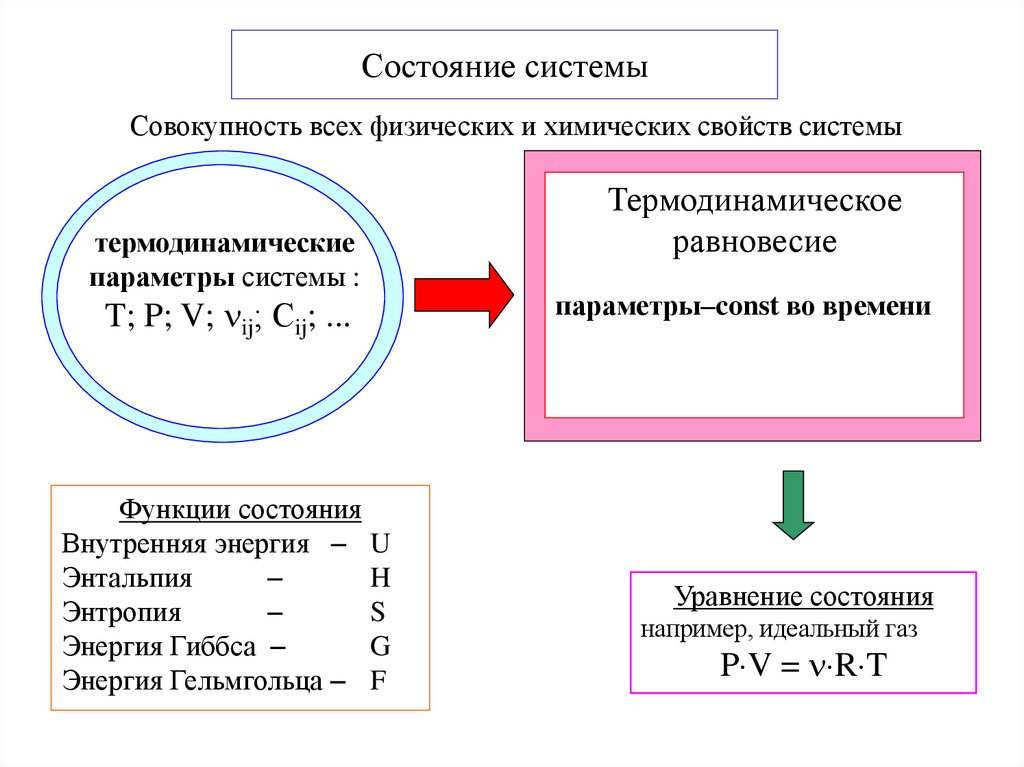
5. Состояние системы
Совокупность всех физических и химических свойств системытермодинамические
параметры системы :
T; P; V; ij; Сij; ...
Функции состояния
Внутренняя энергия U
Энтальпия
H
Энтропия
S
Энергия Гиббса
G
Энергия Гельмгольца F
Термодинамическое
равновесие
параметры–const во времени
Уравнение состояния
например, идеальный газ
P V = R T
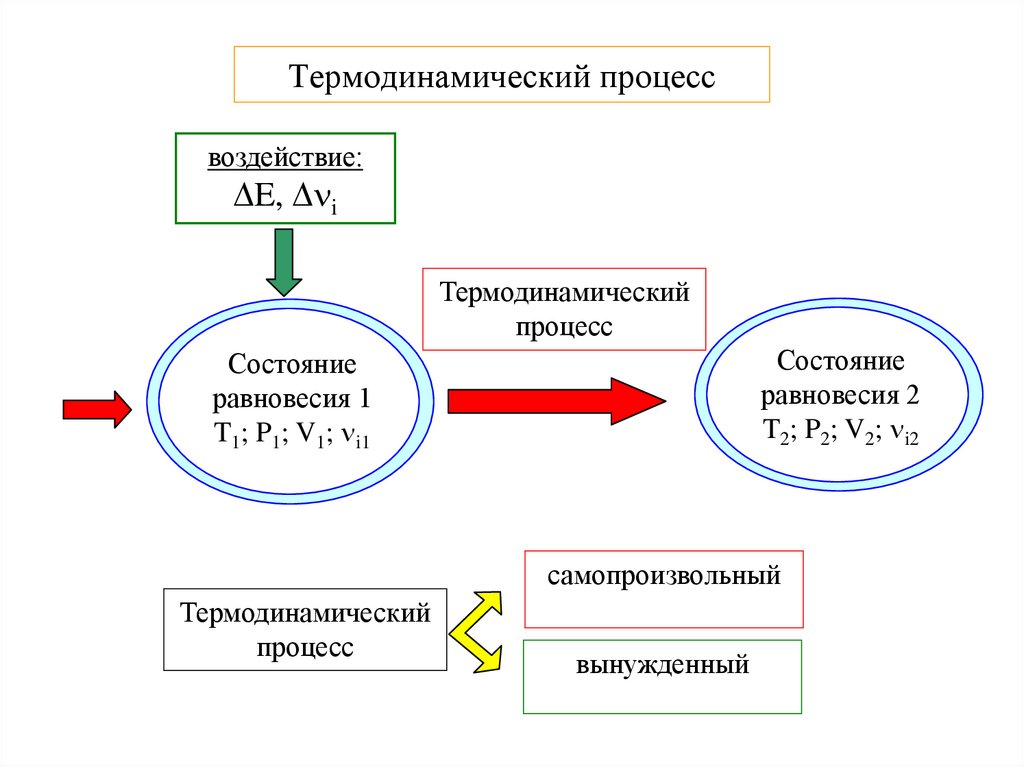
6. Термодинамический процесс
воздействие:E, i
Термодинамический
процесс
Состояние
равновесия 2
T2; P2; V2; i2
Состояние
равновесия 1
T1; P1; V1; i1
самопроизвольный
Термодинамический
процесс
вынужденный
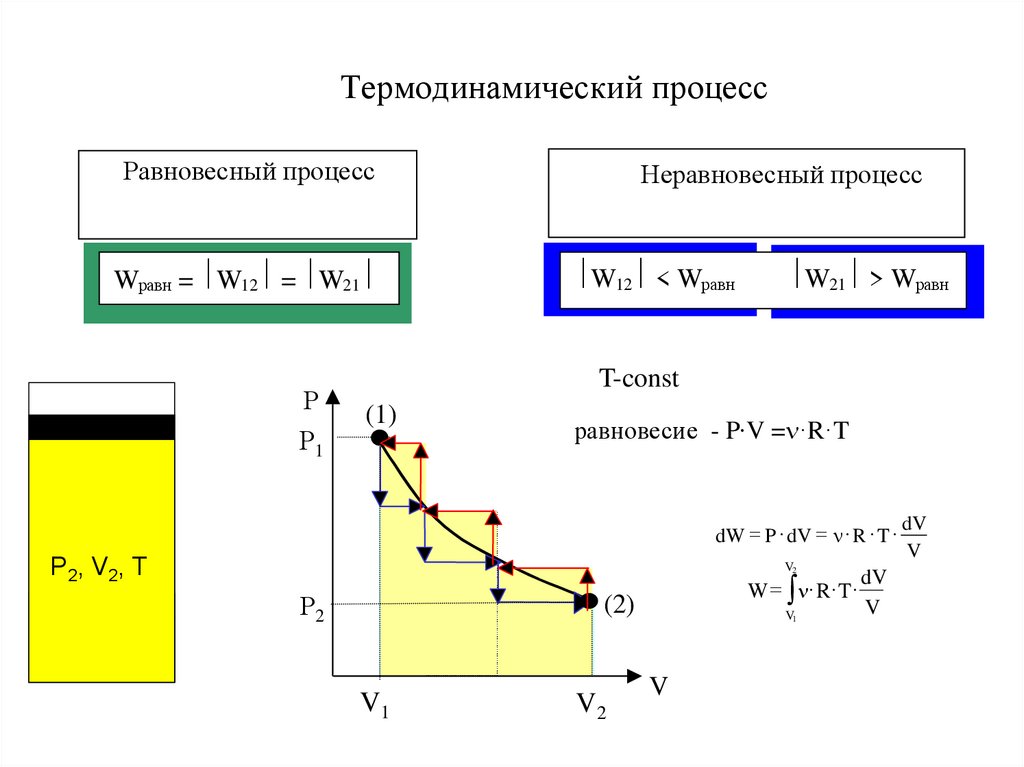
7. Термодинамический процесс
изотермический - Т=constизохорический - V=const
изобарический - Р= const
равновесный (обратимый)
Термодинамический
процесс
неравновесный (необратимый)
8. Термодинамический процесс
Равновесный процессWравн = W12 = W21
Р
Р1
Неравновесный процесс
W12 < Wравн
W21 > Wравн
T-const
(1)
равновесие - P∙V = ·R·T
dW = P dV = R T
mg
P2, V2, T
V2
Р2
W = R T
(2)
V1
P1, V1, T
V1
V2
V
dV
V
dV
V
9. Химическая реакция
αА + βB = γC + δDисходные продукты
вещества
α,β,γ,δ –
стехиометрические
коэффициенты
количество исходных веществ уменьшается
количество продуктов увеличивается
количество продуктов уменьшается
количество исходных веществ увеличивается
10. Первое начало термодинамики
Теплота (Q), сообщенная термодинамической системе, идет наувеличение внутренней энергии ( U) системы и на совершение
системой работы (W).
Q
Q = U + W
U
Термодинамическая
система
T; P; V; Сi
Q = dU + W
W
Q = dU + P dV
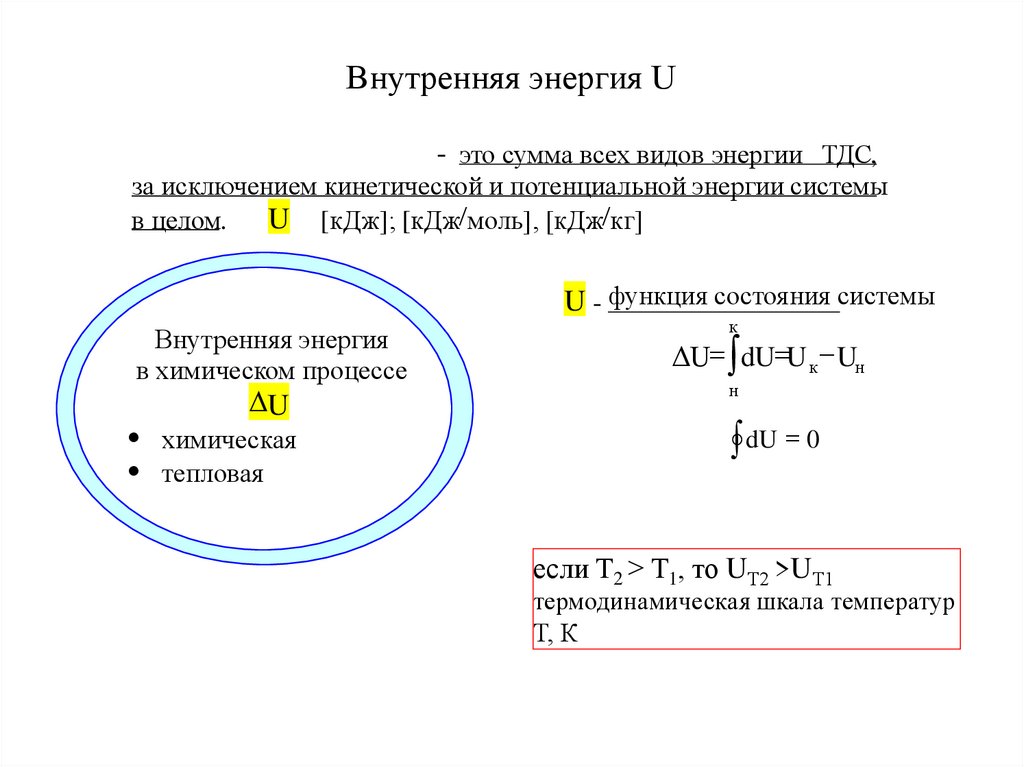
11. Внутренняя энергия U
- это сумма всех видов энергии ТДС,за исключением кинетической и потенциальной энергии системы
U [кДж]; [кДж/моль], [кДж/кг]
в целом.
U - функция состояния системы
к
Внутренняя энергия
в химическом процессе
ΔU= dU=U к Uн
н
U
dU = 0
химическая
тепловая
если Т2 > Т1, то UТ2 >UТ1
термодинамическая шкала температур
Т, К
12. Энтальпия
Q = dU + WW = P dV
QV = U
V=const
P =const
QP = U+ P V
Н= U + P V – энтальпия
[кДж]; [кДж/моль], [кДж /кг]
Q = dU + P dV
QV = dU
QP = dU + P dV
QP = d(U + P V)
QP = d Н
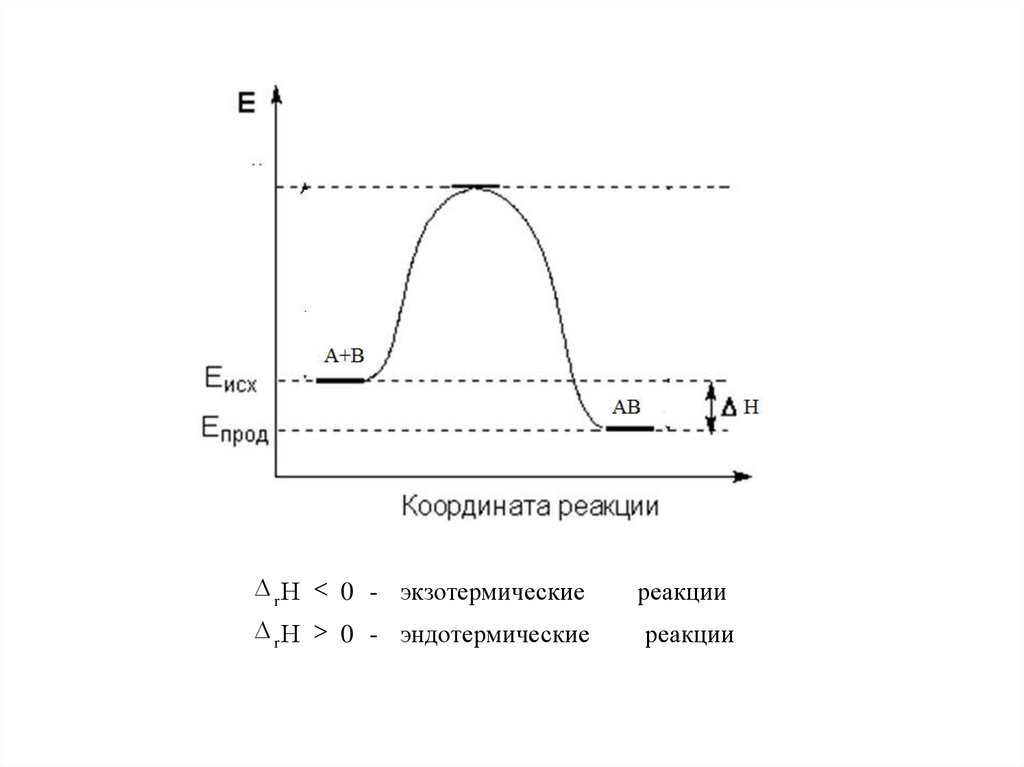
13. Тепловой эффект химической реакции
- количество теплоты QP =const или V=const
экзотермические
Химическая реакция
Т=const
Q
эндотермические
Изохорный т епловой эффект химической реакции Изобарный тепловой эффект химической реакции -
Q V = r U
Q P = r Н
Н < 0 - экзотермические реакции
r
Н > 0 - эндотермические реакции
r
14.
r Н < 0 - экзотермическиеr Н > 0 - эндотермические
реакции
реакции
15.
Теплота сгорания вещества – тепловой эффект реакцииокисления 1 моля вещества в избытке кислорода до
высших устойчивых оксидов.
1 Al + 3 /4 O2 = 1 / 2 Al2O3 + cН
cН = -838,05 [ кДж/моль]
cН – сгорание
одного моля в-ва
16.
Теплота растворения – тепловой эффект процессарастворения 1 моля вещества в бесконечно большом
количестве растворителя.
∆Нраств = ∆Нкр.реш.+ ∆Нсольв
∆Нкр.реш < 0
∆Нсольв > 0
Мольная масса,
г/ моль
q,
Дж/моль
NaCl
58,5
+ 4 944
Na2SO4
142
−1 927
Na2SO4*10H2O
322
+78 600
NaNO3
85
+21 080
K2CO3*1,5H2O
165
+ 1 590
KC1
74,6
+ 17 560
KNO3
101
+35 700
Формула соли
KOH*2H2O
92
+126
(NH4)2SO4
132
+9 930
CaCl2*6H2O
219
+18 060
MgCl2*6H2O
203
—12 360
17.
Теплота образования вещества – тепловой эффект реакцииобразования 1 моля сложного вещества из простых.
Теплоты образования простых веществ принимаются
равными нулю.
Na +1/2 O2 + 1/2 H2 = NaOH + fН
Н2 + 1/2 О2 = Н2О
Na+ Н2О = NaOH+ 1/2 H2
18. Стандартная энтальпия образования вещества
• Стандартные условия:Р0 = 1,013 105 Па
Т0 = 298,15 К
С0 = 1моль/л
fН0298 стандартная
энтальпия(теплота)
образования
• fН0298 –Стандартная
энтальпия образования веществ:
1. простые в-ва
fН0298= 0 кДж/моль
1. Газообразный водород
2. Ртуть жидкость
3.Углерод твердый
графит
алмаз
2. сложные в-ва
fН0298= QР кДж/моль
1/2 А2 + 1/2 В2 = АВ + fН0298
fН0298= 0 кДж/моль.
fН0298= 0 кДж/моль.
fН0298 = 0 кДж/моль,
fН0298 = 1,83кДж/моль
19. Закон Г.И.Гесса
«тепловой эффект реакции зависит только от вида и состоянияисходных веществ и конечных продуктов и не зависит от пути
превращения одних веществ в другие (промежуточных стадий)»
rН , кДж
C; O 2
1.
2.
C + O 2 = CO 2
rН 1 = -393.51 кДж
C + 0.5O 2 = CO
rН 2 = -110.53 кДж
CO + 0.5O 2 = CO 2
rН 3 = -282.98 кДж
CO
rН 2
rН 1
rН 3
CO 2
r Н 1 = r Н 2 + rН 3
20. Следствие из закона Гесса:
rН0298 = ( i fН0i)продукты – ( i fН0i)исходныеДля реакции
вещества
αA + βB = γC + δD
rН0298 = (γ fН0C + δ fН0D ) – (α fН0A + β fН0B)
Пример.
реакция :
fН0298, кДж/моль
CH4 (газ) + CO2 (газ) = 2 CO (газ) + 2H2 (газ)
–74,85
–393,51
–110,5
0
Расчет теплового эффекта реакции:
rН0298 = [2 (–110,5) + 2 0] – [(–74,85) + (–393,51)] = 247,36 [кДж]
21. Зависимость энтальпии образования в-ва от температуры
cр =cp - изобарная теплоемкость,
молярная [Дж/мольК]
T
δQ р
dT
=
dH
dT
T
Δ f H T = Δ f H 0 298 c р dT
Δ f H T Δ f H 0 298 = c р dT
298
298
Если в интервале Т1 - Т2 фазовые переходы: плавление Тпл, кипение Ткип
Т пл
ΔH T 2 ΔH T 1 = c рт dT Δ m H 0
T1
Т кип
Т пл
mН0 [кДж/моль] – энтальпия плавления
vН0 [кДж/моль] – энтальпия испарения
čр - const
HТ2 – HТ1 = čр (T2 – T1)
cp(Т) = а + b Т + c Т2 +…
c рж dT Δ v H 0
T2
c
Т кип
рп
dT
22. пример - Н2О
fHT(cp) пар
vH
(cp) жидкость
fH0
(cp) лед
mH
273
298
373
Т, К
23. Второе начало термодинамики.
24.
Второе начало термодинамики.Энтропия
Термодинамическая энтропия - термодинамическая
функция, характеризующая меру необратимого рассеяния
энергии в системе. (Клаузиус, 1865г.)
Q
=S
T
S - энтропия
мера отклонения реального
процесса от идеального.
Для обратимых (равновесных) процессов
dS =
δQ
T
S =
Q
T
dS = 0
Функция состояния
25.
Неравновесный процессQ
T2 < T1.
ΔS > 0.
в изолированной системе
самопроизвольно протекают процессы с увеличением энтропии
при равновесии S максимальна (dS = 0)
(dS > 0)
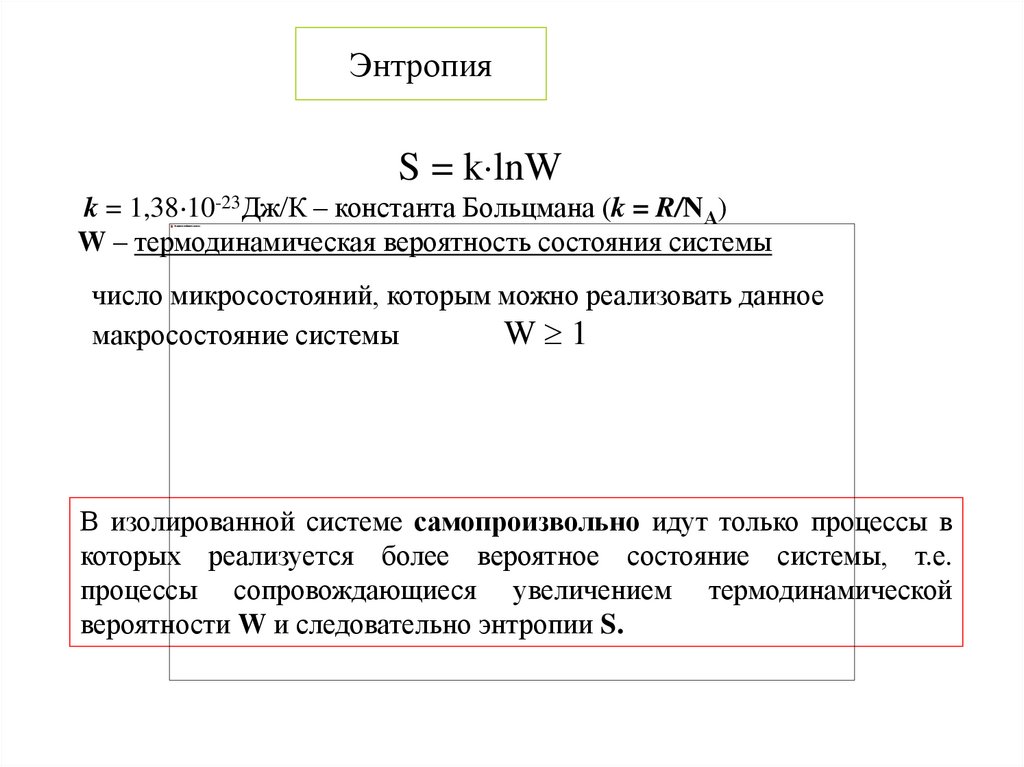
26. Энтропия
S = k lnWk = 1,38 10-23Дж/К – константа Больцмана (k = R/NА)
W – термодинамическая вероятность состояния системы
число микросостояний, которым можно реализовать данное
макросостояние системы
W 1
В изолированной системе самопроизвольно идут только процессы в
которых реализуется более вероятное состояние системы, т.е.
процессы сопровождающиеся увеличением термодинамической
вероятности W и следовательно энтропии S.
27. Энтропия
IW1= 1
II
Энтропия
I – V варианты распределения по двум половинам (макросостояния системы)
Wi – число способов (микросостояний)
W2= 4
III
реализации макросостояний
ΣWi=16 - всего способов размещения 4-х
молекул по двум половинам
W3= 6
P=6/16 математическая вероятность
W4= 4
W – термодинамическая вероятность
0≤P≤1
IV
V
W5= 1
W3=6
1≤W≤∞
Max
28.
Третье начало термодинамикиПри приближении к абсолютному нулю, приращение
энтропии не зависит от конкретных значений
термодинамических параметров состояния системы и
стремится к вполне определенному конечному пределу.
Энтропия каждого индивидуального вещества в состоянии
совершенного кристалла при Т=0 равна нулю
29. Факторы влияющие на величину энтропии
S [Дж/К]S0298 [Дж/моль К]
S ф1 Sф2 =
• Фазовый переход
Фаза
S0298, Дж/моль К
лед
39,33
Δ фп H
Tфп
= Δ фп S
жидкая вода
69,95
водяной пар
188,72
• Химическая реакция
rS0 = ( i S0i)продукты – ( i S0i)исх. вещества
• Температура
Tфп
SТ 2 SТ 1 =
T2
T2
dT Δ фп H
dT
(c р )1
(c р ) 2
T
Tфп
T
Tфп
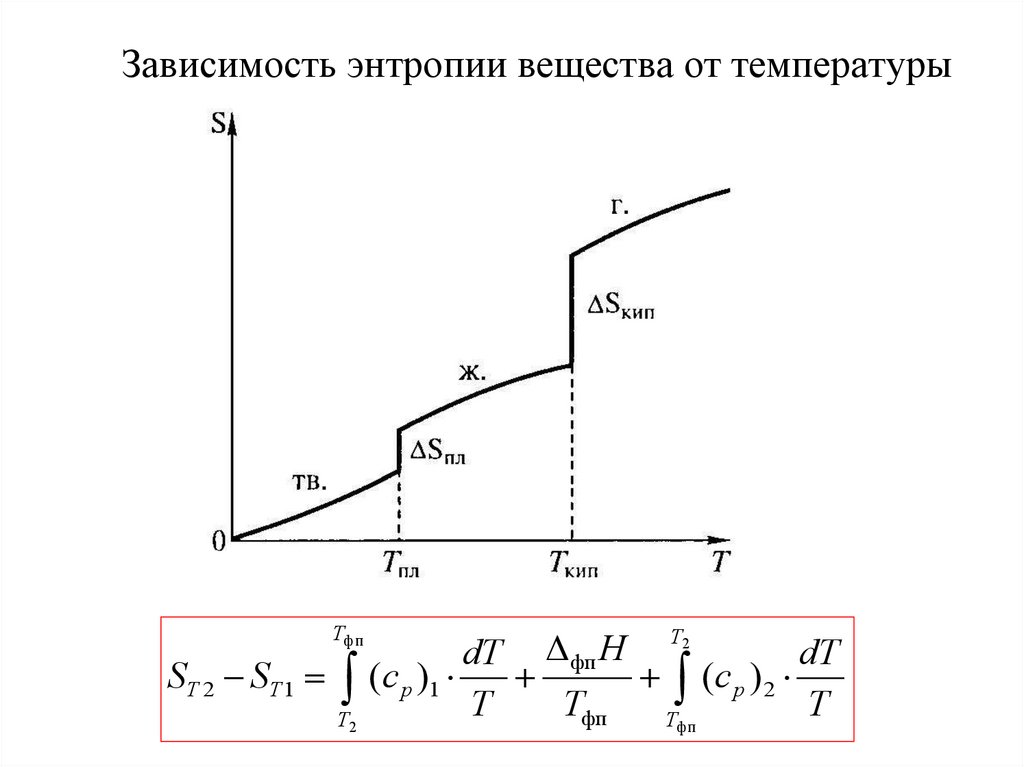
30. Зависимость энтропии вещества от температуры
TфпSТ 2 SТ 1 =
T2
Δ фп H
T2
dT
dT
(c р )1
(c р ) 2
T
Tфп
T
Tфп
31. Критерии самопроизвольности протекания химических процессов
Для изолированной системы: реакция протекает в сторонуувеличения энтропии.
• увеличение числа молей газа
• увеличение числа фаз (выпадение осадка)
Для закрытых систем: потенциалы
Гельмгольца ( изохорно-изотермический) F U – T S
G H – T S
Гиббса (изобарно-изотермический)
[кДж; кДж/моль]
32. Свободная энергия
ΔF = ΔU – T ΔSΔU = ΔF +T ΔS
ΔG = ΔH – T ΔS
ΔH = ΔG + T ΔS
33. Свободная энергия Гиббса
По физическому смыслу свободная энергия Гиббса - это тачасть теплосодержания Н, которое тело может превратить в
работу при постоянных температуре и давлении.
Свободная энергия Гиббса - это величина,
показывающая изменение энергии в ходе химической
реакции и дающая ответ на вопрос о возможности
протекания химической реакции
34. Температурная зависимость rG
Температурная зависимость rGrG(T) rH0 – T rS0
rG(T) = rH(T) – T rS(T)
rG < 0 - самопроизвольный процесс
rG(T) rH0 – T rS0 < 0
Направление протекания химической реакции
rH0< 0
rH0 > 0
rS0>0
rG < 0 при любой Т
rS0<0
Δr H0
rG < 0 при T <
Δ r S0
rS0>0
rG < 0 при
rS0<0
Δr H0
T>
Δ r S0
rG > 0 при любой Т
35.
Вопросы для конспектирования1. Термодинамика как наука. Основные понятия, границы применимости. :
Системы и их классификации, термодинамическая фаза, термодинамические
переменные (параметры состояния), термодинамические функции, равновесие.
2. I начало термодинамики. Энтальпия. Стандартная энтальпия образования
вещества. Зависимость энтальпии от температуры.
3. II начало термодинамики. Энтропия. . Статистический смысл энтропии по
Больцману.
4. Свободная энергия Гиббса.
5. Условия равновесия и самопроизвольности протекания процесса.


























 physics
physics chemistry
chemistry








