Similar presentations:
Физико-химические основы патологии клетки. Митохондрии и апоптоз
1. Физико-химические основы патологии клетки
Российский Государственный Медицинский УниверситетМосковский Государственный Университет
Ю. А. Владимиров
Физико-химические основы
патологии клетки
Митохондрии и
апоптоз
Москва © 1999
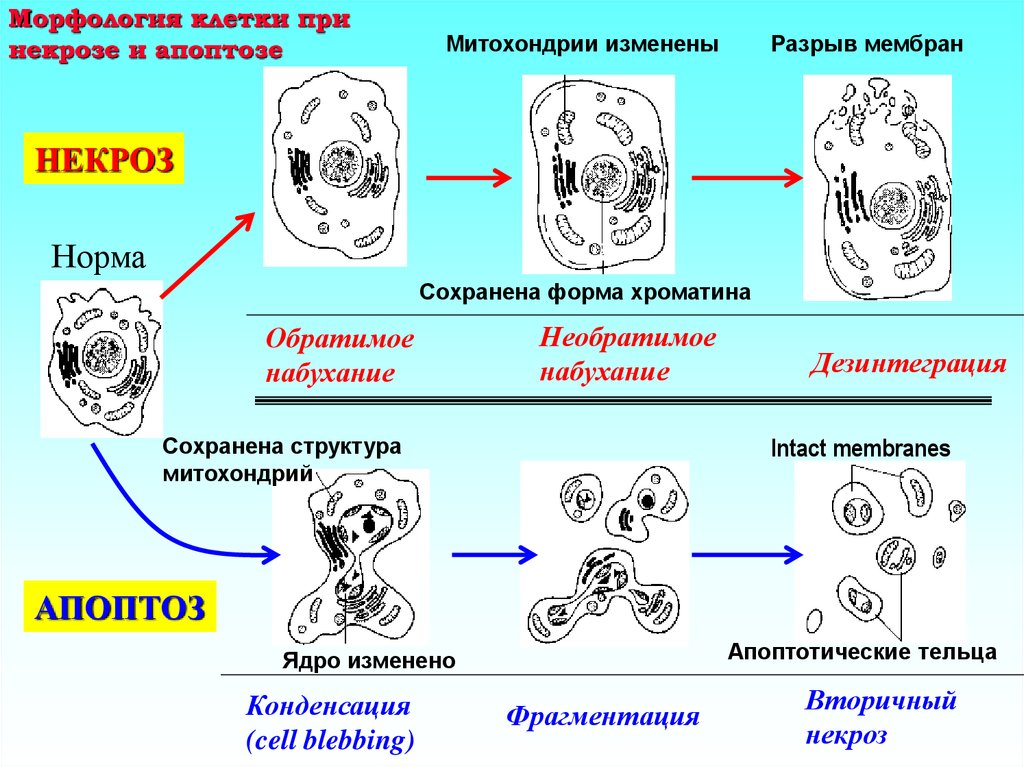
2. Морфология клетки при некрозе и апоптозе
Митохондрии измененыРазрыв мембран
НЕКРОЗ
Норма
Сохранена форма хроматина
Обратимое
набухание
Необратимое
набухание
Дезинтеграция
Intact membranes
Сохранена структура
митохондрий
АПОПТОЗ
Апоптотические тельца
Ядро изменено
Конденсация
(cell blebbing)
Фрагментация
Вторичный
некроз
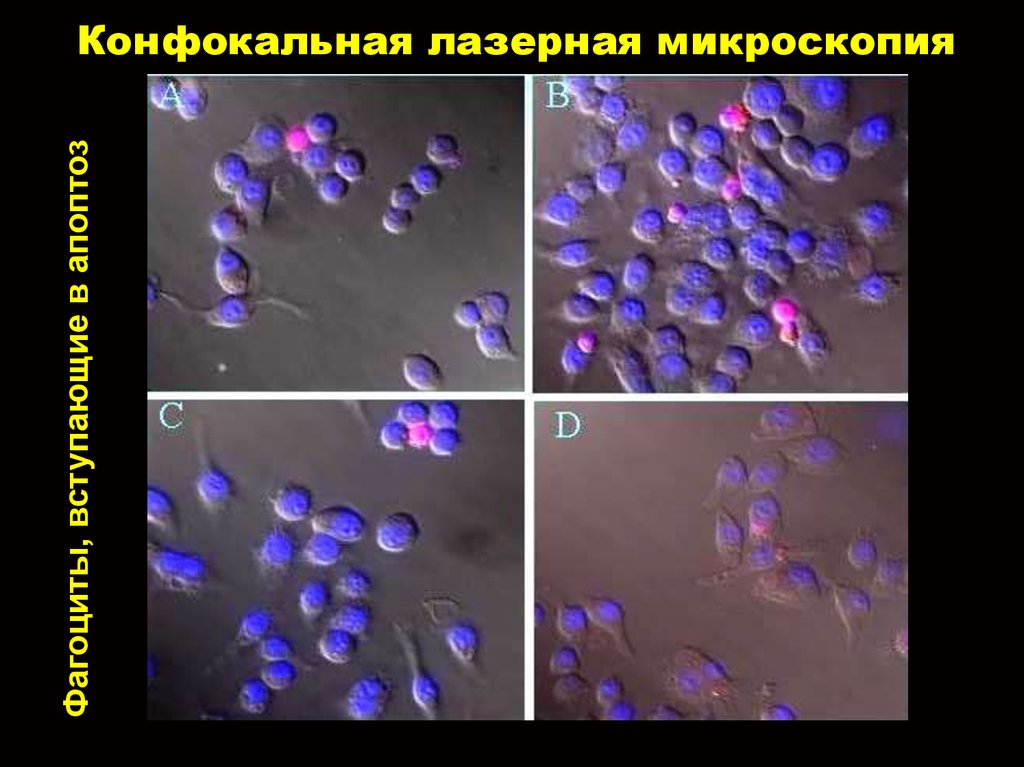
3. Apoptosis in neutrophils
controlspontaneous
xantinoxidase
glucosoxidase
Fig. 4. Morphology of apoptotic neutrophils. 100,000 purified neutrophils were cytocentrifuged and the slides were then fixed and
stained as indicated in Materials and Methods. (A) Freshly purified neutrophils; (B) purified neutrophils incubated in standard culture
conditions for 22 h (spontaneous apoptosis); (C) purified neutrophils incubated with 27 mU/ml XO for 10 h; (D) purified neutrophils
incubated with 5 mU/ml GO for 10 h.
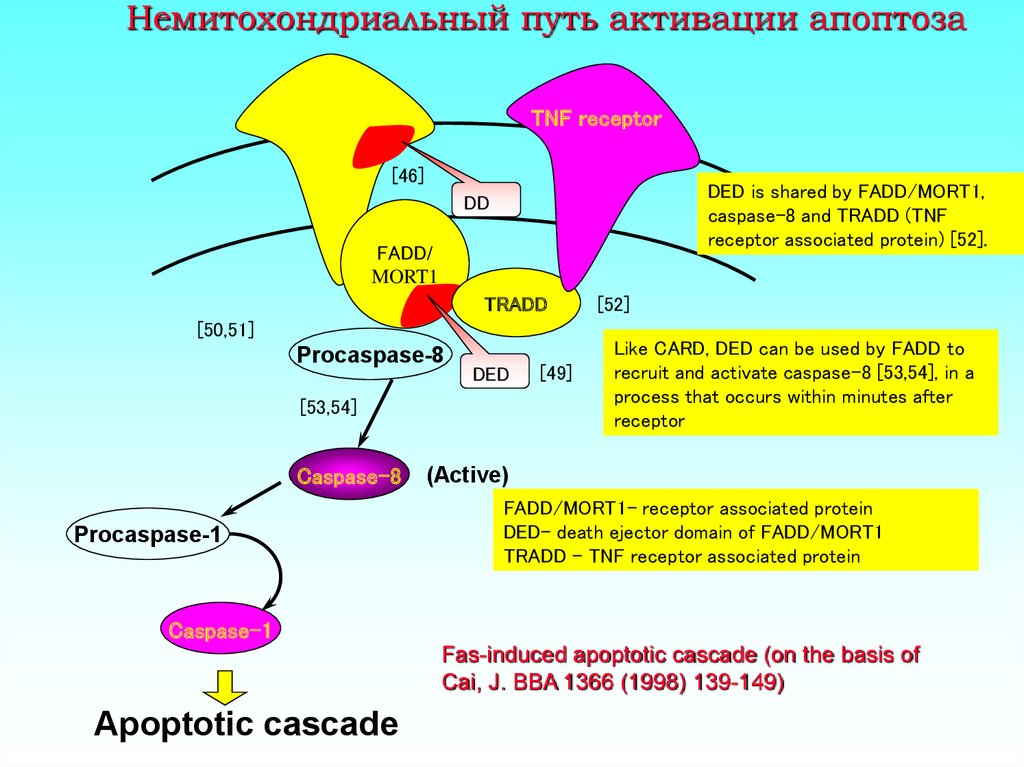
4. Немитохондриальный путь активации апоптоза
Fas receptorTNF receptor
[46]
DED is shared by FADD/MORT1,
caspase-8 and TRADD (TNF
receptor associated protein) [52].
DD
FADD/
MORT1
TRADD
[50,51]
Procaspase-8
DED
[53,54]
Caspase-8
Procaspase-1
[49]
[52]
Like CARD, DED can be used by FADD to
recruit and activate caspase-8 [53,54], in a
process that occurs within minutes after
receptor
(Active)
FADD/MORT1- receptor associated protein
DED- death ejector domain of FADD/MORT1
TRADD - TNF receptor associated protein
Caspase-1
Fas-induced apoptotic cascade (on the basis of
Cai, J. BBA 1366 (1998) 139-149)
Apoptotic cascade
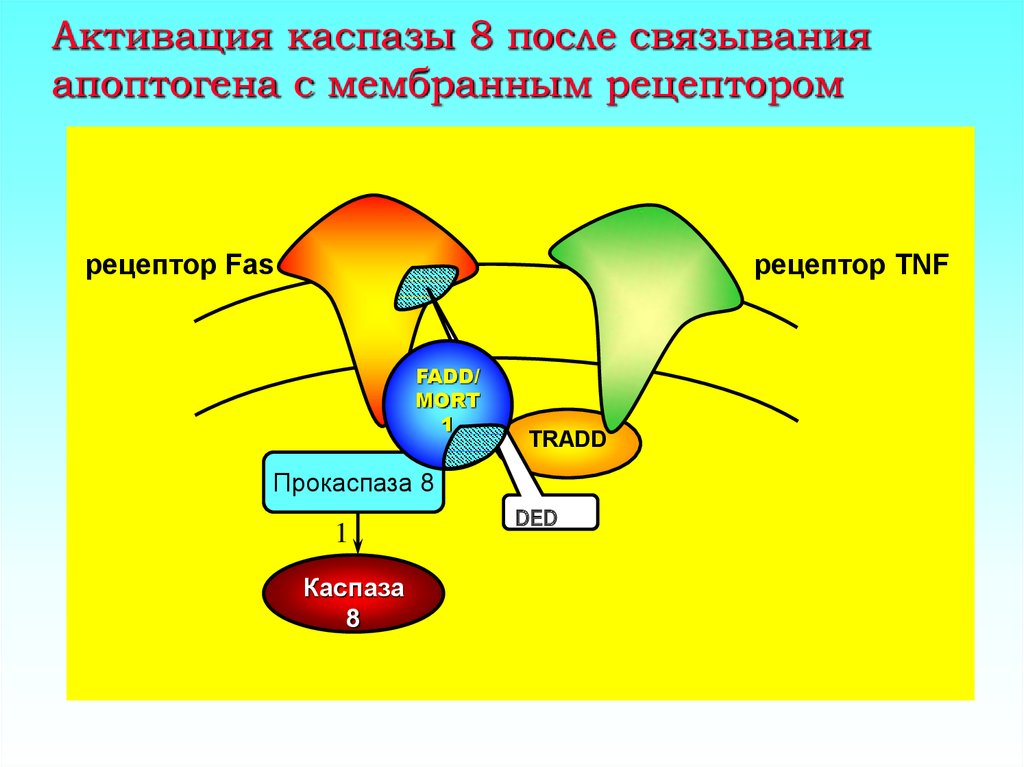
5. Активация каспазы 8 после связывания апоптогена с мембранным рецептором
рецептор Fasрецептор TNF
FADD/
MORT
1
TRADD
Прокаспаза 8
1
Каспаза
8
DED
6. Апоптоз
CD95LFADD
CD95
Прокаспаза-8
c-FLIP
Повреждение ДНК
1
Bid
2
Каспаза-8
Прокаспаза-3
8
Апоптосома
6
Каспаза-9
Каскад ферментных реакций
4
t-Bid
3
Прокаспаза-9
7
p53
Bcl-xL
9
Каспаза-3
Bcl-2
5
Cyt c
dАТФ
Apaf-1
АПОПТОЗ
Bax
AIF
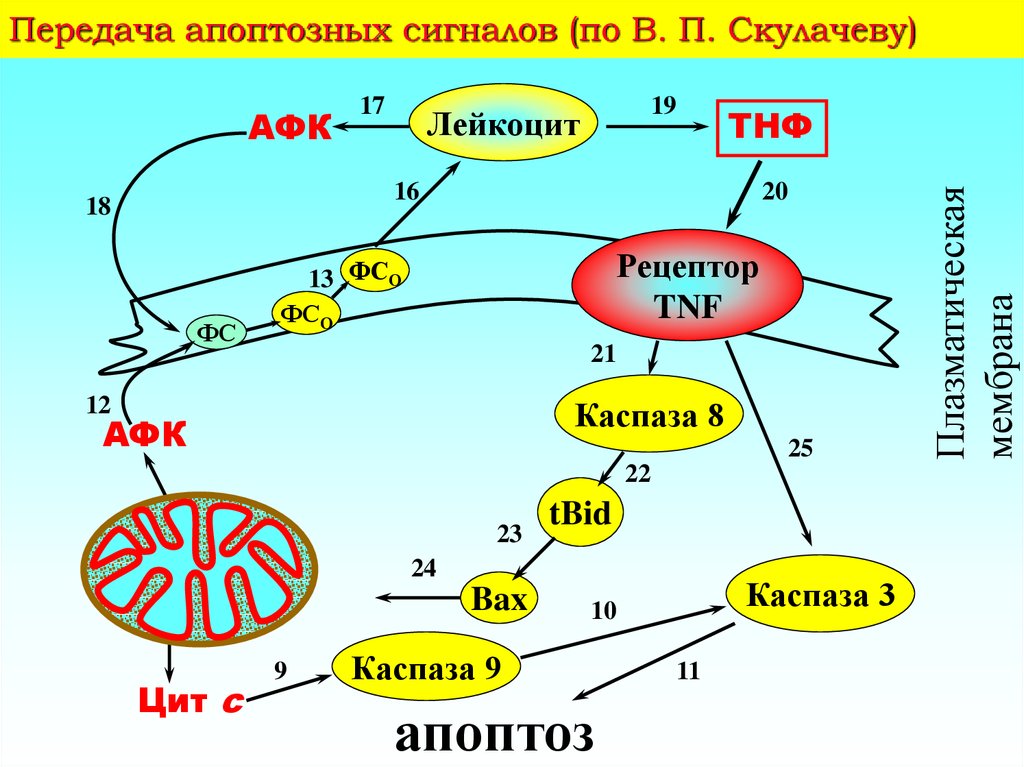
7. Передача апоптозных сигналов (по В. П. Скулачеву)
19Лейкоцит
ТНФ
16
18
ФС
20
Рецептор
TNF
13 ФСО
ФСО
21
Каспаза 8
12
АФК
25
22
23
tBid
24
Bax
Цит c
9
Каспаза 3
10
Каспаза 9
апоптоз
11
Плазматическая
мембрана
АФК
17
8. Каскад активации апоптоза, инициированный выходом цитохрома c
прокаспаза 93
4
Apaf 1
Apaf 1
прокаспаза 3
+dATP
5
2
6
Cyt c
Cyt c
1
7
каспаза 9
каспаза 3
Активация белковапоптогенов и инактивация
ферментов репарации ДНК
8
АПОПТОЗ
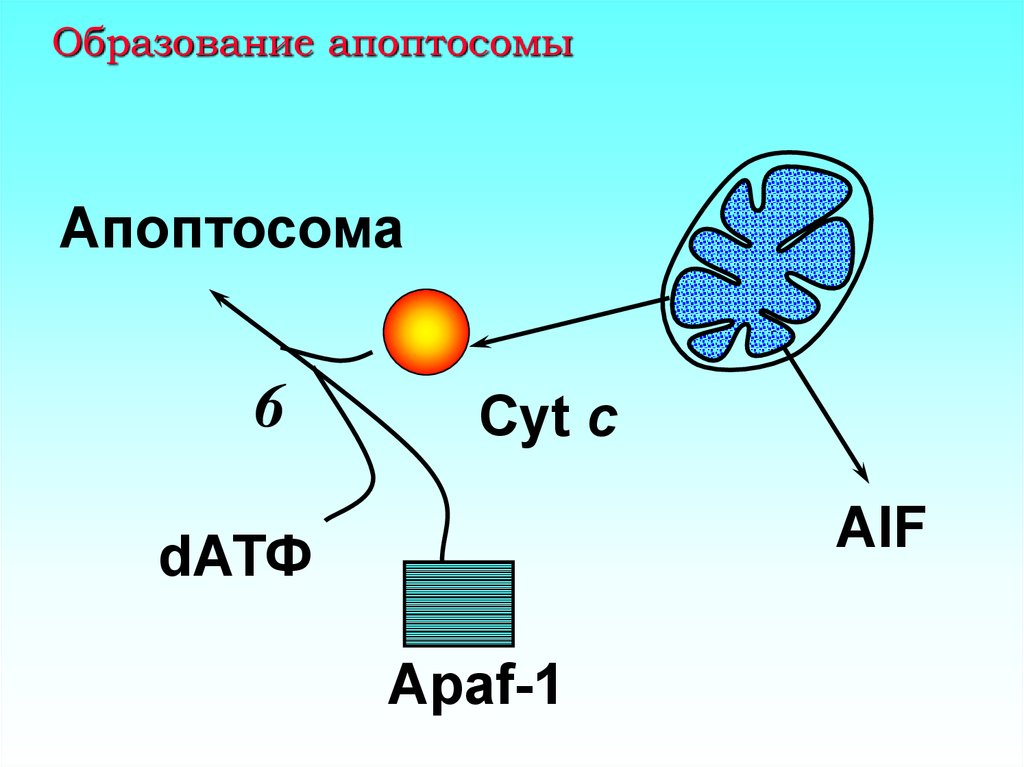
9. Образование апоптосомы
Апоптосома6
Cyt c
AIF
dАТФ
Apaf-1
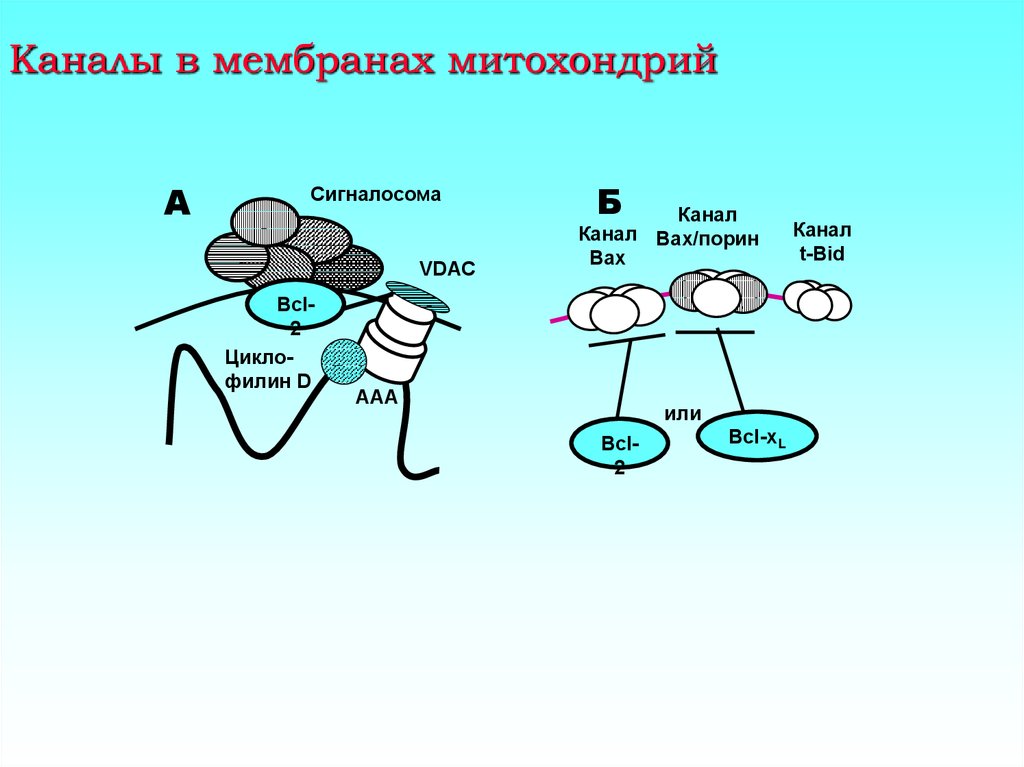
10. Каналы в мембранах митохондрий
АСигналосома
VDAC
Bcl2
Циклофилин D
Б
Канал
Канал Bax/порин
Bax
ААА
или
Bcl2
Bcl-xL
Канал
t-Bid
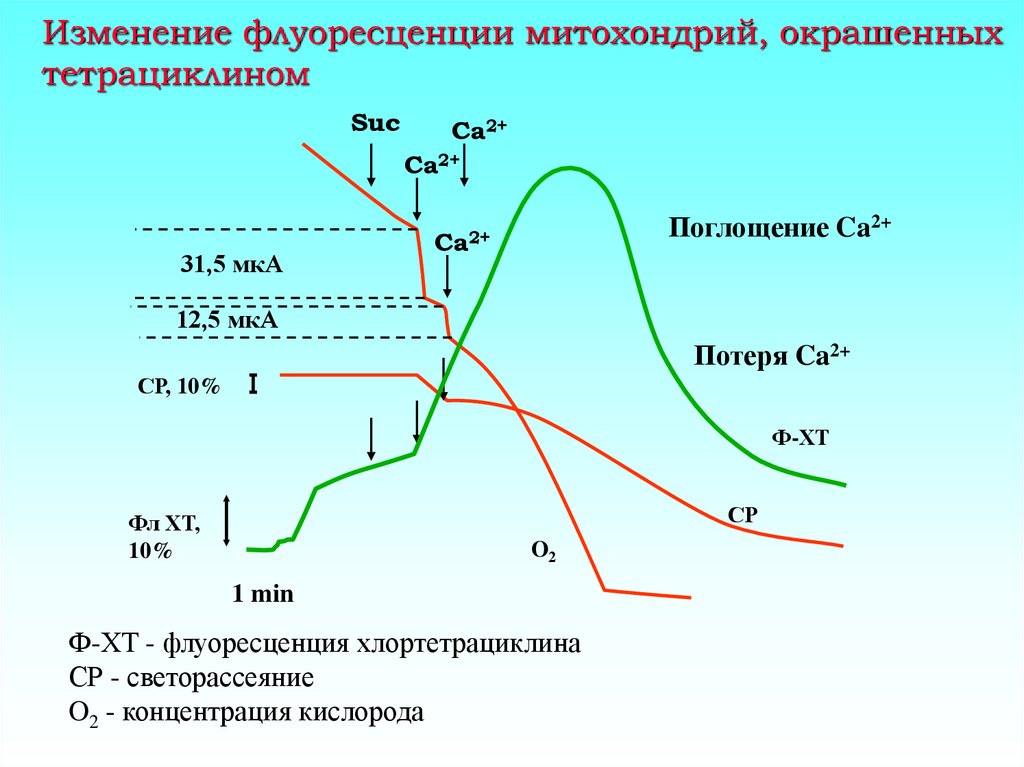
11. Изменение флуоресценции митохондрий, окрашенных тетрациклином
SucCa2+
Ca2+
31,5 мкА
Поглощение Ca2+
Ca2+
12,5 мкА
Потеря Ca2+
СР, 10%
Ф-ХТ
СР
Фл ХТ,
10%
O2
1 min
Ф-ХТ - флуоресценция хлортетрациклина
СР - светорассеяние
O2 - концентрация кислорода
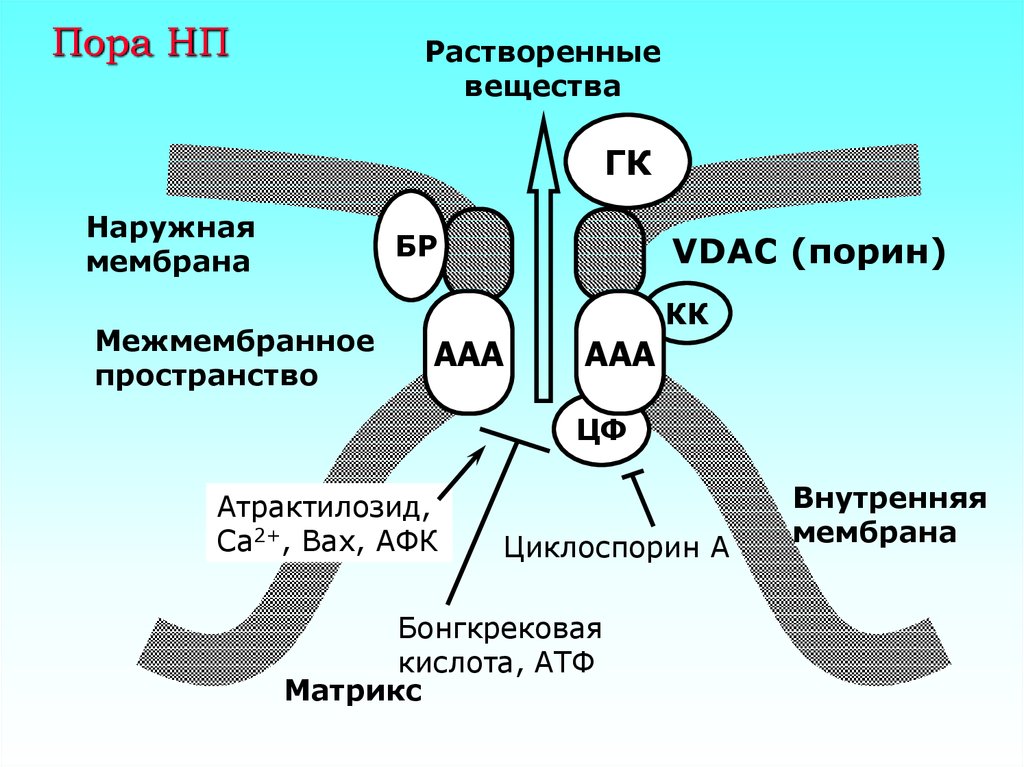
12. Пора НП
Растворенныевещества
ГК
Наружная
мембрана
БР
Межмембранное
пространство
VDAC (порин)
КК
ААА
ААА
ЦФ
Атрактилозид,
Са2+, Вах, АФК
Циклоспорин А
Бонгкрековая
кислота, АТФ
Матрикс
Внутренняя
мембрана
13. Конфокальная лазерная микроскопия
Фагоциты, вступающие в апоптозКонфокальная лазерная микроскопия
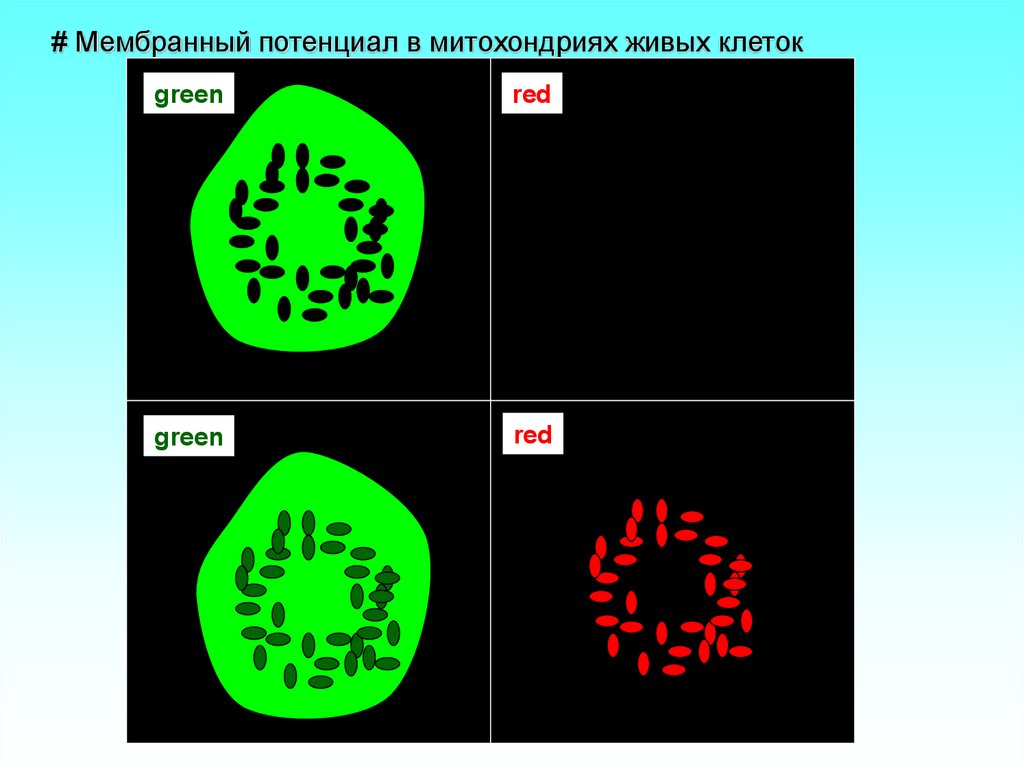
14. # Мембранный потенциал в митохондриях живых клеток
greenred
green
red
15. Мембранная фаза апоптоза: связывание прокаспазы 8
CD95LFADD
CD95
Прокаспаза-8
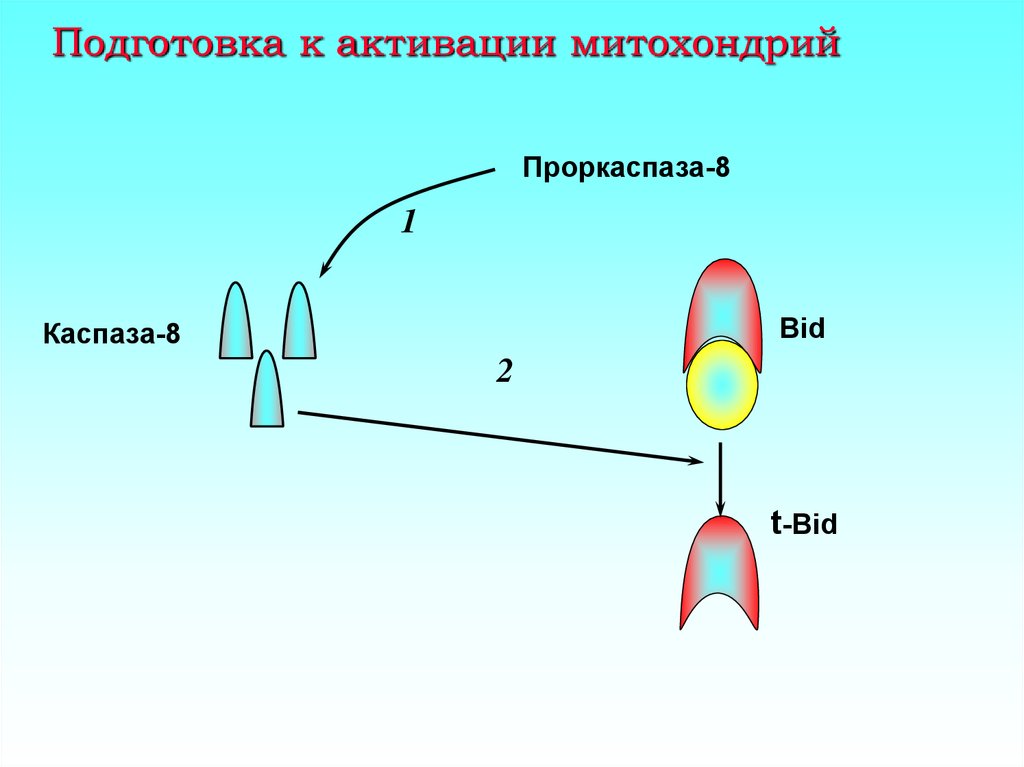
16. Подготовка к активации митохондрий
Проркаспаза-81
Bid
Каспаза-8
2
t-Bid
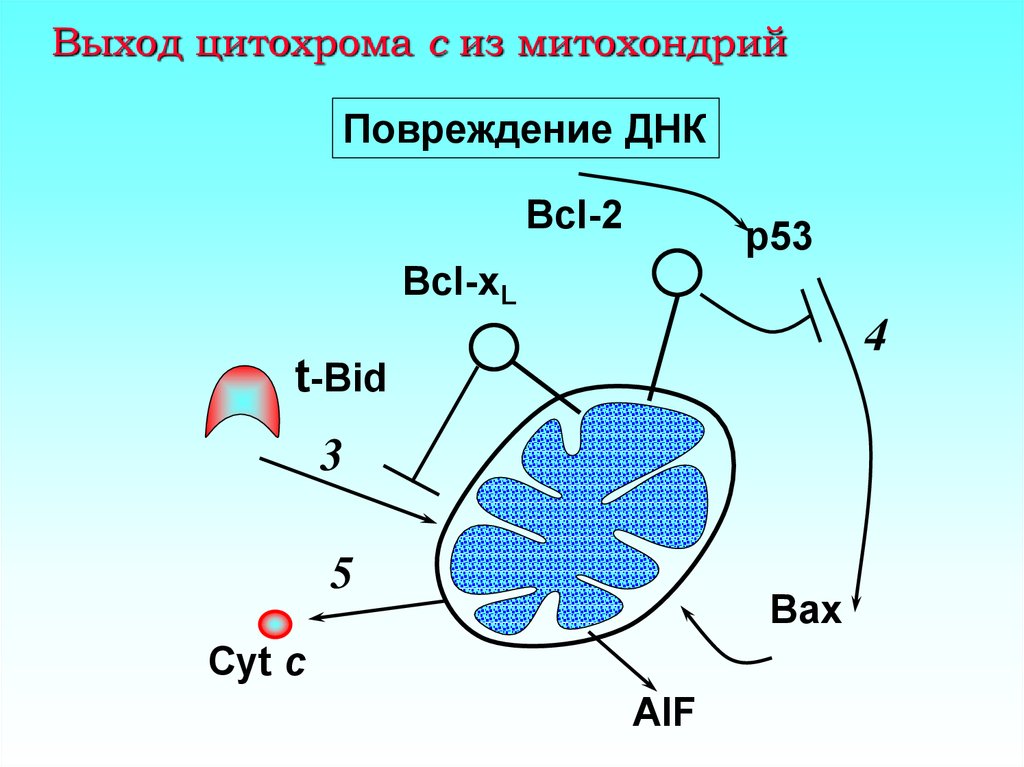
17. Выход цитохрома с из митохондрий
Повреждение ДНКBcl-2
p53
Bcl-xL
4
t-Bid
3
5
Bax
Cyt c
AIF
18. Апоптозный каскад реакций каспаз 3 9
Апоптозный каскад реакций каспаз 3 9Прокаспаза-3
Прокаспаза-9
8
7
Апоптосома
Каспаза-3
Каспаза-9
Каскад ферментных реакций
АПОПТОЗ
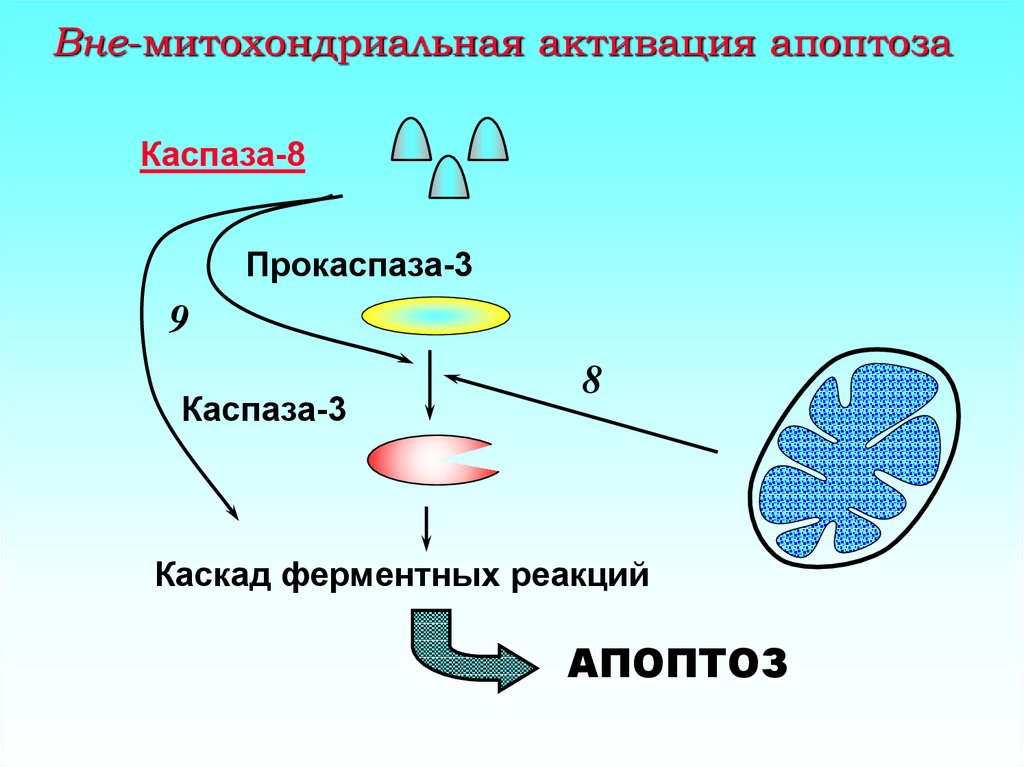
19. Вне-митохондриальная активация апоптоза
Каспаза-8Прокаспаза-3
9
Каспаза-3
8
Каскад ферментных реакций
АПОПТОЗ
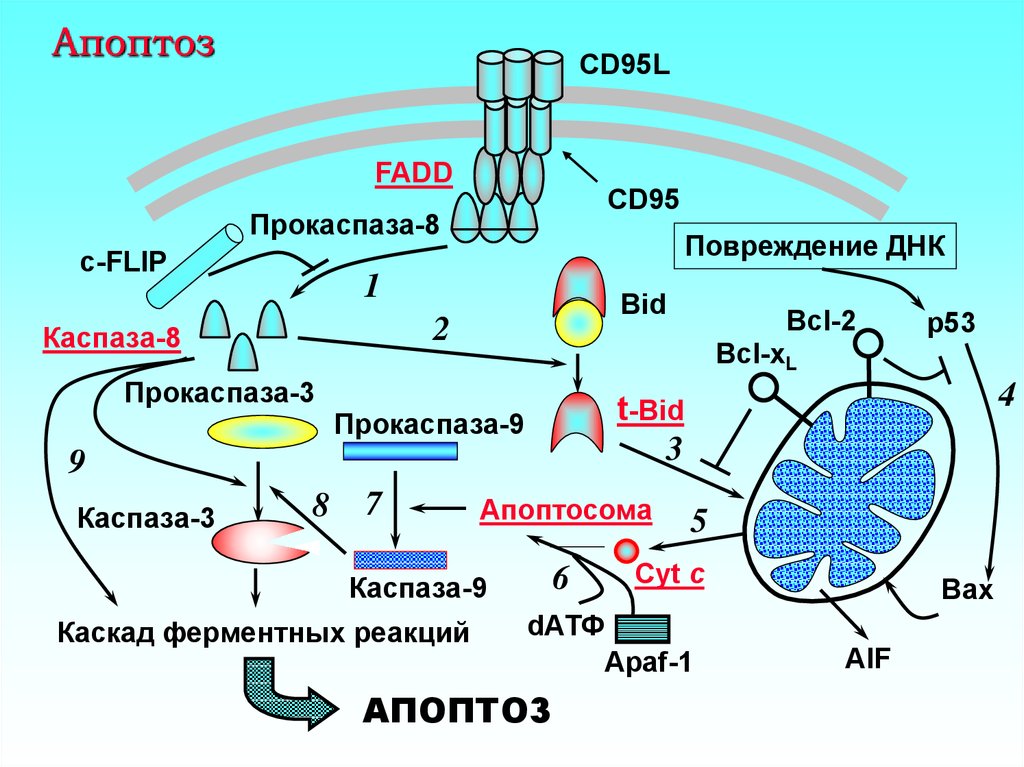
20. Апоптоз
CD95LFADD
CD95
Прокаспаза-8
c-FLIP
Повреждение ДНК
1
Bid
2
Каспаза-8
Прокаспаза-3
8
Апоптосома
6
Каспаза-9
Каскад ферментных реакций
4
t-Bid
3
Прокаспаза-9
7
p53
Bcl-xL
9
Каспаза-3
Bcl-2
5
Cyt c
dАТФ
Apaf-1
АПОПТОЗ
Bax
AIF
21. Физико-химические основы патологии клетки
Российский Государственный Медицинский УниверситетМосковский Государственный Университет
Ю. А. Владимиров
Физико-химические основы
патологии клетки
АФК и апоптоз
Москва © 2003
22. Морфология нейтрофилов при апоптозе
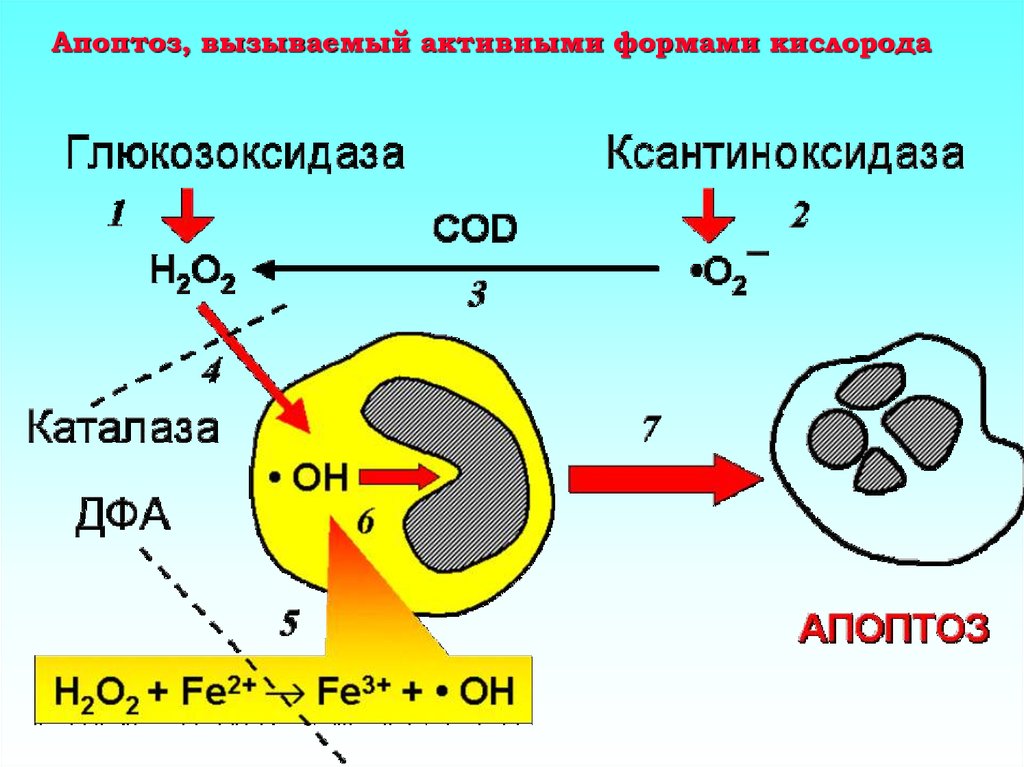
23. Апоптоз, вызываемый активными формами кислорода
24. Рис. 4. Апоптоз
CD95LFADD
CD95
Прокаспаза-8
c-FLIP
Повреждение ДНК
1
Bid
2
Каспаза-8
Прокаспаза-3
8
Апоптосома
6
Каспаза-9
Каскад ферментных реакций
4
t-Bid
3
Прокаспаза-9
7
p53
Bcl-xL
9
Каспаза-3
Bcl-2
5
Cyt c
dАТФ
Apaf-1
АПОПТОЗ
Bax
AIF
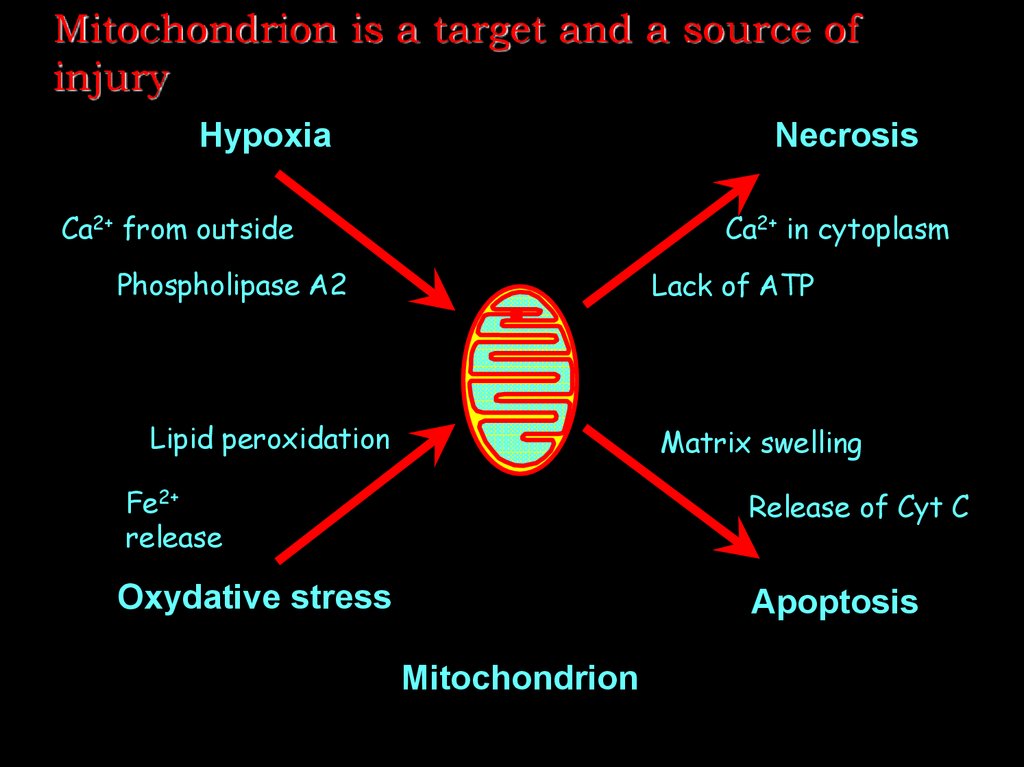
25. Mitochondrion is a target and a source of injury
HypoxiaNecrosis
Ca2+ from outside
Ca2+ in cytoplasm
Phospholipase A2
Lack of ATP
Lipid peroxidation
Matrix swelling
Fe2+
release
Release of Cyt C
Oxydative stress
Apoptosis
Mitochondrion
26. Superoxide manufacturers in the cell
1. NADPH oxidase in plasma membrane2. Respiratory chain in mitochondria
Phagocyte
Mitochondrion
Fumarate
NADH
NAD+
2e¯
I
Q
QH2
Inner membrane
II
Succinate
2e¯
Q
QH2
III
Matrix
4H+ 2H2O
IV
e¯
C
C
O2
Inter membrane space
27. Lucigenin is an adequate CL-probe for superoxide.
1256 – sucr-TRIS+100 mcL lucigenin+100mcL xantin1346 – +XO less than 100 mcL
1686 – 100 mcL lucigenin
1804 – 100 mcL lucigenin
lucigenin
1926 – 50 mcL SOD
2036 – off
450
400
CL response, mV
350
300
250
lucigenin + xantin
lucigenin
200
150
SOD
XO
100
50
0
-50
-100
1200
1400
1600
1800
Time, s
2000
2200
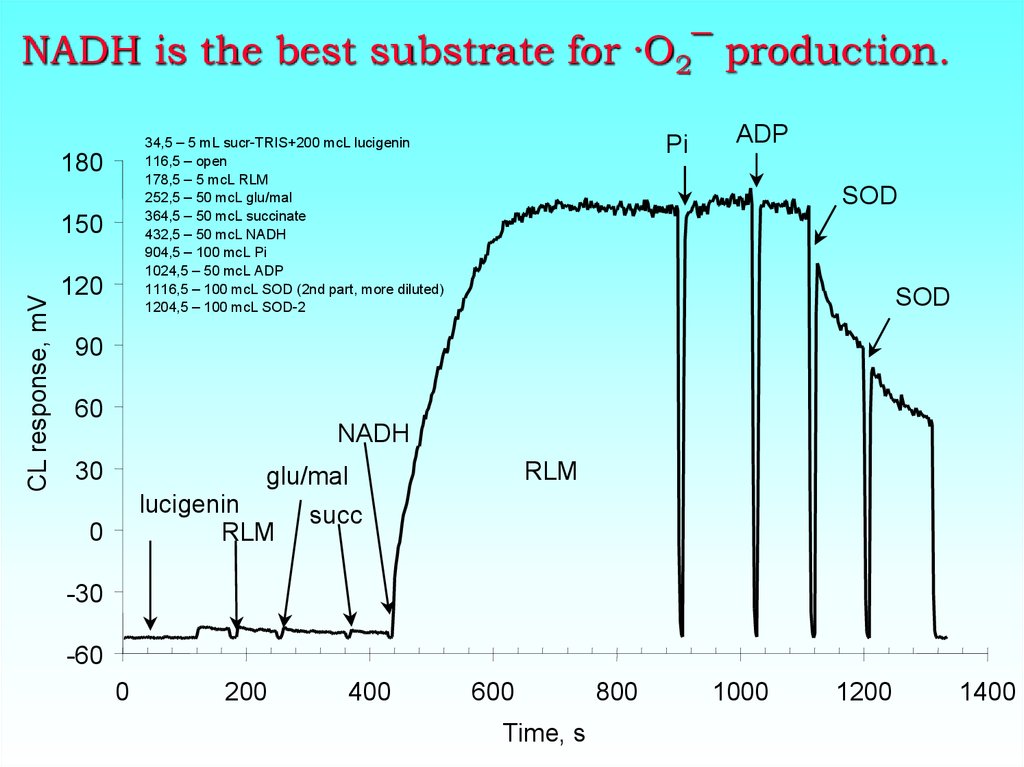
28. NADH is the best substrate for ·O2¯ production.
180150
CL response, mV
Pi
34,5 – 5 mL sucr-TRIS+200 mcL lucigenin
116,5 – open
178,5 – 5 mcL RLM
252,5 – 50 mcL glu/mal
364,5 – 50 mcL succinate
432,5 – 50 mcL NADH
904,5 – 100 mcL Pi
1024,5 – 50 mcL ADP
1116,5 – 100 mcL SOD (2nd part, more diluted)
1204,5 – 100 mcL SOD-2
120
ADP
SOD
SOD
90
60
NADH
30
RLM
glu/mal
lucigenin
RLM
0
succ
-30
-60
0
200
400
600
Time, s
800
1000
1200
1400
29. Kinetic control of superoxide production
There are at least two mechanisms regulating the bifurcation of electron fluxes: kinetic andstructural.
Matrix
Succinate
II
NADH
4H+ 2H O
2
e¯
NAD+
I
e¯
Q
QH2
IV
III
e¯
C
+ O2
·O2¯
·O2¯
C
C
O2
Intermembrane space
FAD is a probable bifurcation site
30. NAD(P)H – FMN oxidoreductase
NADH oxidaseFMN
FMN
FMN
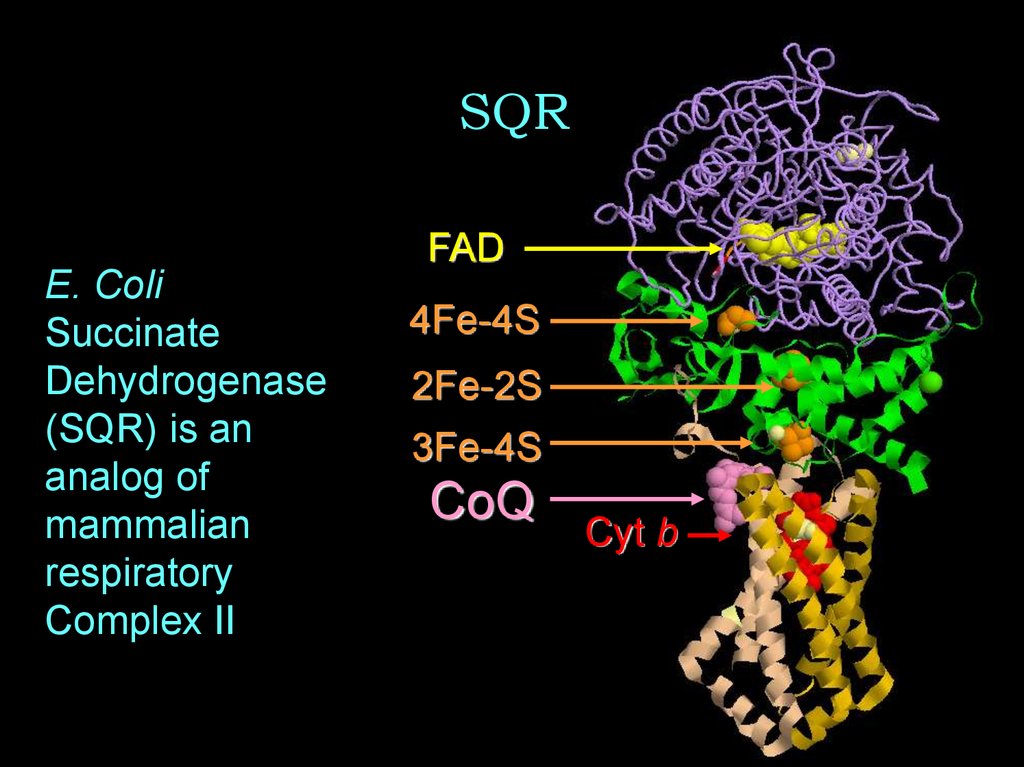
31. SQR
FADE. Coli
Succinate
Dehydrogenase
(SQR) is an
analog of
mammalian
respiratory
Complex II
4Fe-4S
2Fe-2S
3Fe-4S
CoQ
Cyt b
32. Manifestations of mutations in SQR gene in eukaryotes
Clinical phenotypes:1. Optic atrophy
2. Tumor formation
(paraganglioma, pheochromocytoma )
3. Myopathy
4. Encephalopathy
P. Rustin, A. Roetig, Biochim. Biophys.
Acta 1553, 117 (2002) – a review.
T. Bourgeron et al., Nature Genet. 11, 144 (1995).
B. E. Baysal et al., Science 287, 848 (2000).
S. Niemann, U. MuЁller, Nature Genet. 26, 268(2000).
These disorders can be caused by oxidative stress produced by complex II
33. Метаболизм первичных радикалов
Владимиров, А., Три гипотезы о механизме действия лазерногооблучения на клетки и организм человека, in Эфферентная
медицина, С. Чикин (ред.), 1994, Институт Биомедицинской Химии
РАМН: Москва. p. 51-66.
5
OONO (пероксинитрит)
.NO
Повреждение
1
Регуляция
Cl¯ миелопероксидаза
.OO¯ SOD
Защита
ClO¯
O2 + H2O2
2
3
catalase
4
Детоксикация H2O2
6
peroxidases
Fe3+
7
Fe2+
8
LOOH
9
HOOH
10
HClO
LO.
HO.
HO.
Повреждение
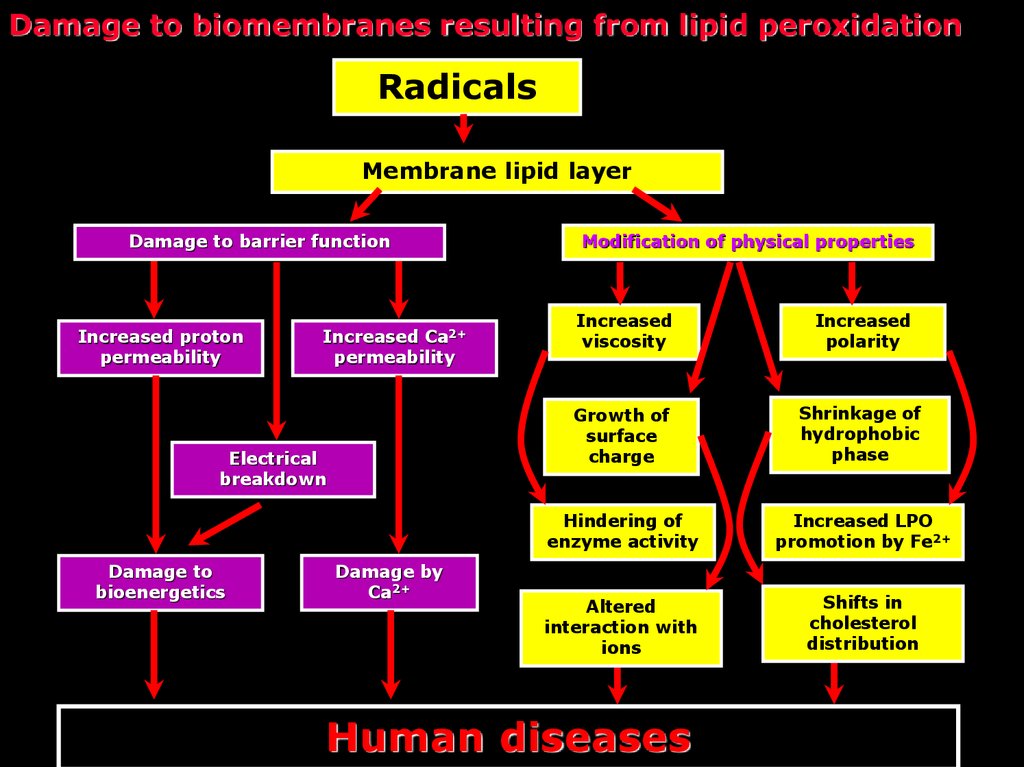
34. Damage to biomembranes resulting from lipid peroxidation
RadicalsMembrane lipid layer
Damage to barrier function
Increased proton
permeability
Increased Ca2+
permeability
Electrical
breakdown
Damage to
bioenergetics
Damage by
Ca2+
Modification of physical properties
Increased
viscosity
Increased
polarity
Growth of
surface
charge
Shrinkage of
hydrophobic
phase
Hindering of
enzyme activity
Increased LPO
promotion by Fe2+
Altered
interaction with
ions
Shifts in
cholesterol
distribution
Human diseases
35. How we created and measured the membrane potential in mitochondria?
Inner mitochondrial membrane generatespotential difference (Dj)and pH
difference (DpH) between bathing
solutions, in the presence of respiration
substrates and oxygen.
DmH+ = RTDln[H+] + zFDj
Upon addition of permeable acid (e.g. acetic acid)
DpH would decrease and hence Dj would
increase.
The fluorescence probe was used to measure the
membrane potential (Dj).
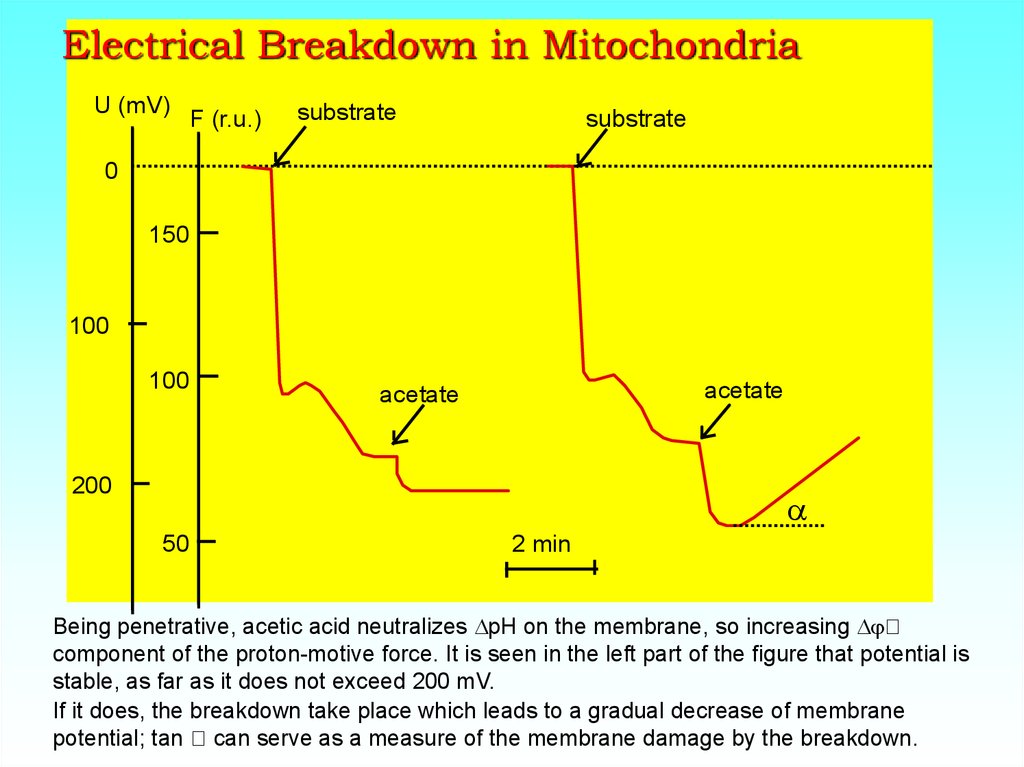
36. Electrical Breakdown in Mitochondria
U (mV)F (r.u.)
substrate
substrate
0
150
100
100
acetate
acetate
200
a
50
2 min
Being penetrative, acetic acid neutralizes DpH on the membrane, so increasing Dj
component of the proton-motive force. It is seen in the left part of the figure that potential is
stable, as far as it does not exceed 200 mV.
If it does, the breakdown take place which leads to a gradual decrease of membrane
potential; tan can serve as a measure of the membrane damage by the breakdown.
37. Dose-effect curves of SH group
-SH3.0
TBARS
0.9
-SH
2.0
0.8
0.7
TBARS
0
1.0
0
1.2
2.4
Radiation dose (J/m2 104)
3.6
TBARS (nmole/mg protein)
SH groups (arbitrary units)
1.0
38. ААА
Permeability transition poreWater solutes
HK
BPR
Outer
membrane
VDAC
CK
ААА
Intermembra
ne space
Inner
membrane
Cph. D
Atractulosid
e Ca2+, Bax,
ROS
Циклосполрин А
Bongkrecic acid,
ATP
Matrix
39. Fig. 6. Damage to Ca2+ ATPase under lipid peroxidation
ATP Ca2+ADP
ATP
2+
Ca
Native CaATPase
Damaged
ATPase
ADP
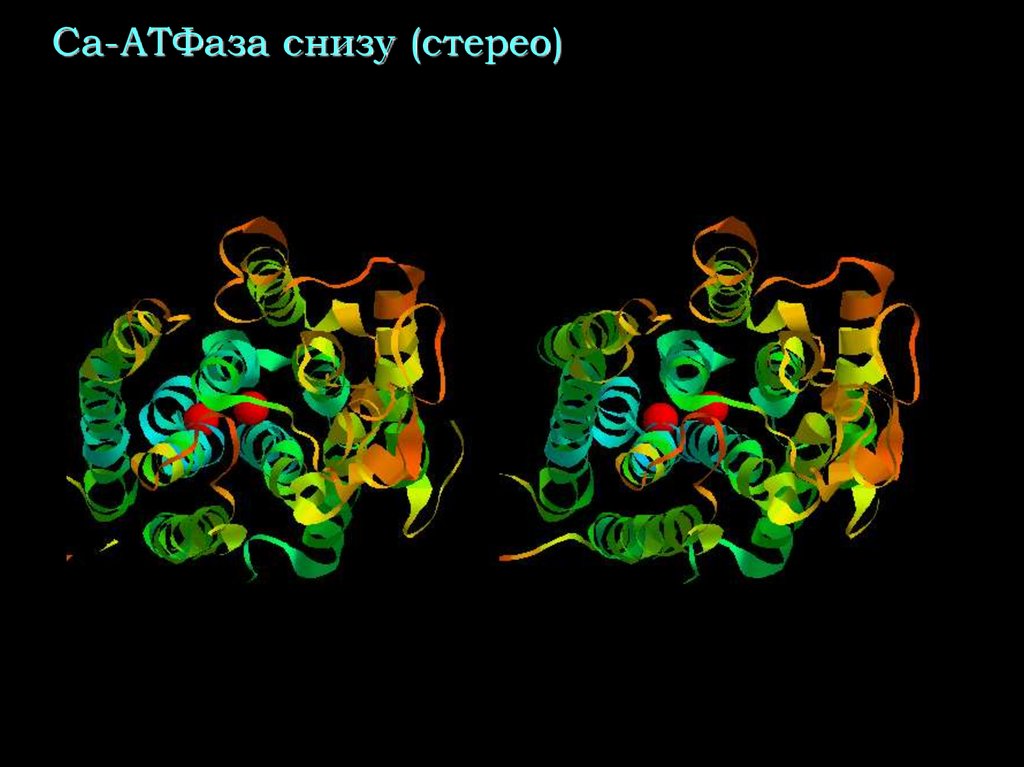
40. Са-АТФаза снизу (стерео)
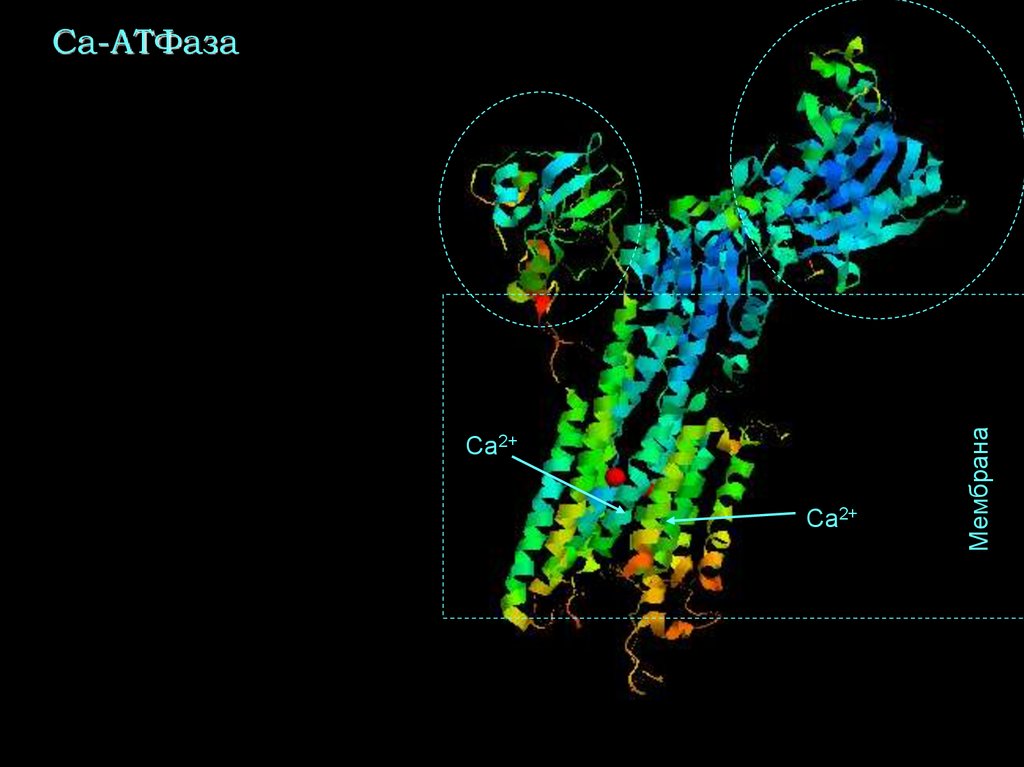
41. Са-АТФаза
Ca2+Ca2+
Мембрана
Са-АТФаза
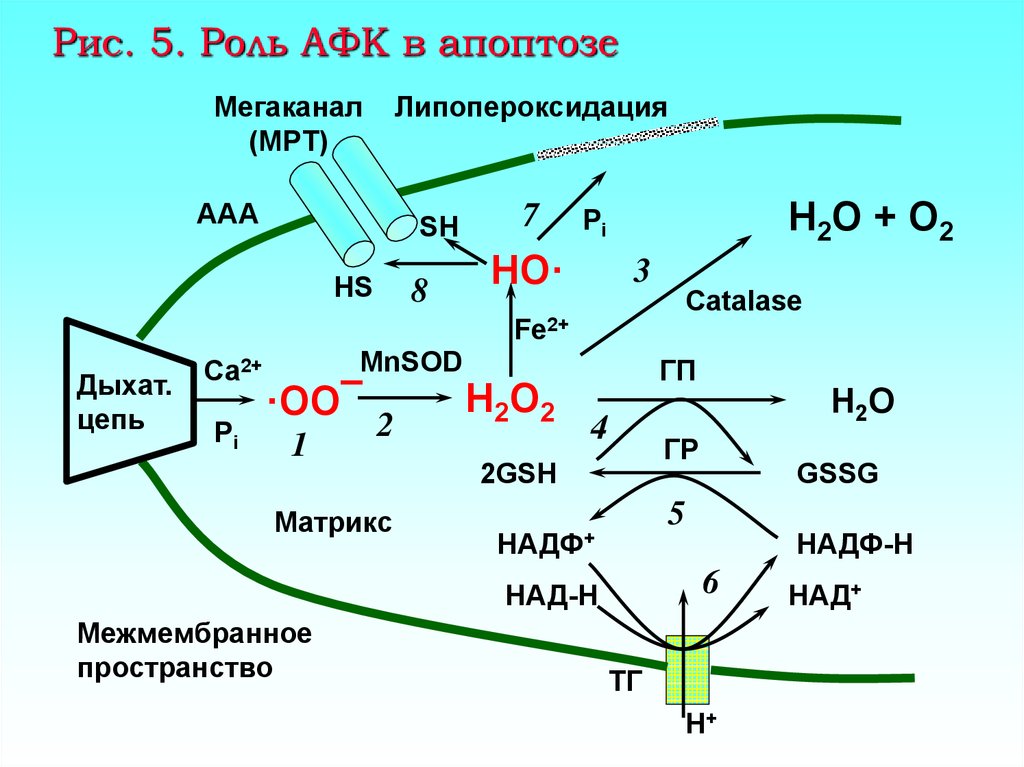
42. Рис. 5. Роль АФК в апоптозе
Мегаканал(MPT)
Липопероксидация
ААА
SH
HS
8
7
H2O + O2
Pi
HO·
3
Catalase
Fe2+
Дыхат.
цепь
Ca2+
Pi
MnSOD
·OO¯
1
2
Матрикс
H2O2
ГП
H2O
4
ГР
2GSH
5
НАДФ+
НАДФ-H
6
НАД-H
Межмембранное
пространство
GSSG
ТГ
H+
НАД+
43. Радикалы, клеточная мембрана и апоптоз
44. Передача апоптозных сигналов (по В. П. Скулачеву)
ТНФ16
18
ФС
20
Рецептор
TNF
13 ФСО
ФСО
21
Каспаза 8
12
Митохондрия
19
Лейкоцит
АФК
25
22
23
tBid
24
Bax
Цит c
9
Каспаза 3
10
Каспаза 9
апоптоз
11
Плазматическая
мембрана
АФК
17
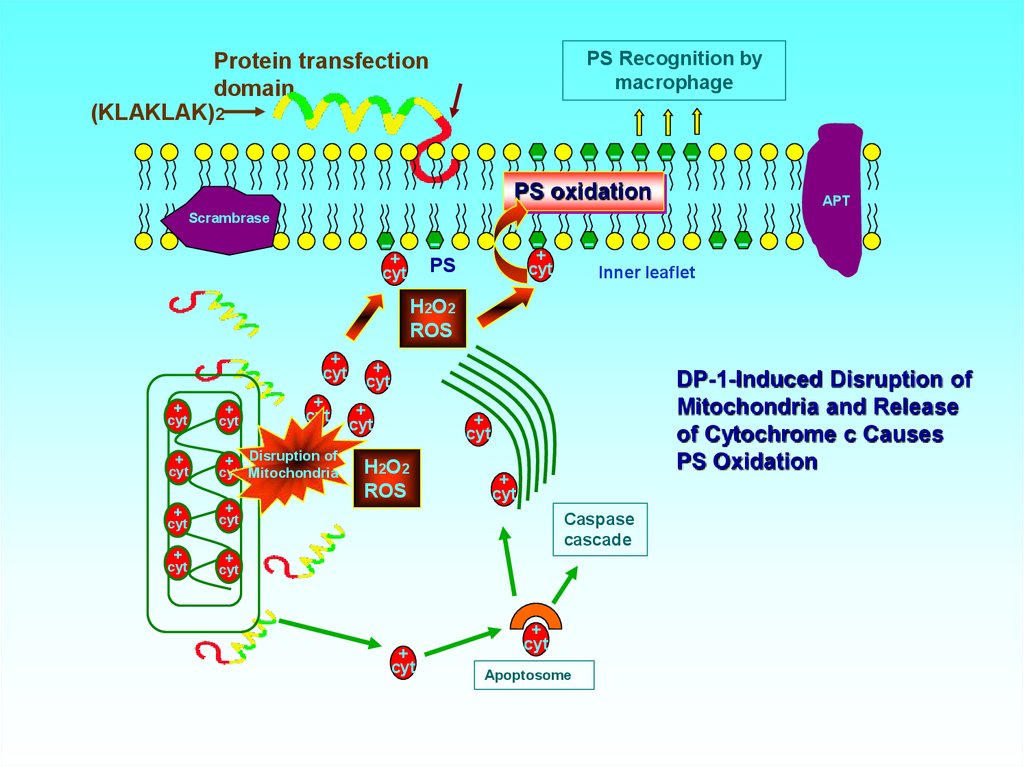
45. DP-1-Induced Disruption of Mitochondria and Release of Cytochrome c Causes PS Oxidation
PS Recognition bymacrophage
Protein transfection
domain
(KLAKLAK)2
-
- - - - -
PS oxidation
Scrambrase
-+ -
-+
PS
cyt
APT
-
cyt
- Inner leaflet
H2O2
ROS
+
cyt
+
cyt
+
cyt
+
cyt
+
cyt
+ Disruption of
cyt Mitochondria
+
cyt
+
cyt
+
cyt
+
cyt
+
cyt
+
cyt
DP-1-Induced Disruption of
Mitochondria and Release
of Cytochrome c Causes
PS Oxidation
+
cyt
H2O2
ROS
+
cyt
Caspase
cascade
+
cyt
+
cyt
Apoptosome
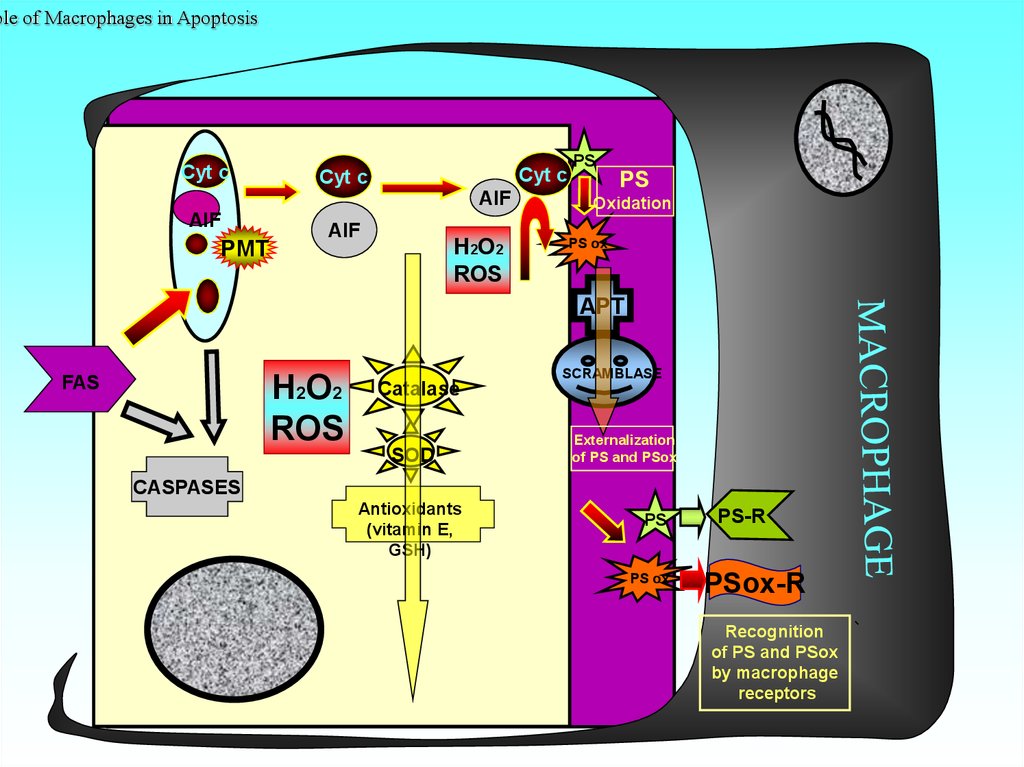
46. Role of Macrophages in Apoptosis
ole of Macrophages in ApoptosisCyt c
Cyt c
Cyt c
AIF
AIF
PMT
AIF
H2O2
ROS
PS
PS
Oxidation
PS ox
APT
H2O2
ROS
FAS
SCRAMBLASE
Catalase
SOD
Externalization
of PS and PSox
CASPASES
Antioxidants
(vitamin E,
GSH)
PS
PS ox
PS-R
PSox-R
Recognition
of PS and PSox
by macrophage
receptors





















 biology
biology physics
physics chemistry
chemistry








