Similar presentations:
Молекулярные механизмы апоптоза
1. Молекулярные механизмы апоптоза
2.
«Апоптоз– это запрограммированныйпроцесс уничтожения клетки, вызванный
внутренними (внутриклеточными) или
внешними (внеклеточными) как
физиологическими, так и
патологическими факторами,
активирующими генетическую программу
гибели клетки и ее удаление из ткани»
3. Термин «апоптоз» впервые введен в 1972 г. J.Kerr, A.Wyllie, A.Currie при изучении гибели клеток в растущих тканях.
• Термин может быть переведен как опадание листьев,лепестков, но его также употребляли Гиппократ и Гален,
обозначая отмирание и потерю ненужных организму
частиц.
• В 1987 г. А.Wyllie сфрмулировал главные признаки
апоптоза:
– уменьшение объема клетки;
– конденсация и фрагментация хроматина, формирование
апоптотических телец;
– изменение мембраны клетки, приводящее к распознаванию ее фагоцитами;
– сопряжение апоптоза с активным синтезом белка
4.
Результатом совместной работы J.Kerr, A.Wyllie,A.Currie стала знаменитая ныне статья «Апоптоз как
фундаментальный
биологический
феномен
с
множественными функциями в регуляции кинетики
тканей».
Любопытно, что трое соавторов посылали свою статью
в ведущие журналы того времени и везде ее отклоняли,
оценивая тему как малоинтересную. Карри был членом
редколлегии «British Journal of Cancer», и он уговорил
редактора принять статью к публикации (Kerr, Wyllie, Currie,
1972, 26, 4, 239—257, doi: 10.1038/bjc.1972.33). Это «любезное
одолжение» в дальнейшем сильно увеличило импакт-фактор
журнала — статью цитировали тысячи раз и продолжают
цитировать по сей день.
5.
6.
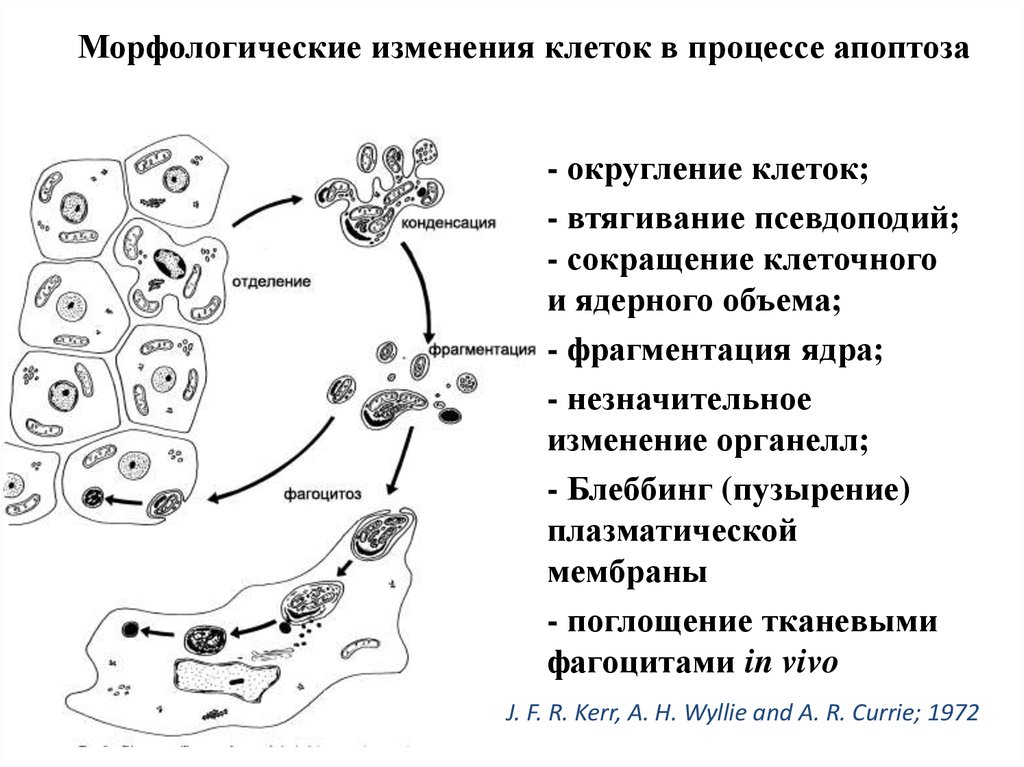
Морфологические изменения клеток в процессе апоптоза- округление клеток;
- втягивание псевдоподий;
- сокращение клеточного
и ядерного объема;
- фрагментация ядра;
- незначительное
изменение органелл;
- Блеббинг (пузырение)
плазматической
мембраны
- поглощение тканевыми
фагоцитами in vivo
J. F. R. Kerr, A. H. Wyllie and A. R. Currie; 1972
7. Нобелевская премия 2002 г. «за открытия, посвященные генетической регуляции развития органов и программированной клеточной смерти»
Сидней БреннерРоберт Хорвиц
Джон Салстон
8.
Представляя работы Бреннера, Хорвица иСалстона, член Нобелевского Комитета профессор
У. Лендал говорил, что важность деления,
дифференциации и отмирания клеток и развития
органов для человека понимали многие, но прогресс
в исследовании этих процессов был медленным изза сложности человеческого организма,
состоящего из огромного количества клеток. Еще
в 1960-е годы Бреннер выбрал в качестве модельного
объекта изучения червя (1мм) нематоду Caenorhabditis elegans с 959 клетками,
питающуюся бактериями. В 1974г. он
продемонстрировал, что мутации генов приводили к
изменениям в развитии органов. Этот странный, как
казалось, выбор привел к тому, что Бреннер создал
важный инструмент исследования развития
организмов.
9.
"Я готов работать в чулане".Сидни Бреннер, из переписки с Фрэнсисом Криком.
В качестве многоклеточного, но простого
организма
Бреннер
выбрал
нематоду Caenorhabditis elegans – маленького
червя (1 мм) с коротким жизненным циклом,
прозрачного, так что процесс деления клеток
можно было наблюдать под микроскопом. Выбор
простого модельного организма, состоящего из
обозримого числа клеток, но обладающего
нервной, мускульной и репродуктивной
системой, сам Бреннер считал очень важным
для исследований.
В знак заслуг Бреннера и его пионерской
роли во всеобщем исследовательском
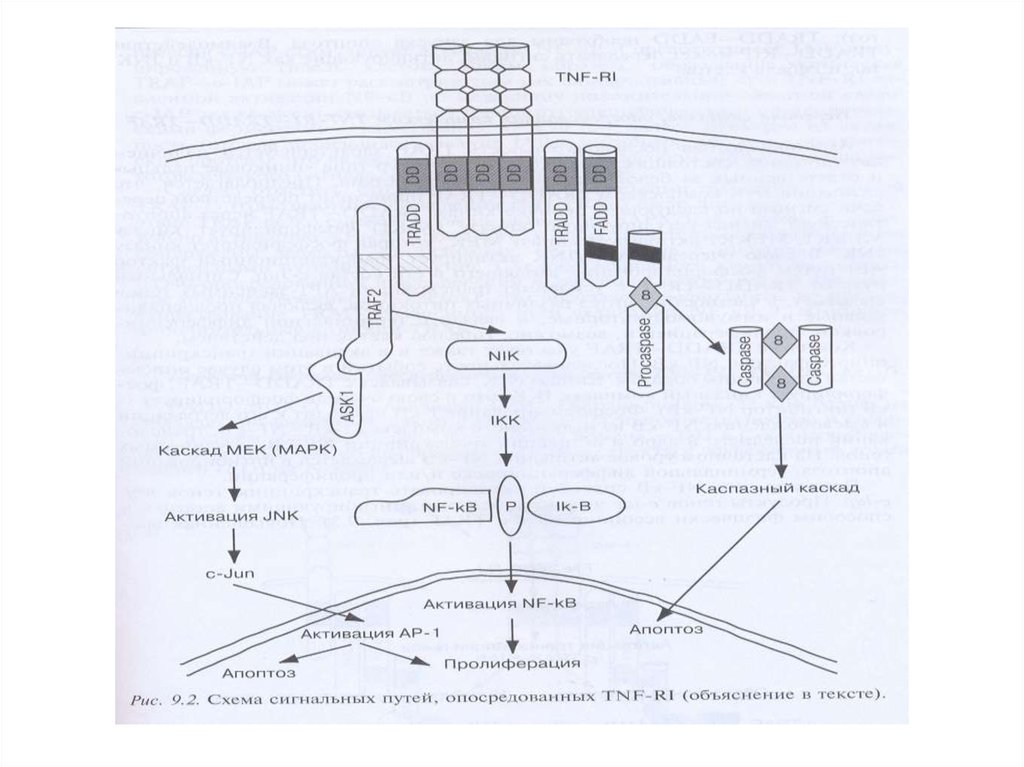
сообществе, работающем на C. elegans,
другая нематода, родственная C. elegans,
была названа Сaenorhabditis brenneri
10.
«Когда мы разгадаем червя - мы поймемжизнь»
Джон Салстон.
В 1970 г. Салстон показал, что дифференцировка
клеток С. elegans
направляется
единой
генетической программой
и часть клеток
обязательно погибает путем апоптоза. Он же
обнаружил мутацию одного из генов,
регулирующих апоптоз.
11.
Р. Хорвиц открыл генетическую основурегуляции апоптоза и показал, что она похожа
и у самых примитивных, и у высших животных.
В 1980-ых годах он описал три «гена смерти» и
показал, что аналогичные гены существуют и в
геноме человека.
Тридцать лет своей жизни Хорвиц отдал изучению
генов, которые влияют на развитие 22-х клеток
одной из частей репродуктивной системы C.
elegans. Чтобы поддерживать необходимую для
эксперимента температуру, В 70-х-80-х годах ему
часто приходилось по целым дням сидеть в
специальной "холодовой" - термоизолированной
неотапливаемой комнате без окон. Кому-то такая
работа показалась бы сущей пыткой. Для Хорвица
же она - удовольствие.
12. Выделяют 4 вида программированной гибели клеток (ПГК), основанные на морфо-физиологических изменениях
1) ПГК I типа (апоптоз) (сжатие клетки, олигонуклеосомнаядеградация ДНК, конденсация хроматина, коллапс ядра,
апоптотические тельца, фагоцитоз без участия лизосом,
нет разрыва плазматической мембраны)
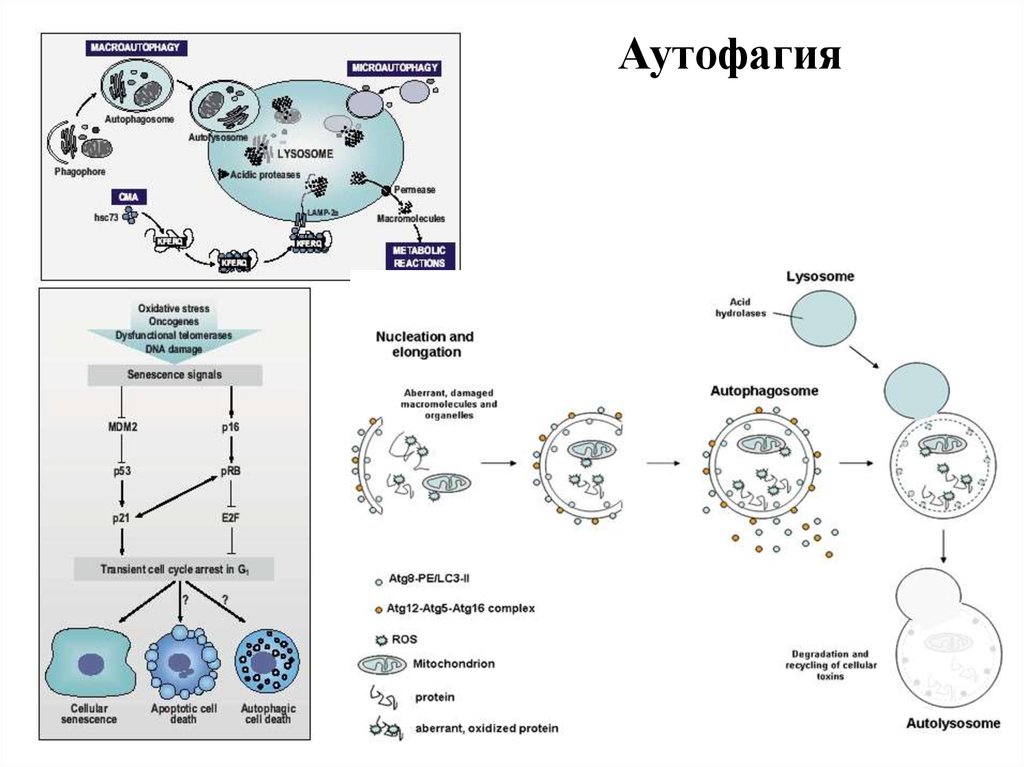
2) ПГК II типа (аутофагия) (аутофагия органелл, набухание
ЭПР, митохондрий, аутофагосомы, с участием лизосом)
3) ПГК III типа (некроз) (набухание органелл, без участия
лизосом, есть разрыв плазматической мембраны и
развитие воспаления)
4) ПГК IV типа (митотическая катастрофа) (гибель
клетки в процессе митоза, в результате нарушения ДНК,
остановка клетки в сверочных точках клеточного цикла)
13.
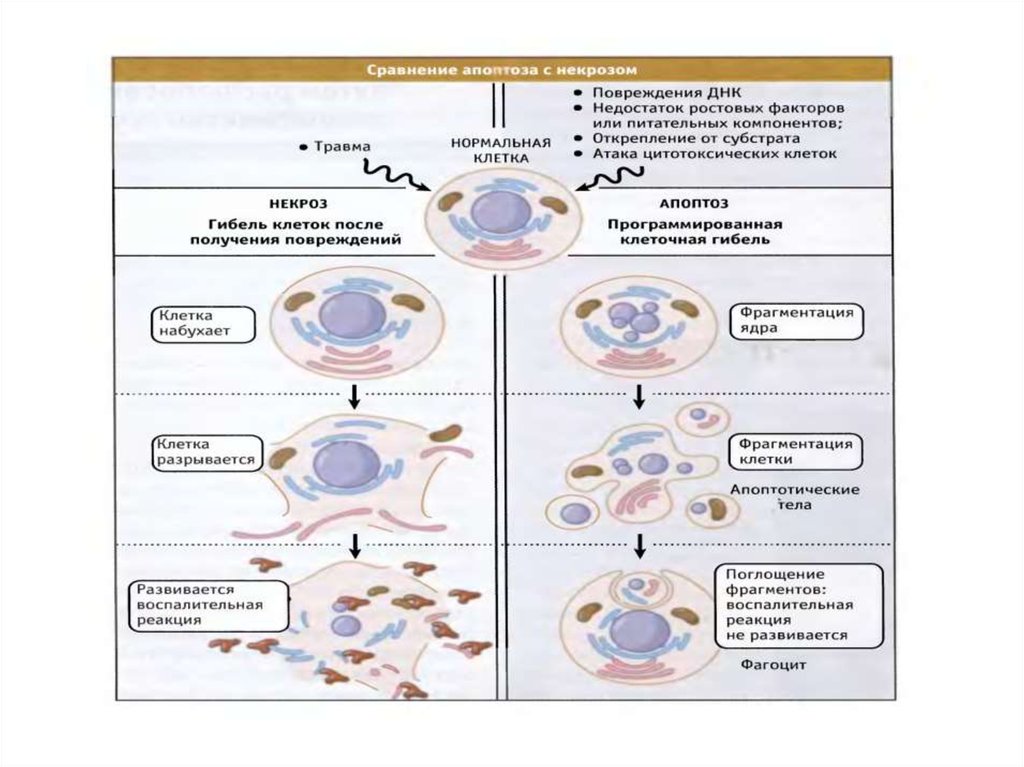
Аутофагия14. Сравнение апоптоза и некроза
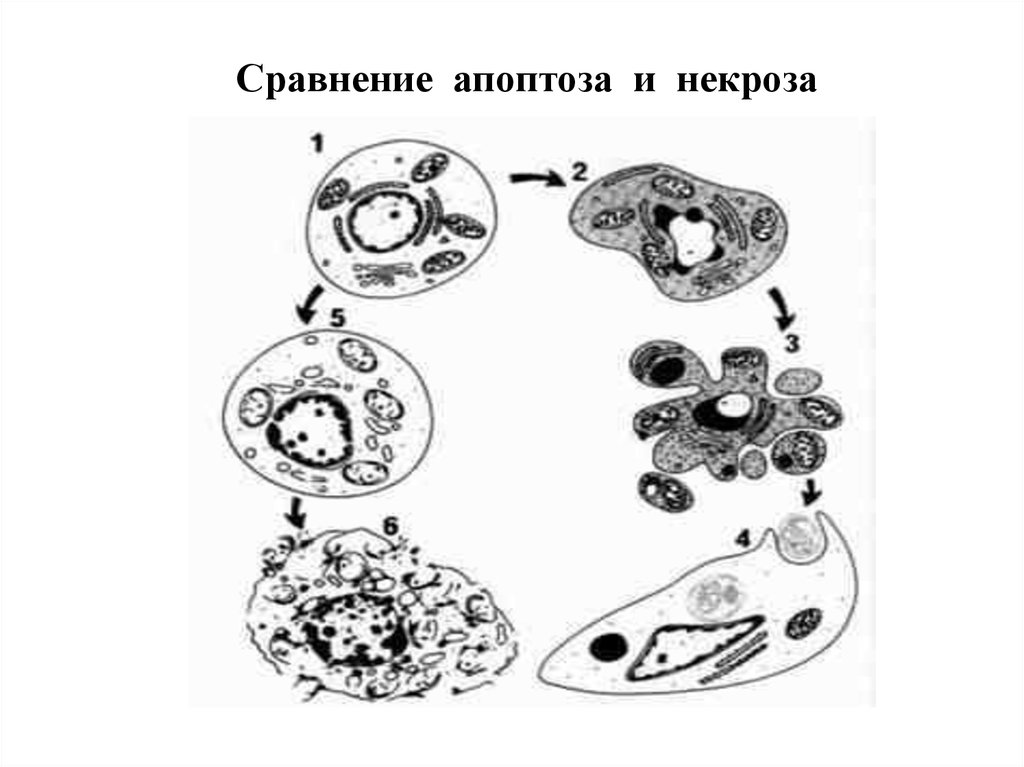
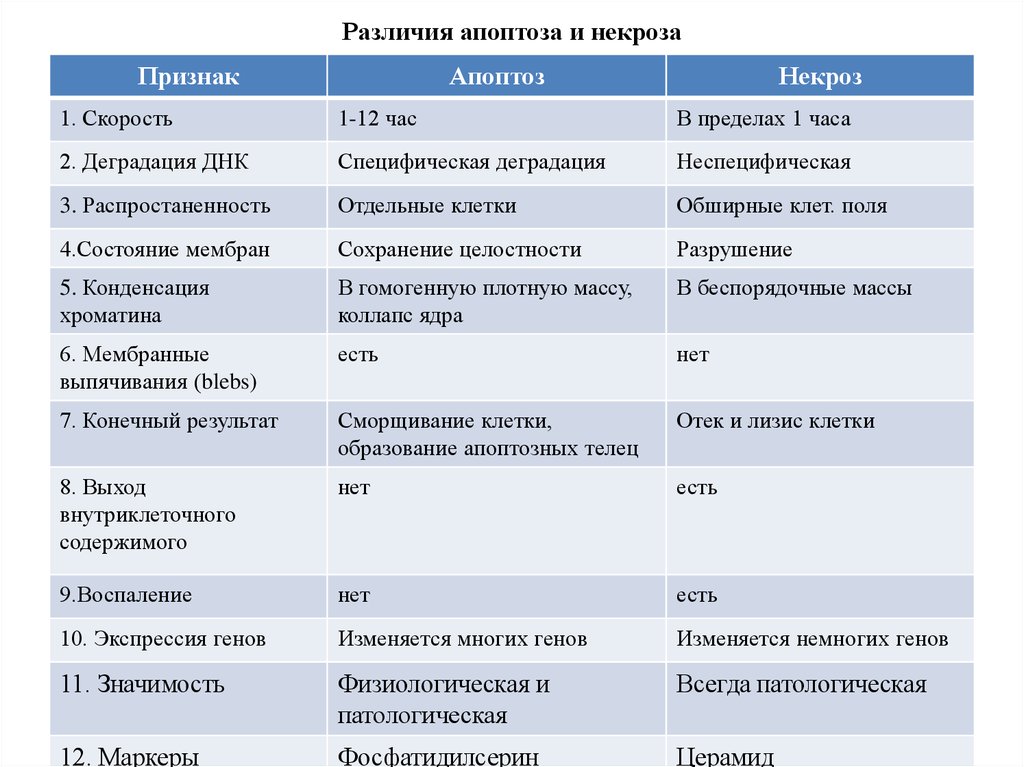
15. Различия апоптоза и некроза
ПризнакАпоптоз
Некроз
1. Скорость
1-12 час
В пределах 1 часа
2. Деградация ДНК
Специфическая деградация
Неспецифическая
3. Распростаненность
Отдельные клетки
Обширные клет. поля
4.Состояние мембран
Сохранение целостности
Разрушение
5. Конденсация
хроматина
В гомогенную плотную массу,
коллапс ядра
В беспорядочные массы
6. Мембранные
выпячивания (blebs)
есть
нет
7. Конечный результат
Сморщивание клетки,
образование апоптозных телец
Отек и лизис клетки
8. Выход
внутриклеточного
содержимого
нет
есть
9.Воспаление
нет
есть
10. Экспрессия генов
Изменяется многих генов
Изменяется немногих генов
11. Значимость
Физиологическая и
патологическая
Всегда патологическая
12. Маркеры
Фосфатидилсерин
Церамид
16.
17.
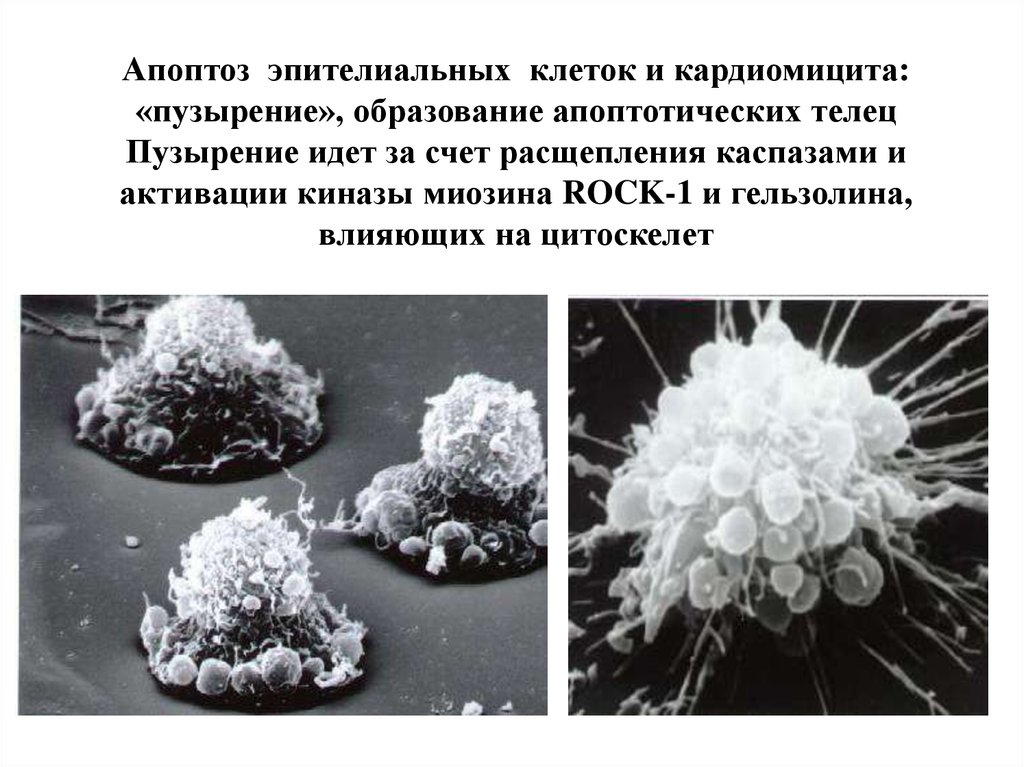
18. Апоптоз эпителиальных клеток и кардиомицита: «пузырение», образование апоптотических телец Пузырение идет за счет расщепления каспазами
Апоптоз эпителиальных клеток и кардиомицита:«пузырение», образование апоптотических телец
Пузырение идет за счет расщепления каспазами и
активации киназы миозина ROCK-1 и гельзолина,
влияющих на цитоскелет
19.
Блеббинг плазматической мембраны лимфоцита: наснимке зафиксированы выпячивания цитоплазматической
мембраны лимфоцита в нижнем полюсе клетки.
Увеличение х900, фазово-контрастная микроскопия
20. Апоптоз лейкоцитов
21.
Программированная гибель клетки —активная форма клеточной смерти, являющаяся
результатом реализации ее генетической
программы или ответом на внешние сигналы и
требующая затрат энергии и синтеза
макромолекул de novo (биохимический способ
определения).
Апоптоз — форма гибели клетки,
проявляющаяся в уменьшении ее размера,
конденсации и фрагментации хроматина,
уплотнении наружной и цитоплазматических
мембран без выхода содержимого клетки в
окружающую среду (морфологический способ
определения).
22. Роль апоптоза
1. Апоптоз - фундаментальный процессфизиологического разрушения клеток в
составе целого организма, необходимый для его
нормального функционирования.
2. Апоптоз происходит в процессе развития
тканей и органов в эмбриогенезе, необходим
для поддержания гомеостаза клеток.
3.
Апоптоз
необходим
для
удаления
опухолевых и дефектных клеток, а также
клеток, инфицированных вирусами.
23. Роль апоптоза
24.
Апоптоз во время нормального развития конечностимыши. Клетки, подвергшиеся апоптозу, ярко
окрашены. Справа — та же конечность день спустя
(W. Wood et al., «Development», 2000, 127:5245—5252)
25.
В организме среднестатистического взрослогочеловека в результате апоптоза погибает
ежедневно порядка 50—70 миллиардов клеток.
Для среднестатистического ребёнка в возрасте от 8
до 14 лет число клеток, погибших путём апоптоза,
составляет порядка 20—30 миллиардов в день.
Суммарная масса клеток, которые на протяжении
1 года жизни подвергаются разрушению,
эквивалентна массе тела человека. При этом
восполнение утраченных клеток обеспечивается за
счёт пролиферации— увеличения клеточной
популяции путём деления
26.
При описании каких процессов мы сталкиваемся сявлением апоптоза?
Роль апоптоза при протекании физиологических процессов:
- при эмбриогенезе (морфогенетический,
гистогенетический, филогенетический)
- при пролиферацц в клеточных популяциях
(поддержание тканевого гомеостаза и обеспечение
дифференцировки клеток)
- при гормон-зависимой инволюции органов и тканей
Роль апоптоза при патологии:
- при повреждении ДНК
- при опухолевом процессе
- при ишемии органов и тканей
- при дефиците гормона (апоптоз гормон-зависимых
органов)
- при окислительном стрессе
- при заражении клеток вирусом
- при трансплантации органов (апоптоз клеток «хозяина»)
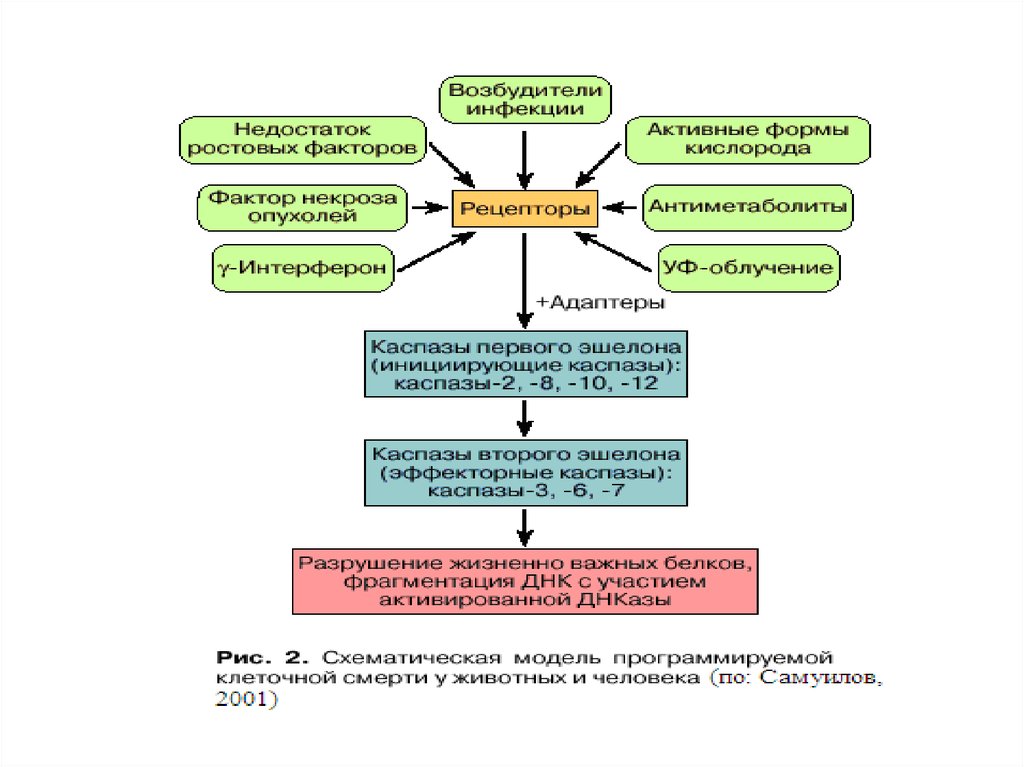
27. Индукция апоптоза
28.
29.
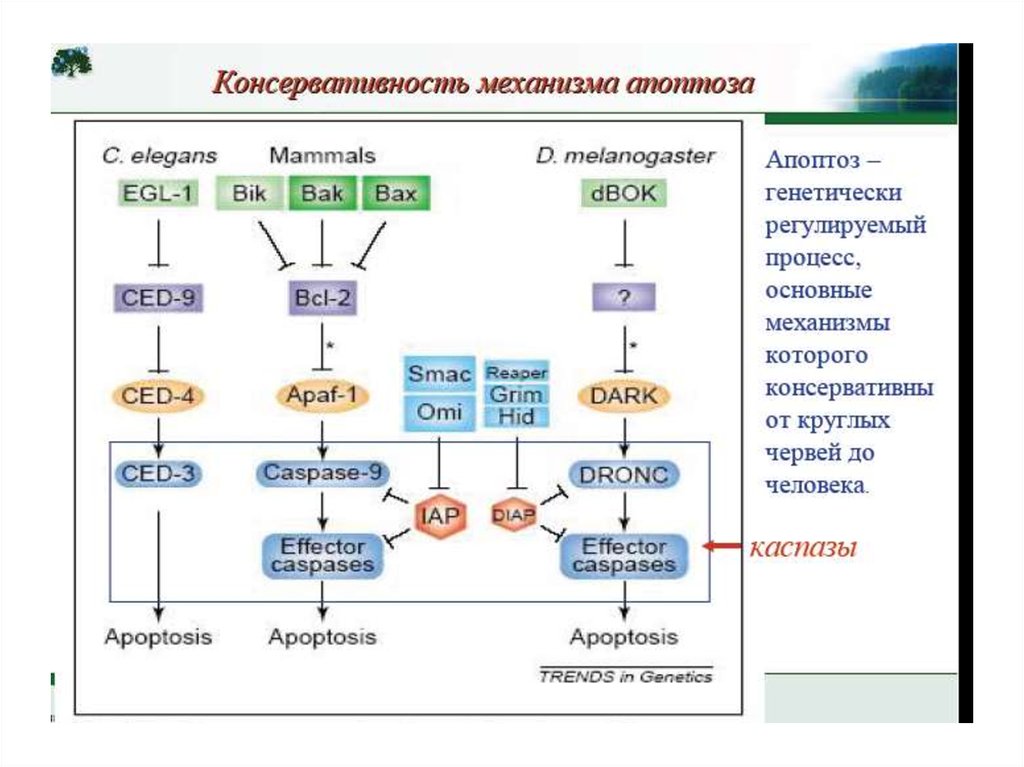
•Апоптоз – эволюционноконсервативный процесс
•Апоптоз у нематоды осуществляется за
счет протеолитического расщепления
белков клетки каспазами
•Сигнальная платформа активации
каспаз у нематоды связана с
митохондриями
30.
31.
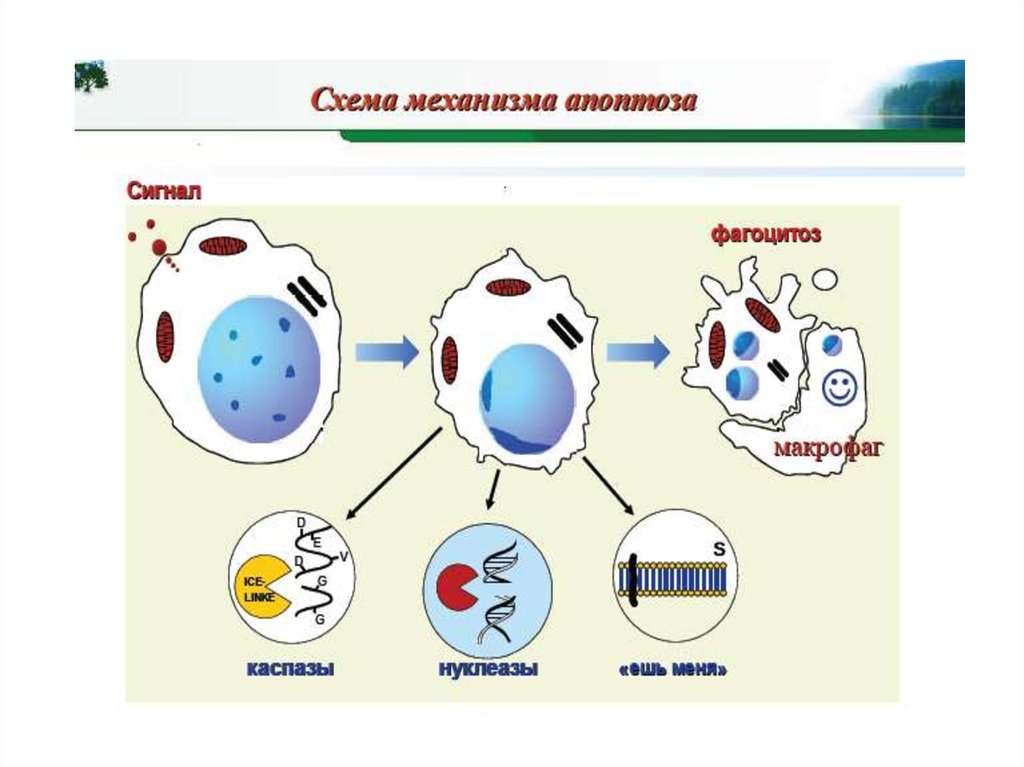
32. Стадии апоптоза
1.Индукция апоптоза: рецепция сигнала и начальныеэтапы его передачи (стадия обратима и
разнообразна для различных клеток)
2.Эффекторная,
стадия
программирования:
активация эффекторных каспаз, расщепление
внутриклеточных субстратов
3.Реализация апоптоза, запрограммированного на
предыдущей
стадии
(фрагментация
ДНК,
морфологические эффекты)
Стадии 2 и 3 необратимые, протекают по единому
плану для всех клеток.
4. Поглощение фрагментов клетки.
33. Индукция апоптоза :
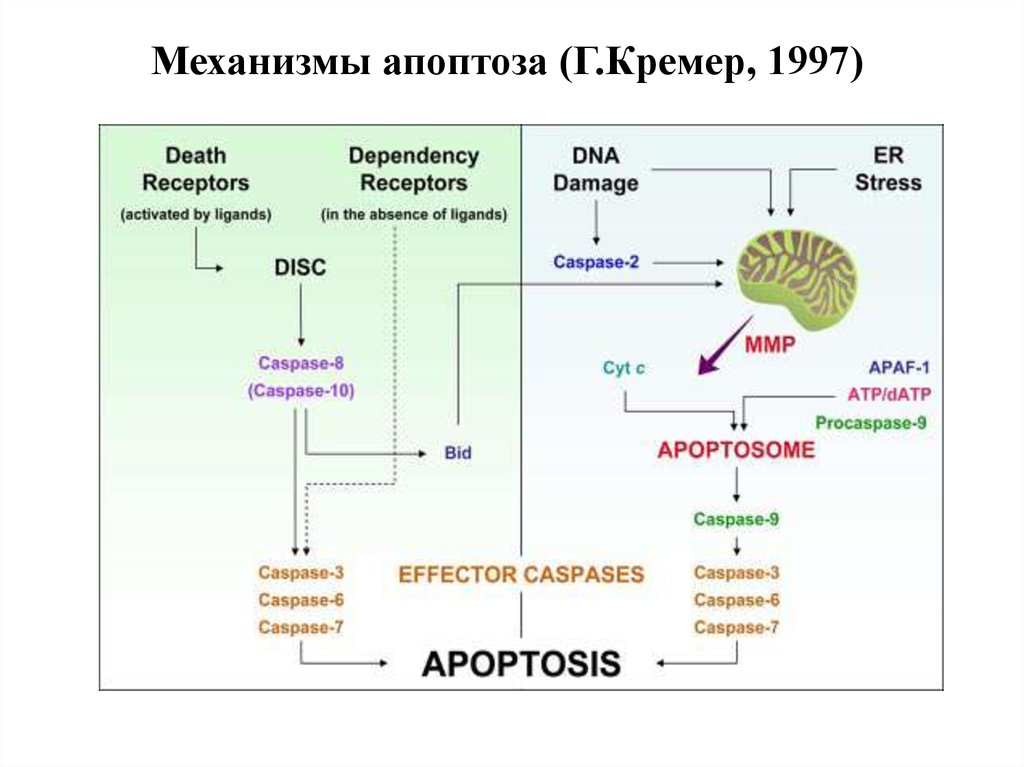
Главные пути:1.Митохондриальный ( внутренний) путь,
приводящий к активации каспазы 9
2.Рецепторный (внешний) путь, приводящий к
активации каспазы 8
Дополнительные пути:
- ЭПР-зависимый (нарушение Са2+-гомеостаза)
- Гранзим В-зависимый
- Потеря клеточного ядра (кариорексис)
- ПАРП-зависимый (ПАРП – поли-АДФ-рибозаполимераза, репарирует разрывы в хроматине)
34. Механизмы апоптоза (Г.Кремер, 1997)
35. Общая схема “классического” апоптоза млекопитающих.
36.
37.
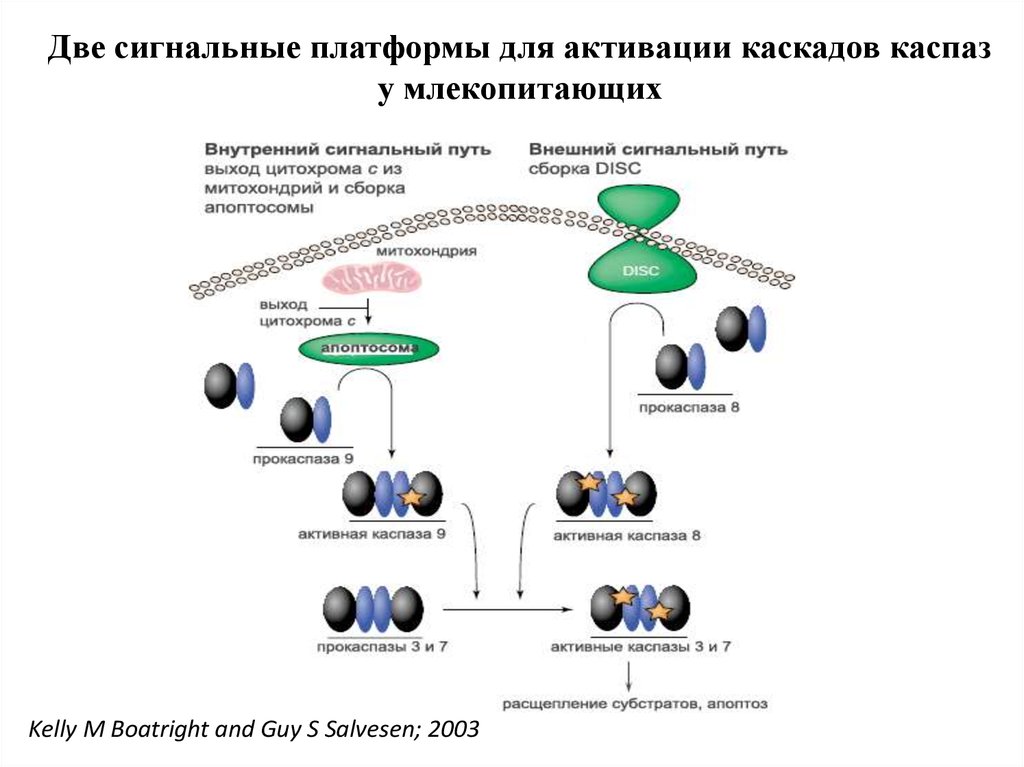
Две сигнальные платформы для активации каскадов каспазу млекопитающих
Kelly M Boatright and Guy S Salvesen; 2003
38. Образование апоптосомы и инфламмасомы
Cytochrome CCed9
Ced4
Apaf1
PAMPs
NLRs
Apoptosome
Active
Ced3
APOPTOSIS
Active
Caspase-9
APOPTOSIS
Bcl-2,
Bcl-xl
Inflammasome
Active
Caspase-1
PYROPTOSIS &
INFLAMMATION
39. Общая характеристика каспаз: Каспазы – цистеин содержащие специфические протеазы, расщепляющие субстраты после аспартата (Asp-Xaa-Xaa-Asp/Gly (Ser,A
Общая характеристика каспаз:Каспазы – цистеин содержащие специфические протеазы,
расщепляющие субстраты после аспартата
(Asp-Xaa-Xaa-Asp/Gly (Ser,Ala))
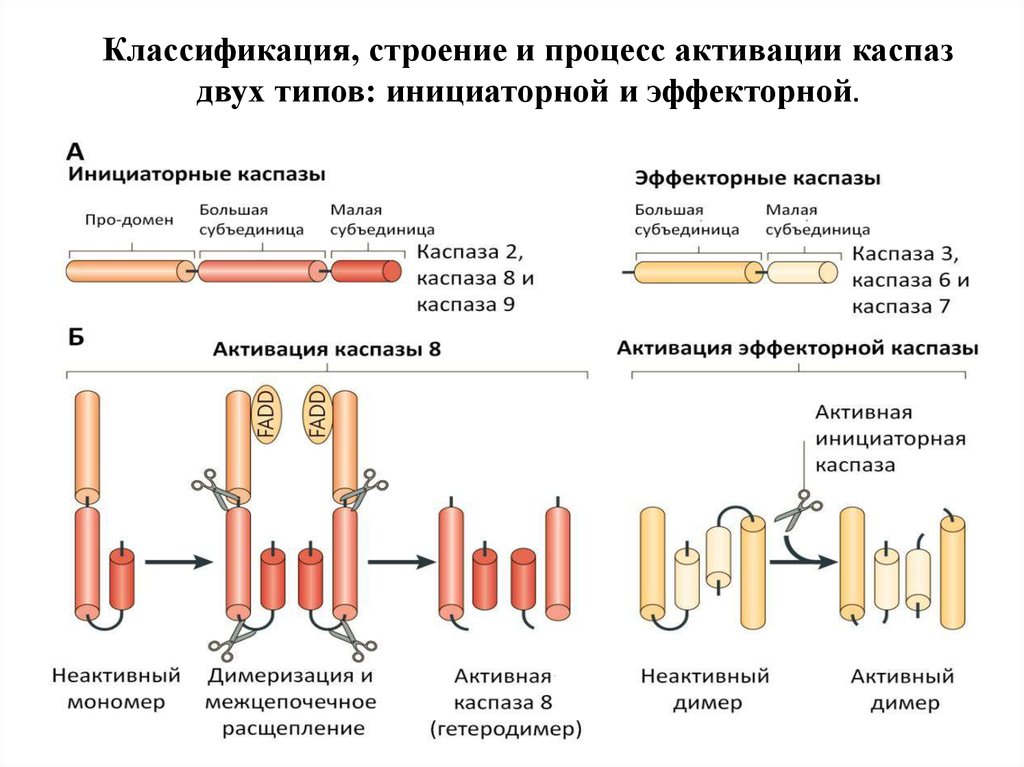
Выделяют 3 группы каспаз:
1.Инициаторные (касп-8, -9)
2. Эффекторные (касп-3, -7)
3. Каспазы, участвующие в воспалении (касп-1)
Присутствуют в клетке в виде неактивных зимогенов
и при активации апоптоза не происходит их нового
синтеза.
Расщепляют более 500 белковых субстратов.
40.
Каспазы (caspase-cysteine-dependent aspartatspecific protease) :
1.Каспазы 1-го эшелона (инициирующие) –
каспазы- 2,8,9,10,12, активируются с помощью
белков-адаптеров, их субстраты – каспазы 2-го
эшелона, имеют длинные продомены (100 АК),
которые содержат домены DED, CARD, DID для
связывания с адаптерами.
2.Каспазы 2-го эшелона (эффекторные,
«казнящие») – каспазы- 3,6,7, их субстраты > 500
различных белков (ДНК-аза, ПАРП, белки
цитоскелета-ламины, фодрин, актин, кератин; cdk,
антиапоптозные белки), имеют короткие продомены
(30 АК).
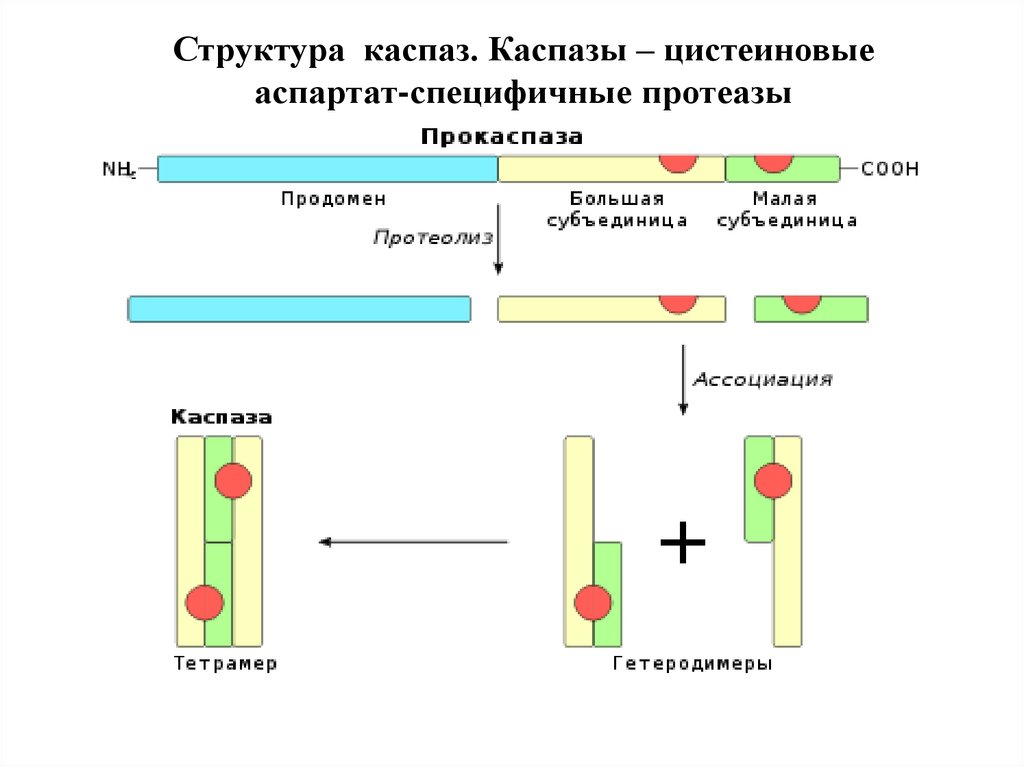
41. Структура каспаз
1. Прокаспазы представлены мономерами, которые содержат3 домена: N-концевой продомен, домен-предшественник
большой субъединицы и домен-предшественник малой
субъединицы.
1. Инициаторные каспазы содержат длинные продомены
(100 АК) с последовательностями, характерными для
белок-белковых взаимодействий. Это домен смерти (DD),
домен мобилизации каспаз (CАRD), эффекторный домен
смерти (DED). Все вместе они называются складками
смерти и структурно близки друг к другу.
2. Эффекторные каспазы содержат малый продомен (30 АК)
без складок смерти.
42.
43.
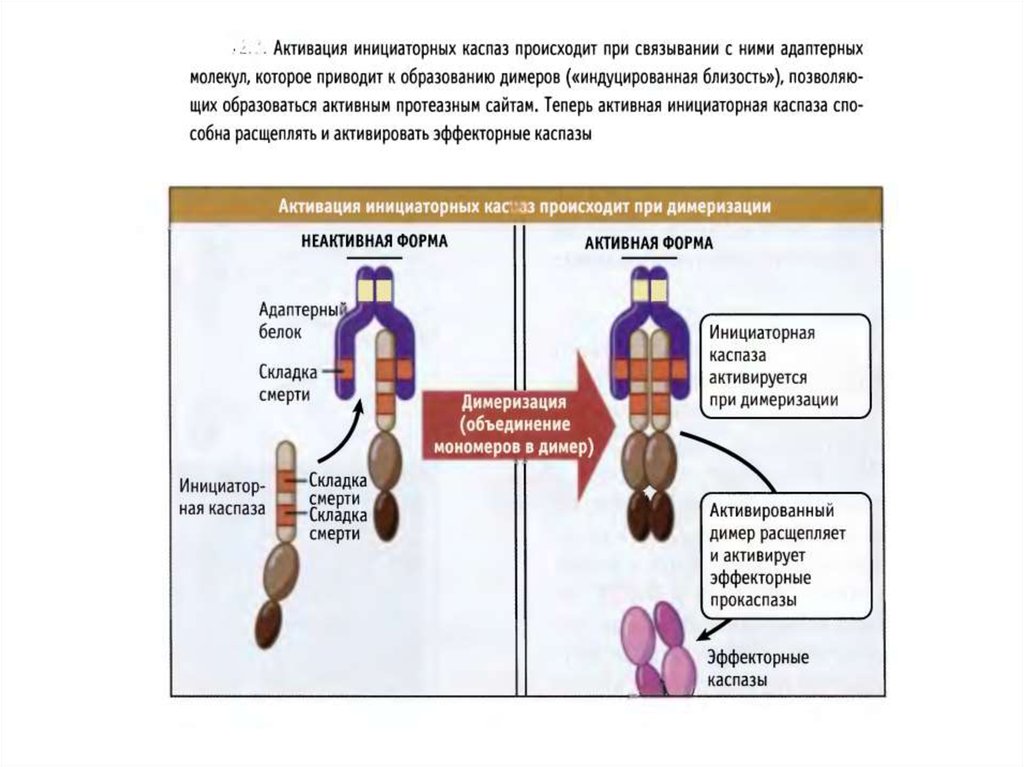
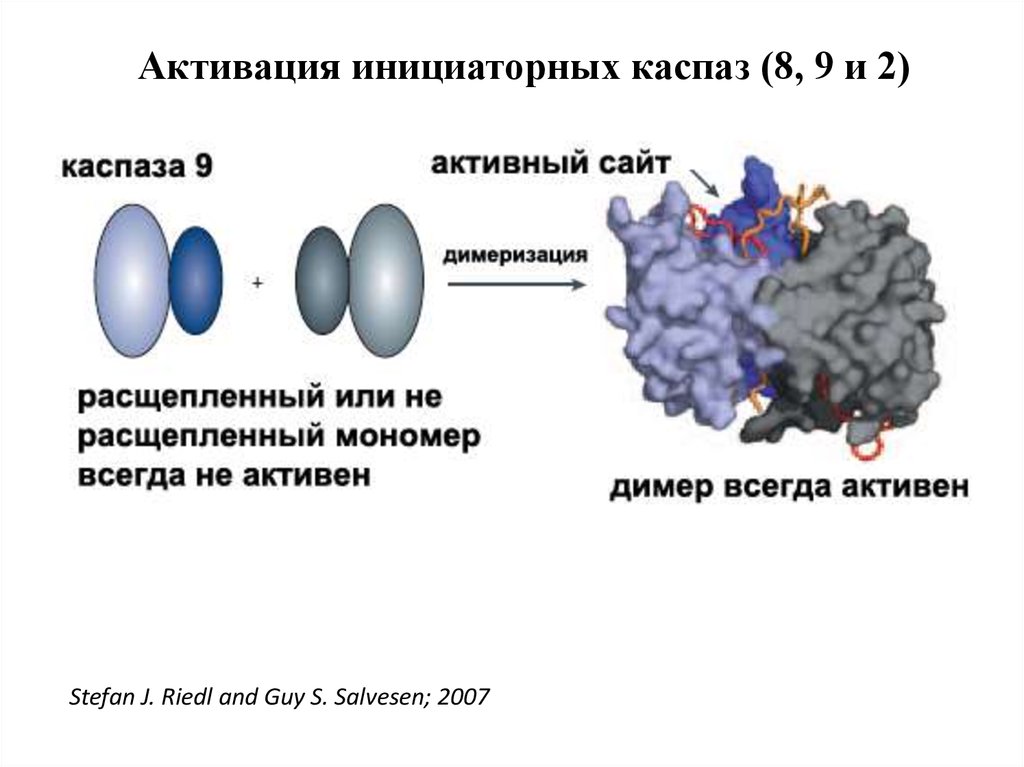
44. Активация инициаторных каспаз происходит по механизму индуцированного сближения
1. Инициаторные каспазы (-2,-8,-9,-10) находятся вклетках в виде неактивных мономеров.
2. Активация происходит путем связывания с
адаптерными белками и объединения двух
мономеров в димер, в котором формируются
активные сайты.
3. После образования димера происходит расщепление
по сайтам, содержащим аспартат, что стабилизирует
димер. Такой механизм активации за счет димеризации называется индуцированным сближением.
45.
46.
Активация инициаторных каспаз (8, 9 и 2)Stefan J. Riedl and Guy S. Salvesen; 2007
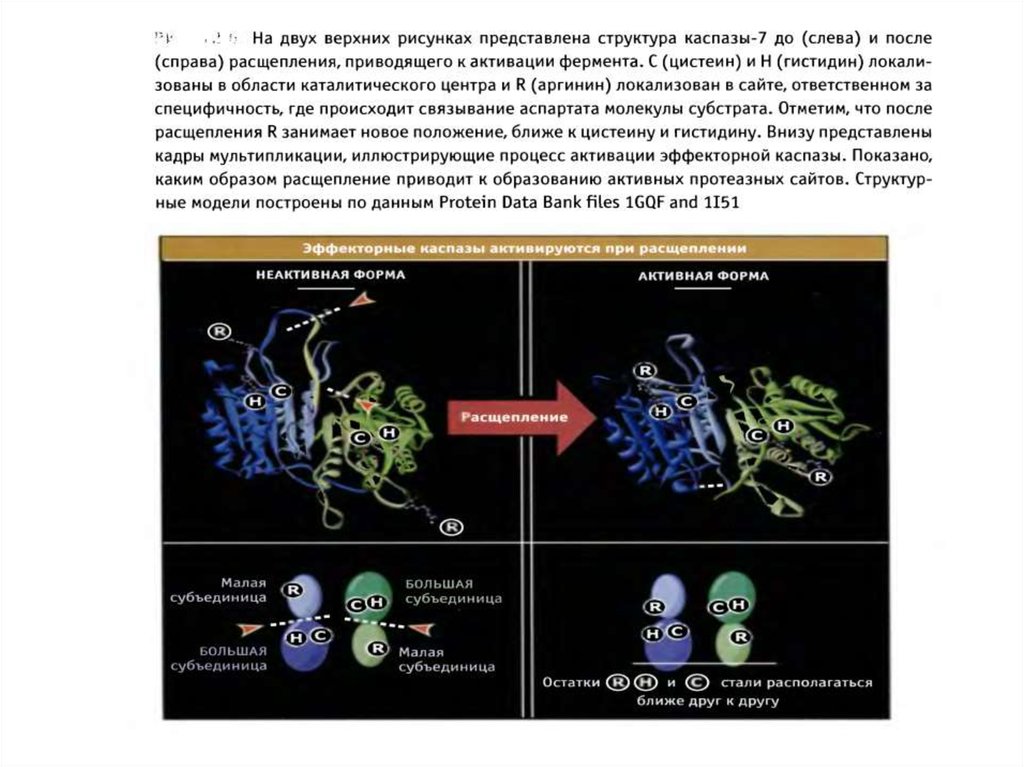
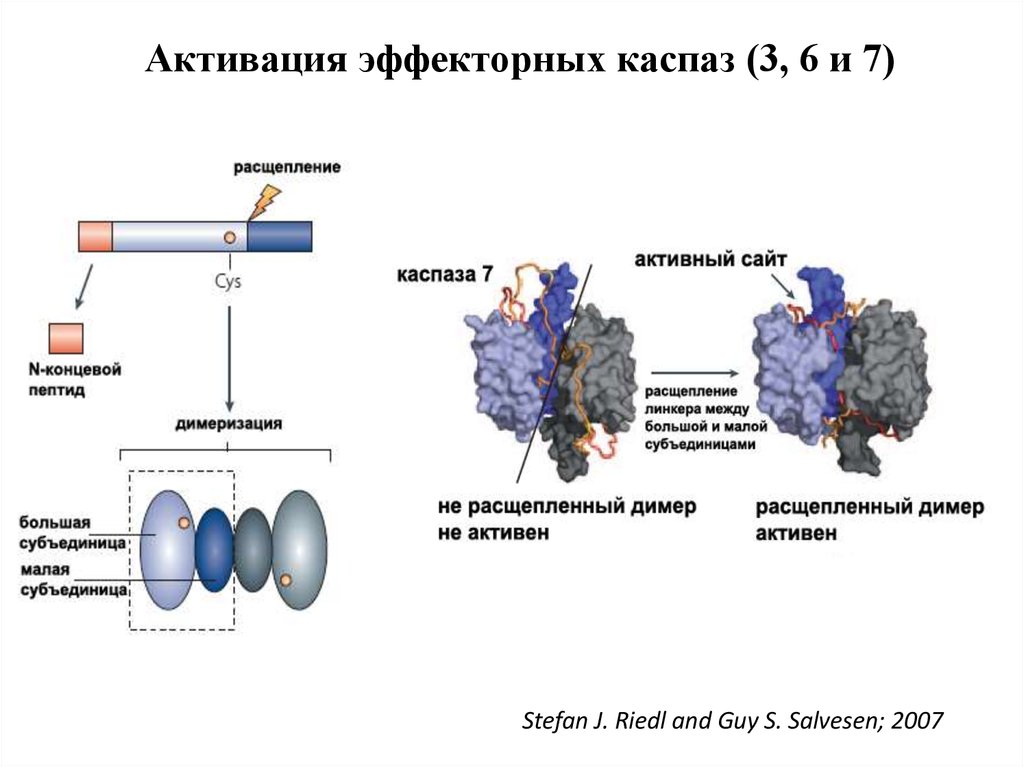
47. Активация эффекторных каспаз
1.Эффекторные каспазы (-7,-3,-6) присутствуют в клетках в виденеактивных димеров.
2.При активации происходит расщепление прокаспазы по аспартатсодержащим сайтам с помощью инициаторных каспаз.
3. Освобождается большая субъединица, содержащая в активном
сайте Цис-Гис, и малая субъединица, содержащая Арг в сайте
связывания субстрата.
4. Расщепление эффекторной каспазы формирует активный центр
фермента, при этом каталитический димер Цис-Гис, необходимый
для протеазной активности, сближается с Арг, который
специфически связывает Асп субстрата.
5. Два гетеродимера объединяются, образуя тетрамер с 2 активными
центрами.
48.
49.
Активация эффекторных каспаз (3, 6 и 7)Stefan J. Riedl and Guy S. Salvesen; 2007
50. Структура каспаз. Каспазы – цистеиновые аспартат-специфичные протеазы
51.
Классификация, строение и процесс активации каспаздвух типов: инициаторной и эффекторной.
52.
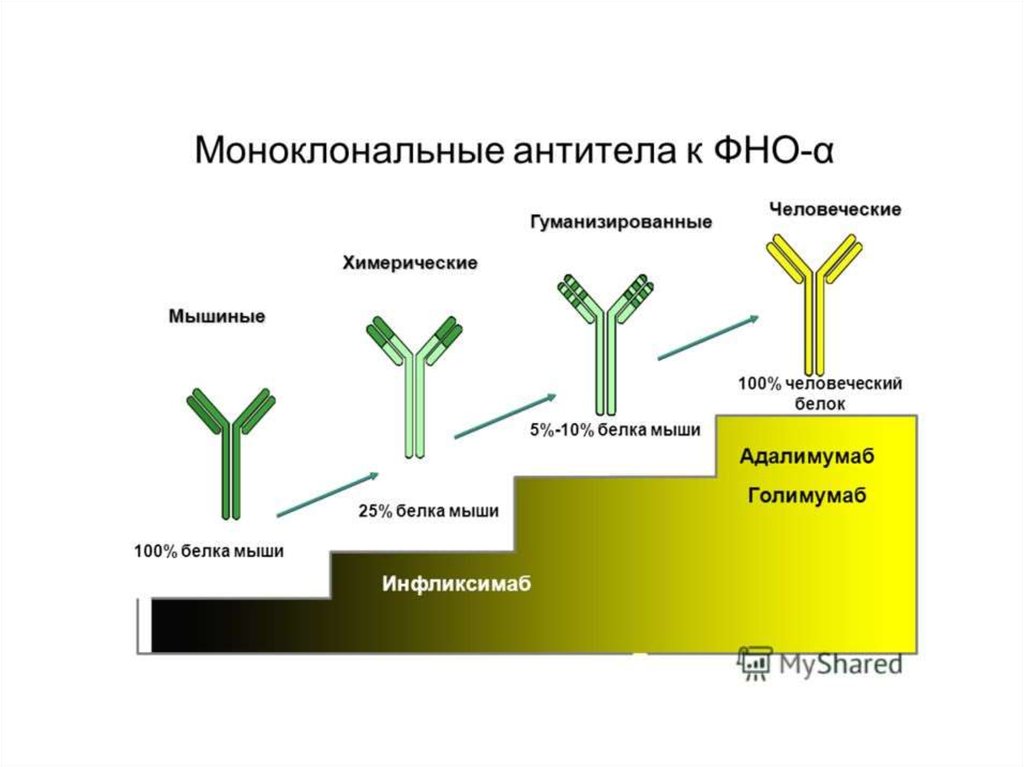
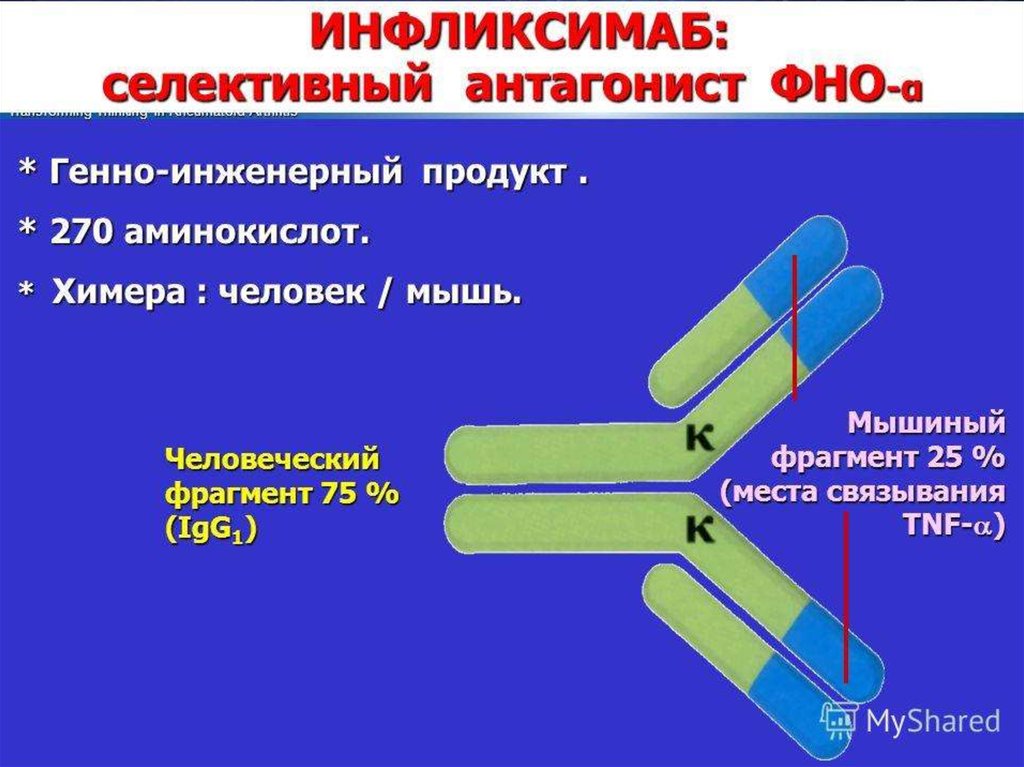
В 1990—2000-е годы многие фармацевтические фирмывкладывали огромные деньги в разработку ингибиторов каспаз.
Теперь практически все прекратили работу в этом направлении,
поскольку ингибиторы оказались токсичными, — именно потому,
что блокируют нормальную функцию каспаз в клетках.
В настоящее время ингибиторы каспаз используют лишь в
экстренных ситуациях, например при остром циррозе печени,
когда необходимо как можно скорее остановить разрушение ткани.
Другой пример — такое тяжелое заболевание, как болезнь
Крона: хроническое воспаление всех отделов желудочнокишечного тракта, от полости рта до прямой кишки, с
образованием свищей, инфекционными осложнениями и прочими
проблемами. При лечении болезни Крона (а также ревматоидного
артрита и язвенного колита) хорошо показал себя препарат
инфликсимаб, в России известный как ремикейд, — он действует
как раз через каспазу-1.
53.
54.
55.
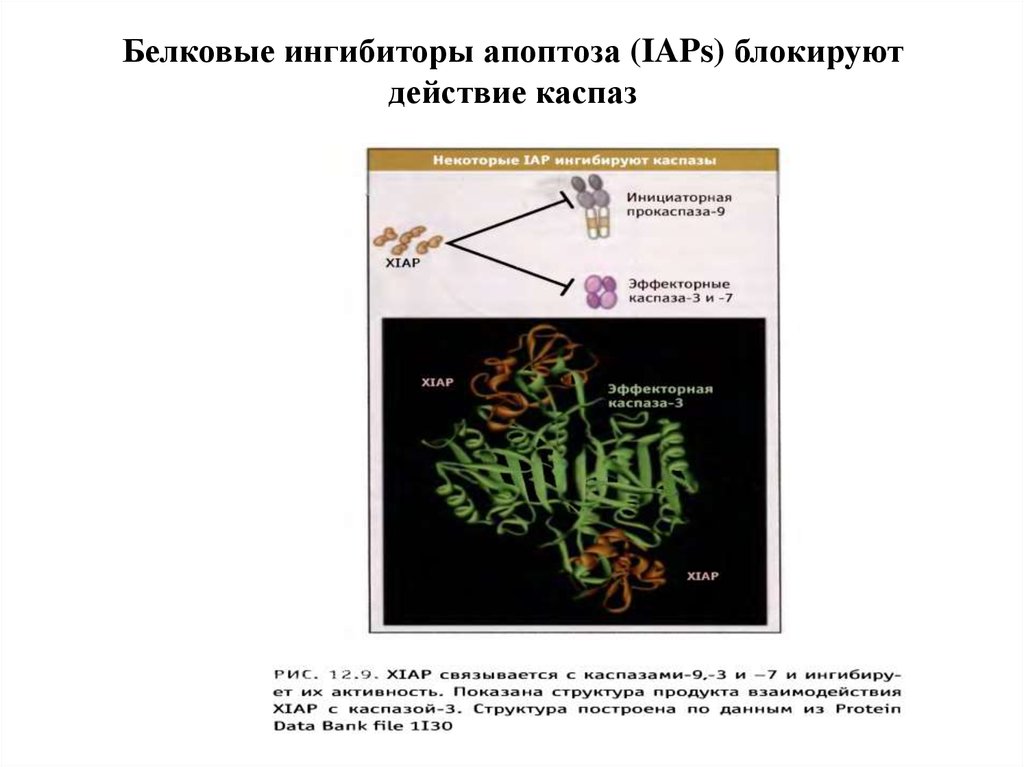
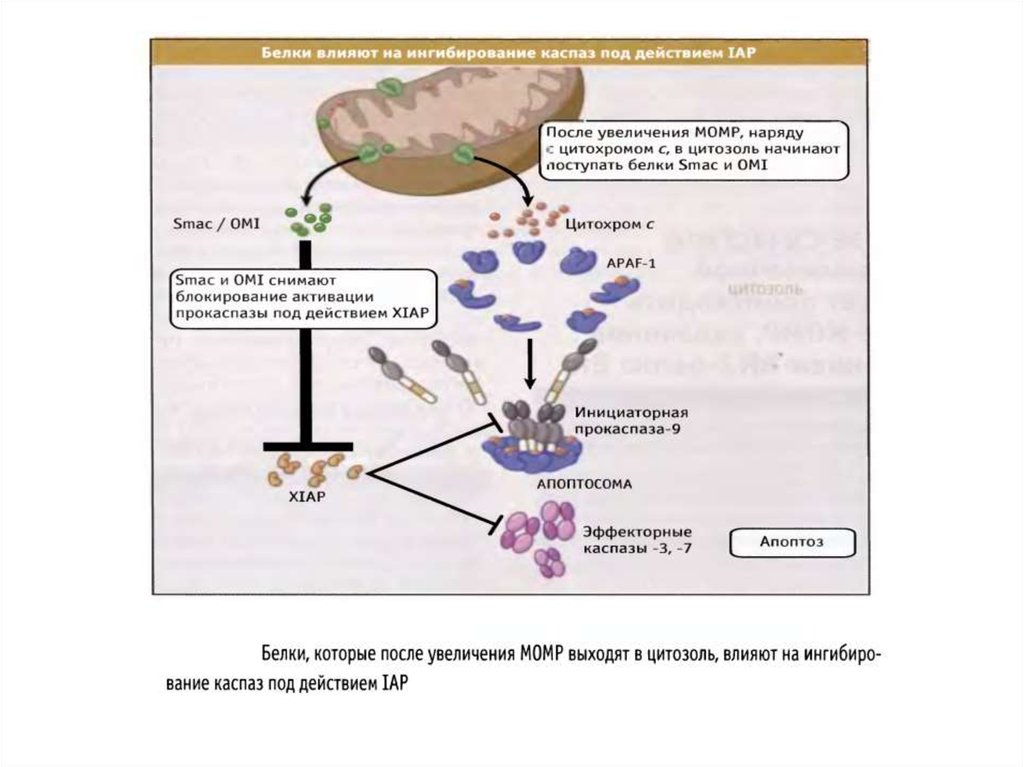
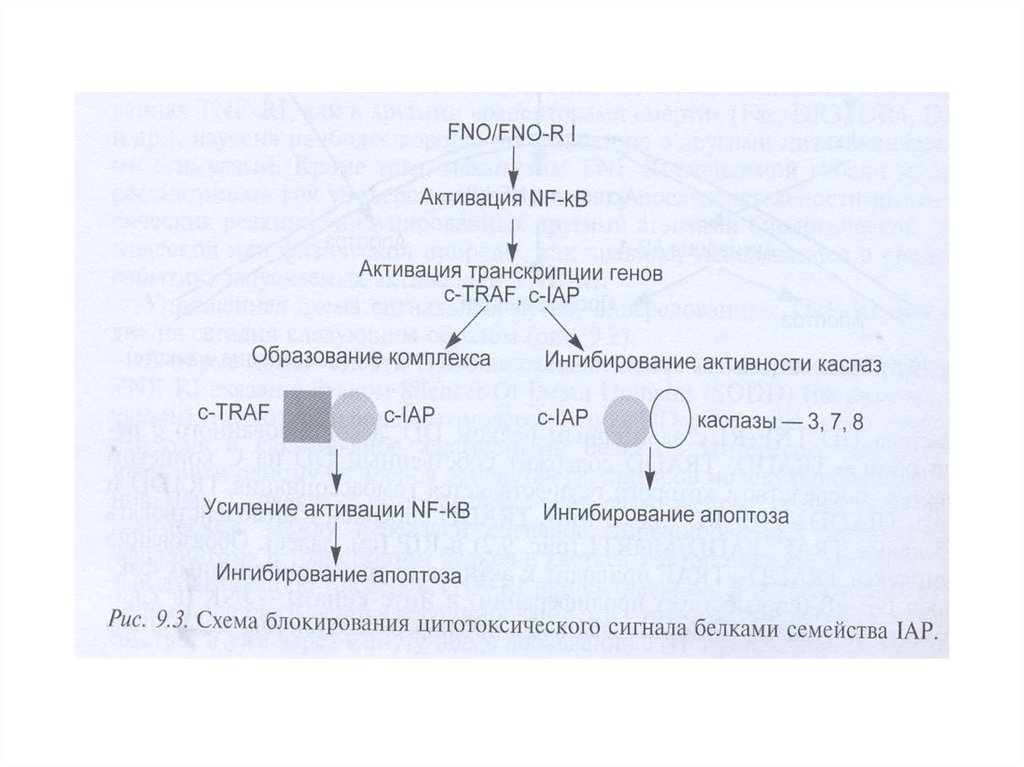
Белки семейства IAP (ingibitors of apoptosis proteases) ингибируют каспазы, темсамым выключая апоптоз. Впервые обнаружены у бакуловирусов , гомологи IAP
найдены у всех эукариот, от дрожжей до млекопитающих.
У млекопитающих обнаружено 8 представителей этого семейства, каждый из
которых содержит от одного до трех 70-аминокислотных участков, называемых BIRдоменами (baculoviruses inhibitor of apoptosis repeat domains).
IAP (XIAP) кодируется Х-хромосомой и содержит каждый 3 N-концевых BIRдомена и С-концевой RING -домен (really interesting new gene). XIAP
ингибируют каспазу-3, 7, 9.
BIR-домены связываются с каспазами, блокируя их активные сайты. С-Концевой
RING-домен обеспечивает деградацию каспаз благодаря своей убиквитинлигазной
активности ;
XIAP подвержен отрицательной регуляции. 25 кДа-митохондриальный
полипептид Smac/DIABLO (direct IAP-binding protein with low pi), выходя из
митохондрий в цитозоль, связывается с ними и нарушает их связывание с каспазами ,
ускоряя их активацию. Также ведет себя Omi/HtrA2 . При сверхэкспрессии каспаза3 и каспаза-7 могут сами расщеплять XIAP .
По последним данным, XIAP способен противостоять ингибирующему действию
Smac/DIABLO, присоединяя к нему убиквитин .
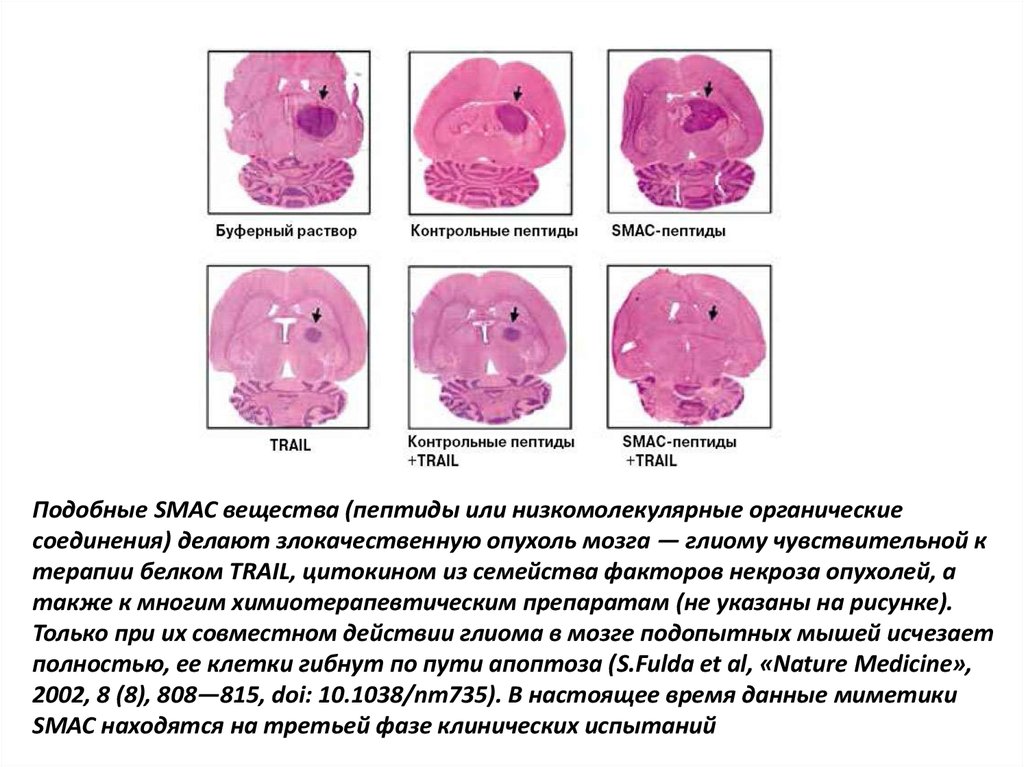
Низкомолекулярные миметики SMAC (небольшие молекулы, имитирующие
функцию этого белка) показали себя достаточно эффективными при терапии глиомы
— опухоли мозга
56. Белковые ингибиторы апоптоза (IAPs) блокируют действие каспаз
57.
Подобные SMAC вещества (пептиды или низкомолекулярные органическиесоединения) делают злокачественную опухоль мозга — глиому чувствительной к
терапии белком TRAIL, цитокином из семейства факторов некроза опухолей, а
также к многим химиотерапевтическим препаратам (не указаны на рисунке).
Только при их совместном действии глиома в мозге подопытных мышей исчезает
полностью, ее клетки гибнут по пути апоптоза (S.Fulda et al, «Nature Medicine»,
2002, 8 (8), 808—815, doi: 10.1038/nm735). В настоящее время данные миметики
SMAC находятся на третьей фазе клинических испытаний
58.
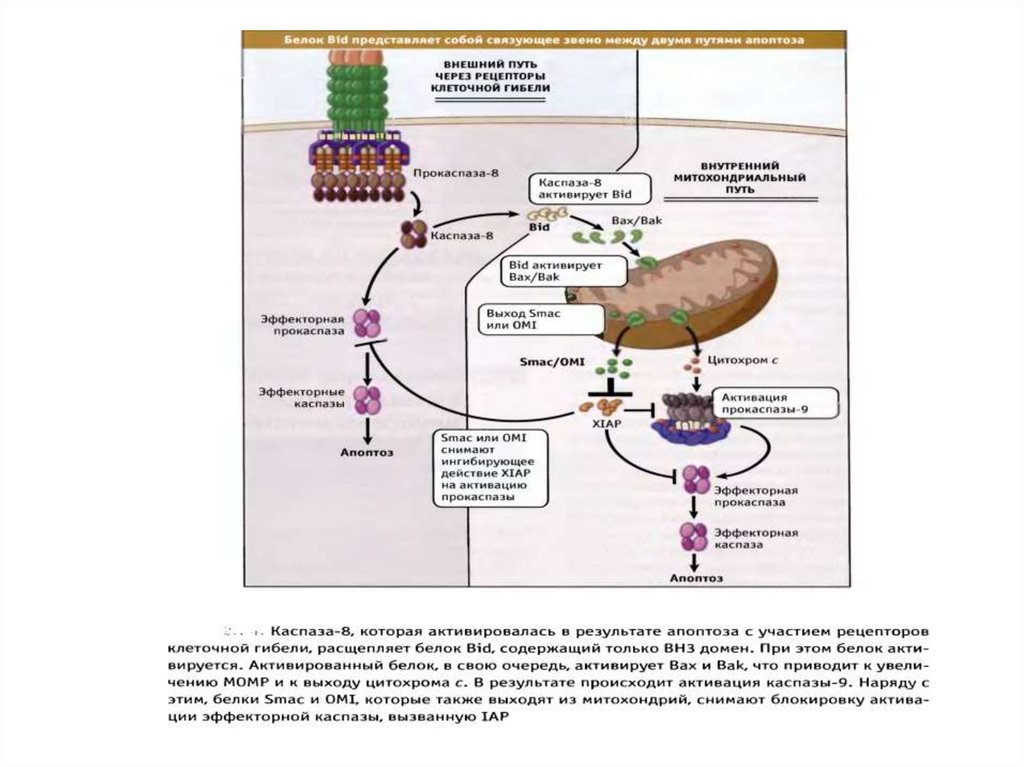
Митохондрии выполняют роль «контрольно-пропускногопункта» апоптотического сигнала
повреждения ДНК
рецепторы
смерти
различные стрессы
каспаза 2
каспаза 8
эффекторные каспазы
Bid
MMP
MMP
поверхностные
рецепторы
Smac/Diablo
Omi/HtrA2
цитохром с
AIF
каспаза 9
Эндонуклеаза G
эффекторные каспазы
фрагментация ДНК
апоптоз
IAP XIAP
(ингибиторы
каспаз)
59.
60.
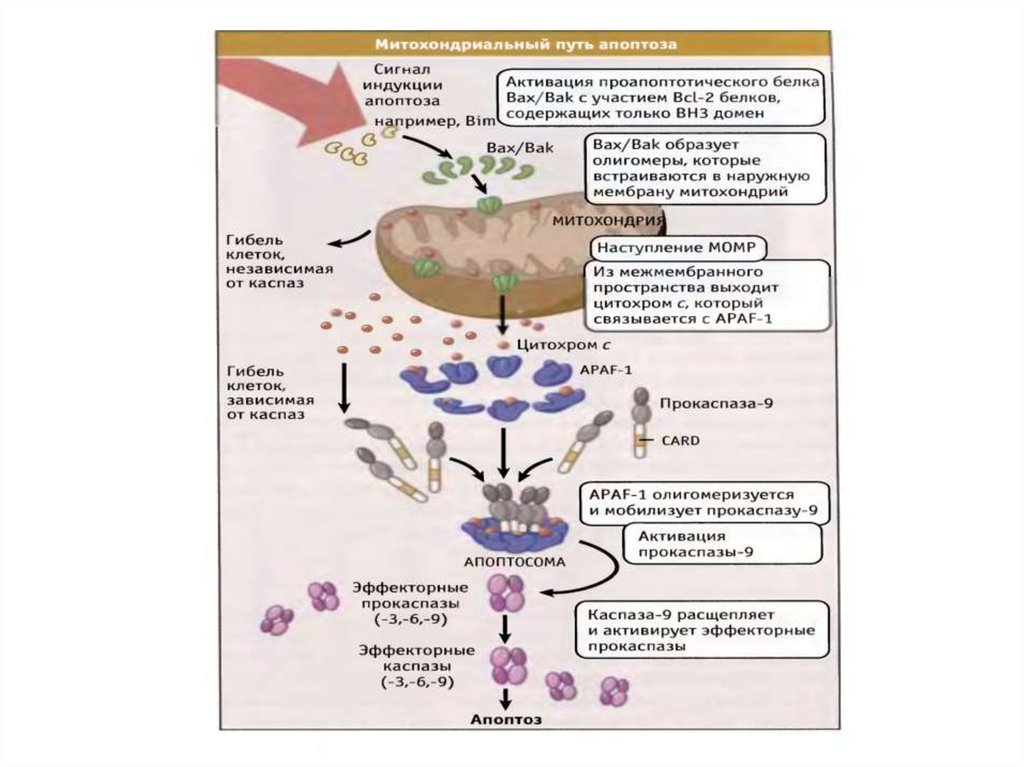
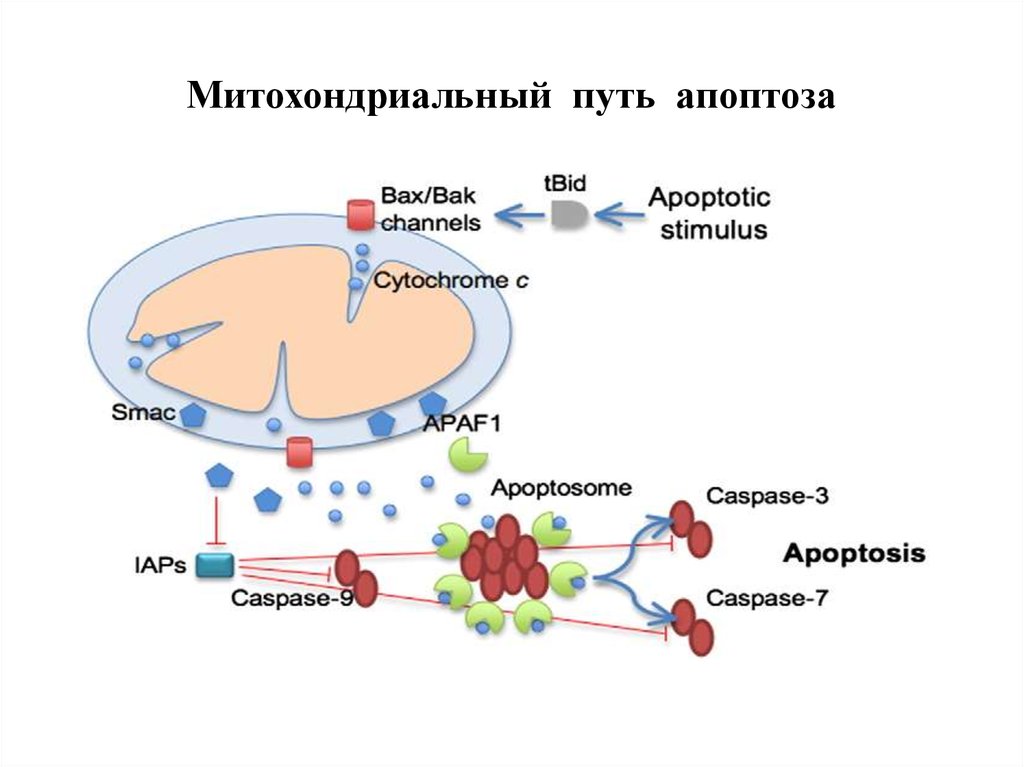
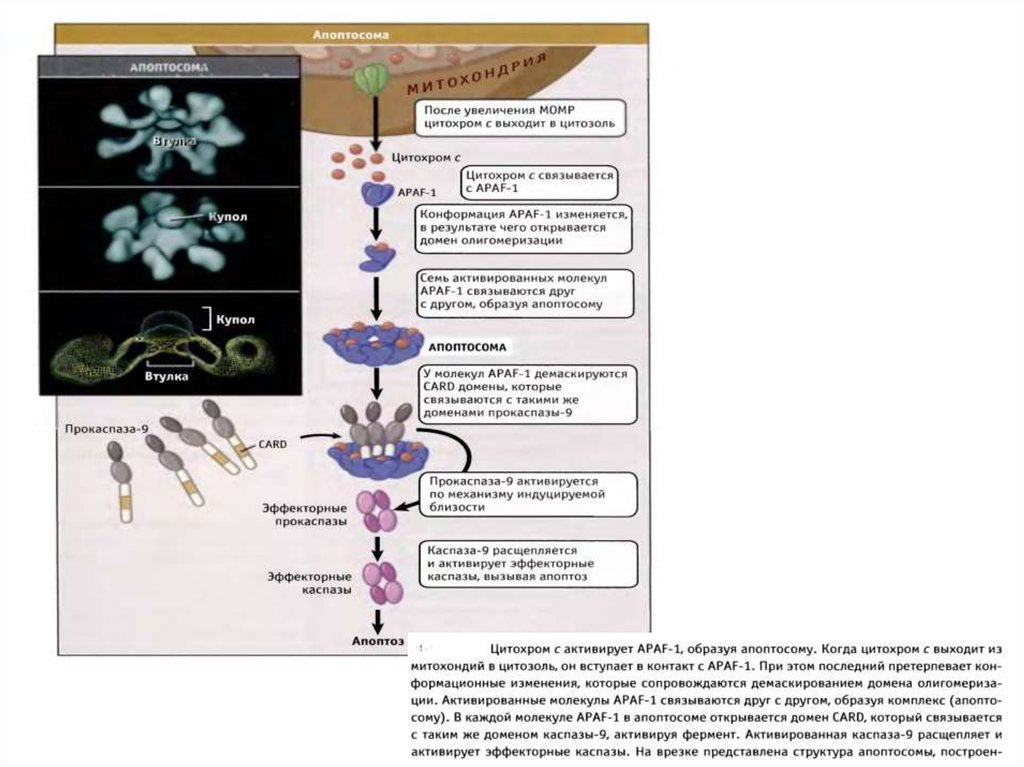
61. Митохондриальный путь апоптоза
62. Митохондриальный путь апоптоза (Кремер, 1997)
63.
64. Фрагмент схемы апоптоза, протекающего по митохондриальному пути.
65.
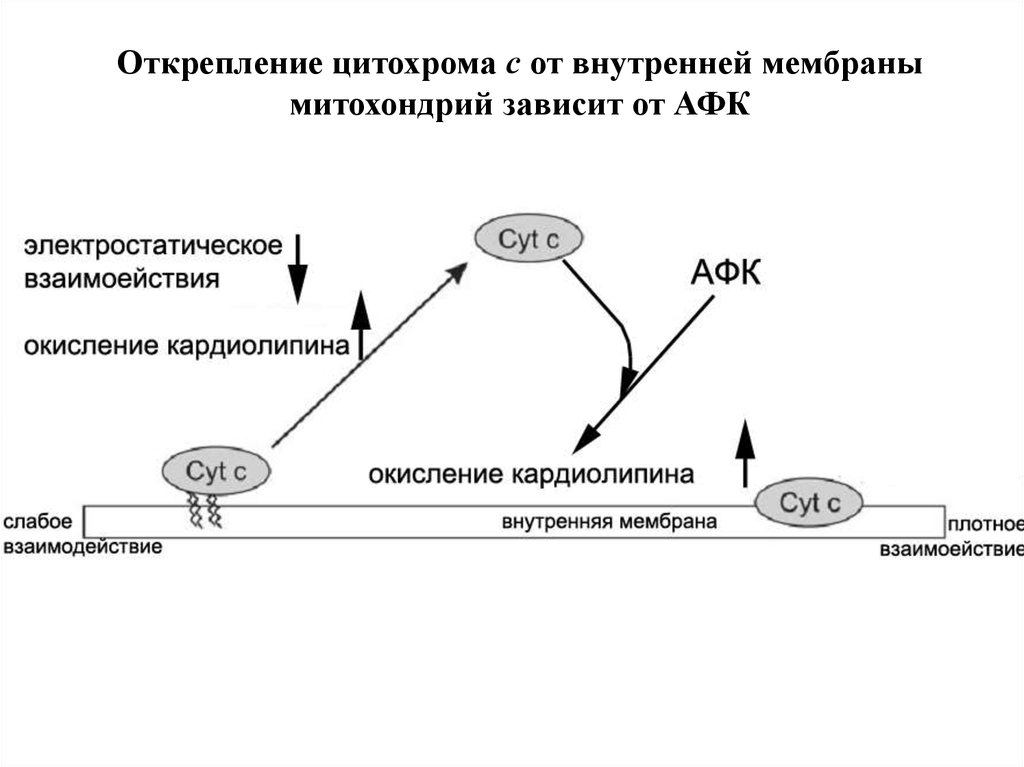
Открепление цитохрома с от внутренней мембранымитохондрий зависит от АФК
66.
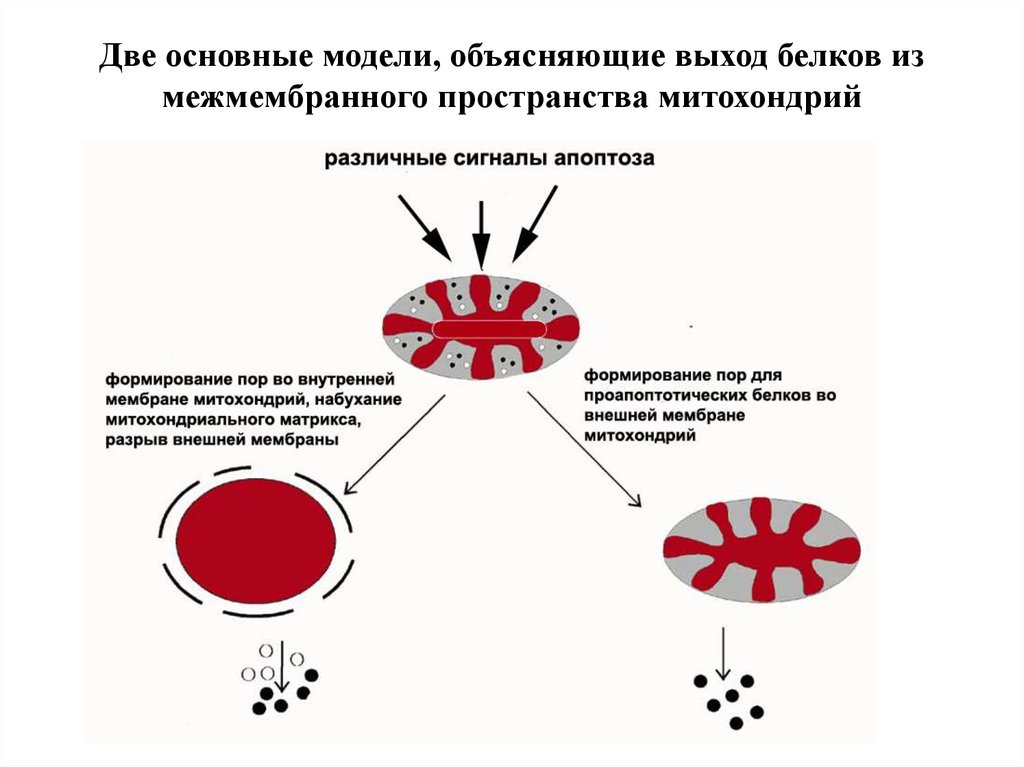
Две основные модели, объясняющие выход белков измежмембранного пространства митохондрий
67.
Одна из моделей мегапоры (PTP)68.
Возможные механизмы обеспечения проницаемостивнешней мембраны Bax/Bak и Bax/tBid
69.
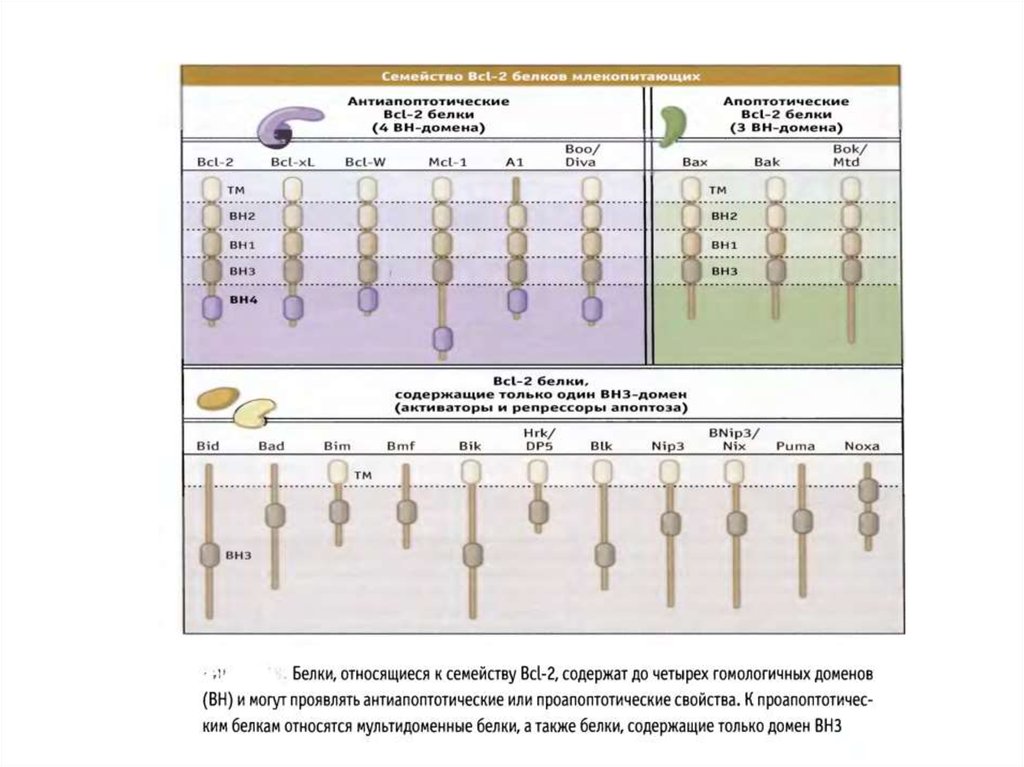
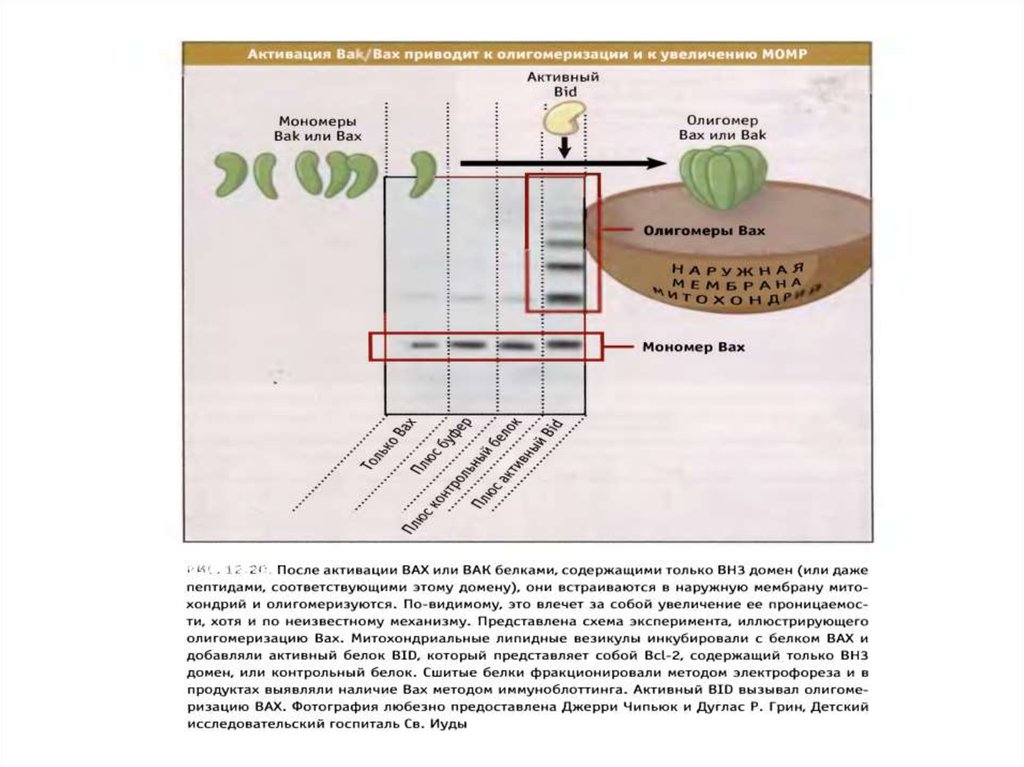
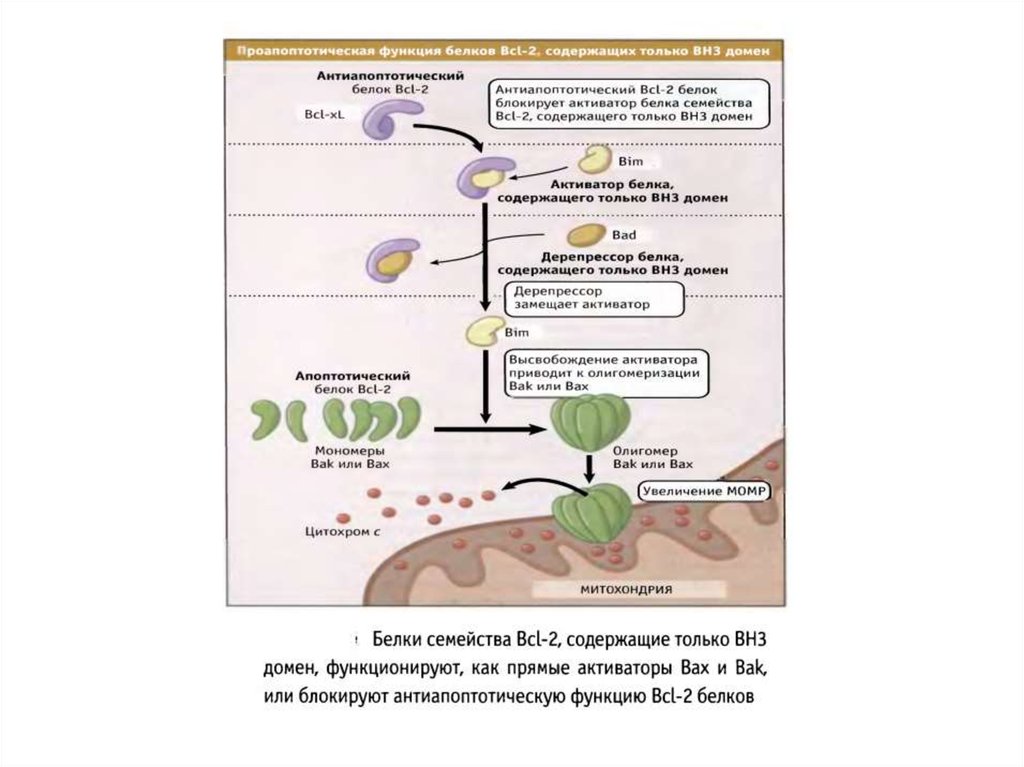
70. Белки сем Bcl-2 участвуют в апоптозе
• Белки сем.Bcl-2 играют главную роль вмитохондриальном пути апоптоза.
• Известно 3 класса Bcl-2 белков, которые являются
индукторами, непосредственной причиной или
ингибиторами повышения проницаемости наружной
мембраны митохондрий (MOMP).
• Белки Baх и Bak повышают МОМР и необходимы для
реализации митохондриального пути апоптоза.
• Антиапоптотические белки сем.Bcl-2 блокируют
повышение МОМР, вызванное белками Bcl-2.
• ВН3 белки сем.Bcl-2 могут активировать Baх и Bak или
нарушают функции антиапоптотических белков.
71.
Bcl-2. Перенос его гена с одной хромосомы на другую(транслокация) ассоциируется с лимфомой В-клеток. Отсюда
название белка и его гена — B cell lymphoma.
В 80-е годы ХХ века австралийский биолог Дэвид Во с
коллегами показал, что этот белок работает как
антиапоптотический, препятствуя гибели В-клеток; вскоре это
подтвердили и другие исследователи. Таким образом, впервые
было доказано, что белки, участвующие в негативной
регуляции гибели клеток, могут работать как онкогены: если
апоптоз блокирован и дефектные клетки не погибают,
заболевание развивается.
(D.L.Vaux, S. Cory, J.M.Adams, «Nature», 1988, 335, 440—
442).
72.
73.
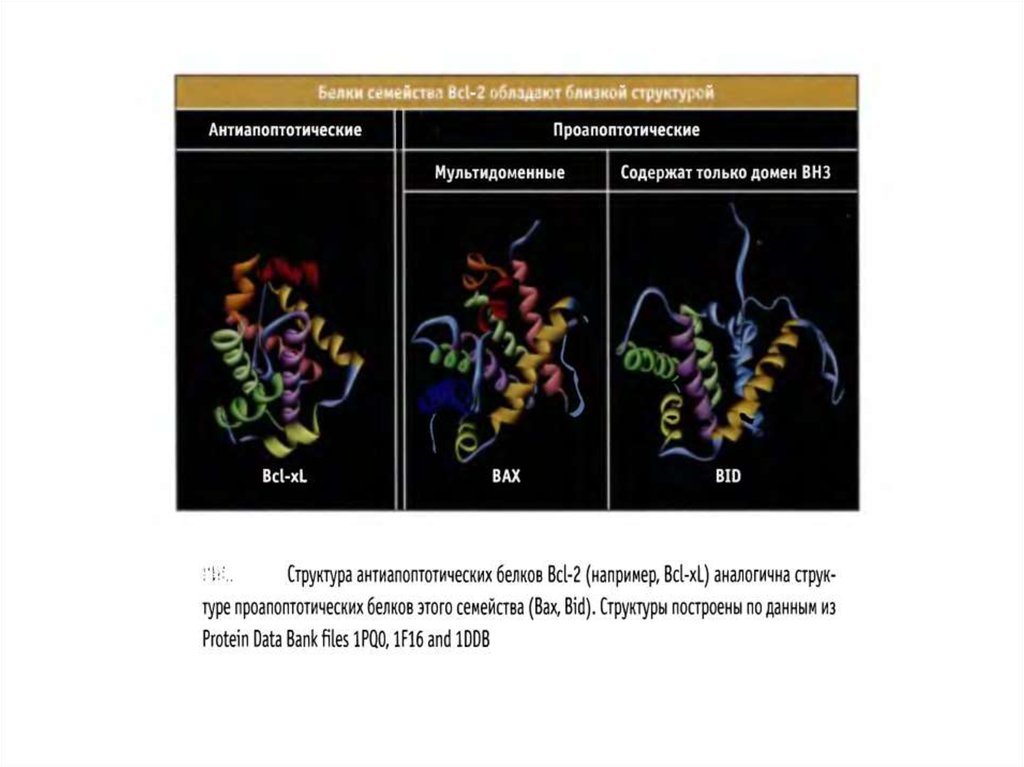
Белки семейства BCL-274.
75.
76.
77.
78.
79.
80.
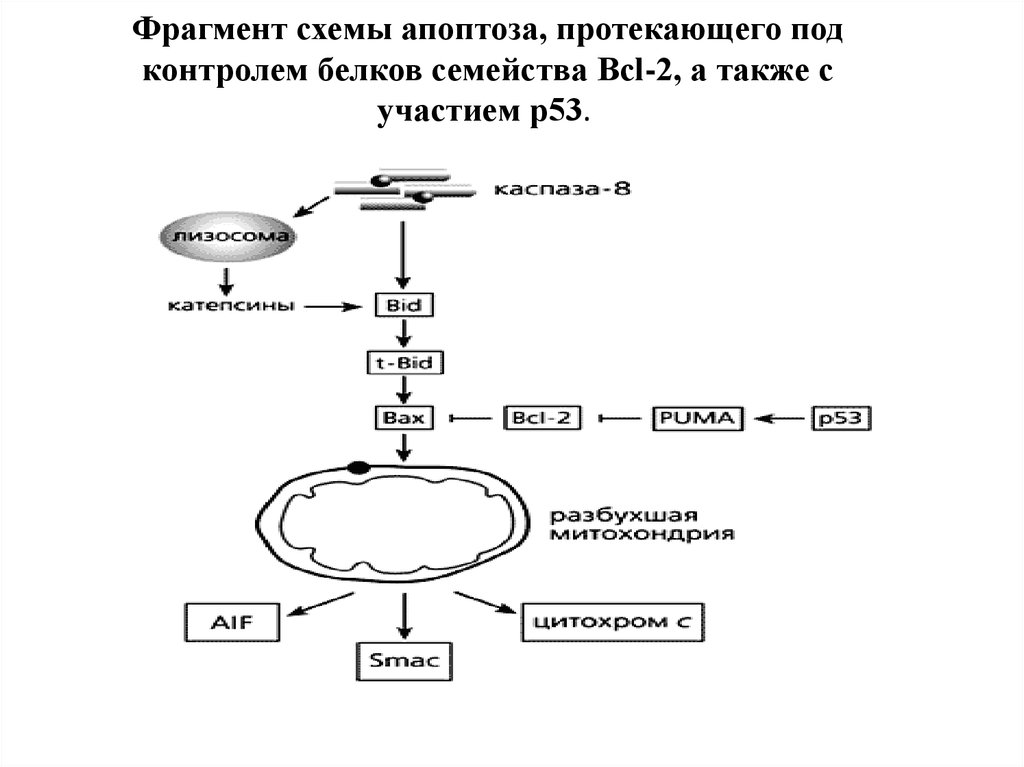
81. Фрагмент схемы апоптоза, протекающего под контролем белков семейства Bcl-2, а также с участием p53.
Фрагмент схемы апоптоза, протекающего подконтролем белков семейства Bcl-2, а также с
участием p53.
82.
Митохондриальные белки, вызывающиефрагментацию ДНК независимо от каспаз
Эндонуклеаза G
AIF(Apoptosis Inducing Factor)
83.
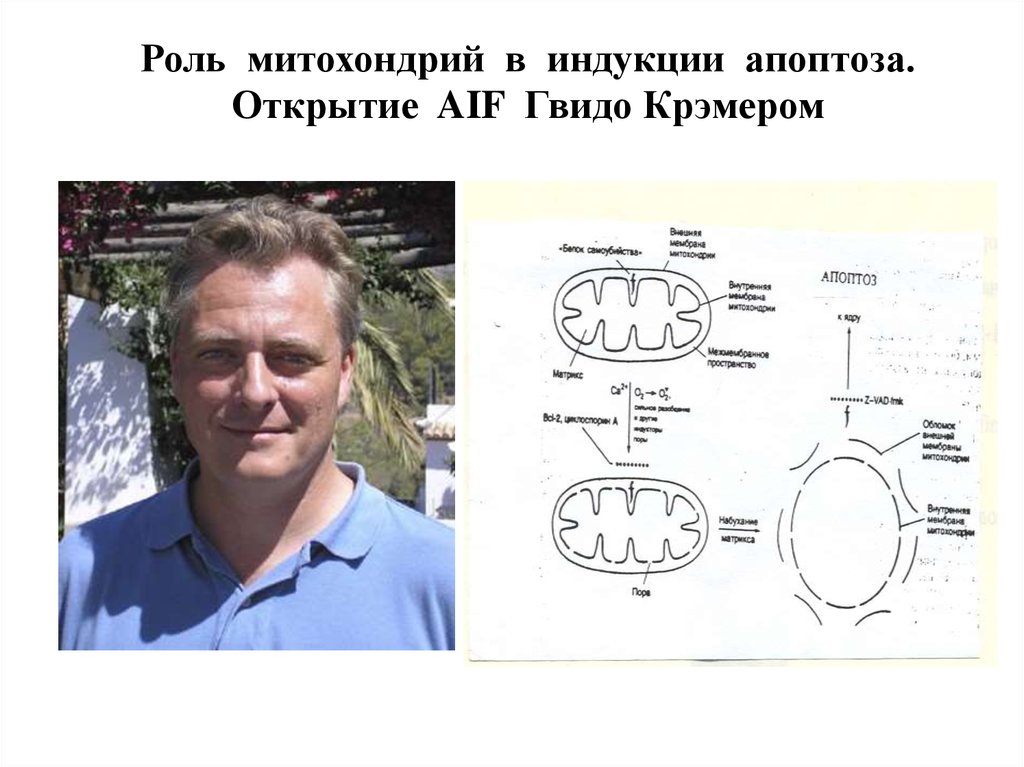
Роль митохондрий в индукции апоптоза.Открытие AIF Гвидо Крэмером
84.
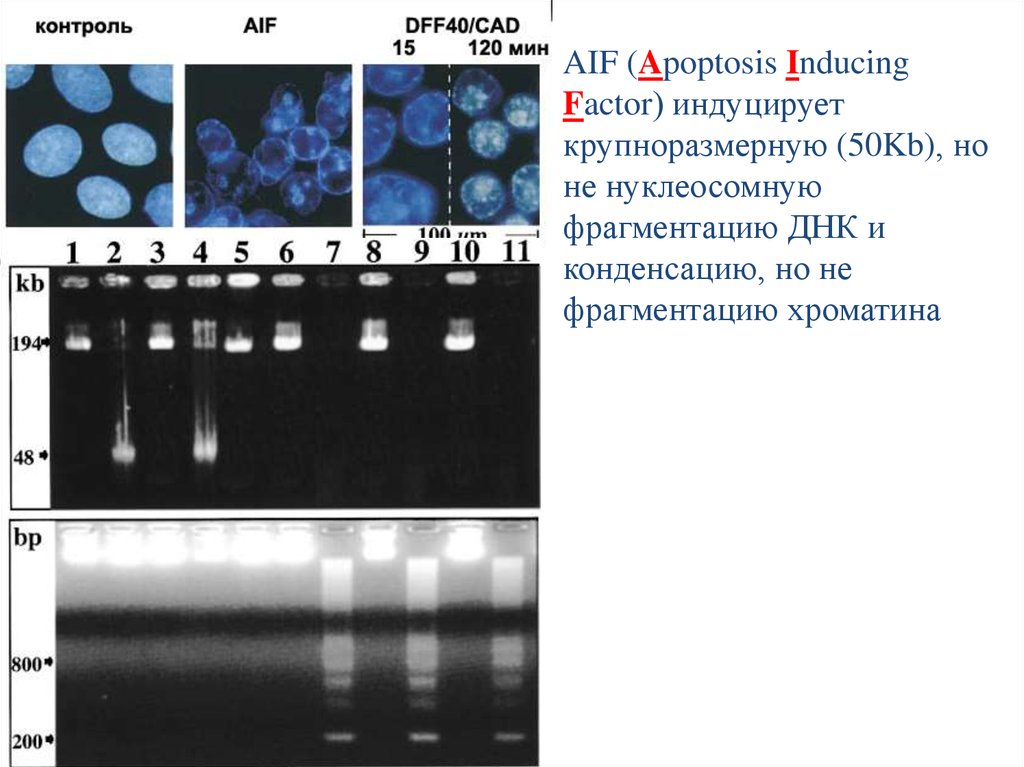
AIF (Apoptosis InducingFactor) индуцирует
крупноразмерную (50Kb), но
не нуклеосомную
фрагментацию ДНК и
конденсацию, но не
фрагментацию хроматина
85.
Отделение AIF от внутренней мембраны митохондрийрегулируется Ca2+ и АФК
86.
Контроль сборкиили разборки
комплекса 1
дыхательной цепи
митохондрий
Эффекты AIF
MОMP- выход
цитохрома с и
AIF
AIF
Неизвестный
цитоплазматический
эффектор
Неизвестный
ядерный эффектор
НАДФН-оксидаза
– генерация
супероксид аниона
50Kb фрагментация
ДНК
87.
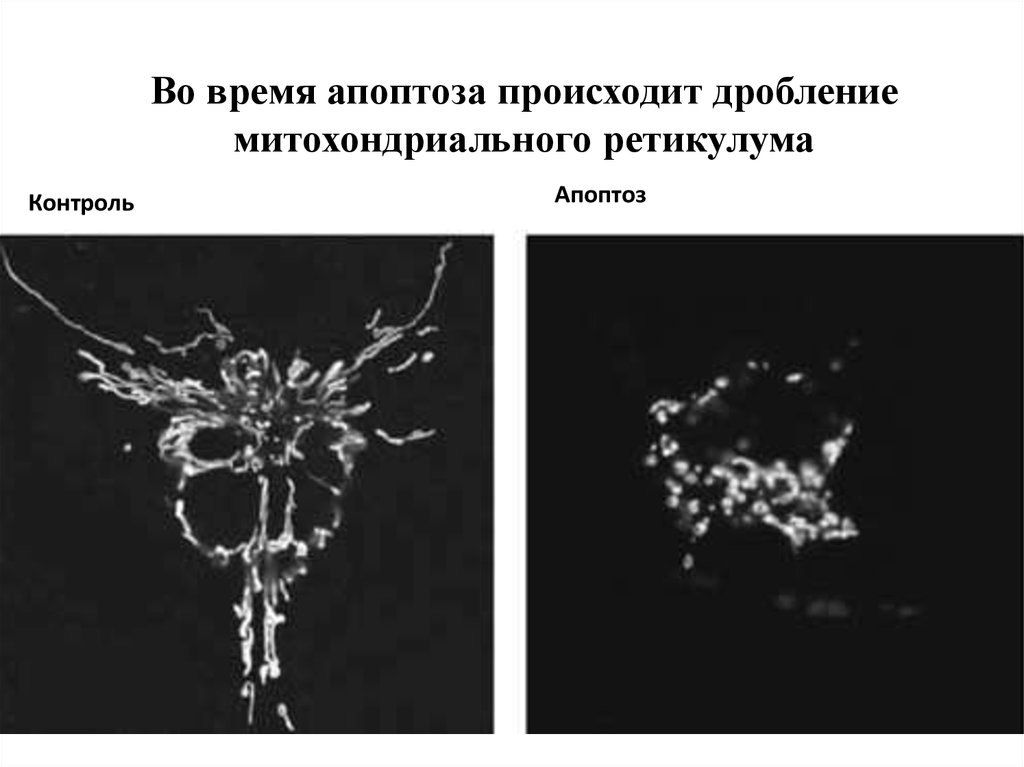
Во время апоптоза происходит дроблениемитохондриального ретикулума
Контроль
Апоптоз
88.
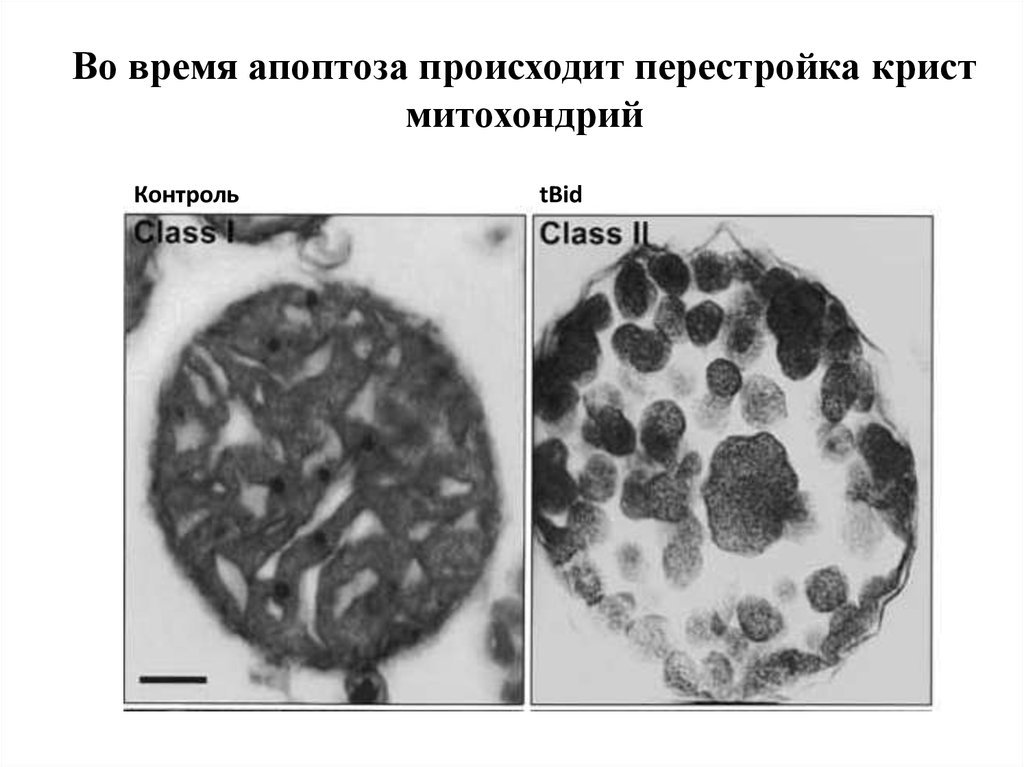
Во время апоптоза происходит перестройка кристмитохондрий
Контроль
tBid
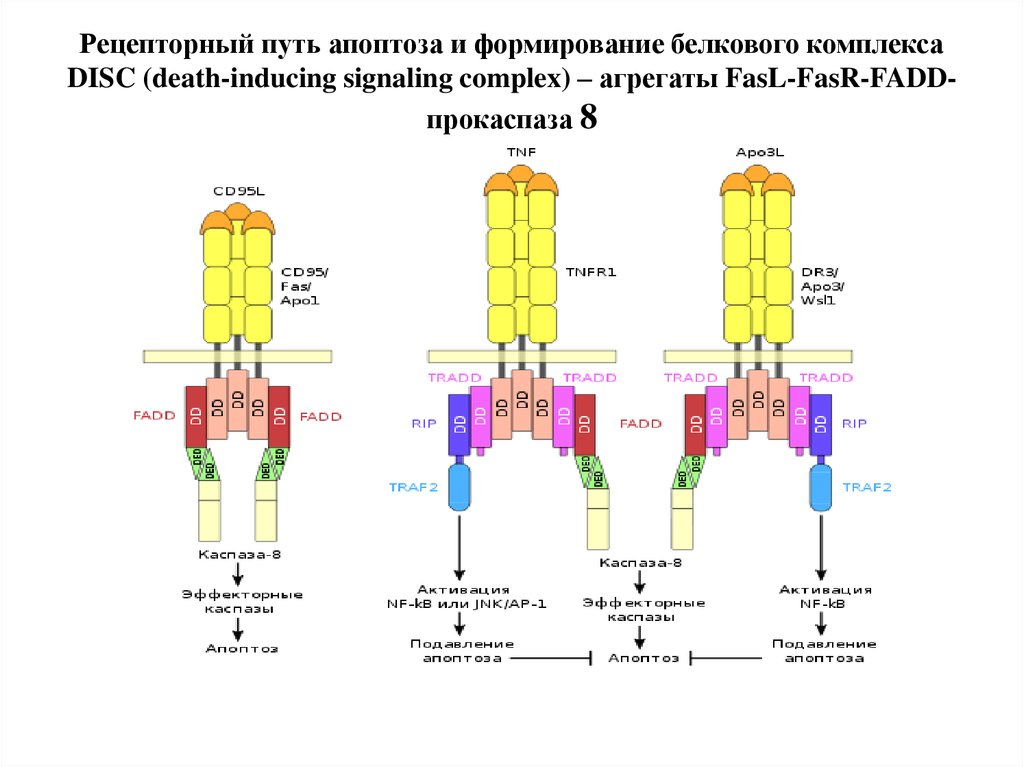
89. Рецепторный путь апоптоза и формирование белкового комплекса DISC (death-inducing signaling complex) – агрегаты FasL-FasR-FADD-прокаспаза 8
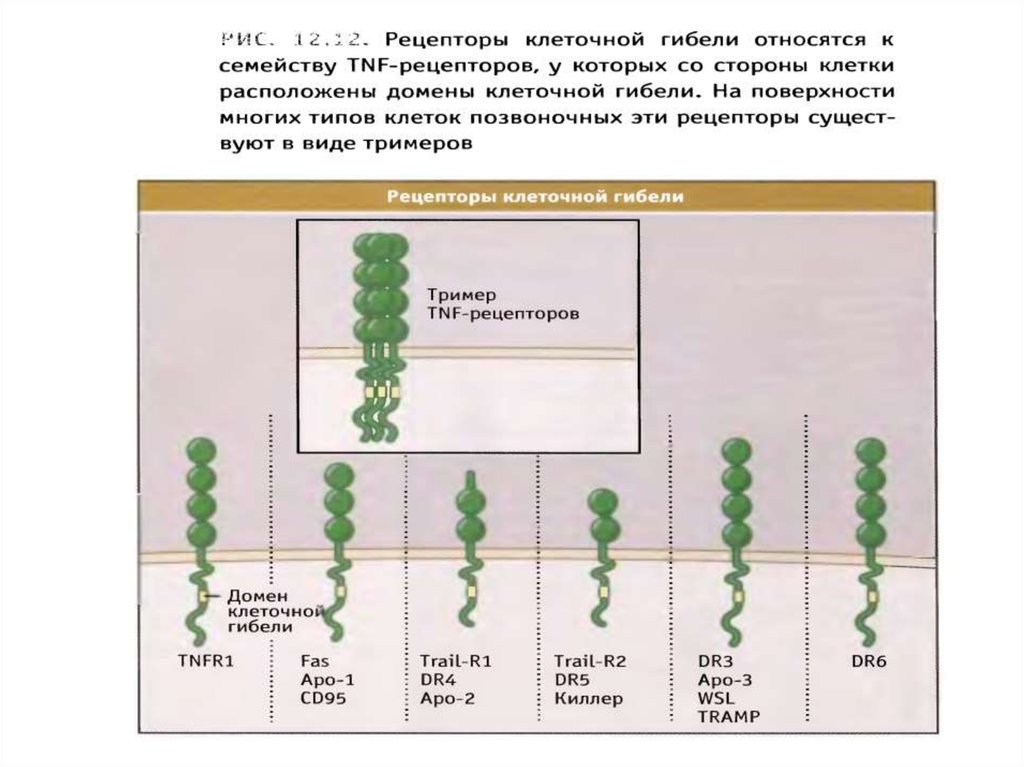
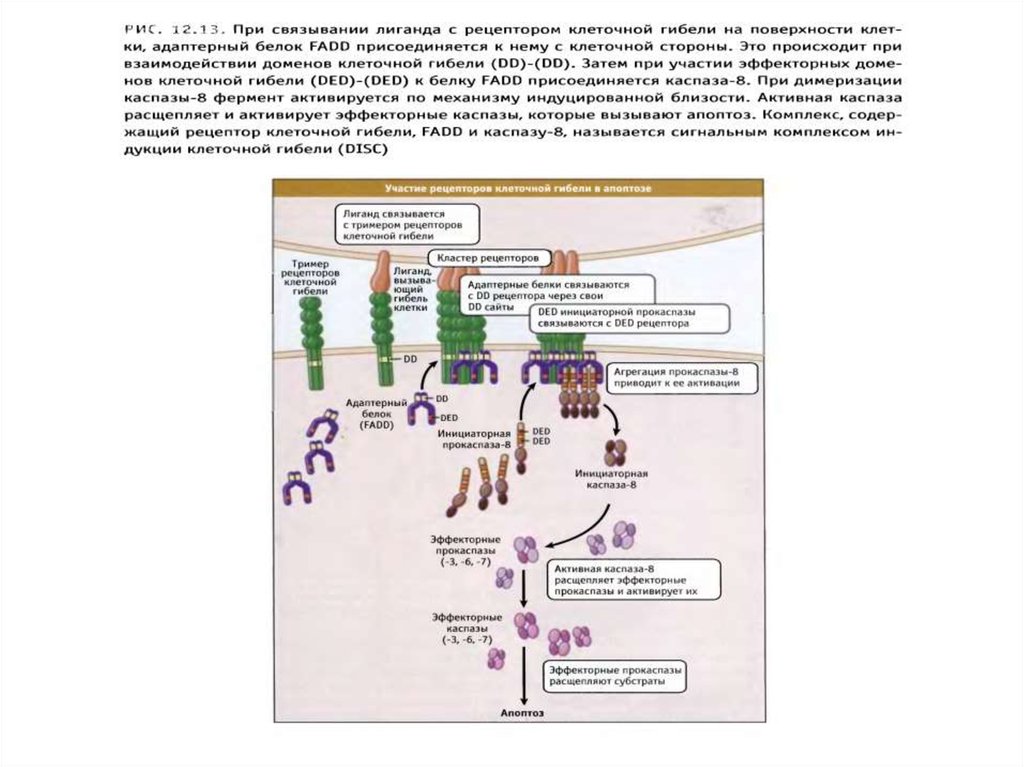
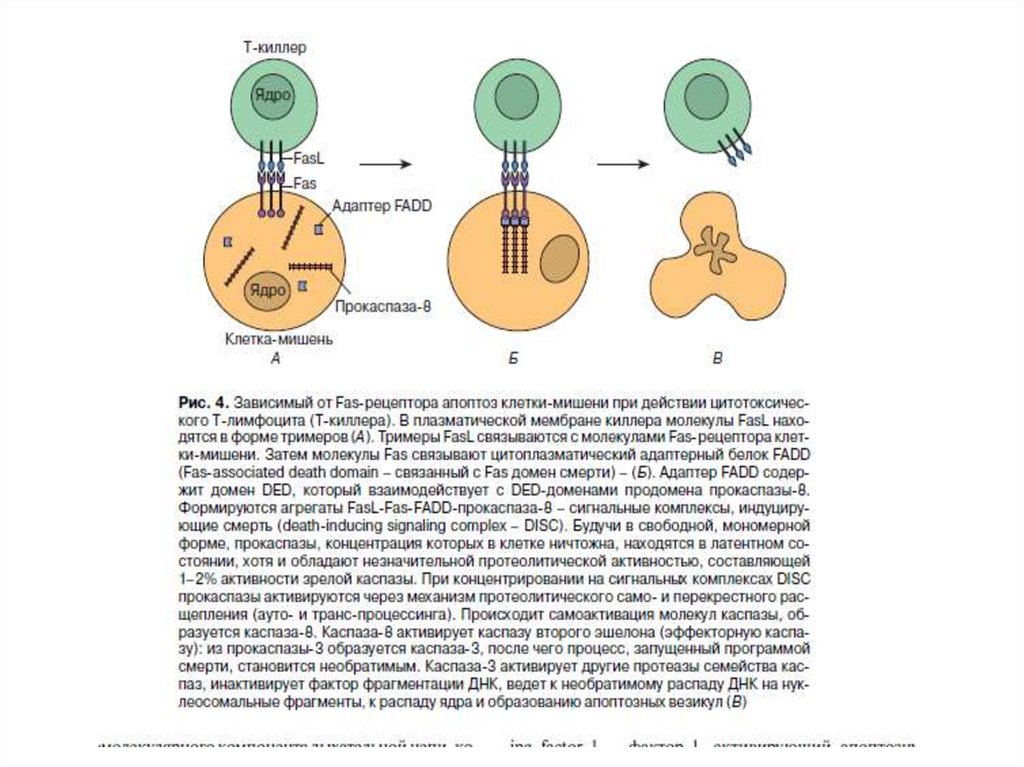
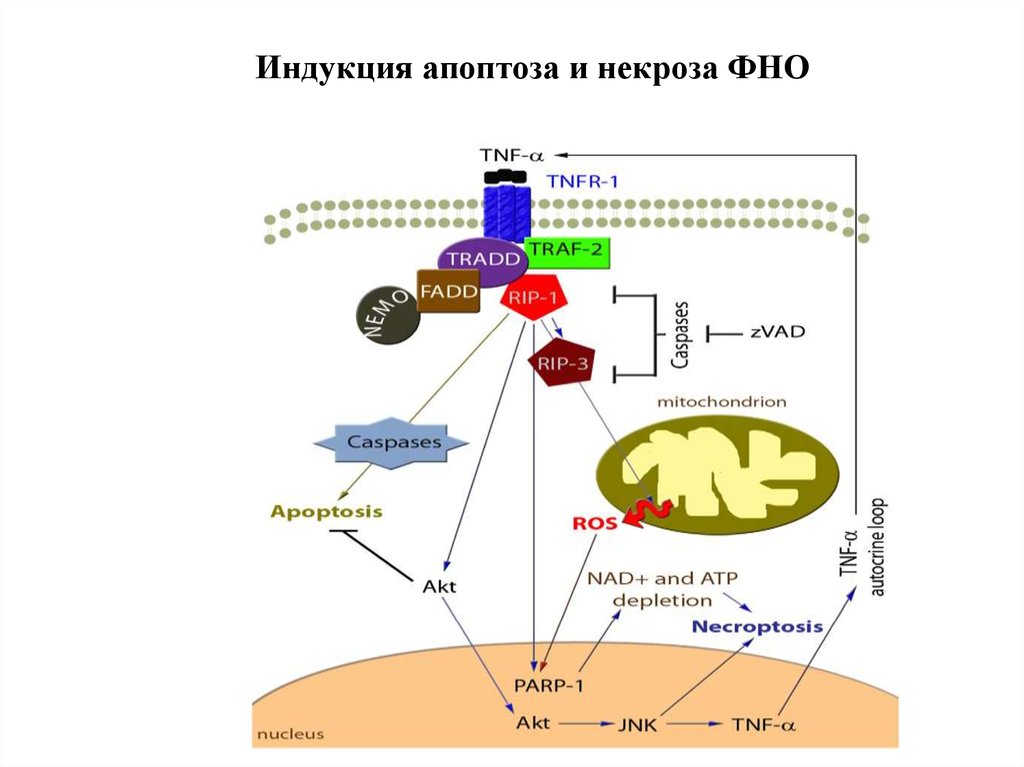
Рецепторный путь апоптоза и формирование белкового комплексаDISC (death-inducing signaling complex) – агрегаты FasL-FasR-FADDпрокаспаза 8
90.
91.
92.
93.
94.
95.
96. Деградация ДНК идет поэтапно
1 этап. Образование крупных фрагментов,содержащих 300 тыс. п.н., затем 30-50 тыс.
п.н.
Идет протеолиз топоизомеразы II,
участвующей в формировании суперспирализованных петель по 50 тыс. п.н., 6
петель объединяются в дисковидную
розетку – 300 тыс. п.н. Активны ДНК-азы I,
II; Ca, Mg- зависимые эндонуклеазы.
2 этап. Межнуклеосомная деградация ДНК с
образованием фрагментов в 180-200 п.н.
(протяженность нити в нуклеосоме) или
кратных им по величине. Расщепление
гистона H1. Активируется эндонуклеаза
CAD (в результате расщепления Касп-3
ингибитора ICAD).
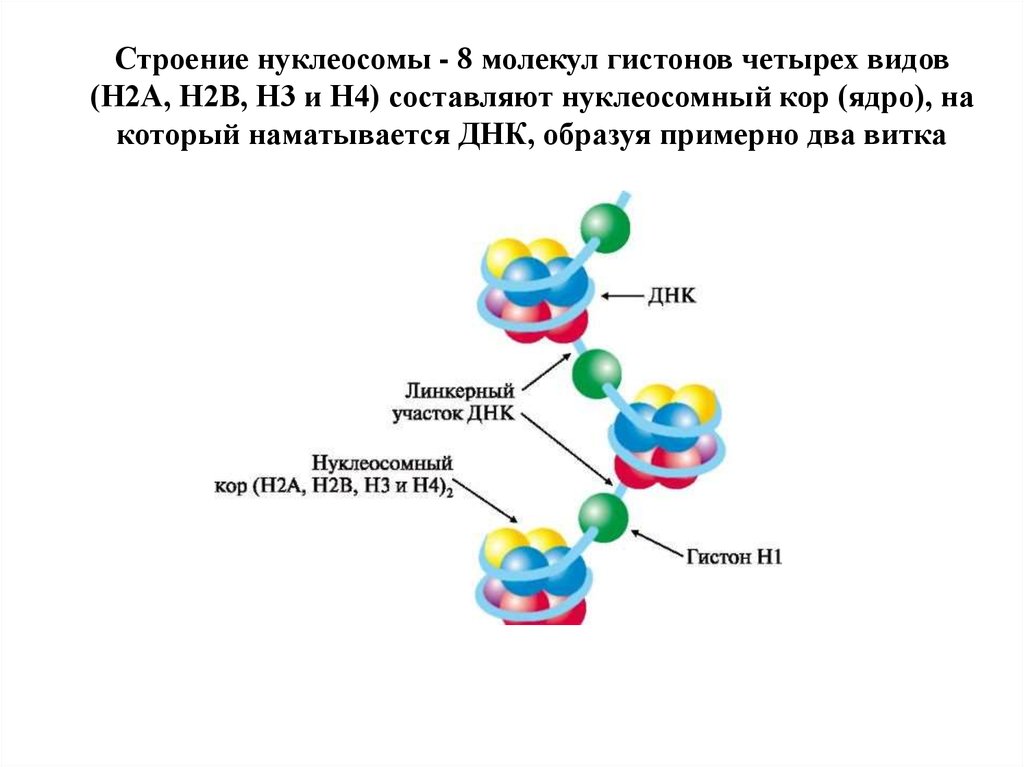
97. Строение нуклеосомы - 8 молекул гистонов четырех видов (Н2А, Н2В, Н3 и Н4) составляют нуклеосомный кор (ядро), на который наматывается ДНК, образ
Строение нуклеосомы - 8 молекул гистонов четырех видов(Н2А, Н2В, Н3 и Н4) составляют нуклеосомный кор (ядро), на
который наматывается ДНК, образуя примерно два витка
98.
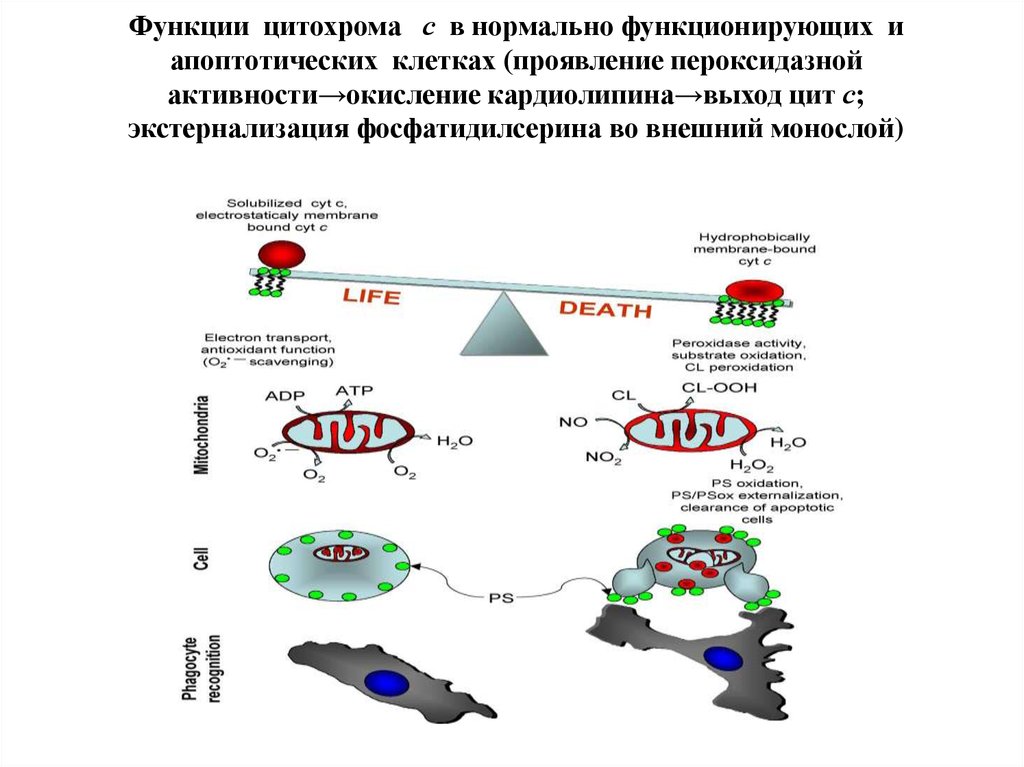
99. Функции цитохрома с в нормально функционирующих и апоптотических клетках (проявление пероксидазной активности→окисление кардиолипина→
Функции цитохрома с в нормально функционирующих иапоптотических клетках (проявление пероксидазной
активности→окисление кардиолипина→выход цит с;
экстернализация фосфатидилсерина во внешний монослой)
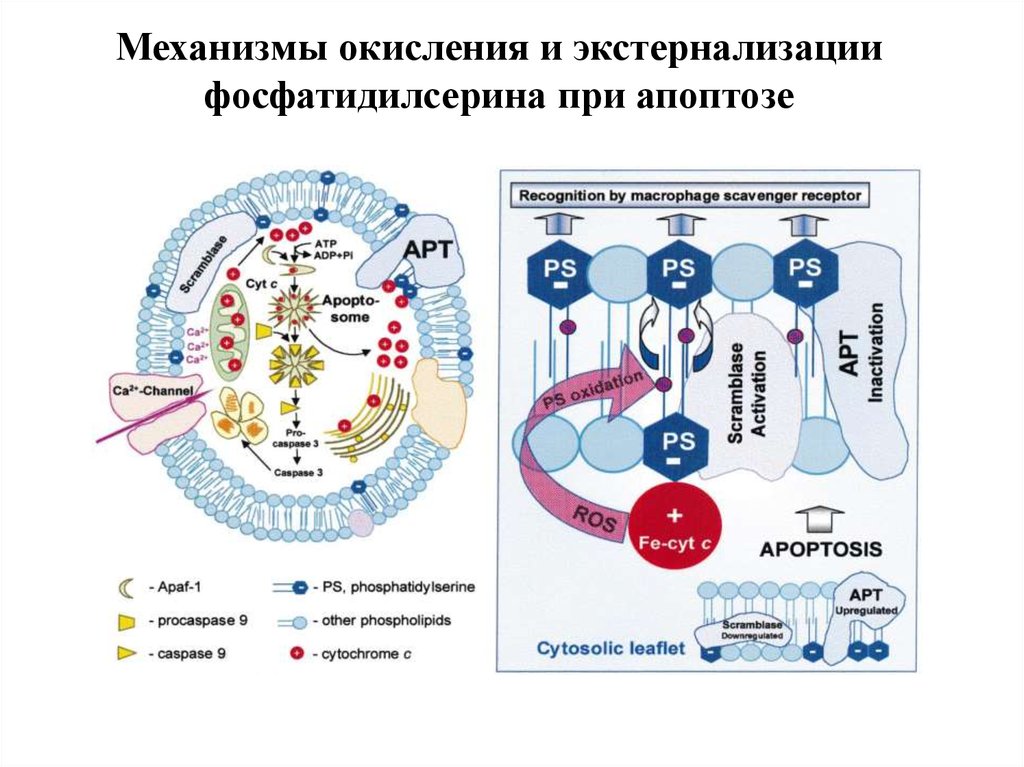
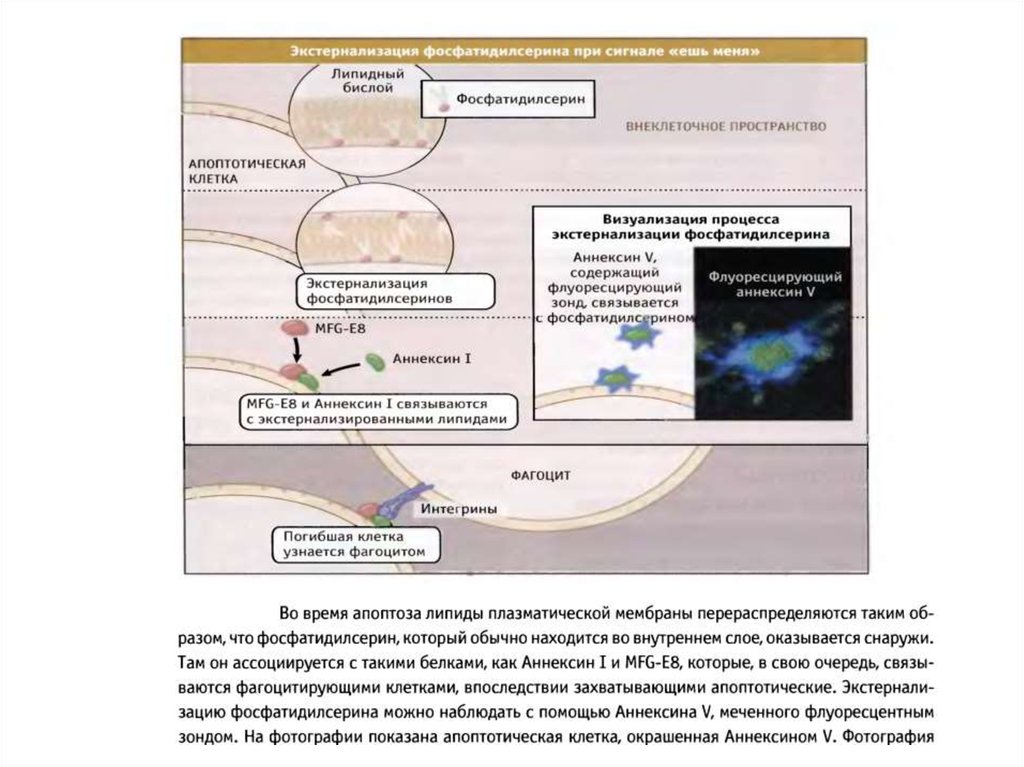
100. Механизмы окисления и экстернализации фосфатидилсерина при апоптозе
101.
102.
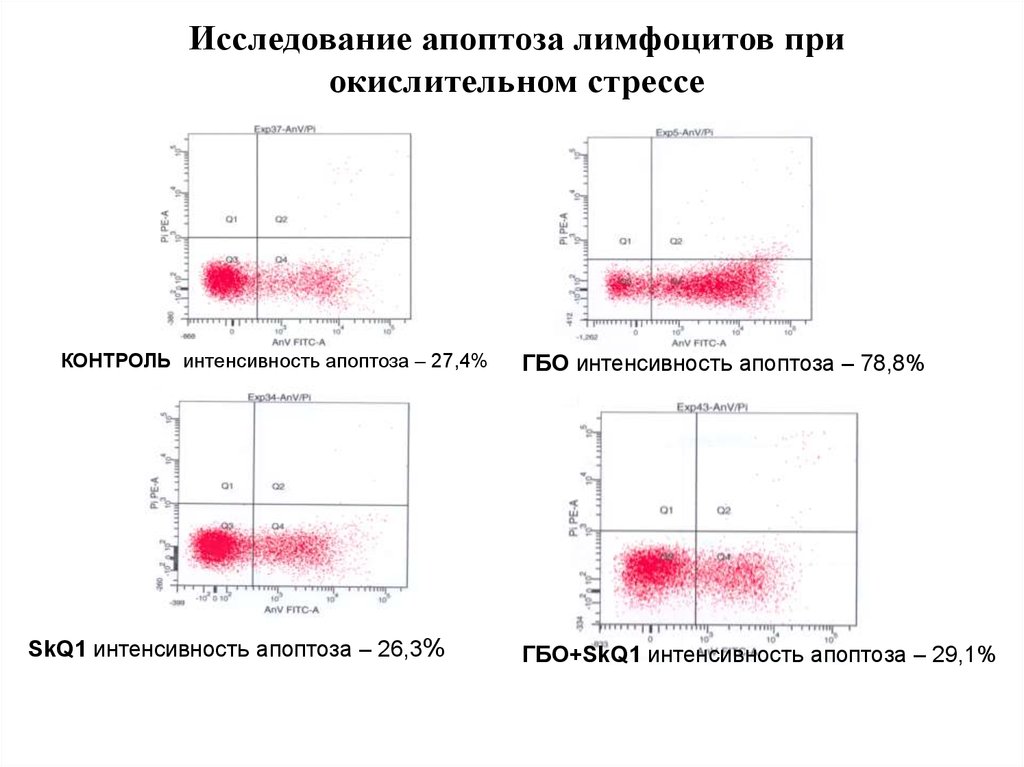
103. Исследование апоптоза лимфоцитов при окислительном стрессе
КОНТРОЛЬ интенсивность апоптоза – 27,4%SkQ1 интенсивность апоптоза – 26,3%
ГБО интенсивность апоптоза – 78,8%
ГБО+SkQ1 интенсивность апоптоза – 29,1%
104.
Транслоказы фосфолипидов создают асимметричноераспределение мембранных липидов. АТФ-зависимые
специфические переносчики – «флипазы» и «флопазы»;
АТФ-независимые мало специфические – скрамблазы
нарушают асимметрию.
105.
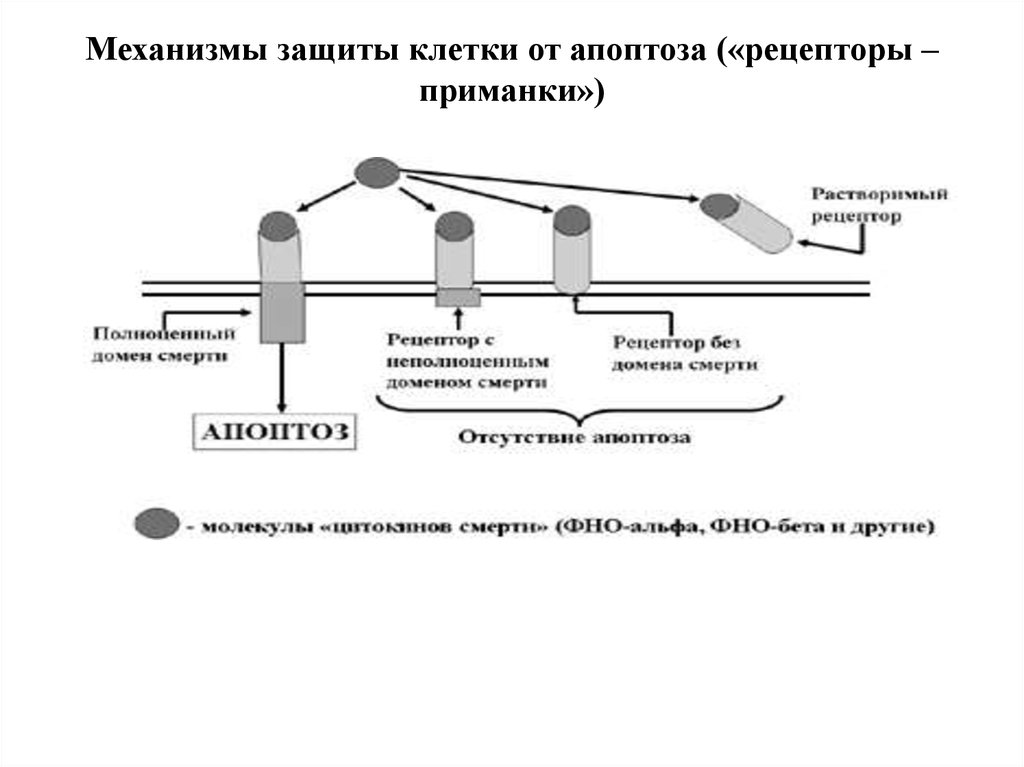
Защита клетки от апоптоза:1)Клетки способны синтезировать неполноценные
рецепторы смерти, которые или вообще лишены
домена смерти, или имеют неполноценный домен
смерти (сигнал апоптоза не передается).
2) Клетка способна «слущивать» (шеддинг) с себя
экстрацеллюлярную часть рецепторов, которые при
этом становиться так называемыми «растворимыми
рецепторами». Появляющиеся в межклеточном
пространстве молекулы ФНО прочно соединяются с
ними и уже не могут воздействовать на реальные
клеточные рецепторы смерти.
106.
Механизмы защиты клетки от апоптоза («рецепторы –приманки»)
107.
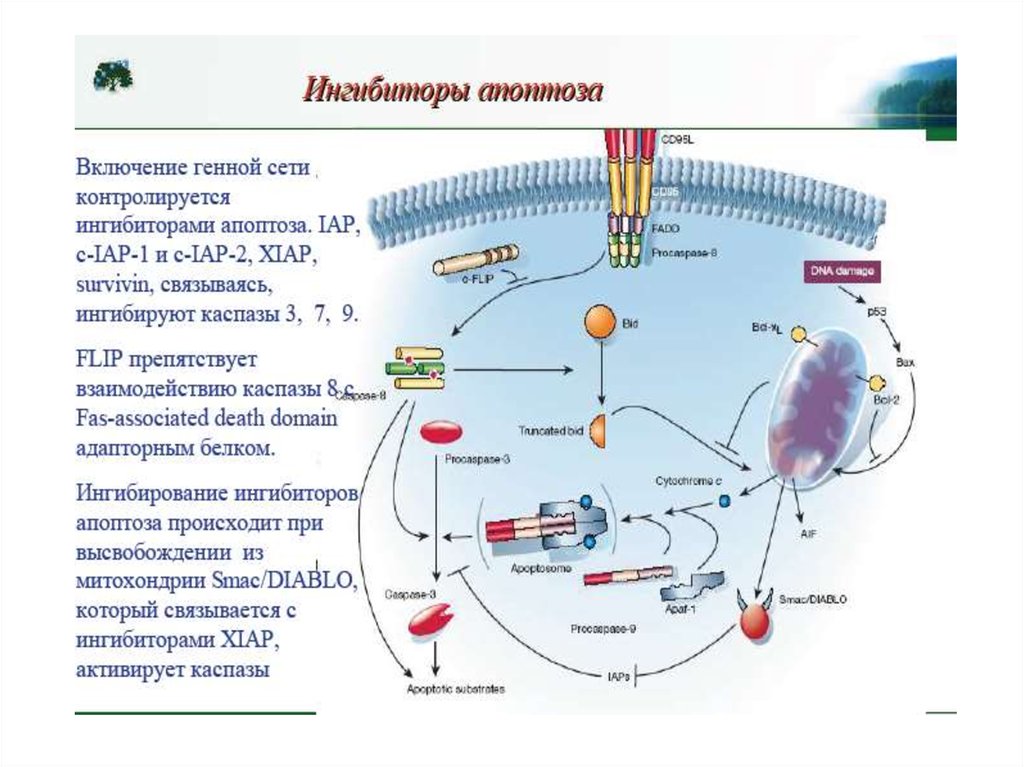
Ингибиторы каспаз:1.Вирусные белки (белок CrmA вируса оспы ингибирует К-8, 1, гранзим В; белок р35 бакуловируса ингибирует К-1,-3,-6,-8,10).
2.Белки сем.IAP (inhibitors of apoptosis) ингибируют К-9,-3,-7.
Обнаружены первоначально у бакуловирусов, у млекопитающих
8 белков-ингибиторов (XIAP, cIAP1,cIAP2, NAIP и др.). имеют
специфический домен BIR (70 АК).
Сурвивин обнаружен в клетках многих опухолей, ингибирует
К-3,-7.
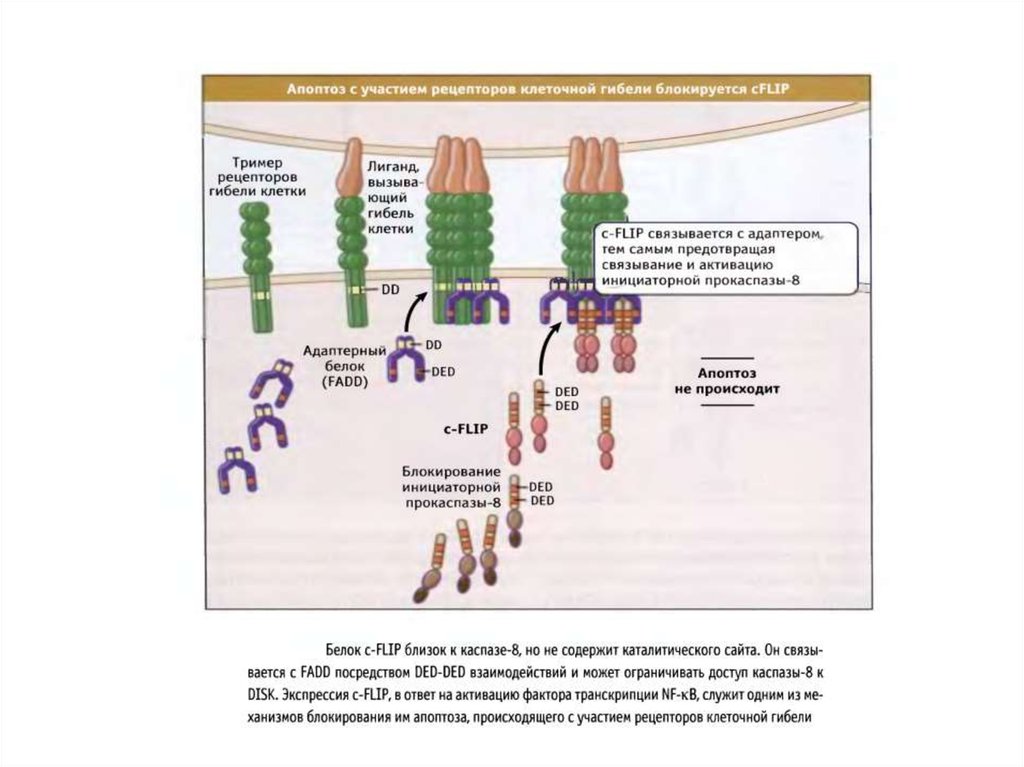
3.Белок FLIP связывается с белковым комплексом DISC и
блокирует апоптоз.
4.Белок BAR конкурирует с адаптером FADD за свзывание с К8,10 и ингибирует апоптоз.
108.
109.
110.
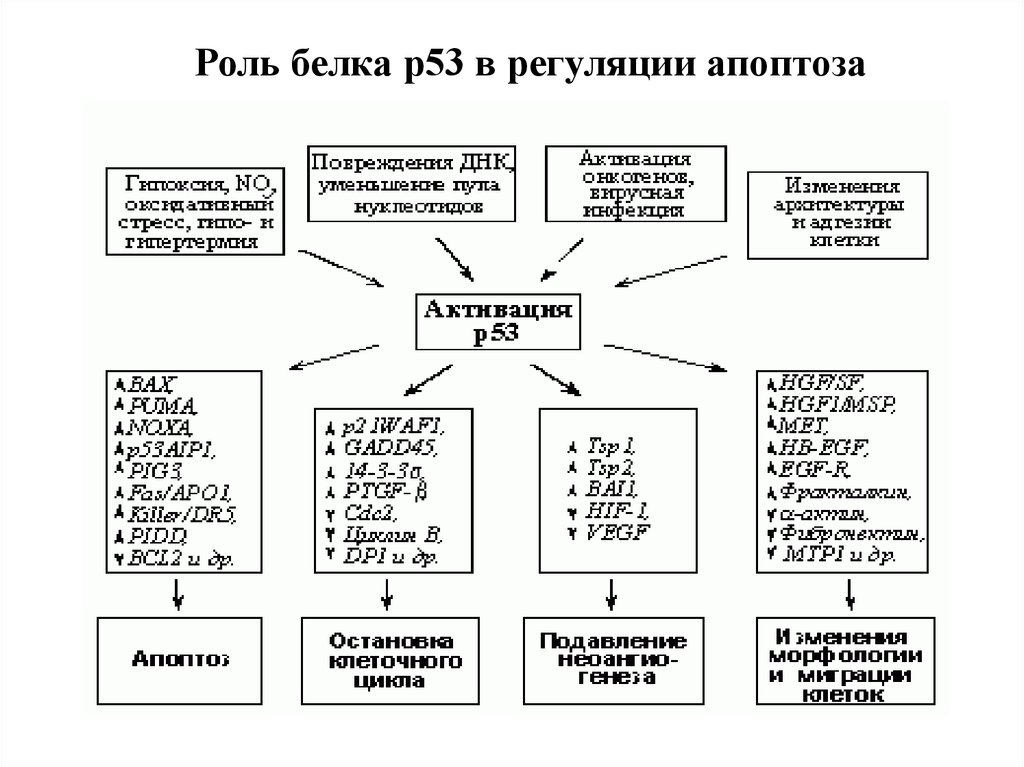
Роль белка р53 в регуляции апоптоза111.
Антионкоген р53, который часто называют «стражем генома».1.Полифункционален - р53 активируется в ответ на стрессовые
стимулы и другие факторы, способные привести к мутациям в ДНК, и
включает гибель клетки.
2. В норме присутствует в следовых количествах и быстро
расщепляется в протеасомах. При повреждающих сигналах
стабилизируется
путем
ковалентной
модификации
(фосфорилирование, ацетилировние, гликозилирование и др.).
2. Мутации в гене этого белка часто бывают связаны с
онкологическими заболеваниями. Нормальный же белок p53
заставляет клетку погибнуть в апоптозе, убирая антиапоптотическую
функцию Bcl-2. Следовательно, если причина онкологического
заболевания — мутация в p53, потенциально хорошим лекарством
будет вещество, которое выключало бы функцию белков семейства
Bcl-2. Нет активности антиапоптотических белков — есть апоптоз, и
р53 уже не нужен.
112.
Перспективны для применения в клинике активация нормального, но«спящего» р53, и реактивация мутантного белка. Уже имеются
низкомолекулярные соединения, которые воздействуют на различные
участки (домены) р53 и восстанавливают его функцию. Формулы двух таких
молекул, PRIMA-1 и RITA, впервые исследованных в Каролинском
институте, под руководством Галины Селивановой и Класа Вимана
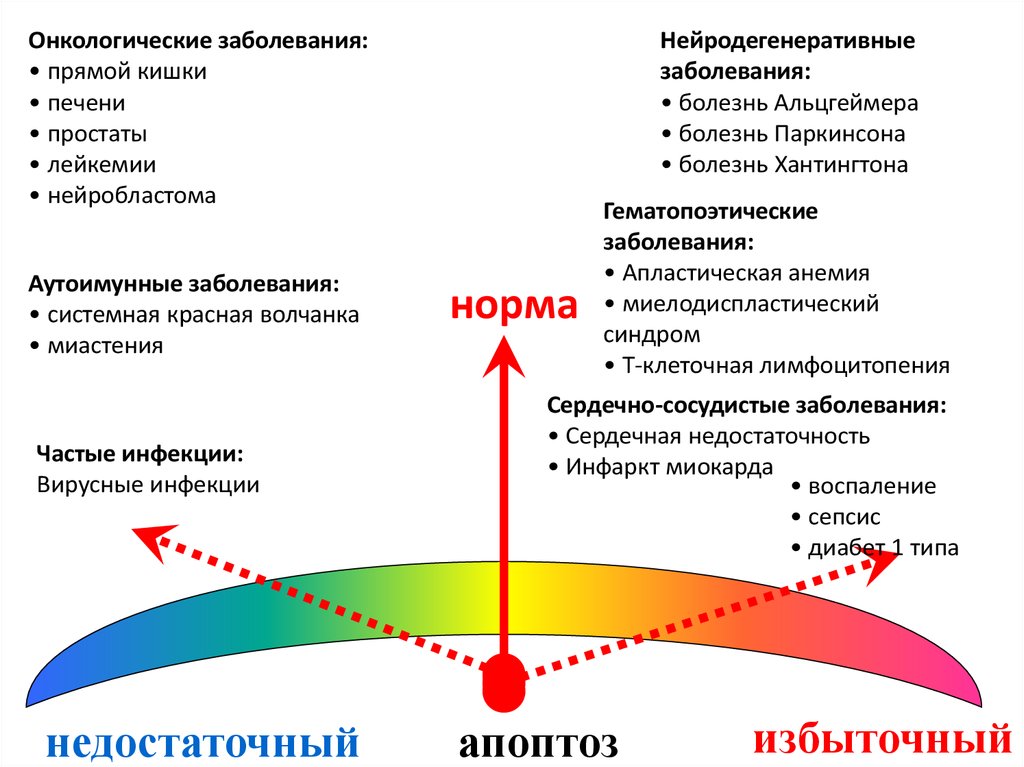
113. Изменение уровня апоптоза при патологиях
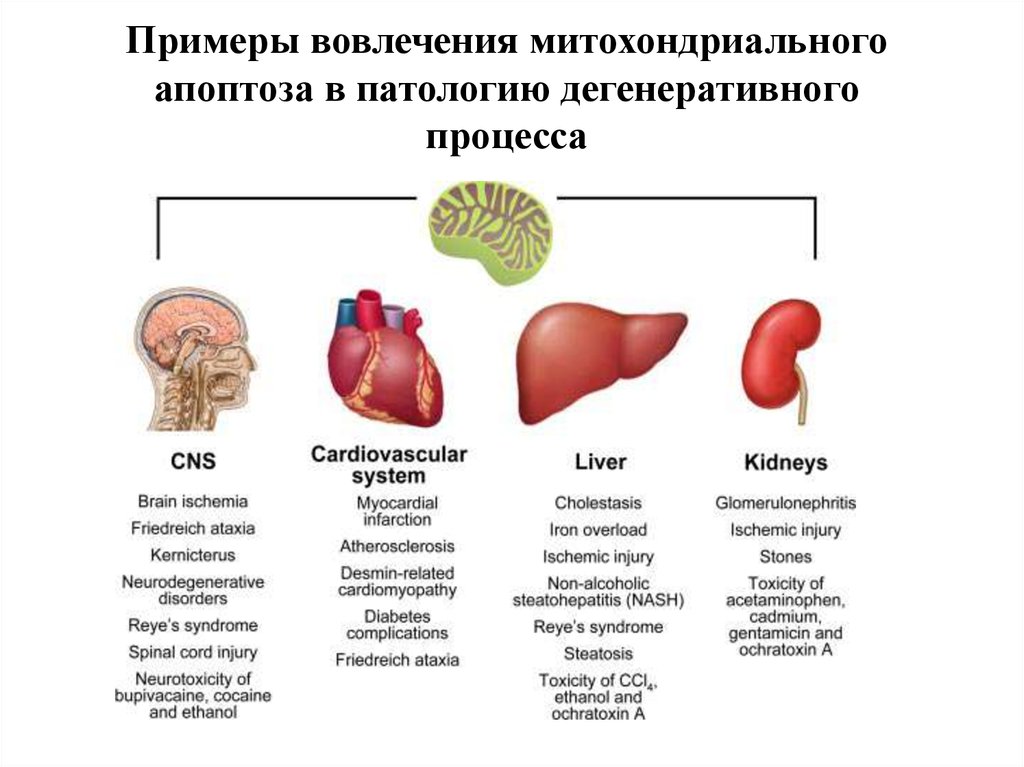
Канцерогенез114. Примеры вовлечения митохондриального апоптоза в патологию дегенеративного процесса
115.
Онкологические заболевания:• прямой кишки
• печени
• простаты
• лейкемии
• нейробластома
Аутоимунные заболевания:
• системная красная волчанка
• миастения
Частые инфекции:
Вирусные инфекции
недостаточный
Нейродегенеративные
заболевания:
• болезнь Альцгеймера
• болезнь Паркинсона
• болезнь Хантингтона
норма
Гематопоэтические
заболевания:
• Апластическая анемия
• миелодиспластический
синдром
• Т-клеточная лимфоцитопения
Сердечно-сосудистые заболевания:
• Сердечная недостаточность
• Инфаркт миокарда
• воспаление
• сепсис
• диабет 1 типа
апоптоз
избыточный
116.
117.
118.
119. Активация инфламмасомы
120.
Фрагментация ДНК идет поэтапно:1. Образование крупных фрагментов, содержащих 300 тыс.
п.н., затем 30-50 тыс. п.н.
- активируются Са2+, Mg2+-зависимые эндонуклеазы, ДНКазы I и II:
- протеолиз топоизомеразы II, участвующей в образовании
структуры ДНК высшего порядка (суперспирализованных
петель -50 тыс. п.н., дисковидных розеток – 300 тыс. п.н.)
2. Межнуклеосомная деградация ДНК с образованием
фрагментов 180-200 п.н. (протяженность нити в нуклеосоме)
или кратных им по величине.
- активация эндонуклеазы CAD (за счет расщепления К-3 ее
ингибитора ICAD).
- расщепление гистона Н1, защищающего ДНК от действия
ДНК-аз на межнуклеосомном уровне.
































































 biology
biology