Similar presentations:
Апоптоз. Механизмы апоптоза
1. Часть 6 Апоптоз
2.
Во время жизни животных и человека наблюдается 2 типа ЗПКГ:апоптоз и аутофагия (mTOR). Термин ввели Kerr с соавт. в 1971
г. Через 20 лет открыто новое семейство протеаз – каспазы.
3. Механизмы апоптоза
4. Изменение ультраструктуры клеток при некрозе и апоптозе
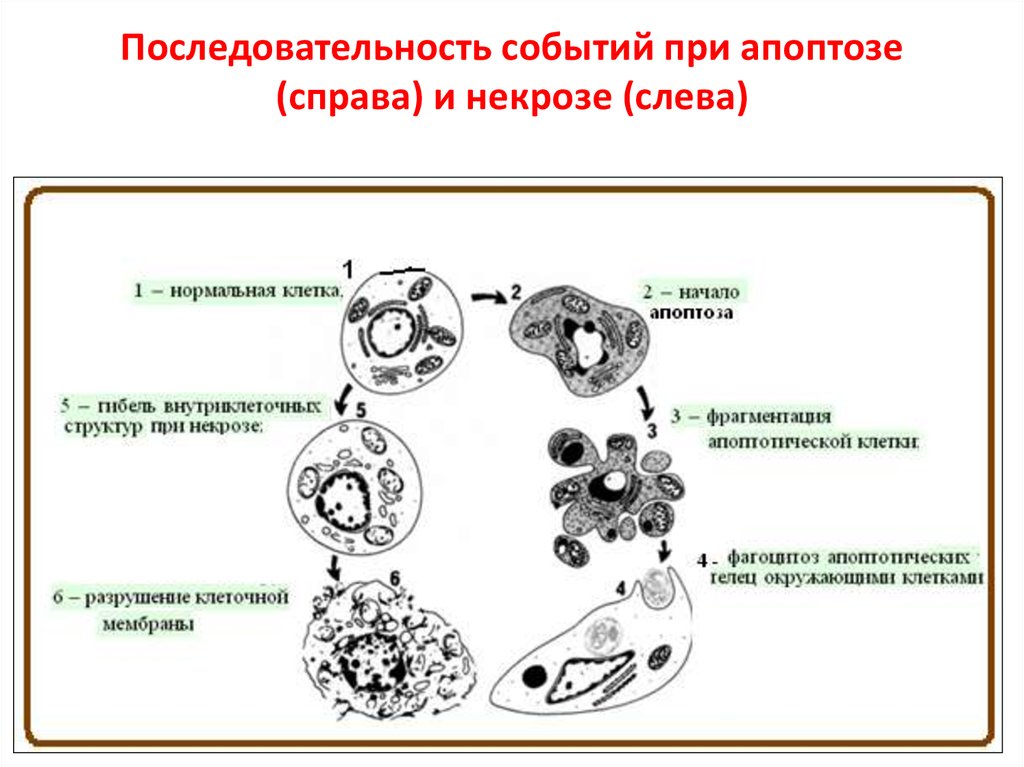
5. Последовательность событий при апоптозе (справа) и некрозе (слева)
6. Функции апоптоза
7. Стадии апоптоза
• 1. Индукция. Изменения в клеточном окружении,приводящие к активации апоптоза через R и СТ
• 2. Исполнение. Клетка решает войти в апоптоз.
• 3. Дегенерация. События, связанные с конечным
развертыванием клеточных процессов,
позволяющих подойти клетке к точке, откуда нет
возврата.
8. Индукторы и супрессоры апоптоза
• Индукторы: дефицит ФР, глюкозы, УФ и гаммаизлучение, перекись, ПОЛ, ГК гормоны, ТХДД, ФНО,экспрессия проапоптотических генов сем. Bcl-2
цитолитические Т-лимфоциты, вирусы,
химиотерапевтические лекарства и др.
• Супрессоры: экспрессия антиапоптотических генов сем.
Bcl-2, MDR, теломеразы, ингибиторы синтеза РНК и
белков, мут.р53 и др.
9.
10. Сигналы к апоптозу
11. Лиганды и рецепторы
• Лиганды: сем. гомотримерных лигандовTNF - FasL, TRAIL (Apo2L), TNF α и β,
CD40L,CD27L, OX40L.
• Рецепторы: FAS и др. рецепторы семейства
TNF
12. Взаимодействие лиганда смерти TRAIL с рецептором
13. Зависимый от Fas-рецептора апоптоз при действии цитотоксического Т-лимфоцита
14. два варианта рецептор-опосредованного апоптоза
15. Передача КС при апоптозе
16.
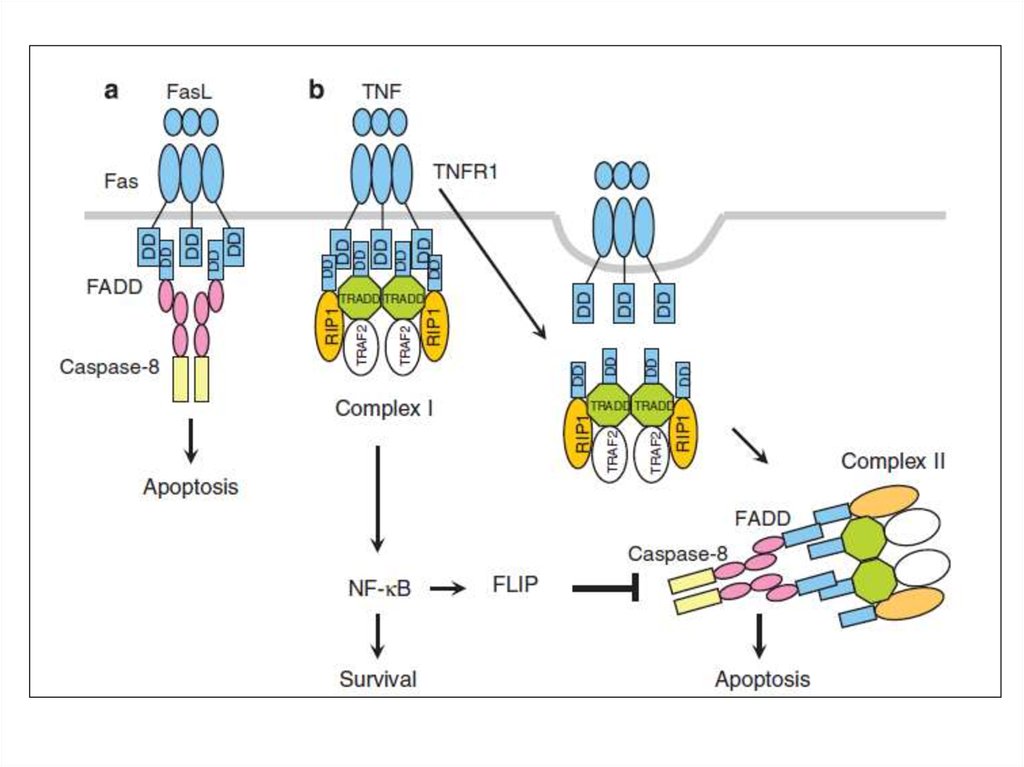
17. Fas/FADD/pro-caspase комплекс образует Fas death-inducing signaling complex (DISC)
Fas/FADD/pro-caspase комплекс образует Fas deathinducing signaling complex (DISC)18. TNF-R1 инициирует образование 2-х комплексов
КомплексI
(голубой)
содержит TNF-R1, адаптор
TRADD, receptor interacting
kinase (RIP), и TNF-receptor
ssociated factor 2 (TRAF2).
TNF-α активирует NF-kB
путь, который индуцирует
гены выживания c-FLIP.
Позже из комплекса I
диссоциируется
и
интернализируется
TNF-R1.
19. Потеря экспрессии FADD дает раковой клетке преимущество выживание/рост
20. Ключевая роль NF-kB
21. Митохондриальный апоптоз
22.
23. Модель образования протеосомы
24. Доменная организация апоптосомы
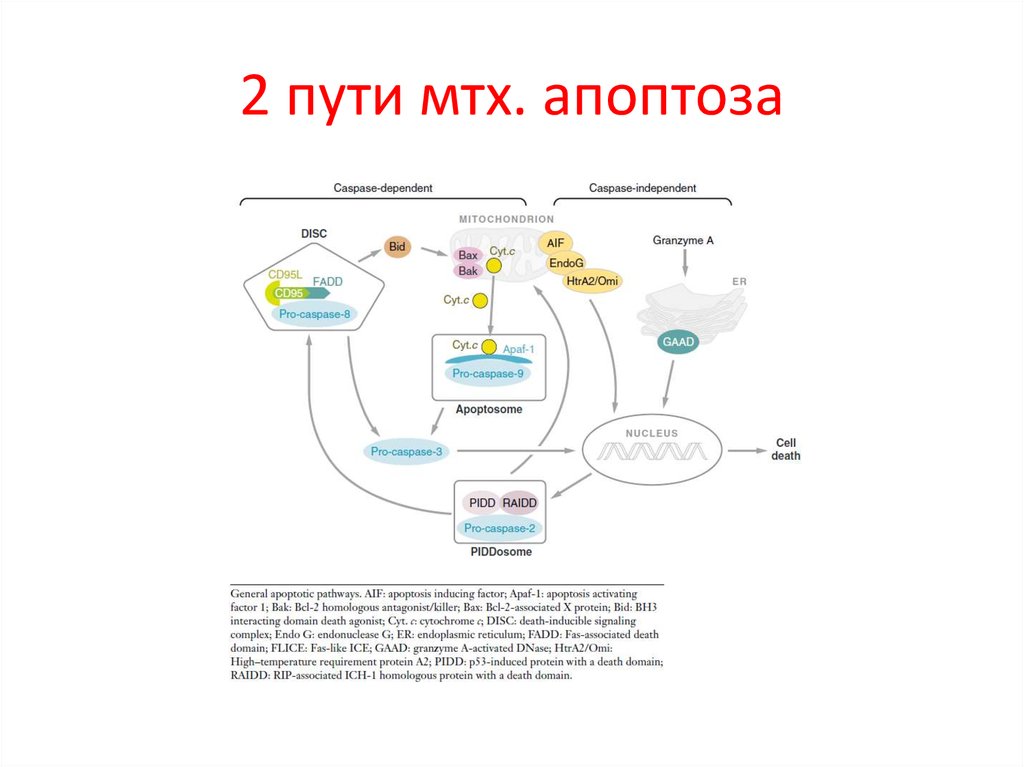
25. 2 пути мтх. апоптоза
26. Множество белков IMS (intermembrane space) высвобождается, когда активируются внутриклеточные сигналы индукции апоптоза
Целостностьмитохондриального
матрикса
контролируется Bcl-2 сем.
BH-3-белки
активируются
при
стрессе.
Bid,
например,
расщепляется
многими
протеазами
(caspase-8, granzyme B и cathepsin B) в tBid, который
взаимодействует с антиап. Bcl-2 белками и может
напрямую активировать Bax. Другие BH-3-белки
ненапрямую активируют Bax, блокируя антиап. Bcl2. Цитозольный cyt c запускает образование
апоптосомы через каскад каспаз. Для них много
субстратов:
ICAD,
в
результате
активируется
CAD,
к.
транслоцируется
в
ядро
и
начинает
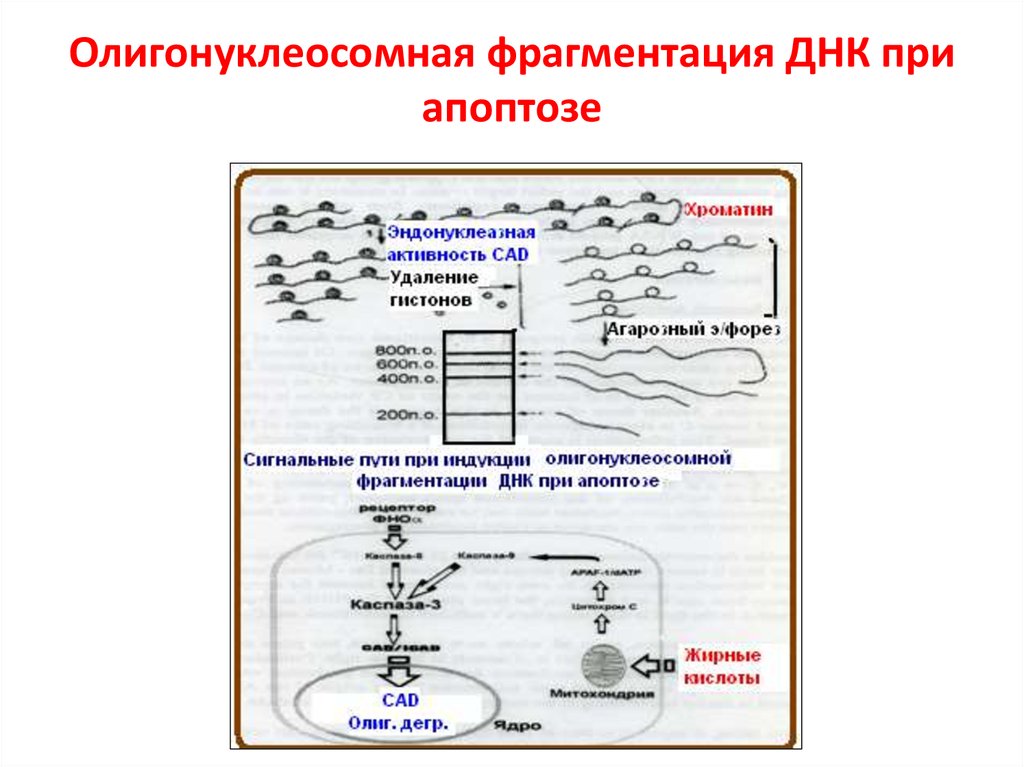
олигонуклеосомальную фрагментацию ДНК.
IAPs предотвращает димеризацию caspase-9 и
блокирует активные caspase-3 и -7. Smac/DIABLO
(Smac) и HtrA2/OMI (Omi) нейтрализуют
Ингибирующий эффект IAP связыванием с BIR2 и
BIR3 доменами. Димерный Smac/DIABLO связывает
BIR1 и BIR2, а HtrA2/
OMI преимущественно связывает BIR2 белка XIAP.
Кроме того, Omi может расщеплять IAPs благодаря
серин-протеазной активности. Smac – субстрат для
деградации УБ-протеосомами, находясь в
C-terminal RING домене белка XIAP и cIAP1 и cIAP2.
AIF и endonuclease G (endo G) переходят из мтх. В
ядро, где расщепляют ДНК (независимо от каспаз).
27. Механизмы MOMP
28. B cell lymphoma-2 (Bcl-2)
Семейство белков BCL-2B CELL LYMPHOMA-2 (BCL-2)
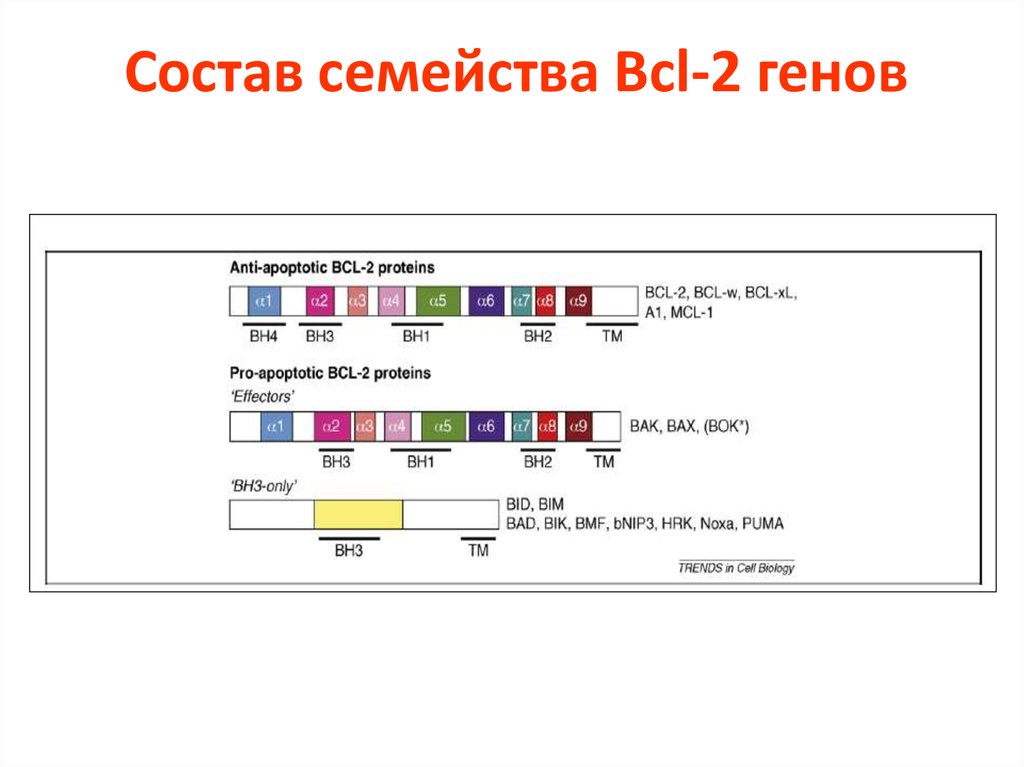
29. Состав семейства Bcl-2 генов
30. Способы взаимодействия между белками Bcl-2
31. Meeting points Bcl-2
32. Регуляция мтх. апоптоза (1)
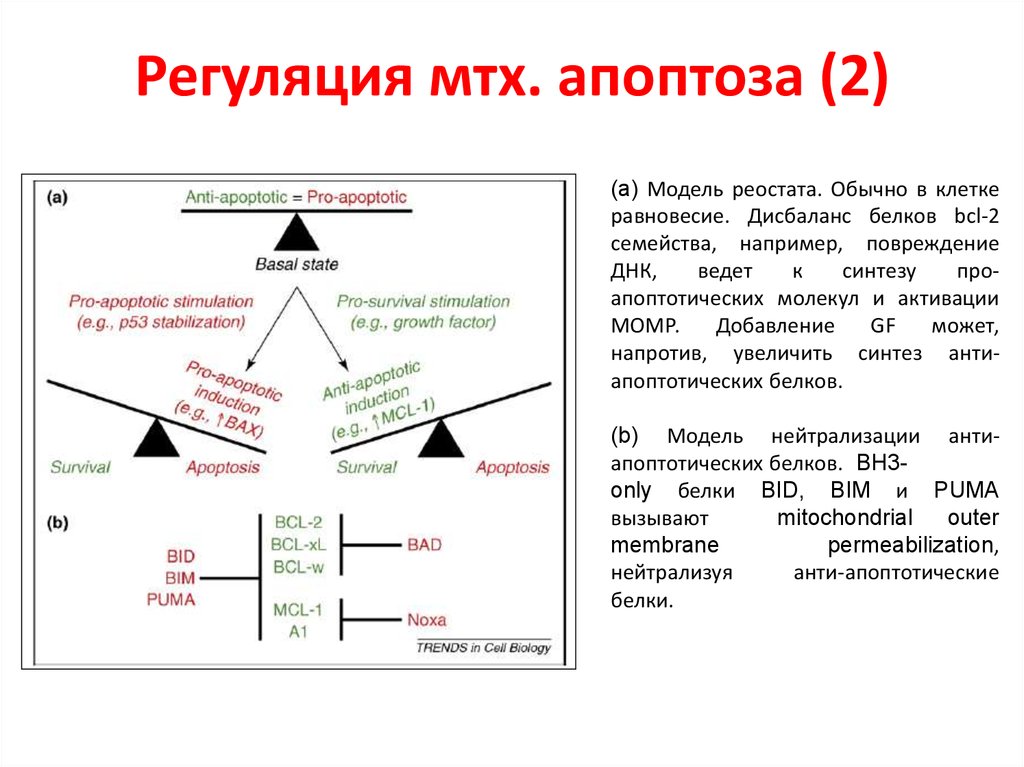
33. Регуляция мтх. апоптоза (2)
(a) Модель реостата. Обычно в клеткеравновесие. Дисбаланс белков bcl-2
семейства, например, повреждение
ДНК,
ведет
к
синтезу
проапоптотических молекул и активации
МОМР.
Добавление
GF
может,
напротив, увеличить синтез антиапоптотических белков.
(b) Модель нейтрализации антиапоптотических белков. BH3only белки BID, BIM и PUMA
вызывают
mitochondrial
outer
membrane
permeabilization,
нейтрализуя
анти-апоптотические
белки.
34. Механизмы активации про-апоптотических белков (1)
Модель прямой активации.(a) MOMP
активируется
через олигомеризацию
BAX или BAK. Эти белки,
один раз активируется
BH3-only
белком,
образуют
протеолипидные поры.
(b) (b) Прямой активатор
BH3-only белков (e.g.
BIM and BID) индуцирует
олигомеризацию
BAX
или BAK при отсутствии
других белков
35. Механизмы активации про-апоптотических белков (2)
(c) A subset of BH3-only proteins, the derepressors/sensitizers, cannot induce the activation ofBAX or BAK alone. In this scenario, a direct activator BH3only protein is sequestered by an anti-apoptotic BCL2 protein. Following stress, a de-repressor/sensitizer BH3only protein is induced, either by transcriptional upregulation or by post-translational modification, and this
protein then binds to an anti-apoptotic BCL-2 protein,
promoting the release of a sequestered, direct activator
BH3-only protein. In this example, BIM is tonically
sequestered by MCL-1, and the induction of Noxa enables
the release of BIM to engage MOMP. If cells constitutively
harbor a sequestered direct activator protein, they are
referred to as being ‘primed for death’ or ‘BCL-2 addicted’.
Not shown in this figure is the potential influence of Noxainduced MCL-1 degradation after binding, which might
have important implications in maintaining anti-apoptotic
levels to preserve outer mitochondrial membrane integrity
[53]. (d) Cells are sensitized to undergo MOMP when
de-repressor/sensitizer
BH3-only
proteins
are
constitutively inhibiting anti-apoptotic BCL-2 proteins, and
any future induction of BID or BIM cannot be tolerated.
This scenario is referred to as ‘sensitized for death’. In this
example, BCL-xL is inhibited by BAD, and the induction of
BIM engages MOMP; in the absence of BAD expression,
the MOMP signal would have been inhibited by BCL-xL.
36. Семейство цистеиновых протеаз
КаспазыСЕМЕЙСТВО ЦИСТЕИНОВЫХ
ПРОТЕАЗ
37. Сборка каспаз
Общая структура прокаспаз и протеолитическое созревание расщеплениемпосле остатков аспарагина.
В результате генерируется большая с (р20) и малая (р10) субъединицы, в
каждой из которых формируется активный центр (кружок). Два гетеродимера
складываются в тетрамер.
38. Функциональные взаимодействия между каспазами
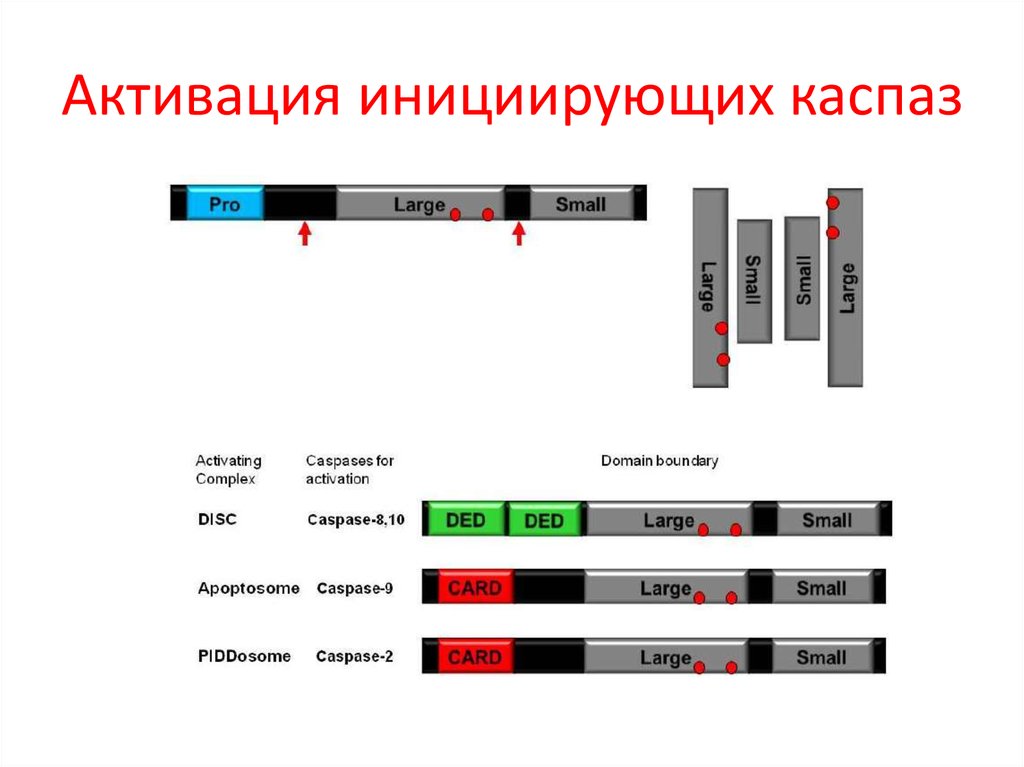
39. Активация инициирующих каспаз
40. Caspase-2 инициаторная каспаза, наиболее эволюционно консервативная, действует upstream от митохондрий. Вовлечена в расщепление
Bid и транслокации Bax41. Доменная организация компонентов Death Inducing Signaling Complex (DISC), Fas, FADD, и caspase-8, 10
42. Структурная организация каспаз
Структура и доменная организациякаспаз
млекопитающих.
(a)
каталитическая
петля
(L1–L4).
Инициаторные
каспазы
содержат
большие продомены CARD или DED, а
экзекуторные каспазы имеют короткие
продомены.
Активный цент Cys показан красным.
Процессинг разделения p20 и p10
Происходит в L2. The resulting large
subunit potion of the L2 loop of one
monomer and small subunit portion of the
L2 loop of the neighboring monomer (L20)
are involved in loop bundle formation (b
and c). (b) Ribbon representation of the
active caspase-3
structure showing the positions of the
active center loops (L1-L4, L20) based on
the crystal structure of the complex of
caspase-3 with peptide inhibitor (in pink).
Reproduced with permission from Shi
(2002). (c) The active site conformations
of the caspases with known structures.
Loops L1 and L3 are highly conserved,
whereas L2 and L4 are responsible for the
differences in substrate binding specificity.
Reproduced with permission from Shi
(2002). CARD, caspase recruitment
domain; DED, death effector domain
43. Активация каспаз
44. CK-2 киназы – субстраты для каспаз
45. CK-2 киназы в митозе
Схематическое изображениеCK2a и CK2b с сайтами ф-я
(треонины
344 и 360, серины 362 и370 в
CK2a, серин 209 в CK2b)
черным.
(B)
Модель
временной регуляции
ф-я
CK2a (C) Модель ф-ия CK2 в
митозе. После ф-ия CK2
киназой Cdk1, CK2a C-terminal
ф. сайты могут связываться
с пролил изомеразой Pin1.
Образование комплекса Pin1,
Topoisomerase II, и ф-ый
CK2a вызывает снижение фия Topoisomerase II киназой
CK2 . Митотическая киназа
Plk1 может также связаться с
C-terminal CK2a по ф. сайту.
Но
функция
этого
взаимодействия неизвестна.
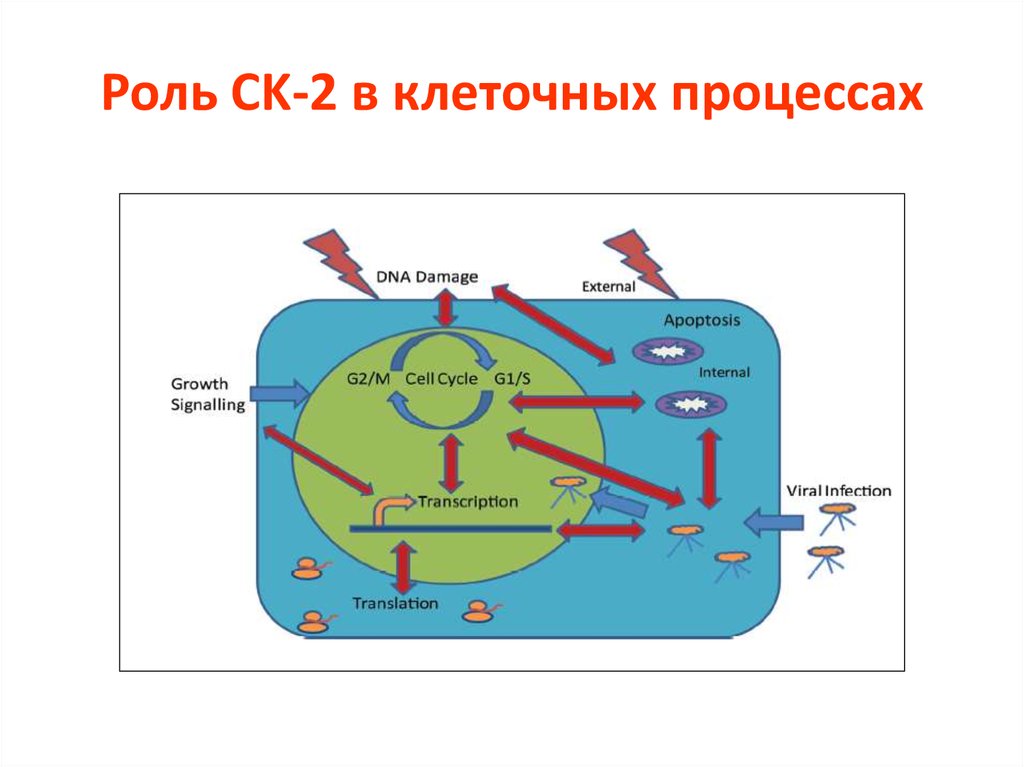
46. Роль CK-2 в клеточных процессах
47. Регуляция апоптоза ингибиторными белками
48. Различная организация BIR
49. Взаимодействие с каспазой 3 (а) и IPVA (b)
50. Взаимодействие с каспазой 9 (а) и Smac/DIABLO (b)
51. Селективное связывание IAP белков
52. Баланс между убиквитиляцией и автоубиквитиляцией cIAP1 and cIAP2
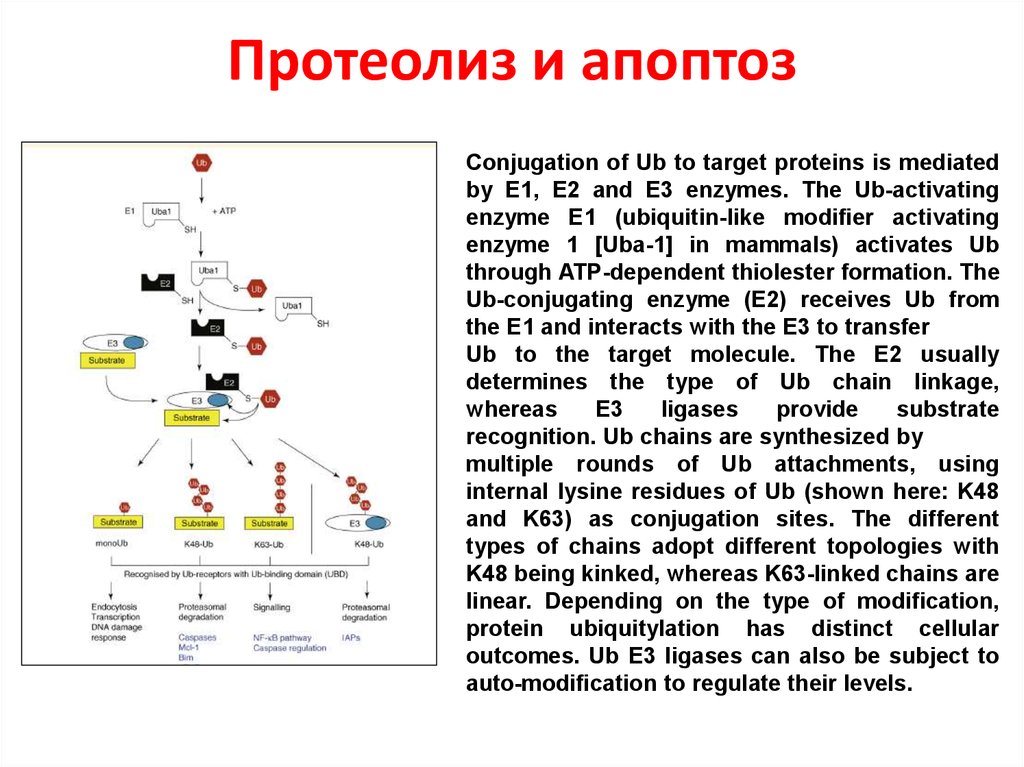
53. Протеолиз и апоптоз
Conjugation of Ub to target proteins is mediatedby E1, E2 and E3 enzymes. The Ub-activating
enzyme E1 (ubiquitin-like modifier activating
enzyme 1 [Uba-1] in mammals) activates Ub
through ATP-dependent thiolester formation. The
Ub-conjugating enzyme (E2) receives Ub from
the E1 and interacts with the E3 to transfer
Ub to the target molecule. The E2 usually
determines the type of Ub chain linkage,
whereas
E3
ligases
provide
substrate
recognition. Ub chains are synthesized by
multiple rounds of Ub attachments, using
internal lysine residues of Ub (shown here: K48
and K63) as conjugation sites. The different
types of chains adopt different topologies with
K48 being kinked, whereas K63-linked chains are
linear. Depending on the type of modification,
protein ubiquitylation has distinct cellular
outcomes. Ub E3 ligases can also be subject to
auto-modification to regulate their levels.
54.
55. IAPs функция как E3 лигаз и Ub рецепторы в TNF-signalling
Domain structures of cIAPs. BIR domains provide substrate interaction, whereas theUbbinding UBA domain binds polyUb. The caspase recruitment domain (CARD) is a protein–
protein interaction domain, but is not involved in caspase binding here. The Cterminal RING
domain is required for E3 ligase activity, dimerization interface and docking site for the E2. A
predicted structure of the three conserved a-helices of the UBA domain (green) of cIAP2 and
the residues forming the hydrophobic interaction surface for Ub (consisting of Met-Gly-Phe
[MGF] and Leu-Leu [LL]) is shown [66]. The structure of a cIAP2–RING dimer is shown on the
right (grey and green depict two respective cIAP2 molecules)
56. Suggested functions for cIAPs in TNF-R signalling. Stimulation with TNFa triggers the formation of ‘complex-I’ at the TNF-R, in
which cIAP has been suggested to K63-ubiquitylate RIP1. These linear Ubchains serve as docking and activation platforms for the IKK complex, which leads to activation of the
transcription factor NF-kB (p65/p50). cIAPs also seem to suppress the death-inducing ‘complex-II’,
which is the activation platform for caspase-8 that induces death by the extrinsic pathway.
57. Основные пути апоптоза
58.
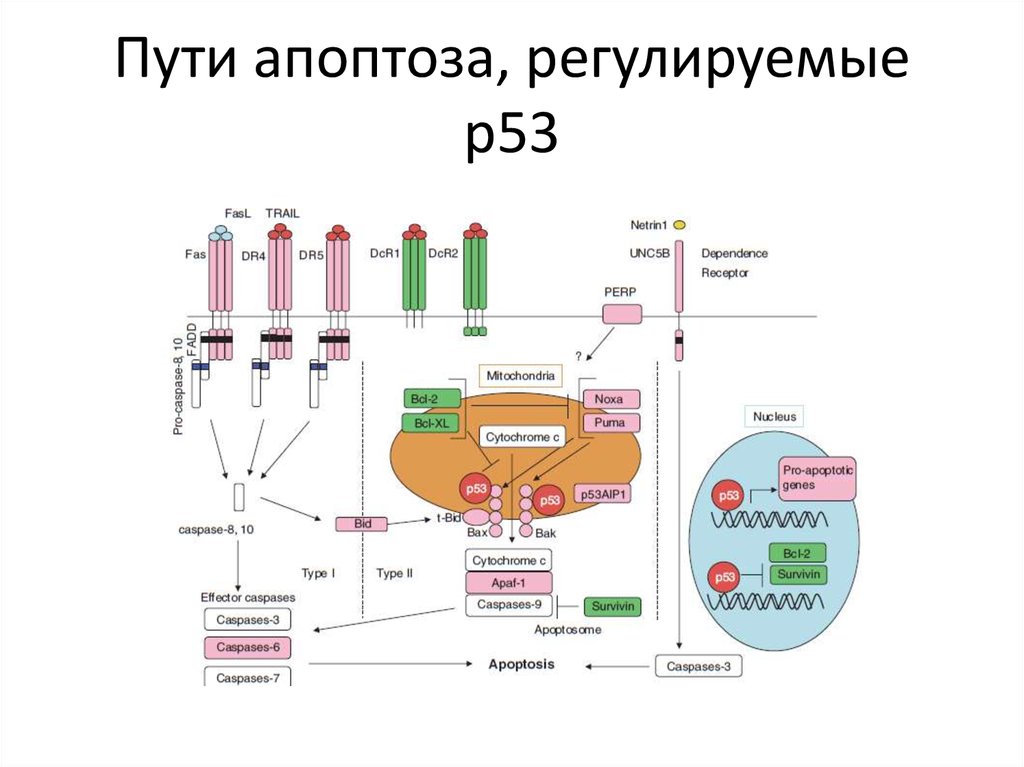
Р53 – регулятор апоптоза59. Пути апоптоза, регулируемые р53
60. Интегральная схема регуляции
61. Методы определения фрагментации ДНК
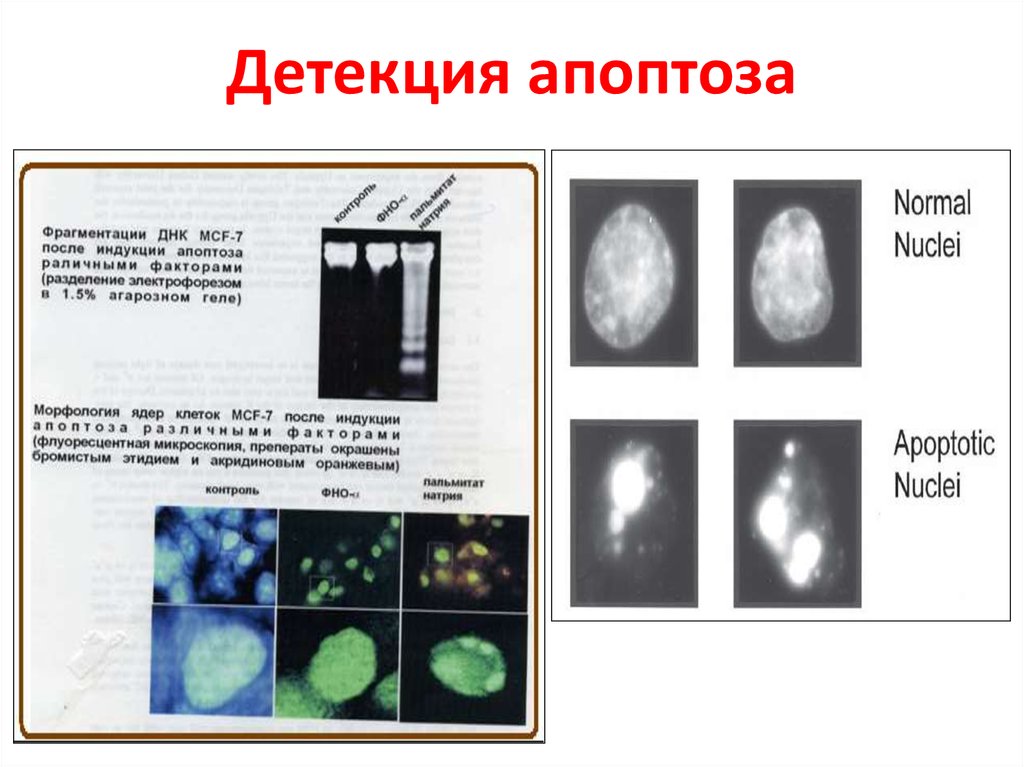
62. Детекция апоптоза
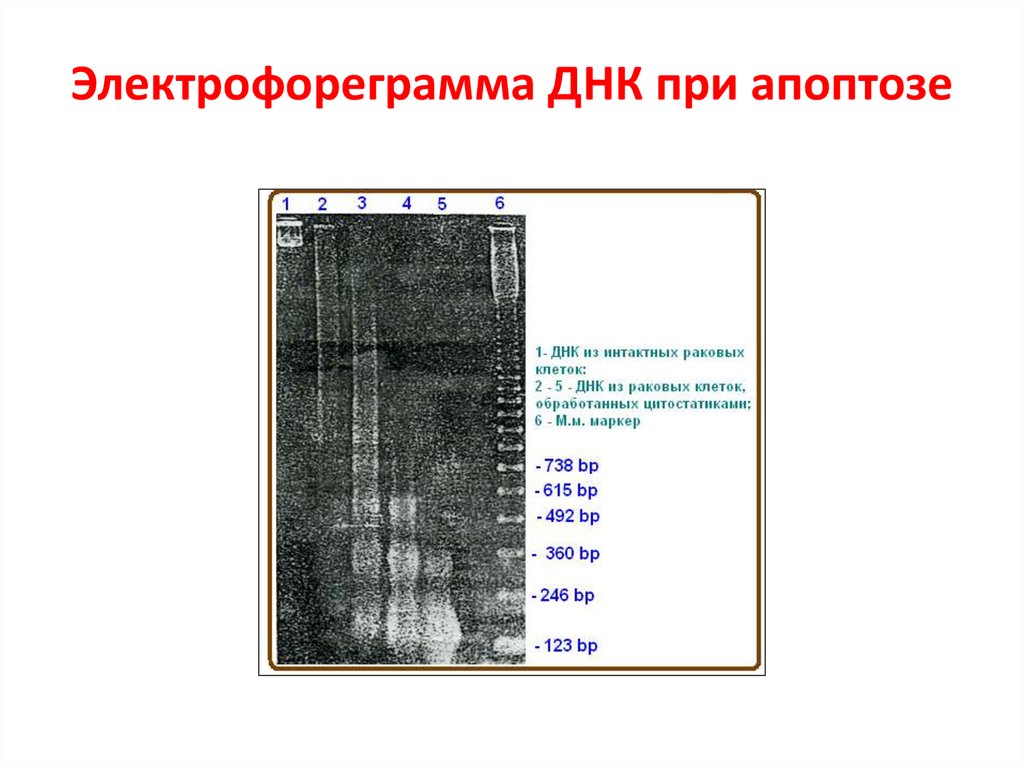
63. Электрофореграмма ДНК при апоптозе
64. Олигонуклеосомная фрагментация ДНК при апоптозе
65. Типичная картина апоптоза
66.
Молекулярныйимидж клеточной
гибели (c 2009 г.)
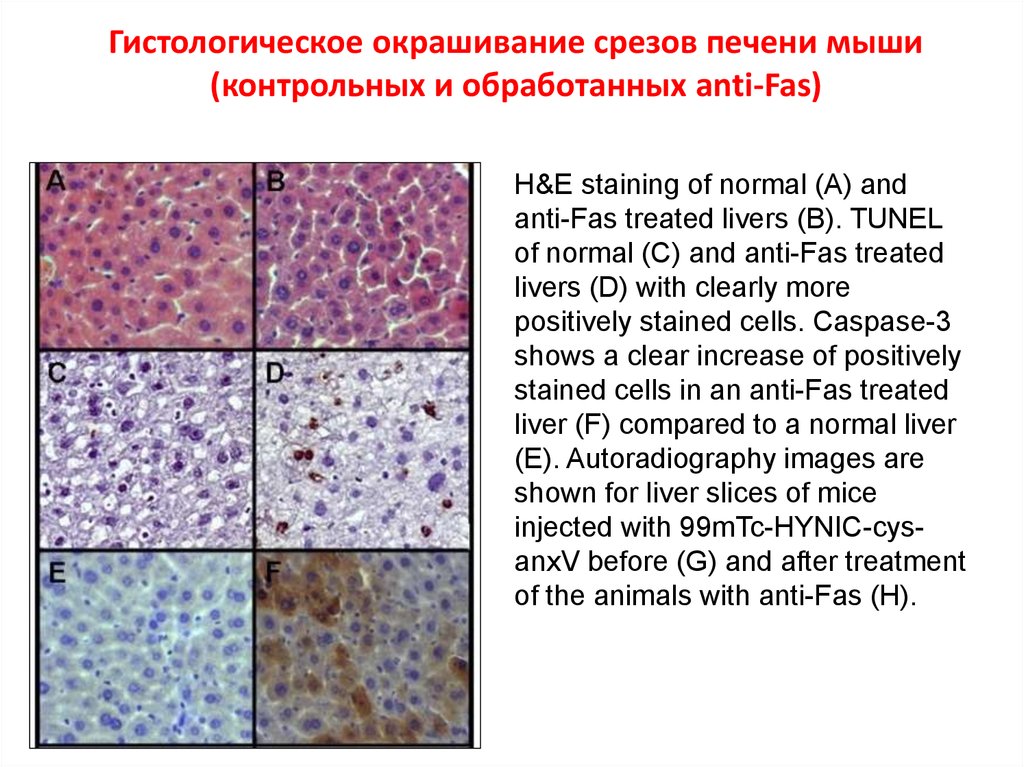
67. Гистологическое окрашивание срезов печени мыши (контрольных и обработанных anti-Fas)
H&E staining of normal (A) andanti-Fas treated livers (B). TUNEL
of normal (C) and anti-Fas treated
livers (D) with clearly more
positively stained cells. Caspase-3
shows a clear increase of positively
stained cells in an anti-Fas treated
liver (F) compared to a normal liver
(E). Autoradiography images are
shown for liver slices of mice
injected with 99mTc-HYNIC-cysanxV before (G) and after treatment
of the animals with anti-Fas (H).
68. In vivo planar image
In vivo planar image of a control rat and a rat with reperfused hepatic infarction at 7 h postinjection of 99mTc(CO)3-bis-DTPA pamoate (A). Autoradiographs of 30-μm liver slices of the
necrotic liver (B, top row) and viable liver (B, bottom row) and scanned photographs of the
same slices after H&E staining (C) staining show good correlation with the in vivo planar
image.
69. Апоптоз в опухоли после химиотерапии (А,В – не леченные, H&E и TUNEL окрашивание)
Апоптоз в опухоли после химиотерапии(А,В – не леченные, H&E и TUNEL окрашивание)









































































 biology
biology