Similar presentations:
Апоптоз
1.
Апоптоз2.
Во время жизни животных и человека наблюдается 2 типа ЗПКГ:апоптоз и аутофагия (mTOR). Термин ввели Kerr с соавт. в 1971
г. Через 20 лет открыто новое семейство протеаз – каспазы.
Макроаутофагия (аутофагия) - это эволюционно древний
механизм, с помощью которого клеточный материал
доставляется в лизосомы для деградации. Оба процесса часто
используют один и тот же молекулярный механизм, и недавние
исследования показывают, что аутофагия имеет большое
влияние на решение клетки жить или умереть. Однако принятие
этого решения осложняется тем фактом, что роль аутофагии в
определении того, должна ли клетка жить или умереть, идет в
обоих направлениях: ингибирование аутофагии может привести
к большей или меньшей гибели клетки в зависимости от
стимула к смерти, типа клетки или контекста. Аутофагия также
может по-разному влиять на разные типы гибели клеток.
Аутофагия может определять, умирают клетки или нет, не влияя
напрямую на механизм гибели клеток. Например, хорошо
известно, что аутофагия имеет решающее значение для
предотвращения гибели клеток в результате аминокислотного
голодания.
3.
Регуляция каноническогоапоптоза аутофагией
4.
Механизмы апоптоза5.
Изменение ультраструктуры клеток принекрозе и апоптозе
6.
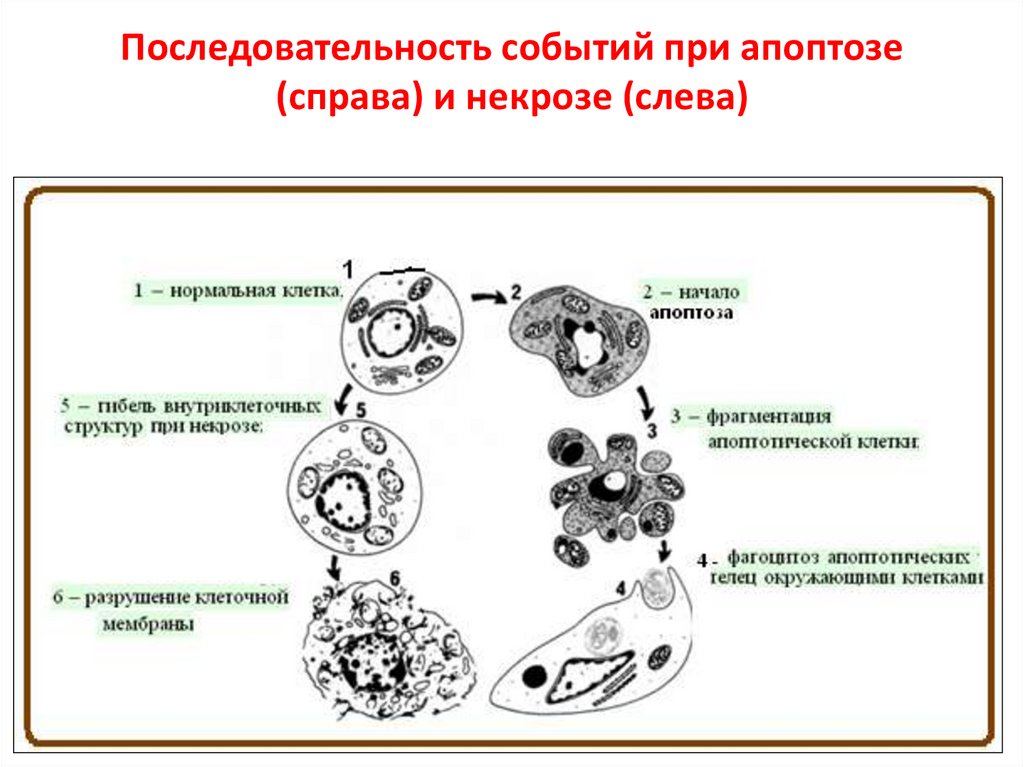
Последовательность событий при апоптозе(справа) и некрозе (слева)
7.
Функции апоптоза8.
Стадии апоптоза• 1. Индукция. Изменения в клеточном окружении,
приводящие к активации апоптоза через R и СТ
• 2. Исполнение. Клетка решает войти в апоптоз.
• 3. Дегенерация. События, связанные с конечным
развертыванием клеточных процессов,
позволяющих подойти клетке к точке, откуда нет
возврата.
9.
Индукторы и супрессоры апоптоза• Индукторы: дефицит ФР, глюкозы, УФ и гаммаизлучение, перекись, ПОЛ, ГК гормоны, ТХДД, ФНО,
экспрессия проапоптотических генов сем. Bcl-2
цитолитические Т-лимфоциты, вирусы,
химиотерапевтические лекарства и др.
• Супрессоры: экспрессия антиапоптотических генов сем.
Bcl-2, MDR, теломеразы, ингибиторы синтеза РНК и
белков, мут.р53 и др.
10.
11.
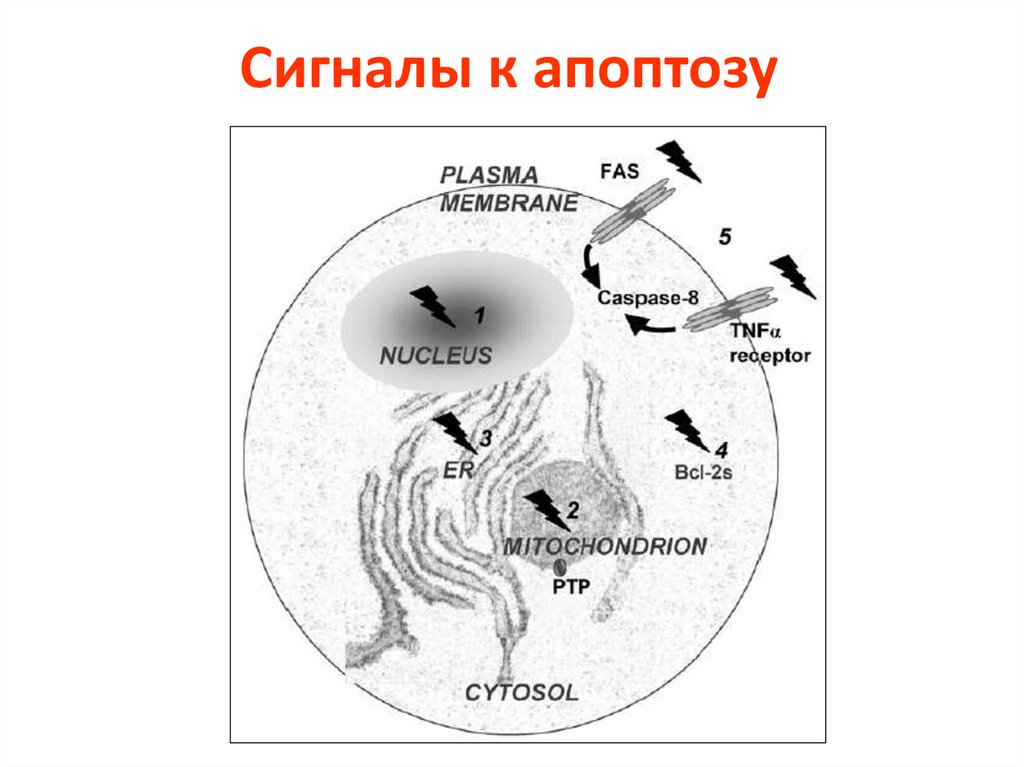
Сигналы к апоптозу12.
Лиганды и рецепторы• Лиганды: сем. гомотримерных лигандов
TNF - FasL, TRAIL (Apo2L), TNF α и β,
CD40L,CD27L, OX40L.
• Рецепторы: FAS и др. рецепторы семейства
TNF
13.
Взаимодействие лиганда смерти TRAIL срецептором
14.
Зависимый от Fas-рецептора апоптоз придействии цитотоксического Т-лимфоцита
15.
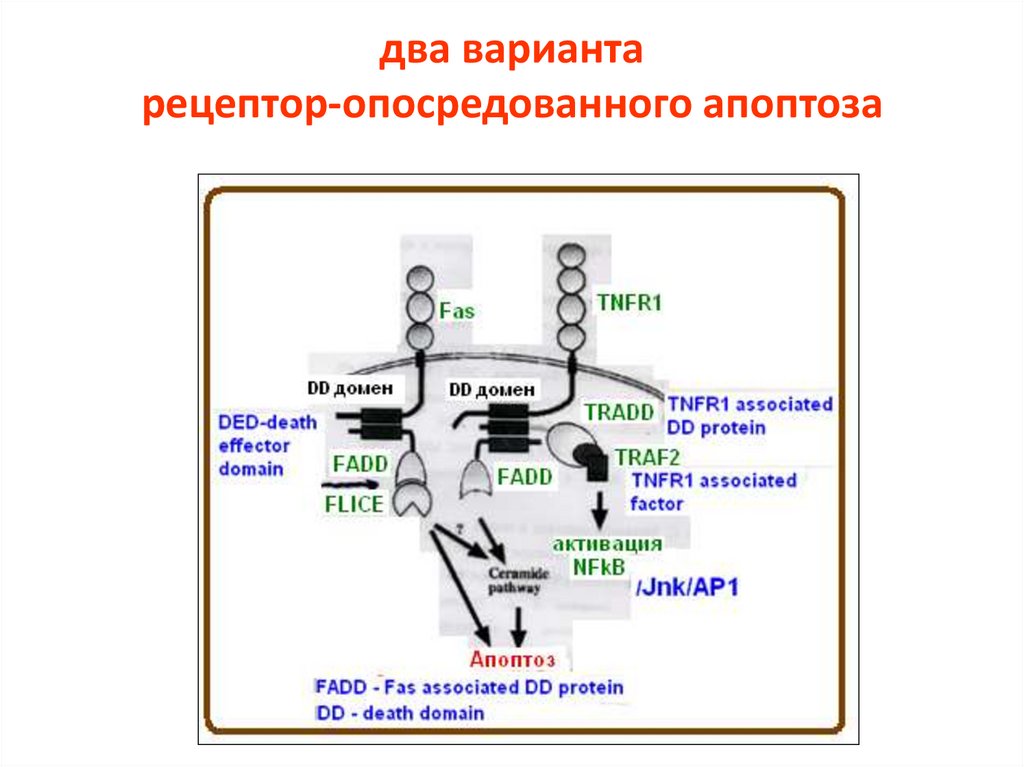
два вариантарецептор-опосредованного апоптоза
16.
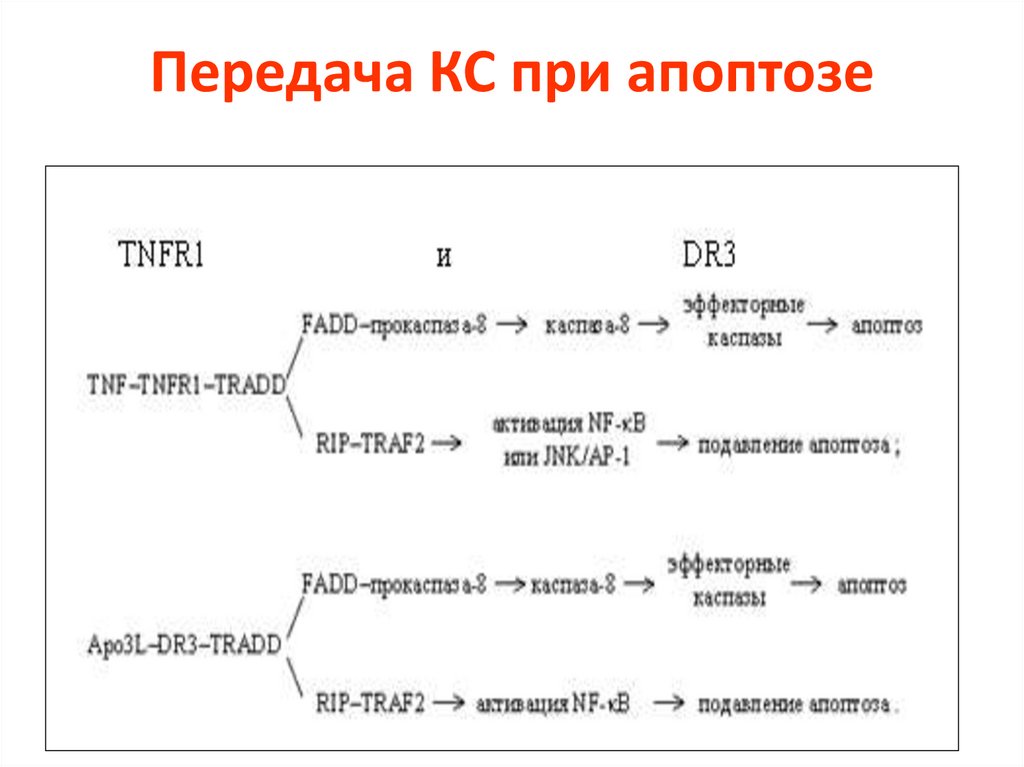
Передача КС при апоптозе17.
18.
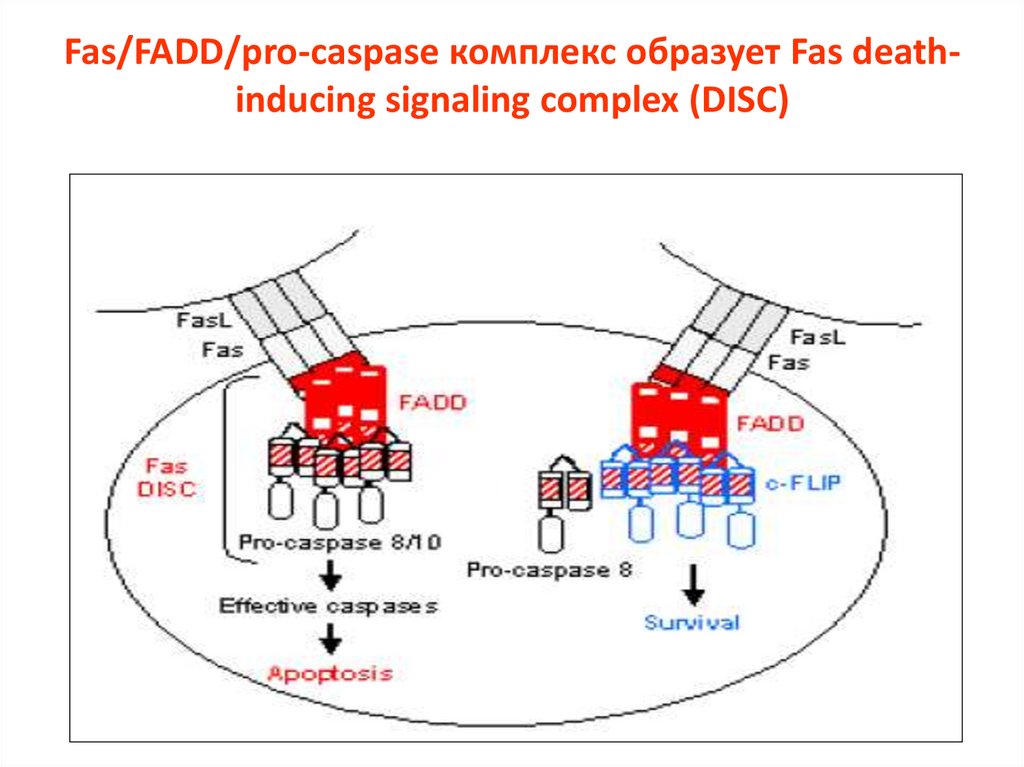
Fas/FADD/pro-caspase комплекс образует Fas deathinducing signaling complex (DISC)19.
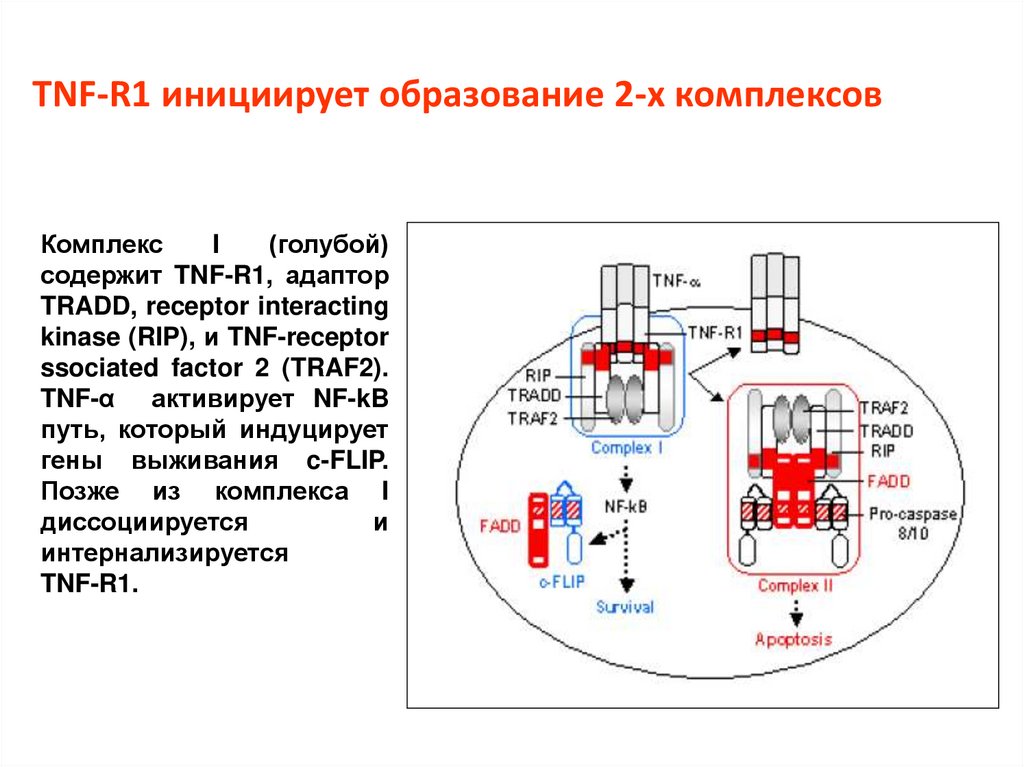
TNF-R1 инициирует образование 2-х комплексовКомплекс
I
(голубой)
содержит TNF-R1, адаптор
TRADD, receptor interacting
kinase (RIP), и TNF-receptor
ssociated factor 2 (TRAF2).
TNF-α активирует NF-kB
путь, который индуцирует
гены выживания c-FLIP.
Позже из комплекса I
диссоциируется
и
интернализируется
TNF-R1.
20.
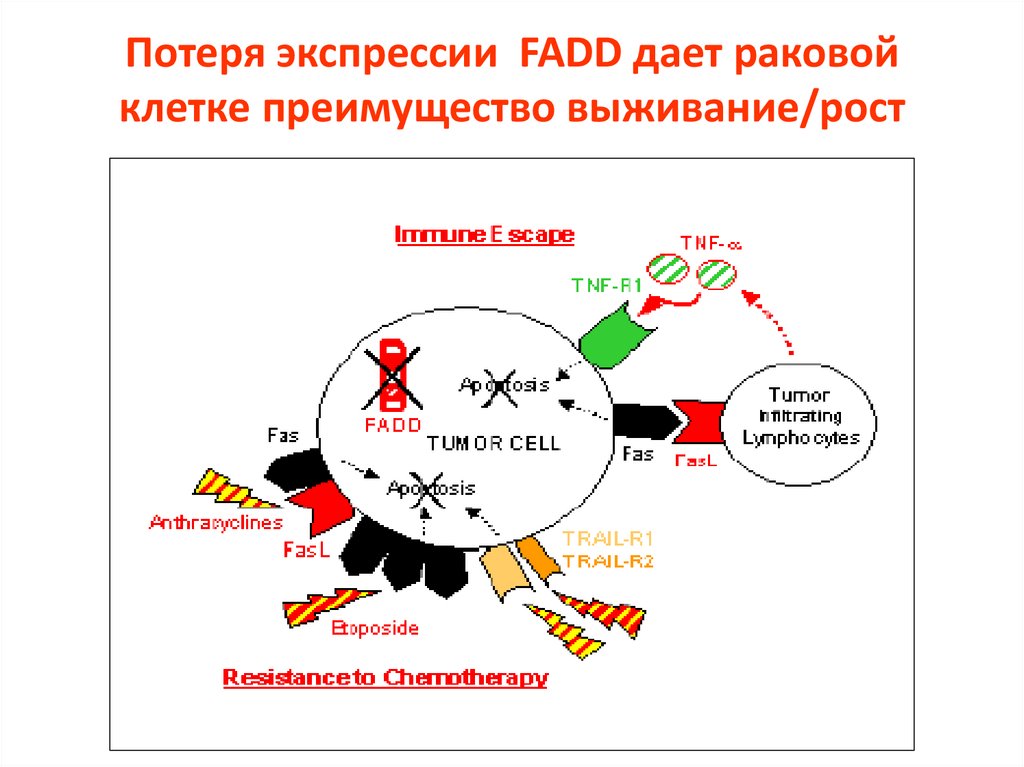
Потеря экспрессии FADD дает раковойклетке преимущество выживание/рост
21.
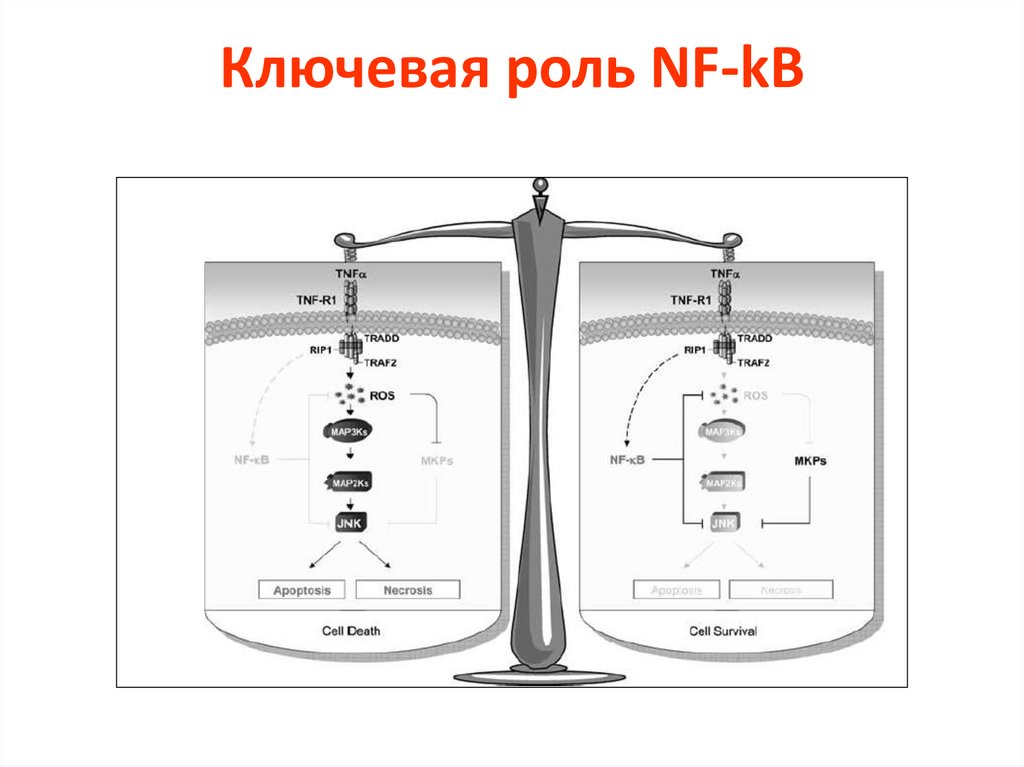
Ключевая роль NF-kB22.
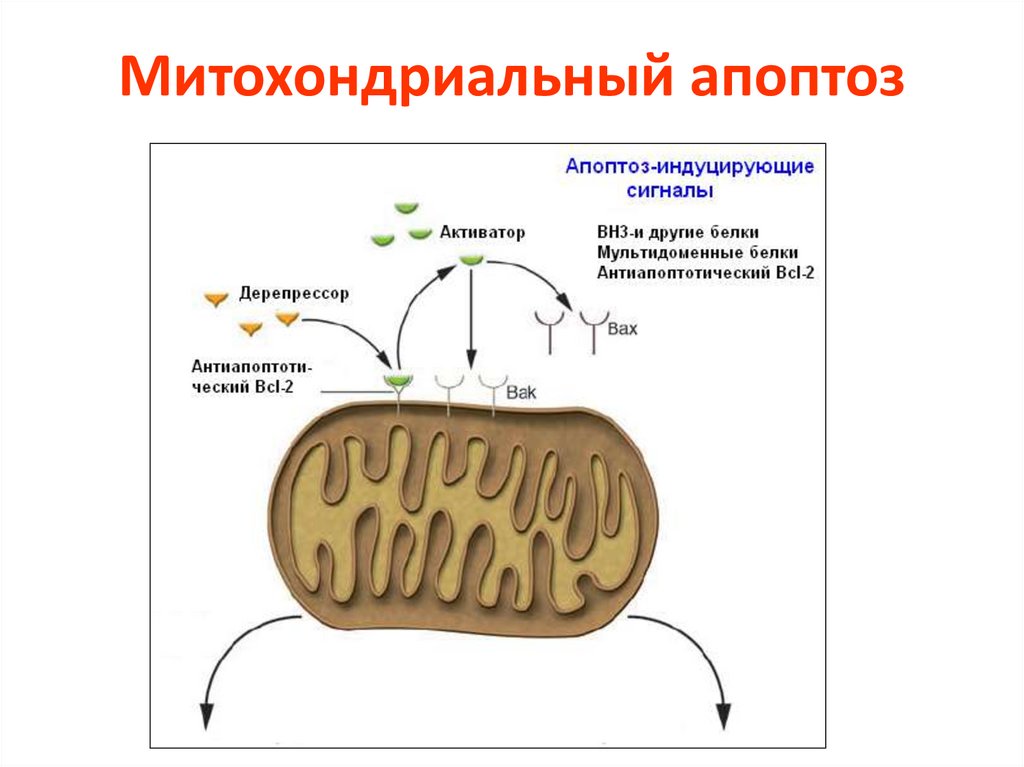
Митохондриальный апоптоз23.
24.
Модель образования протеосомы25.
Доменная организацияапоптосомы
26.
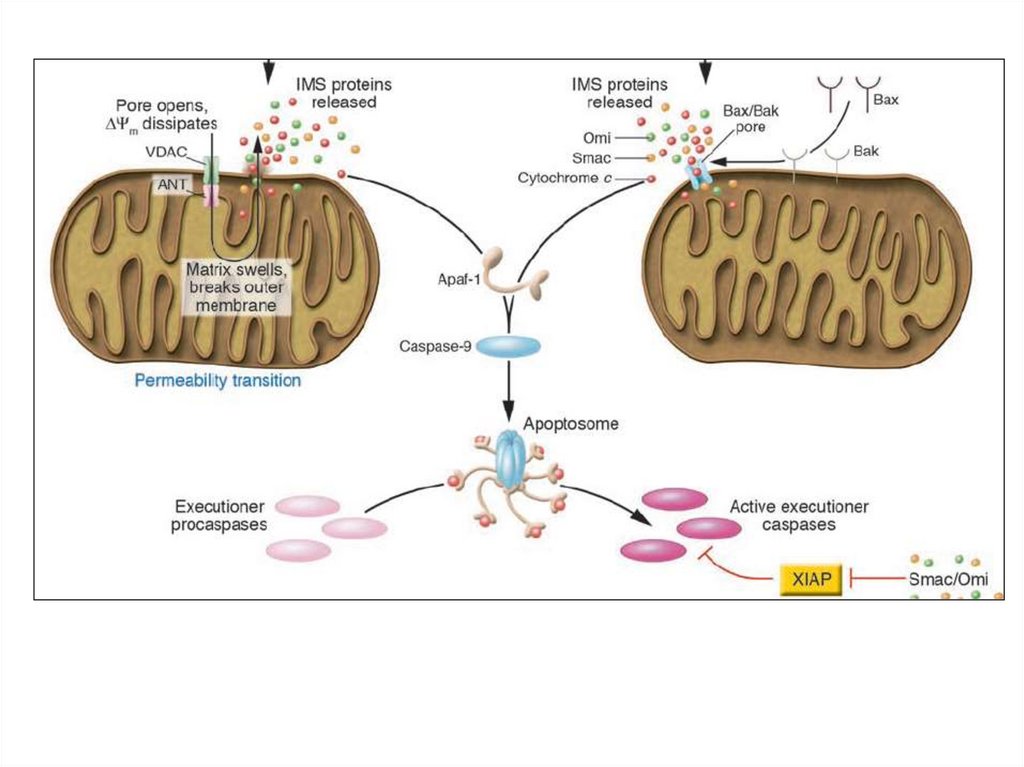
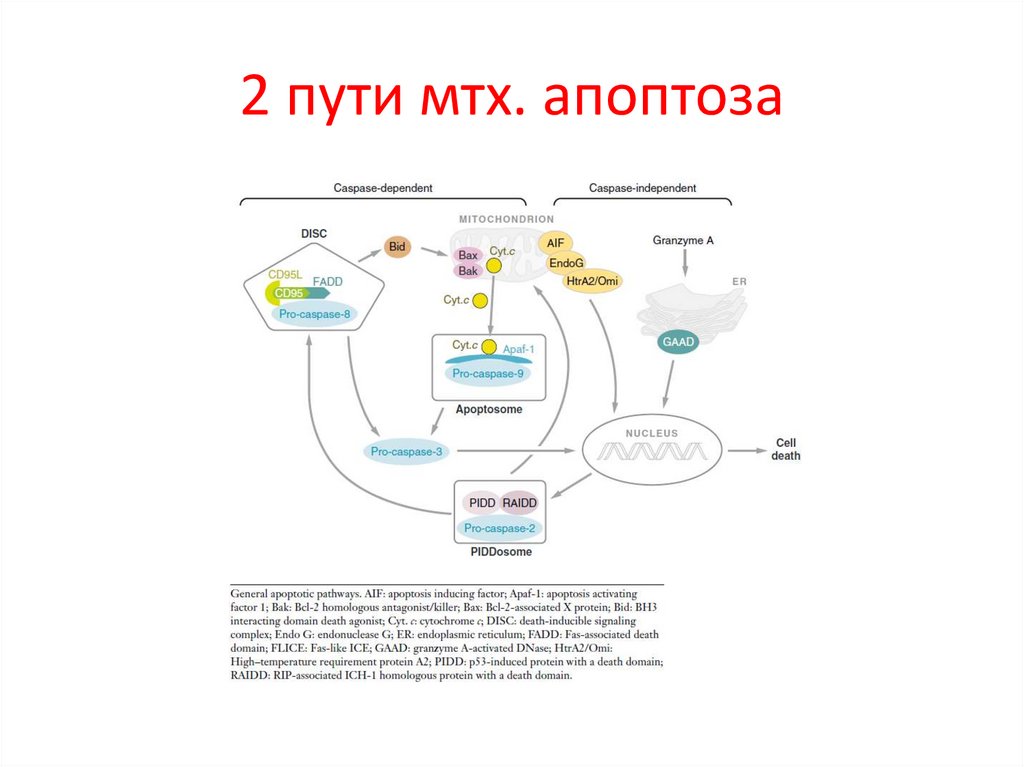
2 пути мтх. апоптоза27.
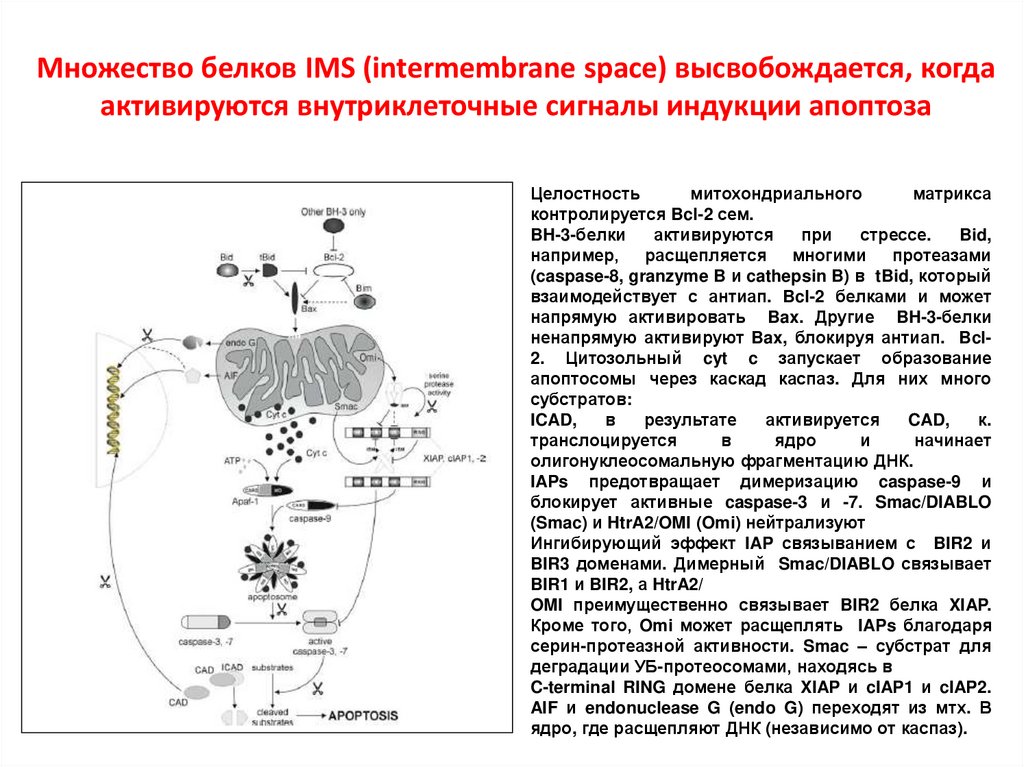
Множество белков IMS (intermembrane space) высвобождается, когдаактивируются внутриклеточные сигналы индукции апоптоза
Целостность
митохондриального
матрикса
контролируется Bcl-2 сем.
BH-3-белки
активируются
при
стрессе.
Bid,
например,
расщепляется
многими
протеазами
(caspase-8, granzyme B и cathepsin B) в tBid, который
взаимодействует с антиап. Bcl-2 белками и может
напрямую активировать Bax. Другие BH-3-белки
ненапрямую активируют Bax, блокируя антиап. Bcl2. Цитозольный cyt c запускает образование
апоптосомы через каскад каспаз. Для них много
субстратов:
ICAD,
в
результате
активируется
CAD,
к.
транслоцируется
в
ядро
и
начинает
олигонуклеосомальную фрагментацию ДНК.
IAPs предотвращает димеризацию caspase-9 и
блокирует активные caspase-3 и -7. Smac/DIABLO
(Smac) и HtrA2/OMI (Omi) нейтрализуют
Ингибирующий эффект IAP связыванием с BIR2 и
BIR3 доменами. Димерный Smac/DIABLO связывает
BIR1 и BIR2, а HtrA2/
OMI преимущественно связывает BIR2 белка XIAP.
Кроме того, Omi может расщеплять IAPs благодаря
серин-протеазной активности. Smac – субстрат для
деградации УБ-протеосомами, находясь в
C-terminal RING домене белка XIAP и cIAP1 и cIAP2.
AIF и endonuclease G (endo G) переходят из мтх. В
ядро, где расщепляют ДНК (независимо от каспаз).
28.
Механизмы MOMP29.
Семейство белков BCL-2БЫЛ ИДЕНТИФИЦИРОВАН В ТОЧКЕ ХРОМОСОМНОГО РАЗРЫВА T (14,18), ХАРАКТЕРНОЙ ДЛЯ
ПАЦИЕНТОВ С B-КЛЕТОЧНОЙ ФОЛЛИКУЛЯРНОЙ ЛИМФОМОЙ, В КОТОРОЙ ГЕН BCL-2 БЫЛ
ПЕРЕМЕЩЕН ВНИЗ ОТ ЛОКУСА ТЯЖЕЛОЙ ЦЕПИ ИММУНОГЛОБУЛИНА (IGH), ПРИВОДЯЩИЙ К
КОНСТИТУТИВНОЙ ЭКСПРЕССИИ БЕЛКА.
30.
Состав семейства Bcl-2 генов31.
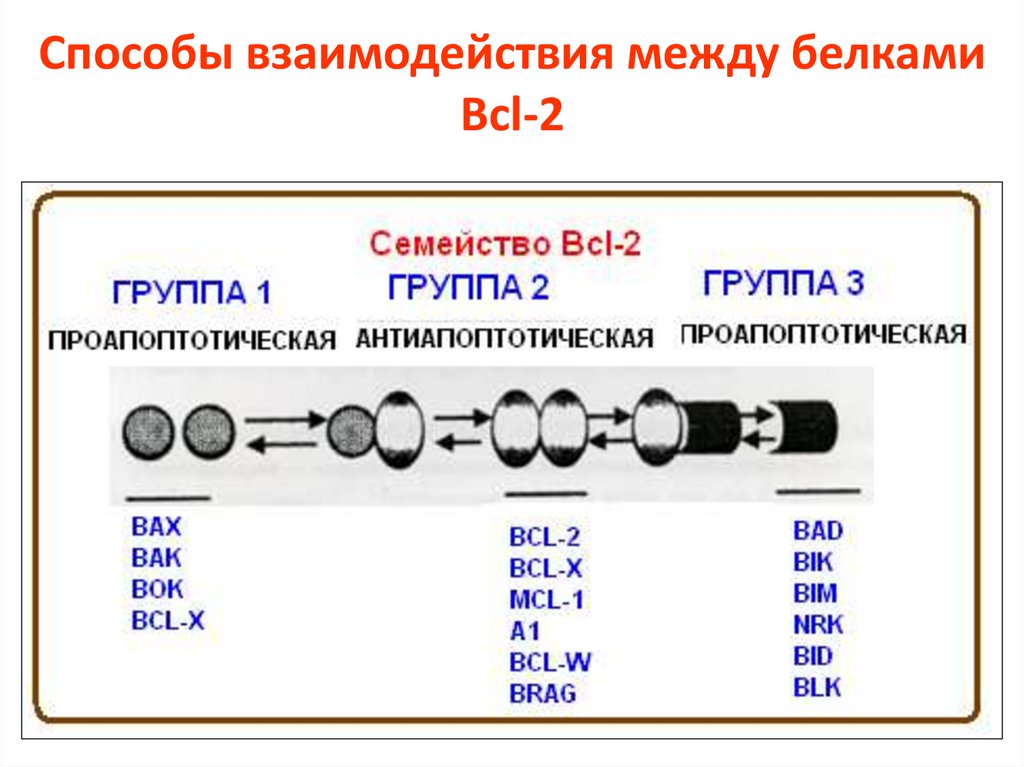
Способы взаимодействия между белкамиBcl-2
32.
Meeting points Bcl-233.
Регуляция мтх. апоптоза (1)34.
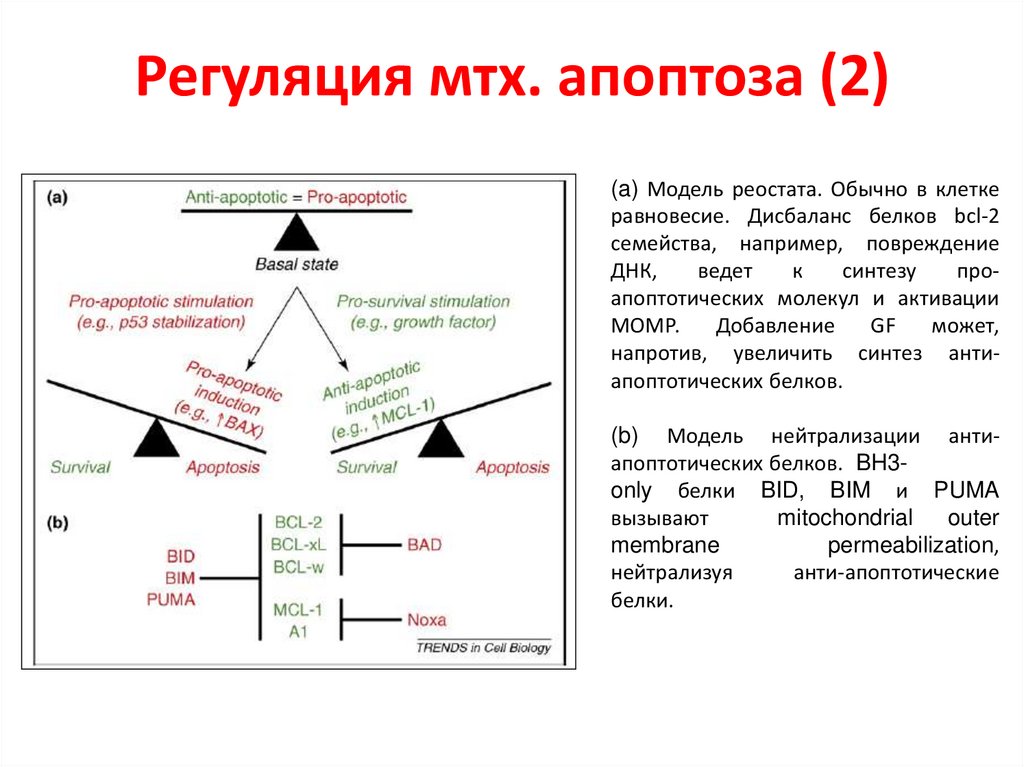
Регуляция мтх. апоптоза (2)(a) Модель реостата. Обычно в клетке
равновесие. Дисбаланс белков bcl-2
семейства, например, повреждение
ДНК,
ведет
к
синтезу
проапоптотических молекул и активации
МОМР.
Добавление
GF
может,
напротив, увеличить синтез антиапоптотических белков.
(b) Модель нейтрализации антиапоптотических белков. BH3only белки BID, BIM и PUMA
вызывают
mitochondrial
outer
membrane
permeabilization,
нейтрализуя
анти-апоптотические
белки.
35.
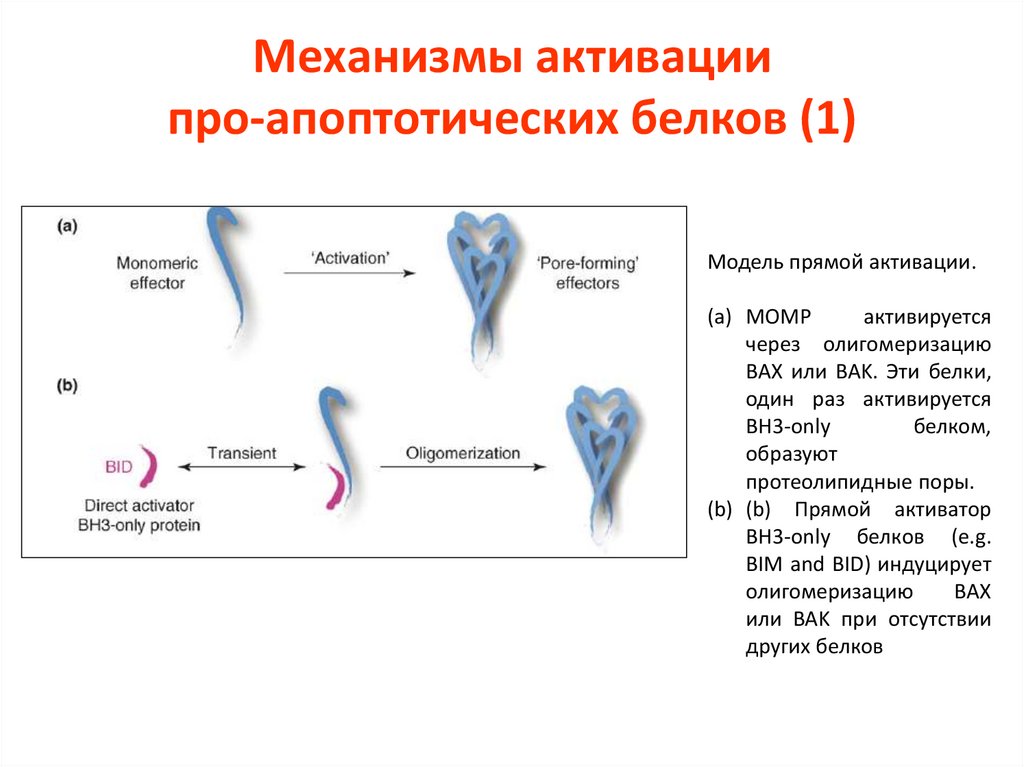
Механизмы активациипро-апоптотических белков (1)
Модель прямой активации.
(a) MOMP
активируется
через олигомеризацию
BAX или BAK. Эти белки,
один раз активируется
BH3-only
белком,
образуют
протеолипидные поры.
(b) (b) Прямой активатор
BH3-only белков (e.g.
BIM and BID) индуцирует
олигомеризацию
BAX
или BAK при отсутствии
других белков
36.
Механизмы активациипро-апоптотических белков (2)
(c) A subset of BH3-only proteins, the derepressors/sensitizers, cannot induce the activation of
BAX or BAK alone. In this scenario, a direct activator BH3only protein is sequestered by an anti-apoptotic BCL2 protein. Following stress, a de-repressor/sensitizer BH3only protein is induced, either by transcriptional upregulation or by post-translational modification, and this
protein then binds to an anti-apoptotic BCL-2 protein,
promoting the release of a sequestered, direct activator
BH3-only protein. In this example, BIM is tonically
sequestered by MCL-1, and the induction of Noxa enables
the release of BIM to engage MOMP. If cells constitutively
harbor a sequestered direct activator protein, they are
referred to as being ‘primed for death’ or ‘BCL-2 addicted’.
Not shown in this figure is the potential influence of Noxainduced MCL-1 degradation after binding, which might
have important implications in maintaining anti-apoptotic
levels to preserve outer mitochondrial membrane integrity
[53]. (d) Cells are sensitized to undergo MOMP when
de-repressor/sensitizer
BH3-only
proteins
are
constitutively inhibiting anti-apoptotic BCL-2 proteins, and
any future induction of BID or BIM cannot be tolerated.
This scenario is referred to as ‘sensitized for death’. In this
example, BCL-xL is inhibited by BAD, and the induction of
BIM engages MOMP; in the absence of BAD expression,
the MOMP signal would have been inhibited by BCL-xL.
37.
КаспазыСЕМЕЙСТВО ЦИСТЕИНОВЫХ
ПРОТЕАЗ
38.
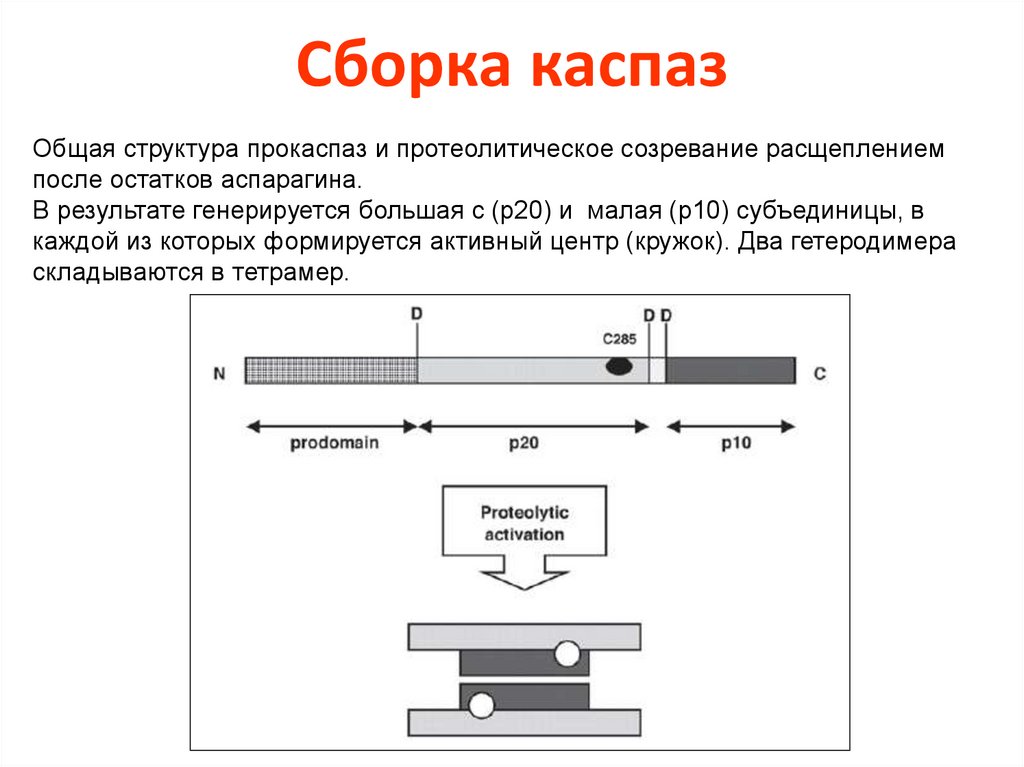
Сборка каспазОбщая структура прокаспаз и протеолитическое созревание расщеплением
после остатков аспарагина.
В результате генерируется большая с (р20) и малая (р10) субъединицы, в
каждой из которых формируется активный центр (кружок). Два гетеродимера
складываются в тетрамер.
39.
Функциональные взаимодействия междукаспазами
40.
Активация инициирующих каспаз41.
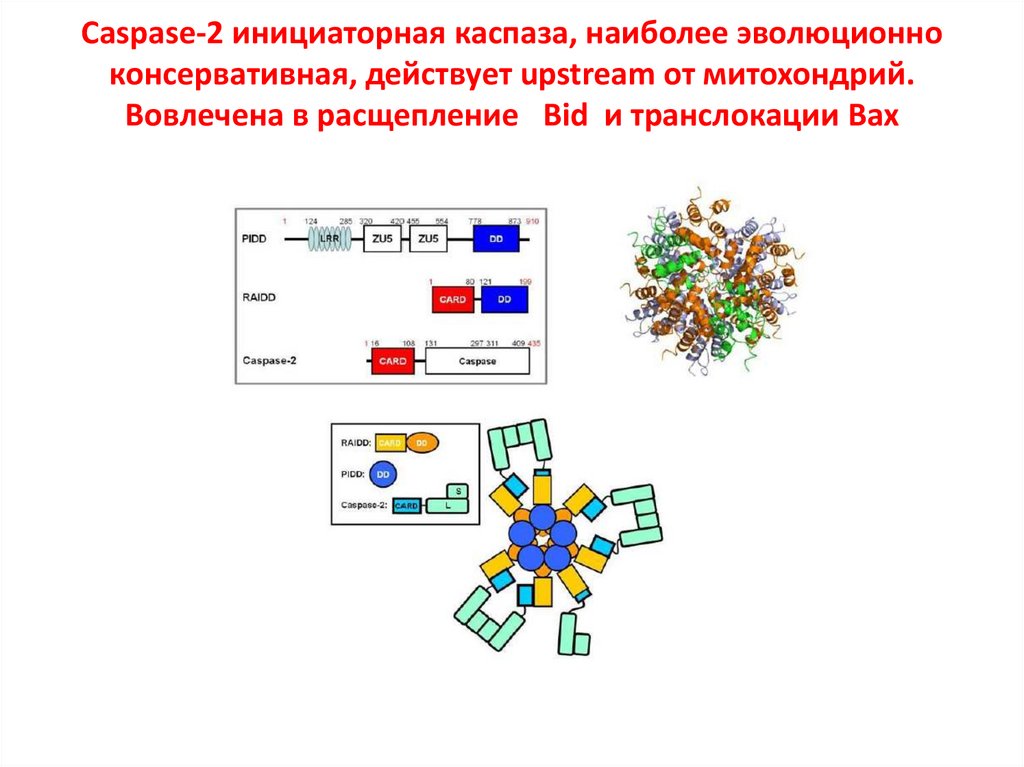
Caspase-2 инициаторная каспаза, наиболее эволюционноконсервативная, действует upstream от митохондрий.
Вовлечена в расщепление Bid и транслокации Bax
42.
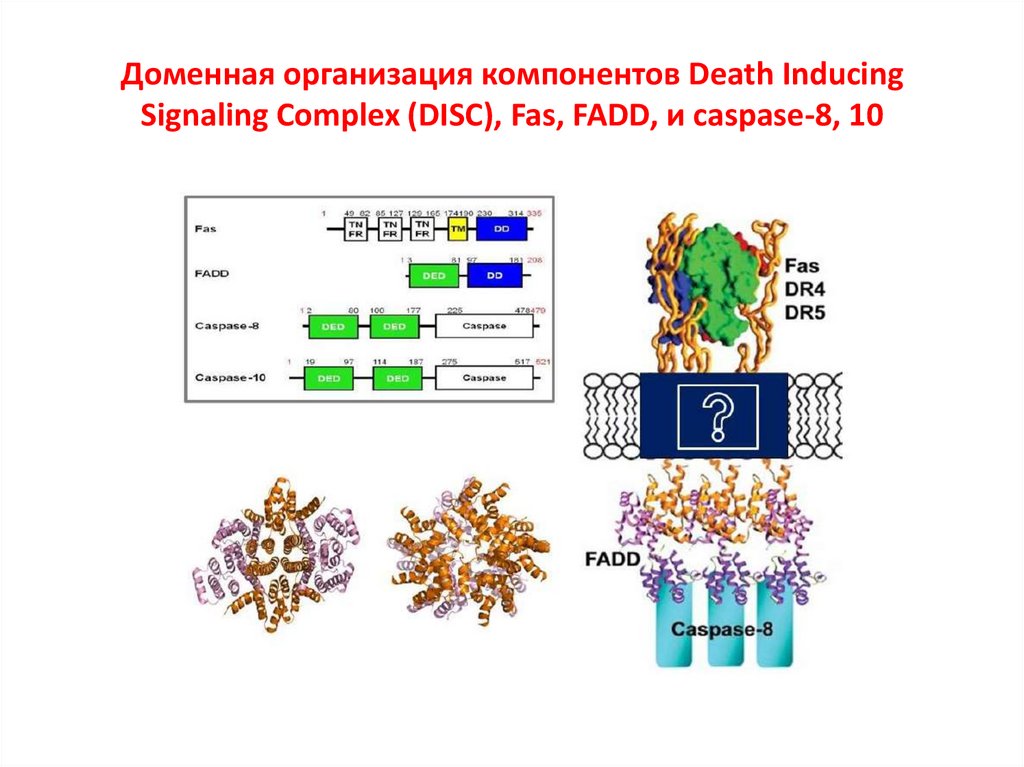
Доменная организация компонентов Death InducingSignaling Complex (DISC), Fas, FADD, и caspase-8, 10
43.
Структурная организация каспазСтруктура и доменная организация
каспаз
млекопитающих.
(a)
каталитическая
петля
(L1–L4).
Инициаторные
каспазы
содержат
большие продомены CARD или DED, а
экзекуторные каспазы имеют короткие
продомены.
Активный цент Cys показан красным.
Процессинг разделения p20 и p10
Происходит в L2. The resulting large
subunit potion of the L2 loop of one
monomer and small subunit portion of the
L2 loop of the neighboring monomer (L20)
are involved in loop bundle formation (b
and c). (b) Ribbon representation of the
active caspase-3
structure showing the positions of the
active center loops (L1-L4, L20) based on
the crystal structure of the complex of
caspase-3 with peptide inhibitor (in pink).
Reproduced with permission from Shi
(2002). (c) The active site conformations
of the caspases with known structures.
Loops L1 and L3 are highly conserved,
whereas L2 and L4 are responsible for the
differences in substrate binding specificity.
Reproduced with permission from Shi
(2002). CARD, caspase recruitment
domain; DED, death effector domain
44.
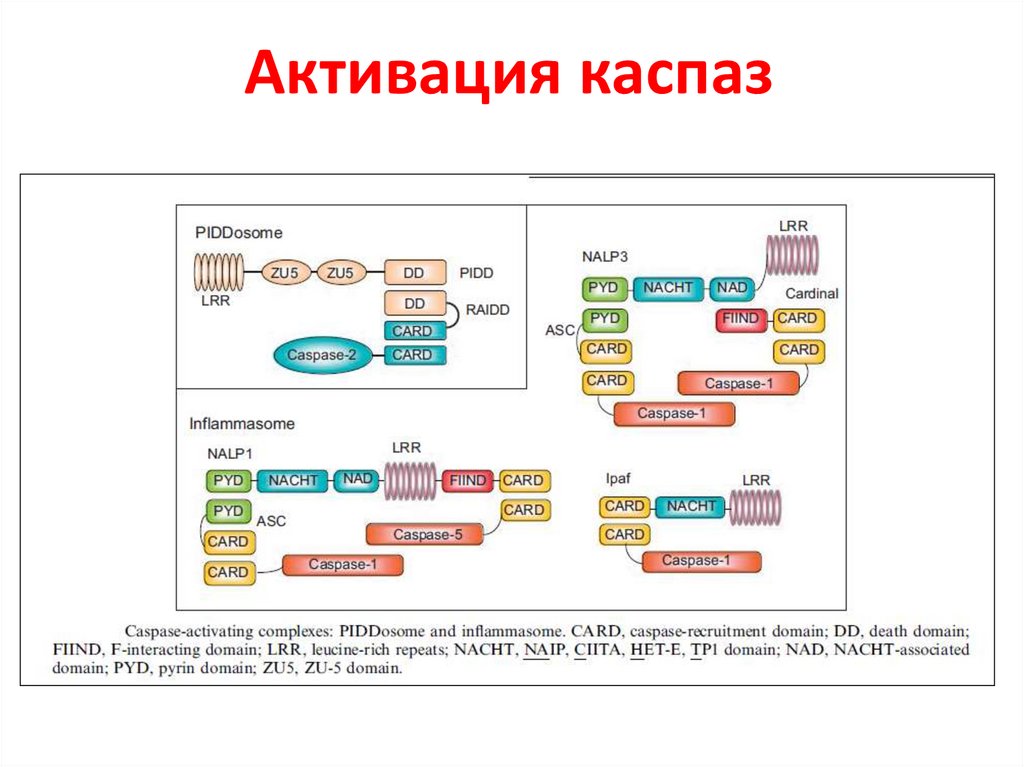
Активация каспаз45.
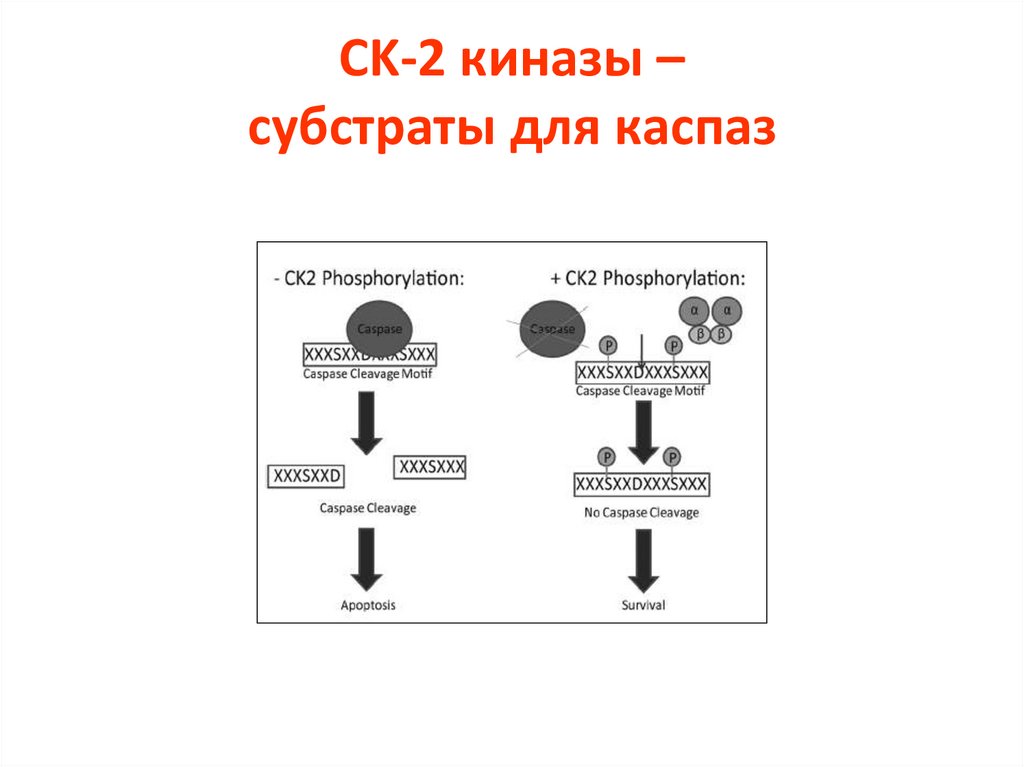
CK-2 киназы –субстраты для каспаз
46.
CK-2 киназы в митозеСхематическое изображение
CK2a и CK2b с сайтами ф-я
(треонины
344 и 360, серины 362 и370 в
CK2a, серин 209 в CK2b)
черным.
(B)
Модель
временной регуляции
ф-я
CK2a (C) Модель ф-ия CK2 в
митозе. После ф-ия CK2
киназой Cdk1, CK2a C-terminal
ф. сайты могут связываться
с пролил изомеразой Pin1.
Образование комплекса Pin1,
Topoisomerase II, и ф-ый
CK2a вызывает снижение фия Topoisomerase II киназой
CK2 . Митотическая киназа
Plk1 может также связаться с
C-terminal CK2a по ф. сайту.
Но
функция
этого
взаимодействия неизвестна.
47.
Роль CK-2 в клеточных процессах48.
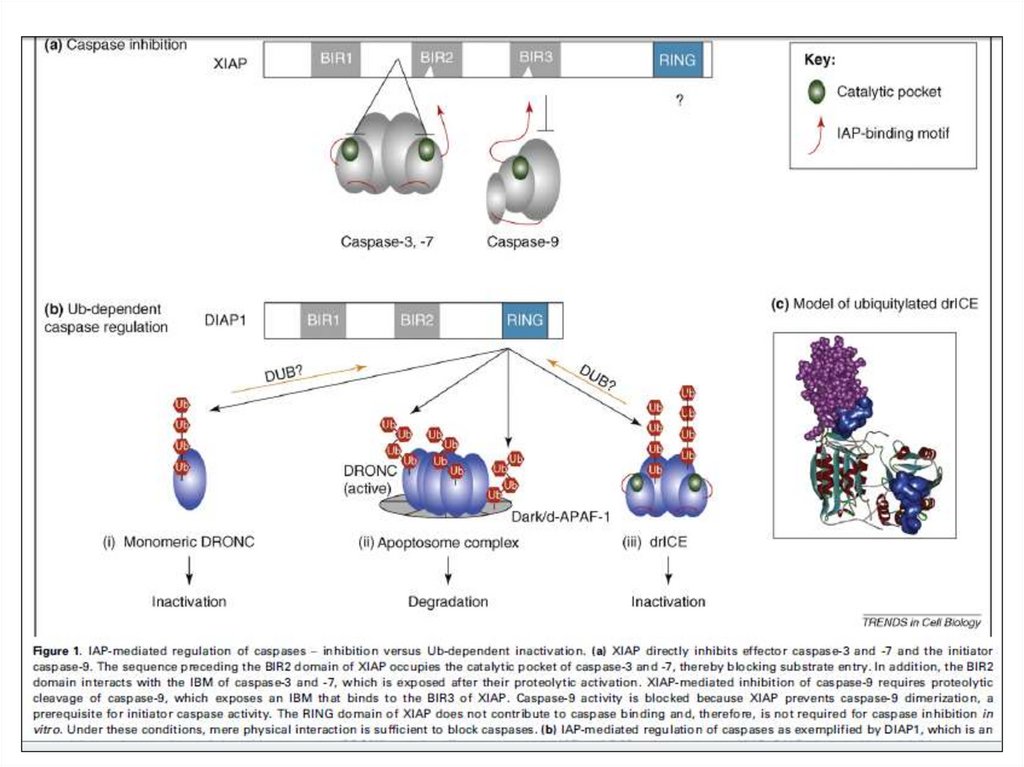
Регуляция апоптоза ингибиторнымибелками
49.
Различная организация BIR50.
Взаимодействие с каспазой 3 (а) и IPVA (b)51.
Взаимодействие с каспазой 9 (а) иSmac/DIABLO (b)
52.
Селективное связываниеIAP белков
53.
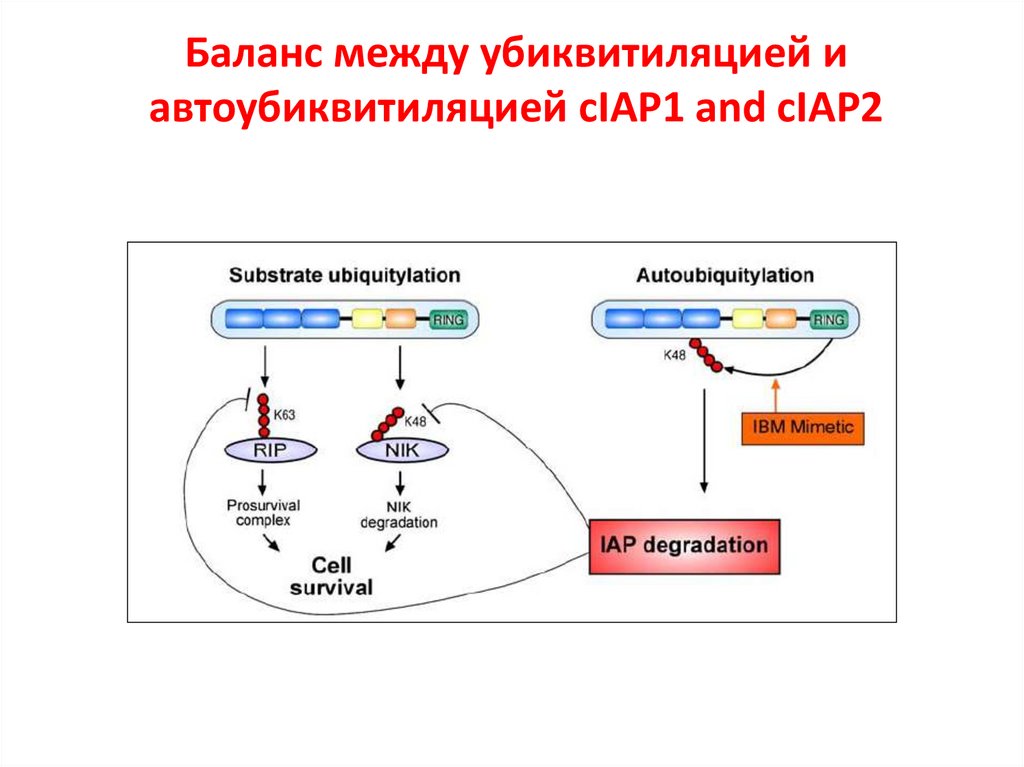
Баланс между убиквитиляцией иавтоубиквитиляцией cIAP1 and cIAP2
54.
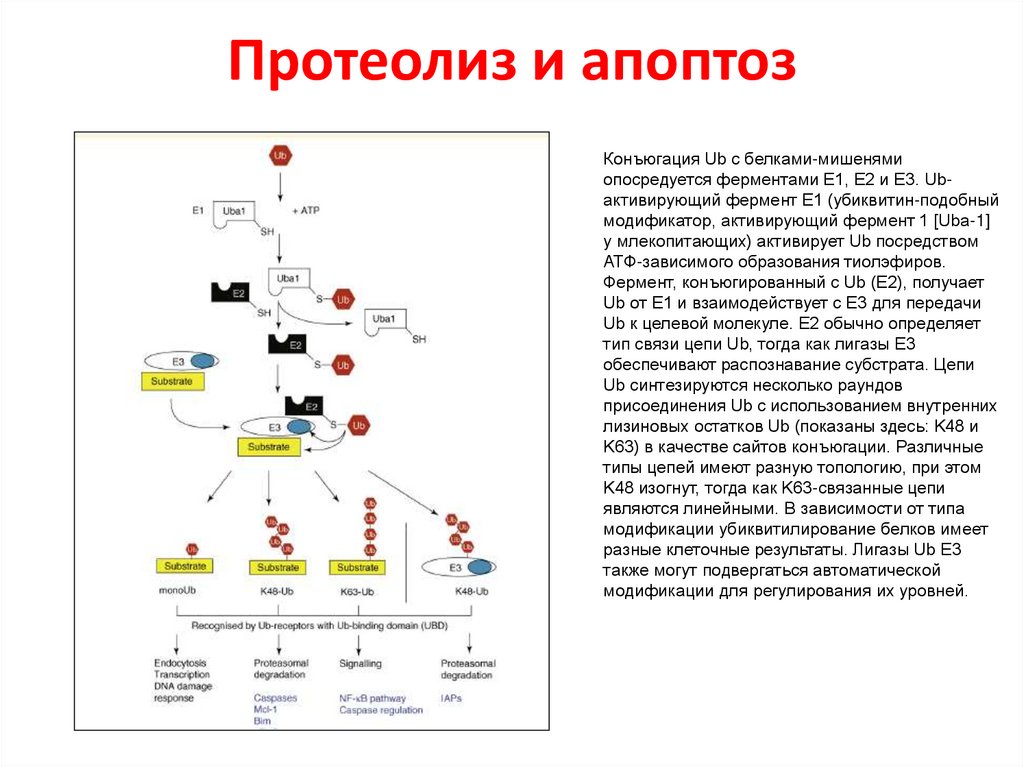
Протеолиз и апоптозКонъюгация Ub с белками-мишенями
опосредуется ферментами E1, E2 и E3. Ubактивирующий фермент E1 (убиквитин-подобный
модификатор, активирующий фермент 1 [Uba-1]
у млекопитающих) активирует Ub посредством
АТФ-зависимого образования тиолэфиров.
Фермент, конъюгированный с Ub (E2), получает
Ub от E1 и взаимодействует с E3 для передачи
Ub к целевой молекуле. E2 обычно определяет
тип связи цепи Ub, тогда как лигазы E3
обеспечивают распознавание субстрата. Цепи
Ub синтезируются несколько раундов
присоединения Ub с использованием внутренних
лизиновых остатков Ub (показаны здесь: K48 и
K63) в качестве сайтов конъюгации. Различные
типы цепей имеют разную топологию, при этом
K48 изогнут, тогда как K63-связанные цепи
являются линейными. В зависимости от типа
модификации убиквитилирование белков имеет
разные клеточные результаты. Лигазы Ub E3
также могут подвергаться автоматической
модификации для регулирования их уровней.
55.
56.
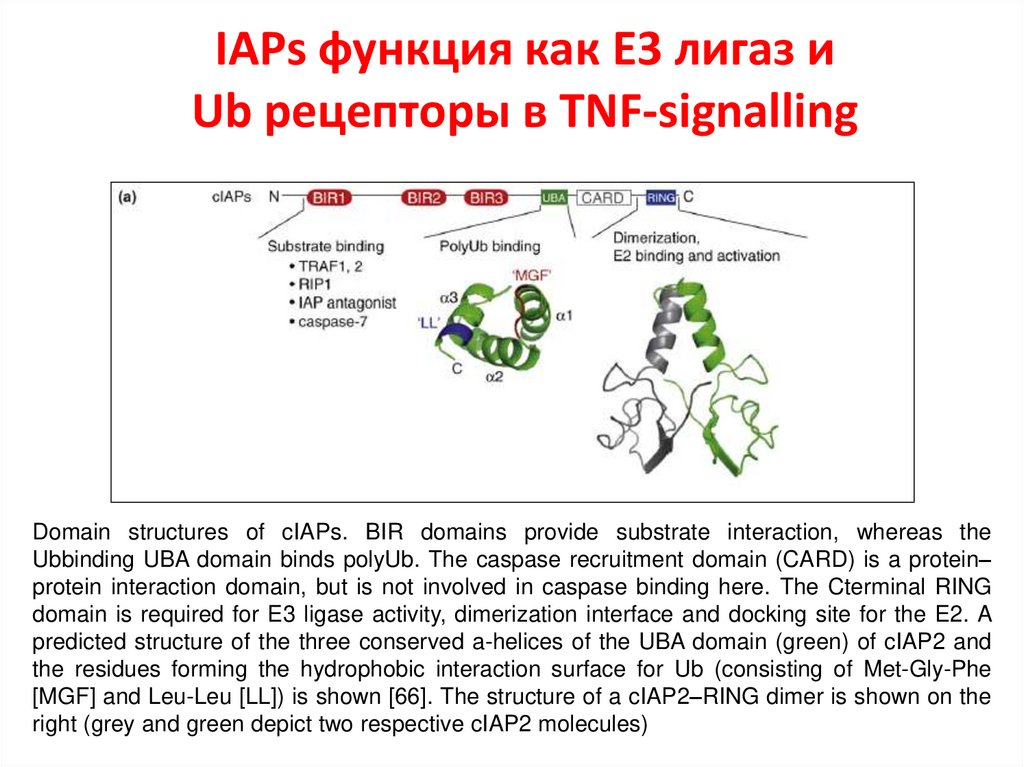
IAPs функция как E3 лигаз иUb рецепторы в TNF-signalling
Domain structures of cIAPs. BIR domains provide substrate interaction, whereas the
Ubbinding UBA domain binds polyUb. The caspase recruitment domain (CARD) is a protein–
protein interaction domain, but is not involved in caspase binding here. The Cterminal RING
domain is required for E3 ligase activity, dimerization interface and docking site for the E2. A
predicted structure of the three conserved a-helices of the UBA domain (green) of cIAP2 and
the residues forming the hydrophobic interaction surface for Ub (consisting of Met-Gly-Phe
[MGF] and Leu-Leu [LL]) is shown [66]. The structure of a cIAP2–RING dimer is shown on the
right (grey and green depict two respective cIAP2 molecules)
57.
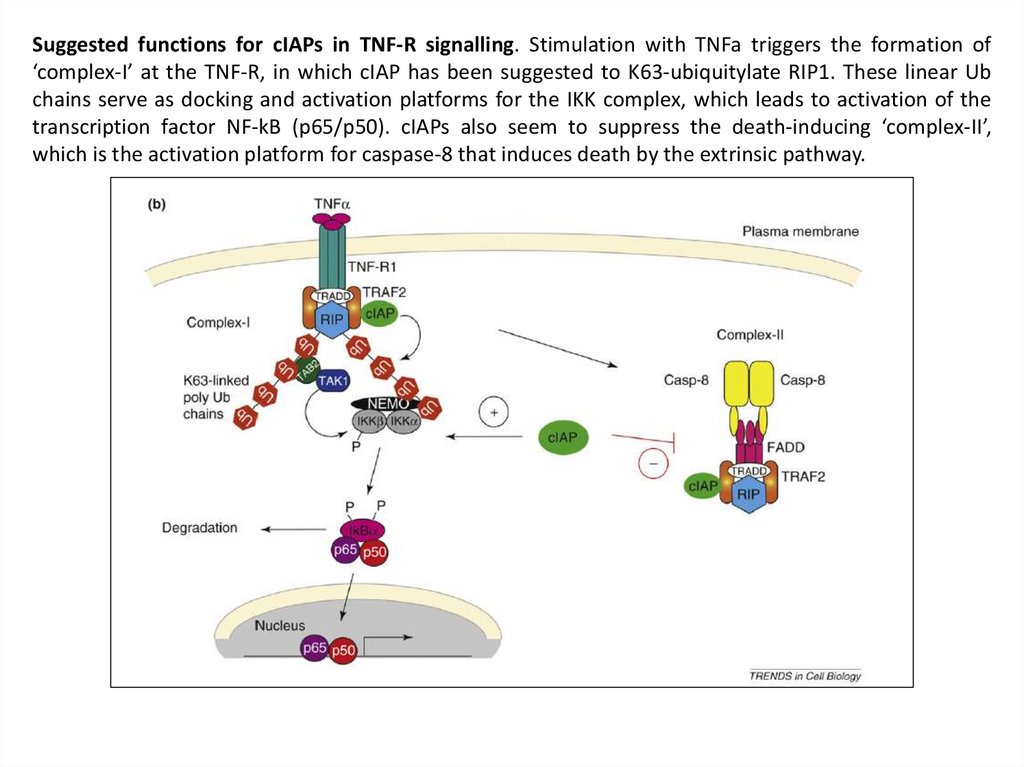
Suggested functions for cIAPs in TNF-R signalling. Stimulation with TNFa triggers the formation of‘complex-I’ at the TNF-R, in which cIAP has been suggested to K63-ubiquitylate RIP1. These linear Ub
chains serve as docking and activation platforms for the IKK complex, which leads to activation of the
transcription factor NF-kB (p65/p50). cIAPs also seem to suppress the death-inducing ‘complex-II’,
which is the activation platform for caspase-8 that induces death by the extrinsic pathway.
58.
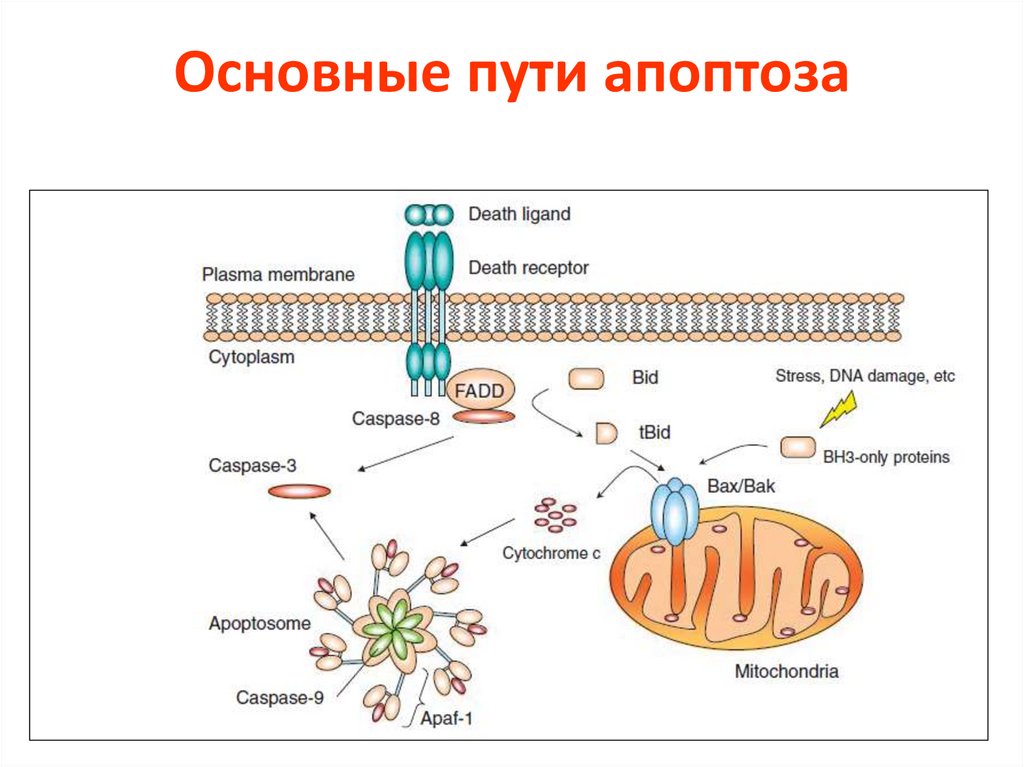
Основные пути апоптоза59.
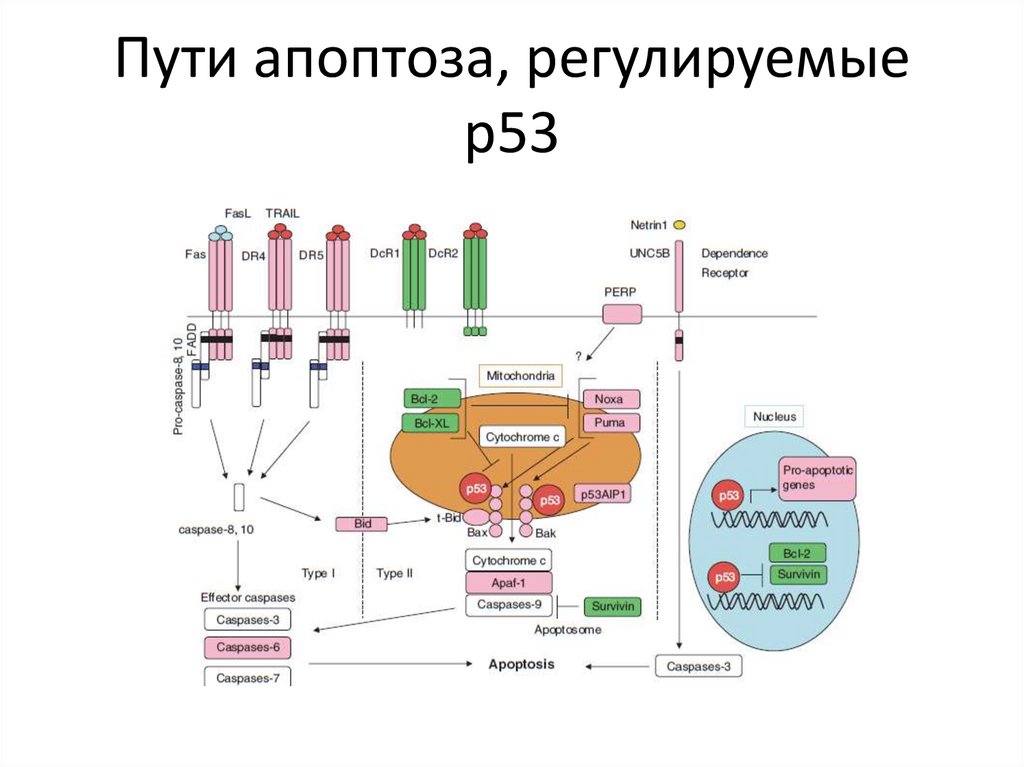
Р53 – регулятор апоптоза60.
Пути апоптоза, регулируемыер53
61.
Интегральная схема регуляции62.
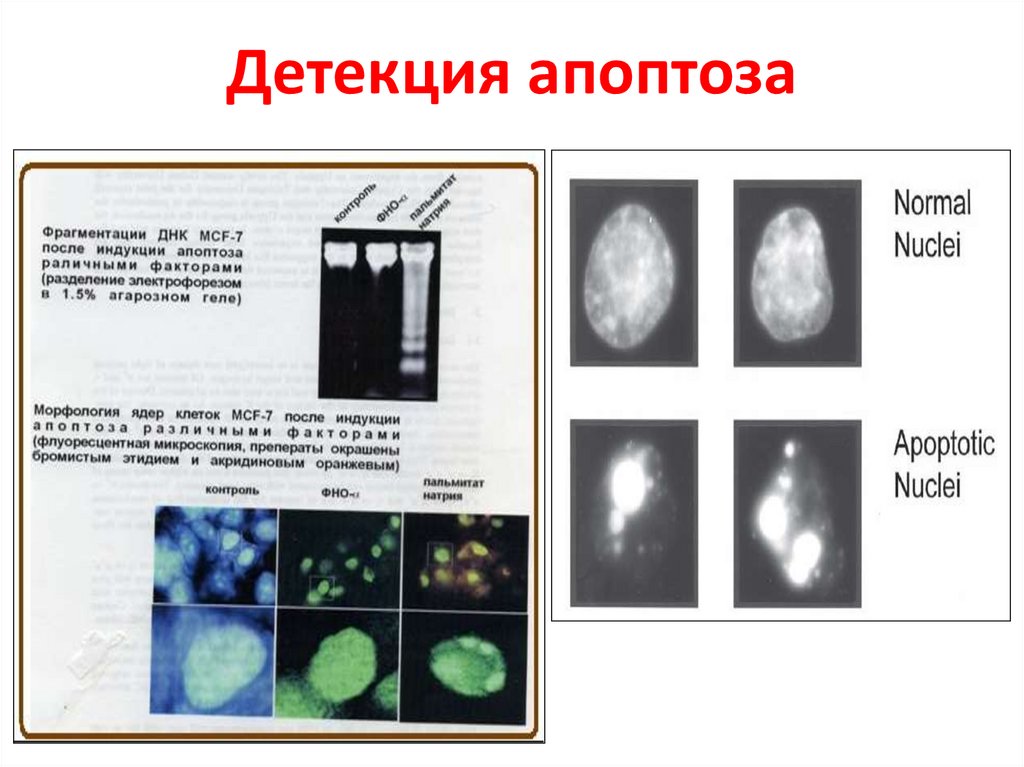
Методы определения фрагментацииДНК
63.
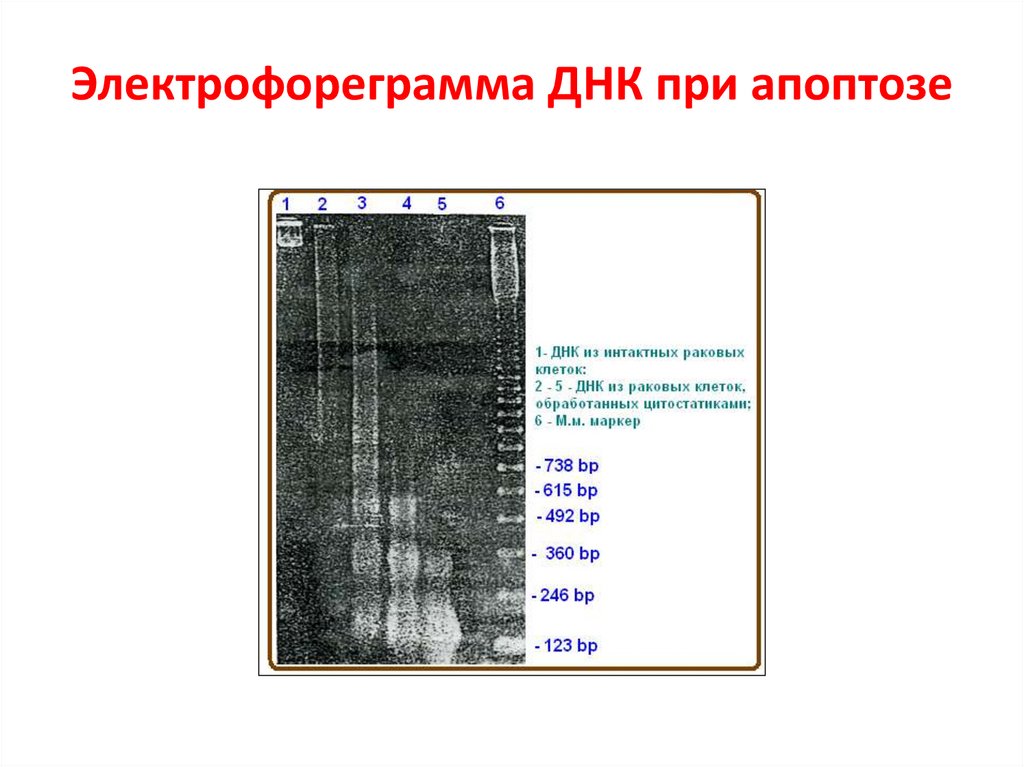
Детекция апоптоза64.
Электрофореграмма ДНК при апоптозе65.
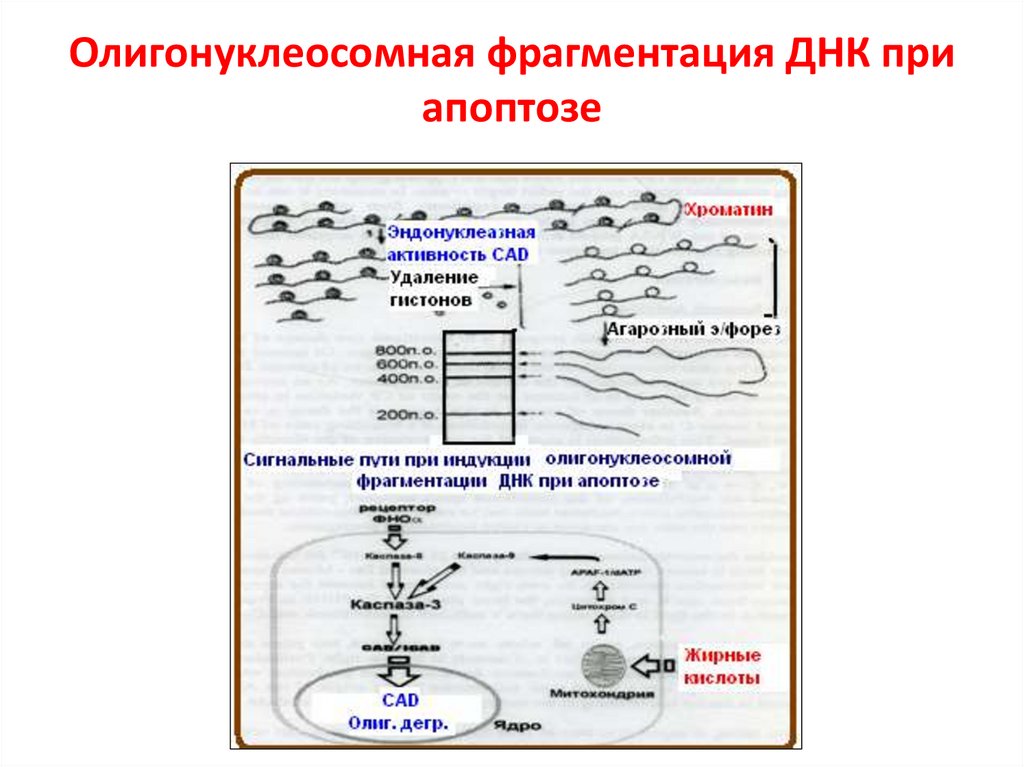
Олигонуклеосомная фрагментация ДНК приапоптозе
66.
Типичная картина апоптоза67.
Молекулярныйимидж клеточной
гибели (c 2009 г.)
68.
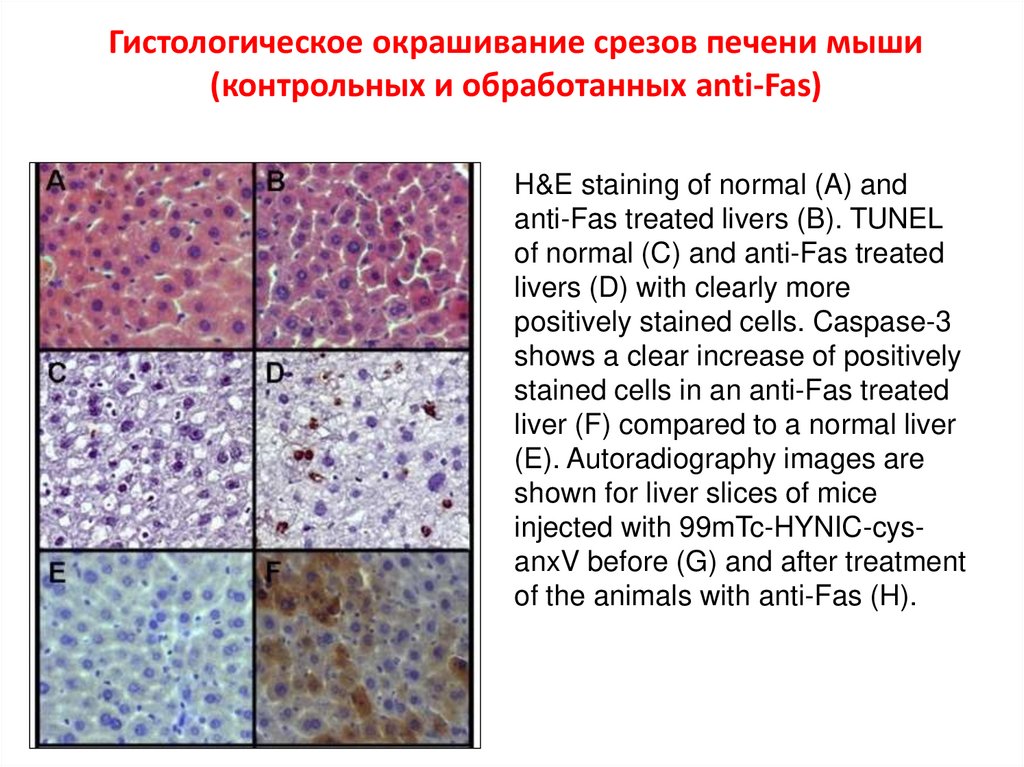
Гистологическое окрашивание срезов печени мыши(контрольных и обработанных anti-Fas)
H&E staining of normal (A) and
anti-Fas treated livers (B). TUNEL
of normal (C) and anti-Fas treated
livers (D) with clearly more
positively stained cells. Caspase-3
shows a clear increase of positively
stained cells in an anti-Fas treated
liver (F) compared to a normal liver
(E). Autoradiography images are
shown for liver slices of mice
injected with 99mTc-HYNIC-cysanxV before (G) and after treatment
of the animals with anti-Fas (H).
69.
In vivo planar imageIn vivo planar image of a control rat and a rat with reperfused hepatic infarction at 7 h post
injection of 99mTc(CO)3-bis-DTPA pamoate (A). Autoradiographs of 30-μm liver slices of the
necrotic liver (B, top row) and viable liver (B, bottom row) and scanned photographs of the
same slices after H&E staining (C) staining show good correlation with the in vivo planar
image.
70.
Апоптоз в опухоли после химиотерапии(А,В – не леченные, H&E и TUNEL окрашивание)
71.
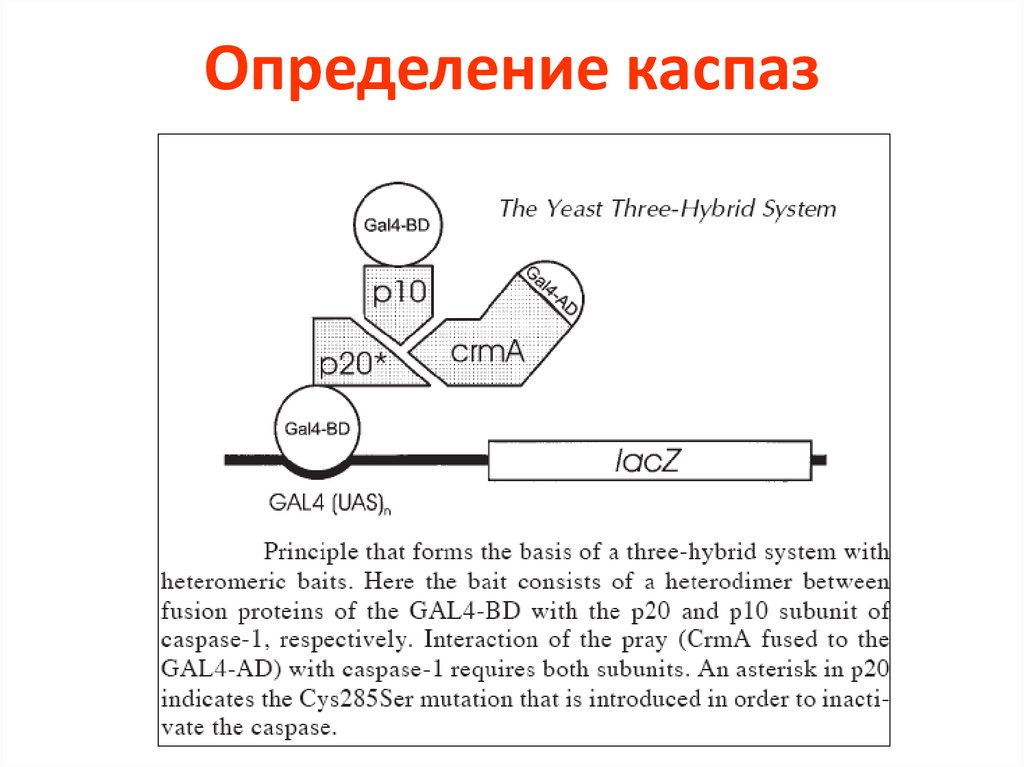
Определение активности каспаз72.
Определение каспаз73.
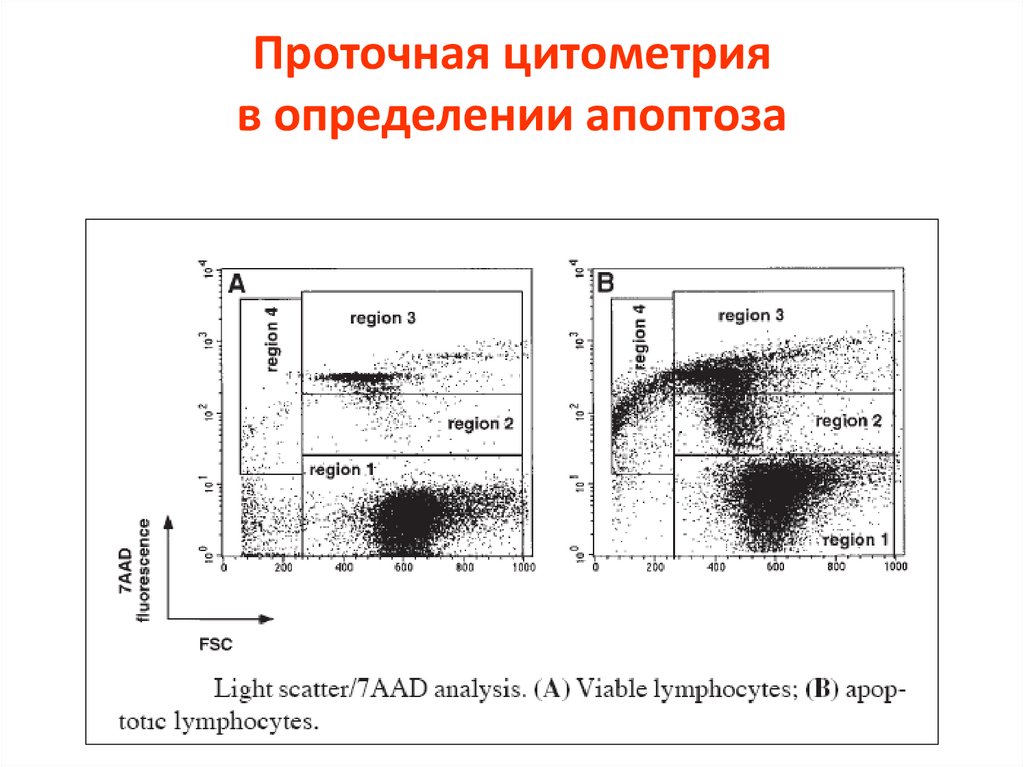
Проточная цитометрияв определении апоптоза
74.
Определение мит. апоптоза75.
Апоптоз в нейронах76.
Апоптоз в нейронах77.
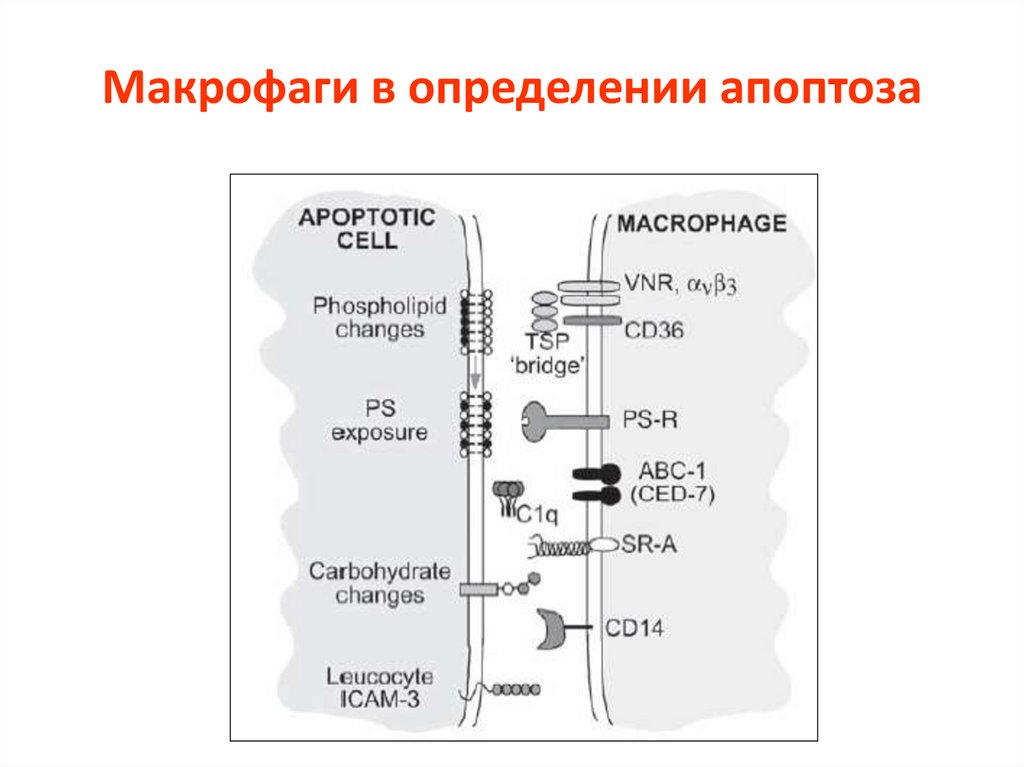
Макрофаги в определении апоптоза78.
Взаимодействие макрофагов сапоптотическими клетками
79.
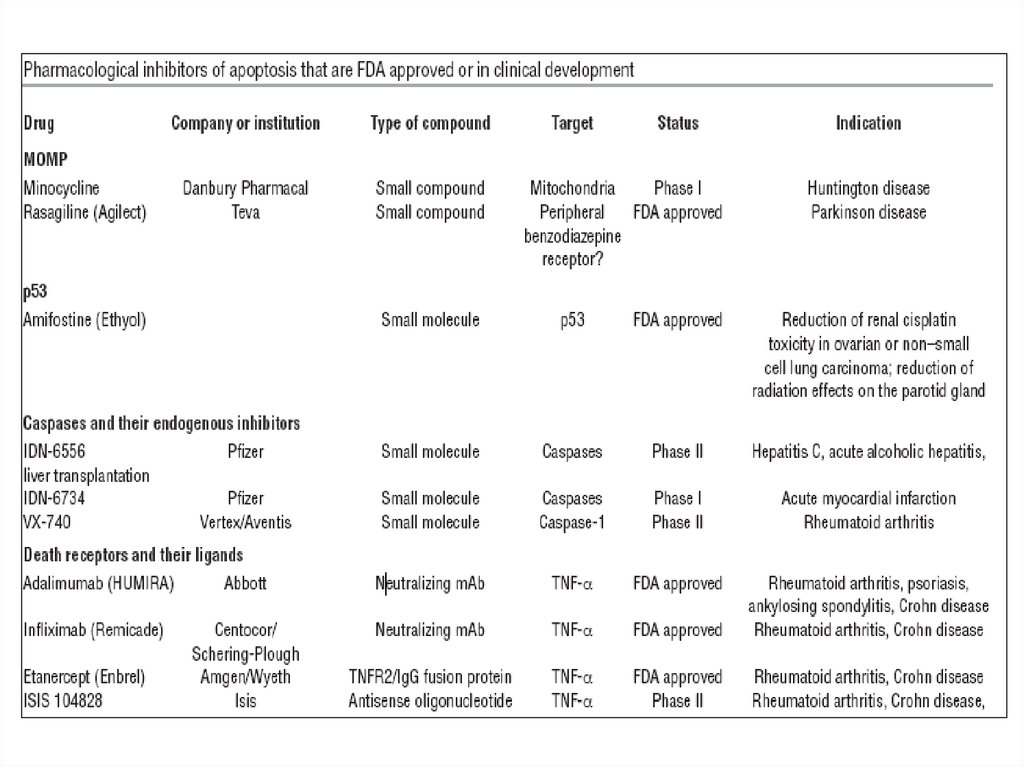
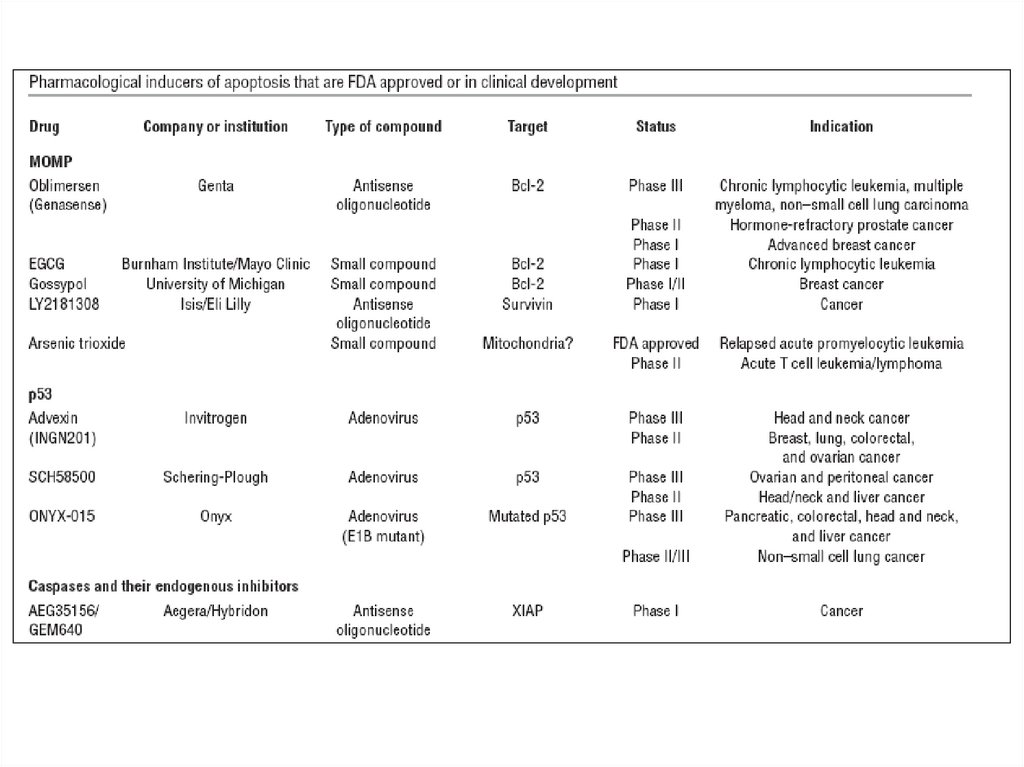
Терапевтические мишени для ингибированияапоптоза (доклиническая стадия)
80.
81.
82.
83.
84.
85.
86.
87.
ЗПКГ выполняет критическую роль в развитии нервной системы у позвоночных.Около 50% всех нейронов гибнет через апоптоз
88.
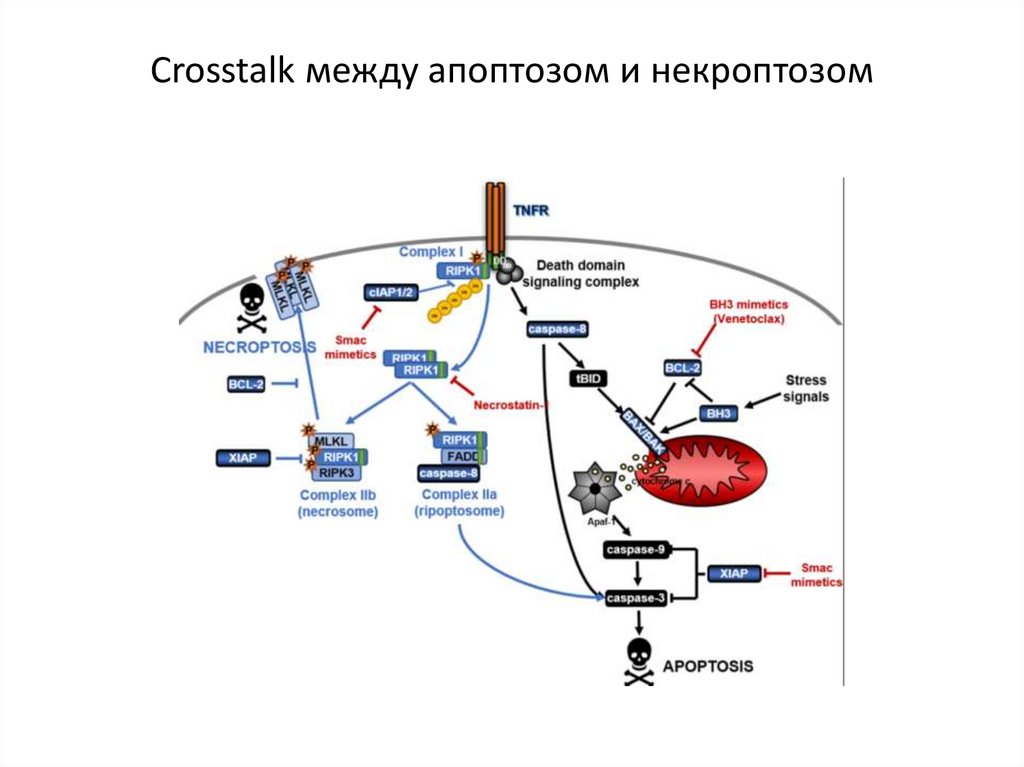
Crosstalk между апоптозом и некроптозом89.
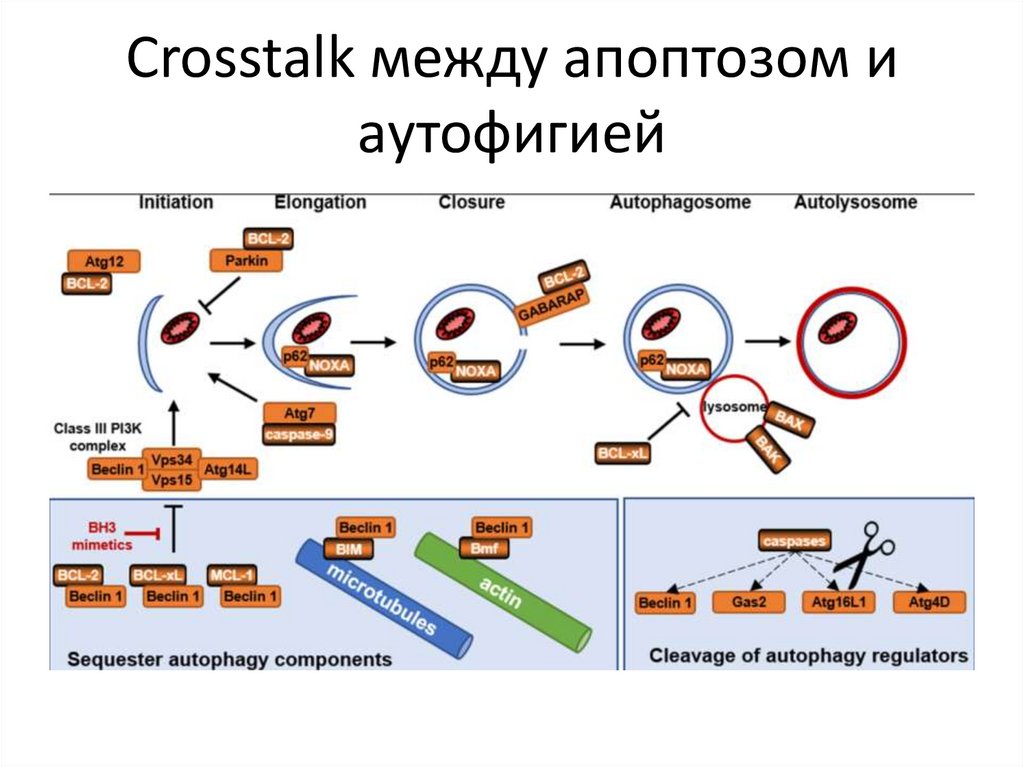
Crosstalk между апоптозом иаутофигией


















































 biology
biology