Similar presentations:
1.2.Лицензирование_Падыганова
1.
Лицензированиефармацевтической деятельности
2.
ПОСТАНОВЛЕНИЕПРАВИТЕЛЬСТВА РФ от 31.03.2022 г. N 547
Об утверждении положения о
лицензировании
фармацевтической деятельности
(с 01.09.2022 по 01.09.2028)
3.
ФАРМАЦЕВТИЧЕСКАЯ ДЕЯТЕЛЬНОСТЬВ СФЕРЕ ОБРАЩЕНИЯ ЛС
ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ:
Оптовая торговля ЛС для медицинского применения
2. Хранение ЛС для медицинского применения
3. Хранение ЛП для медицинского применения
4. Перевозка ЛС для медицинского применения
5. Перевозка ЛП для медицинского применения
6. Розничная торговля ЛП для медицинского применения
7. Отпуск ЛП для медицинского применения
8. Изготовление ЛП для медицинского применения
4.
Что следует понимать под«Фармацевтической организацией»?
Организации оптовой торговли и
аптечные организации в соответствии
с ФЗ «Об основах охраны здоровья
граждан в Российской Федерации»,
объединяются понятием
фармацевтические организации
ФО
Организации оптовой
торговли
Аптечные
организации
Приказ МЗ РФ от 31.07.2020 № 780н «Об утверждении видов аптечных организаций»
1. Аптека, осуществляющая розничную торговлю (отпуск) лекарственных препаратов населению:
готовых лекарственных форм;
Индивидуальные
производственная с правом изготовления лекарственных препаратов;
предприниматели, имеющие
производственная с правом изготовления асептических лекарственных препаратов.
2. Аптека как структурное подразделение медицинской организации:
готовых лекарственных форм;
производственная с правом изготовления лекарственных препаратов;
производственная с правом изготовления асептических лекарственных препаратов;
производственная с правом изготовления радиофармацевтических лекарственных препаратов.
3. Аптечный пункт, в том числе как структурное подразделение медицинской организации.
4. Аптечный киоск.
лицензию на
фармацевтическую
деятельность, в части
регулирования этой
деятельности
приравниваются к ФО
5.
Федеральный закон от 12.04.2010 №61- ФЗ «Обобращении лекарственных средств»
Фармацевтическая
деятельность
Аптечная
организация
Ветеринарная
аптечная организация
• Деятельность, включающая в себя оптовую торговлю ЛС, их
хранение, перевозку и (или) розничную торговлю ЛП, в том
числе дистанционным способом, их отпуск, хранение,
перевозку, изготовление ЛП
• Организация, структурное подразделение МО или
осуществляющая розничную торговлю ЛП, в том числе
дистанционным способом, хранение, перевозку,
изготовление и отпуск лекарственных препаратов для
медицинского применения
• Организация, структурное подразделение ветеринарной
организации, осуществляющие розничную торговлю
ЛП, в том числе дистанционным способом,
хранение, изготовление и отпуск лекарственных
препаратов для ветеринарного применения
6.
Федеральный закон от 04.05.2011 №99- ФЗ «Олицензировании отдельных видов деятельности»
Лицензирование
лицензирующие
органы
лицензия
деятельность лицензирующих органов по предоставлению, переоформлению лицензий,
продлению срока действия лицензий в случае, если ограничение срока действия лицензий
предусмотрено ФЗ, осуществлению лицензионного контроля, приостановлению, возобновлению,
прекращению действия и аннулированию лицензий, формированию и ведению реестра
лицензий, формированию государственного информационного ресурса, а также по
предоставлению в установленном порядке информации по вопросам лицензирования;
• уполномоченные ФОИВ и (или) их территориальные органы, а в случае передачи
осуществления полномочий Российской Федерации в области лицензирования
органам государственной власти субъектов Российской Федерации органы
исполнительной власти субъектов РФ, осуществляющие лицензирование;
• специальное разрешение на право осуществления ЮЛ или ИП конкретного
вида деятельности (выполнения работ, оказания услуг, составляющих
лицензируемый вид деятельности), которое подтверждается записью в
реестре лицензий;
7.
Федеральный закон от 04.05.2011 №99- ФЗ «Олицензировании отдельных видов деятельности»
соискатель
лицензии
лицензионные
требования
лицензиат
Юридическое лицо или инд. предприниматель,
обратившийся в лицензирующий орган с
заявлением о предоставлении лицензии
совокупность требований, которые установлены положениями о
лицензировании конкретных видов деятельности, основаны на
соответствующих требованиях законодательства РФ и направлены
на обеспечение достижения целей лицензирования;
юридическое лицо или индивидуальный предприниматель,
имеющие лицензию;
8.
Лицензирование фармацевтической деятельностиосуществляют следующие лицензирующие органы:
а) Федеральная служба по надзору в сфере здравоохранения - в части деятельности,
осуществляемой:
✓ организациями оптовой торговли ЛС для медицинского применения;
✓ АО, подведомственными федеральным органам исполнительной власти;
✓ иными организациями и ИП, осуществляющими фармацевтическую деятельность, в
части оценки соблюдения лицензиатами лицензионных требований посредством
осуществления федерального государственного контроля (надзора) в сфере
обращения ЛС;
б) органы исполнительной власти субъектов РФ - в части осуществления деятельности
в сфере обращения ЛС для медицинского применения…..
в) Федеральная служба по ветеринарному и фитосанитарному надзору - в части
деятельности, осуществляемой в сфере обращения ЛС для ветеринарного
применения.
ПП РФ от 31.03.2022 г. N 547 «Об утверждении положения о лицензировании фармацевтической деятельности»
9.
Кто осуществляет лицензирование?1) Росздравнадзор осуществляет лицензирование фармацевтической
деятельности в части деятельности, осуществляемой организациями
оптовой торговли лекарственными средствами для медицинского
применения;
2) территориальные органы осуществляют лицензирование
фармацевтической деятельности в части деятельности, осуществляемой
аптечными организациями, подведомственными федеральным органам
исполнительной власти.
Приказ Росздравнадзора от 23.11.2020 N 10935
"Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по предоставлению
государственной услуги по лицензированию фармацевтической деятельности, осуществляемой организациями оптовой торговли
лекарственными средствами для медицинского применения и аптечными организациями, подведомственными федеральным органам
исполнительной власти"
10.
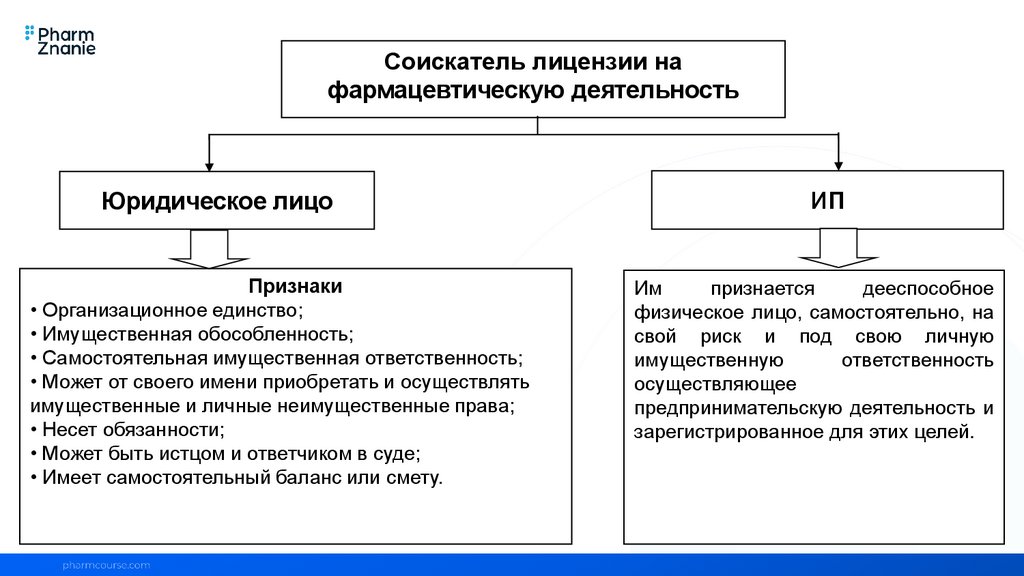
Соискатель лицензии нафармацевтическую деятельность
Юридическое лицо
Признаки
• Организационное единство;
• Имущественная обособленность;
• Самостоятельная имущественная ответственность;
• Может от своего имени приобретать и осуществлять
имущественные и личные неимущественные права;
• Несет обязанности;
• Может быть истцом и ответчиком в суде;
• Имеет самостоятельный баланс или смету.
ИП
Им
признается
дееспособное
физическое лицо, самостоятельно, на
свой риск и под свою личную
имущественную
ответственность
осуществляющее
предпринимательскую деятельность и
зарегистрированное для этих целей.
11.
ЛИЦЕНЗИОННЫЕ ТРЕБОВАНИЯ1. Наличие помещений и оборудования, необходимых
для выполнения работ, которые составляют
фармацевтическую деятельность, соответствующих
установленным требованиям
12.
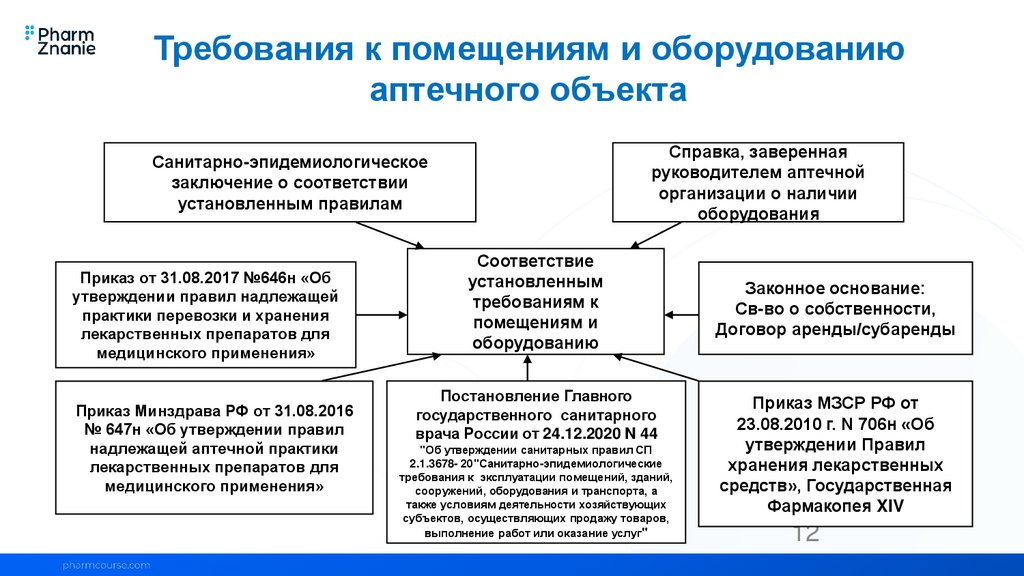
Требования к помещениям и оборудованиюаптечного объекта
Справка, заверенная
руководителем аптечной
организации о наличии
оборудования
Санитарно-эпидемиологическое
заключение о соответствии
установленным правилам
Приказ от 31.08.2017 №646н «Об
утверждении правил надлежащей
практики перевозки и хранения
лекарственных препаратов для
медицинского применения»
Приказ Минздрава РФ от 31.08.2016
№ 647н «Об утверждении правил
надлежащей аптечной практики
лекарственных препаратов для
медицинского применения»
Соответствие
установленным
требованиям к
помещениям и
оборудованию
Постановление Главного
государственного санитарного
врача России от 24.12.2020 N 44
"Об утверждении санитарных правил СП
2.1.3678- 20"Санитарно-эпидемиологические
требования к эксплуатации помещений, зданий,
сооружений, оборудования и транспорта, а
также условиям деятельности хозяйствующих
субъектов, осуществляющих продажу товаров,
выполнение работ или оказание услуг"
Законное основание:
Св-во о собственности,
Договор аренды/субаренды
Приказ МЗСР РФ от
23.08.2010 г. N 706н «Об
утверждении Правил
хранения лекарственных
средств», Государственная
Фармакопея XIV
12
13.
ПОСТАНОВЛЕНИЕ ГЛАВНОГО ГОСУДАРСТВЕННОГОСАНИТАРНОГО ВРАЧА РФ ОТ 24 ДЕКАБРЯ 2020 Г. № 44
V. Санитарно-эпидемиологические требования при предоставлении
услуг аптечными организациями.
Аптека должна располагать помещениями,
оборудованием,
инвентарем, позволяющими обеспечить хранение ИЛП и других ЛС, а
также сохранение качества, эффективности и безопасности ЛС, при
транспортировании (в случае осуществления аптекой данного вида
деятельности), хранении и реализации.
Аптека должна размещаться в изолированном блоке
помещений в
многоквартирных домах, общественных зданиях или в отдельно
стоящих зданиях.
14.
Санитарно-эпидемиологические требованияпри предоставлении услуг АО
Помещения аптек должны иметь естественное и
искусственное освещение. Естественное освещение может
отсутствовать в складских помещениях (без постоянного
рабочего места), кладовых, туалетах, гардеробных, душевых,
бытовых и вспомогательных помещениях.
15.
Санитарно-эпидемиологические требованияпри предоставлении услуг АО
Светильники общего и местного освещения должны иметь защитную
арматуру, позволяющую осуществить их влажную очистку.
Светильники общего освещения должны иметь сплошные (закрытые)
рассеиватели.
Помещения аптек оборудуются общеобменной вентиляцией с
естественным или механическим побуждением. В аптеках, не
осуществляющих изготовление ЛС, система вентиляции с
механическим побуждением может отсутствовать. Не допускается
отсутствие систем вентиляции с механическим побуждением в
помещениях с постоянными рабочими местами, не имеющих
естественного проветривания.
16.
Санитарно-эпидемиологические требованияпри предоставлении услуг АО
Поверхности мебели и оборудования должны
быть
устойчивы к воздействию моющих и дезинфицирующих
средств.
Помещения аптек должны подвергаться ежедневной
влажной уборке с применением моющих и
дезинфицирующих средств
Должна быть организована административно бытовая зона
для приема пищи и хранения личных вещей работников.
17.
ПРИКАЗОТ 31 АВГУСТА 2016 Г. N 647н
ПРАВИЛА
НАДЛЕЖАЩЕЙ АПТЕЧНОЙ ПРАКТИКИ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
18.
Требования к помещениям1.
2.
✓
✓
✓
Помещения должны соответствовать санитарно- гигиеническим
нормам и требованиям
Площадь помещений должна быть разделена на зоны,
предназначенные для выполнения следующих функций:
торговли ТАА с обеспечением мест хранения, не
допускающим свободного доступа покупателей к товарам,
отпускаемым, в том числе по рецепту;
приемки ТАА, зона карантинного хранения, в том числе отдельно
для ЛП;
раздельного хранения одежды работников.
19.
Требования к помещениямПомещения должны быть оснащены системами
отопления и
или приточно-вытяжной
кондиционирования, естественной
вентиляцией
Помещения
могут иметь как естественное, так и
искусственное освещение. Общее искусственное освещение
должно быть
предусмотрено во всех помещениях, для
отдельных
рабочих
мест
при
необходимости
предусматривается местное искусственное освещение.
20.
Требования к оборудованиюПомещения для хранения ЛП должны быть оснащены
оборудованием, позволяющим обеспечить их хранение с учетом
требований надлежащей практики хранения и перевозки ЛП (Пр
МЗ РФ № 646н)
Помещения,
а также оборудование, должны отвечать
санитарным требованиям, пожарной безопасности, а также
технике безопасности
21.
Требования к оборудованиюОборудование не должно загораживать
естественный или
искусственный источник света и загромождать проходы.
Оборудование
должно
иметь
технические
паспорта,
хранящиеся в течение всего времени эксплуатации
оборудования.
Торговое помещение и (или) зона должны быть оборудованы
витринами, стеллажами (гондолами), обеспечивающими
возможность обзора товаров аптечного ассортимента
22.
ПРИКАЗ МИНЗДРАВА РОССИИ ОТ31.08.2016 N 646н
Об утверждении Правил надлежащей
практики хранения и перевозки
лекарственных препаратов для
медицинского применения
23.
Требования к помещениямПлощадь помещений должна быть разделена на зоны,
предназначенные для выполнения следующих функций:
приемки лекарственных препаратов;
хранения ЛП, требующих специальных условий;
хранения выявленных фальсифицированных,
недоброкачественных, контрафактных ЛП, а также ЛП с
истекшим сроком годности;
карантинного хранения ЛП.
Административно-бытовые помещения отделяются от зон
хранения ЛП
24.
Требования к помещениямВ помещениях для хранения ЛП запрещается хранение пищевых
продуктов, табачных изделий, напитков, за исключением
питьевой воды, а также ЛП, предназначенных для личного
использования работниками.
В помещениях и (или) зонах должны поддерживаться
температурные режимы хранения и влажность, соответствующие
условиям хранения, указанным в нормативной документации,
составляющей регистрационное досье ЛП, инструкции по
медицинскому применению ЛП и на упаковке ЛП
25.
Требования к помещениям и оборудованиюОтделка помещений (внутренние поверхности
стен,
потолков) для хранения ЛП должна допускать возможность
проведения влажной уборки и исключать накопление пыли.
Оборудование, инвентарь и материалы для
уборки (очистки),
а также моющие и дезинфицирующие средства должны
храниться в отдельных зонах (шкафах).
26.
Требования к помещениям и оборудованиюПомещения для хранения ЛП должны быть
спроектированы и оснащены таким образом, чтобы
обеспечить защиту от проникновения насекомых,
грызунов или других животных.
В помещения (зоны) для хранения ЛП не допускаются
лица, не имеющие права доступа, определенного
стандартными операционными процедурами.
27.
Состав помещений/зон/рабочих мест в АОп. 24 Приказа МЗ РФ № 647н и п. 15 Приказа МЗ РФ № 646н,
Государственная Фармакопея XIV издания
Зоны (отдельные помещения) в помещениях субъекта розничной торговли,
предназначенные для выполнения следующих функций:
- зона приемки ТАА,
- зона хранения ЛП, требующих специальных условий;
- зона карантинного хранения ЛП;
- зона карантинного хранения других товаров АА;
- зона хранения выявленных фальсифицированных,
недоброкачественных, контрафактных ЛП, а также ЛП с истекшим сроком
годности;
- зона торговли ТАА с обеспечением мест хранения, не допускающим свободного
доступа покупателей к товарам, отпускаемым, в том числе по рецепту;
- зона раздельного хранения одежды работников.
28.
Зоны (помещения)хранения ЛП
Доступ в зоны (помещения) должны иметь только лица,
уполномоченные руководителем (п. 32 приказа 647н и п. 27 приказа 646н)
Охранная система и система контроля доступа (п. 35, 37 приказа 646н)
В помещениях и (или) зонах должны поддерживаться температурные режимы
хранения и влажность, соответствующие условиям хранения, указанным в
нормативной документации, составляющей регистрационное досье ЛП (п. 21
приказа 646н)
Отделка помещений:
соблюдение санитарно-гигиенических требований (возможность проведения
влажной уборки и исключение накопления пыли)
соблюдение требований пожарной безопасности (п. 27 приказа 647н и п. 25 приказа
646н)
Помещения должны быть спроектированы и оснащены таким образом, чтобы
обеспечить защиту от проникновения насекомых, грызунов или других животных
(п. 27 приказа 647н и п. 26 приказа 646н)
29.
Требования НПД, предъявляемыек оборудованию при хранении ЛП
Стеллажи, шкафы, сейфы, поддоны, подтоварники
Системы кондиционирования
Холодильные камеры и (или) холодильники
Охранная и пожарная сигнализация
Системы контроля доступа
Вентиляционная система
Термогигрометры (психрометры) или иное оборудование, используемое для
регистрации температуры и влажности.
(п. 37, 48 приказа 646н, п. 4,5 приказа № 706 н, ОФС. 1.1.0010.18)
Установка оборудования должна производиться на расстоянии не менее 0,5 метров от стен или
другого оборудования, чтобы иметь доступ для очистки, дезинфекции, ремонта, технического
обслуживания, поверки и (или) калибровки оборудования, обеспечивать доступ к товарам
аптечного ассортимента, свободный проход работников.
Оборудование не должно загораживать естественный или искусственный источник света и
загромождать проходы (п. 31 приказа 647н).
30.
Требования к помещениям и оборудованиюСтеллажи (шкафы) для хранения ЛП должны
быть маркированы,
иметь стеллажные карты, находящиеся в видимой зоне,
обеспечивать идентификацию ЛП в соответствии с применяемой
субъектом обращения лекарственных препаратов системой учета.
Допускается применение электронной системы обработки данных
вместо стеллажных карт. При использовании электронной
системы обработки данных допускается идентификация при
помощи кодов
31.
Оборудование для хранения ЛСсистемы кондиционирования;
холодильные камеры и (или) холодильники;
охранная и пожарная сигнализация;
системы контроля доступа;
вентиляционная система;
термогигрометры (психрометры) или иное
оборудование, используемое для регистрации
температуры и влажности.
32.
Оборудование для хранения ЛСОборудование, относящееся к средствам измерений, до
ввода в эксплуатацию, а также после ремонта подлежит
первичной поверке и (или) калибровке, а в процессе
эксплуатации - периодической поверке и (или) калибровке в
соответствии с требованиями законодательства РФ об
обеспечении единства измерений
33.
Лицензионные требования2. Соблюдение лицензиатом, осуществляющим
оптовую торговлю лекарственными средствами:
требований статей 53 и 54 ФЗ №61 и части 7 статьи 67 ФЗ
№61
правил надлежащей дистрибьюторской практики ЛП для
медицинского применения,
правил надлежащей практики хранения и
перевозки ЛП для медицинского применения,
34.
Лицензионные требованияНаличие в соответствии с правилами надлежащей практики хранения и
перевозки ЛП, правилами надлежащей дистрибьюторской практики в
рамках Евразийского экономического союза лица, ответственного за
внедрение и обеспечение системы качества хранения и перевозки
лекарственных препаратов и актуализацию стандартных
операционных процедур для осуществления фармацевтической
деятельности в сфере обращения ЛС для медицинского
применения;
35.
Лицензионные требования при оптовой продаже ЛССтатья 53. Продажа, передача лекарственных средств организациями
оптовой торговли лекарственными средствами
(Федеральный закон № 61-ФЗ «Об обращении лекарственных средств»)
Организации оптовой торговли ЛС могут продавать ЛС или передавать их:
1) другим организациям оптовой торговли ЛС;
2) производителям ЛС для целей производства ЛС;
3) аптечным организациям и ветеринарным АО;
4) научно-исследовательским учреждениям для научноисследовательской работы;
5) индивидуальным предпринимателям, имеющим лицензии на
фармацевтическую деятельность или лицензию на медицинскую
деятельность;
6) медицинским организациям, ветеринарным организациям;
36.
Лицензионные требования при оптовой продаже ЛС –соблюдение требований
• Правил надлежащей дистрибьюторской практики лекарственных препаратов для
медицинского применения (Решение Совета ЕЭК № 80 от 03.11.2016 г. «Об
утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского
экономического союза»
• Правил надлежащей практики хранения и перевозки лекарственных препаратов
для медицинского применения (Приказ МЗ РФ от 31.08.2016. № 646н)
• Приказа Минздрава РФ от 17.06.2013 № 378н «Об утверждении правил
регистрации операций, связанных с обращением ЛС для медицинского
применения, включенных в перечень лекарственных средств для медицинского
применения, подлежащих предметно-количественному учету, в специальных
журналах учета…, и правил ведения и хранения специальных журналов учета
операций…»
37.
Часть 7 статьи 67 ФЗ «Об обращении ЛС»С 01.07.2020)
Юридические лица и индивидуальные предприниматели,
осуществляющие производство, хранение, ввоз в РФ, отпуск,
реализацию, передачу, применение и уничтожение ЛП для
медицинского применения, обеспечивают в порядке и в составе,
которые установлены Правительством РФ с учетом вида
осуществляемой ими деятельности, внесение информации о ЛП для
медицинского применения в систему мониторинга движения ЛП для
медицинского применения.
38.
ЛИЦЕНЗИОННЫЕ ТРЕБОВАНИЯ2. Соблюдение лицензиатом, осуществляющим
розничную торговлю ЛП для медицинского применения:
правил надлежащей аптечной практики,
правил надлежащей практики хранения и перевозки ЛП,
правил отпуска ЛП,
правил отпуска наркотических средств и
психотропных веществ, зарегистрированных в качестве ЛП
части 7 статьи 67 Федерального закона «Об
обращении лекарственных средств»
39.
Лицензионные требования при розничной продажеЛП аптечными организациями
- Правила НАП лекарственных препаратов для медицинского применения (Приказ МЗ РФ от
31.08.2016 г. № 647н)
- Правила надлежащей практики хранения и перевозки лекарственных препаратов для
медицинского применения (Приказ МЗ РФ от 31.08.2016 г. № 646н)
- Правила и порядок отпуска ЛП, в т.ч. наркотических и психотропных:
✓ Приказ Минздрава РФ № 1094н от 24.11.2021;
✓ Приказ Минздрава РФ № 1093н от 24.11.2021 «Об утверждении правил отпуска лекарственных
препаратов для медицинского применения ….»
✓ Приказ Минздрава РФ № 183н от 22.04.2014 «Об утверждении перечня ЛС для медицинского
применения, подлежащих ПКУ»
- Правила регистрации операций и правила ведения и хранения специальных журналов учета
операций, связанных с обращением ЛП, подлежащих ПКУ:
✓ Приказ Минздрава РФ № 378н от 17.06.2013
✓ Статья 55. Порядок розничной торговли лекарственными препаратами Федеральный закон "Об
обращении лекарственных средств« (извлечения)
40.
ЛИЦЕНЗИОННЫЕ ТРЕБОВАНИЯ3. Соблюдение правил регистрации операций, связанных с
обращением ЛС, подлежащих предметно-количественному
учету, в специальных журналах учета операций, связанных
с обращением ЛС, правил ведения и хранения
специальных журналов учета операций, связанных с
обращением ЛС
41.
НПА, регламентирующие порядок ПКУ ЛПв фармацевтических организациях
➢ Статья 58.1 Федерального закона РФ от 12.04.2010 г. № 61-ФЗ «Об обращении
лекарственных средств».
➢ Постановление Правительства РФ от 30.11.2021 г. № 2117 «О порядке
представления сведений о деятельности, связанной с оборотом наркотических средств
и психотропных веществ, и регистрации операций, связанных с оборотом
наркотических средств и психотропных веществ» (Срок действия документа ограничен
1 марта 2028 года).
➢ Постановление Правительства РФ от 28.10.2021 г. № 1846 «О предоставлении
сведений о деятельности, связанной с оборотом прекурсоров наркотических средств и
психотропных веществ, и регистрации операций, связанных с их оборотом» (Срок
действия документа ограничен 1 марта 2028 года).
42.
ПРИКАЗ МИНЗДРАВА РОССИИ ОТ 22.04.2014N 183Н
(В РЕД. ПРИКАЗА МИНЗДРАВА РОССИИ ОТ
27 ИЮЛЯ 2018 Г. N 471н)
Об утверждении перечня лекарственных
средств для медицинского применения,
подлежащих предметно-количественному
учету.
43.
I. Лекарственные средства – фармацевтические субстанции и ЛП,содержащие наркотические средства, психотропные вещества и их
прекурсоры (их соли, изомеры, стереоизомеры) и включенные в Списки II,
III, IV Перечня наркотических средств, психотропных веществ и их
прекурсоров, подлежащих контролю в РФ, утвержденного Постановлением
Правительства РФ от 30 июня 1998 г. N 681, в сочетании с
фармакологически неактивными веществами, а также ЛП, содержащие
наркотические средства, психотропные вещества и их прекурсоры в
сочетании с фармакологически активными веществами:
Список II: Бупренорфин, Морфин, Омнопон, Промедол и др.
Список III: Диазепам, Клоназепам, Золпидем и др.
Список IV: Перманганат калия, Эргометрин, Эфедрин и др.
44.
II. Лекарственные средства - фармацевтические субстанции и ЛП,содержащие сильнодействующие и ядовитые вещества, внесенные в списки
сильнодействующих и ядовитых веществ для целей Статьи 234 и других
статей УК РФ, утвержденные Постановлением Правительства РФ от 29
декабря 2007 г. № 964, в сочетании с фармакологически неактивными
веществами, а также лекарственные
препараты, содержащие сильнодействующие и ядовитые
вещества в сочетании с фармакологически активными
веществами (при условии включения их в перечень отдельной позицией):
Сильнодействующие: клонидин, трамадол, сибутрамин,
прегабалин, тропикамид и др.
Ядовитые: спирт этиловый, сумма алкалоидов красавки
экстракт чилибухи и др.
тапентадол,
45.
III. Комбинированные ЛП, содержащие кроме малых количествнаркотических средств, психотропных веществ и их прекурсоров другие
фармакологически активные вещества (пункт 5 Порядка отпуска физическим
лицам ЛП для медицинского применения, содержащих кроме малых
количеств наркотических средств, психотропных веществ и их прекурсоров
другие фармакологически активные вещества, утвержденного приказом
МЗиСР РФ от 17 мая 2012г. N 562н
кодеин или его соли в количестве до 20 мг на 1 дозу
твердой
лекарственной формы
эфедрина гидрохлорид в количестве до 50 мг
включительно (на 1 дозу твердой лекарственной формы) и др.
46.
IV. Иные лекарственные средства, подлежащие предметноколичественному учету:Циклопентолат (лекарственные препараты)
47.
Порядок предметно-количественногоучета ЛП
Приказ Минздрава России от 17.06.2013 N 378н "Об утверждении
правил регистрации операций, связанных с обращением ЛС для
медицинского применения, включенных в перечень ЛС для
медицинского применения, подлежащих предметно-количественному
учету, в специальных журналах учета операций, связанных с
обращением ЛС для медицинского применения, и правил ведения и
хранения специальных журналов учета операций, связанных с
обращением ЛС для медицинского применения"
(попал под действие регуляторной гильотины)
48.
Формы журналов регистрацииЖурнал регистрации операций, связанных с оборотом наркотических
средств и психотропных веществ (Постановление Правительства РФ от
30 ноября 2021 г. N 2117) (действует до 01.03.2028)
Журнал регистрации операций, при которых изменяется количество
прекурсоров наркотических средств и психотропных веществ
(Постановление Правительства РФ от 28.10.2021г. N 1846) (действует до
01.03.2028)
Журнал учета операций, связанных с обращением лекарственных
средств для медицинского применения (приказ Минздрава России от
17.06.2013 N 378н) (попал под действие регуляторной гильотины)
49.
ЛИЦЕНЗИОННЫЕ ТРЕБОВАНИЯ4. Соблюдение требований части 6 статьи 55 Федерального
закона «Об обращении лекарственных средств»
(минимальный ассортимент)
50.
Распоряжение Правительства РФот 12.10.2019 N 2406-Р
(с изменениями на основании распоряжения
Правительства РФ от 24.08.2022 N 2419-р.)
Минимальный ассортимент ЛП, необходимых для
оказания медицинской помощи:
1. Для аптек (готовых лекарственных форм, производственных,
производственных с правом изготовления асептических ЛП)
2. Для аптечных пунктов, аптечных киосков и индивидуальных
предпринимателей, имеющих лицензию на фармацевтическую
деятельность
51.
Лицензионные требования5. Соблюдение лицензиатом, осуществляющим изготовление
ЛП, правил изготовления и отпуска лекарственных препаратов
для медицинского применения
52.
Изготовление ЛППриказ Минздрава России от 22.05.2023 N 249н
"Об утверждении правил изготовления и отпуска
ЛП для медицинского применения"
53.
Лицензионные требования при изготовлениилекарственных препаратов
Статья 56. Изготовление и отпуск лекарственных препаратов
Федеральный закон "Об обращении лекарственных средств" (извлечения)
Изготовление лекарственных препаратов аптечными организациями, индивидуальными
предпринимателями, имеющими лицензию на фармацевтическую деятельность, осуществляется по
рецептам на лекарственные препараты, по требованиям медицинских организаций
53) рецепт на лекарственный препарат - медицинский документ установленной формы,
содержащий назначение лекарственного препарата для медицинского применения, выданный
медицинским работником в целях отпуска лекарственного препарата или его изготовления и отпуска
на бумажном носителе или с согласия пациента или его законного представителя в форме
электронного документа, подписанного с использованием усиленной квалифицированной
электронной подписи медицинского работника, либо документ установленной формы, содержащий
назначение лекарственного препарата для ветеринарного применения, выданный специалистом в
области ветеринарии в целях отпуска лекарственного препарата или его изготовления и отпуска на
бумажном носителе;
(в ред. Федеральных законов от 29.07.2017 N 242-ФЗ, от 02.08.2019 N 297-ФЗ)
54.
Лицензионные требования при изготовлениилекарственных препаратов
Статья 56. Изготовление и отпуск лекарственных препаратов
Федеральный закон "Об обращении лекарственных средств"
(извлечения)
Изготовление лекарственных препаратов аптечными организациями,
индивидуальными предпринимателями, имеющими лицензию на фармацевтическую
деятельность, осуществляется по рецептам на лекарственные препараты, по
требованиям медицинских организаций
54) требование медицинской организации, - документ установленной формы, который
выписан медицинским работником, имеющими на это право, и содержит в письменной
форме указание аптечной организации об отпуске лекарственного препарата или о его
изготовлении и об отпуске для обеспечения лечебного процесса в медицинской
организации,.
(в ред. Федерального закона от 02.08.2019 N 297-ФЗ)
55.
Лицензионные требования при изготовлениилекарственных препаратов
Статья 56. Изготовление и отпуск лекарственных препаратов
Федеральный закон "Об обращении лекарственных средств"
(извлечения)
При изготовлении лекарственных препаратов аптечными организациями,
индивидуальными предпринимателями, имеющими лицензию на
фармацевтическую деятельность, используются фармацевтические
субстанции, включенные в государственный реестр ЛС.
Не допускается изготовление аптечными организациями,
индивидуальными
предпринимателями,
имеющими
лицензию
на
фармацевтическую
деятельность,
лекарственных
препаратов,
зарегистрированных в РФ.
56.
Лицензионные требования6. Соблюдение требований статьи 57 Федерального закона «Об
обращении лекарственных средств»
(Продажа фальсифицированных лекарственных средств,
недоброкачественных лекарственных средств, контрафактных
лекарственных средств запрещается)
57.
Лицензионные требования о запрещении продажифальсифицированных, недоброкачественных,
контрафактных ЛС (ст.57 закона № 61-ФЗ)
Недоброкачественные, фальсифицированные и контрафактные ЛС подлежат
изъятию из гражданского оборота и уничтожению в порядке, установленном
Правительством РФ
Статья 59. Основание и порядок уничтожения
лекарственных средств Федерального закона № 61-ФЗ
"Об обращении лекарственных средств"
Постановление Правительства РФ от 15 сентября 2020 г. № 1447 "Об
утверждении Правил уничтожения изъятых фальсифицированных
лекарственных средств, недоброкачественных лекарственных средств и
контрафактных лекарственных средств”
58.
Лицензионные требования7. Соблюдение лицензиатом, осуществляющим
хранение ЛС, правил хранения лекарственных
средств для медицинского применения
59.
Нормативно-правовые документы, регулирующиехранение ЛС
ГФ IV - ОФС. Хранение лекарственных средств
Пр МЗ СР от 23.08.2010 № 706н «Правила хранения лекарственных
средств»
Пр МЗ РФ от 31.08.2016 № 646н «Об утверждении Правил надлежащей
практики хранения и перевозки ЛП для медицинского применения»
Пр МЗ РФ от 31.08.2016 N 647н «Об утверждении Правил надлежащей
аптечной практики ЛП для медицинского применения»
СанПиН 3.3686-21 Об утверждении санитарных правил и норм
"Санитарно-эпидемиологические
требования
по
профилактике
инфекционных болезней"
60.
Лицензионные требования8. наличие у индивидуального предпринимателя
для осуществления фармацевтической деятельности в сфере
обращения лекарственных средств для медицинского
применения
o высшего или среднего фармацевтического образования,
o а также сертификата специалиста или пройденной
аккредитации специалиста;
61.
Лицензионные требования для руководителяорганизации (соискатель и лицензиат)
отсутствуют
62.
Лицензионные требования9. Наличие у лицензиата работников, заключивших с ним
трудовые договоры, деятельность которых непосредственно
связана с оптовой или розничной торговлей ЛП, их отпуском,
хранением и изготовлением, имеющих:
o высшее или среднее фармацевтическое образование
o сертификат специалиста (или пройденную аккредитацию
специалиста
63.
Квалификационные требования кспециалистам с высшим фарм. образованием
Приказ МЗ РФ №
отот
02.05.2023
г. г.
Приказ
02.05.2023
206н
МЗ РФ No206н
Специальность «Фармацевтическая технология»
Уровень профессионального
образования
Высшее образование - специалитет по специальности
"Фармация"
Интернатура/ординатура по специальности
«Фармацевтическая технология»
Дополнительное
профессиональное
образование
Должности
Повышение квалификации
не реже 1 раза в 5 лет в течение трудовой деятельности
-
провизор-технолог
заведующий (начальник)
структурного подразделения (отдела) АО
64.
Квалификационные требования к специалистамс высшим фарм. образованием
Специальность «Фармация»
No 206н
МЗ РФ
ПриказПриказ
МЗ РФ
№ 206н
от 02.05.2023 г.
Уровень
профессионального
образования
Доп. проф.
образование
Должности
Высшее образование – специалитет по специальности "Фармация"
Повышение квалификации не реже 1 раза в 5 лет в течение всей трудовой деятельности
-
провизор
65.
Профессиональный стандарт ПровизорПриказ Минтруда от 09.03.2016 г № 91н
Обобщенная
трудовая функция
Квалифицированная
фармацевтическая
помощь
-населению,
-пациентам МО, работы,
услуги по доведению
лекарственных препаратов,
медицинских изделий,
других товаров,
разрешенных к отпуску в
аптечных организациях, до
конечного
потребителя
Возможные
Трудовые функции
наименования
должностей
провизор,
провизортехнолог
Оптовая, розничная торговля, отпуск лекарственных
препаратов и других товаров аптечного ассортимента
Проведение приемочного контроля поступающих в
организацию лекарственных средств и других товаров
аптечного ассортимента
Обеспечение хранения лекарственных средств и других
товаров аптечного ассортимента
Информирование населения и медицинских работников
о лекарственных препаратах и других товарах аптечного
ассортимента
Изготовление лекарственных препаратов в
условиях аптечных организаций
Требования к
образованию и
обучению
Высшее
образование специалитет
Повышение
квалификации не
реже одного раза в 5
лет в течение всей
трудовой
деятельности
66.
Квалификационные требования кспециалистам с высшим фарм. образованием
Специальность «Фармацевтическая химия и фармакогнозия»
Приказ МЗ РФПриказ
№ 206н
г.
М от
No02.05.2023
206н
Высшее образование - специалитет по специальности "Фармация"
Уровень
профессионального
образования
Доп. проф.
образование
Подготовка в интернатуре/ординатуре по специальности Фармацевтическая химия и фармакогнозия или
Профессиональная переподготовка при наличии сведений о прохождении аккредитации специалиста
по специальности Фармация и (или) подготовки в интернатуре/ординатуре по специальности УЭФ
Повышение квалификации
не реже 1 раза в 5 лет в течение трудовой деятельности
- провизор-аналитик;
Должности
- заведующий (начальник) структурного подразделения (отдела) аптечной организации
67.
Приказ Минтруда от 22.05.2017 г № 427нПрофстандарт «ПРОВИЗОР-АНАЛИТИК»
Возможные наименования
должностей, профессий
Возможные наименования должностей, профессий Провизор-аналитик
Заведующий (начальник) структурного подразделения (отдела) аптечной организации
Требования к образованию и обучению
Высшее образование по специальности "Фармация"
Интернатура/ординатура по специальности
"Фармацевтическая химия и фармакогнозия"
Требования к опыту практической работы
Особые условия допуска к работе
Прохождение обязательных предварительных (при
поступлении на работу) и периодических медицинских осмотров (обследований), а также
внеочередных
медицинских осмотров (обследований) в порядке,
установленном законодательством РФ
Прохождение обучения по охране труда, пожарной безопасности, подготовка в области
защиты от
чрезвычайных ситуаций
Наличие свидетельства об аккредитации/сертификата
специалиста
Другие характеристики
Повышение квалификации не реже одного раза в пять лет в течение всей трудовой
деятельности
68.
МИНИСТЕРСТВО ТРУДА И СОЦИАЛЬНОЙ ЗАЩИТЫРОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 31 мая 2021 г. N 349н
(вступил в силу 01.03.2022)
ОБ УТВЕРЖДЕНИИ ПРОФЕССИОНАЛЬНОГО
СТАНДАРТА «ФАРМАЦЕВТ»
69.
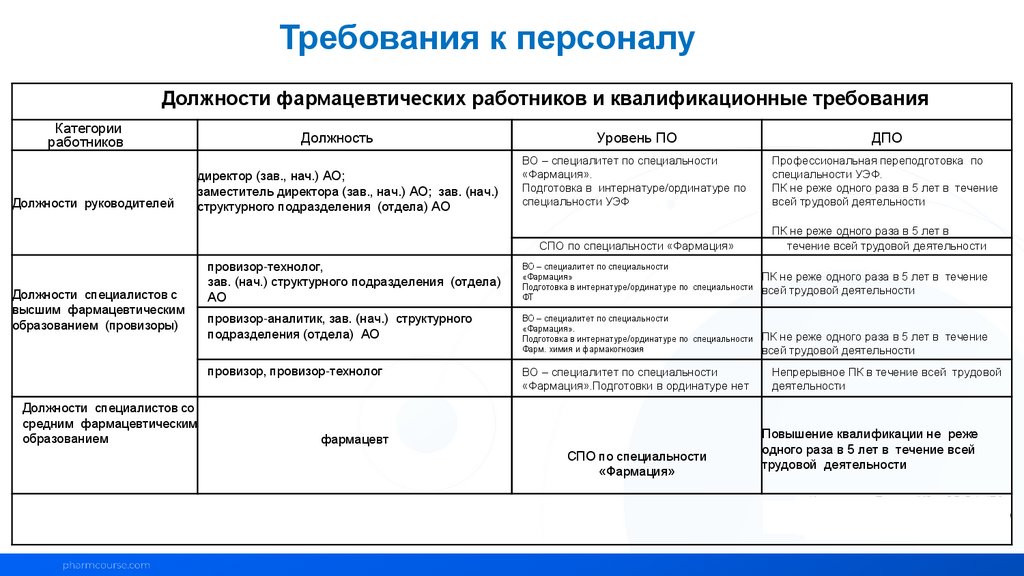
Требования к персоналуДолжности фармацевтических работников и квалификационные требования
Категории
работников
Должности руководителей
Должности специалистов с
высшим фармацевтическим
образованием (провизоры)
Должности специалистов со
средним фармацевтическим
образованием
Должность
директор (зав., нач.) АО;
заместитель директора (зав., нач.) АО; зав. (нач.)
структурного подразделения (отдела) АО
Уровень ПО
ДПО
ВО – специалитет по специальности
«Фармация».
Подготовка в интернатуре/ординатуре по
специальности УЭФ
Профессиональная переподготовка по
специальности УЭФ.
ПК не реже одного раза в 5 лет в течение
всей трудовой деятельности
СПО по специальности «Фармация»
ПК не реже одного раза в 5 лет в
течение всей трудовой деятельности
провизор-технолог,
зав. (нач.) структурного подразделения (отдела)
АО
ВО – специалитет по специальности
«Фармация»
Подготовка в интернатуре/ординатуре по специальности
ФТ
провизор-аналитик, зав. (нач.) структурного
подразделения (отдела) АО
ВО – специалитет по специальности
«Фармация».
Подготовка в интернатуре/ординатуре по специальности
Фарм. химия и фармакогнозия
провизор, провизор-технолог
ВО – специалитет по специальности
«Фармация».Подготовки в ординатуре нет
фармацевт
СПО по специальности
«Фармация»
ПК не реже одного раза в 5 лет в течение
всей трудовой деятельности
ПК не реже одного раза в 5 лет в течение
всей трудовой деятельности
Непрерывное ПК в течение всей трудовой
деятельности
Повышение квалификации не реже
одного раза в 5 лет в течение всей
трудовой деятельности
Источники: Приказ МЗ и СР РФ 176н,
Приказ МЗ РФ №707н, Приказ МЗ РФ №83н
70.
Лицензионные требования10. Повышение квалификации специалистов с
фармацевтическим образованием не реже 1 раза в 5 лет.
71.
Приказ Федеральной службы по надзору в сфере здравоохраненияот 26
2022 года
отавгуста
19 января
2022№г.7974
N 195
Об утверждении форм оценочных листов, в соответствии с которыми
федеральной службой по надзору в сфере здравоохранения и ее ТО
проводится оценка соответствия соискателя лицензии или лицензиата
лицензионным требованиям при осуществлении фармдеятельности
Начало действия документа - 08.03.2022.
В соответствии с частью 8 статьи 19.1 Федерального закона от 4 мая 2011 г. N 99-ФЗ "О лицензировании отдельных
видов деятельности" (Собрание законодательства Российской Федерации, 2011, N 19, ст. 2716; 2021, N 24, ст.
4188), подпунктом "а" пункта 3 Положения о лицензировании фармацевтической деятельности, утвержденного
постановлением Правительства Российской Федерации от 22 декабря 2011 г. N 1081 "О лицензировании
фармацевтической деятельности" (Собрание законодательства Российской Федерации, 2012, N 1, ст. 126),
приказываю:
1. Утвердить прилагаемую форму оценочного листа, в соответствии с которым Федеральной службой по надзору в
сфере здравоохранения и ее территориальными органами проводится оценка соответствия соискателя лицензии
или лицензиата лицензионным требованиям при осуществлении фармацевтической деятельности организациями
оптовой торговли лекарственными средствами для медицинского применения (приложение N 1);
2. Утвердить прилагаемую форму оценочного листа, в соответствии с которым Федеральной службой по надзору в
сфере здравоохранения и ее территориальными органами проводится оценка соответствия соискателя лицензии
или лицензиата лицензионным требованиям при осуществлении фармацевтической деятельности аптечными
организациями, подведомственными федеральным органам исполнительной власти (приложению N 2).
72.
Приказ от 19 января 2022 г. N 196Об утверждении формы оценочного листа, в соответствии с которым
Федеральной службой по надзору в сфере здравоохранения и ее ТО
проводится оценка соответствия соискателя лицензии или лицензиата
лицензионным требованиям при осуществлении деятельности по обороту НС,
ПВ и их прекурсоров, культивированию наркосодержащих растений
В соответствии с частью 8 статьи 19.1 Федерального закона от 4 мая 2011 г. N 99-ФЗ "О
лицензировании отдельных видов деятельности" (Собрание законодательства Российской
Федерации, 2011, N 19, ст. 2716; 2021, N 24, ст. 4188), подпунктом "а" пункта 3 Положения о
лицензировании деятельности по обороту наркотических средств, психотропных веществ и их
прекурсоров, культивированию наркосодержащих растений, утвержденного постановлением
Правительства Российской Федерации от 22 декабря 2011 г. N 1085 (Собрание законодательства
Российской Федерации, 2012, N 1, ст. 130; 2016, N 40, ст. 5738), приказываю:
Утвердить прилагаемую форму оценочного листа, в соответствии с которым Федеральной
службой по надзору в сфере здравоохранения и ее территориальными органами проводится
оценка соответствия соискателя лицензии или лицензиата лицензионным требованиям при
осуществлении деятельности по обороту наркотических средств, психотропных веществ и их
прекурсоров, культивированию наркосодержащих растений.
73.
Действие лицензии на фармацевтическую деятельность1. Лицензия предоставляется на каждый вид деятельности.
2. Юридическое лицо или индивидуальный предприниматель, получившие
лицензию, вправе осуществлять деятельность, на которую предоставлена
лицензия, на всей территории РФ.
3. Лицензия действует бессрочно.
4. Деятельность, на осуществление которой лицензия предоставлена
лицензирующим органом субъекта РФ, может осуществляться на территориях
других субъектов РФ при условии уведомления.
74.
Действие лицензии на фармацевтическуюдеятельность
5. Принятие решения о переоформлении (об отказе в переоформлении) лицензии
(в случаях реорганизации юридического лица в форме преобразования, слияния,
изменения его наименования, адреса места нахождения, прекращения
деятельности по одному или нескольким адресам) - 10 рабочих дней со дня
поступления надлежащим образом оформленного заявления о переоформлении
лицензии и документов
6. Принятие решения о переоформлении (об отказе в переоформлении) лицензии
(в случаях изменения адресов мест осуществления юридическим лицом
лицензируемого вида деятельности, перечня выполняемых работ, составляющих
лицензируемый вид деятельности) - 30 рабочих дней со дня поступления
надлежащим образом оформленного заявления о переоформлении лицензии и
документов
7. За предоставление лицензии, переоформление лицензии, выдачу дубликата
лицензии уплачивается государственная пошлина в размерах и в порядке, которые
установлены законодательством РФ о налогах и сборах
75.
КОДЕКС РОССИЙСКОЙФЕДЕРАЦИИ
ОБ АДМИНИСТРАТИВНЫХ
ПРАВОНАРУШЕНИЯХ
ОТ 30.12.2001 N 195-ФЗ
(в ред. 04.02.2021)
76.
КоАП РФ СТАТЬЯ 14.1.Осуществление предпринимательской деятельности с
нарушением требований и условий, предусмотренных
лицензией, влечет предупреждение или наложение
административного штрафа:
на граждан в размере от 1500 до 2000 руб.;
на должностных лиц – от 3000 до 4000 руб.;
на юридических лиц – от 30 000 до 40 000 руб.
77.
КоАП РФ СТАТЬЯ 14.1.Осуществление предпринимательской деятельности с грубым
нарушением требований, предусмотренных лицензией, влечет
наложение административного штрафа:
на лиц, осуществляющих предпринимательскую
деятельность без
образования юридического лица, в размере от 4000 до 8000 руб. или
административное приостановление деятельности на срок до 90 суток;
на должностных лиц - от 5000 до 10 000 руб.;
на юридических лиц - от 100 000 до 200 000 руб. или
административное приостановление деятельности на срок до 90 суток.
78.
КоАП РФ Статья 14.4.2.Нарушение законодательства об обращении ЛС
Нарушение установленных правил оптовой торговли ЛС и порядка
розничной торговли ЛП влечет наложение административного
штрафа:
на граждан в размере от 1500 до
3000 руб.;
на должностных лиц – от 5000 до
10 000 руб.;
на юридических лиц – от 20 000
до 30 000 руб.
79.
КоАП РФ Статья 14.4.2Реализация либо отпуск ЛП
с
нарушением требований законодательства об
обращении ЛС в части установления предельных размеров оптовых надбавок к
фактическим отпускным ценам, установленным производителями на указанные ЛП,
или розничных надбавок к фактическим отпускным
ценам, установленным
производителями на указанные ЛП
влечет наложение административного штрафа:
на должностных лиц в размере от 250 тысяч до 500 тысяч рублей;
на лиц, осуществляющих предпринимательскую деятельность без
образования
юридического лица, - в двукратном размере излишне полученной выручки от
реализации ЛП вследствие неправомерного завышения регулируемых государством
цен за весь период, в течение которого совершалось правонарушение, но не более
одного года;
на юридических лиц - в двукратном размере излишне полученной
выручки от
реализации ЛП вследствие неправомерного завышения регулируемых государством
цен за весь период, в течение которого совершалось правонарушение, но не более
одного года.
80.
Производство, реализация или ввоз на территорию РФфальсифицированных ЛС, либо производство, реализация или ввоз
на территорию РФ фальсифицированных МИ, либо
реализация или ввоз на территорию РФ контрафактных ЛС, либо
реализация или ввоз на территорию РФ контрафактных МИ, либо
оборот фальсифицированных БАД
если эти действия не содержат признаков уголовно наказуемого деяния, влечет наложение административного штрафа:
на граждан в размере от 70 000 до 100 000 руб.;
на должностных лиц - от 100 000 до 600 000 руб.;
на индивидуальных предпринимателей - от 100 000 до 600
000 руб. или административное приостановление деятельности на срок до
90 суток;
на юридических лиц - от 1 млн. до 5 млн. руб. или
административное
приостановление деятельности на срок до девяноста суток.
81.
Реализация или ввоз на территорию РФнедоброкачественных ЛС, либо реализация или ввоз на
территорию РФ недоброкачественных МИ, либо незаконные
производство, реализация или ввоз на территорию РФ
незарегистрированных ЛС
если эти действия не содержат признаков уголовно наказуемого деяния,
влечет наложение административного штрафа
на граждан в размере от 70 000 до 100 000 руб.;
на должностных лиц - от 100 000 до 600 000 руб.
на индивидуальных предпринимателей - от 100 000
до 600 000 руб. или
административное
приостановление деятельности на срок до 90 суток;
на юридических лиц - от 1 млн. до 5 млн. рублей или
административное
приостановление деятельности на срок до девяноста суток.
82.
Реализация фальсифицированных, контрафактных, недоброкачественныхили незарегистрированных ЛС или фальсифицированных БАД либо
реализация фальсифицированных, контрафактных или недоброкачественных
МИ, совершенные с использованием средств массовой
информации или информационно-телекоммуникационных сетей, в том числе
сети "ИНТЕРНЕТ"
если эти действия не содержат уголовно наказуемого деяния, - влечет
наложение административного штрафа:
на граждан в размере от семидесяти пяти тысяч до двухсот
тысяч рублей;
на должностных лиц - от ста пятидесяти тысяч до шестисот
тысяч рублей;
на индивидуальных предпринимателей - от ста пятидесяти
тысяч до
шестисот тысяч рублей или административное приостановление деятельности
на срок до девяноста суток;
на юридических лиц - от двух миллионов до шести миллионов
рублей или
административное приостановление деятельности на срок до девяноста суток.
83.
КоАП РФСтатья 6.34.
Несвоевременное внесение данных в систему мониторинга
движения ЛП для медицинского
применения либо внесение в нее недостоверных данных влечет
наложение административного штрафа на должностных лиц:
в размере от пяти тысяч до десяти тысяч рублей;
на юридических лиц - от пятидесяти тысяч до ста тысяч
рублей.

















































































 medicine
medicine








