Similar presentations:
Хранение и учет лекарственных средств в фармацевтической организации. Нормативно-правовое регулирование
1.
ПРИЕМКАЧеснокова Наталья Николаевна
провизор
2020г.
2.
3. ПОРЯДОК ПРИЁМА ТОВАРОВ ОТ ПОСТАВЩИКОВСопроводительными документами являются:
1.
Товарная накладная – форма №ТОРГ-12 (является
основанием для приёмки и оприходования товара)
2.
Счёт (используется для оплаты товара)
3.
Счёт-фактура (служит основанием для принятия к
налоговому учёту суммы НДС, регистрируется в
бухгалтерии в Книге покупок; может служить и
основанием для оплаты поступивших товаров)
4.
Протокол
согласования
цен
поставки
ЛП,
включённых в перечень ЖНВЛП (оформляется в
случает поставки именно этой категории препаратов).
5.
Упаковочный ярлык – документ, подтверждающий
количество товара, при поставке товара в упакованном
виде.
NB! Предоставляются поставщиком товара.
2
3.
34.
45.
56.
67.
78.
89.
910.
1011.
3. ПОРЯДОК ПРИЁМА ТОВАРОВ ОТ ПОСТАВЩИКОВПриемка товаров:
1. По количеству мест и массе брутто (при необходимости) (брутто – это
масса товара с контейнером, тарой, упаковкой, сумма весов перевозимого,
используемого, приобретаемого продукта и сопутствующей ему упаковки).
1)
2)
На одном из экземпляров товарной накладной, сопровождающей товар,
ставится отметка «Принято по количеству мест (указывается цифрами и
прописью) без пересчета количества единиц и без проверки качества», дата
приёмки, печать аптеки и подпись материально-ответственного лица.
Этот экземпляр возвращается поставщику.
2. По числу единиц и массе нетто (масса товара без упаковки, чистый доход
за вычетом всех удержаний) на основании товарной накладной (оставшийся
второй экземпляр) и упаковочного ярлыка.
1)
2)
Проверяется соответствие наименований товара, форм выпуска, дозировок,
№ серии и количества данным, указанных в документах поставщика
(товарная накладная/упаковочный ярлык).
Проведение приемочного контроля (см. Приказ
показателям: упаковка, маркировка, описание.
МЗ
РФ
№751)
по
11
12.
3. ПОРЯДОК ПРИЁМА ТОВАРОВ ОТ ПОСТАВЩИКОВПриемка товаров:
После этого на бланке товарной накладной ставится Штамп приёмки (АП-1), в
который вписывается дата, сумма принятого товара по цене поступления,
подпись материально-ответственного лица. Вместо штампа приемки может быть
оформлен Акт приёмки товаров (ТОРГ-1).
Следует помнить!!
Товары по количеству и качеству должны быть приняты:
В сроки, указанные в договоре купли-продажи (договор поставки);
В сроки, указанные в Инструкциях, о порядке приемки продукции
производственно-технического назначения и товаров народного потребления
по количеству и качеству (П-6, П-7), если в договоре есть ссылка на эти
Инструкции.
12
13.
3. ПОРЯДОК ПРИЁМА ТОВАРОВ ОТ ПОСТАВЩИКОВ! Выявление отклонений в количестве и (или) качестве:
В этом случае должна быть создана комиссия и оформлен:
Акт об установленном расхождении в количестве и качестве при
приёмке товара (форма АП-2) или
Акт об установленном расхождении по количеству и качеству при
приёмке товарно-материальных ценностей (формы ТОРГ-2 или ТОРГ-3).
На основании акта предъявляются претензии поставщику (оформление в
письменном виде).
! Поступление товаров без сопроводительных документов:
В этом случае также создается комиссия и оформляется Акт о приемке
товара, поступившего без счета поставщика (форма АП-3). Акт
представляет опись фактически поступившего товара. После приемки товара
таким образом, принимаются меры к получению сопроводительных документов.
13
14.
4. ДОКУМЕНТАЛЬНОЕ ОФОРМЛЕНИЯ ПОСТУПИВШЕГОТОВАРА
Принятый товар приходуется (регистрируется факт его
поступления и приемки) в документах первичного учета в
денежном измерителе в общей сумме по ценам
поступления и в розничных ценах:
Журнал регистрации поступления товара по группам в
произвольной форме или по форме АП-5
Приходная часть Товарного отчёта (ф. АП-25 или ТОРГ-29)
Некоторые ЛС дополнительно регистрируются в натуральных
измерителях в следующих документах: см. следующий слайд.
14
15.
4. ДОКУМЕНТАЛЬНОЕ ОФОРМЛЕНИЯ ПОСТУПИВШЕГОТОВАРА
Некоторые
ЛС
дополнительно
регистрируются
в
натуральных измерителях в следующих документах:
Журнал регистрации операций, связанных с оборотом НС и
ПВ (ПП РФ №644)
Журнал
регистрации операций, в результате которых
изменяется количество прекурсоров НС и ПВ (ПП РФ №419)
Журнал учёта операций, связанных с обращением ЛС для
медицинского применения (Приказ МЗ РФ N 378н)
Журнал учёта движения иммунобиологических ЛП (ПГГСВ РФ
№19)
Журнал учёта сроков годности (возможен учет сроков
годности в электронном виде с архивацией)
15
16.
Хранение лекарственных средств вфармацевтической организации.
Нормативно-правовое регулирование
Чеснокова Наталья Николаевна
провизор
2020г.
17.
Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 03.04.2020)"Об обращении лекарственных средств"
Статья 58. Хранение лекарственных средств
Хранение лекарственных средств осуществляется:
производителями ЛС,
организациями оптовой торговли ЛС,
аптечными организациями,
ветеринарными аптечными организациями,
индивидуальными предпринимателями, имеющими лицензию на фармацевтическую
деятельность или лицензию на медицинскую деятельность,
• медицинскими организациями, ветеринарными организациями и иными организациями,
осуществляющими обращение лекарственных средств.
1.
NB! Хранение лекарственных средств для ветеринарного применения организациями и
индивидуальными предпринимателями в случаях, если они используются исключительно при
разведении, выращивании, содержании и лечении животных, может осуществляться без
получения лицензии на фармацевтическую деятельность.
17
18.
Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 03.04.2020)"Об обращении лекарственных средств"
Статья
58.
Хранение
лекарственных средств
2.
Правила
хранения
лекарственных
средств
утверждаются
соответствующим
уполномоченным федеральным
органом исполнительной власти.
3.
Хранение
наркотических
лекарственных
средств,
психотропных
лекарственных
средств, радиофармацевтических
лекарственных
средств
осуществляется в соответствии с
законодательством Российской
Федерации.
1)
2)
3)
4)
1)
2)
3)
Приказ Минздравсоцразвития РФ от 23.08.2010 N 706н "Об
утверждении Правил хранения лекарственных средств».
Приказ Минздрава России от 31.08.2016 N 646н "Об утверждении
Правил
надлежащей
практики
хранения
и
перевозки
лекарственных препаратов для медицинского применения».
Приказ Минздрава России от 31.08.2016 N 647н "Об утверждении
Правил надлежащей аптечной практики лекарственных препаратов
для медицинского применения».
ГФ 14 (Приказ Минздрава России от 31.10.2018г. №749).
Постановление Правительства РФ от 31.12.2009 N 1148 "О порядке
хранения наркотических средств, психотропных веществ и их
прекурсоров».
Приказ Минздрава России от 24.07.2015 N 484н "Об утверждении
специальных требований к условиям хранения наркотических средств и
психотропных веществ, …. в аптечных, медицинских, научноисследовательских, образовательных организациях и организациях
оптовой торговли ЛС».
Приказ Росгвардии N 1, МВД России N 5 от 09.01.2018 "Об
утверждении Требований к оснащению инженерно-техническими
средствами охраны объектов и помещений, в которых осуществляются
18
деятельность, связанная с оборотом НС, ПВ …"
19.
1. Общие требования корганизации хранения ЛС
2. Хранение ИЛП
Хранение ЛС
4. Ответственность за
нарушение требований к
организации хранения ЛС
3. Хранение ЛС,
подлежащих ПКУ
19
20.
1. Общие требования к организациихранения ЛС
20
21.
Содержание1.1. Организация процесса хранения.
1.2. Помещения для хранения.
1.3. Отделка помещений.
1.4. Стеллажи (шкафы) для хранения.
1.5. Оборудование для хранения.
1.6. Особенности хранения отдельных групп ЛС.
21
22.
1.1. Организация процесса хранения706 н
Хранение ЛП для
медицинского применения
осуществляется в
соответствии с
требованиями:
производителя (п.3)
нормативной
документации (п.8, п.32)
Государственной
фармакопеи (п.32, п.45)
ГФ 14
646 н
При
создании
условий
хранения отдельно взятого ЛС
необходимо
руководствоваться
требованиями, указанными
в:
фармакопейной статье или
нормативной документации
на
это
лекарственное
средство, установленными
производителем
(разработчиком)
лекарственного
средства (ОФС.1.1.0010.18)
Все действия субъекта
обращения ЛП по хранению и
(или) перевозке ЛП
осуществляются таким
образом, чтобы:
идентичность и
качественные
характеристики
лекарственных препаратов
не были утрачены и
соблюдались условия их
хранения, указанные в
инструкции по медицинскому
применению и на упаковке
лекарственного препарата. 22
23.
1.1. Организация процесса храненияТребования производителя (упаковка)
Нормативную документацию на лекарственное средство
Государственную фармакопею 14
Инструкцию по медицинскому применению
То есть в совокупности следует ориентироваться на ….
23
24.
1.1. Организация процесса храненияРуководитель субъекта обращения ЛП
обеспечивает реализацию комплекса мер,
направленных на соблюдение его работниками настоящих Правил при хранении и (или)
перевозке лекарственных препаратов (далее - система качества),посредством
утверждения документов, в которых регламентируются в том числе
порядок совершения работниками действий при осуществлении хранения и (или)
перевозке лекарственных препаратов,
порядок обслуживания и поверки измерительных приборов и оборудования,
ведение записей, отчетов и их хранение,
прием, транспортировка,
размещение ЛП(далее - стандартные операционные процедуры),
и организации контроля за соблюдением стандартных операционных процедур.
Приказ Минздрава России от 31.08.2016 №646н
«Об утверждении Правил надлежащей практики хранения и перевозки ЛП…»
24
25.
1.1. Организация процесса храненияПравила хранения и (или) перевозки
лекарственных препаратов в конкретной
организации - это система качества, которая
должна быть в ней
создана.
П. 3 приказа Минздрава России от 31.08.2016 №646н
«Об утверждении Правил надлежащей практики хранения и перевозки ЛП…»
25
26.
1.1. Организация процесса храненияСистема качества должна гарантировать, что:
а) перемещение ЛП между субъектами обращения ЛП, в том числе внутри конкретного
субъекта обращения ЛП, обеспечивает хранение и (или) перевозку с соблюдением
требований, установленных настоящими Правилами;
б) определена ответственность работников субъекта обращения ЛП за нарушение
требований, установленных настоящими Правилами, и стандартных операционных
процедур;
в) ЛП доставляются субъектом обращения ЛП в согласованный с получателем ЛП период
времени с соблюдением требований, установленных настоящими Правилами;
г) документальное оформление действий по хранению и перевозке, и достигнутых
результатов осуществляется в ходе выполнения или непосредственно после завершения
соответствующих действий;
д) в отношении каждого нарушения требований, установленных настоящими Правилами,
стандартными операционными процедурами, проводится внутренняя проверка и
разрабатываются корректирующие действия с целью устранения выявленных нарушений.
П. 4 приказа Минздрава России от 31.08.2016 №646н
«Об утверждении Правил надлежащей практики хранения и перевозки ЛП…»
26
27.
1.1. Организация процесса храненияТо есть, процесс хранения в конкретной
организации должен быть дополнительно
документально оформлен – через
стандартные операционные процедуры.
Проверять соблюдение требований в конкретной организации следует
через внутренний аудит.
П. 4 приказа Минздрава России от 31.08.2016 №646н
«Об утверждении Правил надлежащей практики хранения и перевозки ЛП…»
27
28.
1.1. Организация процесса храненияУполномоченный по
качеству.
Следует оформить
должностную
инструкцию.
Руководителем субъекта обращения
лекарственных препаратов
с учетом требований трудового законодательства
Российской Федерации и иных нормативных
правовых актов, содержащих нормы трудового
права,
назначается лицо,
ответственное за внедрение и обеспечение
системы качества,
осуществляющее
мониторинг
эффективности
системы качества и
актуализацию
стандартных
операционных
процедур
П. 5 приказа Минздрава России от 31.08.2016 №646н
«Об утверждении Правил надлежащей практики хранения и перевозки ЛП…»
28
29.
1.1. Организация процесса храненияг) соблюдение лицензиатом, осуществляющим розничную торговлю
лекарственными препаратами для медицинского применения:
аптечными организациями, индивидуальными предпринимателями,
имеющими лицензию на осуществление фармацевтической деятельности, правил надлежащей аптечной практики лекарственных препаратов для
медицинского применения,
правил надлежащей практики хранения и перевозки лекарственных
препаратов для медицинского применения.
Постановление Правительства РФ от 22.12.2011 N 1081
"О лицензировании фармацевтической деятельности"
29
30.
1.2. Помещения для храненияСубъект обращения лекарственных препаратов для осуществления
деятельности по хранению лекарственных препаратов должен иметь:
необходимые помещения и (или) зоны, а также
оборудование для выполнения операций с лекарственными препаратами,
обеспечивающие их хранение в соответствии с требованиями настоящих
Правил.
!!! Помещения для хранения лекарственных препаратов должны обладать
вместимостью и обеспечивать безопасное раздельное хранение и
перемещение лекарственных препаратов.
Пп. 11-12 приказа Минздрава России от 31.08.2016 №646н
«Об утверждении Правил надлежащей практики хранения и перевозки ЛП…»
30
31.
1.2. Помещения для хранения (розница)706 н
646 н
647 н
ГФ 14
При выявлении
ЛС с истекшим
сроком
годности
они
должны
храниться
отдельно
от
других групп ЛС
в
специально
выделенной и
обозначенной
(карантинной)
зоне.
15. Площадь помещений,
используемых
другими
субъектами
обращения
лекарственных
препаратов,
должна быть разделена на
зоны, предназначенные для
выполнения
следующих
функций:
а) приемки лекарственных
препаратов;
б) хранения лекарственных
препаратов,
требующих
специальных условий;
в)
хранения
выявленных
фальсифицированных,
недоброкачественных,
контрафактных
лекарственных препаратов,
а также ЛП с истекшим
сроком годности;
г) карантинного хранения
лекарственных препаратов.
24. Площадь помещений,
используемых
субъектом
розничной торговли, должна
быть разделена на зоны,
предназначенные
для
выполнения
следующих
функций:
а)
торговли
товарами
аптечного ассортимента с
обеспечением
мест
хранения,
не
допускающим свободного
доступа покупателей к
товарам, отпускаемым, в
том числе по рецепту;
б)
приемки
товаров
аптечного
ассортимента,
зона
карантинного
хранения, в том числе
отдельно
для
лекарственных препаратов;
в) раздельного хранения
одежды работников.
Комплекс помещений для хранения должен
включать:
помещение
(зону)
приемки,
предназначенную для распаковки и приема
упаковок с лекарственными средствами и их
предварительного осмотра;
- помещение (зону) для отбора проб
лекарственных средств в соответствии с
требованиями ОФС «Отбор проб»;
- помещение (зону) для карантинного
хранения лекарственных средств;
- помещения для лекарственных средств,
требующих особых условий хранения;
- помещение
(зону)
для
хранения
забракованных,
возвращенных,
отозванных
и/или
лекарственных
средств с истекшим сроком годности.
Указанные лекарственные средства и места
их
хранения
должны
быть
четко
обозначены.
Зона хранения выделяется в общем
31
помещении для хранения при отсутствии
отдельного изолированного помещения.
32.
1.2. Помещения для хранения (розница)приемки лекарственных препаратов
хранения лекарственных препаратов, требующих специальных условий
хранения выявленных фальсифицированных, недоброкачественных,
контрафактных ЛС + с истекшим сроком годности
карантинного хранения
раздельного хранения одежды работников
помещение (зону) для отбора проб лекарственных средств в соответствии с
требованиями ОФС «Отбор проб»
32
33.
1.2. Помещения для хранения (опт)706 н
646 н
23.1. Площадь складских помещений
должна соответствовать объему хранимых
лекарственных средств, но составлять не
менее 150 кв. м, включая:
• зону приемки лекарственных средств;
• зону
для
основного
хранения
лекарственных средств;
• зону экспедиции;
• помещения для лекарственных средств,
требующих особых условий хранения.
13.
Площадь
помещений,
используемых
производителями
лекарственных
препаратов
и
организациями
оптовой
торговли
лекарственными
препаратами, должна соответствовать объему хранимых
лекарственных препаратов и составлять не менее 150 кв.
метров.
14. Площадь помещений, используемых производителями
лекарственных препаратов и организациями оптовой
торговли лекарственными препаратами, должна быть
разделена на зоны, предназначенные для выполнения
следующих функций:
а) приемки лекарственных препаратов;
б) основного хранения лекарственных препаратов;
в) экспедиции;
г) хранения ЛП, требующих специальных условий;
д)
хранения
выявленных
фальсифицированных,
недоброкачественных, контрафактных ЛП;
е) карантинного хранения ЛП.
33
34.
1.2. Помещения для храненияВ помещениях для хранения лекарственных препаратов
запрещается хранение:
• пищевых продуктов,
• табачных изделий,
• напитков, за исключением питьевой воды, а также
• лекарственных препаратов, предназначенных для личного
использования работниками субъекта обращения лекарственных
препаратов.
Приказ МЗ РФ от 31 августа 2016 г. N 646н «Об утверждении правил
надлежащей практики хранения и перевозки лекарственных препаратов
для медицинского применения»
34
35.
1.3. Отделка помещений для храненияВнутренняя поверхность стен и потолков должны быть гладкой, допускать
возможность проведения влажной уборки (Приказ 706, ГФ 14, Приказ 646н, 647н)
Отделка помещений (внутренняя поверхность стен, потолков) должна исключать
накопление пыли (Приказ 646н)
Процедуры по уборке помещений (зон) проводятся в соответствии с СОП
(Приказ 646н)
Оборудование , инвентарь и материалы для уборки и дез.средства моющие
должны храниться в отдельных зонах (шкафах) (Приказ 646н)
Материалы для отделки должны соответствовать требованиям пожарной
безопасности (Приказ 647н).
Места примыкания стен к потолку и полу не должны иметь углублений, выступов и
карнизов.
35
36.
1.2. Помещения для храненияЛС следует хранить так, чтобы не допустить их загрязнения, смешивания и
перекрестной контаминации.
Необходимо избегать посторонних запахов в помещениях для хранения.
Должна быть установлена в организации система учёта ЛС с ограниченным
сроком годности.
Если на хранении находятся несколько серий одного наименования ЛС, то
для использования в первую очередь должно быть взято ЛС, срок годности
которого истекает раньше, чем у других.
Забракованные ЛС должны быть идентифицированы и храниться в
соответствующем помещении (зоне) в условиях, не допускающих их
несанкционного использования.
Государственная фармакопея №14
36
37.
1.2. Помещения для храненияПри осуществлении деятельности в отдельно стоящих зданиях следует
ориентироваться на:
СанПиН 2.2.1/2.1.1.1278-03 "Гигиенические требования к естественному,
искусственному и совмещенному освещению общественных и жилых зданий",
СанПиН
2.2.4.548-96
"Гигиенические
требования
к
микроклимату
производственных помещений",
СанПиН 2.1.4.1074-01 "Питьевая вода. Гигиенические требования к качеству
воды централизованных систем питьевого водоснабжения. Контроль качества",
СанПиН 2.2.4/2.1.8.562-96 "Шум на рабочих местах, в помещениях жилых,
общественных зданий и на территории жилой застройки"
37
38.
1.4. Стеллажи (шкафы) для храненияСтеллажи (шкафы) должны быть
установлены т.о., чтобы
обеспечить:
Доступ к ЛС, к погрузочноразгрузочных работ
Свободный проход персонала,
Доступность стен, потолков и пола
для уборки
(Приказ 706н, ГФ14)
Стеллажи, шкафы, полки
должны быть
идентифицированы
(Приказ 706н),
маркированы (Приказ
646н)
Торговое помещение и (или)
зона должны быть
оборудованы витринами
стеллажами – при открытой
выкладке,
обеспечивающими
возможность обзора,
удобство в работе (Приказ
647н)
Помещения для хранения должны
быть оборудованы достаточным
количеством шкафов, сейфов,
стеллажей, подтоварников,
поддонов (ГФ 14). Не допускается
размещение ЛП на полу без
поддона (в 1 ряд на полу, на
стеллажах в нескольких ярусов)
(Приказ 646н)
При ручном способе
разгрузочно-погрузочных
работ высота укладки ЛС
не должна превышать
1,5м.
(ГФ 14)
38
39.
1.4. Стеллажи (шкафы) для храненияХранящиеся ЛС должны быть также идентифицированы
• с помощью стеллажной карты,
• содержащей информацию о хранящемся лекарственном средстве:
а) наименование,
б) форма выпуска
в) дозировка,
г) номер серии,
д) срок годности,
е) производитель лекарственного средства.
• При использовании компьютерных технологий допускается идентификация при помощи кодов и
электронных устройств.
Пункт 10 Правил определяет необходимость идентификации хранящихся лекарственных средств
(независимо от места их хранения) либо с помощью стеллажной карты, либо, при использовании
компьютерных технологий, - при помощи кодов и электронных устройств. Особенности кодировки
определяются компьютерной программой, используемой организацией (индивидуальным
предпринимателем) ( Письмо Минздравсоцразвития РФ от 08.02.2011 № 25-1/10/2-1208).
Приказ Минздравсоцразвития РФ от 23.08.2010 N 706н "Об утверждении
Правил хранения лекарственных средств».
39
40.
1.5. Оборудование для храненияПомещения
лекарственных
быть оснащены
706н
для
хранения
препаратов
должны
специальным
оборудованием,
позволяющим обеспечить
их хранение с учетом
-физико-химических,
- фармакологических
- токсикологических свойств,
- а также требований стандартов
качества лекарственных средств
Государственной
фармакопеи
Российской Федерации
и их надлежащую сохранность
ГФ XIV
646н
Оборудование, оказывающее влияние на
хранение и (или) перевозку ЛП, должно
проектироваться,
размещаться и
обслуживаться
согласно документации по его использованию
(эксплуатации).
К оборудованию, используемому в процессе
хранения и (или) перевозки ЛП, относятся в том
числе:
а) системы кондиционирования;
б) холодильные камеры и (или)
холодильники;
в) охранная и пожарная сигнализация;
г) системы контроля доступа;
д) вентиляционная система;
е) термогигрометры (психрометры) или иное
оборудование, используемое для регистрации
температуры и влажности.
40
41.
1.5. Оборудование для хранения706н
Помещения для хранения
ЛС должны быть
оборудованы
кондиционерами
и другим оборудованием,
позволяющим обеспечить
надлежащее хранение
ГФ XIV
646н
Необходимый воздухообмен в
помещениях для хранения
создается с помощью
кондиционеров, приточновытяжной вентиляции или
другого оборудования.
В каждом помещении для хранения необходимо
поддерживать климатический режим, соблюдая
температуру и влажность воздуха, установленные
фармакопейной статьей или нормативной
документацией на ЛС.
Необходимый воздухообмен в помещениях для
хранения создается с помощью кондиционеров,
приточно-вытяжной вентиляции или другого
оборудования.
либо помещения
рекомендуется оборудовать
форточками, фрамугами,
вторыми решетчатыми
дверьми.
41
42.
1.5. Оборудование для хранения38. Оборудование, относящееся к средствам измерений, до ввода в эксплуатацию, а также после
ремонта подлежит первичной поверке и (или) калибровке, а в процессе эксплуатации периодической поверке и (или) калибровке в соответствии с требованиями законодательства
Российской Федерации об обеспечении единства измерений (статьи 13 и 18 Федерального закона
от 26 июня 2008 г. N 102-ФЗ "Об обеспечении единства измерений" ).
39. Ремонт, техническое обслуживание, поверка и (или) калибровка оборудования должны
осуществляться в соответствии с утверждаемым планом-графиком, таким образом, чтобы качество
лекарственных препаратов не подвергалось негативному воздействию.
40. На время ремонта, технического обслуживания, поверки и (или) калибровки оборудования и
средств измерения должны быть приняты меры, обеспечивающие требуемые условия хранения
лекарственных препаратов.
Ремонт, техническое обслуживание, поверка и (или) калибровка оборудования и средств измерения
должны быть соответствующим образом отражены в документах, которые архивируются и хранятся в
соответствии с законодательством Российской Федерации об архивном деле.
Приказ МЗ РФ от 31 августа 2016 г. N 646н «Об утверждении правил надлежащей практики
хранения и перевозки лекарственных препаратов для медицинского применения»
42
43.
1.5. Оборудование для храненияПомещения для хранения лекарственных средств должны быть оснащены
необходимым количеством поверенных в установленном порядке средств
измерений (термометрами, гигрометрами, психрометрами и др.) для контроля и
регистрации температуры и влажности, осуществляемых не реже одного раза в
сутки.
Средства измерений размещаются на расстоянии не менее 3 м от дверей, окон и
отопительных приборов в доступном для считывания оказаний месте, на высоте
1,5−1,7 м от пола.
При этом их рекомендуется размещать в местах, где имеется наибольшая
вероятность колебаний температуры и влажности или наиболее часто
наблюдаются отклонения от требуемых параметров.
Регистрационные записи должны демонстрировать установленные для помещений
режимы температуры и влажности, а при их несоответствии – корректирующие
действия.
Государственная фармакопея №14
43
44.
1.5. Оборудование для храненияТермолабильные лекарственные средства следует хранить в
специально оборудованных помещениях (холодильных камерах)
или в помещениях для хранения, оснащенных достаточным
количеством холодильных шкафов, холодильников.
Для
хранения
термочувствительных
(термолабильных)
лекарственных
средств
ТАКЖЕ
МОГУТ
использоваться
фармацевтические холодильники или холодильники для крови и ее
препаратов.
Государственная фармакопея №14
44
45.
1.6. Особенности хранения отдельных групп ЛС.В помещениях для хранения лекарственные средства размещают в соответствии с
требованиями нормативной документации, указанной на упаковке лекарственного
препарата, с учетом:
• физико-химических свойств лекарственных средств;
• фармакологических групп (для аптечных и медицинских организаций);
• способа применения (внутреннее, наружное);
• агрегатного состояния фармацевтических субстанций (жидкие, сыпучие, газообразные).
• При размещении лекарственных средств допускается использование компьютерных
технологий (по алфавитному принципу, по кодам).
Приказ Минздравсоцразвития РФ от 23.08.2010 N 706н "Об утверждении
Правил хранения лекарственных средств».
45
46.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА И ВЛИЯНИЕ ОКРУЖАЮЩЕЙ СРЕДЫЛС делят на:
требующие защиты от света;
от воздействия влаги;
от улетучивания и высыхания;
от воздействия повышенной температуры;
от воздействия пониженной температуры;
от воздействия газов, содержащихся в окружающей среде;
пахучие и красящие;
дезинфицирующие.
NB! При хранении ЛС, требующих защиты от влияния факторов внешней среды,
необходимо обеспечить указанный в фармакопейной статье или нормативной
документации режим хранения. Отклонения от регламентирующих условий допускаются
однократно только на краткосрочный период (не более 24 часов), если при этом
специальные условия не оговорены отдельно.
46
47.
1. Лекарства, хранящиеся в защищенном от света местеантибиотики,
настойки,
экстракты,
витамины,
кортикостероиды,
растительное сырье,
нитросоединения (противогрибковые и др.),
амино- и амидосоединения,
производные фенола, фенотиазина.
47
48.
1. Лекарства, хранящиеся в защищенном от света месте• ЛС, которые под действием световой энергии могут изменять свои свойства
(окисляться, восстанавливаться, разлагаться, изменять свой цвет и др.),
являются фото- или светочувствительными;
• ЛС, устойчивые к действию света, являются фотостабильными.
• Влияние световой энергии может проявляться в воздействии прямых
солнечных лучей, рассеянного света видимой области светового спектра и
излучения ультрафиолетовой области.
• Маркировка светочувствительных ЛС, как правило, содержит указание:
«Хранить в защищённом от света месте».
48
49.
Хранение ЛС, требующих защиты от действия света706н
ЛС, требующие защиты от действия света,
хранятся в помещениях или специально
оборудованных местах, обеспечивающих
защиту
от естественного
и искусственного освещения.
ЛП, требующие защиты от действия света,
упакованные в первичную и вторичную
(потребительскую) упаковку,
следует хранить в шкафах или
на стеллажах при условии принятия мер
для предотвращения попадания на
указанные ЛП прямого солнечного света
или иного яркого направленного света
(использование светоотражающей пленки,
жалюзи, козырьков и др.).
ГФ XIV
Маркировка светочувствительных ЛС, как
правило, содержит указание: «Хранить в
защищенном от света месте».
ЛС, требующие защиты от действия света,
должны храниться
в помещениях или специально
оборудованных зонах,
обеспечивающих защиту от естественного
и искусственного освещения.
Светочувствительные ЛП должны
быть упакованы в светозащитную
вторичную (потребительскую) упаковку
и/или
храниться в защищенном от света месте.
646н
ЛП, требующие защиты от
воздействия света, должны
храниться в помещениях
или
специально оборудованных
зонах, обеспечивающих защиту
от попадания на указанные ЛП
прямых солнечных лучей.
50.
2. Защита лекарственных средств от влаги:сухие экстракты,
растительное сырье,
соли азотистой, азотной, фосфорной кислот,
антибиотики,
ферменты.
Эти лекарственные средства хранят в сухом помещении в плотной таре:
из стекла,
металла,
алюминиевой фольги,
пластмассы.
Если гигроскопические свойства резко выражены, тара должна быть герметично
укупоренной, залитой сверху парафином.
50
51.
2. Защита лекарственных средств от влаги:• ЛС, которые при контакте с водой, влагой могут выделять газы и т.п., являются
влагочувствительными.
• Маркировка влагочувствительных ЛС, как правило, содержит указание: «Хранить в сухом
месте».
• При хранении таких ЛС необходимо создать условия, чтобы относительная влажность воздуха
не превышала 50% при комнатной температуре (при нормальных условиях хранения) или
эквивалентном давлении паров при другой температуре.
• Выполнение требования также предусматривает хранение влагочувствительного ЛС в
воздухонепроницаемой (влагонепроницаемой) потребительской упаковке, обеспечивающей
указанную защиту и соблюдение условий хранения при обращении ЛС.
• Для поддержания низкого содержания влаги при хранении ЛС в установленных случаях
используют осушающие вещества при условии исключения их прямого контакта с ЛС.
51
52.
3. ЛС, на которые влияют газывоздуха:
морфин и его производные,
ферменты,
серосодержащие соединения,
органопрепараты,
соли щелочных металлов,
эуфиллин,
едкий натр и едкий кали,
окись магния и т.д.
3. ЛС, на которые влияют газы воздуха
Данные ЛС изменяют свои свойства под
воздействием газов атмосферного воздуха,
таких как кислород или углерода диоксид.
Для обеспечения защиты ЛС
рекомендуется осуществлять в
герметичной упаковке из материалов, не
проницаемых для газов.
Упаковка, по возможности, должна быть
заполнена доверху и укупорена
герметично.
52
53.
4. ЛС, требующие защиты отвысыхания и улетучивания
спиртовые настойки,
густые экстракты,
жидкие спиртовые концентраты,
эфирные масла,
растворы аммиака,
хлористого водорода,
формальдегида,
карболовой кислоты,
спирт этиловый,
перекись водорода,
гидрокарбонат натрия,
хлорамин В.
4. ЛС, требующие защиты от
высыхания и улетучивания
ЛС, представляющие собой собственно
летучие ЛС или ЛС, содержащие
летучий растворитель; растворы и
смеси летучих веществ, ЛС,
разлагающиеся с образованием летучих
продуктов, требуют создания условий
хранения, защищающих их от
улетучивания и высыхания.
Рекомендуется хранить ЛС в
прохладном месте, в герметично
укупоренной упаковке из
непроницаемых для улетучивающихся
веществ материалов или первичной и
вторичной (потребительской) упаковке.
53
54.
5. ЛС, требующие защиты отвоздействия повышенной
температуры
антибиотики,
гормональные препараты,
гликозиды,
витамины,
мази на жировой основе,
иммунобиологические
препараты.
5. ЛС, требующие защиты от воздействия повышенной
температуры
Температурный режим на полках холодильника различен: температура
ниже возле морозильной камеры, выше – возле открываемой дверной
панели.
Обеспечение холодного места подразумевает хранение ЛС в холодильнике
при температуре от 2 до 8 С, не допуская замораживания.
Хранение в прохладном месте подразумевает хранение при Т=8-15 С. В
этом случае допускается хранение ЛС в холодильнике, за исключением ЛС,
которые при хранении в условиях температурного режима холодильника
ниже 8 С могут изменить свои физико-химические характеристики,
например, настойки, жидкие экстракты и др.
Хранение при комнатной температуре подразумевает температурный
режим от 15 до 25 С или, в зависимости от климатических условий, до 30С.
Хранение в морозильной камере обеспечивает температурный режим от 5 до -18С.
Хранение в условиях глубокого замораживания предусматривает
температурный режим ниже -18С.
ЛС целесообразно размещать в зонах и на полках холодильника,
соответствующих их температурному режиму хранения.
Не допускается хранение ИЛП на дверной панели холодильника.
54
55.
56.
57.
6. Хранение лекарственных средств, требующих защитыот воздействия пониженной температуры
Хранение лекарственных средств, требующих защиты от воздействия пониженной температуры
(лекарственные средства, физико-химическое состояние которых после замерзания изменяется
и при последующем согревании до комнатной температуры не восстанавливается (40% раствор
формальдегида, растворы инсулина)), организации и индивидуальные предприниматели
должны осуществлять в соответствии с температурным режимом, указанным на
первичной и вторичной (потребительской) упаковке лекарственного средства в
соответствии с требованиями нормативной документации.
Замерзание препаратов инсулина не допускается.
Не допускается подвергать замораживанию ЛС, помещённые в упаковку, способную
разрушаться при замораживании, например, ЛП в ампулах, стеклянных флаконах и др.
57
58.
Красящие и пахучие лекарственные средства:Пахучие лекарственные средства (фармацевтические субстанции
как летучие, так и практически нелетучие, но обладающие сильным
запахом) следует хранить в герметически закрытой таре,
непроницаемой для запаха.
• Красящие лекарственные средства (фармацевтические субстанции,
которые оставляют окрашенный след, не смываемый обычной
санитарно-гигиенической обработкой, на таре, укупорочных
средствах, оборудовании и инвентаре (бриллиантовый зеленый,
метиленовый синий, индигокармин)) следует хранить в
специальном шкафу в плотно укупоренной таре.
58
59.
Хранение огнеопасных лекарственных средствХранение огнеопасных ЛС (ЛС, обладающие легковоспламеняющимися свойствами (спирт и
спиртовые растворы, спиртовые и эфирные настойки, спиртовые и эфирные экстракты, эфир,
скипидар, молочная кислота, хлорэтил, коллодий, клеол, жидкость Новикова, органические масла);
лекарственные средства, обладающие легкогорючими свойствами (сера, глицерин, растительные
масла, нерасфасованное ЛРС)) должно осуществляться отдельно от других ЛС.
При осуществлении хранения готовых лекарственных препаратов для медицинского
применения, обладающих легковоспламеняющими свойствами (спиртовые растворы,
спиртовые и эфирные настойки и др.), в первичной и вторичной упаковках необходимо
руководствоваться требованиями
к их хранению, указанными на вторичной (потребительской) упаковке указанного
лекарственного препарата;
государственной фармакопеи и нормативной документации, а также с учетом свойств
веществ, входящих в их состав.
.( Письмо Минздравсоцразвития РФ от 08.02.2011 № 25-1/10/2-1208).
N 706н
59
Приказ Минздравсоцразвития РФ «Об утверждении правил хранения лекарственных средств» от 23.08.2010
60.
Требования к помещениям для хранения огнеопасных и взрывоопасных ЛС иорганизации их хранения
• В аптечных организациях и у индивидуальных предпринимателей выделяются
изолированные помещения, оборудуемые средствами автоматической пожарной защиты и
сигнализацией, для хранения огнеопасных фармацевтических субстанций и
взрывоопасных лекарственных средств.
Требования раздела IV "Требования к помещениям для хранения огнеопасных и взрывоопасных
лекарственных средств и организации их хранения" Правил распространяются на случаи
хранения:
- огнеопасных фармацевтических субстанций и взрывоопасных лекарственных средств
(фармацевтических субстанций и лекарственных препаратов, таких как, раствор
нитроглицерина, порошок калия перманганата) в аптечных организациях и у
индивидуальных предпринимателей, имеющих лицензию на фармацевтическую
деятельность.( Письмо Минздравсоцразвития РФ от 08.02.2011 № 25-1/10/2-1208).
N 706н
60
Приказ Минздравсоцразвития РФ «Об утверждении правил хранения лекарственных средств» от 23.08.2010
61.
Хранение огнеопасных лекарственных средств• Легковоспламеняющиеся лекарственные средства хранят в плотно укупоренной прочной,
стеклянной или металлической таре, чтобы предупредить испарение жидкостей из
сосудов.
• Бутыли, баллоны и другие крупные емкости с легковоспламеняющимися и
легкогорючими лекарственными средствами должны храниться на полках стеллажей в
один ряд по высоте.
• Запрещается их хранение в несколько рядов по высоте с использованием
различных прокладочных материалов.
• Не допускается хранение указанных лекарственных средств у отопительных приборов.
• Расстояние от стеллажа или штабеля до нагревательного элемента должно быть не
менее 1 м.
• Хранение бутылей с легковоспламеняющимися и легкогорючими фармацевтическими
субстанциями должно осуществляться в таре, предохраняющей от ударов, или в баллоноопрокидывателях в один ряд.
N 706н
61
Приказ Минздравсоцразвития РФ «Об утверждении правил хранения лекарственных средств» от 23.08.2010
62.
Хранение огнеопасных лекарственных средств• Не допускается хранение легковоспламеняющихся и легкогорючих лекарственных
средств в полностью заполненной таре. Степень заполнения должна быть не более 90%
объема. Спирты в больших количествах хранятся в металлических емкостях,
заполняемых не более чем на 75% объема.
• Не допускается совместное хранение легковоспламеняющихся лекарственных средств с
минеральными кислотами (особенно серной и азотной кислотами), сжатыми и
сжиженными газами, легкогорючими веществами (растительными маслами, серой,
перевязочным материалом), щелочами, а также с неорганическими солями, дающими с
органическими веществами взрывоопасные смеси (калия хлорат, калия перманганат,
калия хромат и др.).
• Эфир медицинский и эфир для наркоза хранят в промышленной упаковке, в прохладном,
защищенном от света месте, вдали от огня и нагревательных приборов.
N 706н
62
Приказ Минздравсоцразвития РФ «Об утверждении правил хранения лекарственных средств» от 23.08.2010
63.
Хранение взрывоопасных ЛСВзрывоопасные
лекарственные средства:
лекарственные средства,
обладающие взрывчатыми
свойствами (нитроглицерин);
лекарственные средства,
обладающие взрывоопасными
свойствами (калия
перманганат, серебра нитрат)
При их хранении следует:
принимать меры против загрязнения их
пылью.
ёмкости с взрывоопасными
лекарственными средствами (штангласы,
жестяные барабаны, склянки и др.)
необходимо плотно закрывать во
избежание попадания паров этих средств в
воздух.
При работе с диэтиловым эфиром не
допускается встряхивание, удары, трение.
63
64.
Хранение дезинфицирующих средствДезинфицирующие средства хранят:
в прохладном темном месте,
в герметично укупоренной таре,
вдали от хранения пластмассовых, металлических и резиновых
изделий, от помещений получения дистиллированной воды.
64
65.
П. 3.2. Для дезинфекции, стерилизации, дезинсекции и дератизациииспользуют химические и биологические средства, оборудование,
аппаратуру и материалы, допущенные к применению в установленном
порядке, не оказывающие неблагоприятного воздействия на
человека.
Сопроводительная документация на дезсредства:
Свидетельство о госрегистрации
Сведения о декларации о соответствии
Наличие инструкции по применению
Критерии выбора дезсредств:
Широкий диапазон микробных агентов, на которые воздействует
дезсредство
Удобство использования (растворимость в воде, отсутствие
неприятного запаха и т.п.)
Наличие функциональных добавок (антикоррозионные добавки,
растворители, регуляторы рН и т.п.)
Простота и дешевизна утилизации (возможность вылить в унитаз)
Длительный срок годности
Требования к
дезсредствам
Постановление Главного
государственного санитарного
врача РФ от 09.06.2003 N 131
"О введении в действие санитарноэпидемиологических правил
СП 3.5.1378-03
"Дезинфектология. Санитарноэпидемиологические
требования к организации и
осуществлению
дезинфекционной
деятельности»
66.
Выбор дезсредствhttp://dezr.ru
http://dezreestr.ru
П. 2.8. В случае, если организация, осуществляющая
дезинфекционную
деятельность,
использует
дезинфекционные
средства
в
количестве,
не
превышающем пять килограммов одновременного
хранения, их запас хранится в местах, исключающих их
несанкционированное использование.
П. 2.11. В помещении для хранения средств дезинсекции не
допускается хранить пищевые продукты, питьевую воду,
принимать пищу, находиться посторонним лицам.
Хранение
дезсредств
Постановление Главного
государственного санитарного
врача РФ от 09.06.2003 N 131
"О введении в действие
санитарно-эпидемиологических
правил
СП 3.5.1378-03
"Дезинфектология. Санитарноэпидемиологические требования
к организации и осуществлению
дезинфекционной деятельности»
67.
http://dezreestr.ru68.
http://dezr.ru69.
Хранение медицинских пиявок• Хранение медицинских пиявок осуществляется в светлом
помещении без запаха лекарств, для которого
устанавливается постоянный температурный режим.
• Содержание пиявок осуществляется в установленном
порядке.
69
70.
Хранение МИ(Приказ МЗ РФ от 13.11.1996 №377 «Об утверждении инструкции по организации хранения в
аптечных учреждениях различных групп ЛС и ИМН»)
Резиновые изделия
Необходимо хранить:
в темном месте,
при температуре от 0 до +20 °С,
беречь от механических повреждений, агрессивных веществ
(формалина, лизола и т.д.).
Сохранению эластичности резины способствует углекислый
аммоний, сосуды с которым рекомендуется ставить в шкафах и
помещениях для хранения резиновых изделий.
Чтобы изделия не сдавливались, нельзя укладывать их в шкафы в
несколько слоев.
70
71.
• Шкафы для резиновых изделий должныиметь:
плотно закрывающиеся дверцы,
гладкую внутреннюю поверхность
• Жгуты, зонды хранятся в подвешенном
состоянии на съемных вешалках,
расположенных под крышкой шкафа.
• Резиновые грелки, накладные круги, пузыри
для льда хранят слегка надутыми.
• Съемные резиновые части приборов
необходимо хранить отдельно.
• Эластичные катетеры, перчатки, бужи,
резиновые бинты, напальчники хранят в
плотно закрытых коробках, пересыпав
тальком.
• Резиновые бинты пересыпают тальком по
всей поверхности и хранят в скатанном виде.
• Отдельно хранят прорезиненную ткань в
рулонах, горизонтально подвешенную на
стойках. Можно хранить ее на полках,
уложенной не более чем в 5 рядов.
• Эластичные лаковые бужи, катетеры, зонды
хранят в сухом месте. Изделия бракуются, если
появляется их клейкость и размягчение.
• При затвердении резиновых перчаток их
помещают в теплый 5%-ный раствор аммиака
на 15 мин, затем их разминают и держат 15 мин
в 5%-ном водно-глицериновом растворе с
температурой +40—50 °С.
71
72.
Пластмассовые изделия хранят:Стерильные бинты, салфетки и вата
в темном проветриваемом помещении,
хранятся в заводской упаковке.
на расстоянии не менее 1 м от
Нестерильный перевязочный материал
отопительных приборов,
хранят на стеллажах упакованным в
с относительной влажностью воздуха не
выше 65 %.
плотную бумагу или в мешки.
Выключатели и электроприборы должны
Вспомогательный материал (бумажные
быть противопожарного исполнения.
капсулы, фильтровальную бумагу) хранят
Перевязочные средства и вспомогательные
материалы необходимо хранить:
в заводской упаковке в отдельных шкафах
в сухом проветриваемом помещении.
в строго гигиенических условиях. После
Шкафы, стеллажи и поддоны для хранения
вскрытия упаковки материал хранят в
должны быть выкрашены изнутри
пакетах из бумаги или полиэтилена или в
светлой масляной краской.
мешках из крафт-бумаги.
Периодически их надо протирать
растворами дезинфицирующих средств
(например, 0,2%-ным раствором
хлорамина).
72
73.
Металлические изделия медицинскойтехники, в том числе хирургические
инструменты, хранят в сухих
помещениях при комнатной
температуре.
Металлические изделия, не имеющие
антикоррозийной смазки,
необходимо обработать тонким
слоем вазелина. Такие инструменты
необходимо хранить, завернув в
парафиновую бумагу. Брать
инструменты надо марлевой
салфеткой или пинцетом. Скальпели
и ножи во избежание затупления
хранят в специальных пеналах
ящиков.
Хранить хирургические инструменты
надо по наименованиям. Это удобно
для их отпуска и контроля.
Медные (латунные), оловянные
изделия смазывания не требуют.
Если появляется ржавчина на
окрашенных изделиях из железа, ее
удаляют, и изделие вновь красят.
Изделия из серебра нельзя хранить
вместе с серой, резиновыми
изделиями, так как их поверхность
может почернеть.
NB! Недопустимо резкое колебание
температуры и влажности воздуха в
помещении хранения.
Относительная влажность воздуха
должна быть не выше 60 % (редко
70 %).
73
74.
Приказ Минздрава РФ №377 «Об утв. инструкции по орг. хранения в АУ различных групп ЛС и ИМН» от 13.11.1996Наименование
Резиновые изделия
Свет/ температура
защита от света,
особенно прямых
солнечных лучей
не более 20 град
и не менее 0 град
Пластмассовые
изделия
-
влажность
Примечание
не менее 65% (для предупреждения
высыхания, деформации и потери их
эластичности)
Для поддержания в сухих помещениях
повышенной влажности рекомендуется
ставить сосуды с 2% водным раствором
карболовой кислоты.
вдали от нагревательных
приборов
не выше 65% (для целлофановых,
целлулоидных, аминопластовых изделий)
не менее 1 м от отопительных
систем
Перевязочные
средства
-
Сухое проветриваемом
(не более 50%)
Запрещается хранение
стерильного перевязочного
материала (бинты, марлевые
салфетки, вата) в первичной
вскрытой упаковке
Вспомогательный
материал
-
Сухое проветриваемое
(не более 50%)
-
Изделия медицинской
техники (хирургические
инструменты и другие
металлические изделия)
комнатная
Не выше 60% Сухое
74
75.
2. Хранение ИЛП75
76.
ПЕРЕЧЕНЬВИДОВ ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ
Статья 4, п.7: иммунобиологические лекарственные препараты - лекарственные
препараты, предназначенные для формирования активного или пассивного иммунитета
либо диагностики наличия иммунитета или диагностики специфического приобретенного
изменения иммунологического ответа на аллергизирующие вещества.
1.
2.
3.
4.
5.
6.
вакцины,
анатоксины,
токсины
сыворотки,
иммуноглобулины
аллергены
Федеральный закон "Об обращении лекарственных средств" от 12.04.2010 №61_ФЗ
77.
Медицинские иммунобиологические препараты. Санитарноэпидемиологическое нормированиеНаименование
Санитарные правила СП 3.3.2.1288-03 Надлежащая практика производства
медицинских иммунобиологических препаратов
Документ или орган, утвердивший санитарные
требования
Постановление Главного государственного
санитарного врача РФ от 18.04.2003 N 60
Методические указания МУ 3.3.2.1172-02 Порядок обеспечения государственных
Главный государственный санитарный врач РФ
муниципальных организаций здравоохранения медицинскими иммунобиологическими 14.11.2002
препаратами в рамках национального календаря профилактических прививок и
календаря профилактических прививок по эпидемическим показаниям
Санитарные правила СП 3.3.2.3332-16 Санитарно-эпидемиологические правила
к условиям транспортирования и хранения иммунобиологических
лекарственных препаратов
Постановление Главного государственного
санитарного врача РФ от 17.02.2016 N 19
Методические указания МУ 3.3.2.1121-02 Организация контроля за соблюдением
правил хранения и транспортирования медицинских иммунобиологических
препаратов
Главный государственный санитарный врач РФ
04.04.2002
Методические указания МУ 3.3.2.1081-01 Порядок государственного надзора за
качеством медицинских иммунобиологических препаратов
Главный государственный санитарный врач РФ
09.11.2001
Санитарные правила СП 3.3.2.561-96 Государственные испытания и регистрация
новых медицинских иммунобиологических препаратов
Постановление Госкомсанэпиднадзора РФ от
31.10.1996 N 33
77
78.
НПД, регламентирующие оборот ИЛП• Постановление Главного государственного санитарного врача РФ от
17.02.2016
N
19
"Об утверждении санитарно-эпидемиологических правил СП 3.3.2.3332-16
"Условия транспортирования и хранения иммунобиологических лекарственных
препаратов«
• Приказ МЗ РФ от 31.08.2016 №646н «Об утверждении правил надлежащей
практики хранения и перевозки ЛП для медицинского применения»
• ОФС. 1.1.0010.15 «Хранение лекарственных средств (введена Приказом МЗ
РФ от 29.10.2015г. №771)
• Приказ МЗ РФ от 11.07.2017г. №403н «Об утверждении Правил отпуска ЛП
для медицинского применения, в том числе иммунобиологических ЛП,
аптечными организациями, индивидуальными предпринимателями, имеющими
лицензию на фармацевтическую деятельность»
79.
Приказ МЗ РФ от 11.07.2017г. №403н «Об утверждении Правил отпуска ЛП длямедицинского применения, в том числе иммунобиологических ЛП, аптечными
организациями, индивидуальными предпринимателями, имеющими лицензию на
фармацевтическую деятельность»
Правила отпуска ЛП по рецептам
Отпуск гражданам иммунобиологических лекарственных
препаратов для иммунопрофилактики производится по рецепту
на лекарственный препарат аптечными организациями
(аптеки и аптечные пункты, кроме ИП) в порядке,
установленном федеральным органом исполнительной власти,
осуществляющим функции по выработке и реализации
государственной
политики
и
нормативно-правовому
регулированию в сфере здравоохранения.
80.
Постановление Главного государственного санитарного врача РФ от17.02.2016 N 19
"Об утверждении санитарно-эпидемиологических правил СП 3.3.2.3332-16
"Условия транспортирования и хранения иммунобиологических
лекарственных препаратов"
80
81.
Постановление Главного гос. Сан. врача РФ от 17.02.2016 №19 «Об утверждениисанитарно-эпидемиологических правил СП 3.3.2.3332-16 "Условия транспортирования и
хранения иммунобиологических лекарственных препаратов"»
1.3. Контроль за выполнением настоящих санитарноэпидемиологических правил осуществляется в соответствии с
законодательством Российской Федерации
органами, уполномоченными на осуществление федерального
государственного санитарно-эпидемиологического надзора
Роспотребнадзор
81
82.
Постановление Главного гос. Сан. врача РФ от 17.02.2016 №19 «Об утверждениисанитарно-эпидемиологических правил СП 3.3.2.3332-16 "Условия транспортирования и
хранения иммунобиологических лекарственных препаратов"»
2.1.
Санитарно-эпидемиологические
правила
устанавливают :
1. порядок транспортирования и хранения ИЛП от момента их
изготовления до использования в медицинских организациях,
а также
2. требования к оборудованию, обеспечивающему сохранность
исходного качества и безопасность ИЛП, и порядок
использования этого оборудования.
82
83.
Постановление Главного гос. Сан. врача РФ от 17.02.2016 №19 «Об утверждениисанитарно-эпидемиологических правил СП 3.3.2.3332-16 "Условия транспортирования и
хранения иммунобиологических лекарственных препаратов"»
2.2. Для сохранения высокого качества и безопасности ИЛП
• проводится
комплекс
организационных,
санитарнопротивоэпидемических
(профилактических),
технических,
контрольных и надзорных, учебно-методических и иных
мероприятий
по
обеспечению
оптимальных
условий
транспортирования и хранения ИЛП
• на всех этапах (уровнях) их движения от производителя до
потребителя ("ХОЛОДОВАЯ ЦЕПЬ")
83
84.
Постановление Главного гос. Сан. врача РФ от 17.02.2016 №19 «Об утверждении санитарноэпидемиологических правил СП 3.3.2.3332-16 "Условия транспортирования и храненияиммунобиологических лекарственных препаратов"»
Деятельность:
• Хранение ИЛП
• Розничная
реализация
ИЛП
• Доставка до 4
уровня
84
85.
Постановление Главного гос. Сан. врача РФ от 17.02.2016 №19 «Об утверждениисанитарно-эпидемиологических правил СП 3.3.2.3332-16 "Условия транспортирования и
хранения иммунобиологических лекарственных препаратов"»
• 2.3. При транспортировании и хранении ИЛП на всех уровнях
"холодовой цепи", а также при применении ИЛП
• руководитель организации (индивидуальный предприниматель)
• организует и обеспечивает выполнение
• установленных настоящими правилами требований к условиям
транспортирования и хранения ИЛП, гарантирующих сохранность
качества ИЛП.
85
86.
Постановление Главного гос. Сан. врача РФ от 17.02.2016 №19 «Об утверждениисанитарно-эпидемиологических правил СП 3.3.2.3332-16 "Условия транспортирования и
хранения иммунобиологических лекарственных препаратов"»
2.4.
В
организациях,
осуществляющих
хранение
и
транспортирование ИЛП
• на всех уровнях "холодовой цепи",
• должны работать специалисты,
• прошедшие
инструктаж
по
вопросам
обеспечения
сохранности качества препарата и защиты его от воздействия
вредных факторов окружающей среды.
• Инструктаж специалистов проводится ежегодно с отметкой в
специальном журнале.
86
87.
Температурный режим транспортирования и хранения ИЛПВиды вакцин
Температурный интервал
Большинство ИЛП, в т. ч. содержащих в упаковке
растворитель
От 2 С до 8 С включительно
• Адсорбированные препараты, содержащие
адъюванты (коклюшно-дифтерийно-столбнячной
вакцины, дифтерийно-столбнячного анатоксина,
вакцин против гепатита В и А, субъединичных
гриппозных вакцин, инактивированной вакцины
против полиомиелита)
• Растворители для вакцин
Не допускается замораживания
Живая оральная полиомиелитная вакцина (ОПВ)
на первом и втором уровне холодовой цепи
• -20 С и ниже или
• От 2 С до 8 С включительно
Допускается повторное
замораживание при
транспортировании
87
88.
Транспортировка со 2 на 3 уровеньАвторефрижераторы
Обычный автотранспорт
1. Термометры и терморегистраторы
(автономные и встроенные).
2. Термоиндикаторы (дополнительное
средство контроля)
1. Активные термоконтейнеры (со
встроенной холодильной установкой).
2. Пассивные
термоконтейнеры
(однократного
и
многократного
применения с хладоэлементами)
Термоконтейнеры многократного применения должны быть укомплектованы паспортом,
термокартой, инструкцией по применению, должны иметь покрытие, легко
подвергающееся санитарной обработке
88
89.
NB!!! П. 7.5• Оборудование для контроля температурного режима в
системе "холодовой цепи", регистрирующее и отображающее
конкретные значения температуры в конкретный момент
времени (термометры, датчики температуры, термографы,
терморегистраторы), должно подвергаться периодической
поверке в соответствии с Федеральным законом от
26.06.2008 N 102-ФЗ "Об обеспечении единства
измерений".
• Периодичность поверки и калибровки определяется при
регистрации конкретного устройства.
89
90.
Приемка на 3 уровне1. Вскрытие термоконтейнеров и
проверка показания приборов
контроля литературы
2. В случае подтверждения требуемых
условий транспортировки ИЛП
3. Распаковка, перемещение ИЛП в
местах хранения
В помещении, где расположены холодильнике для хранения ИЛП, при
температуре не выше +20С (не выше +27С для 4 уровня), при
отсутствии холодильной камеры
• Показания термоиндикаторов,
• Распечатка показаний терморегистраторов, приложение «распечатки» к
приемочной документации.
• Оформление приходных документов.
NB!! Проверка наличия ЛП в
базе
данных
РЗН
о
приостановленных
или
изъятых из обращения ЛС
• Выгрузка термоконтейнеров и размещение ИЛП в холодильниках в
срок до 10 минут.
• Регистрация поступления ИЛП в Журнале учета движения ИЛП.
• Регистрация показаний термоиндикаторов в Журнале учета движения
ИЛП.
90
91.
Отказ от приемки• Порядок оформления претензии (вообще порядок
действия) должен быть прописан в договоре и в СОПе
• П 8.8 Решение об отказе в получении ИЛП
принимается руководителем организации.
• Порядок действий получателя при отказе от приемки
ИЛП определяется условиями договора между
получателем и поставщиком ИЛП.
91
92.
9293.
9394.
9495.
Постановление Главного гос. Сан. врача РФ от 17.02.2016 №19 «Об утверждении санитарноэпидемиологических правил СП 3.3.2.3332-16 "Условия транспортирования и храненияиммунобиологических лекарственных препаратов"». Раздел 6.ТРЕБОВАНИЯ К ОБОРУДОВАНИЮ.
Холодильные камеры (комнаты)
Высота не менее 2 м.
Стеллажи, маркированные для каждого вида ИЛП.
Загрузка не более 2/3 объёма.
Пространство для упаковки ИЛП и охлаждения
термоконтейнеров.
Не разрешается размещение ИЛП, замораживание
которых
недопустимо,
термоиндикаторов
и
автономных
термометров
на
траектории
распространения потока холодного воздуха с
температурой ниже +2С.
Температурная и охранная звуковая и световая
сигнализация.
Холодильники для «холодовой цепи»
Длительное (не менее 24 часов) удержание
температурного
режима
при
отключении
электричества.
Отдельные маркированные полки для хранения
отдельных ИЛП.
Загрузка не более 2/3 объема.
Место для размещения хладоэлементтов (1/6
общего объёма).
Замена ранее установленных фармацевтических
и бытовых холодильников на холодильники для
«холодовой цепи» производится в плановом
порядке, либо при выходе из строя устаревшего
оборудования.
Оборудование для контроля температуры
встроенные терморегистратор и термометр,
Автономные терморегистраторы,
Автономные термометры и термоиндикаторы (не менее 3
штук)
Оборудование для контроля температуры
встроенные термометр,
2 автономных термометра,
95
2 автономных термоиндикатора (терморегистратора)
96.
Хранение на 3 уровнеДля замораживания и хранения хладоэлементов должны быть
морозильники (объём морозильной камеры должен быть не менее
50 литров).
При загрузке хладоэлементов в морозильник для замораживания с
целью обеспечения свободной циркуляции воздуха и равномерного
охлаждения внутреннего объёма морозильника не допускается их
размещение вплотную друг к другу как по горизонтали, так и по
вертикали.
Генеральная уборка морозильника (морозильного отделения
холодильника) с отключением от источника электроснабжения,
мытьем и обработкой дезинфицирующими средствами внутренних и
наружных поверхностей проводится не реже одного раза в месяц,
96
текущая уборка - по мере необходимости.
97.
Хранение на 3 уровнеNB!!! Запрещается хранить в морозильном отделении
холодильника продукты и посторонние предметы
В прививочных кабинетах:
Двухкамерные холодильники с автономным компрессором для каждой камеры:
сверху – холодильная камера для хранения ИЛП объёмом 130-250л, снизу –
холодильная камера для хранения других термолабильных ЛП объёмом 25-140л
или
Однокамерные холодильники в количестве не менее 2.
П. 6.26 Для замораживания хладоэлементов в условиях прививочного
кабинета можно использовать морозильное отделение двухкамерного
холодильника.
В морозильном отделении холодильника могут также храниться форма для
замораживания льда и пузырь со льдом для оказания экстренной
медицинской помощи.
97
98.
Хранение на 3 уровнеКонтроль температурного режима. Размещение средств
измерения температуры и средств выявления нарушений
температурного режима
Холодильник оснащается:
встроенным термометром,
2 автономными термометрами и
2 термоиндикаторами (терморегистраторами).
Датчик встроенного термометра размещается в контрольной точке каждой
камеры холодильника, которая определяется производителем и обозначается
на термокарте холодильника.
Автономные термометры и термоиндикаторы (терморегистраторы)
размещаются рядом друг с другом непосредственно на коробках с ИЛП или
непосредственно на полках в двух контрольных точках каждой камеры
холодильника:
Наиболее «теплой» (наиболее удаленной от источника холода) и
Наиболее «холодной» (подверженной вероятному замораживанию, но не ближе
10 см к источнику холода).
98
99.
Хранение на 3 уровнеКонтроль температурного режима. Размещение средств
измерения температуры и средств выявления нарушений
температурного режима
Холодильные камеры (комнаты) оснащаются:
терморегистратором,
встроенным и автономными термометрами, а также
термоиндикаторами.
Датчик встроенного термометра и встроенного терморегистратора (либо автономные
терморегистраторы) размещаются по периметру холодильной камеры (комнаты) на уровне
средних полок стеллажей не менее чем в двух контрольных точках, определенных
производителем холодильной камеры (комнаты) или в соответствии с термокартой.
Автономные термометры и термоиндикаторы размещаются не менее чем в трех
контрольных точках:
На нижней полке, наиболее удаленной от двери,
На средней полке в центре камеры (комнаты) и
Вблизи двери.
Автономные термометры и термоиндикаторы размещаются непосредственно на
коробках с ИЛП рядом друг с другом.
Точки размещения автономных средств контроля определяются в соответствии с термокартой.
99
100.
Хранение на 3 уровнеКонтроль показаний приборов
Контроль показаний каждого термометра осуществляется два раза в
сутки: в начале и конце рабочего дня (на 4 уровне – в рабочие дни).
Показания термометров регистрируются в специальном журнале.
Информация о динамике температуры по данным терморегистратора
сохраняется на электронном и бумажном носителе.
Создание электронной копии и распечатку данных на бумажном
носителе следует делать при хранении:
Не реже 1 раза в неделю либо
После окончания этапа транспортирования или
При возникновении аварийной ситуации.
Данная информация хранится на каждом уровне в течение 1 года.
100
101.
Иммунобиологические лекарственные препаратыЖУРНАЛ РЕГИСТРАЦИИ ТЕМПЕРАТУРЫ В ХОЛОДИЛЬНОМ ОБОРУДОВАНИИ
Дата
Время
Показания
термометров
N1
N2
Показания термоиндикаторов
N1
Идентификацион
ный номер
N2
Показания
Идентификацион Показания
ный номер
9.00
+5
+5
Норма
Норма
17.00
+5
+5
Норма
Норма
9.00
+5
+5
Норма
Норма
17.00
+5
+5
Норма
Норма
Постановление Главного гос. Сан. врача РФ от 17.02.2016 «Об утверждении санитарно-эпидемиологических правил СП
N 19
3.3.2.3332-16 "Условия транспортирования и хранения иммунобиологических лекарственных препаратов"
101
102.
Хранение на 3 уровнеКонтроль показаний приборов (продолжение)
Контроль показаний каждого термоиндикатора в оборудовании для
хранения ИЛП осуществляется 2 раза в сутки (на 4 уровне – в рабочие
дни).
Показания каждого термоиндикатора регистрируются в специальном
журнале.
При
транспортировании
ИЛП
контроль
показаний
каждого
термоиндикатора производится при загрузке (отправлении) и выгрузке
(получении) препаратов.
Показания
каждого
термоиндикатора
с
указанием
его
персонифицированного номера регистрируются в специальном журнале
учета движения ИЛП (приложение 3 к ПГГСВ №19).
102
103.
Иммунобиологические лекарственные препаратыЖУРНАЛ УЧЕТА ДВИЖЕНИЯ ИЛП
Приход
Дата
Название Производ Поставщ Серия,
Срок
Количест
Тип и
Показани
Дата
поступле
ИЛП
итель
ик
контр. годности
во
контрольны
я
отпуска
ния
номер
доз/фасо
й номер
термоинд
вка
термоиндик икатора
атора
Расход
Кому
Количест
отпущено
во
доз/фасо
вка
Постановление Главного гос. Сан. врача РФ от 17.02.2016 «Об утверждении санитарно-эпидемиологических правил СП
Остаток
(доз)
Тип и
Показания
контрольны термоинди
й номер
катора
термоиндик
атора
N 19
3.3.2.3332-16 "Условия транспортирования и хранения иммунобиологических лекарственных препаратов"
103
104.
Постановление Главного гос. Сан. врача РФ от 17.02.2016 №19 «Обутверждении санитарно-эпидемиологических правил СП 3.3.2.3332-16 "Условия
транспортирования и хранения иммунобиологических лекарственных
препаратов« (раздел 8)
8.1. На всех уровнях "холодовой цепи" в специальном журнале проводится
регистрация поступления и отправления ИЛП в организации с указанием:
наименования производителя препарата,
его количества (для вакцин и растворителей к ним - в дозах),
серии,
контрольного номера,
срока годности,
даты поступления (отправления),
организации-поставщика,
показаний термоиндикаторов и их идентификационных номеров,
фамилии, имени, отчества (при наличии) ответственного работника, осуществляющего
регистрацию.
104
105.
Хранение на 3 уровнеСроки хранения ИЛП (раздел 8)
П. 8.10.3. Не допускается отгрузка ИЛП на 3 уровень со сроком годности
менее 4 месяцев.
Длительность хранения ИЛП на третьем уровне:
не более 3 месяцев,
при розничной реализации ИЛП – в течение срока годности препарата, но
не позднее 7 суток до его окончания.
Длительность хранения ИЛП на 4 уровне не должна превышать 1
месяца.
В труднодоступных районах срок хранения может быть увеличен до 3
месяцев.
Не допускается хранение вакцин в холодильнике с другими ЛС.
105
106.
Хранение на 3 уровнеОборудование
Требования по уборке оборудования для хранения
ИЛП (раздел 6)
Текущая уборка
Генеральная уборка
Холодильник
По мере необходимости
Не реже 1 раза в месяц
• Отключение
от
источника
электроснабжения.
• Мытье
и
обработка
дезинфицирующими
средствами
внутренних
и
наружных
поверхностей
Морозильник (морозильное
отделение холодильника)
По мере необходимости
Не реже 1 раза в месяц
• Отключение
от
источника
электроснабжения.
• Мытье
и
обработка
дезинфицирующими
средствами
внутренних
и
наружных
поверхностей
Холодильные камеры (комнаты),
морозильные камеры
• Ежедневно
• По мере необходимости
Не реже 1 раза в месяц
106
107.
Иммунобиологические препараты хранят раздельнопо:
наименованиям,
сериям,
с учетом срока их годности.
Температура хранения этих средств указана в
инструкции.
Не реже 1 раза в месяц иммунобиологические
препараты подвергаются визуальному контролю.
N 706н
Приказ Минздравсоцразвития РФ «Об утверждении правил хранения лекарственных средств» от 23.08.2010
107
108.
Порядок отпуска ИЛППриказ МЗ РФ от 11.07.2017г. №403н «Об утверждении Правил отпуска ЛП для
медицинского применения, в том числе иммунобиологических ЛП, аптечными
организациями, индивидуальными предпринимателями, имеющими лицензию на
фармацевтическую деятельность»
13. При отпуске иммунобиологического лекарственного препарата на рецепте
или корешке рецепта, который остается у лица, приобретающего (получающего)
лекарственный препарат, указывается точное время (в часах и минутах)
отпуска лекарственного препарата.
Отпуск иммунобиологического лекарственного препарата осуществляется лицу,
приобретающему (получающему) лекарственный препарат, при наличии у него
специального термоконтейнера, в который помещается лекарственный
препарат, с разъяснением необходимости доставки данного лекарственного
препарата в медицинскую организацию при условии хранения в специальном
термоконтейнере в срок, не превышающий 48 часов после его
приобретения.
108
109.
Порядок хранения ИЛПОрганизация экстренных мероприятий (раздел 9)
В каждой организации, осуществляющей деятельность по транспортированию, хранению и
использованию ИЛП, должен быть разработан и утвержден руководителем организации план
мероприятий по обеспечению "холодовой цепи" в чрезвычайных ситуациях (Приложение N 4
ПГГСВ №19).
9.3. В плане экстренных мероприятий должны быть четко определены:
- порядок и средства оповещения ответственных лиц на случай чрезвычайной ситуации;
- порядок действий по обеспечению условий хранения и транспортирования ИЛП и должностные
лица, ответственные за эти действия;
- места размещения и порядок использования резервного оборудования для "холодовой цепи", в
том числе оборудования для контроля температурного режима и автономных источников
освещения;
- порядок включения и использования системы автономного электропитания;
- транспорт для перевозки ИЛП с указанием контактных телефонов водителей.
9.4. Для выполнения плана экстренных мероприятий в чрезвычайных ситуациях на втором,
третьем и четвертом уровнях "холодовой цепи" должен быть запас термоконтейнеров,
термоиндикаторов (терморегистраторов) и замороженных хладоэлементов (наличие
109
морозильников или морозильных камер).
110.
Уничтожение ИЛПВыявление ФНК ЛП и (или) с истекшим сроком
годности
Акт о перемещении.
Постановление Роспотребнадзора и ГГСВ
РФ от 09.12.2020г. №163
«Об утверждении САНПИН 2.1.7.2790-10…»
Зона хранения ФНК ЛП + ЛП с истекшим сроком
годности
«Отходы. Класс Г».
Передать на уничтожение ЛП организации, имеющей
лицензию на деятельность по сбору,
транспортированию, обработке, утилизации,
обезвреживанию, размещению отходов I – IV классов
опасности в соответствии с договором
Получить акт об уничтожении ЛП
(2 экземпляра)
Постановление Правительства РФ от
03.09.2010 г. №674 «Об утверждении
правил уничтожения ФНК ЛС»
Направить в Росздравнадзор 1 экземпляр
акта об уничтожении ЛП в течение 5 дней
со дня его составления
110
111.
3. Хранение ЛС, подлежащих ПКУ111
112.
Нормативные акты, регламентирующие предметноколичественный учет лекарственных средствПриказ МЗ РФ № 378н от 17.06.2013 г. « об утверждении правил
регистрации операций, связанных с обращением ЛС для медицинского
применения, включенных в перечень ЛС для медицинского применения,
подлежащих ПКУ, в специальных журналах учета операций….»
Приказ МЗ РФ № 30н от 20 января 2014 г. Об утверждении порядка
включения лекарственных средств в перечень лекарственных средств для
медицинского применения, подлежащих предметно-количественному учету
Приказ МЗ РФ . № 183н от 22 апреля 2014 г Об утверждении перечня
лекарственных средств для медицинского применения, подлежащих предметноколичественному учету
13.10.2014
112
113.
Перечень особо контролируемых групп лекарственных средствРаздел I. Лекарственные средства - фармацевтические субстанции и лекарственные
препараты, содержащие НС, ПВ и их ПК (их соли, изомеры, стереоизомеры), включенные в списки II,
III, IV перечня НС, ПВ и их ПК, подлежащих контролю в РФ, утвержденного постановлением
Правительства РФ от 30 июня 1998 г. N 681
Раздел II. Лекарственные средства - фармацевтические субстанции и лекарственные
препараты, содержащие СД и ЯВ (их соли, изомеры, простые и сложные эфиры, смеси и растворы
независимо от концентрации), внесенные в списки СД и ЯВ, утвержденные постановлением
Правительства РФ от 29 декабря 2007 г. № 964
Раздел III. Комбинированные лекарственные препараты, содержащие кроме малых количеств
наркотических средств, психотропных веществ и их прекурсоров другие фармакологические
активные вещества, поименованные в пункте 5 приказа МЗСР от 17.05.12 г. № 562.
Раздел IV. Иные лекарственные средства, подлежащие предметно-количественному учету:
Прегабалин (лекарственные препараты)
Приказ МЗ РФ№378н от 17.06.2013 г. «Об утверждении правил регистрации
операций, связанных с обращением ЛС для медицинского применения, включенных
Тропикамид (лекарственные препараты)
в перечень ЛС для медицинского применения, подлежащих ПКУ, в специальных
журналах учета операций….»
Циклопентолат (лекарственные препараты).
113
114.
Хранение ЛП, подлежащих ПКУ706н
ЛС, подлежащие предметноколичественному учету в соответствии с
Приказом Министерства здравоохранения
и социального развития Российской
Федерации от 11.07.2017 N403н «Об
утверждении", за исключением НС и ПВ,
СД и ЯД, хранятся
в металлических или деревянных
шкафах,
опечатываемых или пломбируемых в
конце рабочего дня.
ГФ XIV
646н
ЛП, подлежащие предметноколичественному учету , за
исключением наркотических,
психотропных, сильнодействующих и
ядовитых ЛС, хранятся
в металлических или деревянных
шкафах,
опечатываемых или пломбируемых
в конце рабочего дня.
115.
Хранение ЛП, подлежащих ПКУ706н
Хранение СД и ЯД, находящихся под контролем в
соответствии с международными правовыми
нормами, осуществляется в помещениях,
оборудованных инженерными и техническими
средствами
охраны,
аналогичными
предусмотренным для хранения НС и ПВ.
Допускается хранение в одном технически
укрепленном помещении СД и ЯД, находящихся
под международным контролем, и НС и ПВ.
При этом хранение СД и ЯД должно
осуществляться (в зависимости от объема
запасов) на разных полках сейфа (металлического
шкафа) или в разных сейфах (металлических
шкафах).
Хранение СД и ЯД, не находящихся под
международным контролем, осуществляется в
металлических шкафах, опечатываемых или
пломбируемых в конце рабочего дня.
ГФ XIV
646н
ЛП, содержащие НС и ПВ, должны храниться в
соответствии с законодательством РФ о НС и ПВ.
Хранение ЛП, содержащих СД и ЯД, находящихся
под
контролем
в
соответствии
международными
правовыми
нормами,
осуществляется в помещениях, оборудованных
инженерными и техническими средствами охраны,
аналогичными предусмотренным для хранения
НС и ПВ.
Допускается хранение в одном технически
укрепленном помещении ЛП, содержащих НС и
ПВ и ЛП, содержащих СД и ЯД.
При этом хранение таких лекарственных
препаратов должно осуществляться (в зависимости
от объема запасов) на разных полках сейфа
(металлического шкафа) или в разных сейфах
(металлических шкафах), опечатываемых или
пломбируемых в конце рабочего дня.
N 61-ФЗ
116.
Нормативные документы• Приказ МЗ РФ от 17.06.2013 г. №378н «Об утверждении
правил регистрации операций, связанных с обращением
ЛС для медицинского применения, включенных в
перечень ЛС, подлежащих ПКУ…»
117.
Положения, утвержденные приказом МЗ Россииот 17.06.2013 г. № 378н
Правила регистрации операций, связанных с
обращением ЛС для медицинского применения,
включенных в перечень лекарственных средств,
подлежащих ПКУ, в специальных журналах учета
операций (журналы учета);
2. Правила ведения и хранения специальных журналов
учета.
3. Формы Журналов учета операций, связанных с
обращением лекарственных средств, подлежащих
ПКУ
1.
117
118.
ПРАВИЛАрегистрации операций, связанных с обращением лекарственных
средств, включенных в перечень лекарственных средств,
подлежащих предметно-количественному учету
Регистрация осуществляется в специальных журналах учета операций:
№ 1;
Производителями ЛС и организациями оптовой торговли согласно приложению
Аптечными организациями и индивидуальными предпринимателями имеющими
лицензию на фармацевтическую деятельность согласно приложению № 2;
Медицинскими организациями и индивидуальными предпринимателями,
имеющими лицензию на медицинскую деятельность, согласно приложению № 3.
Ведется по каждому торговому наименованию (для каждой отдельной дозировки
и лекарственной формы) на бумажном носителе или в электронном виде.
лицами, уполномоченными руководителем юридического лица на ведение и
хранение журналов учета,
118
119.
Настоящие Правила не распространяются на ведение и хранение специальныхжурналов учета операций, связанных с наркотическими средствами, психотропными
веществами и их прекурсорами,
Журналы учета оформляются на календарный год.
Перед началом их ведения Журналы учета, на бумажном носителе,
сброшюровываются, пронумеровываются и скрепляются подписью руководителя ЮЛ
(ИП) и печатью ЮЛ (ИП).
Листы журналов учета, заполняемых в электронной форме, ежемесячно
распечатываются, нумеруются, подписываются лицом, уполномоченным на ведение и
хранение журналов учета, и брошюруются по наименованиям лекарственного
средства, дозировке, лекарственной форме.
По истечении календарного года сброшюрованные листы оформляются в журнал,
опечатываются с указанием количества листов и заверяются подписью лица, уполномоченного
на ведение и хранение журналов учета, руководителя юридического лица (индивидуального
предпринимателя) и печатью ЮЛ (ИП)
119
120.
Записи в журналах учета производятся в конце рабочего дня наосновании документов, подтверждающих совершение приходных и
расходных операций.
Поступление отражается в журнале учета по каждому приходному
документу в отдельности с указанием номера и даты.
Расход записывается ежедневно.
Аптечные организации и индивидуальные предприниматели, записывают
ежедневный расход лекарственного средства с указанием отдельно по
рецептам и по требованиям медицинских организаций.
Исправления в журналах учета заверяются подписью лица,
уполномоченного на ведение и хранение журналов учета. Подчистки и
незаверенные исправления в журналах учета не допускаются.
На последнее число каждого месяца, проводится сверка фактического
наличия лекарственных средств с их остатком по журналу учета и вносит
соответствующие записи в журнал учета.
120
121.
Хранение журнала учетаЖурнал учета хранится в металлическом шкафу (сейфе),
ключи от которого находятся у лица, уполномоченного на
ведение и хранение журнала учета.
Приходные и расходные документы (их копии)
подшиваются в порядке их поступления по датам и
хранятся вместе с журналом учета.
Заполненные журналы учета хранятся в архиве
юридического лица индивидуального предпринимателя
(срок хранения не указан)
121
122.
N 378нПриказ Минздрава РФ «Об утверждении правил регистрации операций, связанных с обращением ЛС, включенных в перечень ЛС,
подлежащих предметно-количественному учету…» от 17.06.2013
123.
https://yandex.by/collections/card/5b7ff9931a9efd00b954a097/
08.10.2015
В.П.Падалкин
123
124.
ХРАНЕНИЕ НАРКОТИЧЕСКИХ СРЕДСТВ ИПСИХОТРОПНЫХ ВЕЩЕСТВ
124
125.
Нормативные акты, регламентирующие хранение НЛС и ПЛС1. ФЗ «О наркотических средствах и психотропных веществах» (№ 3-ФЗ от 8 января1998
г. ред. от 03.02.2015 г.)
2. ПП РФ от 31.12.09 г. № 1148 ПП РФ «О порядке хранения наркотических средств,
психотропных веществ и их прекурсоров»
3. «О порядке установления требований к оснащению инженерно-техническими
средствами охраны объектов и помещений…»(ПП № 1035 от 17.12.2010 г.)
4. Приказ МЗСР России «Об утверждении правил хранения лекарственных средств» (№
706 н от 23.08.10 г. в ред. от 28.12.2010 г.)
5. Приказ МЗ «Об утверждении специальных требований к условиям хранения НС и
ПВ……..(№484 н от 24.07.2015 г.).
6. Приказ Росгвардии № 1, МВД № 5 от 09.01.2018 г. "Об утверждении Требований к
оснащению инженерно-техническими средствами охраны объектов и помещений, в
которых осуществляются деятельность, связанная с оборотом наркотических средств,
психотропных веществ
125
126.
Подлежат хранениюЗапасы НС и ПВ
Прекурсоры
СДВ, ЯВ
Требования
накладные
Рецепты на НС
Журналы регистрации
/ Заполненные
журналы
регистрации
126
127.
Запасы НС и ПВЗапасы НС и ПВ, зарегистрированных в установленном порядке в РФ в качестве лекарственных
средств, предназначенных для медицинского применения, определяются юридическими
лицами на основании установленных Министерством здравоохранения и социального развития
Российской Федерации нормативов для расчета потребности в указанных лекарственных
средствах, предназначенных для медицинского применения.
• Сроки использования запаса не лимитируются. Запас это не срок хранения, а возможный
срок использования
• Контролирующим органам недопустимо требовать наличия «нулевого» остатка
наркотиков или обязательного расходования их при отсутствии показаний к использованию
(письмо МЗ РФ от 02.11.2005 . № 5268-ВС)
• На новые наркотические и психотропные лекарственные препараты пока не установлены
расчетные нормативы потребности. ЮЛ могут производить расчет с учетом их фактического
оборота за 3-5 лет (письмо МЗ от 21.03.13 г. № 25-4/10/2-1971)
ПП РФ от 31.12.09 г. № 1148 пункт 4
127
128.
РАСЧЕТНЫЕ НОРМАТИВЫ ПОТРЕБНОСТИ НС И ПВДЛЯ АМБУЛАТОРНЫХ И СТАЦИОНАРНЫХ БОЛЬНЫХ
Приказ Минздрава РФ «О мерах по улучшению учета, хранения, выписывания и использования НС и
ПВ» №330 от 12.11.1997г.
1) РАСЧЕТНЫЕ НОРМАТИВЫ ПОТРЕБНОСТИ НАРКОТИЧЕСКИХ СРЕДСТВ И ПСИХОТРОПНЫХ ВЕЩЕСТВ НА
1000 ЧЕЛОВЕК НАСЕЛЕНИЯ В ГОД (В ГРАММАХ) для МО, оказывающих первичную медико-санитарную и
паллиативную медицинскую помощь в амбулаторных условиях
2) РАСЧЕТНЫЕ НОРМАТИВЫ ПОТРЕБНОСТИ В НАРКОТИЧЕСКИХ СРЕДСТВАХ И ПСИХОТРОПНЫХ
ВЕЩЕСТВАХ НА ОДНУ КОЙКУ В ГОД для МО, оказывающих специализированную, в том числе высокотехнологичную
медицинскую помощь
(Руководителям органов управления здравоохранением субъектов РФ разрешается по представлениям руководителей ЛПУ увеличивать приведенные в настоящей
таблице расчетные нормативы, но не более чем в 1,5 раза.
Руководителям ЛПУ разрешается перераспределять между отделениями указанные в настоящей таблице НС и ПВ в
пределах общего норматива потребности на учреждение по каждому наименованию.
При наличии медицинских показаний для купирования выраженного болевого синдрома в указанных в настоящей таблице
отделениях ЛПУ разрешается использовать неинвазивные формы НС и ПВ в количествах, соответствующих медицинским
показаниям и состоянию больного)
+ Приказ Минздрава РФ «Об утверждении нормативов для расчета потребности в НС и ПВ,
предназначенных для медицинского применения» №917н от 20.12.2016
129.
РАСЧЕТНЫЕ НОРМАТИВЫ ПОТРЕБНОСТИ НС И ПВВ АПТЕКАХ СТАЦИОНАРНЫХ МО
Расчет годовой потребности наркотических средств составляется в 2-х
экземплярах, заверяется подписью главного врача и круглой печатью.
Ежегодно, приказом по учреждению, утверждается потребность наркотических
средств и психотропных веществ на год, с учетом фактического максимального
расхода наркотических средств и психотропных веществ за последние три года.
На основании расчета, приказом по стационарному ЛПУ, утверждается
ежемесячный расход наркотических средств и психотропных веществ по
учреждению.
Запас НС и ПВ в аптеках больниц на первое число каждого месяца не должен
превышать утвержденной месячной потребности, рассчитанной из реального
максимального месячного расхода за последние три года.
130.
Постановление Правительства РФ№892 от 06.08.1998
«Об утверждении правил допуска лиц к работе с НС
и ПВ, а также к деятельности, связанной с оборотом
прекурсоров НС и ПВ»
Постановление правительства РФ «О лицензировании деятельности по обороту наркотических средств,
психотропных веществ и их прекурсоров, культивированию наркосодержащих растений » №1085 от 22.12.2011
130
131.
ДОПУСКДопуск лиц к работе с НС и ПВ осуществляется
• руководителями организаций, учреждений и предприятий независимо от их организационно-правовой формы
или
• лицами, их замещающими
Допуск лиц к работе с НС и ПВ предусматривает
• ознакомление этих лиц с законодательством РФ о наркотических средствах, психотропных веществах,
прекурсорах и включение в трудовой договор взаимных обязательств организации и лица, связанных с
оборотом НС и ПВ.
Не допускаются к работе с НС и ПВ , лица:
• не достигшие 18-летнего возраста
• лица, в отношении которых отсутствуют справки и заключения, предусмотренные соответственно абзацами
третьим и четвертым пункта 3 статьи 10 и абзацами вторым и третьим пункта 7 статьи 30 Федерального закона
"О наркотических средствах и психотропных веществах".
Постановление правительства РФ «О лицензировании деятельности по обороту наркотических средств,
психотропных веществ и их прекурсоров, культивированию наркосодержащих растений » №1085 от 22.12.2011
131
132.
ДОПУСКабзац третий и четвертый пункта 3 статьи 10
Наличие:
справки, выданные учреждениями государственной или муниципальной системы здравоохранения,
об отсутствии у работников, которые в силу своих служебных обязанностей получат доступ
непосредственно к НС и ПВ, заболеваний наркоманией, токсикоманией, хроническим
алкоголизмом;
заключения органов по контролю за оборотом НС и ПВ об отсутствии у работников, которые в
силу своих служебных обязанностей получат доступ непосредственно к НС и ПВ, непогашенной
или неснятой судимости за преступление средней тяжести, тяжкое преступление или преступление,
связанное с незаконным оборотом НС и ПВ, в том числе совершенное вне пределов РФ, а равно о
том, что указанным работникам не предъявлено обвинение в совершении преступлений, связанных с
незаконным оборотом НС и ПВ, и о соответствии установленным требованиям объектов и
помещений, где осуществляется деятельность, связанная с оборотом НС и ПВ.
Постановление правительства РФ «О лицензировании деятельности по обороту наркотических средств,
психотропных веществ и их прекурсоров, культивированию наркосодержащих растений » №1085 от 22.12.2011
132
133.
ДОПУСКабзац второй и третий пункта 7 статьи 30
Наличие:
справки, выданные учреждениями государственной или муниципальной системы
здравоохранения, об отсутствии у работников, которые в силу своих служебных
обязанностей получат доступ непосредственно к прекурсорам, заболеваний наркоманией,
токсикоманией, хроническим алкоголизмом в порядке, установленном законодательством
Российской Федерации;
заключения органов по контролю за оборотом НС и ПВ об отсутствии у работников,
которые в силу своих служебных обязанностей получат доступ непосредственно к
прекурсорам, непогашенной или неснятой судимости за преступление средней тяжести,
тяжкое и особо тяжкое преступление или преступление, связанное с незаконным оборотом
НС и ПВ и их прекурсоров, в том числе совершенное за пределами Российской Федерации.
Постановление правительства РФ «О лицензировании деятельности по обороту наркотических средств,
психотропных веществ и их прекурсоров, культивированию наркосодержащих растений » №1085 от 22.12.2011
133
134.
ДОПУСКСтудентам
организаций,
осуществляющих
образовательную деятельность по образовательным
программам
среднего
профессионального
образования и высшего образования,
разрешается работать в ходе учебного процесса с
наркотическими
средствами,
психотропными
веществами и (или) прекурсорами только в
присутствии лиц, допущенных к работе с ними в
установленном порядке
134
135.
ДОПУСКПостановление Правительства РФ от 23.09.2002 № 695 "О прохождении обязательного
психиатрического освидетельствования…… "
Постановление Правительства РФ от 18 мая 2011 г. № 394 ред. от 04.09.12 г. «Об утверждении
перечня отдельных видов профессиональной деятельности и деятельности, связанной с источником
повышенной опасности, на занятие которыми устанавливаются ограничения для больных
наркоманией»
Приказ Минздравсоцразвития РФ от 12 апреля 2011 г. № 302н в ред. от 05.12.2014 № 801н «Об
утверждении перечней вредных и (или) опасных производственных факторов и работ, при
выполнении которых проводятся обязательные предварительные и периодические медицинские
осмотры (обследования)…»
Приказ Минздравсоцразвития РФ от 02.05.2012 г. № 441н «Об утверждении порядка выдачи
медицинскими организациями справок и медицинских заключений»
Приказ Минздрава России от 15.12.14 г. № 834н «Об утверждении унифицированных форм
медицинской документации, используемых в медицинских организациях, оказывающих
медицинскую помощь в амбулаторных условиях, и порядков по их заполнению»
135
136.
ДОПУСКПриказ Миндравсоцразвития РФ от 11 апреля 2012 г. № 339н «Об утверждении разъяснения по
применению перечня отдельных видов профессиональной деятельности и деятельности, связанной
с источником повышенной опасности, на занятие которыми устанавливаются ограничения для
больных наркоманией, утвержденного постановлением Правительства РФ от 18 мая 2011 г. № 394
Приказ МВД РФ от 17.07.2017 №470 «Об утверждении административного регламента МВД РФ
государственной услуги по выдаче заключений об отсутствии у работников, которые в
соответствии со своими служебными обязанностями должны иметь доступ к наркотическим
средствам, психотропным веществам, внесенным в список I прекурсорам или культивируемым
наркосодержащим растениям, непогашенной или неснятой судимости за преступление средней
тяжести, тяжкое, особо тяжкое преступление или преступление, связанное с незаконным оборотом
наркотических средств, психотропных веществ, их прекурсоров либо с незаконным
культивированием наркосодержащих растений, в том числе за преступление, совершенное за
пределами российской федерации
136
137.
Порядок получения заключений органов ГУКН России(Главное управление по контролю за наркотиками)
Об отсутствии судимости…….
Руководитель организации (лицо, его
замещающее) или ИП направляет в органы
ГУКН запрос с приложением анкеты
указанного лица по формам и в порядке,
которые установлены Федеральной службой
Российской Федерации по контролю за
оборотом наркотиков.
Направлять граждан в ГУКН России не
допускается
13.10.2014
137
138.
ДОПУСКЗаключение ГУКН России выдаются юридическому
лицу, а не физическому лицу
При переходе сотрудника на другое место работы
копия ранее выданного заключения не выдается,
необходимо оформлять новое заключение
138
139.
ДОПУСКДля получения справок сотрудниками, которые в соответствии со своими
служебными обязанностями должны иметь доступ к наркотическим средствам
и психотропным веществам, руководитель организации (лицо, его
замещающее) выдает направления в медицинские организации для
прохождения в установленном порядке предварительного (периодического)
медицинского осмотра (обследования) и обязательного психиатрического
освидетельствования.
На основании полученной информации отдел кадров составляет письменное
заключение о возможности допуска специалиста к работе с наркотическими
средствами и психотропными веществами.
139
140.
ДОПУСКПри отсутствии оснований, препятствующих допуску лица к работе с НС и ПВ
руководитель организации (лицо, его замещающее) или индивидуальный
предприниматель
издает соответствующий приказ
заключает с указанным лицом трудовой договор.
Срок действия допуска лица к работе с НС и ПВ, а также к деятельности,
связанной с оборотом прекурсоров, ограничивается сроком действия
трудового договора.
Список лиц, имеющих право доступа в помещения, утверждается приказом
руководителя юридического лица. (пост № 1148)
Постановление правительства РФ «О лицензировании деятельности по обороту наркотических средств,
психотропных веществ и их прекурсоров, культивированию наркосодержащих растений » №1085 от 22.12.2011
140
141.
ДОПУСКВ том случае, если трудовой договор был заключен в период, когда
сотрудник не работал с наркотическими средствами и психотропными
веществами и в договоре отсутствуют взаимные обязательства при
допуске к работе с наркотическими средствами и психотропными
веществами,
должно быть оформлено дополнительное соглашение к трудовому
договору.
141
142.
ДОПУСКВ
типовом трудовом договоре или дополнительно к нему оформляется трудовой договор по допуску
специалиста к работе с НС и ПВ, где должны быть оговорены взаимные обязательства сторон, а именно:
администрация учреждении обязана в письменном виде ознакомить сотрудника с существующими
нормативными документами, регламентирующими работу с НС и ПВ; административной и уголовной
ответственностью за нарушения порядка работы с ними; обеспечить условия работы в соответствии с
действующими приказами;
-
работник обязан осуществлять работу с НС и ПВ в соответствии с действующими приказами,
проходить медицинское освидетельствование в установленные сроки, своевременно представлять
сведения о себе, препятствующие работе с НС и ПВ;
-
в заключительной части договора оговаривается в письменном виде согласие работника на работу с НС
и ПВ, административная и уголовная ответственность за нарушения этой работы.
-
142
143.
ДОПУСК"Утверждаю"
Главный врач
"___"_____________20__ г.
Список
сотрудников ЛПУ, имеющих допуск к работе с наркотическими
средствами и психотропными веществами
N п/п
Ф.И.О.
Дата
рождения
Место
рождения
Адрес регистрации**
1
2
3
4
5
** В случае изменения места регистрации о течении года необходимо
указать и адрес предыдущей регистрации.
143
144.
144145.
Допуск к работе с НС и ПВ (психиатрическоеосвидетельствование и медосмотр)
Условие об обязательном прохождении психиатрического освидетельствования должно быть
прописано в трудовом договоре работника либо в коллективном договоре, правилах внутреннего
трудового распорядка или ином локальном нормативном акте работодателя, с которым работник
ознакомлен под роспись.
Освидетельствование работника проводится:
– на добровольной основе кроме случаев указанных в статье 23 Закона РФ от 2 июля 1992 г. № 3185-1 "О
психиатрической помощи и гарантиях прав граждан при ее оказании".
– не реже одного раза в 5 лет.
– в срок не более 20 дней с даты его обращения в комиссию
– с целью определения его пригодности по состоянию
психического здоровья к осуществлению отдельных видов деятельности, а также к работе в условиях
повышенной опасности, предусмотренных Перечнем.
– врачебной комиссией из трех врачей-психиатров, создаваемой органом управления
здравоохранением. Комиссия вправе запрашивать у медицинских учреждений дополнительные сведения,
о чем работник ставится в известность.
145
146.
Допуск к работе с НС и ПВ (психиатрическоеосвидетельствование и медосмотр)
Как правило, освидетельствование проводится в психо-неврологическом диспансере в течение
20 дней с момента обращения.
При необходимости она может запросить дополнительные сведения о здоровье работника в
других медицинских учреждениях.
Решение комиссия принимает простым большинством голосов и выдает его в письменной
форме работнику под роспись в течение трех дней после принятия.
В этот же срок работодателю направляется сообщение о дате принятия решения комиссией и
дате выдачи его работнику.
Комиссия принимает соответствующее решение в течение 10 дней после получения
дополнительных сведений. Решение принимается простым большинством голосов о
пригодности (непригодности) работника к выполнению вида деятельности (работы в условиях
повышенной опасности), указанного в направлении на освидетельствование.
146
147.
Допуск к работе с НС и ПВ (психиатрическоеосвидетельствование и медосмотр)
Формулировка в справке, которую может требовать работодатель только одна
«не имеет противопоказаний к выполнению деятельности, связанной с
оборотом НС и ПВ»
Нередко представляют справку «Информации о наличии психических
расстройств нет». Такая справка не для работодателя она для психиатра
комиссии.
Образцы форм направления на психиатрическое освидетельствование, решения
комиссии и сообщения работодателю приведены в Приказе Департамента
здравоохранения г. Москвы от 18 сентября 2008 г. N 705 «Об организации
обязательного
психиатрического
освидетельствования
работников,
осуществляющих отдельные виды деятельности…», которыми можно
воспользоваться, в случае если в субъекте РФ аналогичный приказ отсутствует.
147
148.
Перевозка1.
2.
3.
4.
5.
Федеральный закон от 08.01.98 г. № 3-ФЗ «О наркотических средствах и
психотропных веществах» (Статья 21)
Постановление правительства РФ от 12 июня 2008 г. N 449 «О порядке перевозки
наркотических средств, психотропных веществ и их прекурсоров на территории РФ, а
также оформления необходимых для этого документов» в ред. от 06.08.2015 г. № 807
Постановление Правительства РФ от 15 июня 1998 г. N 591 "Об утверждении
Правил провоза наркотических средств или психотропных веществ в лечебных целях
больными, следующими транзитом через территорию РФ"
Соглашение о порядке перемещения наркотических средств, психотропных веществ и
их прекурсоров по таможенной территории таможенного союза. Заключено в г.
Минске 24 октября 2013 года
Дополнительная информация Письмо Минздрава России от 21.10.2015 г. № 25-4/10/26290
148
149.
ПеревозкаЧто перевозится:
наркотические средства,
психотропные вещества
внесенные в Список I прекурсоры
Условия перевозки:
Лицензия у юридического лица
Обеспечение сохранности груза
Федеральный закон «О наркотических средствах и психотропных веществах» № 3-ФЗ от 08.01.1998
149
150.
ПеревозкаФизическим лицам разрешается перевозить НС и
ПВ:
полученные в медицинских целях, при наличии
документа, выданного аптечной организацией и
подтверждающего законность получения наркотических
средств и психотропных веществ.
Таким документом является сигнатура.
150
151.
ПеревозкаПостановление правительства РФ от 12 июня 2008 г.
N 449 «О порядке перевозки наркотических средств,
психотропных веществ и их прекурсоров на
территории РФ, а также оформления необходимых
для этого документов» в ред. от 06.08.2015 г. № 807
151
152.
ПеревозкаИзменения (ВСТУПИЛИ В СИЛУ В 2015 ГОДУ)
– установление нормы о наличии обязательной специализированной
охраны только при перевозке:
а) наркотических средств и психотропных веществ, внесенных в список I
перечня, а также прекурсоров;
б) наркотических средств и психотропных веществ, внесенных в списки II и
III перечня, предназначенные для дальнейших производства, изготовления
(за исключением изготовления аптечными организациями), переработки и
распределения;
152
153.
ПеревозкаИзменения (ВСТУПИЛИ В СИЛУ В 2015 ГОДУ)
в) наркотических средств и психотропных веществ, внесенных в списки II и III
перечня, реализуемые организациям оптовой торговли наркотическими
средствами и психотропными веществами, а также
г) организациям, осуществляющим хранение наркотических средств и
психотропных веществ, предназначенных для ликвидации медикосанитарных последствий чрезвычайных ситуаций природного и
техногенного характера или для мобилизационных нужд.
153
154.
ПеревозкаОтменена норма о необходимости оформления маршрута перевозки
наркотических средств, психотропных веществ и их прекурсоров при
любых случаях перевозки указанных средств и веществ.
Норма о необходимости заполнения маршрута перевозки наркотических
средств, психотропных веществ и их прекурсоров (сроком до 1 года)
установлена только для случаев осуществления перевозки с
привлечением специализированной охраны.
154
155.
ПеревозкаКаким организациям нужно привлекать охрану к перевозке:
Производители
Импортеры
Оптовые организации
NB!! Для целей переработки или распределения
В иных случаях перевозки наркотических средств и психотропных
веществ, внесенных в списки II и III перечня (аптечными, медицинскими и
иными организациями), решение о необходимости обеспечения их охраны
принимается руководителем юридического лица.
155
156.
ПеревозкаПри отсутствии у организации лицензии на охрану при перевозке, к
охране должны быть привлечены:
подразделений вневедомственной охраны полиции или организации,
подведомственной Министерству внутренних дел РФ;
ведомственной охраны федеральных органов исполнительной власти или
организаций;
юридического лица, имеющего лицензию на осуществление частной
охранной деятельности.
156
157.
ПеревозкаДОКУМЕНТЫ, НЕОБХОДИМЫЕ ДЛЯ ПЕРЕВОЗКИ
договор перевозки,
договор поставки,
договор передачи на уничтожение
иной договор, в соответствии с которым у одной из сторон договора возникает обязанность
осуществить перевозку наркотических средств, психотропных веществ и прекурсоров (далее
– договор);
NB!!! без заключения договора в целях обеспечения наркотическими средствами,
психотропными веществами и прекурсорами своих структурных подразделений (филиал,
представительство или иное обособленное подразделение юридического лица, указанное в
его учредительных документах), адрес места нахождения которых отличается от адреса места
нахождения юридического.
157
158.
ПеревозкаПри каждой перевозке наркотических средств, психотропных веществ и
прекурсоров руководителем юридического лица, осуществляющего
перевозку наркотических средств, психотропных веществ и прекурсоров,
издается
приказ о назначении лиц, ответственных за их получение, доставку,
передачу и сохранность, допущенных в установленном порядке к работе с
наркотическими средствами, психотропными веществами и прекурсорами
(далее – лица, ответственные за перевозку).
158
159.
ПеревозкаВ приказе указываются:
транспортные средства, используемые для перевозки
наркотических средств, психотропных веществ и
прекурсоров,
дата и номер договора (если перевозка осуществляется
на его основании)
159
160.
ПеревозкаМЕСТО ПЕРЕВОЗКИ
Для перевозки наркотических средств, психотропных веществ и
прекурсоров используются закрытые транспортные средства, которые
оборудованы запирающим устройством и имеют места для
размещения лиц, ответственных за перевозку, и лиц, осуществляющих
охрану.
Для перевозки наркотических средств, психотропных веществ и
прекурсоров используются транспортная тара, упаковка и упаковочные
материалы, соответствующие установленным стандартам и
обеспечивающие в пути следования условия для сохранности
наркотических средств, психотропных веществ и прекурсоров
160
161.
ПеревозкаНаркотические средства, психотропные вещества и
прекурсоры, упакованные юридическим лицом-отправителем
в транспортную тару, упаковку или упаковочный материал с
указанием адресов отправителя и получателя наркотических
средств,
психотропных
веществ
и
прекурсоров,
опечатываются (пломбируются).
Номера (описание) печатей (пломб), использованных при
опечатывании (пломбировании), указываются в акте.
161
162.
ПеревозкаПри перевозке наркотических средств, психотропных веществ и прекурсоров
лица, ответственные за перевозку, должны иметь при себе следующие
документы:
товарно-транспортные накладные, счета, счета-фактуры, требования
заверенные печатью юридического лица, осуществляющего перевозку
наркотических средств, психотропных веществ и прекурсоров, копии лицензии и
приказа руководителя юридического лица;
маршрут перевозки наркотических средств, психотропных веществ и прекурсоров
(для случаев перевозки наркотических средств, психотропных веществ и
прекурсоров, обеспеченной охраной). Маршрут оформляется на срок до 1 года.
В случае необходимости изменения маршрута, он подлежит переоформлению;
акт.
162
163.
е) хранениеХранение
Статья 20. Хранение наркотических средств, психотропных веществ и
внесенных в Список I прекурсоров
1. Хранение НС и ПВ осуществляется юридическими лицами в порядке,
установленном Правительством РФ, в специально оборудованных
помещениях при наличии лицензии на указанный вид деятельности.
2. Хранение НС и ПВ в любых количествах в целях, не предусмотренных
настоящим Федеральным законом, запрещается.
Федеральный закон «О наркотических средствах и психотропных
веществах» № 3-ФЗ от 08.01.1998
163
164.
ХранениеПП РФ № 1148 от 31.12.2009
«О порядке хранения наркотических средств, психотропных веществ и их прекурсоров»
Хранение НС и ПВ осуществляется
в изолированных помещениях, специально оборудованных инженерными и техническими
средствами охраны
в местах временного хранения.
Постановление Правительства РФ «О порядке хранения наркотических средств, психотропных
веществ и их прекурсоров» №1148 от 31.12.2009
164
165.
ХранениеХранение
• К 1-й категории относятся помещения:
• юридических лиц, осуществляющих производство, изготовление (за исключением
изготовления аптечными организациями), переработку наркотических средств,
психотропных веществ и внесенных в список I прекурсоров;
• юридических лиц, осуществляющих оптовую торговлю наркотическими
средствами, психотропными веществами и внесенными в список I прекурсорами;
• юридических лиц, осуществляющих хранение наркотических средств и
психотропных веществ, предназначенных для ликвидации медико-санитарных
последствий чрезвычайных ситуаций природного и техногенного характера или
для мобилизационных нужд.
166.
ХранениеХранение
• Наркотические средства, психотропные вещества и прекурсоры в
помещениях 1 категории хранятся в запирающихся сейфах или
металлических шкафах.
• Допускается хранение наркотических средств, психотропных
веществ и прекурсоров на стеллажах (поддонах) в невскрытой
(неповрежденной) групповой или транспортной таре либо в
опечатанной таре в случае хранения больших объемов
наркотических средств, психотропных веществ и прекурсоров, не
позволяющих размещение их в сейфах (металлических шкафах).
167.
ХранениеХранение
• Ко 2-й категории относятся помещения:
• аптечных организаций, предназначенные для хранения 3-месячного или 6месячного запаса (для аптечных организаций, расположенных в сельских
населенных пунктах и удаленных от населенных пунктов местностях)
наркотических средств и психотропных веществ;
• ветеринарных аптечных организаций, предназначенные для хранения 3-месячного
запаса наркотических средств и психотропных веществ.
Наркотические средства, психотропные вещества и прекурсоры в помещениях 2
категории хранятся в запирающихся сейфах или металлических шкафах.
168.
ХранениеХранение
• К 3-й категории относятся помещения:
• медицинских и ветеринарных организаций, предназначенные для хранения 15дневного запаса наркотических средств и психотропных веществ,
внесенных в список II перечня, и месячного запаса психотропных веществ,
внесенных в список III перечня;
• медицинских организаций или обособленных подразделений медицинских
организаций, предназначенные для хранения наркотических лекарственных
препаратов и психотропных лекарственных препаратов, и производящих отпуск
указанных лекарственных препаратов физическим лицам в соответствии с
пунктом 1 статьи 25 Федерального закона от 8 января 1998 г. N 3-ФЗ "О
наркотических средствах и психотропных веществах" <1>;
• юридических лиц, предназначенные для хранения наркотических средств,
психотропных веществ и внесенных список I прекурсоров, используемых в
научных, учебных и экспертных целях.
169.
ХранениеХранение
• Наркотические средства, психотропные вещества и прекурсоры в помещениях
3 категории хранятся в запирающихся насыпных или прикрепленных к
полу (стене) сейфах не ниже 3-го класса устойчивости к взлому.
• Сейф массой менее 1000 килограммов прикрепляется к полу или стене либо
встраивается в стену с помощью анкерного крепления.
170.
ХранениеХранение
• К 4-й категории относятся помещения:
• медицинских и ветеринарных организаций, предназначенные для хранения
суточного запаса наркотических средств и психотропных веществ, внесенных в
список II перечня, и трехдневного запаса психотропных веществ, внесенных в
список III перечня;
• медицинских организаций, предназначенные для хранения неиспользованных
наркотических средств, принятых от родственников умерших больных.
Наркотические средства, психотропные вещества и пре- курсоры в помещениях 4
категории хранятся в запирающихся насыпных или прикрепленных к полу (стене)
сейфах не ниже 3-го класса устойчивости к взлому.
Сейф массой менее 1000 килограммов прикрепляется к полу или стене либо
встраивается в стену с помощью анкерного крепления.
171.
ХранениеХранение
• К местам временного хранения наркотических средств и психотропных веществ
относятся:
• укладки, наборы, комплекты для оказания первичной медико-санитарной, скорой и
специализированной медицинской помощи, в состав которых входят наркотические
средства и психотропные вещества.
• Решение о необходимости организации мест временного хранения,
предназначенных для хранения наркотических средств и психотропных веществ в
количестве, не превышающем суточного запаса, к которым могут быть отнесены
посты среднего медицинского персонала медицинских организаций, рабочие места
фармацевтических работников рецептурного отдела аптечных организаций, рабочие
места специалистов ветеринарных организаций и др., принимает руководитель
юридического лица (пункт 4(1) постановления Правительства РФ от 31.12.09 №
1148 в ред. от 06.08.2015).
172.
ХранениеХранение
• В местах временного хранения наркотические средства
• и психотропные вещества хранятся в запирающихся сейфах
• не ниже 1-го класса устойчивости к взлому или металлических либо
изготовленных из других высокопрочных материалов контейнерах.
173.
Охрана помещений НСПВ174.
ХранениеХранение
П. 10 В целях обеспечения сохранности наркотических средств, психотропных веществ и
прекурсоров помещения подлежат охране.
• Охрана помещений, относящихся к 1-й и 2-й категориям, осуществляется на
договорной основе подразделениями Федеральной службы войск национальной
гвардии Российской Федерации, организацией, подведомственной Федеральной службе
войск национальной гвардии Российской Федерации, либо ведомственной охраной
федеральных органов исполнительной власти и организаций, в ведении которых
находятся указанные помещения.
• Охрана помещений, относящихся к 3-й и 4-й категориям, осуществляется путем
привлечения:
• указанных охранных организаций (см. 1-2 категорию),
• либо юридических лиц, имеющих лицензию на осуществление частной охранной
деятельности.
Постановление Правительства РФ «О порядке хранения наркотических средств, психотропных
веществ и их прекурсоров» №1148 от 31.12.2009
175.
ХранениеХранение
П.11. Уровень инженерно-технической
оснащенности помещений, виды технических
средств охраны и класс устойчивости сейфов к
взлому определяются при заключении договора
с охранной организацией
Постановление Правительства РФ «О порядке хранения наркотических средств, психотропных
веществ и их прекурсоров» №1148 от 31.12.2009
176.
ХранениеР 78.36.032-2013
Инженерно-техническая укрепленность и оснащение техническими средствами охраны
объектов, квартир и МХИГ, принимаемых под централизованную охрану подразделениями
вневедомственной охраны. Часть 1. Методические рекомендации"
Инженерно-техническая укрепленность объекта:
совокупность мероприятий,
•направленных на усиление конструктивных элементов зданий, помещений и охраняемых
территорий,
•обеспечивающих необходимое противодействие несанкционированному проникновению в
охраняемую зону, взлому и другим преступным посягательствам.
Категория охраняемого объекта:
комплексная оценка объекта, учитывающая его экономическую или иную (например, культурную)
значимость, в зависимости
•от характера и концентрации сосредоточенных ценностей,
•последствий от возможных преступных посягательств на них,
•сложности обеспечения требуемой охраны.
176
177.
ХранениеР 78.36.032-2013
Инженерно-техническая укрепленность и оснащение техническими средствами охраны объектов,
квартир и МХИГ, принимаемых под централизованную охрану подразделениями вневедомственной
охраны. Часть 1. Методические рекомендации"
Система охранной сигнализации:
совокупность совместно действующих технических средств
•обнаружения проникновения (попытки проникновения) на охраняемый объект,
•сбора,
•обработки,
•передачи
•представления в заданном виде информации о проникновении (попытки проникновения) и другой
служебной информации.
Система тревожной сигнализации:
совокупность совместно действующих технических средств, позволяющих автоматически или в ручную
выдавать сигналы тревоги на ПЦО (в дежурную часть органов внутренних дел) при разбойном нападении
на объект в период его работы.
177
178.
ХранениеР 78.36.032-2013
Инженерно-техническая укрепленность и оснащение техническими средствами охраны объектов, квартир и МХИГ, принимаемых
под централизованную охрану подразделениями вневедомственной охраны. Часть 1. Методические рекомендации"
•Рубеж охранной сигнализации - шлейф сигнализации, совокупность шлейфов или лучей (для сигнализации,
использующей передачу извещений по радиоканалу), контролирующих охраняемые зоны, территории, здания или
помещения (периметр, объем или площадь последних, непосредственные ценности или подходы к ним), на пути
возможного движения нарушителя к материальным ценностям, при преодолении которых выдается соответствующее
извещение о проникновении.
•Первым рубежом охранной сигнализации, в зависимости от вида предполагаемых угроз объекту, блокируют:
•деревянные входные двери- на «открывание» и «разрушение» («пролом»);
•остекленные конструкции - на «открывание» и «разрушение» («разбитие») стекла;
•металлические двери - на «открывание» и «разрушение»;
•стены, перекрытия и перегородки, не удовлетворяющие требованиям настоящего Руководящего документа или за
которыми размещаются помещения других собственников, позволяющие проводить скрытые работы по разрушению
стены - на «разрушение» («пролом»);
•решетки, установленные с наружной стороны оконного проема - на «открывание» и «разрушение»;
•вентиляционные короба, дымоходы, места ввода/вывода коммуникаций сечением более 200 × 200 мм - на
«разрушение» («пролом»);
178
179.
ХранениеР 78.36.032-2013
Инженерно-техническая укрепленность и оснащение техническими средствами охраны
объектов, квартир и МХИГ, принимаемых под централизованную охрану подразделениями
вневедомственной охраны. Часть 1. Методические рекомендации"
•Вторым рубежом охранной сигнализации защищаются объемы помещений на
«проникновение» с помощью объемных извещателей различного принципа действия.
•Третьим рубежом охранной сигнализации в помещениях блокируются, отдельные предметы,
сейфы, металлические шкафы, в которых сосредоточены ценности.
179
180.
ХранениеР 78.36.032-2013
Инженерно-техническая укрепленность и оснащение техническими
средствами охраны объектов, квартир и МХИГ, принимаемых под
централизованную охрану подразделениями вневедомственной охраны.
Часть 1. Методические рекомендации"
•Для оперативной передачи сообщений на пункт централизованной охраны и/или
в дежурную часть органов внутренних дел объект должен оборудоваться
устройствами тревожной сигнализации (ТС): механическими кнопками,
радиокнопками, радиобрелоками, педалями, оптико-электронными извещателями
и другими устройствами.
•Система тревожной сигнализации организуется «без права отключения».
180
181.
РежимХранениехранения НС и ПВ
12. После окончания рабочего дня
сейфы, металлические шкафы и
помещения опечатываются
(пломбируются) и сдаются под охрану.
Не подлежат сдаче под охрану
помещения, имеющие круглосуточный
режим работы.
Постановление Правительства РФ «О порядке хранения наркотических средств, психотропных
веществ и их прекурсоров» №1148 от 31.12.2009
182.
Режим Хранениехранения НС и ПВ
Приказом руководителя ЮЛ назначаются лица, ответственные за хранение НС
и ПВ, допущенные к работе с НС и ПВ, и устанавливается порядок хранения
ключей от сейфов, металлических шкафов и помещений, а также
используемых при опечатывании (пломбировании) печатей и
пломбировочных устройств.
Список лиц, имеющих право доступа в помещения, утверждается приказом
руководителя ЮЛ.
ПП РФ от 31.12.09 г. № 1148 пункты 12,13 и 14
182
183.
ХранениеПорядок хранения ключей от сейфов, металлических шкафов и
помещений
Пример:
«По окончании рабочего времени ответственным лицом проверяется оттиск печати на сейфе, а
помещение (кабинет) закрывается и опечатывается»
«Ключ от помещения (кабинета) и сейфа размещается на посту охраны ЛПУ (в опечатанном сейфе
в кабинете зам.главного врача по лечебной части)»
И т.д.
183
184.
См. Таблица 1.1. Общие требованияк оснащению ограждающими конструкциями, элементами
инженерно-технической укрепленности различных категорий
объектов и помещений – классы защиты
185.
186.
187.
Хранение. Специальные требованияВ аптечном,
лечебно-профилактическом учреждении или
организации оптовой торговли лекарственными средствами
НС и ПВ для парентерального, внутреннего и наружного применения
должны храниться раздельно.
Приказ Минздрава РФ «Об утверждении специальных требований
к условиям хранения наркотических средств и психотропных
веществ, … » №484н от 24.07.2015
188.
Хранение. Специальные требованияВ аптечных
и медицинских организациях
на внутренних сторонах дверец сейфов или металлических шкафов, в которых
осуществляется хранение наркотических и психотропных лекарственных средств, должны
быть
вывешены списки хранящихся наркотических и психотропных лекарственных средств
с указанием их высших разовых и высших суточных доз.
Дополнительно в медицинских организациях
в местах хранения наркотических и психотропных лекарственных средств
размещаются таблицы противоядий при отравлениях указанными средствами.
Приказ Минздрава РФ «Об утверждении специальных требований к условиям
хранения наркотических средств и психотропных веществ, … » №484н от 24.07.2015
189.
В.П.Падалкин189
190.
В.П.Падалкин190
191.
Хранение. Специальные требованияХранение наркотических и психотропных лекарственных средств,
используемых в течение рабочего дня,
в ассистентских комнатах и рецептурных отделах аптечных учреждений,
в аудиториях учебных организаций,
а также в лабораториях научно-исследовательских организаций
осуществляется в сейфах (контейнерах) этих помещений или отделов.
По истечении рабочего дня наркотические и психотропные лекарственные средства
должны быть возвращены на место основного хранения наркотических и психотропных
лекарственных средств.
Приказ Минздрава РФ «Об утверждении специальных требований к условиям хранения наркотических
средств и психотропных веществ, … » №484н от 24.07.2015
192.
Хранение. Специальные требованияЗапрещается хранение в медицинских организациях наркотических и психотропных лекарственных
препаратов, изготовленных аптечной организацией, в случае отсутствия на упаковке лекарственного
препарата:
• этикетки, содержащей обозначения: "Внутреннее", "Наружное", "Глазные капли", "Глазные мази", "Для
инъекций" и иные обозначения, характеризующие наименование лекарственной формы и (или) способ
применения лекарственного препарата;
• наименования и местонахождения аптечной организации, изготовившей наркотический или
психотропный лекарственный препарат;
• наименований медицинской организации и ее структурного подразделения;
• состава наркотического или психотропного лекарственного препарата в соответствии с прописью,
указанной в требовании-накладной медицинской организации;
• даты изготовления и срока годности наркотического или психотропного лекарственного препарата,
данных о проведенном контроле качества лекарственного препарата;
• подписей лиц, изготовившего, проверившего и отпустившего наркотический или психотропный
лекарственный препарат из аптечной организации.
Приказ Минздрава РФ «Об утверждении специальных требований к условиям хранения наркотических
средств и психотропных веществ, … » №484н от 24.07.2015
193.
Хранение. Специальные требованияМеста хранения наркотических и психотропных лекарственных средств,
требующих защиты от повышенной температуры (холодильная камера, холодильник,
термоконтейнер),
необходимо оборудовать приборами учета температуры.
Приказ Минздрава РФ «Об утверждении специальных требований к условиям хранения наркотических
средств и психотропных веществ, … » №484н от 24.07.2015
194.
Хранение. Специальные требования• в помещениях, относящихся к 3-й категории, – в специальной зоне для
размещения холодильников (холодильных камер), отделенной от основного
места хранения металлической решеткой с запирающейся решетчатой
дверью;
• в помещениях, относящихся к 4-й категории, – в термоконтейнерах,
размещенных в сейфах;
• в местах временного хранения – в термоконтейнерах, размещенных в
сейфах, либо в металлических или изготовленных из других высокопрочных
материалов контейнерах, помещенных в термоконтейнеры.
08.10.2015
В.П.Падалкин
194
195.
Хранение требованияХранение. Специальные
• Недоброкачественные наркотические и психотропные лекарственные
выявленные
в аптечных организациях,
медицинских организациях
или организациях оптовой торговли лекарственными средствами,
средства,
• а также наркотические или психотропные лекарственные средства,
родственниками умерших больных в лечебно-профилактическое учреждение,
сданные
• до их списания и уничтожения
• подлежат хранению на отдельной полке или в отдельном отделении сейфа или
металлического шкафа.
Приказ МЗРФ № 484 от 24.07.2015 г. «Об утверждении специальных требований к условиям хранения НС и ПВ»
196.
Учет НС и ПВ196
197.
т) журналыУчет
Статья 39. Регистрация операций с наркотическими средствами, психотропными
веществами и внесенными в Список I прекурсорами
При осуществлении деятельности, связанной с оборотом наркотических средств,
психотропных веществ и внесенных в Список I прекурсоров, любые операции, в
результате которых изменяются количество и состояние наркотических средств и
психотропных веществ, а также количество внесенных в Список I прекурсоров, подлежат
регистрации в специальных журналах лицами, на которых эта обязанность возложена
приказом руководителя юридического лица.
Указанные журналы хранятся в течение 5 лет после внесения в них последней записи.
Порядок ведения и хранения указанных журналов устанавливается Правительством
Российской Федерации.
Федеральный закон «О наркотических средствах и психотропных веществах» № 3-ФЗ от 08.01.1998
197
198.
т) журналыУчет
НС и ПВ, находящиеся на хранении
в помещениях всех категорий
и в местах временного хранения,
подлежат учету в соответствии с Правилами ведения и хранения
специальных журналов регистрации операций, связанных с
оборотом НС и ПВ, утвержденными Постановлением
Правительства Российской Федерации от 4 ноября 2006 г. N
644.
Постановление Правительства РФ «О порядке хранения наркотических средств, психотропных
веществ и их прекурсоров» №1148 от 31.12.2009
198
199.
https://present5.com/osobennosti-raboty-slekarstvennymi-preparatami-dlya-medicinskogo/199
200.
т) журналыУчет
Постановление Правительства РФ № 644 от 04.11.2006
«О порядке предоставления сведений о деятельности, связанной с оборотом наркотических и
психотропных веществ и регистрации операций, связанных с оборотом наркотических средств и
психотропных веществ»
Регистрация операций, связанных с оборотом НС и ПВ, ведется по каждому наименованию НС и ПВ на
отдельном развернутом листе журнала регистрации или в отдельном журнале регистрации.
При осуществлении видов деятельности, связанных с оборотом НС и ПВ, любые операции, в результате
которых изменяются количество и состояние НС и ПВ, подлежат занесению в журнал регистрации.
Журналы регистрации должны быть сброшюрованы, пронумерованы и скреплены подписью
руководителя юридического лица и печатью юридического лица. При необходимости решением органа
исполнительной власти субъекта РФ определяется орган, заверяющий «Журнал».
Руководитель юридического лица назначает лиц, ответственных за ведение и хранение журналов
регистрации, в том числе в подразделениях.
ПП РФ «О порядке предоставления сведений о деятельности, связанной с оборотом НС и ПВ и
регистрации операций, связанных с оборотом НС и ПВ» №644 от 04.11.2006
200
201.
т) журналыУчет
Приказом руководителя юридического лица назначаются лица, ответственные за
ведение и хранение журнала регистрации операций, связанных с оборотом НС и ПВ,
во всех структурных подразделениях.
К структурным подразделениям юридического лица могут быть отнесены филиалы,
представительства и иные подразделения (обособленные и необособленные).
Наименования структурных подразделений (отделения, группы, палаты, отделы и
т.п.) должны быть отражены в учредительных и иных организационнораспорядительных документах юридического лица. Для каждого структурного
подразделения юридического лица должно быть утверждено положение.
Письмо Минздравсоцразвития РФ «Об обороте НС и ПВ и СД» №6811-ВС от 20.12.2006
201
202.
т) журналыУчет
Записи в журналах регистрации производятся лицом, ответственным за их ведение и
хранение, шариковой ручкой (чернилами) в хронологическом порядке непосредственно
после каждой операции по каждому наименованию НС и ПВ на основании документов,
подтверждающих совершение этой операции. Документы или их копии, подтверждающие
совершение операции с НС и ПВ, заверенные в установленном порядке, подшиваются в
отдельную папку, которая хранится вместе с соответствующим журналом регистрации.
Юридические лица ежемесячно проводят в установленном порядке инвентаризацию НС и
ПВ путем сопоставления их фактического наличия с данными учета (книжными
остатками).В журналах регистрации необходимо отразить результаты проведенной
инвентаризации НС и ПВ (дата инвентаризации, номер сличительной ведомости или
инвентаризационной описи). Согласно ст.38 ФЗ от 08.01.1998 №3-ФЗ сведения о
расхождении в балансе или несоответствии данных баланса результатам проведенной
инвентаризации в трехдневный срок после их обнаружения доводятся до сведения органов
по контролю за оборотом НС и ПВ.
ПП РФ «О порядке предоставления сведений о деятельности, связанной с оборотом НС и ПВ и
регистрации операций, связанных с оборотом НС и ПВ» №644 от 04.11.2006
202
203.
т) журналыУчет
Журнал регистрации НС и ПВ хранится в металлическом шкафу (сейфе) в
технически укрепленном помещении. Ключи от металлического шкафа
(сейфа) и технически укрепленного помещения находятся у лица,
ответственного за ведение и хранение журнала регистрации.
Заполненные журналы регистрации вместе с документами,
подтверждающими осуществление операций, связанных с оборотом НС и ПВ,
сдаются в архив юридического лица, где хранятся в течение 5 лет после
внесения в них последней записи. По истечении указанного срока журналы
регистрации подлежат уничтожению по акту, утверждаемому руководителем
юридического лица.
ПП РФ «О порядке предоставления сведений о деятельности, связанной с оборотом НС и ПВ и
регистрации операций, связанных с оборотом НС и ПВ» №644 от 04.11.2006
203
204.
т) журналыУчет
В случае реорганизации или ликвидации ЮЛ журналы регистрации и
документы, подтверждающие осуществление операций, связанных с
оборотом НС и ПВ, сдаются на хранение:
при реорганизации – новому ЮЛ либо правопреемнику
(правопреемникам) в соответствии с передаточным актом или
разделительным балансом;
при ликвидации – в государственный архив в соответствии с
законодательством РФ.
204
205.
т) журналыУчет
Правила ведения и хранения, а также форма специальных журналов регистрации
операций, в результате которых изменяется количество прекурсоров НС и ПВ,
утверждены постановлением Правительства РФ от 04.11.2006 №419 «О порядке
предоставления сведений о деятельности, связанной с оборотом прекурсоров НС и ПВ, и
регистрации операций, в результате которых изменяется количество прекурсоров НС и
ПВ».
Записи в журналах производятся лицом, ответственным за их ведение и хранение,
шариковой ручкой (чернилами) в хронологическом порядке непосредственно после
каждой операции (по каждому наименованию прекурсора) на основании документов,
подтверждающих совершение операции.
205
206.
т) журналыУчет
Документы, подтверждающие совершение операции, или их копии,
заверенные в установленном порядке, подшиваются в отдельную
папку, которая хранится вместе с соответствующим журналом.
В случае реализации юридическому лицу или индивидуальному
предпринимателю прекурсоров, внесенных в таблицу I списка IV
перечня, копия их лицензии на осуществление деятельности, связанной с
оборотом прекурсоров, внесенных в таблицу I списка IV перечня,
подшивается в отдельную папку, которая хранится вместе с
соответствующим журналом.
206
207.
т) журналыУчет
В случае реализации физическому лицу прекурсоров, внесенных в таблицу II списка IV перечня, копия
документа, удостоверяющего его личность, подшивается в отдельную папку, которая хранится вместе с
соответствующим журналом.
Данные требования не распространяются на случаи регистрации операций по отпуску, реализации,
приобретению или использованию диэтилового эфира (этилового эфира, серного эфира) в концентрации
45 процентов или более или перманганата калия в концентрации 45 процентов или более массой, не
превышающей 10 килограммов, ацетона (2-пропанон) в концентрации 60 процентов или более,
метилэтилкетона (2-бутанон) в концентрации 80 процентов или более, толуола в концентрации 70
процентов или более, серной кислоты в концентрации 45 процентов или более, соляной кислоты в
концентрации 15 процентов или более или уксусной кислоты в концентрации 80 процентов или более
массой, не превышающей 100 килограммов, а также смесей, содержащих только указанные вещества, и
на случаи регистрации операций по использованию метилакрилата в концентрации 15 процентов или
более или метилметакрилата в концентрации 15 процентов или более массой, не превышающей 100
килограммов.
207
208.
т) журналыУчет
При этом запись в журнале о суммарном количестве отпущенных, реализованных, приобретенных или использованных
указанных веществ производится ежемесячно и документального подтверждения совершения каждой операции не
требуется.
Юридические лица и индивидуальные предприниматели, осуществляющие в установленном порядке производство
прекурсоров, внесенных в список IV перечня, а также реализацию и использование прекурсоров, внесенных в таблицы I
и II списка IV перечня, направляют почтовым отправлением с уведомлением о вручении либо доставляют нарочным в
территориальные органы Федеральной службы Российской Федерации по контролю за оборотом наркотиков по месту
нахождения юридического лица или по месту осуществления деятельности индивидуального предпринимателя:
а) квартальные отчеты о количестве каждого произведенного прекурсора, внесенного в список IV перечня, - не позднее
20 апреля, 20 июля, 20 октября и 20 января года по форме согласно приложению N 1;
б) отчет о деятельности за истекший календарный год (далее - годовой отчет) о количестве каждого произведенного
прекурсора, внесенного в список IV перечня, - ежегодно, не позднее 20 февраля, по форме согласно приложению N 2;
в) годовой отчет о количестве каждого реализованного прекурсора, внесенного в таблицы I и II списка IV перечня, ежегодно, не позднее 20 февраля, по форме согласно приложению N 3;
г) годовой отчет о количестве каждого использованного прекурсора, внесенного в таблицы I и II списка IV перечня, ежегодно, не позднее 20 февраля, по форме согласно приложению N 4 (ПП 149)
208
209.
т) журналыУчет
209
210.
т) журналыУчет
Структурное подразделение
Наименование, № и дата
приходного документа
Наименование, № и дата
расходного документа
Отделение медицинской
организации
Требование 09.07 №18
Лист назначения, ФИО,
История болезни
Аптечная организация
Накладная 01.07 №15
Требование 09.07 №18
Рецепт 09.07 №
210
211.
4. Ответственность за нарушениетребований к организации хранения ЛС
211
212.
Административная ответственность за нарушение правил хранения ЛПВид
правонарушения
Ответственность (штрафные санкции)
Статья
Осуществление предпринимательской
влечет
предупреждение
или
наложение Ч. 3 Статья 14.1.
деятельности с нарушением требований и административного штрафа на граждан в размере от Росздравнадзор
условий, предусмотренных специальным
одной тысячи пятисот до двух тысяч рублей; на
разрешением (лицензией),
должностных лиц - от трех тысяч до четырех тысяч
рублей; на юридических лиц - от тридцати тысяч до
сорока тысяч рублей.
Осуществление предпринимательской
деятельности с грубым нарушением
требований и условий, предусмотренных
специальным разрешением (лицензией)
влечет наложение административного штрафа на Ч. 4 Статья 14.1.
лиц,
осуществляющих
предпринимательскую Росздравнадзор
деятельность без образования юридического
лица, в размере от четырех тысяч до восьми тысяч
рублей или административное приостановление
деятельности на срок до девяноста суток; на
должностных лиц - от пяти тысяч до десяти тысяч
рублей; на юридических лиц - от ста тысяч до
двухсот тысяч рублей или административное
приостановление деятельности на срок до девяноста
суток.
Основные статьи
212
213.
Контактные данные• 8-915-947-69-86
Чеснокова Наталья Николаевна, ассистент
кафедры Управления и экономики
фармации и фармацевтической
технологии ФГБОУ ВО «ПИМУ»
Минздрава России
• chesnokova86@list.ru
• 465-09-27 – Кафедра Управления и экономики
фармации и фармацевтической технологии
213


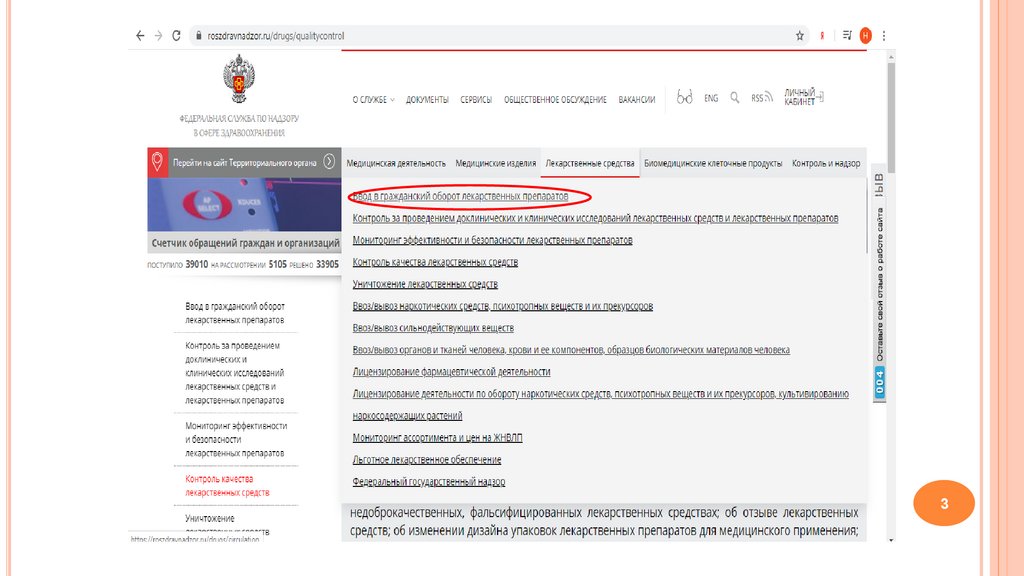
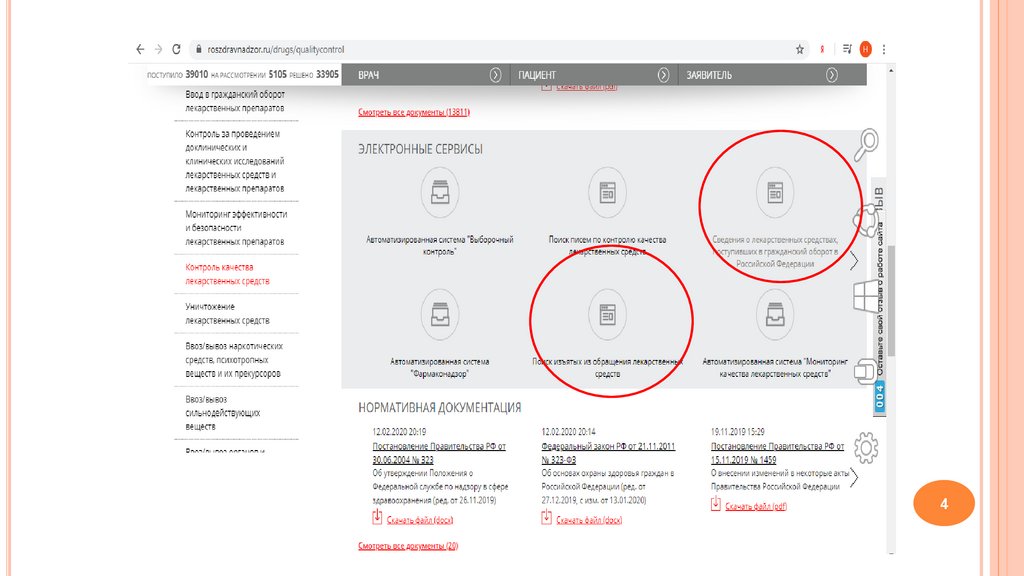
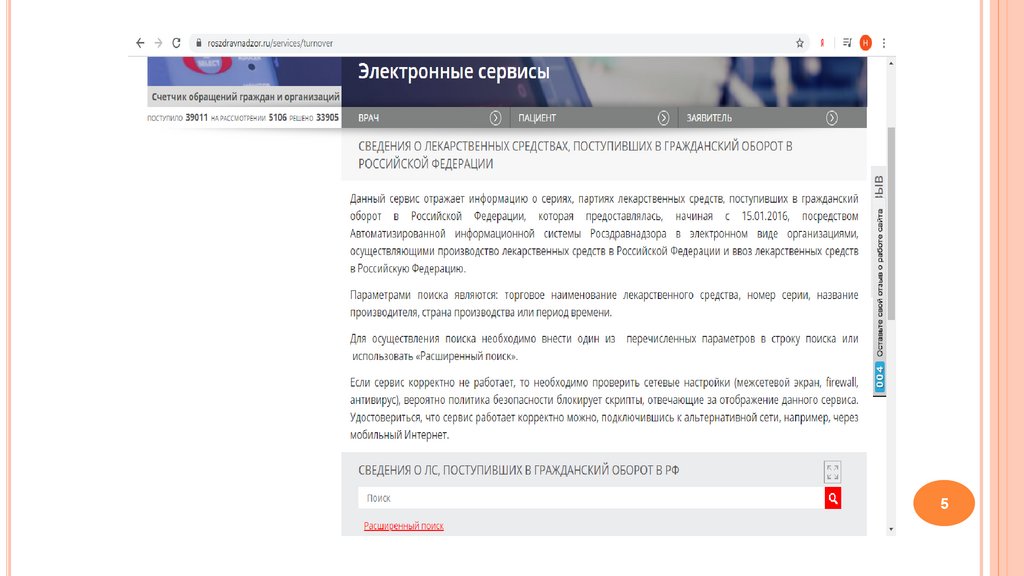
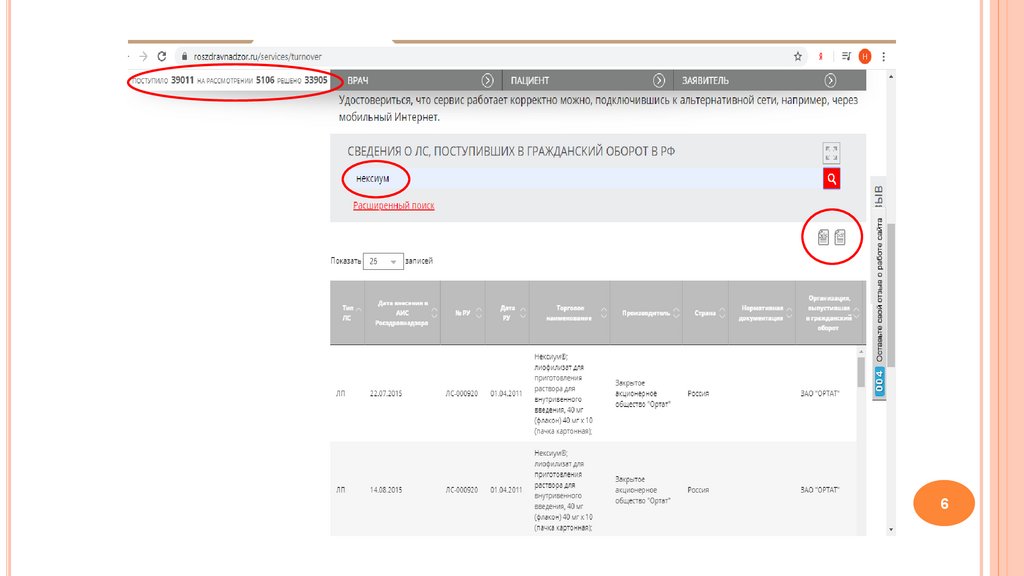









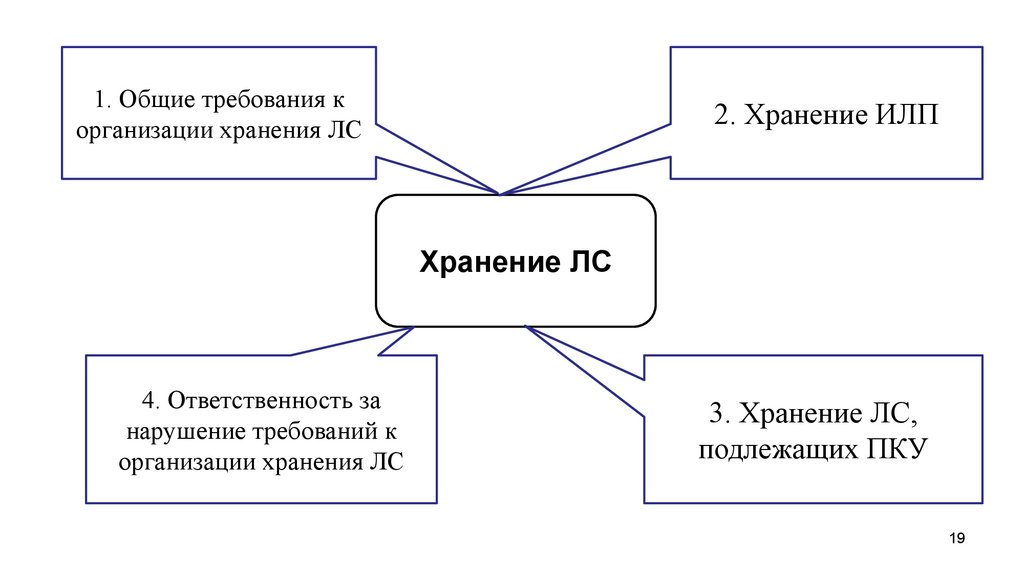



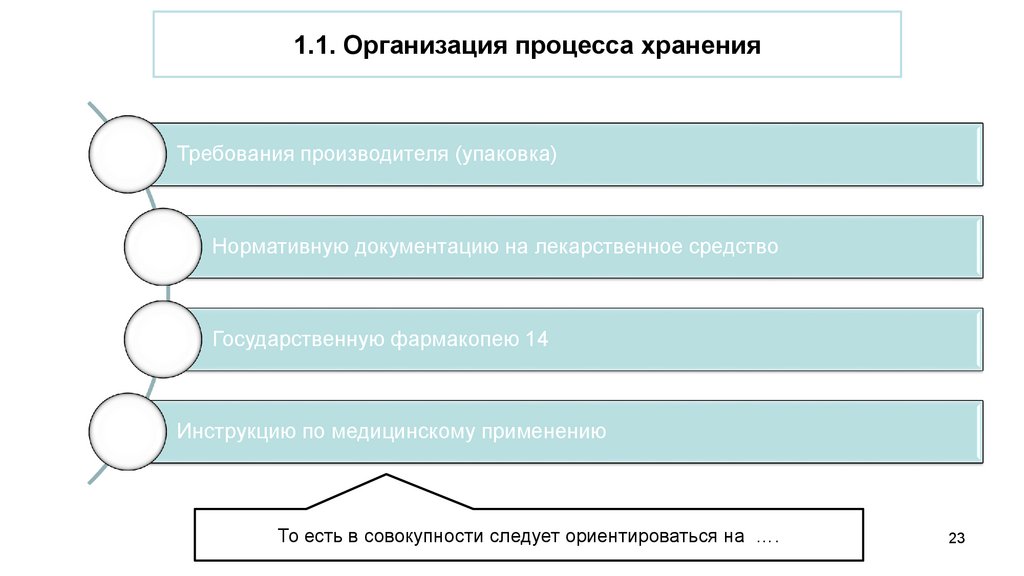




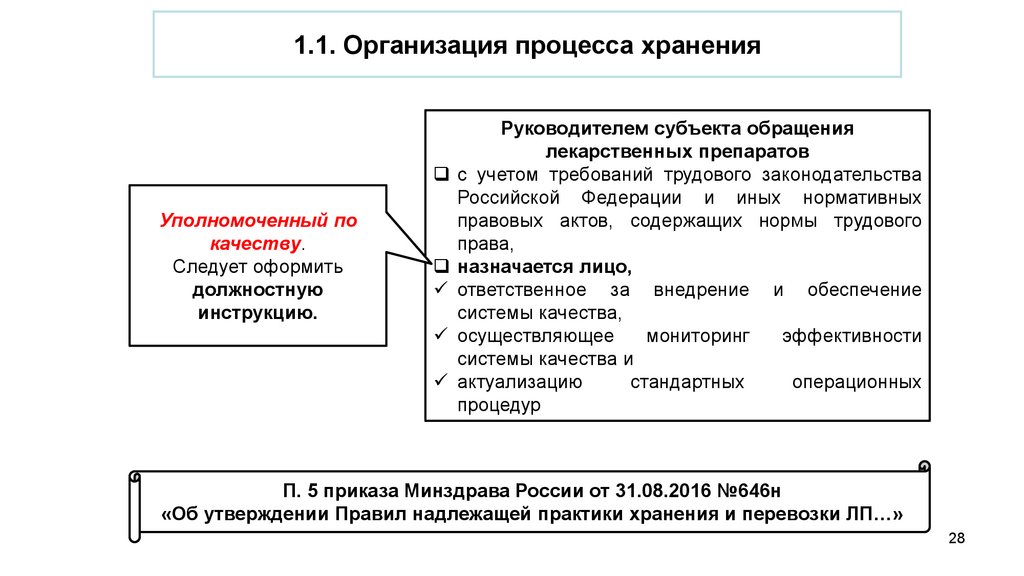









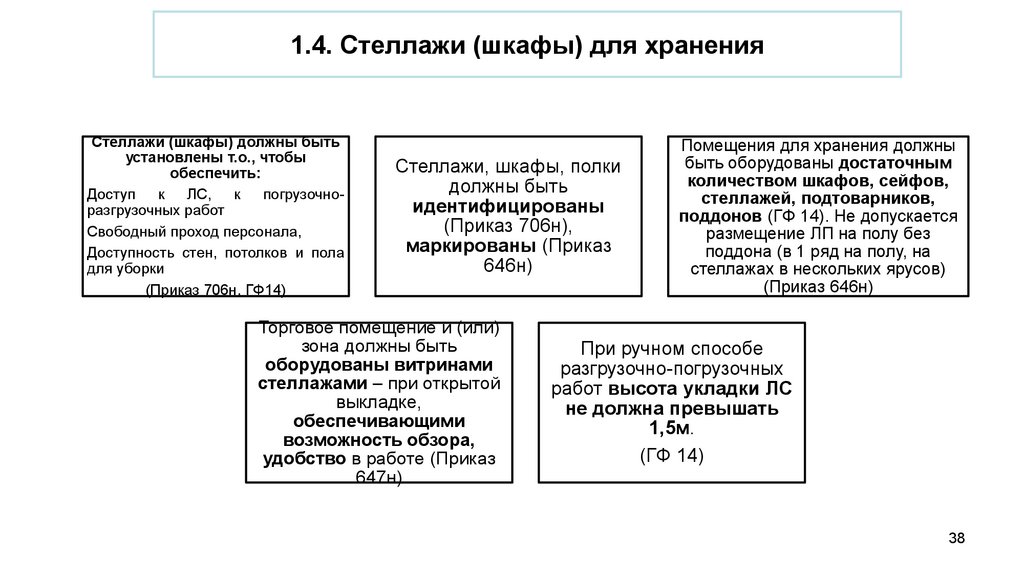

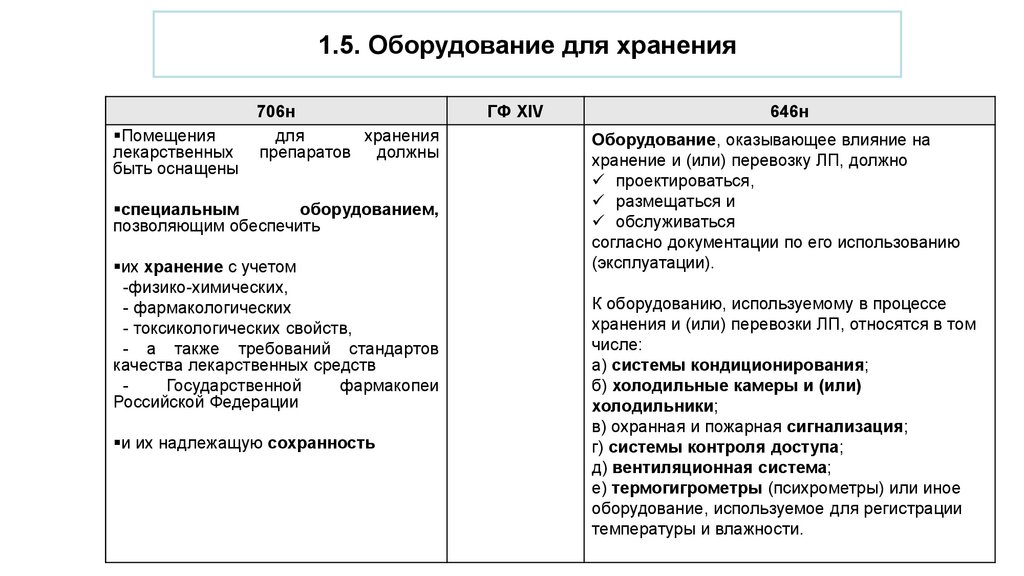
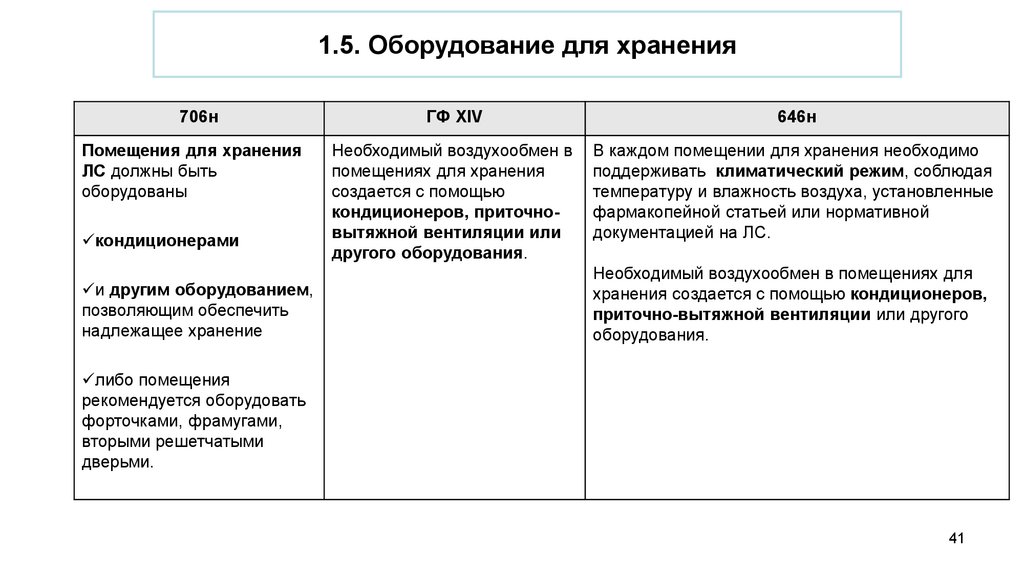







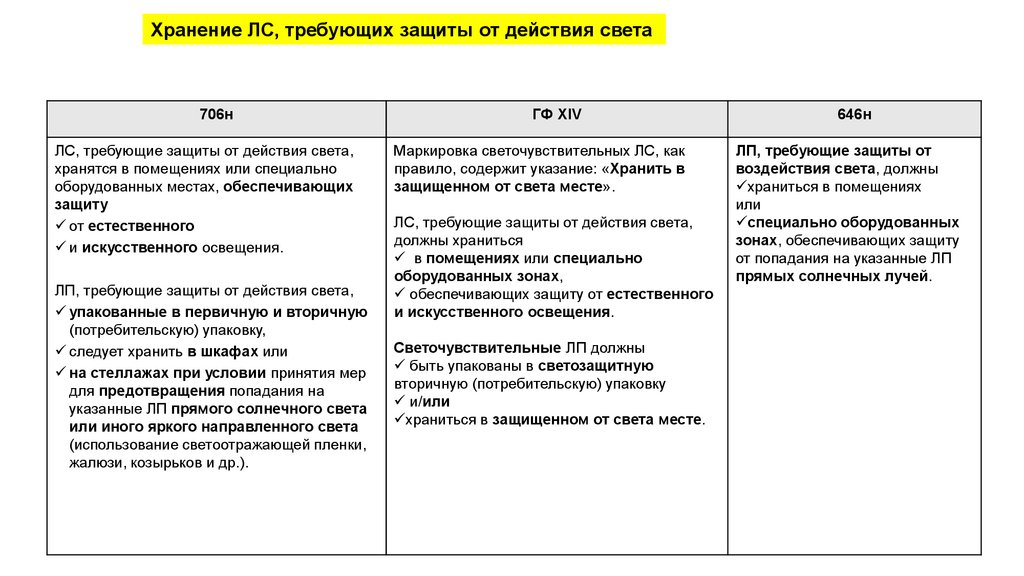






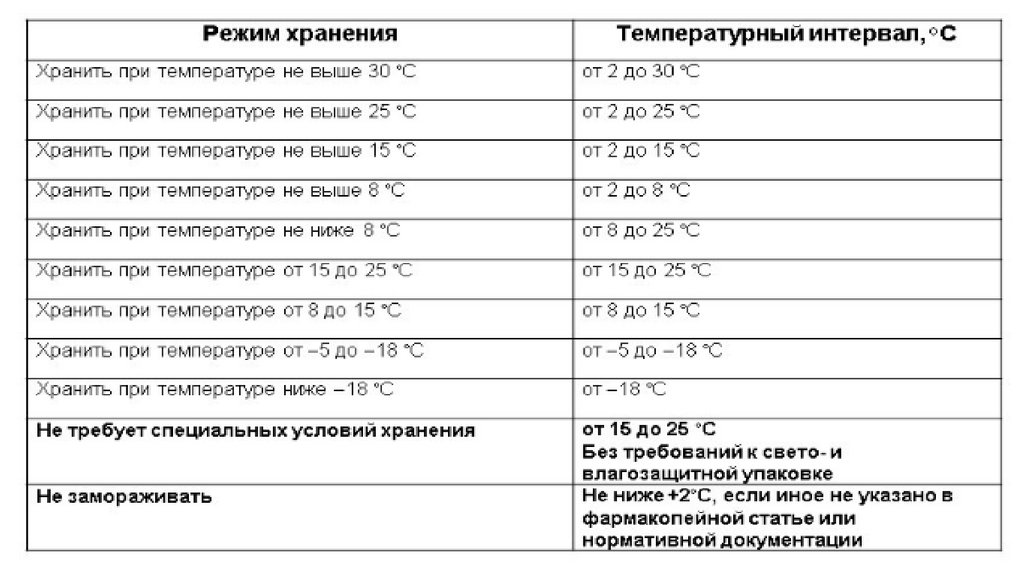









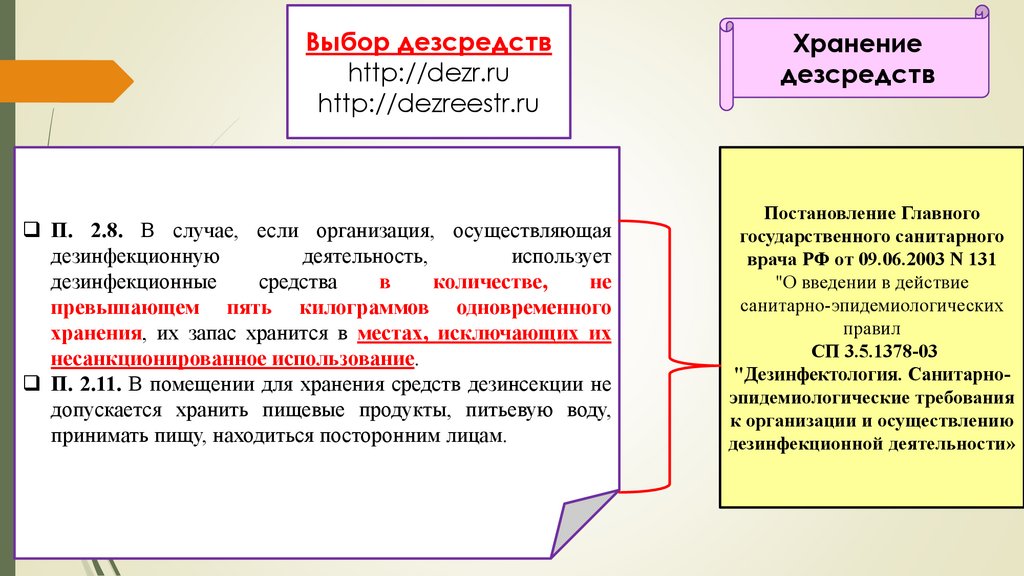





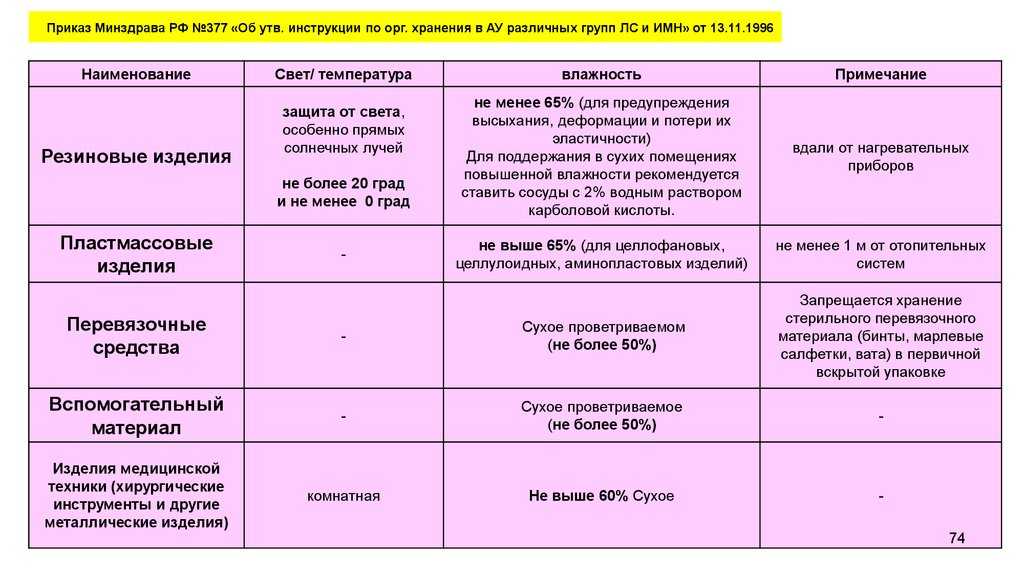












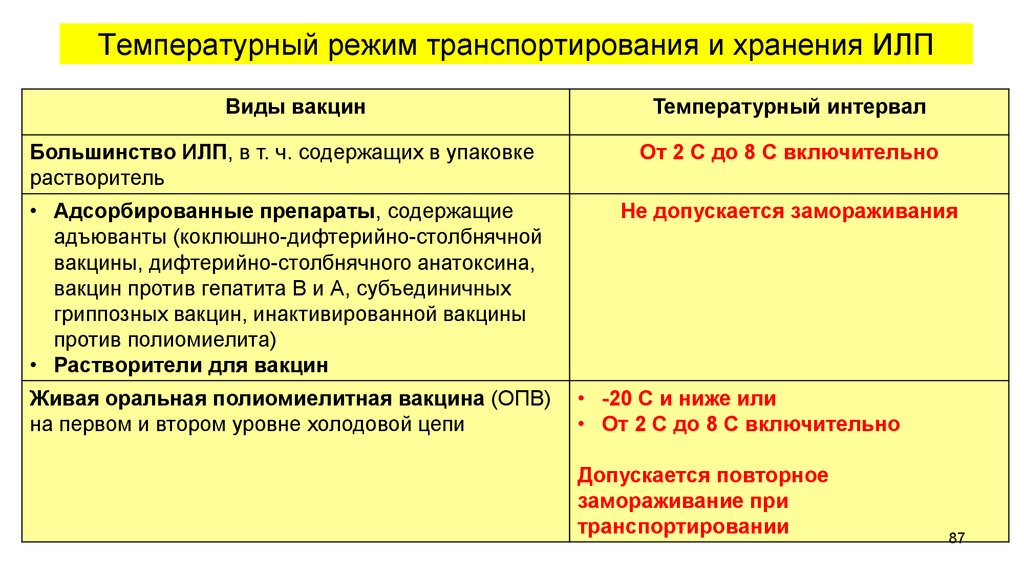
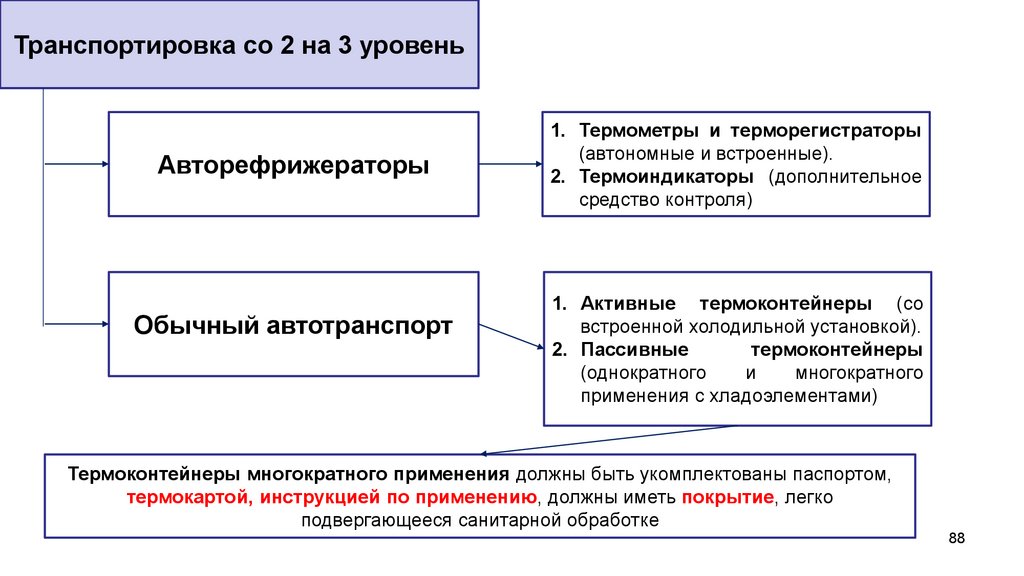

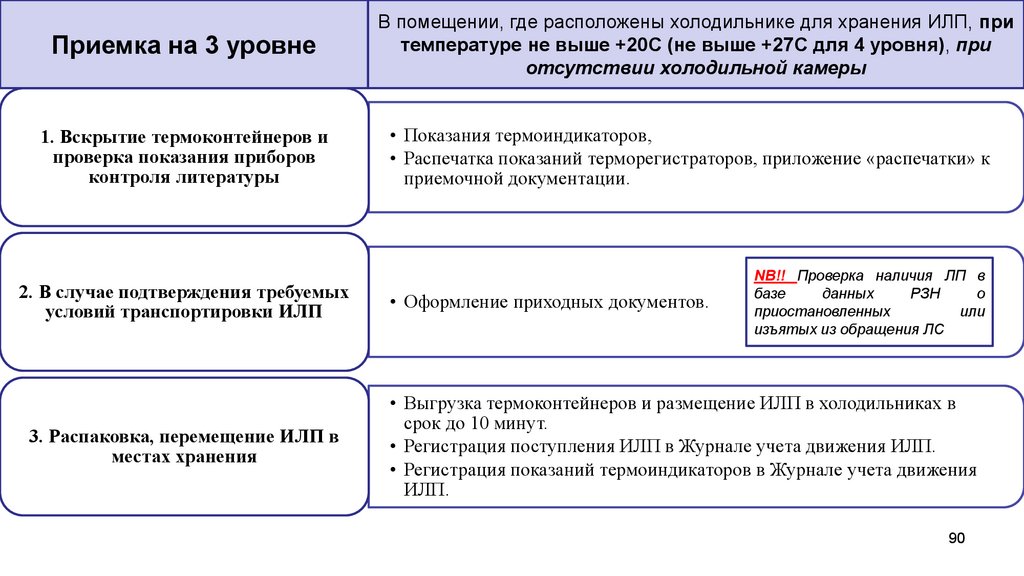







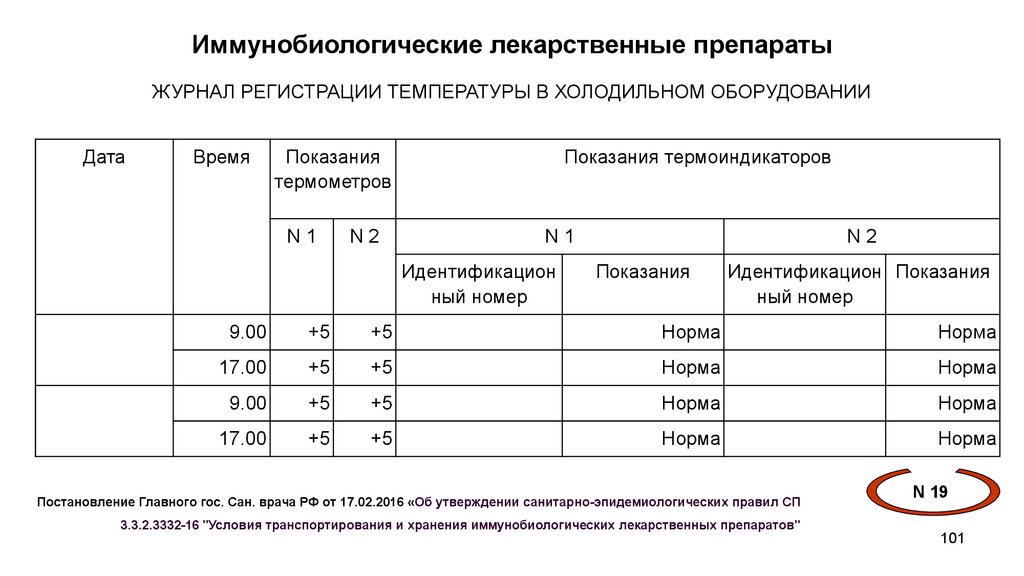

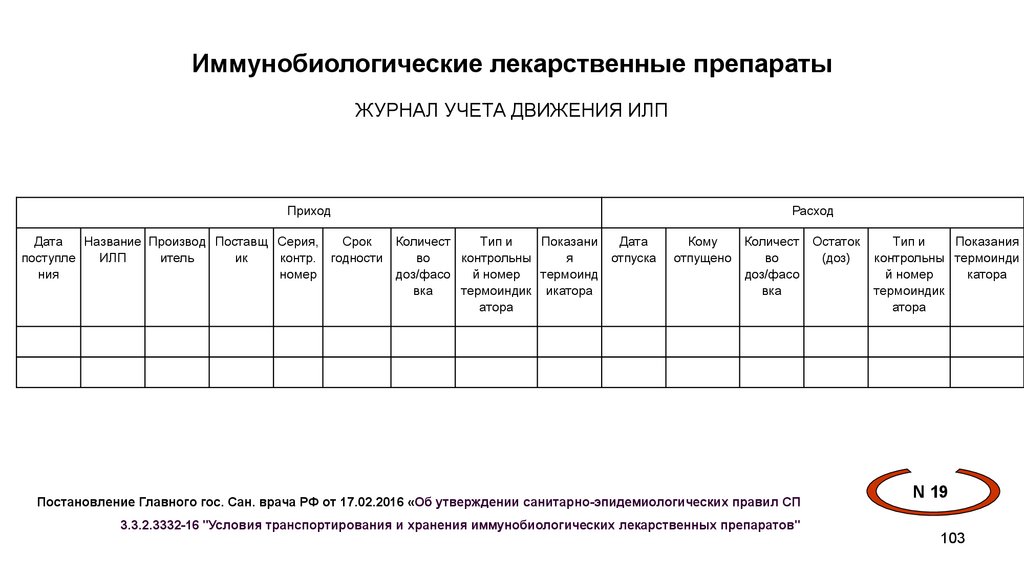


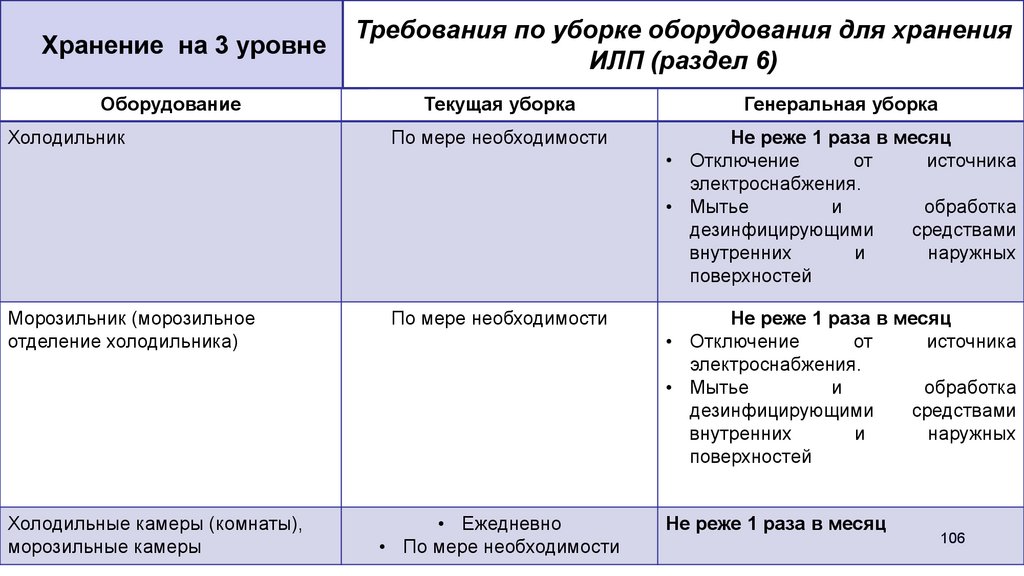



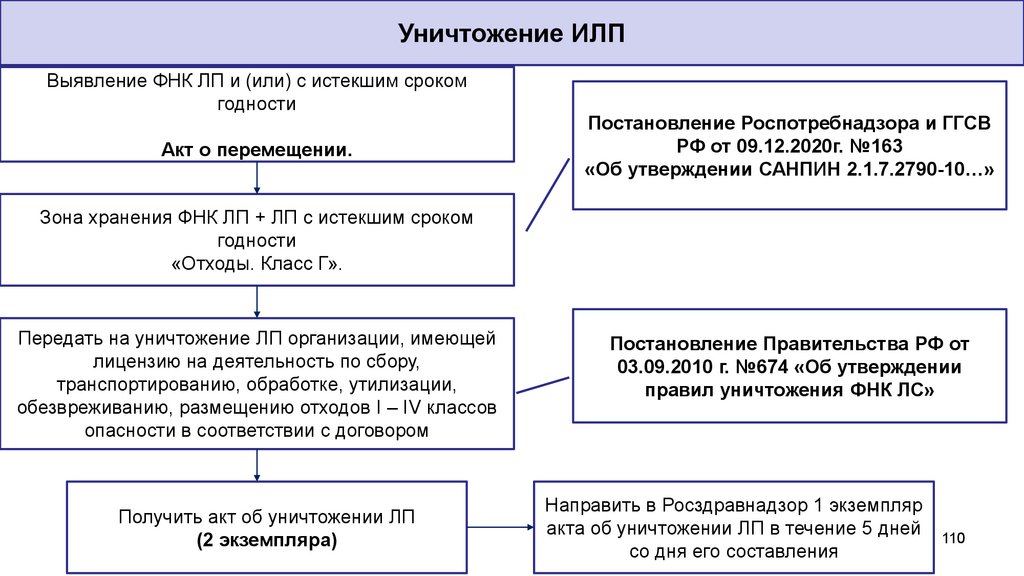



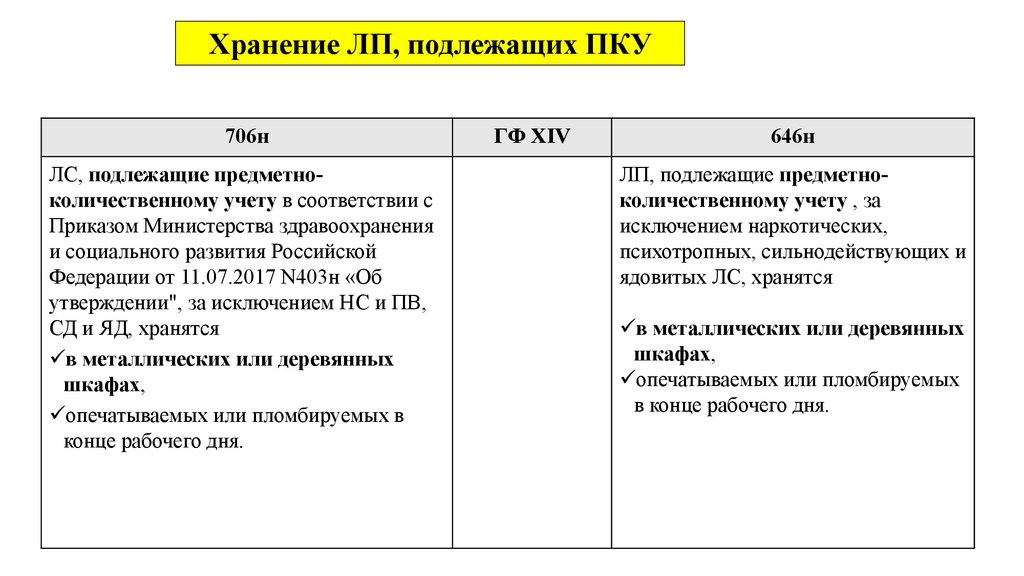
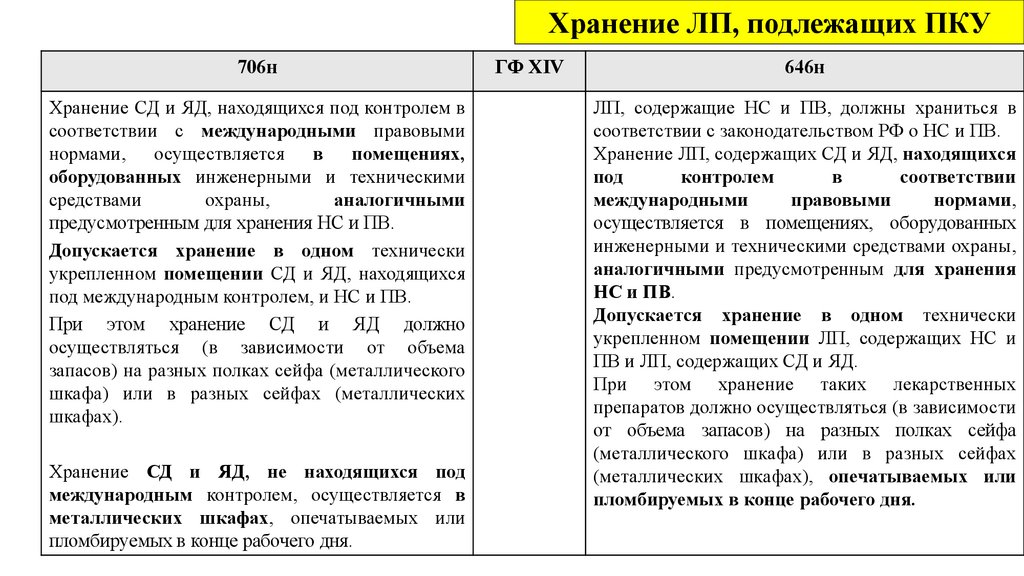






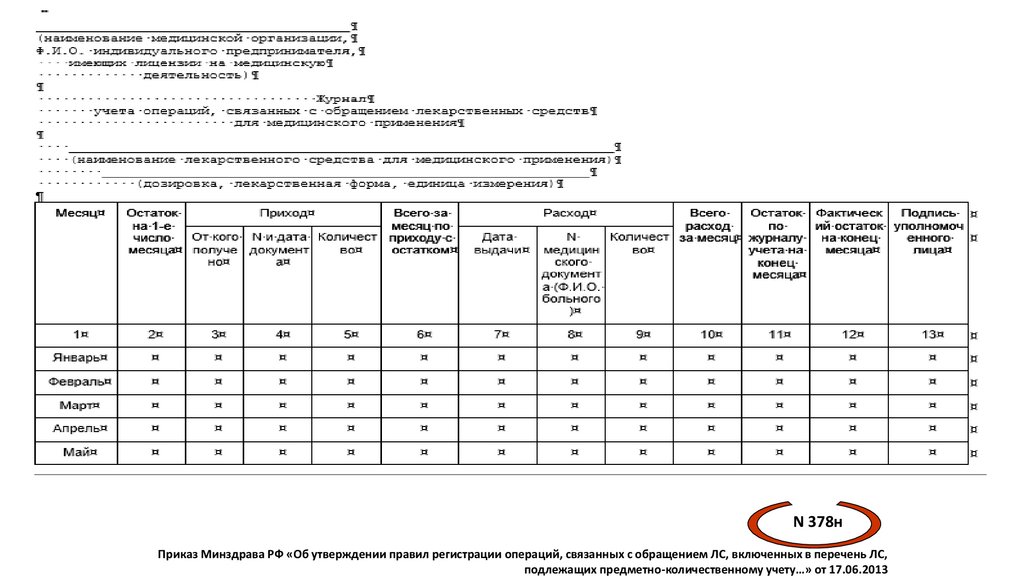
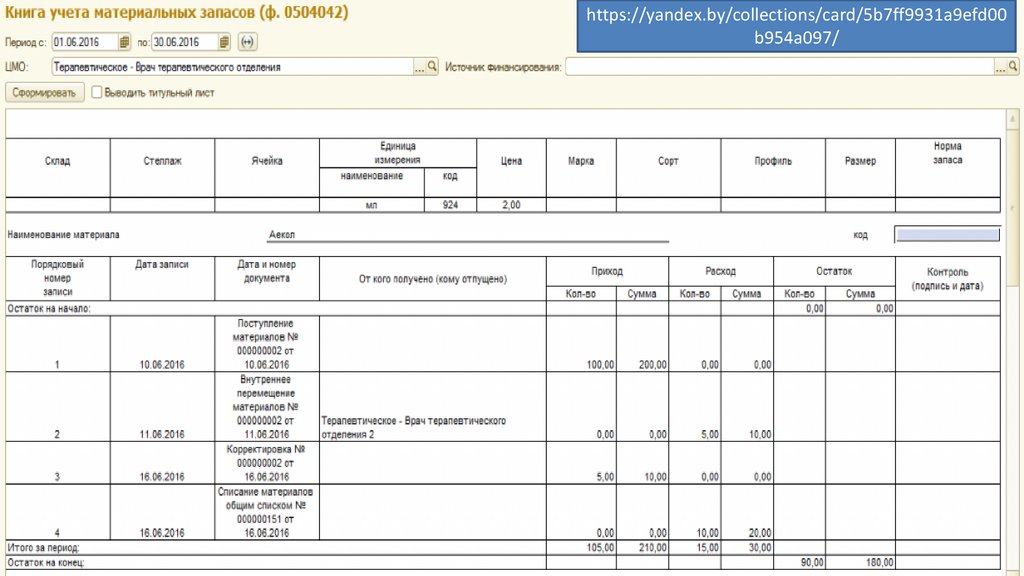


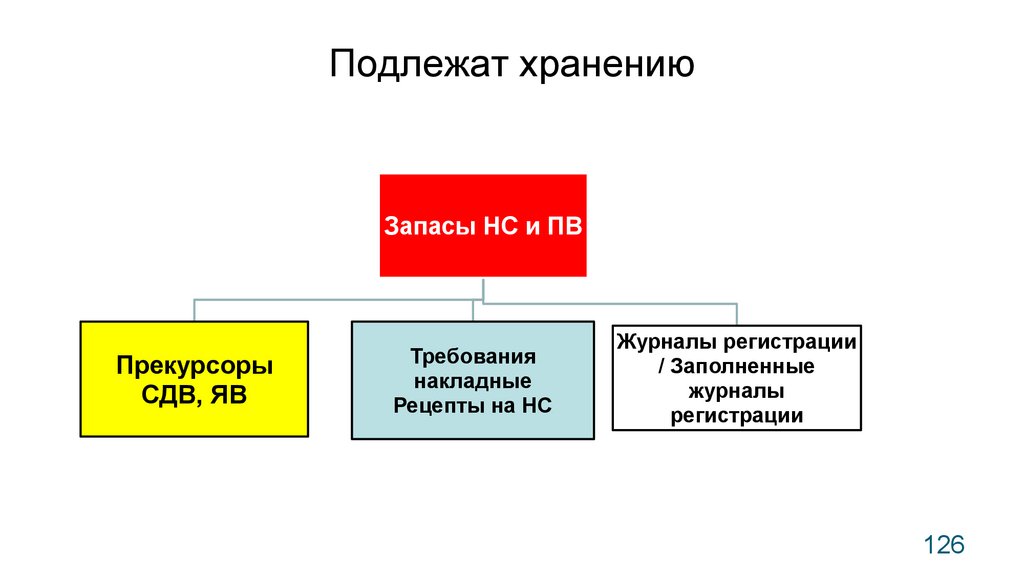


























































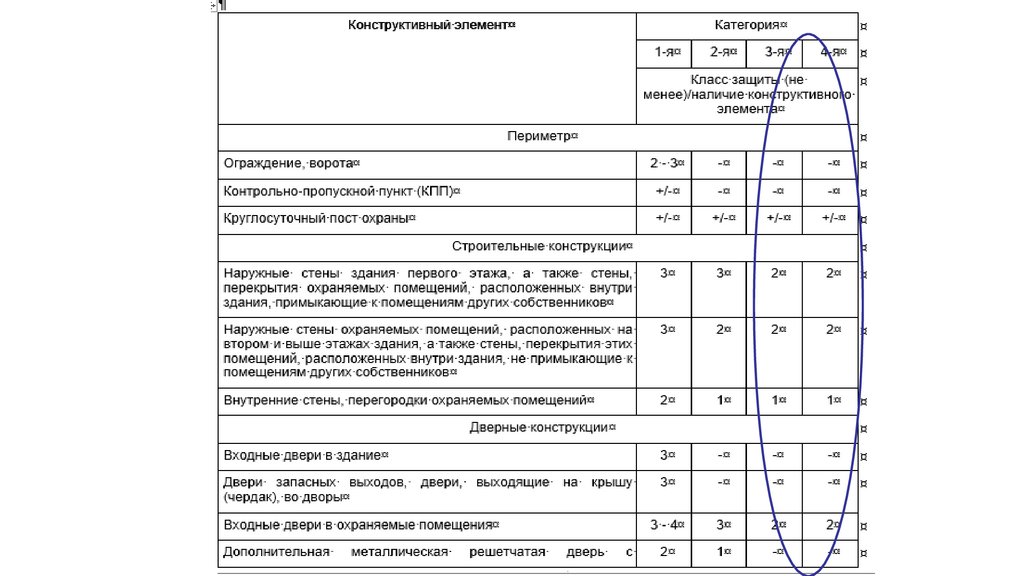
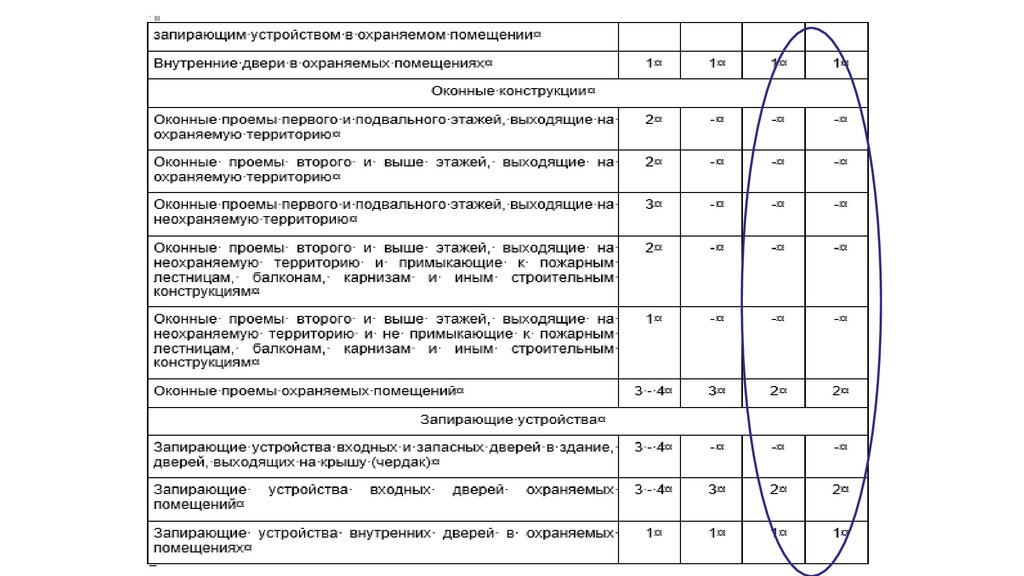


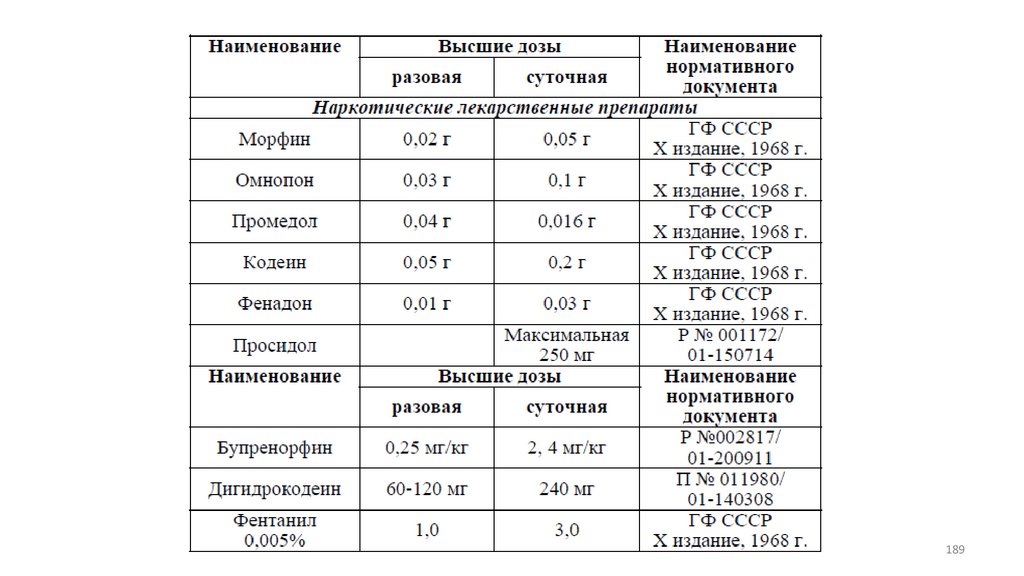
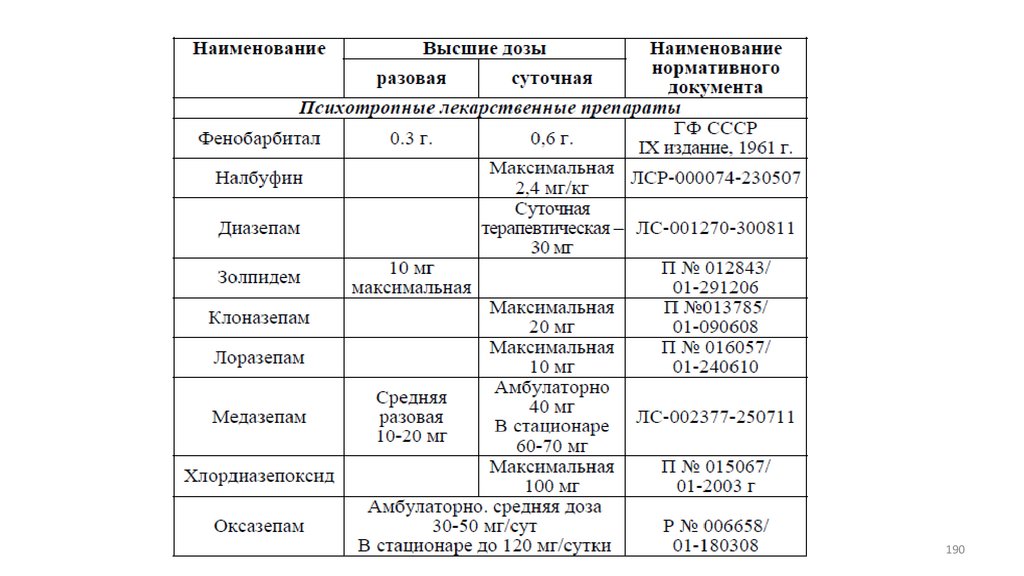








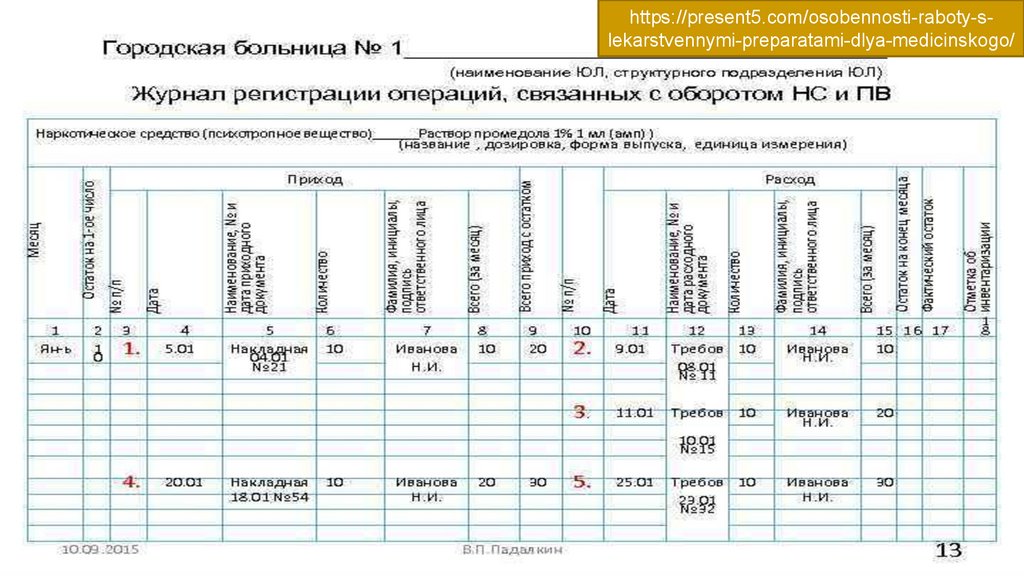









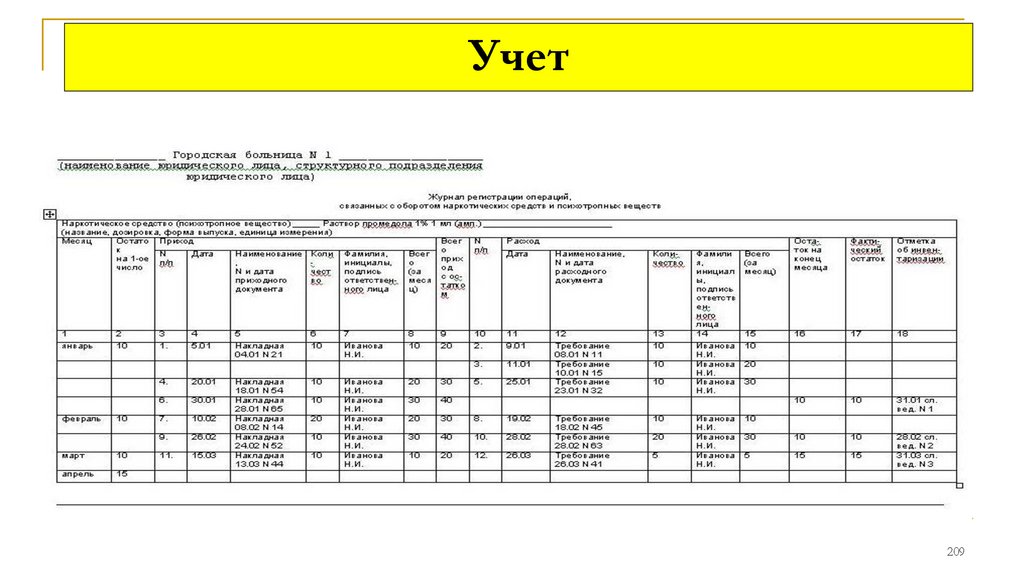
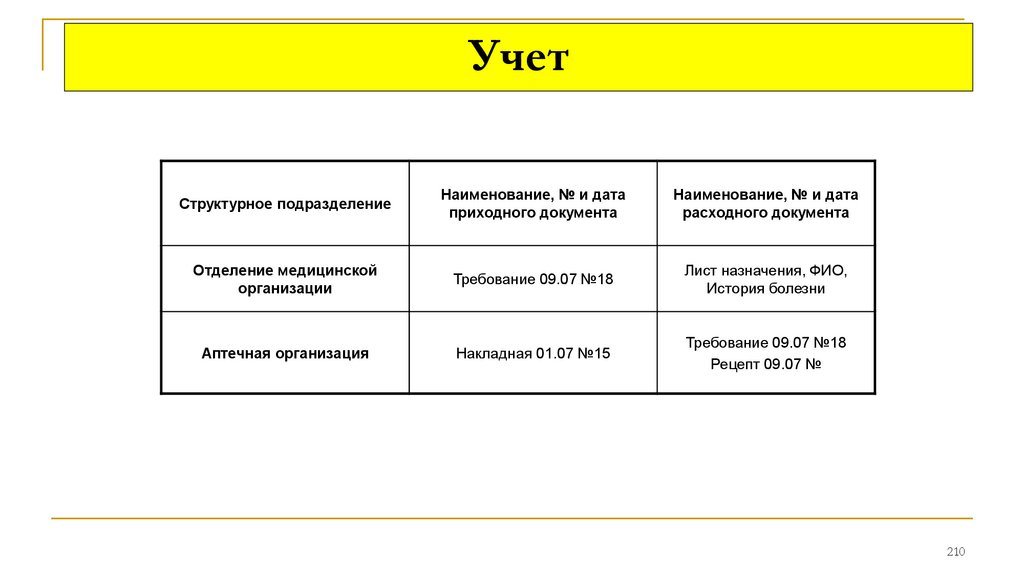

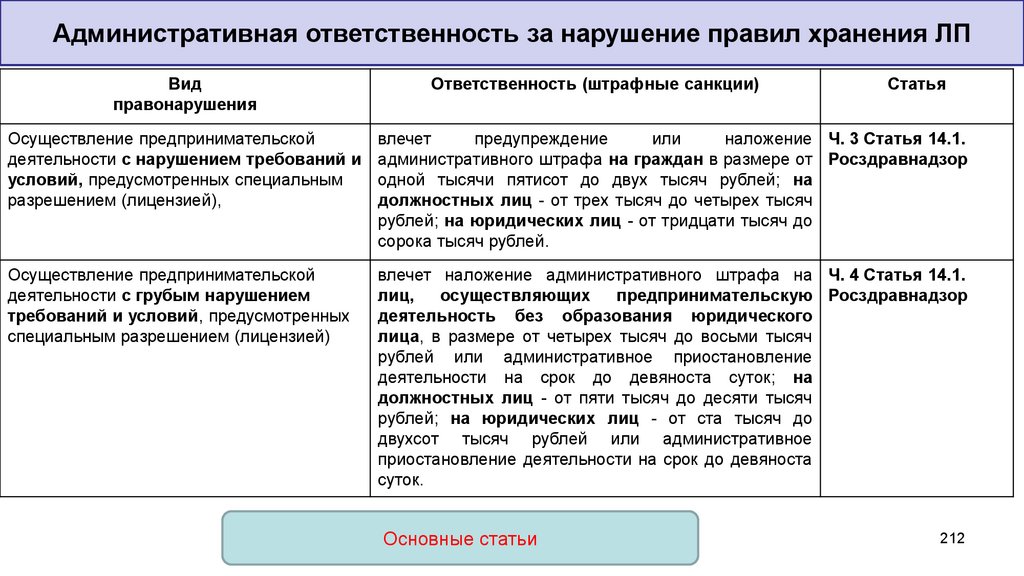

 medicine
medicine law
law








