Similar presentations:
Государственная система контроля качества, эффективности и безопасности лекарственных средств
1. Государственная система контроля качества, эффективности и безопасности лекарственных средств Бейхчан Э.Э. ассистент кафедры
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕУЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Кафедра фармации
Государственная система контроля качества,
эффективности и безопасности
лекарственных средств
Бейхчан Э.Э.
ассистент кафедры
2. Фармацевтическая химия как наука
Фармацевтическая химия – наука о способах получения, особенностяхстроения, свойствах, механизмах биотрансформации лекарственных веществ,
а также о методах контроля качества фармацевтических субстанций и
лекарственных препаратов.
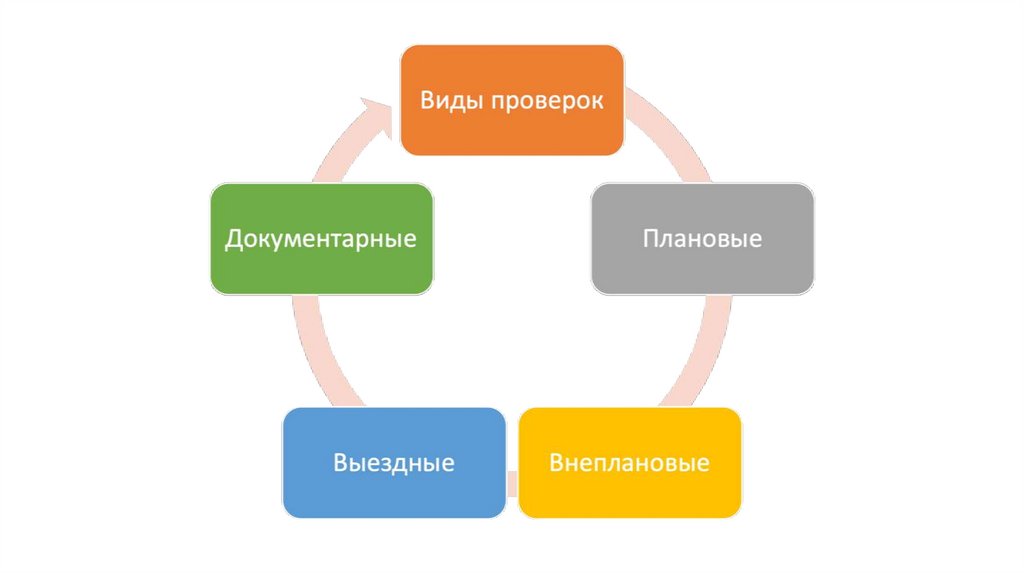
Взаимосвязь фармацевтической химии с другими химическими
дисциплинами:
• Неорганическая химия (методы разработки и способы получения ЛС);
• Органическая химия;
• Физическая и коллоидная химия (свойства ЛС);
• Биохимия
• Аналитическая химия (обеспечение качества ЛС).
3. Фармацевтическая химия как наука
Взаимосвязь фармацевтической химии с естественно-научными и специальными дисциплинами:• Математика
• Информационные технологии в фармации
• Физика
• Биология
• Микробиология
• Фармакология
• Токсикологическая химия
• Фармацевтическая экономика
• Фармацевтическая технология
• Фармакогнозия
• Физиология, патофизиология, фармакотерапия
4. Государственная система контроля качества, эффективности и безопасности ЛС
• Контроль качества, эффективности и безопасности ЛС является однойиз приоритетных задач в системе здравоохранения России в
настоящее время. Для реализации этого направления создана система
государственного контроля качества ЛС, позволяющая своевременно
выявлять и изымать из обращения недоброкачественную и
фальсифицированную продукцию, тем самым обеспечивая население
эффективными и безопасными лекарствами.
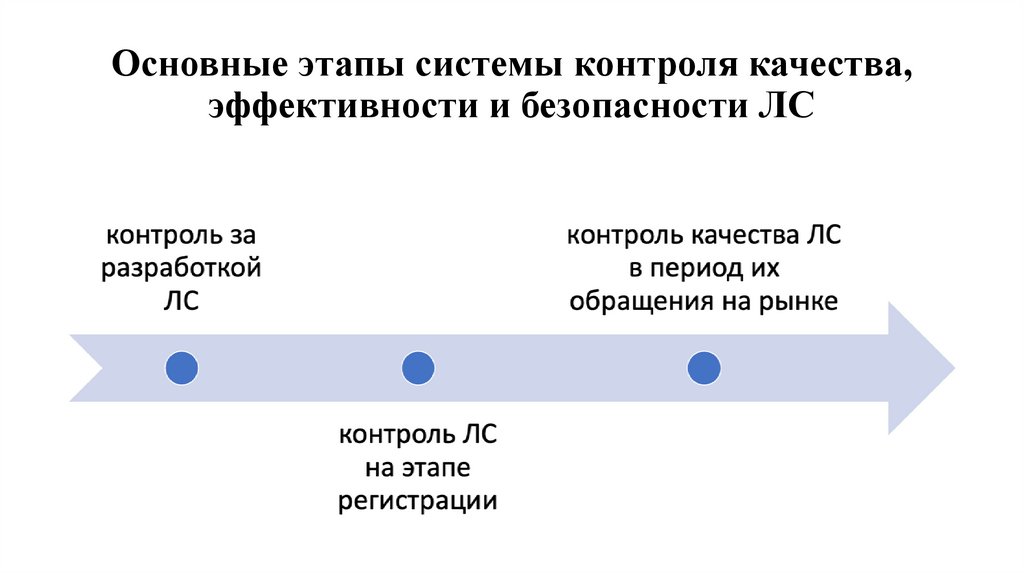
• Основными направлениями работы Системы являются: оценка
качества, эффективности и безопасности ЛС в процессе
государственной регистрации (на опытно-промышленных и
промышленных образцах); экспертиза качества ЛС (проводится
выборочно); мониторинг эффективности и безопасности ЛС,
находящихся в обращении; инспекционный контроль.
5. Государственная система контроля качества, эффективности и безопасности ЛС
• Структурными подразделениями Системы являются Центральныйаппарат Росздравнадзора, его территориальные Управления,
контрольно-испытательные лаборатории, единая информационная
система, органы контроля качества производителей ЛС и
фармацевтических оптово-розничных организаций.
• Основными
элементами
Системы
являются
выявление
недоброкачественных и фальсифицированных ЛС в рамках
мониторинга качества, выборочный контроль качества ЛС, контроль
производства, контроль за качеством и достоверностью испытаний ЛС,
мониторинг безопасности ЛП, контроль проведения клинических
исследований, взаимодействие с правоохранительными органами,
взаимодействие с общественными организациями в сфере обращения
ЛС (ассоциациями производителей, аптечных организаций и др.).
6. Основные этапы системы контроля качества, эффективности и безопасности ЛС
7. Нормативные документы
• ФЗ № 61 от 12 апреля 2010 года «Об обращениилекарственных средств»
• Приказ Федеральной службы по надзору в сфере
здравоохранения от 28 июля 2020 г. N 6720
"Об утверждении Административного регламента
Федеральной службы по надзору в сфере здравоохранения по
осуществлению федерального государственного надзора в
сфере обращения лекарственных средств»
• Постановление Правительства РФ от 29.06.2021 N 1049
"О федеральном государственном контроле (надзоре) в сфере
обращения лекарственных средств» (вместе с "Положением о
федеральном государственном контроле (надзоре) в сфере
обращения лекарственных средств")
8. Нормативные документы
• Приказ Министерства здравоохранения РФ от 22 мая 2023 г. N 249н"Об утверждении правил изготовления и отпуска лекарственных препаратов для
медицинского применения аптечными организациями, имеющими лицензию на
фармацевтическую деятельность»
• Приказ Министерства промышленности и торговли РФ от 7 июня 2013 г. N 877
"Об утверждении Административного регламента Министерства промышленности и
торговли Российской Федерации по предоставлению государственной услуги
по лицензированию производства лекарственных средств для медицинского
применения"
• Постановление Правительства РФ от 6 июля 2012 г. N 686
"Об утверждении Положения о лицензировании производства лекарственных
средств»
• Федеральный закон от 4 мая 2011 г. N 99-ФЗ "О лицензировании отдельных видов
деятельности"
9.
10. Задачи федерального государственного надзора
11.
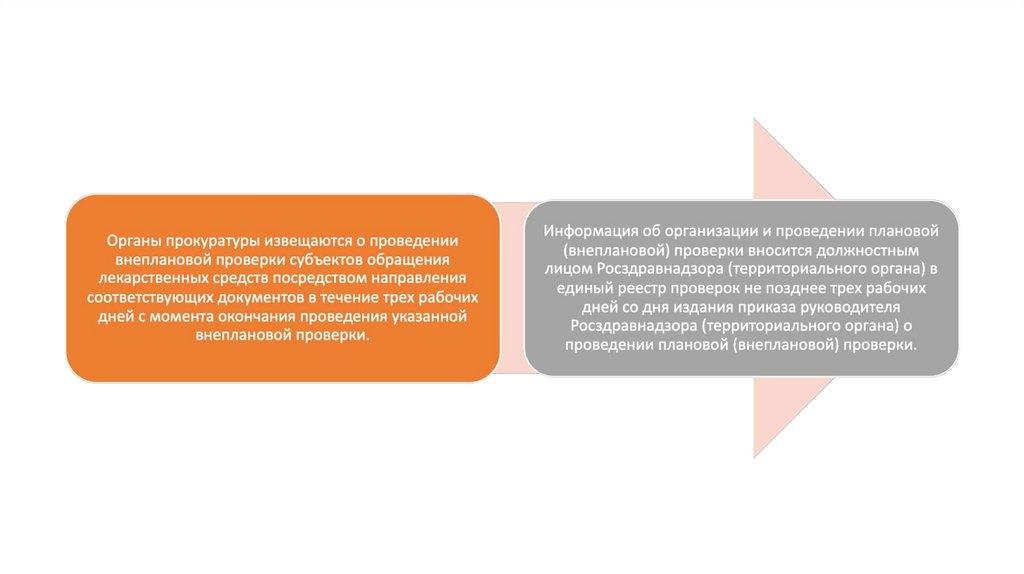
12. Принятие решения о проведении проверки
• Должностное лицо Росздравнадзора (территориального органа) готовитпроект приказа о проведении плановой и (или) внеплановой
документарной и (или) выездной проверки и направляет его на подпись
руководителю Росздравнадзора (территориального органа).
• В приказе руководителя Росздравнадзора (территориального органа)
указываются:
1) наименование органа государственного контроля (надзора), а также
вид (виды) государственного контроля (надзора);
2) фамилии, имена, отчества (при наличии), должности должностного
лица или должностных лиц, уполномоченных на проведение проверки, а
также привлекаемых к проведению проверки экспертов, представителей
экспертных организаций;
13. Принятие решения о проведении проверки
• В приказе руководителя Росздравнадзора (территориального органа)указываются:
3) наименование или фамилия, имя, отчество (при наличии) субъекта обращения
лекарственных средств, проверка которого проводится, место его нахождения
(филиалы, представительства, обособленные структурные подразделения) или место
фактического осуществления деятельности субъекта обращения лекарственных
средств;
4) цели, задачи, предмет проверки и срок ее проведения;
5) правовые основания проведения проверки;
6) подлежащие проверке обязательные требования, в том числе реквизиты
проверочного листа (списка контрольных вопросов), если при проведении плановой
проверки должен быть использован проверочный лист (список контрольных
вопросов);
7) сроки проведения и перечень мероприятий по контролю, необходимых для
достижения целей и задач проведения проверки;
14. Принятие решения о проведении проверки
• В приказе руководителя Росздравнадзора (территориального органа)указываются:
8) перечень административных регламентов по осуществлению
государственного надзора;
9) перечень документов, представление которых субъектом обращения
лекарственных средств необходимо для достижения целей и задач
проведения проверки;
10) даты начала и окончания проведения проверки.
15.
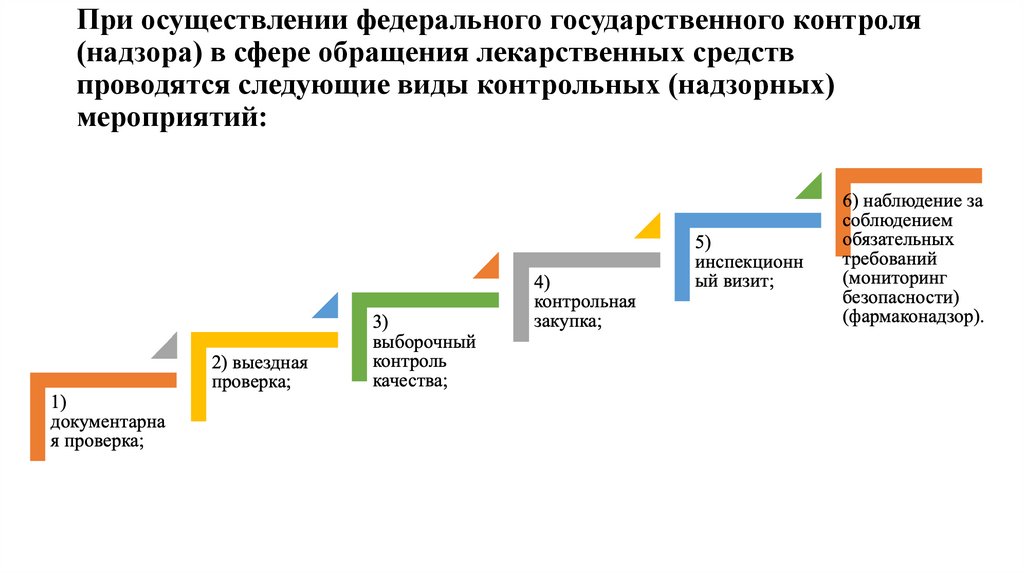
16. При осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств проводятся следующие
виды контрольных (надзорных)мероприятий:
17. Документарная проверка
В ходе документарной проверки могут совершаться следующиеконтрольные (надзорные) действия:
получение письменных объяснений;
истребование документов;
экспертиза.
Документарная проверка проводится по месту нахождения органа
государственного контроля, предметом которой являются исключительно
сведения,
содержащиеся
в
документах
контролируемых
лиц,
устанавливающих их организационно-правовую форму, права и обязанности, а
также документы, используемые при осуществлении деятельности
контролируемыми лицами и связанные с исполнением ими обязательных
требований.
18. Выездная проверка
В ходе выездной проверки могут совершаться следующиеконтрольные (надзорные) действия:
осмотр;
опрос;
получение письменных объяснений;
истребование документов;
отбор проб (образцов);
инструментальное обследование;
испытание;
экспертиза.
19. Выездная проверка
Выезднаяпроверка
проводится
по
месту
нахождения
(осуществления деятельности) контролируемого лица (его филиалов,
представительств, обособленных структурных подразделений) в целях
оценки соблюдения обязательных требований, а также оценки
выполнения предписания органа государственного контроля об
устранении выявленных нарушений обязательных требований.
Срок проведения выездной проверки составляет 10 рабочих дней. В
отношении одного субъекта малого предпринимательства общий срок
взаимодействия в ходе проведения выездной проверки не может
превышать 50 часов для малого предприятия и 15 часов для
микропредприятия.
20. Выборочный контроль
В ходе выборочного контроля могут совершаться следующиеконтрольные (надзорные) действия:
осмотр;
получение письменных объяснений;
истребование документов;
отбор проб (образцов);
инструментальное обследование;
испытание;
экспертиза.
Плановый выборочный контроль качества не проводится.
Внеплановый выборочный контроль качества проводится, в
том числе на основании программы проверок.
21. Выборочный контроль качества ЛС
• Выборочный контроль качества лекарственных средств являетсяэлементом государственного контроля (надзора) в сфере обращения
лекарственных средств наряду с лицензионным контролем в сфере
производства
лекарственных
средств
и
фармацевтической
деятельности и федеральным государственным надзором в сфере
обращения лекарственных средств.
• Предметом выборочного контроля качества является подтверждение
соответствия лекарственных препаратов и фармацевтических
субстанций требованиям фармакопейной статьи, а в случае ее
отсутствия – нормативной документации (т.е. проверка в рамках
выборочного контроля качества не касается проверки в целом
аптечной организации, хранения лекарственных средств, требований к
специалистам и т.д. и не фигурирует на сайте генеральной
прокуратуры в плане проверок.
22. Выборочный контроль качества ЛС
• Целью проверки является выявление причин поступления вгражданский оборот лекарственных средств, качество которых не
соответствует требованиям нормативной документации.
• При выявлении в результате проверки причин поступления в
гражданский оборот лекарственных средств, качество которых не
соответствует требованиям нормативной документации, нарушений
обязательных требований в сфере обращения лекарственных средств,
Росздравнадзором выдается предписание об устранении выявленных
нарушений.
• В случае невыполнения предписания, выданного Росздравнадзором
по итогам осуществления выборочного контроля качества
лекарственных препаратов, Росздравнадзор принимает решение о
приостановлении применения лекарственных препаратов до
устранения выявленных нарушений.
23. Выборочный контроль качества ЛС
• Решение публикуется на официальном сайте Росздравнадзора ссоблюдением ограничений, установленных законодательством о
коммерческой и иной охраняемой законом тайне.
• Невыполнение выданного Росздравнадзором предписания является
административным нарушением и влечет за собой административную
ответственность.
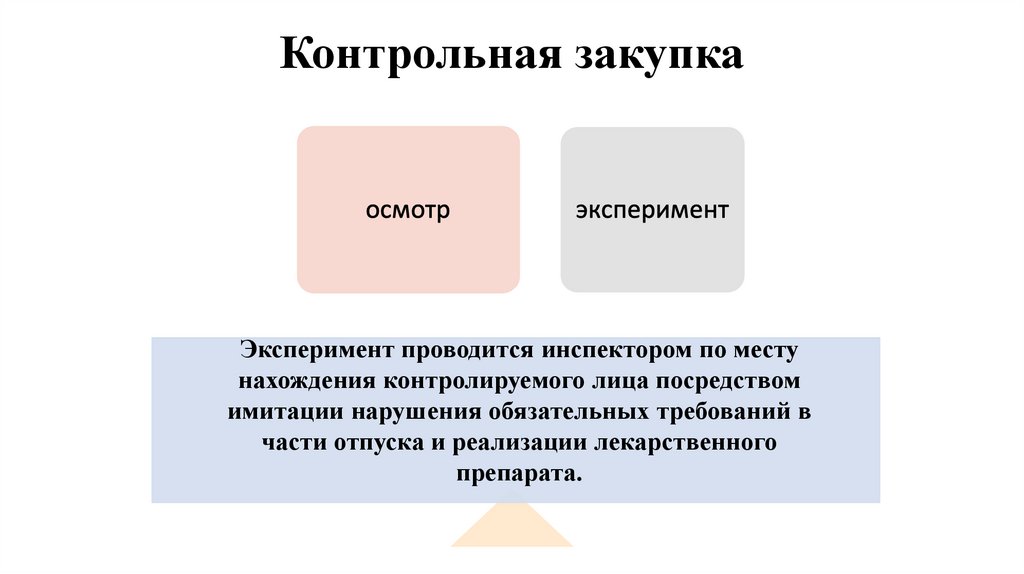
24. Контрольная закупка
Эксперимент проводится инспектором по местунахождения контролируемого лица посредством
имитации нарушения обязательных требований в
части отпуска и реализации лекарственного
препарата.
25. Контрольная закупка
26. Контрольная закупка
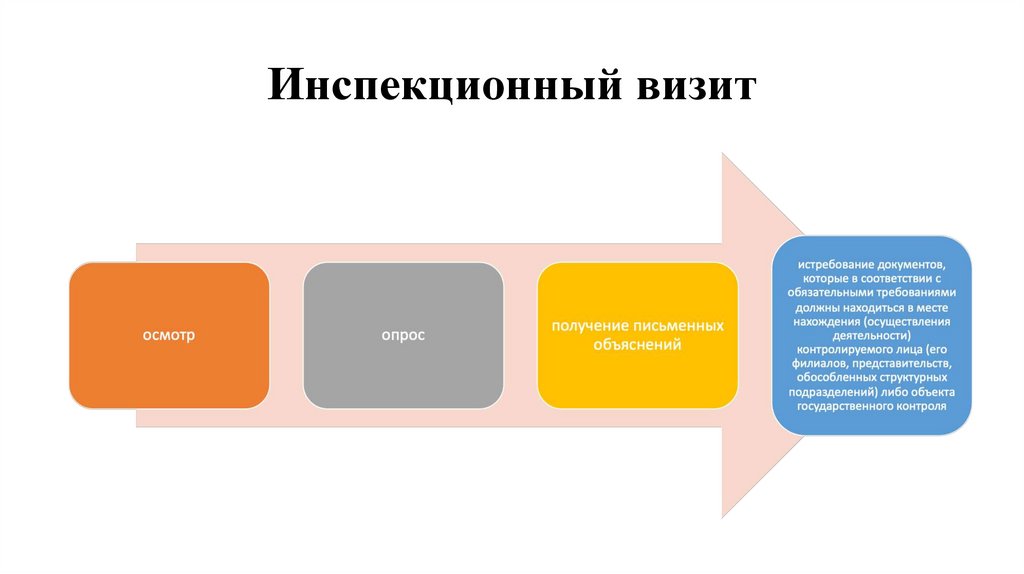
27. Инспекционный визит
28. Наблюдение за соблюдением обязательных требований (мониторинг безопасности) (фармаконадзор)
• Наблюдение за соблюдением обязательных требований (мониторинг безопасности)(фармаконадзор) осуществляется в целях выявления побочных действий,
нежелательных реакций, серьезных нежелательных реакций, непредвиденных
нежелательных
реакций
при
применении
лекарственных
препаратов,
индивидуальной непереносимости, отсутствии эффективности лекарственных
препаратов, а также иных фактах и обстоятельствах, представляющих угрозу жизни
или здоровью человека и животных при применении лекарственных препаратов,
выявленных на всех этапах обращения лекарственных препаратов в Российской
Федерации и других государствах.
• Фармаконадзор в отношении лекарственных средств для медицинского применения
осуществляется Федеральной службой по надзору в сфере здравоохранения.
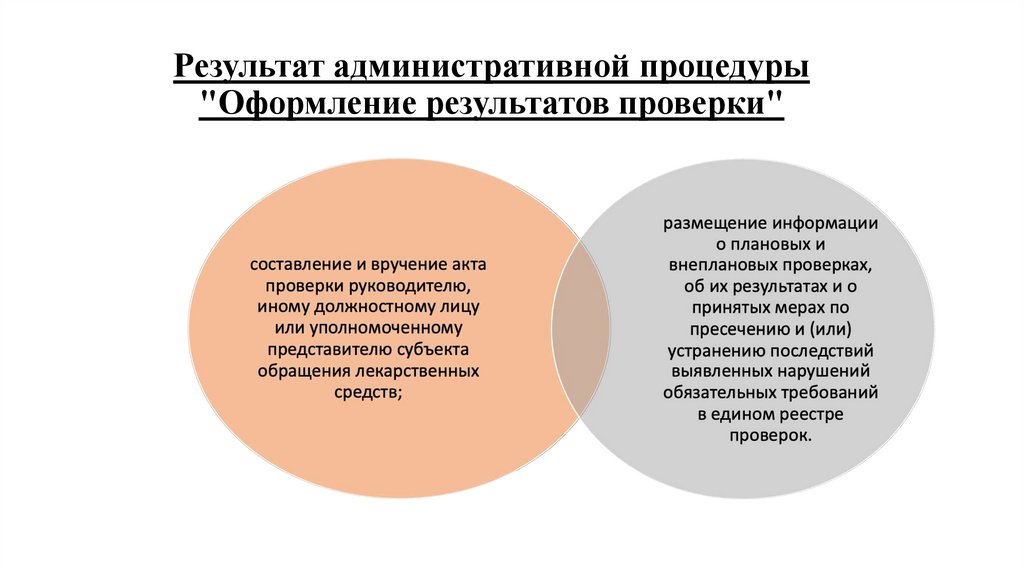
29. Результат административной процедуры "Оформление результатов проверки"
Результат административной процедуры"Оформление результатов проверки"
30. Федеральный государственный надзор
• Как основание для проведения внеплановых проверок Федеральнойслужбой по надзору в сфере здравоохранения и ее территориальными
органами используются индикаторы риска нарушения обязательных
требований,
утверждаемые
Министерством
здравоохранения
Российской Федерации.
• В отношении отдельных организаций, осуществляющих деятельность в
сфере обращения лекарственных средств, плановые проверки
проводятся с установленной периодичностью согласно перечню видов
деятельности в сфере здравоохранения, сфере образования и
социальной сфере, осуществляемых юридическими лицами и
индивидуальными предпринимателями, в отношении которых
плановые проверки проводятся с установленной периодичностью,
утвержденному постановлением Правительства Российской Федерации.
31. Федеральный государственный надзор
• Сроки и последовательность административных процедур приосуществлении
государственного
надзора
устанавливаются
административными
регламентами,
разрабатываемыми
и
утверждаемыми в соответствии с постановлением Правительства
Российской Федерации от 16 мая 2011 г. N 373 "О разработке и
утверждении
административных
регламентов
исполнения
государственных
функций
и
административных
регламентов
предоставления государственных услуг".
32. Должностные лица, уполномоченные осуществлять государственный надзор
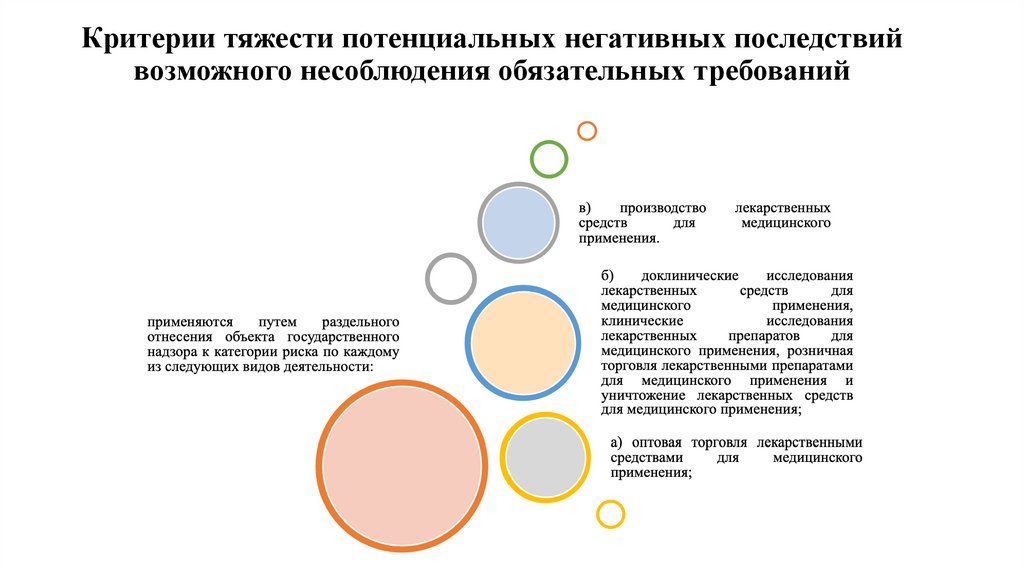
33. Критерии тяжести потенциальных негативных последствий возможного несоблюдения обязательных требований
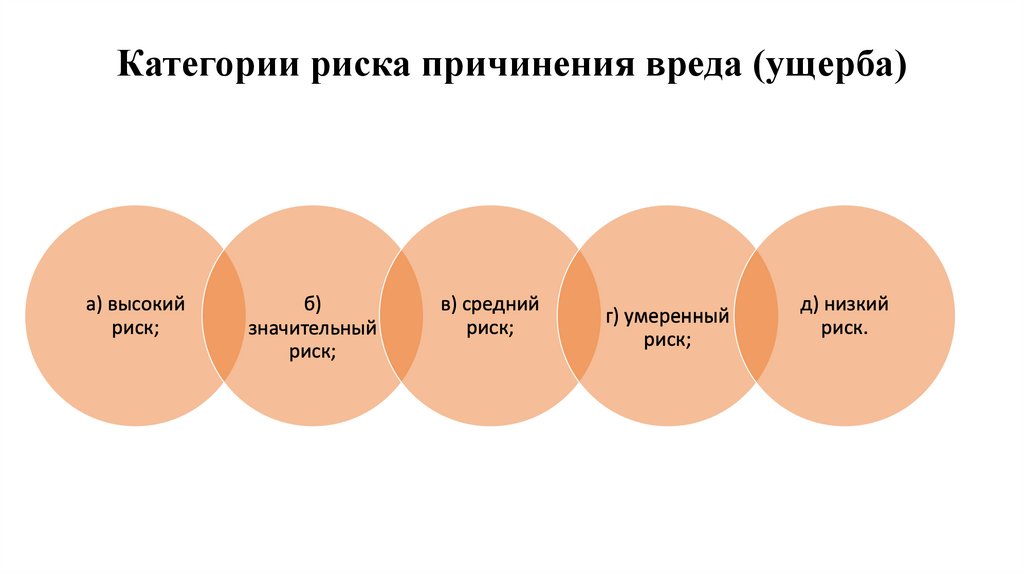
34. Категории риска причинения вреда (ущерба)
35. Контроль качества лекарственных форм, изготовленных в условиях аптечной организации
•Одной из функций аптечной организации может бытьизготовление экстемпоральных ЛФ по рецептам врачей,
требованиям ЛПУ из ЛС, зарегистрированных в РФ.
•Правовой основой реализации аптечной организацией данной
функции является ФЗ – 61 «Об обращении лекарственных средств»
от 12 апреля 2010 года , ст. 56. Изготовление и отпуск
лекарственных препаратов
36. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ, ИЗГОТОВЛЕННЫХ В УСЛОВИЯХ АПТЕЧНОЙ ОРГАНИЗАЦИИ
• Изготовлениелекарственных
препаратов
аптечными
организациями, ветеринарными аптечными организациями,
индивидуальными предпринимателями, имеющими лицензию на
фармацевтическую деятельность, осуществляется по рецептам на
лекарственные препараты, по требованиям медицинских
организаций, ветеринарных организаций в соответствии с
правилами изготовления и отпуска лекарственных препаратов,
утвержденными
уполномоченным
федеральным
органом
исполнительной власти.
37. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ, ИЗГОТОВЛЕННЫХ В УСЛОВИЯХ АПТЕЧНОЙ ОРГАНИЗАЦИИ
• Приизготовлении
лекарственных
препаратов
аптечными
организациями, ветеринарными аптечными организациями, имеющими
лицензию
на
фармацевтическую
деятельность,
используются
лекарственные препараты и (или) фармацевтические субстанции,
включенные соответственно в государственный реестр лекарственных
средств для медицинского применения, государственный реестр
лекарственных средств для ветеринарного применения, единый реестр
зарегистрированных
лекарственных
средств
Евразийского
экономического союза в установленном порядке.
• Не
допускается
изготовление
аптечными
организациями,
ветеринарными аптечными организациями, имеющими лицензию на
фармацевтическую
деятельность,
лекарственных
препаратов,
зарегистрированных в Российской Федерации.
38. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ, ИЗГОТОВЛЕННЫХ В УСЛОВИЯХ АПТЕЧНОЙ ОРГАНИЗАЦИИ
• Общую ответственность за организацию процесса изготовленияЛП в аптечной организации несет заведующий (директор) или его
заместитель.
39. Особенности организации изготовления ЛП в аптеках в сравнении с промышленным производством:
• Разнообразие прописей по составу ЛС, числу и дозировкам ингредиентов,лекарственным формам, отражающим индивидуальный подход к лечению
больного и клиническое мышление врача
• Относительная неустойчивость экстемпоральных ЛФ за счет редкого
использования вспомогательных компонентов-стабилизаторов
• Совмещение в небольших аптеках изготовления разных по составу ЛП на
одном рабочем месте (при условии запрета изготовления разных ЛП
одновременно)
• Высокие
затраты
(значительные
площади,
высокотехнологичное
оборудование,
квалифицированный
персонал,
условия
качества
технологических процессов)
40. Достижению изготовления в условиях аптечного предприятия качественного ЛП способствует управление:
1. Состоянием помещений и рабочих мест, соответствующимтехнологическим требованиям и регламентам
2. Способностью персонала решать профессиональные задачи,
обеспечивать выполнение всех стадий и операций,
предусматриваемых технологическим регламентом.
3. Соответствием технологического, весоизмерительного и
контрольно - аналитического оборудования, необходимого для
изготовления ЛП и контроля качества готового продукта
4. Качеством сырья и материалов, используемых при изготовлении,
и изготовленного ЛП.
41. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ, ИЗГОТОВЛЕННЫХ В УСЛОВИЯХ АПТЕЧНОЙ ОРГАНИЗАЦИИ
Для предупреждения поступления в аптечную организациюнекачественных ЛС проводится приемочный контроль, который
заключается в проверке правильности оформления документов,
подтверждающих качество поступающих препаратов, и их
соответствия требованиям по показателям:
«Описание»: внешний вид, цвет и запах;
«Упаковка»: целостность и соответствие физико- химическим
свойствам лекарственных средств;
«Маркировка»:
соответствие
оформления
действующим
регламентам.
42. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ, ИЗГОТОВЛЕННЫХ В УСЛОВИЯХ АПТЕЧНОЙ ОРГАНИЗАЦИИ
• В случае сомнения в качестве поступившего товара необходимоотобрать образцы и направить их на анализ в испытательный
центр. До получения результатов анализа всю партию товара
хранят отдельно с надписью «Забраковано при приемочном
контроле».
• Повышению качества продукции способствуют следующие
предупредительные мероприятия: соблюдение санитарного
режима, правил получения, сбора и хранения воды очищенной,
технологии изготовления ЛП, обеспечение исправности и
точности
весоизмерительных
приборов,
тщательная
фармацевтическая
экспертиза
поступающих
рецептов,
обеспечение сроков и условий хранения в аптеке ЛС.
43. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ, ИЗГОТОВЛЕННЫХ В УСЛОВИЯХ АПТЕЧНОЙ ОРГАНИЗАЦИИ
• Для обеспечения должного качества все ЛС, изготовленные ваптеке по индивидуальным рецептам или требованиям ЛПУ, а
также внутриаптечная заготовка, концентраты и полуфабрикаты
подвергаются внутриаптечному контролю качества.
• Провизор-аналитик
осуществляет
полный
контроль
приготовленных ЛС.
44. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ, ИЗГОТОВЛЕННЫХ В УСЛОВИЯХ АПТЕЧНОЙ ОРГАНИЗАЦИИ
• Для проведения контроля качества изготовленных JIC в аптекахорганизуются контрольно-аналитические кабинеты (КАК), если в штате
предусмотрена должность провизора-аналитика, или контрольноаналитические столы (КАС), если такой должности нет. КАК и КАС
должны быть оснащены типовым набором оборудования, а также
соответствующими приборами и реактивами.
• Результаты контроля качества ЛC регистрируются в журналах по
установленным формам. Все журналы должны быть пронумерованы,
прошнурованы, скреплены печатью аптеки и заверены подписью
заведующего аптекой. Срок хранения журналов 1 год.
• По итогам контроля качества Л С за год составляется отчет. К отчету
прилагаются
объяснительная
записка
об
организационнометодической работе и сведения о количестве неудовлетворительно
изготовленных ЛC.
45. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ, ИЗГОТОВЛЕННЫХ В УСЛОВИЯХ АПТЕЧНОЙ ОРГАНИЗАЦИИ
• Все ЛС, изготовленные в аптеках по индивидуальным рецептамили требованиям лечебно-профилакти- ческих учреждений, в
виде внутриаптечной заготовки, фасовки, а также концентраты и
полуфабрикаты подвергаются внутриаптечному контролю:
письменному, органолептическому и контролю при отпуске
обязательно;
опросному и физическому — выборочно;
химическому — в соответствии с конкретными требованиями в
зависимости от состава и вида лекарственной формы.
46. Письменный контроль
При изготовлении лекарственных препаратов, в том числе порецептам и требованиям, а также в виде внутриаптечной заготовки,
заполняется паспорт письменного контроля, в котором указываются:
а) дата изготовления лекарственного препарата;
б) номер рецепта или требования;
в) наименование медицинской организации, название отделения
(при наличии); номер серии, количество в серии - для лекарственных
препаратов в виде внутриаптечной заготовки;
г) наименования взятых лекарственных средств и их количества,
степень взятых гомеопатических разведений или гомеопатических
субстанций, число доз, подписи лиц, изготовившего, расфасовавшего
и проверившего лекарственную форму.
47. Письменный контроль
Паспорт письменного контроля заполняется сразу после изготовления
лекарственного препарата, с указанием лекарственных средств на латинском
языке, в соответствии с последовательностью технологических операций.
• Паспорта письменного контроля хранятся в течение двух месяцев со дня
изготовления лекарственных препаратов.
• При изготовлении порошков, суппозиториев указываются общая масса,
количество и масса отдельных доз.
• Общая суппозиторная масса, концентрация и объем (или масса)
изотонирующего вещества, добавленного в глазные капли, растворы для
инъекций и инфузий, должны быть указаны не только в паспортах письменного
контроля, но и на оборотной стороне рецепта на лекарственный препарат.
• В случае использования концентрированных растворов в паспорте
письменного контроля указываются их состав, концентрация и взятый объем.
48. Письменный контроль
• Все расчеты для изготовления лекарственного препаратапроизводятся до изготовления лекарственного препарата и
записываются в паспорте письменного контроля.
• Если в состав лекарственного препарата входят наркотические
средства, психотропные, ядовитые и сильнодействующие вещества,
а также другие лекарственные средства, подлежащие предметноколичественному учету, их количество указывается на оборотной
стороне рецепта.
• В случае, если лекарственные препараты изготавливаются и
отпускаются одним и тем же лицом, паспорт письменного контроля
заполняется в процессе изготовления лекарственного препарата.
49. Письменный контроль
• Изготовленные лекарственные препараты, рецепты и требования,по которым изготовлены лекарственные препараты, заполненные
паспорта письменного контроля передаются на проверку
провизору,
выполняющему
контрольные
функции
при
изготовлении и отпуске лекарственных препаратов.
• Контроль заключается в проверке соответствия записей в паспорте
письменного контроля назначениям в рецепте или требовании,
правильности произведенных расчетов.
• Если провизором-аналитиком проведен полный химический
контроль качества изготовленного лекарственного препарата, то на
паспорте письменного контроля проставляется номер химического
анализа и подпись провизора-аналитика.
50. Опросный контроль
• Опросный контроль осуществляется выборочно и проводится послеизготовления фармацевтом (провизором) не более пяти
лекарственных форм.
• При
проведении
опросного
контроля
провизором,
осуществляющим контрольную функцию, называется первое
входящее в состав лекарственного препарата лекарственное
средство, а в лекарственных препаратах сложного состава
указывается также его количество, после чего фармацевтом
(провизором) указываются все иные используемые лекарственные
средства и их количества. При использовании концентрированных
растворов фармацевтом (провизором) указывается также их состав
и концентрация.
51. Органолептический контроль
• Органолептический контроль является обязательным видом контроля изаключается в проверке лекарственного препарата по внешнему виду, запаху,
однородности смешивания, отсутствию механических включений в жидких
лекарственных формах. На вкус проверяются выборочно лекарственные
формы, предназначенные для детей.
• Однородность порошков, тритураций гомеопатических, масел, сиропов, мазей,
суппозиториев проверяется выборочно у каждого фармацевта (провизора) в
течение рабочего дня с учетом всех видов изготовленных лекарственных форм.
• Результаты органолептического контроля регистрируются в журнале
регистрации результатов органолептического, физического и химического
контроля лекарственных препаратов, изготовленных по рецептам на
лекарственные препараты, требованиям медицинских организаций и в виде
внутриаптечной заготовки, концентрированных растворов, тритураций, спирта
этилового и фасовки лекарственных средств.
52. Физический контроль
• Физический контроль заключается в проверке общей массы илиобъема лекарственного препарата, количества и массы отдельных
доз (не менее трех доз), входящих в лекарственный препарат,
количества гранул в одном грамме гомеопатических гранул,
распадаемости гомеопатических гранул.
• В рамках физического контроля проверяется также качество
укупорки изготовленного лекарственного препарата.
• Лекарственные
препараты,
изготовленные по
рецептам,
требованиям, подлежат физическому контролю выборочно в
течение рабочего дня с учетом всех видов изготовленных
лекарственных форм, но не менее 3% от их количества за день.
53. Физический контроль
• Лекарственные препараты, изготовленные в виде внутриаптечнойзаготовки, подлежат физическому контролю в количестве не менее
трех упаковок каждой серии (в том числе фасовка промышленной
продукции и гомеопатических лекарственных средств). Физический
контроль обязательно осуществляется в отношении лекарственных
препаратов, предназначенных для применения у детей в возрасте
до 1 года, содержащих наркотические средства, психотропные и
сильнодействующие
вещества,
лекарственные
препараты,
требующие
стерилизации,
суппозиториев,
инъекционных
гомеопатических растворов, настоек гомеопатических матричных.
• Обязательному контролю количества гранул в одном грамме
подлежат гранулы сахарные, как вспомогательное вещество, при
поступлении в аптечную организацию, к индивидуальному
предпринимателю.
54. Химический контроль
Химический контроль заключается в оценке качества изготовлениялекарственных препаратов по показателям:
• качественный анализ: подлинность лекарственных средств;
• количественный анализ: количественное определение лекарственных средств.
Для проведения химического контроля оборудуется специальное рабочее
место, оснащенное необходимым оборудованием, приборами и реактивами,
обеспеченное документами в области контроля качества и справочной
литературой.
Результаты качественного анализа регистрируются в журнале
регистрации результатов органолептического, физического и химического
контроля лекарственных препаратов, изготовленных по рецептам, требованиям
и в виде внутриаптечной заготовки, концентрированных растворов, тритураций,
спирта этилового и фасовки лекарственных средств, а также в журнале
регистрации результатов контроля лекарственных средств на подлинность.
55. Химический контроль
Качественномуанализу
в
обязательном
порядке
подвергаются:
а) очищенная вода и вода для инъекций ежедневно из каждого
баллона, а при подаче воды по трубопроводу - на каждом рабочем
месте на отсутствие хлоридов, сульфатов и солей кальция. Вода,
предназначенная для изготовления стерильных растворов, должна
быть также проверена на отсутствие восстанавливающих веществ,
солей аммония и углерода диоксида;
б) все лекарственные средства и концентрированные растворы (в
том числе настойки гомеопатические матричные, тритурации
гомеопатические первого десятичного разведения, растворы
гомеопатические первого десятичного разведения), поступающие из
помещений для хранения в помещения для изготовления
лекарственных препаратов;
56. Химический контроль
Качественномуподвергаются:
анализу
в
обязательном
порядке
в) лекарственные средства, поступившие в аптечную организацию, к
индивидуальному предпринимателю в случае возникновения сомнения в их
качестве;
г) концентрированные растворы, жидкие лекарственные средства в бюреточной
установке и в штангласах с пипетками, находящиеся в помещении изготовления
лекарственных препаратов, при их заполнении;
д) расфасованные лекарственные средства промышленного производства;
е) гомеопатические лекарственные препараты в виде внутриаптечной заготовки.
Качество лекарственного препарата оценивают по вспомогательным веществам.
57. Химический контроль
Качественномуподвергаются:
анализу
в
обязательном
порядке
Вода очищенная и вода для инъекций должны ежеквартально подвергаться полному
качественному и количественному анализу.
При проведении химического контроля очищенной воды и воды для инъекций в
журнале регистрации результатов контроля воды очищенной, воды для инъекций в
обязательном порядке указываются:
а) дата получения (отгонки) воды;
б) дата контроля воды;
в) номер проведенного химического анализа;
г) номер баллона или бюретки, из которых взята на анализ вода;
д) результаты контроля на отсутствие примесей;
е) показатели рН среды;
ж) заключение о результатах анализа воды (удовлетворяет/не удовлетворяет);
з) подпись лица, проводившего анализ.
58. Химический контроль
Качественномуподвергаются:
анализу
в
обязательном
порядке
• Журнал регистрации результатов контроля воды очищенной, воды для
инъекций должен быть пронумерован, прошнурован и скреплен подписью
руководителя учреждения и печатью вышестоящей организации.
• Качественному анализу должны подвергаться выборочно лекарственные
препараты различных лекарственных форм, изготовленные фармацевтом
(провизором) в течение рабочего дня, но не менее 10% от общего количества
изготовленных каждым фармацевтом лекарственных препаратов, кроме
гомеопатических.
• Гомеопатические лекарственные препараты в виде внутриаптечной заготовки
изготавливают под наблюдением провизора-аналитика или провизоратехнолога. В тритурациях гомеопатических и гомеопатических гранулах
качество лекарственного препарата дополнительно оценивают по
вспомогательным веществам.
59. Химический контроль
Качественному анализу в обязательном порядке подвергаются:При проведении химического контроля подлинности лекарственных средств в бюреточной
установке, штангласах и штангласах с пипетками в журнале регистрации результатов контроля
лекарственных средств на подлинность в обязательном порядке указываются следующие сведения:
а) дата заполнения бюреточной установки, штангласа;
б) порядковый номер химического анализа;
в) наименование лекарственного средства;
г) номер серии или номер анализа лекарственного средства производителя лекарственных средств;
д) номер заполняемого штангласа;
е) определяемое вещество (ион);
ж) результаты контроля по шкале "плюс" или "минус";
з) подписи лиц, заполнивших и проверивших заполнение.
Журнал результатов контроля лекарственных средств на подлинность должен быть пронумерован,
прошнурован и скреплен подписью руководителя аптечной организации (индивидуального
предпринимателя) и печатью (при наличии печати).
60. Химический контроль
Качественному и количественному анализу (полныйхимический контроль) подвергаются в обязательном порядке:
а) все растворы для инъекций и инфузий до стерилизации, включая
определение значения рН, изотонирующих и стабилизирующих
веществ. Растворы для инъекций и инфузий после стерилизации
проверяются по значению рН, подлинности и количественному
содержанию
действующих
веществ;
стабилизаторы
после
стерилизации проверяются лишь в случае, предусмотренном
документом в области контроля качества;
б)
стерильные
растворы
для
наружного
применения
(офтальмологические растворы для орошений, растворы для
лечения ожоговых поверхностей и открытых ран, для
интравагинального введения и иные стерильные растворы);
61. Химический контроль
Качественному и количественному анализу (полныйхимический контроль) подвергаются в обязательном порядке:
в) глазные капли и мази, содержащие наркотические средства,
психотропные, сильнодействующие вещества. При анализе глазных
капель содержание в них изотонирующих и стабилизирующих
веществ определяется до стерилизации;
г) все лекарственные формы, предназначенные для лечения
новорожденных детей и детей до 1 года;
д) растворы атропина сульфата и кислоты хлористоводородной (для
внутреннего применения), растворы серебра нитрата;
е) все концентрированные растворы, тритурации, кроме
гомеопатических тритураций;
62. Химический контроль
Качественному и количественному анализу (полныйхимический контроль) подвергаются в обязательном порядке:
ж) лекарственные препараты в виде внутриаптечной заготовки каждой серии, кроме
гомеопатических лекарственных препаратов;
з) стабилизаторы, применяемые при изготовлении растворов для инъекций и инфузий,
буферные растворы, применяемые при изготовлении глазных капель;
и) концентрация спирта этилового при разведении, а также в случае возникновения сомнений в
качестве спирта этилового при его поступлении в аптечную организацию, к индивидуальному
предпринимателю;
к) инъекционные гомеопатические растворы;
л) лекарственные формы, изготовленные по рецептам и требованиям, в количестве не менее
трех лекарственных форм при работе в одну смену с учетом различных видов лекарственных
форм. Особое внимание должно обращаться на лекарственные формы для детей, применяемые
в офтальмологической практике, содержащие наркотические и ядовитые средства, растворы для
лечебных клизм.
63. Требования к контролю качества стерильных растворов
• Изготовление и контроль качества стерильных растворовосуществляются в соответствии с настоящими Правилами,
требованиями Государственной фармакопеи или иного
документа в области контроля качества.
• Микробиологический контроль растворов, за исключением
растворов индивидуального изготовления, на стерильность и
испытание на пирогенность или бактериальные эндотоксины
растворов для инъекций и инфузий проводится в соответствии с
требованиями Государственной фармакопеи или иного
документа в области контроля качества.
64. Требования к контролю качества стерильных растворов
• До и после стерилизации стерильных растворов выполняется ихконтроль на механические включения.
• Механическими включениями являются посторонние подвижные
нерастворимые вещества, кроме пузырьков газа, случайно
присутствующие в растворах лекарственных препаратов.
• Одновременно должны проверяться объем растворов в емкостях
и качество их укупорки.
• В процессе изготовления стерильные растворы должны
подвергаться первичному и вторичному контролю на
механические включения.
• Первичный контроль осуществляется после фильтрования и
фасовки изготовленного раствора.
65. Требования к контролю качества стерильных растворов
• При обнаружении механических включений раствор повторнофильтруется, вновь просматривается, укупоривается, маркируется
и стерилизуется.
• Растворы, изготовленные асептически, просматриваются один
раз после фасовки или стерилизующего фильтрования.
• Первичному и вторичному контролю подлежат 100% емкостей с
растворами.
• Контроль растворов на отсутствие механических включений
осуществляется провизором - технологом с соблюдением условий
и техники контроля.
66. Требования к контролю качества стерильных растворов
• Дляпросмотра
емкостей
должно
быть
специально
оборудованное рабочее место, защищенное от попадания
прямых солнечных лучей, допускается применение черно-белого
экрана и специальных устройств.
• В зависимости от объема емкости просматриваются
одновременно от одной до пяти штук.
67. Контроль при отпуске лекарственных препаратов
Контролюпри
отпуске
лекарственных
препаратов
подвергаются все изготовленные лекарственные препараты, в
рамках которого проверяется соответствие:
а) упаковки лекарственного препарата физико-химическим
свойствам, входящих в него лекарственных средств;
б) указанных в рецепте или требовании доз наркотических средств,
психотропных, сильнодействующих веществ возрасту пациента;
в) реквизитов рецепта, требования сведениям, указанным на
упаковке изготовленного лекарственного препарата;
г) маркировки лекарственного препарата требованиям
При выявлении одного из указанных несоответствий
изготовленный лекарственный препарат не подлежит отпуску.
68. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ, ИЗГОТОВЛЕННЫХ В УСЛОВИЯХ АПТЕЧНОЙ ОРГАНИЗАЦИИ
• Оценка качества изготовленных лекарств проводится по двумпоказателям: «Удовлетворяет» (годная продукция) и «Не
удовлетворяет» (брак). Признаками неудовлетворительного
изготовления лекарств являются несоответствие по описанию
(внешний вид, цвет, запах), прозрачности или цветности, наличие
видимых механических включений, несоответствие по
подлинности, отклонения по массе и объему.
69. Понятие лицензионного контроля
• В соответствии с п.2 ст. 45 ФЗ-61 производство лекарственныхсредств
в
Российской
Федерации
осуществляется
производителями, имеющими соответствующую лицензию, при
этом подтверждение соответствия лицензиата правилам
надлежащей производственной практики осуществляется в
рамках лицензионного контроля.
• Аналогичное требование установлено в ст.12 ФЗ «О
лицензировании отдельных видов деятельности», которая
включает среди прочих видов деятельности, подлежащих
лицензированию, и такой вид деятельности как производство
лекарственных средств.
70. Понятие лицензионного контроля
• п.1 ст. 9 ФЗ-61, который указывает, что лицензионный контроль является одним из видовгосударственного контроля в сфере обращения лекарственных средств, наряду с федеральным
государственным надзором в сфере обращения лекарственных средств и выборочным
контролем качества лекарственных средств. Пункт 2 этой же статьи указывает, что
лицензионный контроль в сфере производства лекарственных средств и фармацевтической
деятельности осуществляется уполномоченными федеральным органом исполнительной
власти и органами исполнительной власти субъектов Российской Федерации.
71. Понятие лицензионного контроля
• Далее, в вопросе определения компетенции в проведениилицензионного контроля федеральным органом исполнительной
власти и органами исполнительной власти субъектов РФ, идет отсылка к
ФЗ от 26 декабря 2008 года N 294-ФЗ «О защите прав юридических лиц
и
индивидуальных
предпринимателей
при
осуществлении
государственного контроля (надзора) и муниципального контроля»
(далее ФЗ-294) и к ФЗ от 4 мая 2011 года N 99-ФЗ «О лицензировании
отдельных видов деятельности» (далее ФЗ-99).
• В п. 1 ст.19 ФЗ-99 снова идет отсылка к иному нормативно-правовому
акту, которая указывает, что порядок организации и осуществления
лицензионного контроля за конкретным видом деятельности
устанавливается положением о лицензировании конкретного вида
деятельности, утверждаемым Правительством Российской Федерации.
72. Понятие лицензионного контроля
• На практике лицензирование производства лекарственных средствосуществляется Министерством промышленности и торговли России
(за исключением лекарственных средств ветеринарного назначения, в
отношении которых лицензирующим органом является Федеральная
служба по ветеринарному и фитосанитарному надзору) на основании
Постановления Правительства РФ от 06.07.2012 г. №686 «Об
утверждении
Положения
о
лицензировании
производства
лекарственных средств», а вот полномочия по лицензированию
фармацевтической деятельности переданы как раз органам
исполнительной власти субъектов РФ в лице региональных
Министерств здравоохранения.
73. Понятие лицензионного контроля
Любая лицензия представляет собой разрешительный документ наопределенные виды работ или услуг, реализацию товаров. В сфере
фармацевтической деятельности сюда входит:
• розничная продажа препаратов, предназначенных для применения в
медицинских целях;
• рецептурный отпуск товаров, чей свободный оборот запрещен или
ограничен;
• производство препаратов по заказам покупателей ил медицинских
организаций;
• хранение лекарств и сырья для их изготовления.
74. Лицензирование производства лекарственных средств для медицинского применения включает в себя следующие виды работ,
составляющихлицензируемый вид деятельности:
1) производство, хранение и реализация фармацевтических субстанций,
получаемых методами химического синтеза;
2) производство, хранение и реализация фармацевтических субстанций,
получаемых методами биотехнологического синтеза;
3) производство, хранение и реализация фармацевтических субстанций,
получаемых методами выделения из химического сырья;
4) производство, хранение и реализация фармацевтических субстанций,
получаемых методами выделения из источников биологического,
животного происхождения;
5) производство, хранение и реализация фармацевтических субстанций,
получаемых методами выделения из источников растительного
происхождения;
5.1) производство, хранение и реализация фармацевтической субстанции спирта этилового (этанола);
75. Лицензирование производства лекарственных средств для медицинского применения включает в себя следующие виды работ,
составляющихлицензируемый вид деятельности:
6) производство, хранение и реализация стерильных лекарственных
препаратов с указанием группы лекарственных препаратов:
а) препараты иммунобиологические медицинские — аллергены,
аллергоиды, анатоксины, вакцины, гамма-глобулины, иммуноглобулины,
иммуномодуляторы, моноклональные антитела, сыворотки, токсины,
цитокины;
б) препараты крови, получаемые методом генетической инженерии,
препараты крови, получаемые из крови человека;
в) препараты, содержащие сильнодействующие вещества;
г) препараты, содержащие высокотоксичные вещества, — антибиотики
бета-лактамного ряда, гормоны, цитостатики;
76. Лицензирование производства лекарственных средств для медицинского применения включает в себя следующие виды работ,
составляющихлицензируемый вид деятельности:
д) препараты, получаемые из животного сырья, — инсулины,
органопрепараты;
е) препараты радиофармацевтические;
ж) препараты, получаемые из лекарственного растительного сырья;
з) препараты, не требующие специального выделения в отдельное
производство, с указанием конкретной лекарственной формы (аэрозоль,
гель, губка, капли, концентрат жидкий, крем, линимент,
лиофилизированные продукты, мазь, паста, пленка, порошок,
растворитель, раствор для диализа, раствор для инъекций, раствор для
инфузий, раствор для наружного применения, суспензия, эмульсия);
77. Лицензирование производства лекарственных средств для медицинского применения включает в себя следующие виды работ,
составляющихлицензируемый вид деятельности:
7) производство, хранение и реализация нестерильных лекарственных
препаратов с указанием группы лекарственных препаратов:
а) препараты иммунобиологические медицинские — бактериофаги,
вакцины, иммуноглобулиновые комплексные препараты, пробиотики;
б) препараты, содержащие сильнодействующие вещества;
в) препараты, содержащие высокотоксичные вещества, — антибиотики
бета-лактамного ряда, гормоны, цитостатики;
г) препараты крови, получаемые из крови человека;
д) биологические лекарственные препараты;
е) препараты гомеопатические;
ж) препараты, получаемые из лекарственного растительного сырья;
78. Лицензирование производства лекарственных средств для медицинского применения включает в себя следующие виды работ,
составляющихлицензируемый вид деятельности:
з) препараты, не требующие специального выделения в отдельное
производство с указанием конкретной лекарственной формы (аэрозоль,
бальзам, брикет, горчичники, гранулы, гель, драже, жидкость, капли,
капсулы, капсулы мягкие, клей, крем, лак для ногтей, линимент, мазь,
масло, настойка, настой, пастилки, пастилки жевательные, паста,
пеллеты, пилюли, пластырь, порошок, раствор, резинка жевательная,
сироп, сок, спрей, суппозитории, суспензия, сырье растительное
измельченное,
сырье
растительное
цельное,
таблетки
для
использования в полости рта, таблетки непокрытые, таблетки покрытые
оболочкой, таблетки шипучие, трансдермальная терапевтическая
система, шампуни, экстракты сухие, экстракты жидкие, эликсиры,
эмульсии);
79. Лицензирование производства лекарственных средств для медицинского применения включает в себя следующие виды работ,
составляющихлицензируемый вид деятельности:
8) производство, хранение и реализация газов медицинских с указанием
лекарственной формы (газ медицинский жидкий, газ медицинский
сжатый);
9) производство, хранение и реализация лекарственных средств с
указанием стадии технологического процесса — упаковка (первичная и
(или) вторичная):
-для фармацевтических субстанций — в соответствии с подпунктами 1-5
настоящего пункта;
-для лекарственных препаратов — в соответствии с подпунктами 6-8
настоящего пункта.
80. Лицензионными требованиями являются:
а) наличие у соискателя лицензии помещений, зданий, сооружений и иных объектов,технических средств, оборудования и технической документации, принадлежащих
ему на праве собственности или на ином законном основании, необходимых для
выполнения заявляемых работ, соответствующих установленным требованиям;
б) соответствие производства лекарственных средств правилам организации
производства и контроля качества лекарственных средств в соответствии со статьей
45 ФЗ «Об обращении лекарственных средств»;
в) наличие в соответствии со статьей 45 ФЗ «Об обращении лекарственных средств»
промышленных регламентов, утвержденных руководителем производителя
лекарственных средств (соискателя лицензии) и включающих в себя перечень
используемых фармацевтических субстанций и вспомогательных веществ с
указанием количества каждого из них, данные об используемом оборудовании и
описание технологического процесса и методов контроля на всех этапах
производства лекарственных средств;
81. Лицензионными требованиями являются:
г) наличие в соответствии со статьей 45 ФЗ «Об обращениилекарственных средств» уполномоченного лица производителя
лекарственных средств, которое при вводе лекарственных средств в
гражданский оборот осуществляет подтверждение соответствия
лекарственных средств требованиям, установленным при их
государственной регистрации, и гарантирует, что лекарственные
средства произведены в соответствии с правилами производства и
контроля качества лекарственных средств, а также которое:
— имеет высшее фармацевтическое, химическое, медицинское или
биологическое образование либо при производстве лекарственных
средств для ветеринарного применения — ветеринарное образование,
стаж работы не менее чем 5 лет в области производства и контроля
качества лекарственных средств;
82. Лицензионными требованиями являются:
— при производстве лекарственных средств для медицинскогоприменения аттестовано в порядке, установленном Министерством
здравоохранения РФ, при производстве лекарственных средств для
ветеринарного
применения
—
в
порядке,
установленном
Министерством сельского хозяйства РФ;
д) наличие работников, заключивших трудовые договоры, имеющих
соответственно
высшее
или
среднее
профессиональное
фармацевтическое,
химическое,
химико-технологическое,
биологическое, биотехнологическое, медицинское или ветеринарное
образование, ответственных за производство и маркировку
лекарственных средств.
83. Перечень документов для лицензии на производство лекарственных средств для медицинского применения:
1. Карточка организации со всеми реквизитами с печатью организации;2. Бланк организации в электронном;
3. Устав, нотариально заверенная копия;
4. Учредительный договор (при наличии), нотариально заверенная
копия;
5. Оригинал платежного поручения об уплате госпошлины;
84. Перечень документов для лицензии на производство лекарственных средств для медицинского применения:
копии документов, подтверждающих соответствующие лицензионнымтребованиям
образование,
квалификацию
и
стаж
работы
уполномоченного лица производителя лекарственных средств для
медицинского применения, а также образование специалистов,
ответственных за производство и маркировку лекарственных средств:
— диплом о высшем или среднем образовании (фармацевтическое,
химическое, медицинское или биологическое);
— свидетельство о повышение квалификации;
— трудовые книжки на сотрудников, подтверждающие стаж 3 года;
— трудовые договора с сотрудниками для получения лицензии;
85. Перечень документов для лицензии на производство лекарственных средств для медицинского применения:
7. Копии титульных листов промышленных регламентов;8. Копии документов, подтверждающих наличие у соискателя лицензии
на праве собственности или на ином законном основании необходимых
для осуществления деятельности по производству лекарственных
средств для медицинского применения помещений, зданий,
сооружений и иных объектов, технических средств, оборудования и
технической
документации,
соответствующих
установленным
требованиям, права на которые не зарегистрированы в Едином
государственном реестре прав на недвижимое имущество и сделок с
ним;
9. Перечень лекарственных форм и (или) видов фармацевтических
субстанций, которые заявитель намерен производить на фирменном
бланке организации;
86. Перечень документов для лицензии на производство лекарственных средств для медицинского применения:
10. Описание основных технологических процессов, обеспечивающих качестволекарственных средств;
11. Копия выданного в установленном порядке документа о соответствии зданий,
помещений, оборудования и иного имущества, которые соискатель лицензии
предполагает использовать для осуществления производства лекарственных средств,
требованиям санитарных правил;
12. Согласие органов местного самоуправления на размещение производства
лекарственных средств на соответствующей территории;
13. Копия выданного в установленном порядке документа о соответствии зданий,
помещений, оборудования и иного имущества, которые соискатель лицензии
предполагает использовать для осуществления производства лекарственных средств,
требованиям санитарных правил;
87. Перечень документов для лицензии на производство лекарственных средств для медицинского применения:
14. Копии патентов РФ и (или) лицензионных договоров, разрешающихпроизводство и продажу патентованных и (или) оригинальных
лекарственных средств;
15. Доверенность на представление интересов;
16. Опись документов в 2 – х экз.
88. Лицензирующий орган и соискатель лицензии
• Министерство промышленности и торговли выдает разрешения напроизводство лекарственных средств для медицинского применения
• Документы для лицензирования фармацевтической деятельности
подаются в Росздравнадзор. В состав заявки обязательно включается
санитарно-эпидемиологическое заключение. Для его оформления
нужно обратиться в Роспотребнадзор. Специалисты этого ведомства
будут проверять соответствие помещений и строения санитарным
нормативам.















































































 medicine
medicine








