Similar presentations:
Организация контроля качества лекарственных средств
1.
Национальный фармацевтическийуниверситет
Кафедра организации и экономики фармации
ОРГАНИЗАЦИЯ КОНТРОЛЯ КАЧЕСТВА
ЛЕКАРСТВЕННЫХ СРЕДСТВ
к.фарм.н. доц.
Тетерич Наталия
Владимировна
2. Теоретические вопросы:
1. Обеспечение качества ЛС как международнаяпроблема
2. Современная концепция обеспечения
качества ЛС
3. Система обеспечения качества ЛС в Украине
4. Лицензирование, регистрация и
сертификация как инструменты
обеспечения качества ЛС
2
3. Литература :
1.2.
3.
4.
5.
6.
Організація фармацевтичного забезпечення населення: навч. посіб.
для студ. вищ. навч. закл. /А.С. Немченко, В.М. Назаркіна, Г.Л.
Панфілова, та ін.; За ред. А.С. Немченко [ЕЛЕКТРОННИЙ РЕСУРС]
Основы организации и экономики фармации в вопросах и ответах:
Учеб.пособ. // Под ред. А.С. Немченко. – Харьков: НФаУ, 2013 – Ч.І.
Приказ МЗ Украины № 436 от 30.10.2001 г. "Об утверждении
инструкции о порядке контроля качества ЛС во время оптовой и
розничной торговли" http://zakon2.rada.gov.ua/laws/show/z0107-02
Приказ МЗ Украины № 809 от 22.11.2011 «Об утверждении Порядка
установления запрета (временного запрета) и возобновления
обращения лекарственных средств на территории Украины»
http://zakon4.rada.gov.ua/laws/show/z0126-12
Приказ МЗ Украины № 812 от 7.10.2012 г. "Об утверждении Правил
производства (изготовления) и контроля качества ЛС в аптеках"
http://zakon2.rada.gov.ua/laws/show/z1846-12
Закон Украины от 8.09.2011 г. № 3718-VI «О внесении изменений в
некоторые законодательные акты Украины относительно
предупреждения фальсификации ЛС»
http://zakon3.rada.gov.ua/laws/show/3718-17
3
4. Обеспечение качества ЛС как международная проблема
45.
Качество и доступностьЛС в терапевтическом
смысле (GXP)
Адекватные действия
врача, клин. провизора
(стандарты мед. услуг,
протоколы, формуляры)
КАЧЕСТВЕННАЯ,
ДОСТУПНАЯ И
ЭФФЕКТИВНАЯ
ФАРМАКОТЕРАПИЯ
Качество
фармацевтических услуг
(Аптечная практика) (GPP)
ГОС. РЕГУЛИРОВАНИЕ
ВРАЧИ
Действия пациента
(Самолечение –
Фармацевтическая опека)
ОБРАЗОВАНИЕ
ПРОВИЗОРЫ
5
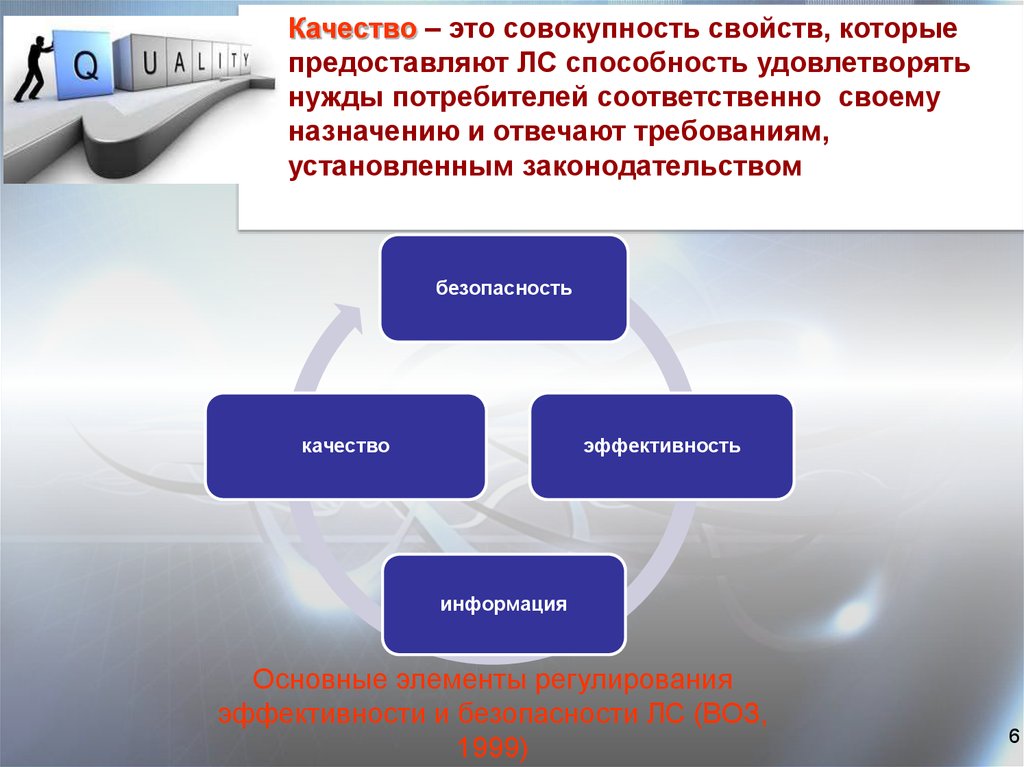
6.
Качество – это совокупность свойств, которыепредоставляют ЛС способность удовлетворять
нужды потребителей соответственно своему
назначению и отвечают требованиям,
установленным законодательством
безопасность
качество
эффективность
информация
Основные элементы регулирования
эффективности и безопасности ЛС (ВОЗ,
1999)
6
7. Основные понятия и термины
Некачественные (субстандартные) ЛС – ЛС, качество которыхне отвечает требованиям нормативных документов.
К некачественным также принадлежат ЛС с истекшим сроком
годности, которые подверглись механическому, химическому,
физическому, биологическому или др. воздействию, что делает
невозможным их дальнейшее использование.
Фальсифицированные ЛС – поддельные/ложно
маркированные/контрафактные – лекарственные средства с
неправильной маркировкой в отношении их подлинности и/или
изготовителя, нанесенной преднамеренно и в обманных целях
(ВОЗ, 2012)
Незарегистрированный препарат – препарат, который не
прошел официальной процедуры государственной регистрации
по занесению его в Государственный реестр ЛС
7
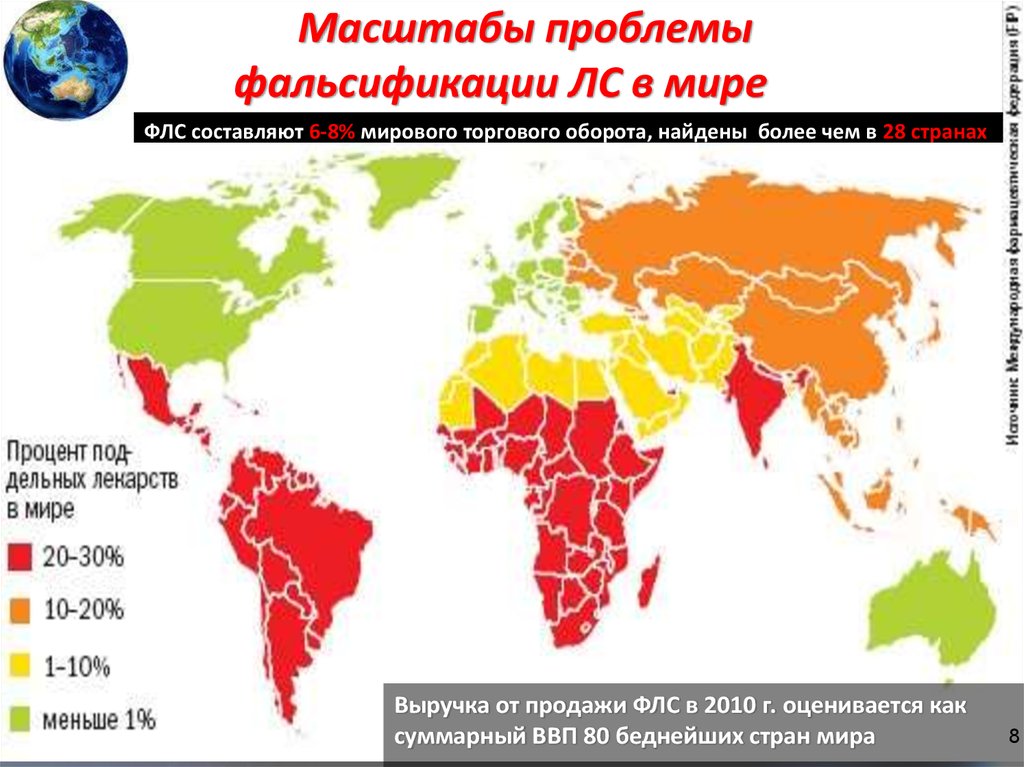
8.
Масштабы проблемыфальсификации ЛС в мире
ФЛС составляют 6-8% мирового торгового оборота, найдены более чем в 28 странах
Выручка от продажи ФЛС в 2010 г. оценивается как
суммарный ВВП 80 беднейших стран мира
8
9.
Фальсифицированные (контрафактные) ЛСІ тип – «плацебо»
не содержат активных
фармацевтических
ингредиентов (АФИ)
ІІ тип – «имитация»
АФИ заменены на
более дешевые и
менее эффективные
ІV тип –
«препараты-копии»
содержат
соответствующие
АФИ в
соответствующем
количестве, но
иного происхождения
ІІІ тип – «измененные /
модифицированные
ЛП» количество АФИ не
соответствует
заявленному
распространяются как по легальным,
так и нелегальным каналам сбыта препаратов
на фармацевтическом рынке
9
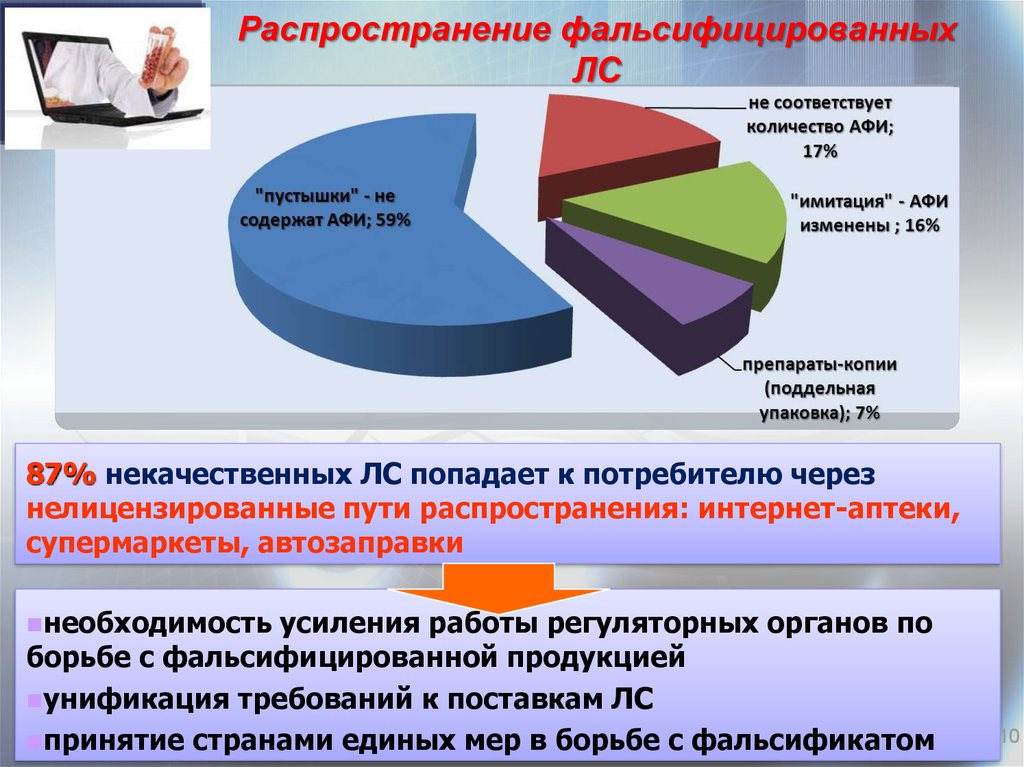
10. Распространение фальсифицированных ЛС на мировом фармрынке (данные ВОЗ)
87% некачественных ЛС попадает к потребителю черезнелицензированные пути распространения: интернет-аптеки,
супермаркеты, автозаправки
необходимость
усиления работы регуляторных органов по
борьбе с фальсифицированной продукцией
унификация требований к поставкам ЛС
принятие странами единых мер в борьбе с фальсификатом
10
11. Факторы, способствующие фальсификации ЛС
недостаточное признание правительствами серьезности проблемынеадекватная нормативно-правовая база, недостаточные санкции
неэффективный контроль изготовления, импорта, распределения ЛС
неэффективное сотрудничество между регуляторными органами
ограниченный доступ населения к надежным каналам снабжения ЛС,
неграмотность, бедность населения
национальная политика, в которой акцент делается на экономических
аспектах производства, а не на проблемах здравоохранения
раздробленные каналы распределения; зоны свободной торговли;
нерегулируемая Интернет-торговля
11
12. Программа помощи национальным системам здравоохранения в борьбе с некачественными и фальсифицированными ЛС (ВОЗ, 1995)
Всемирная база данных ВОЗ по выявлению фальсифицированных ЛСМетодика выявления фальсифицированных и субстандартных ЛС
Глобальная сеть (110 стран) сотрудников национальных систем
здравоохранения, отвечающих за работу по выявлению
фальсифицированных и субстандартных ЛС
12
13.
Международная целевая группа противодействияфальсификации медицинской продукции (IMPACT)
(создана в 2006 г.)
представители более чем 80 стран мира:
руководящие сотрудники государственных регуляторных органов;
эксперты по мед. продукции;
представители международных и региональных организаций:
• ВОЗ;
• специализированных учреждений ООН;
• Совета Европы;
• Организации экономического сотрудничества и развития;
• Европейской комиссии;
• Всемирной таможенной организации;
• Интерпола;
• Международной фармацевтической федерации;
• Международной федерации оптовых организаций в сфере
фармацевтической продукции;
13
14. Система сотрудничества по фармацевтическим инспекциям PIC/S
Конвенция о взаимном признании инспекций относительнопроизводства ЛС (PIC) - 1970 г.
Система сотрудничества по фармацевтическим инспекциям (РIC/S)
Сегодня в PIC/S входят инспекции из 43 стран
Исполнительный комитет находится в Женеве (Швейцария)
Заседания проходят 2 раза в год
Украина является участницей PIC/S с 2011 года
14
15. PIC/S является соглашением не на уровне правительств, а на уровне регуляторных органов, деятельность которых связана с лицензированием прои
PIC/S является соглашением не на уровнеправительств, а на уровне регуляторных органов,
деятельность которых связана с лицензированием
производителей ЛС и в состав которых входит
инспекторат по GMP
Согласно установленным PIC/S правилам, странаучастница, которая импортирует препарат из другой
страны-участницы, признает национальные
инспекции, проведенные в стране-экспортере,
эквивалентными ее собственным.
15
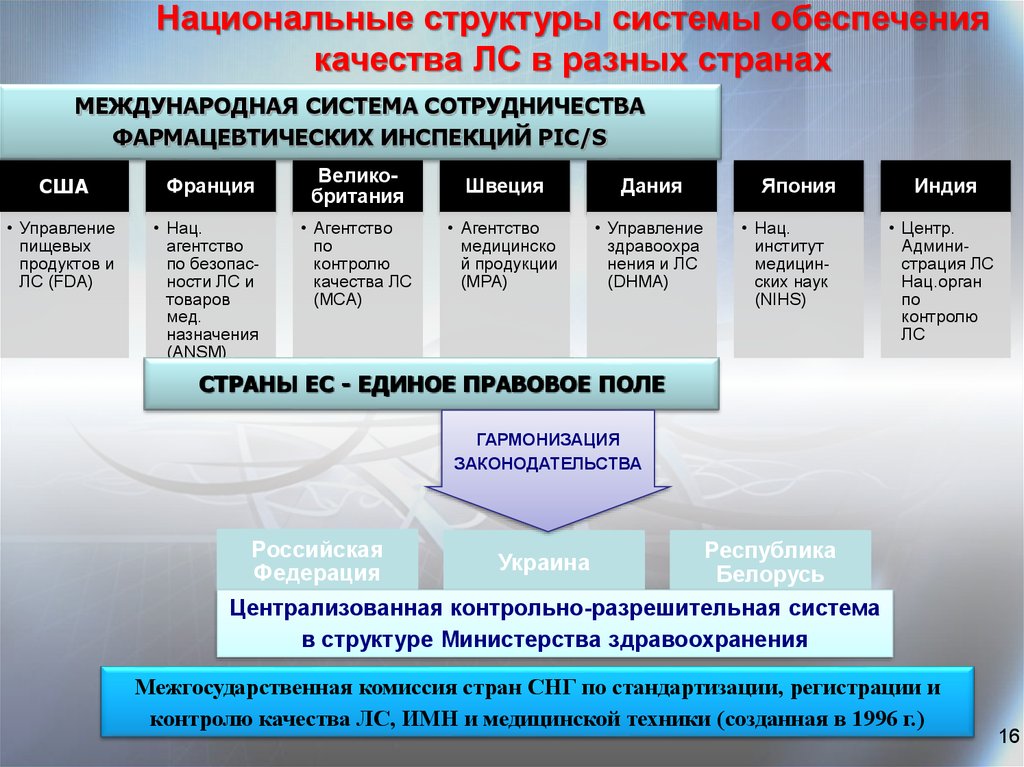
16.
Национальные структуры системы обеспечениякачества ЛС в разных странах
МЕЖДУНАРОДНАЯ СИСТЕМА СОТРУДНИЧЕСТВА
ФАРМАЦЕВТИЧЕСКИХ ИНСПЕКЦИЙ PІС/S
США
Франция
• Управление
пищевых
продуктов и
ЛС (FDA)
• Нац.
агентство
по безопасности ЛС и
товаров
мед.
назначения
(ANSM)
Великобритания
• Агентство
по
контролю
качества ЛС
(МСА)
Швеция
Дания
• Агентство
медицинско
й продукции
(МРА)
• Управление
здравоохра
нения и ЛС
(DHMA)
Япония
• Нац.
институт
медицинских наук
(NІHS)
Индия
• Центр.
Администрация ЛС
Нац.орган
по
контролю
ЛС
СТРАНЫ ЕС - ЕДИНОЕ ПРАВОВОЕ ПОЛЕ
ГАРМОНИЗАЦИЯ
ЗАКОНОДАТЕЛЬСТВА
Российская
Федерация
Республика
Белорусь
Централизованная контрольно-разрешительная система
в структуре Министерства здравоохранения
Украина
Межгосударственная комиссия стран СНГ по стандартизации, регистрации и
контролю качества ЛС, ИМН и медицинской техники (созданная в 1996 г.)
16
17. Ответственность за правонарушения (фальсификацию ЛС)
В США за подделку лекарств сажают втюрьму на 15 лет,
в Европе – в среднем на 13 лет,
в Китае - расстрел
Источник: Госинспекция по контролю качества ЛС, 2010
17
18.
Современная концепцияобеспечения качества
ЛС
18
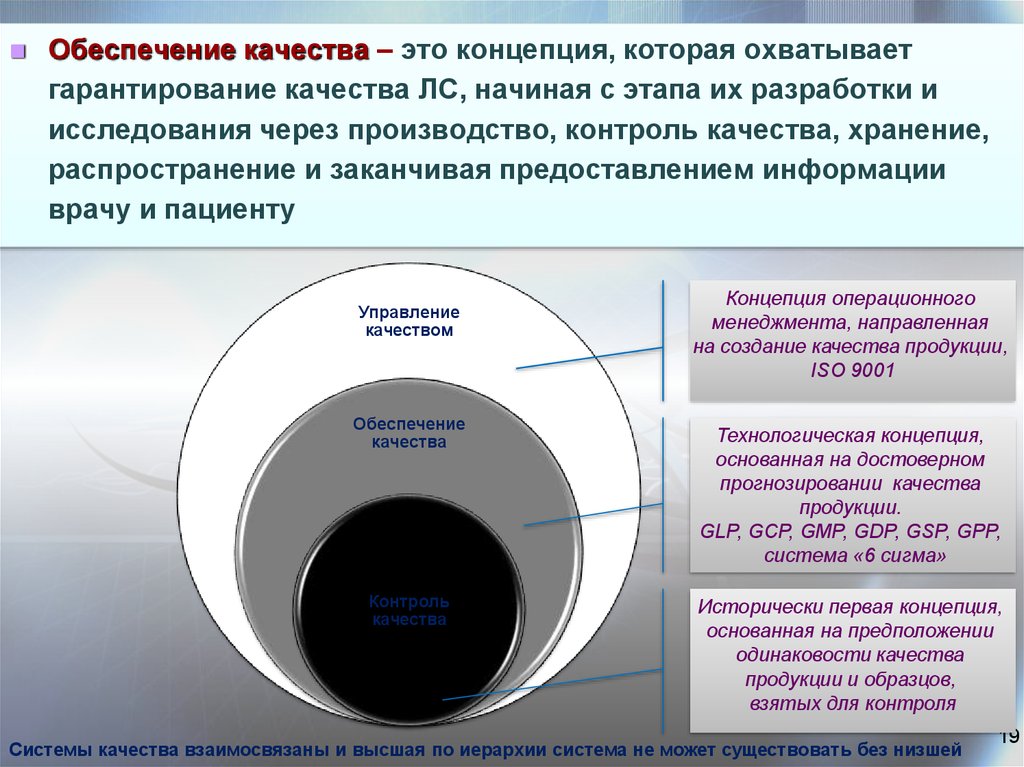
19.
Обеспечение качества – это концепция, которая охватываетгарантирование качества ЛС, начиная с этапа их разработки и
исследования через производство, контроль качества, хранение,
распространение и заканчивая предоставлением информации
врачу и пациенту
Управление
качеством
Обеспечение
качества
Контроль
качества
Концепция операционного
менеджмента, направленная
на создание качества продукции,
ISO 9001
Технологическая концепция,
основанная на достоверном
прогнозировании качества
продукции.
GLP, GCP, GMP, GDP, GSP, GPP,
система «6 сигма»
Исторически первая концепция,
основанная на предположении
одинаковости качества
продукции и образцов,
взятых для контроля
Системы качества взаимосвязаны и высшая по иерархии система не может существовать без низшей
19
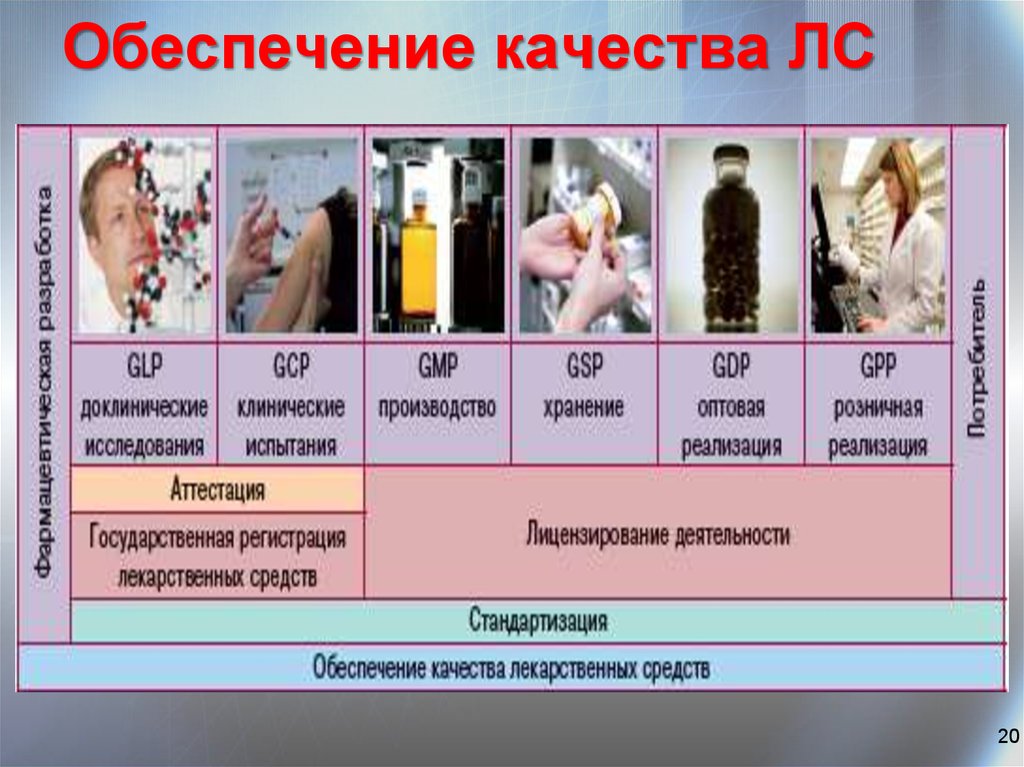
20. Обеспечение качества ЛС
2021.
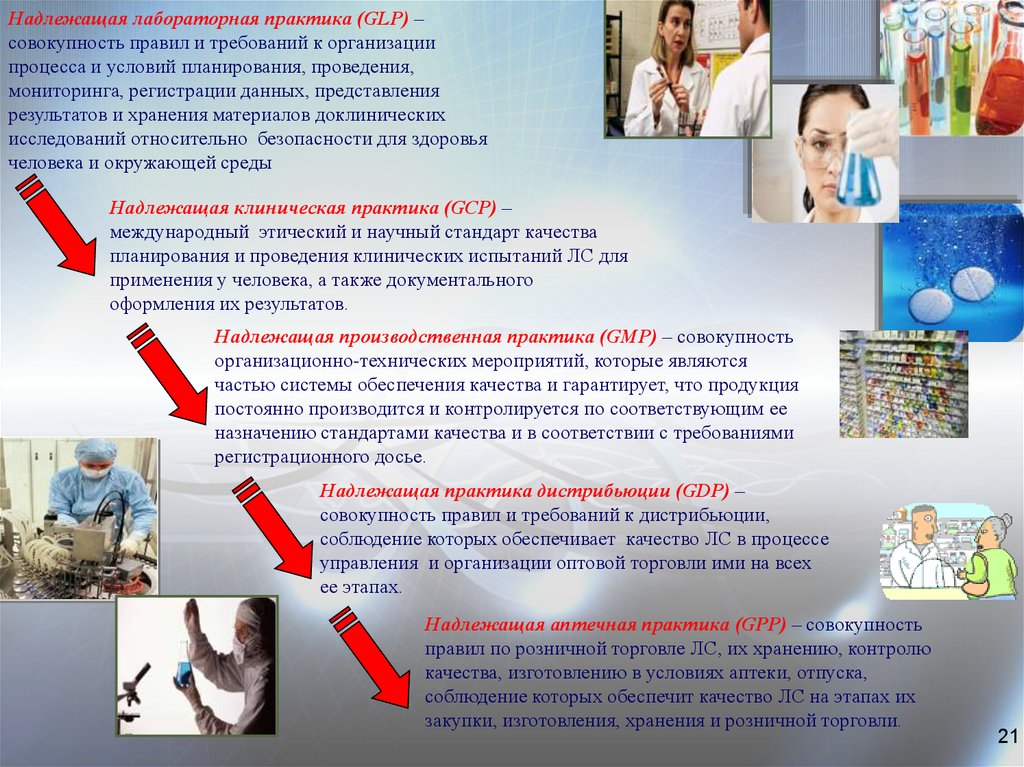
Надлежащая лабораторная практика (GLP) –совокупность правил и требований к организации
процесса и условий планирования, проведения,
мониторинга, регистрации данных, представления
результатов и хранения материалов доклинических
исследований относительно безопасности для здоровья
человека и окружающей среды
Надлежащая клиническая практика (GCP) –
международный этический и научный стандарт качества
планирования и проведения клинических испытаний ЛС для
применения у человека, а также документального
оформления их результатов.
Надлежащая производственная практика (GMР) – совокупность
организационно-технических мероприятий, которые являются
частью системы обеспечения качества и гарантирует, что продукция
постоянно производится и контролируется по соответствующим ее
назначению стандартами качества и в соответствии с требованиями
регистрационного досье.
Надлежащая практика дистрибьюции (GDР) –
совокупность правил и требований к дистрибьюции,
соблюдение которых обеспечивает качество ЛС в процессе
управления и организации оптовой торговли ими на всех
ее этапах.
Надлежащая аптечная практика (GPP) – совокупность
правил по розничной торговле ЛС, их хранению, контролю
качества, изготовлению в условиях аптеки, отпуска,
соблюдение которых обеспечит качество ЛС на этапах их
закупки, изготовления, хранения и розничной торговли.
21
22. Международная стандартизация проводится на международном уровне, участие в ней открыто для соответствующих органов всех стран; междунаро
Стандартизация ЛС – деятельность по установлению правил,норм и характеристик для общего и многократного
использования относительно реально существующих или
потенциальных заданий с целью достижения оптимальной
степени упорядоченности в сфере создания, производства,
контроля качества, регистрации и реализации ЛС
Международная стандартизация
проводится на международном уровне, участие в ней
открыто для соответствующих органов всех стран;
международные стандарты принимаются
Международной организацией по стандартизации
International standardization organization (ISO)
Национальная стандартизация проводится на
уровне одной страны; национальные стандарты – это
госстандарты , принятые центральным органом
исполнительной власти по вопросам стандартизации
(Госстандарт)
22
23. ISО 9000 - Управление качеством
Серия стандартов ИСО 9000затрагивает различные аспекты
управления качеством
ИСО 9001:2008 требования к системе
менеджмента качества
ИСО 9000 - основные
понятия и словарь,
ИСО 9004 - как
сделать систему
управления качеством
более эффективной и
работоспособной.
ИСО 19011 руководство по
проведению
внутреннего и
внешнего аудитов
систем менеджмента
качества.
23
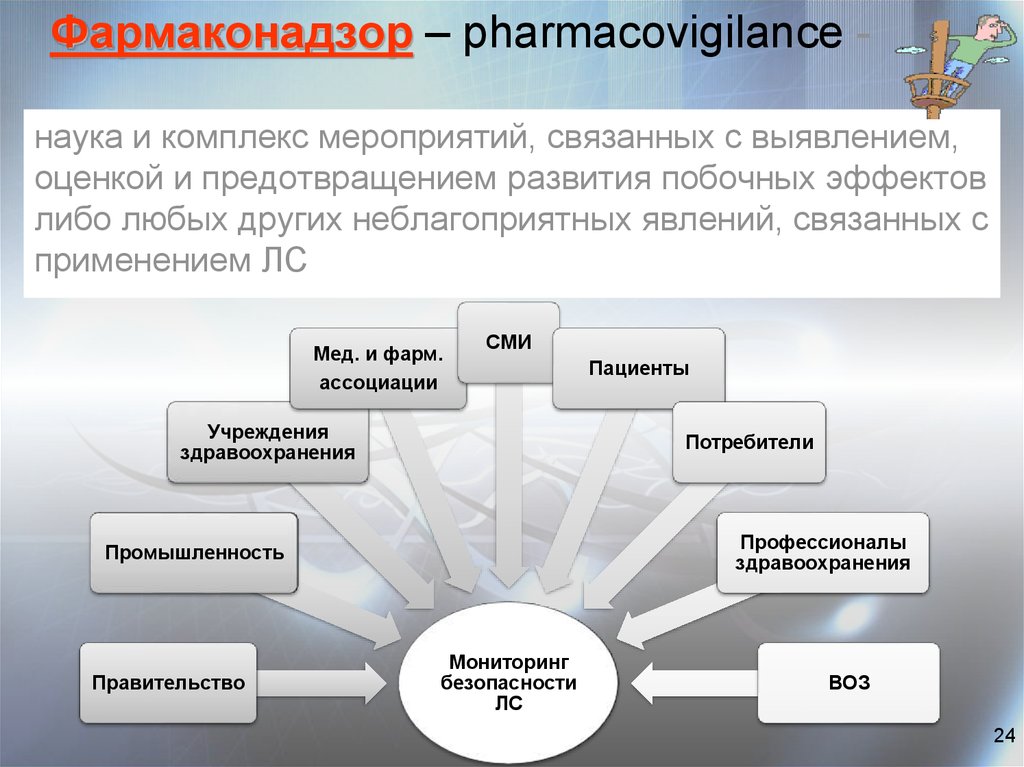
24. Фармаконадзор – pharmacovigilance -
Фармаконадзор – pharmacovigilance наука и комплекс мероприятий, связанных с выявлением,оценкой и предотвращением развития побочных эффектов
либо любых других неблагоприятных явлений, связанных с
применением ЛС
Мед. и фарм.
ассоциации
СМИ
Учреждения
здравоохранения
Потребители
Профессионалы
здравоохранения
Промышленность
Правительство
Пациенты
Мониторинг
безопасности
ЛС
ВОЗ
24
25.
Международная программа по мониторингу ЛС(WHO Programme on International Drug Monitoring)
действует с 1968 г.
глобальная информационная сеть, состоящая
из 104 национальных центров
фармаконадзора, координируемых
Мониторинговым центром ВОЗ
25
26.
Система обеспечениякачества ЛС в Украине
26
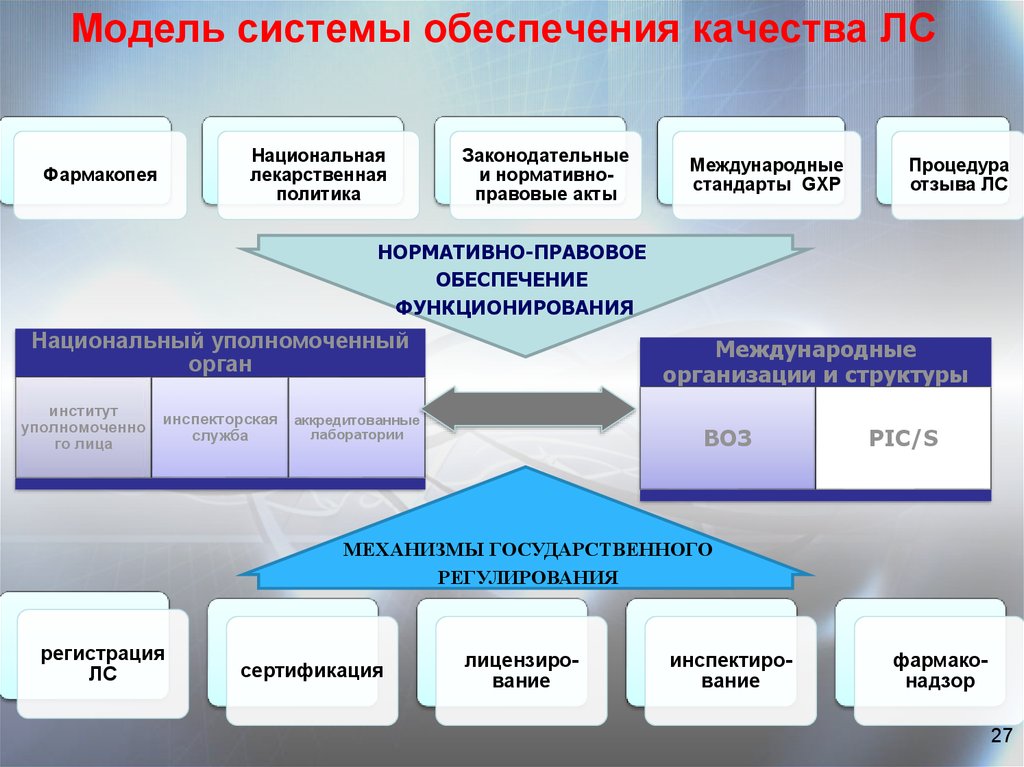
27. Модель системы обеспечения качества ЛС
Национальнаялекарственная
политика
Фармакопея
Законодательные
и нормативноправовые акты
Международные
стандарты GXP
Процедура
отзыва ЛС
НОРМАТИВНО-ПРАВОВОЕ
ОБЕСПЕЧЕНИЕ
ФУНКЦИОНИРОВАНИЯ
Национальный уполномоченный
орган
институт
уполномоченно
го лица
Международные
организации и структуры
инспекторская аккредитованные
лаборатории
служба
ВОЗ
PIC/S
МЕХАНИЗМЫ ГОСУДАРСТВЕННОГО
РЕГУЛИРОВАНИЯ
регистрация
ЛС
сертификация
лицензирование
инспектирование
фармаконадзор
27
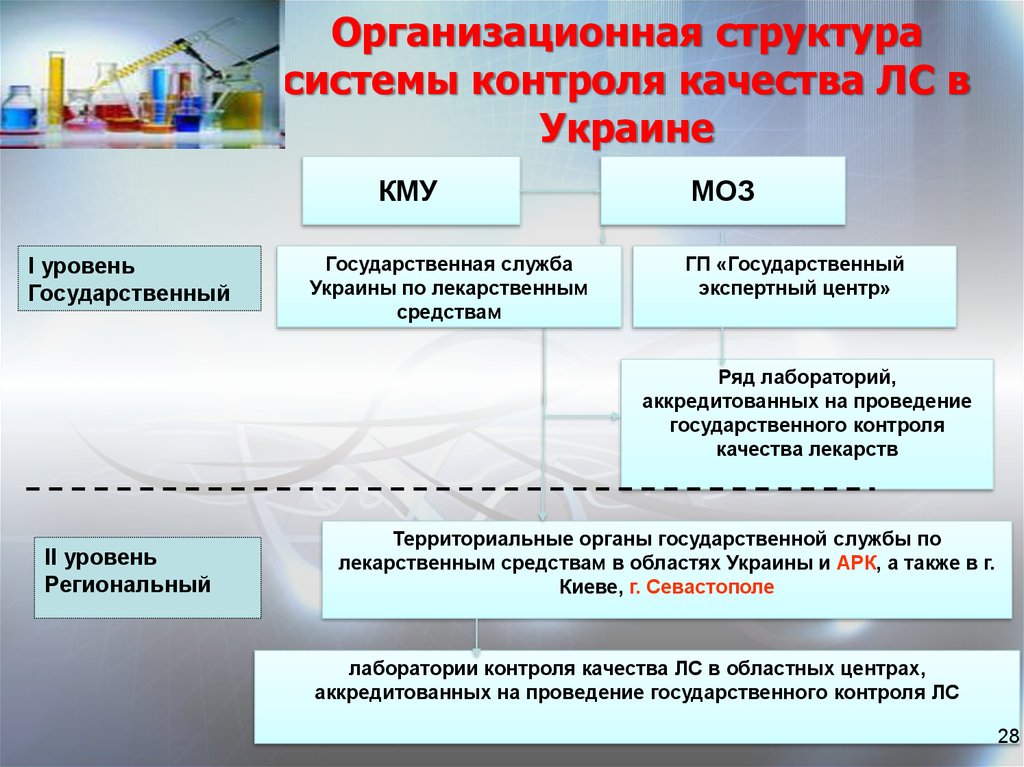
28.
Организационная структурасистемы контроля качества ЛС в
Украине
КМУ
I уровень
Государственный
Государственная служба
Украины по лекарственным
средствам
МОЗ
ГП «Государственный
экспертный центр»
Ряд лабораторий,
аккредитованных на проведение
государственного контроля
качества лекарств
II уровень
Региональный
Территориальные органы государственной службы по
лекарственным средствам в областях Украины и АРК, а также в г.
Киеве, г. Севастополе
лаборатории контроля качества ЛС в областных центрах,
аккредитованных на проведение государственного контроля ЛС
28
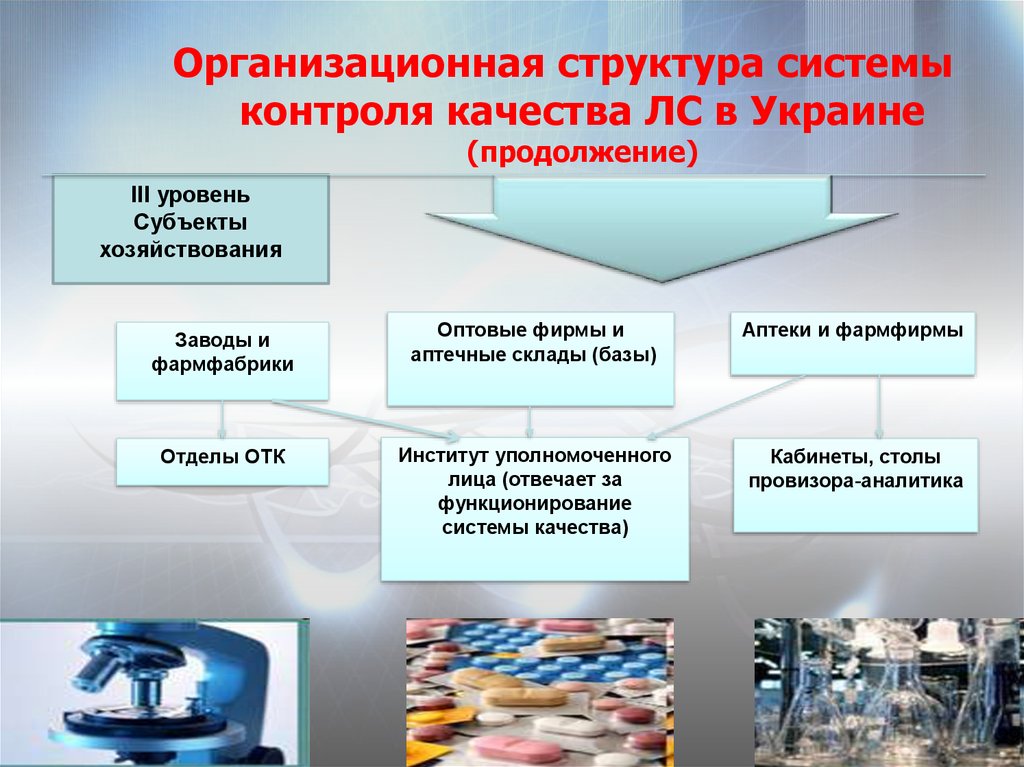
29. Организационная структура системы контроля качества ЛС в Украине (продолжение)
III уровеньСубъекты
хозяйствования
Заводы и
фармфабрики
Оптовые фирмы и
аптечные склады (базы)
Аптеки и фармфирмы
Отделы ОТК
Институт уполномоченного
лица (отвечает за
функционирование
системы качества)
Кабинеты, столы
провизора-аналитика
29
30.
Украина относится ВОЗ к странам с жесткойрегуляторной политикой в сфере обращения ЛС,
количество фальсифицированных, некачественных,
ложномаркированных препаратов составляет до 1%
За 6 мес 2013 г. Гослекслужбой Украины выдано 34
распоряжения о полном запрете 47 серий 25 наименований
фальсифицированных ЛС.
в 2012 г. – 67 распоряжений (67 серий 41 наименования ЛС)
чаще всего подделывают ЛС, которые
активно рекламируются: препараты для
лечения ЖКТ, обезболивающие ЛС
противовирусные
проект изменений к Закону «Об основных принципах гос.
надзора (контроля) в сфере хоз.деятельности» исключение нормы о необходимости предупреждения
субъекта хозяйствования о проведении проверки
качества ЛС за 10 дней
30
31.
Гослекслужба Украины, 2013www.diklz.gov.ua
31
32.
в 2011 г. Украина одной из первыхподписала Конвенцию Совета
Европы о подделке медицинской
продукции и подобных
преступлениях, которые угрожают
здравоохранению (Конвенция
MEDICRIME), которая была
ратифицирована в 2012 г.
принят ряд законодательных актов, направленных на
выполнение норм Конвенции MEDICRIME
введена уголовная ответственность за совершение
преступлений, связанных с фальсификацией ЛС
(лишение свободы на срок от 3 лет до пожизненного
заключения)
32
33. Лицензирование, регистрация и сертификация как инструменты обеспечения качества ЛС
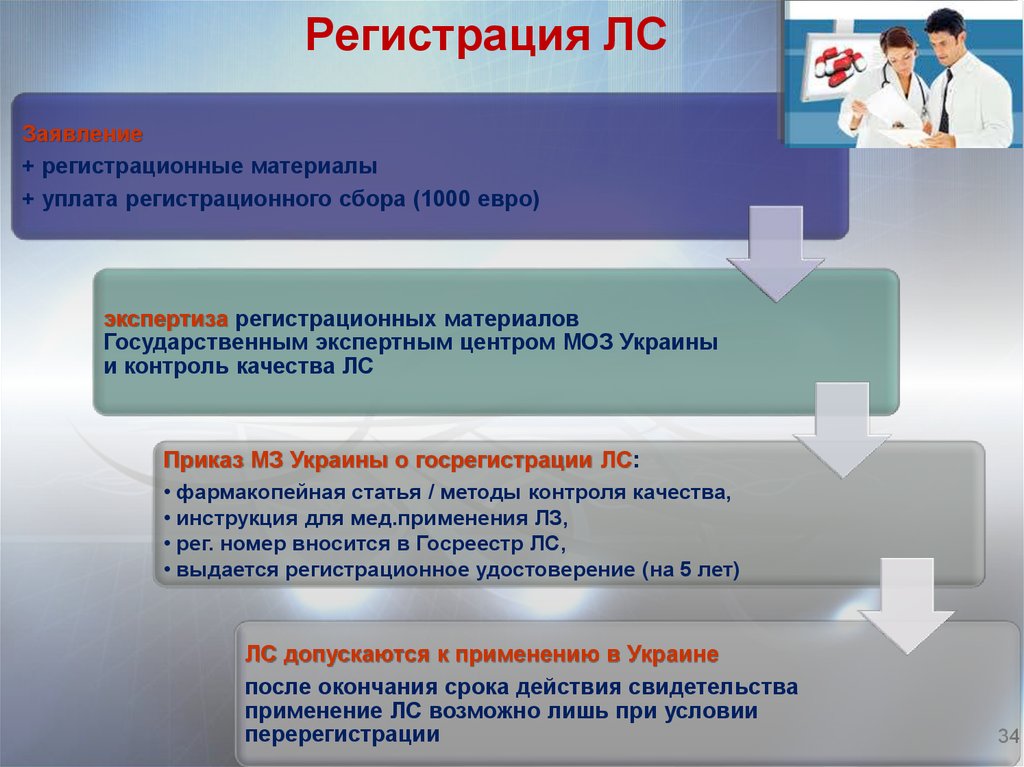
3334. Регистрация ЛС
Заявление+ регистрационные материалы
+ уплата регистрационного сбора (1000 евро)
экспертиза регистрационных материалов
Государственным экспертным центром МОЗ Украины
и контроль качества ЛС
Приказ МЗ Украины о госрегистрации ЛС:
• фармакопейная статья / методы контроля качества,
• инструкция для мед.применения ЛЗ,
• рег. номер вносится в Госреестр ЛС,
• выдается регистрационное удостоверение (на 5 лет)
ЛС допускаются к применению в Украине
после окончания срока действия свидетельства
применение ЛС возможно лишь при условии
перерегистрации
34
35. Минздрав Украины может принять решение о полном или временном запрете применения ЛС в таких случаях:
ЛС вредно для здоровья человека или терапевтическаяэффективность отсутствует при условии применения согласно
инструкции
состав ЛС не отвечает указанному в регистрационных документах
информация о ЛС в регистрационных документах недостоверна
заявитель не обеспечивает выполнения приведенных в
регистрационных документах всех видов контроля качества ЛС
выявлены другие опасные свойства ЛС, которые определяются МЗ с
учетом международной практики
35
36.
В странах ЕС для размещения на рынке ЛСнеобходимо получить торговую лицензию,
которая выдается компетентными
уполномоченными органами
Директива 2001/83/ЕС Европейского Парламента и
Совета ЕС от 6.11.2001 г. "О кодексе Сообщества
относительно медицинских препаратов для человека"
36
37. Сертификация на соответствие GMP и GDP – обязательное условие лицензирования производства и оптовой торговли ЛС в ЕС
В основу сертификациикачества ЛС положены принципы
соответствия:
производства ЛС – нормам и
требованиям GMP;
характеристик препарата –
условиям его регистрации;
образцов серий ЛС – стандарту
качества
37
38. Резолюция по применению Системы сертификации ВОЗ (Ассамблея ВОЗ, май 1992 г. WHA 45/29)
• Меры по сертификации:• лицензирование производителей, оптовых фирмпоставщиков в соответствии с требованиями и нормами
GMP, GDP ;
• регистрация ЛС (заявление о лицензионном статусе
ЛС);
• инспектирование производителей с целью оценки
выполнения требований GMP, GDP ;
• выдача сертификатов;
• расследование рекламаций и сообщений
соответствующих органов о дефектах качества ЛС и
связанной с его использованием потенциальной угрозой
38
39. Порядок сертификации ЛС для международной торговли
Предполагает получение:Сертификат ЛС –
• содержит
информацию о
госрегистрации ЛС
в Украине,
соответствии
производства ЛС
правилам GMP
Сертификат
лицензионного
статуса • подтверждает
регистрацию ЛС в
Украине
Сертификат серии
ЛС –
• выдается
производителем ЛС
и подтверждает
соответствие
показателей
качества и сроков
годности отдельной
серии ЛС
требованиям
стандартов
39
40. Обеспечение качества ЛС во время оптовой и розничной торговли
41. Теоретические вопросы:
1.Организация входного контроля ЛС. Обязанности
Уполномоченного лица
2.
Запрет (временный запрет) обращения ЛС
3.
Организация инспектирования аптечных учреждений
4.
Современные технологии в обеспечении качества ЛС
5.
Лицензирование импорта ЛС. Порядок ввоза ЛС в
Украину
6.
Проведение внутриаптечных видов контроля
качества экстемпоральных ЛС (самостоятельное
изучение)
41
42. Литература :
1.Організація фармацевтичного забезпечення населення: навч. посіб.
для студ. вищ. навч. закл. /А.С. Немченко, В.М. Назаркіна, Г.Л.
Панфілова, та ін.; За ред. А.С. Немченко [ЕЛЕКТРОННИЙ РЕСУРС]
2.
Основы организации и экономики фармации в вопросах и ответах:
Учеб.пособ. // Под ред. А.С. Немченко. – Харьков: НФаУ, 2013 – Ч.І.
3.
Приказ МЗ Украины № 436 от 30.10.2001 г. "Об утверждении
инструкции о порядке контроля качества ЛС во время оптовой и
розничной торговли" http://zakon2.rada.gov.ua/laws/show/z0107-02
4.
Приказ МЗ Украины № 809 от 22.11.2011 «Об утверждении Порядка
установления запрета (временного запрета) и возобновления
обращения лекарственных средств на территории Украины»
http://zakon4.rada.gov.ua/laws/show/z0126-12
5.
Приказ МЗ Украины № 812 от 7.10.2012 г. "Об утверждении Правил
производства (изготовления) и контроля качества ЛС в аптеках"
http://zakon2.rada.gov.ua/laws/show/z1846-12
42
43. Во время оптовой и розничной реализации ЛС и ИМН осуществляется:
• входной контроль – проводитуполномоченное лицо при поступлении
товара от поставщика
• выборочный государственный контроль
качества ЛС (при инспектировании субъектов
хозяйствования органами Гослекслужбы)
Приказ МОЗ Украины № 436 от 30.10.2001 г.
"Об утверждении инструкции о порядке
контроля качества ЛС во время оптовой и
розничной торговли"
43
44. Организация входного контроля ЛС. Обязанности уполномоченного лица
4445. Уполномоченное лицо (Authorized Person)
• в аптеках и оптовых фирмах – специалист с высшимфарм. образованием и стажем работы не менее 2 лет
(искл. – аптеки в сельской местности), на которого
возложены обязанности по функционированию
системы обеспечения качества ЛС при их оптовой и
розничной торговле и оформление вывода входного
контроля качества ЛС
на заводах, фабриках – специалист с высшим
фармацевтическим, химическим, биологическим или
биотехнологическим образованием и стажем работы
не менее 2 лет, на которого возложены обязанности
по функционированию системы обеспечения
качества ЛС при их производстве и выдача
разрешения на выпуск (реализацию) ЛС
45
46. Обязанности Уполномоченного лица
• проведение входного контроля качества ЛС и оформлениевывода (допуск к реализации ЛС);
• ведение реестра ЛС, которые поступили к субъекту хоз.
деятельности (позволяет отследить источник получения
каждой партии ЛС);
• проверка наличия некачественных и
фальсифицированных серий ЛС согласно информации
Гослекслужбы;
• предоставление территориальному органу Гослекужбы
сведений о выявленных ЛС сомнительного качества;
• изъятие из оборота и размещение в карантинной зоне ЛС;
• согласование внутреннего порядка обращения ЛС.
46
47.
Входной контроль ЛСс помощью визуальных методов проверяют:
–
–
–
–
–
–
–
сопроводительные документы,
сертификаты качества и анализа,
№ серии,
регистрацию,
состояние упаковки,
маркировку,
внешний вид ЛС
По результатам контроля заполняется
«Реестр лекарственных средств, которые поступили к субъекту
хозяйственной деятельности»
№
п/
п
Наименование
поставщика
и номер
лицензии
Номер
та дата
накладной
Название ЛС и его
лек.форма, дата
регистрации и
номер
регистрационного
удостоверения
Название
производителя
Номер
серии
Номер и
дата
сертификата
качества
производ
ителя
Количество
полученных
упаковок
Срок
годности
ЛС
Результат
контроля
уполномоч
енным
лицом
47
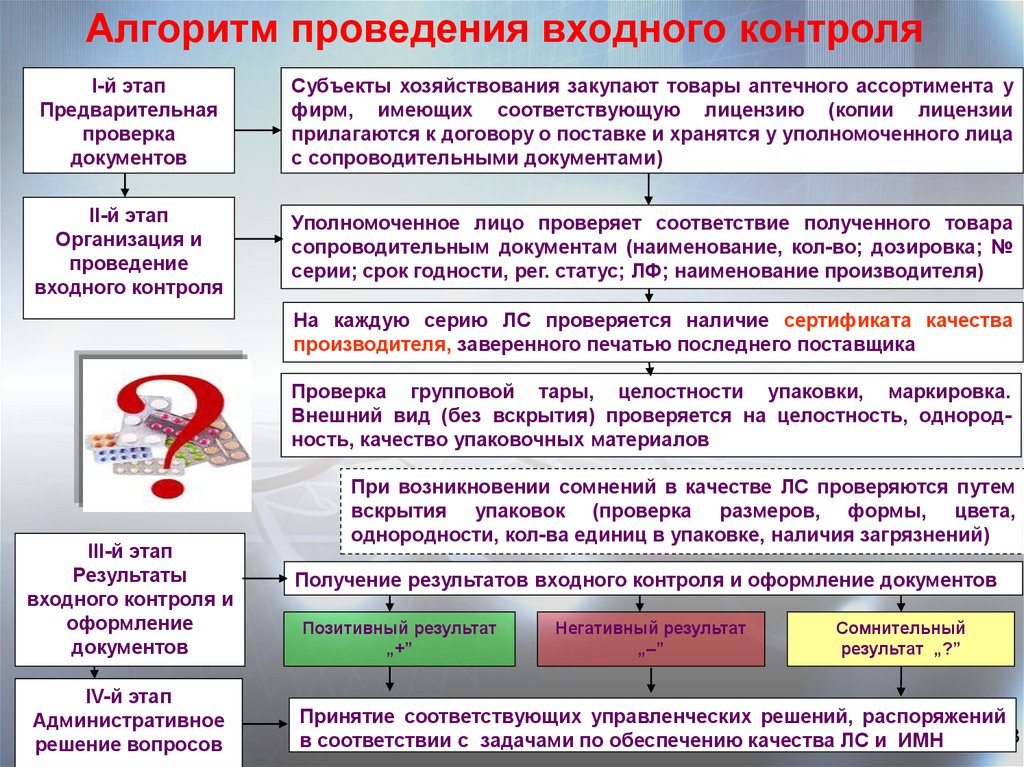
48. Алгоритм проведения входного контроля
І-й этапПредварительная
проверка
документов
Субъекты хозяйствования закупают товары аптечного ассортимента у
фирм, имеющих соответствующую лицензию (копии лицензии
прилагаются к договору о поставке и хранятся у уполномоченного лица
с сопроводительными документами)
ІІ-й этап
Организация и
проведение
входного контроля
Уполномоченное лицо проверяет соответствие полученного товара
сопроводительным документам (наименование, кол-во; дозировка; №
серии; срок годности, рег. статус; ЛФ; наименование производителя)
На каждую серию ЛС проверяется наличие сертификата качества
производителя, заверенного печатью последнего поставщика
Проверка групповой тары, целостности упаковки, маркировка.
Внешний вид (без вскрытия) проверяется на целостность, однородность, качество упаковочных материалов
ІІІ-й этап
Результаты
входного контроля и
оформление
документов
IV-й этап
Административное
решение вопросов
При возникновении сомнений в качестве ЛС проверяются путем
вскрытия упаковок (проверка размеров, формы, цвета,
однородности, кол-ва единиц в упаковке, наличия загрязнений)
Получение результатов входного контроля и оформление документов
Позитивный результат
„+”
Негативный результат
„–”
Сомнительный
результат „?”
Принятие соответствующих управленческих решений, распоряжений
48
в соответствии с задачами по обеспечению качества ЛС и ИМН
49. Запрет (временный запрет) обращения ЛС
Приказ МЗ Украины № 809 от 22.11.2011 «Об утвержденииПорядка установления запрета (временного запрета) и
возобновления обращения лекарственных средств на
территории Украины»
49
50. Государственный контроль качества ЛС
К ПОТРЕБИТЕЛЮ НЕ ДОПУЩЕНО2009 – 230 тыс. упаковок на сумму 0,3 млн. $
2010 – 2,6 млн. упаковок на сумму 2,5 млн. $
2011 – 3,5 млн. упаковок на суму 4,4 млн. $
2012 – 1,5 млн. упаковок на суму 6,9 млн. $
За период с 2010 по 2013 гг.
к потребителю не допущено
более 7,6 млн. упаковок
некачественных и фальсифицированных
ЛС на сумму более 13,8 млн. долл. США
Гослекслужба Украины, 2013
www.diklz.gov.ua
50
51. Классы несоответствий ЛС:
1 класс - несоответствие,связанное с угрозой жизни
или тяжелых последствий
для здоровья
2 класс - несоответствие,
которое может вызвать
развитие болезни или
ненадлежащее лечение
3 класс - несоответствие,
которое не может вызвать
значительного вреда для
здоровья человека
• маркировка с ошибками в названии и/или дозе ЛС;
• отсутствие стерильности ЛС;
• высокий уровень токсичности, пирогенность
инъекц. и инфуз. ЛФ, наличие механических
включений;
• отсутствие в ЛС действующего вещества;
• химическая контаминация;
• фальсификация ЛС;
• наличие ошибок в тексте или в граф.
изображении;
• недостаточная или ошибочная информация в
инструкции;
• превышение уровня примесей;
• несоответствие методов контроля качества
требованиям ГФУ (тест "растворимость",
"идентификация", "колич. содержание",
"прозрачность", "pН", "микробиологическая
чистота");
• отсутствие герметичной упаковки нестерильных
ЛС;
• незначительные отклонения в маркировке (шрифт,
ошибка в рег. номере, штрих-коде, изменение
внешнего вида упаковки);
• несоответствие методов контроля качества ЛС
требованиям ГФУ (несоответствие тестам
"маркировка", "упаковка" и т.п.).
51
52. Действия Гослекслужбы при выявлении некачественных ЛС
распоряжение об установлении запрета обращения ЛСинформирует владельца рег. удостоверения ЛС или его
официального представителя, территориальные органы
Гослекслужбы Украины, МОЗ Украины и субъектов хозяйствования
письмом, по е-mail и путем оповещения в СМИ
При выявлении несоответствий 1 класса –
• распоряжение дается в течение суток –
• срочное сообщение о дефекте качества (отзыв ЛС)
уполномоченным органам ЕС, государств, которые
входят в PIC/S, и др. государств;
При выявлении несоответствий 2 класса –
• распоряжение дается в течение 1-2 суток
• срочное сообщение о дефекте качества
(отзыв ЛС) уполномоченным органам
государств - импортеров данной серии ЛС
52
53. Основания для временного запрета обращения ЛС:
получение Гослекслужбой сообщений о несоответствии качества ЛС– отрицательные результаты лаб. исследований образцов серий ЛС
выявление серии ЛС, относительно которой возникло
подозрение в фальсификации;
отсутствие положительного вывода о качестве ввезенного в
Украину ЛС;
поступление сообщений о непредвиденных побочных
реакциях или смерти человека при применении ЛС до
расследования причин;
отсутствие сертификата качества, которое выдается
производителем;
получение от лабораторий по контролю качества ЛС информации о
невоспроизводимости методик, предусмотренных методами
контроля качества
53
54. Основания для установления запрета обращения ЛС:
отрицательное заключениео качестве
образцов серии ЛС І или ІІ
класса несоответствий по результатам лаб. исследований
установление по результатам расследования факта
фальсификации серии ЛС или незарегистрированного ЛС;
установление факта необеспечения гарантии качества ЛС
технологией производства или методами контроля качества;
установление факта использования производителем
компонентов, не указанных в досье, ненадлежащее
осуществление контроля качества сырья и готовой
продукции;
подтверждение сообщения о возникновении непредвиденной
побочной реакции или смерти человека в результате
применения серии ЛС;
выявлены новые опасные для здоровья и жизни человека свойства
ЛС
54
55. Организация инспектирования аптечных учреждений
5556. Проверки соблюдения лицензиатами Лицензионных условий
Плановые• проводятся согласно
квартальным планам,
утвержденным приказом
Гослекслужбы (на официальном
веб-сайте)
• при условии письменного
уведомления за 10 дней до дня
проведения
• Срок осуществления не может
превышать 15 раб. дней, а для
субъектов малого
предпринимательства - 5.
Внеплановые
• осуществляются на основаниях,
определенных
законодательством
• во время внеплановых проверок
выясняются вопросы, которые
послужили основанием для их
проведения
• Срок осуществления проверки
не может превышать 10 раб.
дней, а для субъектов малого
предпринимательства – 2 дней.
Приказ МЗУ от 31.10.2011 N 724 «Об утверждении Порядка контроля
за соблюдением Лицензионных условий осуществления
хозяйственной деятельности по производству ЛС, оптовой, розничной
торговли ЛС»
56
57. Объекты проверки
учредительные документы;документы, подтверждающие право собственности или пользования
помещением;
соответствие материально-технической базы;
оригинал и копии лицензии;
положение об аптечном учреждении, должностные инструкции;
штатное расписание, трудовые книжки и др. кадровая документация;
соответствие персонала единым квалиф. требованиям (образование,
повышение квалификации, личные мед. книжки;)
наличие копий (бумажных или на эл. носителях) НПА; регулирующих
перечней ЛС;
наличие сертификатов качества и сертификатов анализа;
наличие тех. паспортов приборов, график поверки средств измерения;
журналы регистрации температуры и относ. влажности в помещении;
наличие журналов проведения входного контроля качества ЛС;
оформление журнала (книги) учета ЛС, подлежащих ПКУ;
акты проверок
57
58. Современные технологии в обеспечении качества ЛС
5859. Система отслеживания в обороте лекарственных средств
Директива № 2011/62/EU - направлена на предотвращениепопадания фальсифицированных ЛС в легальную сеть поставок
(с января 2013)
Директива № 2011/62/EU предусматривает, что производитель
должен промаркировать уникальным идентификатором все
рецептурные препараты, зарегистрированные в стране
«белый список»
• рецептурные препараты,
не требующие
кодификации из-за их
низкой стоимости,
ограниченного выпуска,
физической
невозможности подделки
и т.п.
«черный список»
• безрецептурные ЛС,
требуют кодификации изза высокой цены,
большого спроса,
известности торговой
марки и наличия случаев
попадания
фальсифицированных,
контрафактных ЛС в сеть
поставок
59
60.
Указанные изменения в законодательстве ЕС сделаютневозможным обращение фальсифицированных ЛС и
потенциально приведут к выталкиванию таких ЛС на
менее контролируемые рынки. Наиболее привлекательными
для перебрасывания фальсифицированных лекарств по
ряду признаков (географическое положение, объем рынка
страны) является украинский рынок.
С целью внедрения в Украине соответствующей
Системы специалистами Гослекслужбы Украины
была осуществлена масштабная подготовительная
работа.
Разработка и внедрение Системы на территории Украины
осуществляется Гослекслужбой Украины в тесном
сотрудничестве с Европейским директоратом по качеству
лекарственных средств и здравоохранения Совета Европы
(EDQM). EDQM отвечает за реализацию аналогичного
проекта в Европе. Гослекслужба Украины и EDQM подписали
соответствующий Меморандум о сотрудничестве.
60
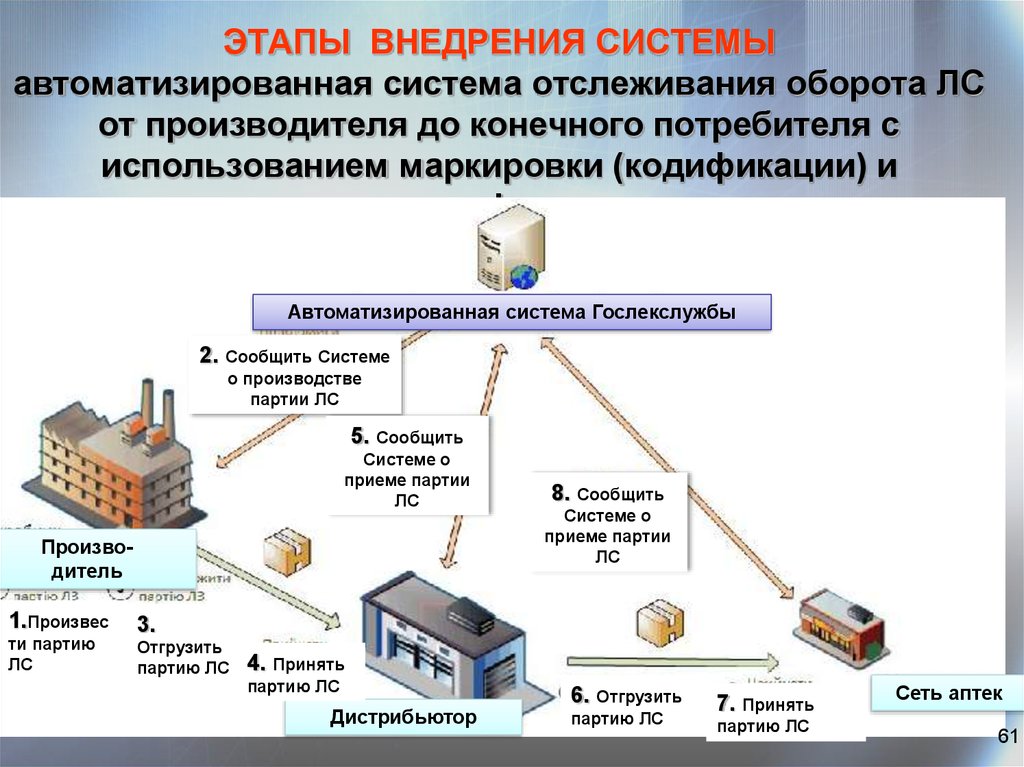
61. ЭТАПЫ ВНЕДРЕНИЯ СИСТЕМЫ автоматизированная система отслеживания оборота ЛС от производителя до конечного потребителя с использованием м
ЭТАПЫ ВНЕДРЕНИЯ СИСТЕМЫавтоматизированная система отслеживания оборота ЛС
от производителя до конечного потребителя с
использованием маркировки (кодификации) и
идентификации
Автоматизированная система Гослекслужбы
2. Сообщить Системе
о производстве
партии ЛС
5. Сообщить
Системе о
приеме партии
ЛС
Производитель
1.Произвес
ти партию
ЛС
8. Сообщить
Системе о
приеме партии
ЛС
3.
Отгрузить
партию ЛС
4. Принять
партию ЛС
Дистрибьютор
6. Отгрузить
партию ЛС
7. Принять
партию ЛС
Сеть аптек
61
62.
В 2013 г. в Украине стартовал пилотный проект по внедрениюиндивидуальной маркировки производителем внешней упаковки
ЛС, что позволит отследить весь путь ЛС от производителя до
конечного потребителя в режиме реального времени, исключить
попадание фальсифицированных ЛС в легальную сеть поставок
ДВУХМЕРНЫЙ КОД GS1 ECC200
13 цифр - код GTIN (код производителя)
(21) 20 цифр - уникальный идентификатор
упаковки – случайно сгенерированная
последовательность цифр (используются
случайные непоследовательные номера для
невозможности подделки)
(17) 6 цифр – срок годности в формате
ГГММДД (год-месяц-день)
(10) Номер серии ЛС
В данном проекте принимают участие компании «ФФ«Дарница»,
«Нобель Фарма» в Украине, «Альба Украина», Киевское КП
«Фармация»
62
62
63. Внедрение инновационных технологий в практику аптек
64. Лицензирование импорта ЛС. Порядок ввоза лс в украину
ЛИЦЕНЗИРОВАНИЕ ИМПОРТА ЛС.ПОРЯДОК ВВОЗА ЛС В УКРАИНУ
64
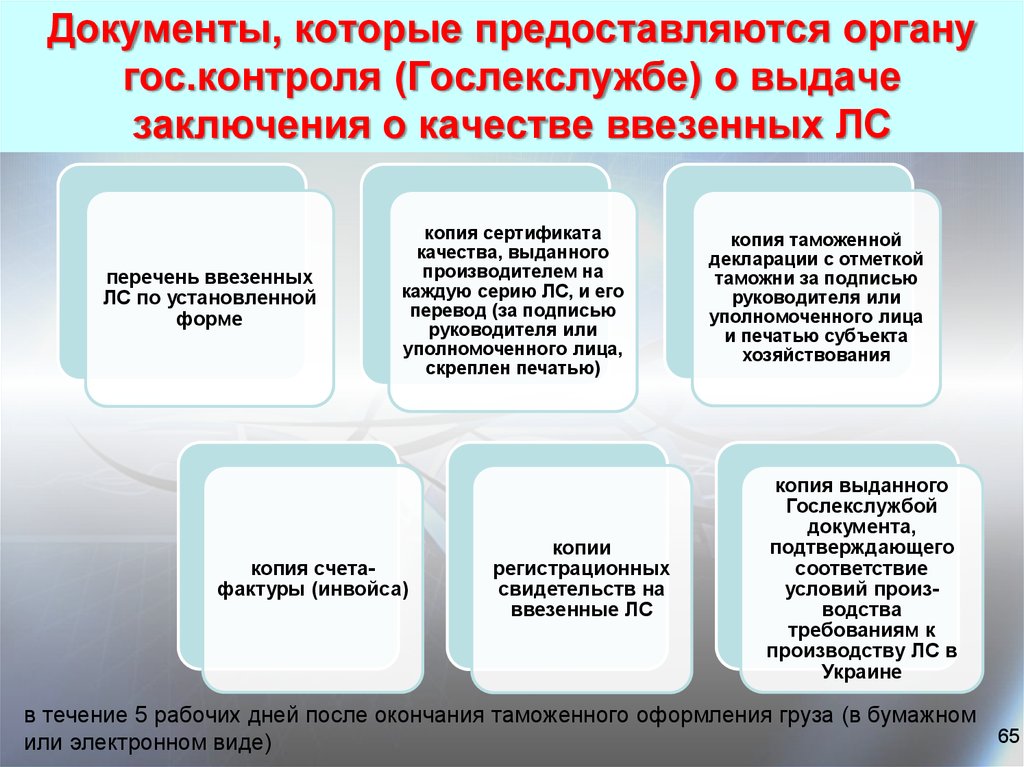
65. Документы, которые предоставляются органу гос.контроля (Гослекслужбе) о выдаче заключения о качестве ввезенных ЛС
перечень ввезенныхЛС по установленной
форме
копия сертификата
качества, выданного
производителем на
каждую серию ЛС, и его
перевод (за подписью
руководителя или
уполномоченного лица,
скреплен печатью)
копия счетафактуры (инвойса)
копии
регистрационных
свидетельств на
ввезенные ЛС
копия таможенной
декларации с отметкой
таможни за подписью
руководителя или
уполномоченного лица
и печатью cубъекта
хозяйствования
копия выданного
Гослекслужбой
документа,
подтверждающего
соответствие
условий производства
требованиям к
производству ЛС в
Украине
в течение 5 рабочих дней после окончания таможенного оформления груза (в бумажном
65
или электронном виде)
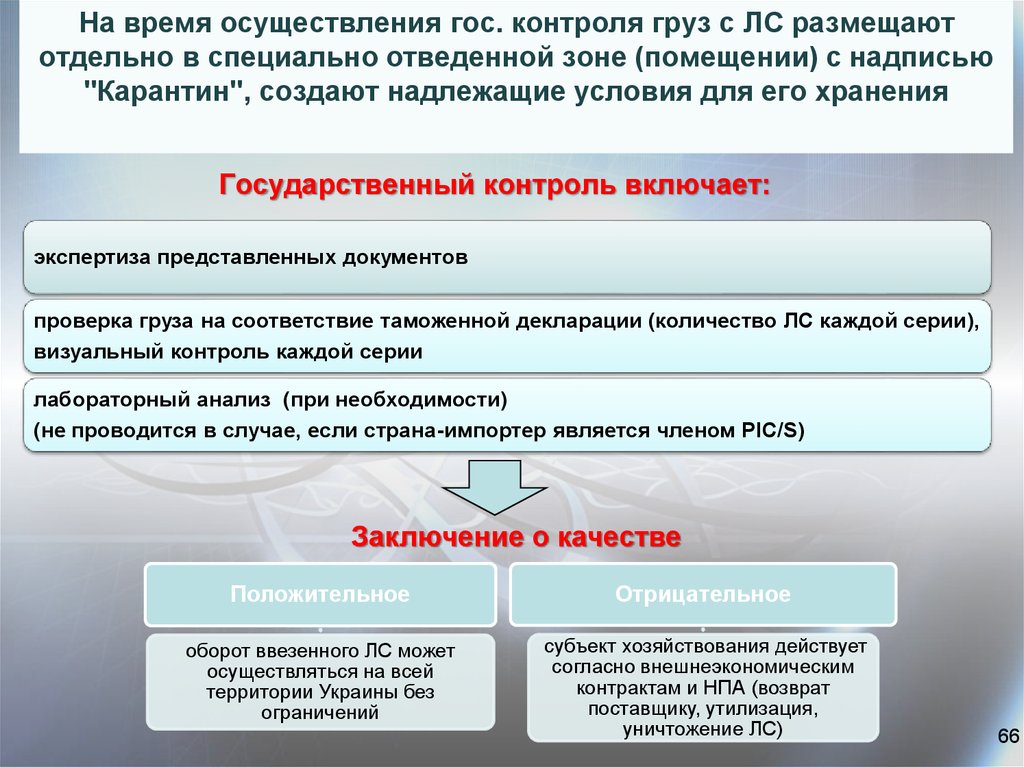
66. На время осуществления гос. контроля груз с ЛС размещают отдельно в специально отведенной зоне (помещении) с надписью "Карантин", создают на
На время осуществления гос. контроля груз с ЛС размещаютотдельно в специально отведенной зоне (помещении) с надписью
"Карантин", создают надлежащие условия для его хранения
Государственный контроль включает:
экспертиза представленных документов
проверка груза на соответствие таможенной декларации (количество ЛС каждой серии),
визуальный контроль каждой серии
лабораторный анализ (при необходимости)
(не проводится в случае, если страна-импортер является членом PІС/S)
Заключение о качестве
Положительное
Отрицательное
оборот ввезенного ЛС может
осуществляться на всей
территории Украины без
ограничений
субъект хозяйствования действует
согласно внешнеэкономическим
контрактам и НПА (возврат
поставщику, утилизация,
уничтожение ЛС)
66
67. Межведомственная база данных "Лекарственные средства, зарегистрированные в Украине"
Межведомственная база данных"Лекарственные средства,
зарегистрированные в Украине"
• содержит сведения о зарегистрированных в Украине ЛС,
• ведется МОЗ Украины (на основе данных Госреестра ЛС) в
электронном виде в режиме реального времени
• используется при ввозе ЛС на территорию Украины и
таможенном оформлении ЛС (отсутствие в базе данных
является основанием для отказа в перемещении через
таможенную границу Украины и в таможенном оформлении)
Согласно п. 197.1.27 ст. 197 Налогового кодекса Украины
освобождаются от налогообложения операции по
поставке ЛС, разрешенных для производства и
применения в Украине и внесенных в Госреестр ЛС, а
также ИМН по перечню, утвержденному КМУ
67
68. Проведение внутриаптечных видов контроля качества экстемпоральных ЛС (для самостоятельного изучения)
6869.
ТЕСТ №1Совокупность правил по розничной торговле ЛС, их хранению,
контролю качества, изготовлению в условиях аптеки, отпуска,
соблюдение которых обеспечит качество ЛС на этапах их
закупки, изготовления, хранения и розничной торговли –
это надлежащая практика.
А) GLP
Б) GСP
В) GMP
Г) GDP
Д) GPP*
69
70.
ТЕСТ № 2Кто отвечает за проведение входного контроля качества в
аптеке?
А) заведующий аптекой
Б) заместитель заведующего
В) уполномоченное лицо*
Г) бухгалтер
Д) провизор-аналитик
70
71.
ТЕСТ № 3Какой стаж трудовой деятельности должен быть у
уполномоченного лица, отвечающего за входной контроль
качества?
А) 5 лет и более
Б) 4 года и более
В) не менее 2 лет*
Г) не менее 3 лет
Д) не менее 1 года
71
























































 medicine
medicine








