Similar presentations:
Азотная кислота (1)
1.
Это вещество было описано арабским химиком вVIII веке Джабиром ибн Хайяном в его труде
«Ямщик мудрости», а с ХV века это вещество
добывалось для производственных целей
2.
Благодаря этому веществурусский учёный Василий
Фомич Петрушевский в
1866 году впервые
получил динамит.
Это вещество –
прародитель большинства
взрывчатых веществ
(например, тротила, или
тола).
3.
Это вещество является компонентомракетного топлива, его использовали
для двигателя первого в мире
советского реактивного
самолёта БИ – 1.
Это вещество в смеси с соляной
кислотой растворяет платину и
золото, признанное «царём»
металлов. Сама смесь, состоящая из
1-ого объёма этого вещества и 3-ёх
объёмов соляной кислоты,
называется «царской водкой».
Константин Федорович Циолковский
4.
Её величествоАзотная кислота
5.
Чистую азотную кислоту впервыеполучил Иоган Рудольф Глаубер,
действуя на селитру
концентрированной серной
кислотой
KNO3 + H2SO4(конц.) → KHSO4 + HNO3
Дальнейшей дистилляцией может
быть получена т.н. «дымящая
азотная кислота»
6.
В 1776 году АнтуанЛоран-Лавузье
доказал наличие
кислорода в кислоте
Жозеф Луи Гей-Люссак
Определил формулу
кислоты
7.
Строение азотной кислотыВ молекуле кислоты атом азота образует четыре
ковалентные связи: три из них — по обменному
механизму, а одну — по донорно-акцепторному
В соответствии с этим структурная формула молекулы
азотной кислоты имеет вид:
При этом атом азота имеет валентность IV, а степень
окисления +5
8.
Строение азотной кислотыОпытным путем доказано, что
двойная связь равномерно
распределена между двумя
атомами кислорода. Степень
окисления азота в азотной кислоте
равна +5, а валентность (обратите
внимание) равна четырем, ибо
имеются только четыре общие
электронные пары. Связь –
ковалентная полярная.
Кристаллическая решетка –
молекулярная
9.
Физические свойства кислотыЖидкость – бесцветная, дымящая на воздухе
t плавления -41,590С
t кипения + 82,690С
смешивается с водой во всех соотношениях
водные растворы HNO3 с массовой долей
0,95—0,98 называют «дымящей азотной
кислотой», с массовой долей 0,6—0,7 —
концентрированной азотной кислотой
10.
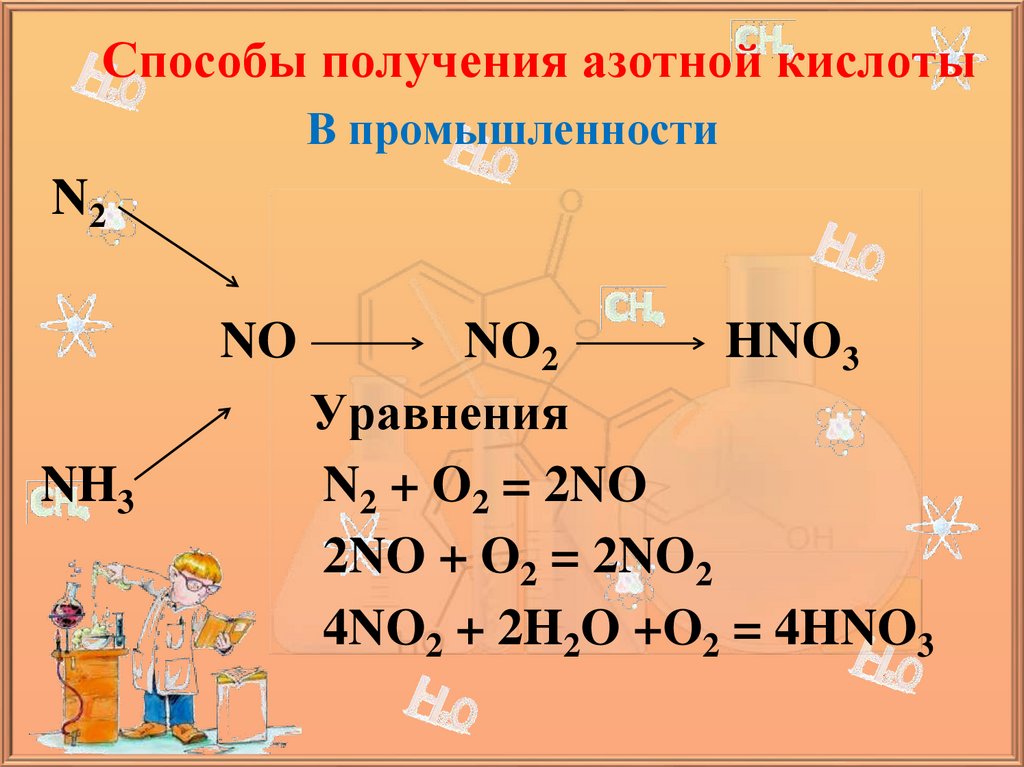
Способы получения азотной кислотыВ промышленности
N2
NO
NH3
NO2
HNO3
Уравнения
N2 + O2 = 2NO
2NO + O2 = 2NO2
4NO2 + 2H2O +O2 = 4HNO3
11.
Химические свойства азотной кислотыВысококонцентрированная HNO3 имеет бурую
окраску вследствие происходящего на свету
процесса разложения:
4HNO3 = 4NO2 +2H2O + O2
В растворе диссоциирует на ионы
HNO3
H+ + NO3-
12.
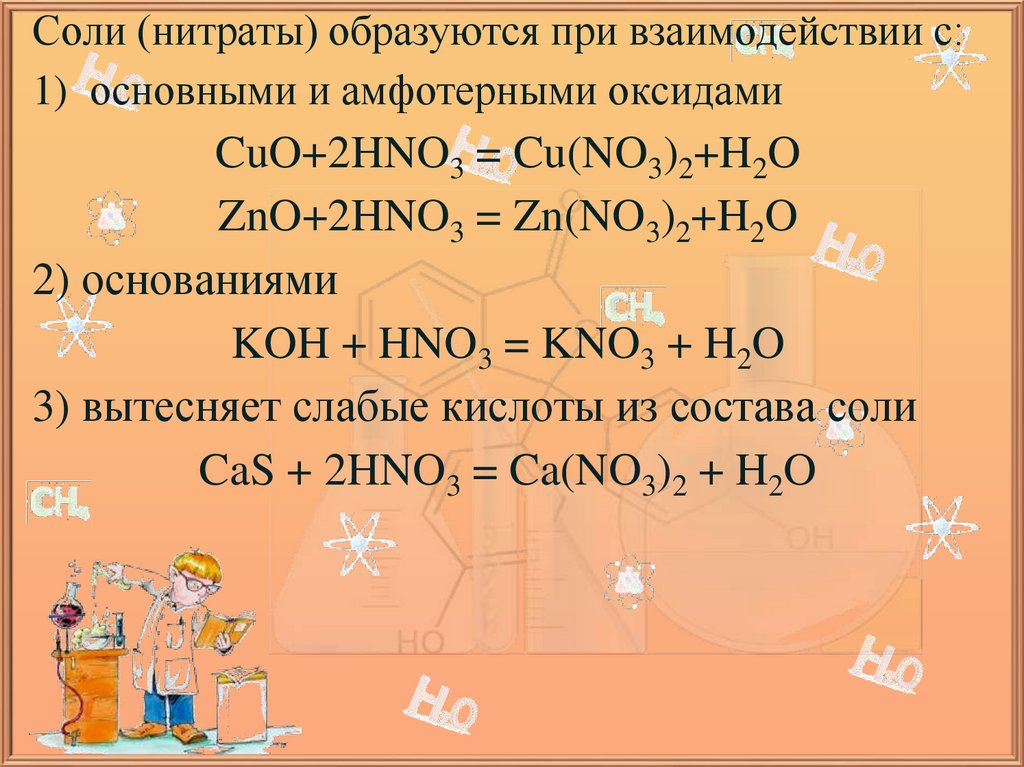
Соли (нитраты) образуются при взаимодействии с:1) основными и амфотерными оксидами
CuO+2HNO3 = Cu(NO3)2+H2O
ZnO+2HNO3 = Zn(NO3)2+H2O
2) основаниями
KOH + HNO3 = KNO3 + H2O
3) вытесняет слабые кислоты из состава соли
CaS + 2HNO3 = Ca(NO3)2 + H2O
13.
Азотная кислота в любой концентрациипроявляет свойства кислоты-окислителя,
при этом азот восстанавливается от
степени окисления +5 до −3. Глубина
восстановления зависит в первую очередь
от природы восстановителя и от
концентрации азотной кислоты. HNO3 окислитель
14.
Она окисляет металлы, расположенные в рядуактивности как до водорода, так и после водорода,
кроме золота и платины. Так, при
взаимодействии концентрированной азотной
кислоты с медью и другими малоактивными
металлами (Ag, Hg и др.) продуктом восстановления
является оксид азота(IV) — бурый газ:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
а в разбавленной азотной кислоте — оксид
азота(II):
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
15.
Состав образующихся продуктов зависит как отконцентрации азотной кислоты, так и от активности
металла. При этом чем ниже концентрация азотной
кислоты и выше активность металла, тем сильнее
восстанавливается азот.
увеличение концентрации кислоты
NO2,NO,N2O,N2,NH4NO3
увеличение активности металла
16.
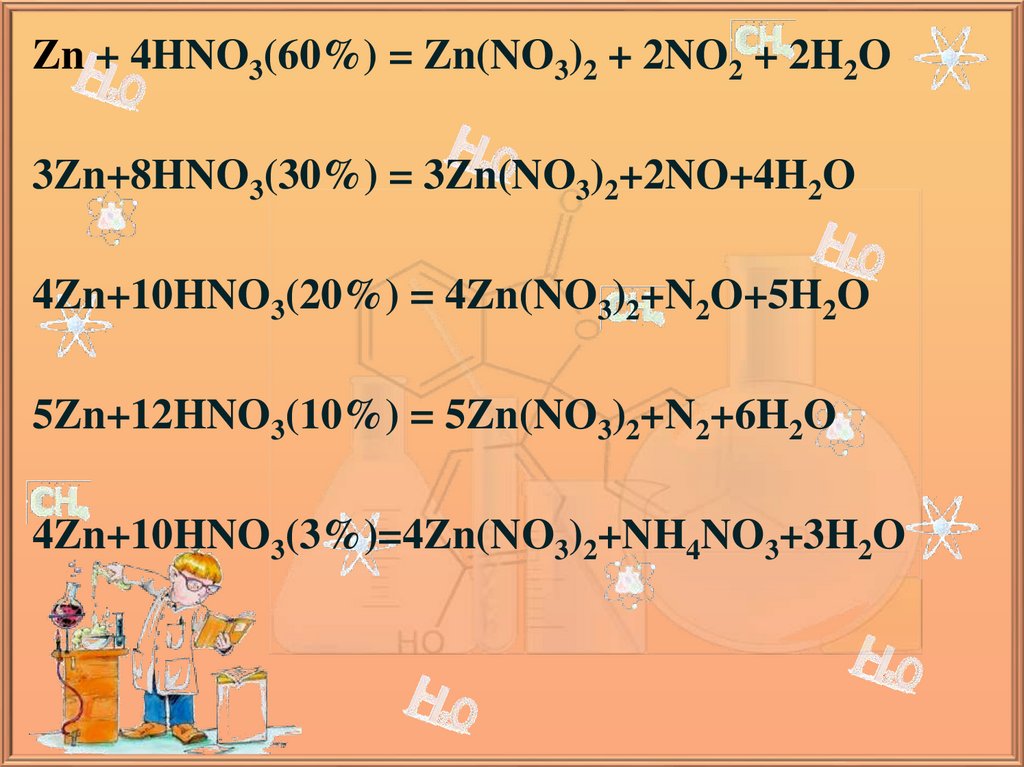
Zn + 4HNO3(60%) = Zn(NO3)2 + 2NO2 + 2H2O3Zn+8HNO3(30%) = 3Zn(NO3)2+2NO+4H2O
4Zn+10HNO3(20%) = 4Zn(NO3)2+N2O+5H2O
5Zn+12HNO3(10%) = 5Zn(NO3)2+N2+6H2O
4Zn+10HNO3(3%)=4Zn(NO3)2+NH4NO3+3H2O
17.
С золотом и платиной азотнаякислота, даже концентрированная, не
взаимодействует.
Железо, алюминий, хром холодной
концентрированной азотной кислотой
пассивируются.
18.
С разбавленной азотной кислотой железовзаимодействует, причём в зависимости от
концентрации кислоты образуются не только
различные продукты восстановления азота, но и
различные продукты окисления железа:
Fe + 4 HNO3(25%) = Fe(NO3)3 + NO + 2H2O
4Fe+10HNO3(2%)=4Fe(NO3)2+NH4NO3+3H2O
19.
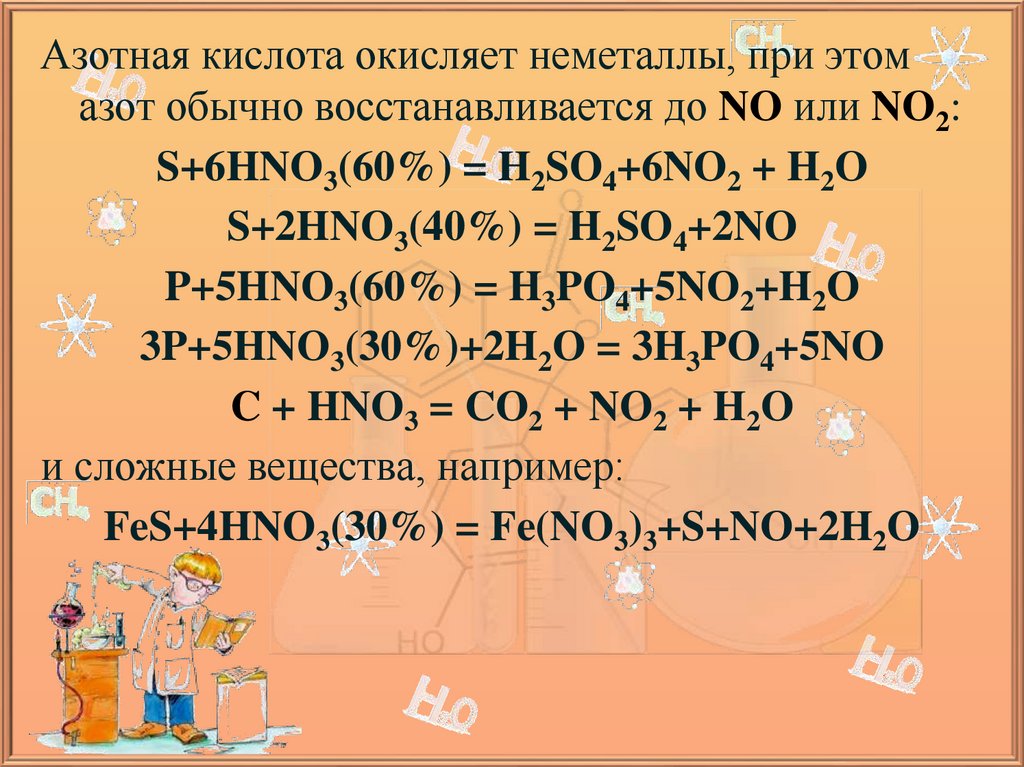
Азотная кислота окисляет неметаллы, при этомазот обычно восстанавливается до NO или NO2:
S+6HNO3(60%) = H2SO4+6NO2 + H2O
S+2HNO3(40%) = H2SO4+2NO
P+5HNO3(60%) = H3PO4+5NO2+H2O
3P+5HNO3(30%)+2H2O = 3H3PO4+5NO
C + HNO3 = CO2 + NO2 + H2O
и сложные вещества, например:
FeS+4HNO3(30%) = Fe(NO3)3+S+NO+2H2O















 chemistry
chemistry








