Similar presentations:
Азотная кислота
1.
Тема урока:«Азотная кислота»
1
2. I. Строение молекулы
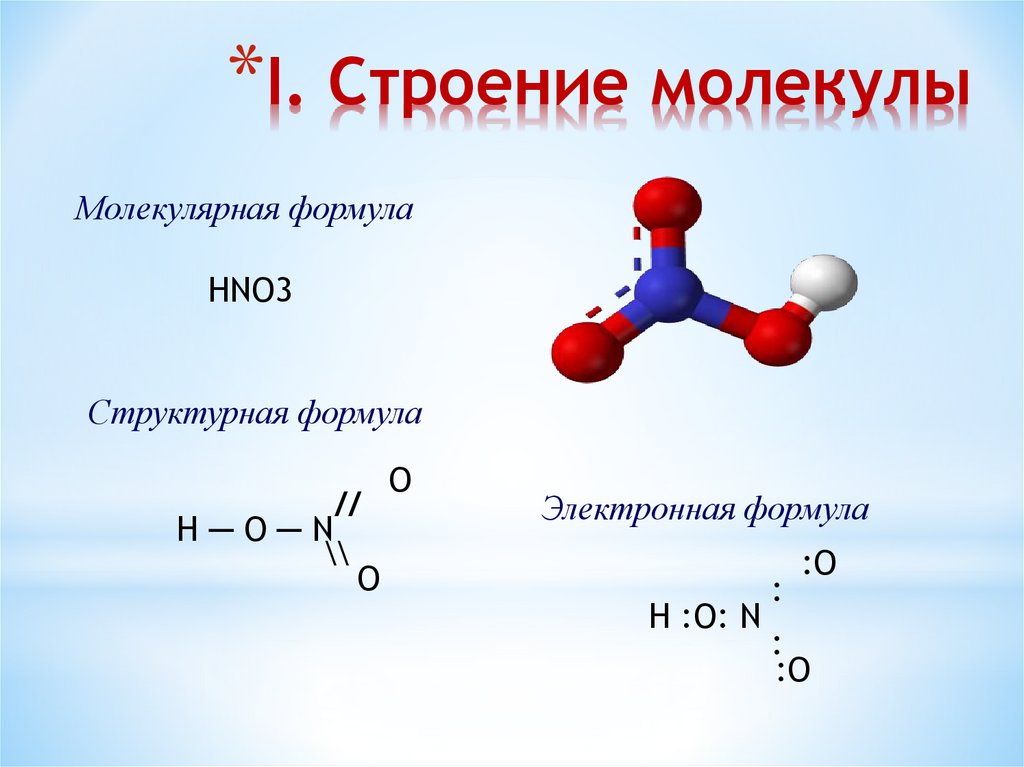
*I. Строение молекулыМолекулярная формула
HNO3
Структурная формула
//
H─O─N
\\
O
O
Электронная формула
H :O: N
:
:O
:
:O
3.
II. Характеристика кислотыПо основности:
одноосновная
По содержанию «О»:
кислородсодержащая
По растворимости в воде:
растворимая
По стабильности:
нестабильная
По летучести:
летучая
По степени диссоциации:
сильная
4. Физические свойства:
* Физические свойства:Ж., едкий з., ρ = 1,51 г/см3, tпл = - 420С, tкип = 860С
НNO3 (конц., дымящая)
ω = 1, желтая
Растворяется в воде
НNO3 (разб., недымящая)
ω = 0,6 бесцветная
HNO3 ---на свету-------> 4NO2 ↑+ O2 ↑ + 2H2O
«Дымит», так как пары ее образуют с влагой воздуха
мелкие капельки тумана
Правила обращения с концентрированной азотной
кислотой
Работать в резиновых перчатках!
Берегись ожога!
При попадании кислоты на кожу место поражения быстро
промыть большим количеством воды!
На коже образует желтое пятно (реакция на белок
5.
Химические свойства:I. Общие с другими кислотами
1. Диссоциация_Сильный электролит, изменяет окраску
индикаторов
НNO3 H+ + NO3НNO3 + лакмус фиолетовый = красный
НNO3 + метиловый оранжевый = розовый
5
6.
2. С основными оксидамиCuO + 2HNO3 = Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3- = Cu2++ 2NO3-+ H2O
CuO + 2H+ = Cu2+ + H2O
6
7.
3.С основаниями (нерастворимыми):Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Cu(OH)2 + 2H++ 2NO 3- = Cu2+ + 2NO3+ 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
7
8.
4. С растворимыми основаниямиNaOH + HNO3 = NaNO3+ H2O
Na+ + OH - + H+ + NO 3- = Na+ + NO3- + H2O
OH - + H+ = H2O
9.
C солями (более слабых кислот):Na2CO3 + 2HNO3 = 2NaNO3 + CO2+ H2O
2Na+ + CO32 - + 2H+ + 2NO3- = 2Na ++ 2NO3+ CO2 ↑ + H2O
CO32- + 2H+ = CO2 ↑ + H2O
9
10.
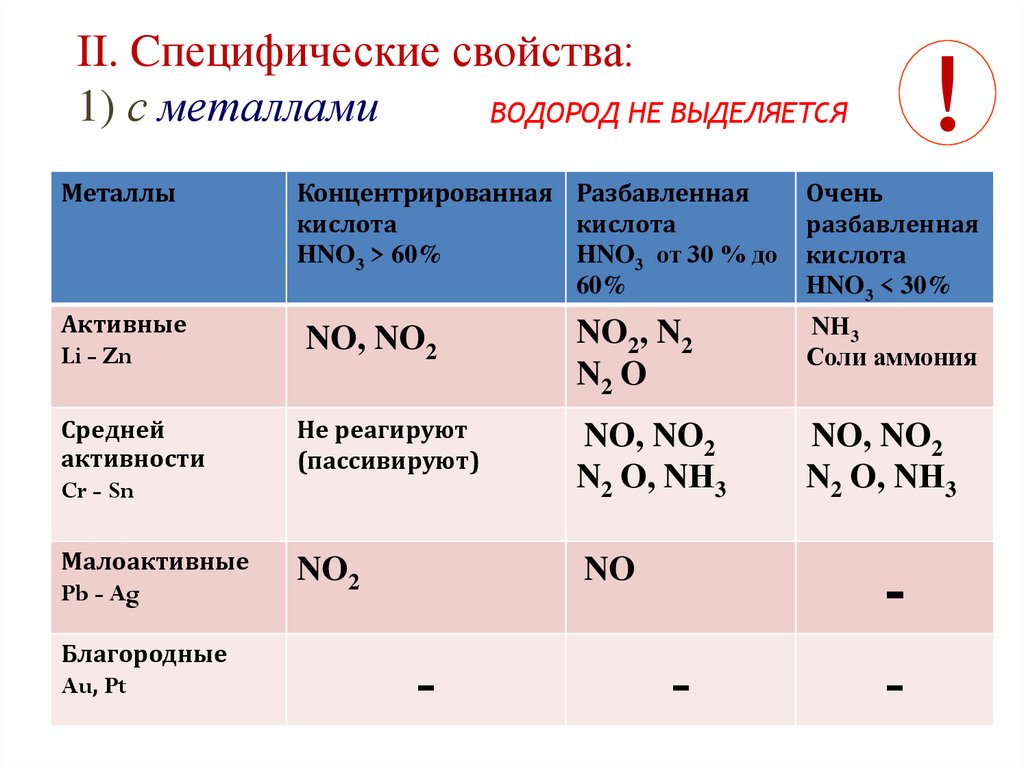
II. Cпецифические свойства:1) с металлами
ВОДОРОД НЕ ВЫДЕЛЯЕТСЯ
Металлы
Активные
Li - Zn
Концентрированная Разбавленная
кислота
кислота
HNO3 > 60%
HNO3 от 30 % до
60%
!
Очень
разбавленная
кислота
HNO3 < 30%
NO, NO2
NO2, N2
N2 O
NН3
Соли аммония
Средней
активности
Cr - Sn
Не реагируют
(пассивируют)
NO, NO2
N2 O, NН3
NO, NO2
N2 O, NН3
Малоактивные
Pb - Ag
NO2
NO
Благородные
Au, Pt
-
-
-
11.
Схема уравненияМе +HNO3 = соль + вода + оксиды азота
(нитрат Ме)
(аммиак, соли аммония)
Cu + HNO3 (конц) = Cu(NO3)2 + NO2 ↑ + 2H2O
Cu + 4HNO3 (конц) = Cu(NO3)2 + 2 NO2 ↑ + 2H2O
Zn + HNO3(разб) = Zn(NO3)2 + NH4NO3 + H2O
4Zn + 10HNO3(разб) = 4Zn(NO3)2 + NH4NO3 + 3H2O
4Zn + 10HNO3 (разбавл.)= 4Zn(NO3)2 + N2O + 5H2O
Ag + 2HNO3 (конц.)= AgNO3 + NO2 + H2O
12.
2)при нагревании и под действием светаразлагается
4HNO3 = 4 NO2 + 2 H2O + O2.
13.
Азотная кислота – сильный окислитель,реагирует с простыми веществами:
2HNO3(конц.) + S -> H2SO4 + 2NO↑
5HNO3 + 3P + 2H2O -> 3H3PO4 + 5NO↑
14.
ГЛАУБЕР Иоганн Рудольф (1604-1670),немецкий химик и врач. Получил
чистую азотную кислоту в 1650 году.
Получение
Действием конц. серной
кислоты на нитрат натрия
(Лаборатория)
NaNO3 + H2SO4 = NaHSO4 + HNO3
?
(Промышленность)
?
Завод азотной кислоты
14
15.
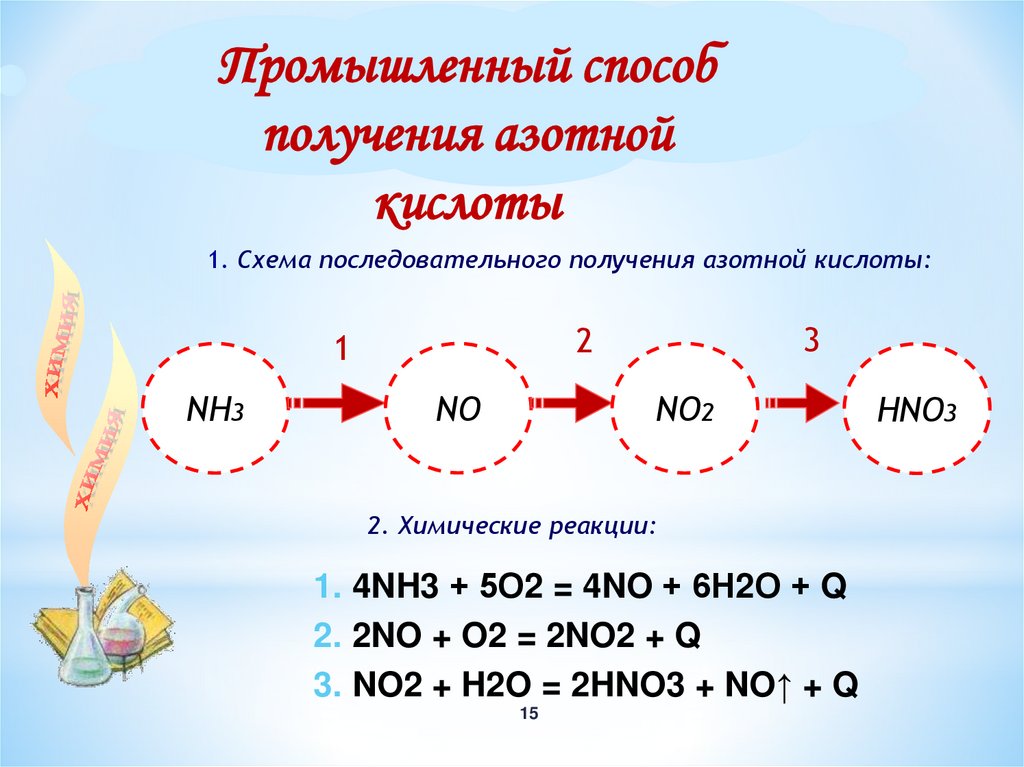
Промышленный способполучения азотной
кислоты
1. Схема последовательного получения азотной кислоты:
NH3
3
2
1
NО
NО2
2. Химические реакции:
1. 4NH3 + 5О2 = 4NO + 6Н2О + Q
2. 2NO + O2 = 2NO2 + Q
3. NO2 + H2O = 2HNO3 + NO↑ + Q
15
НNО3
16.
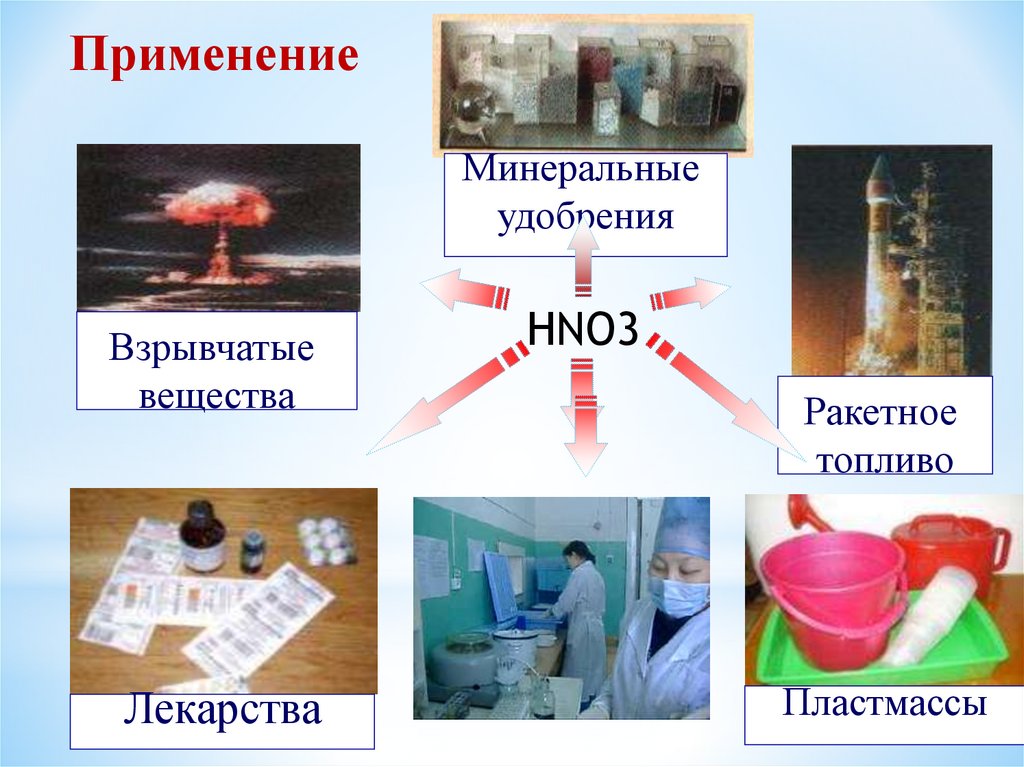
ПрименениеМинеральные
удобрения
Взрывчатые
вещества
Лекарства
HNO3
Ракетное
топливо
16
Пластмассы
17.
Согласны ли вы соследующими утверждениями:
1. Азотная кислота является сильным окислителем.
2. Азотная кислота взаимодействует только с
растворимыми основаниями.
3. Азотная кислота разлагается на свету.
4. Соли азотной кислоты называются нитритами.
5. Азотная кислота взаимодействует только с металлами
стоящими в ряду активности до водорода.
6. Азотная кислота пассивирует алюминий.
7. Азотную кислоту в промышленности получают из
аммиака.
8. При взаимодействии азотной кислоты с металлами
водород не выделяется.
18.
ПРОВЕРЬ СЕБЯ !1. Да
2. Нет
3. Да
4. Нет
5. Нет
6. Да
7. Да
8. Да
18
19.
Домашнее задание§25 Презентация
Пособие стр.79
Вар.1
19















 chemistry
chemistry








