Similar presentations:
Азотная кислота. Строение молекулы
1.
Угадай – те, темуурока!
Это какое «особенное» вещество?
Это кислородсодержащее соединение
№7 элемента с порядковым номером 7.
Это «дымящая» с резким раздражающим
запахом жидкость.
Это вещество – враг металлов.
Это «царица» всех …
1
2.
Тема урока:«Азотная кислота»
2
3.
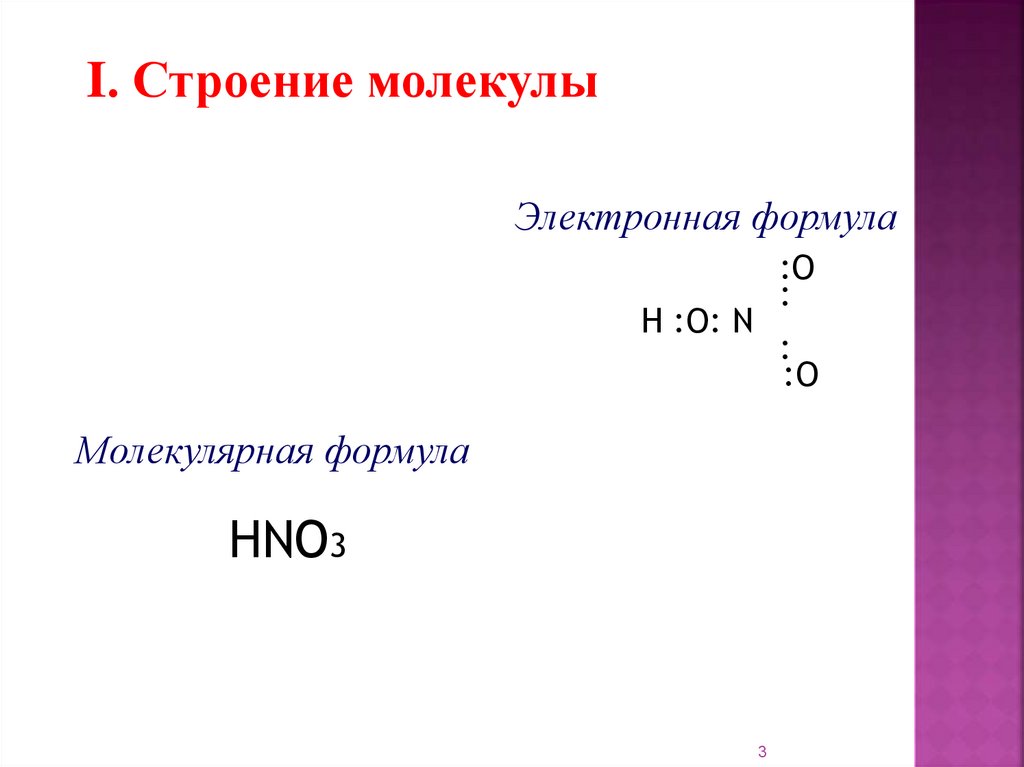
I. Строение молекулыЭлектронная формула
:O
:
H :O: N
:
:O
Молекулярная формула
HNO3
3
4.
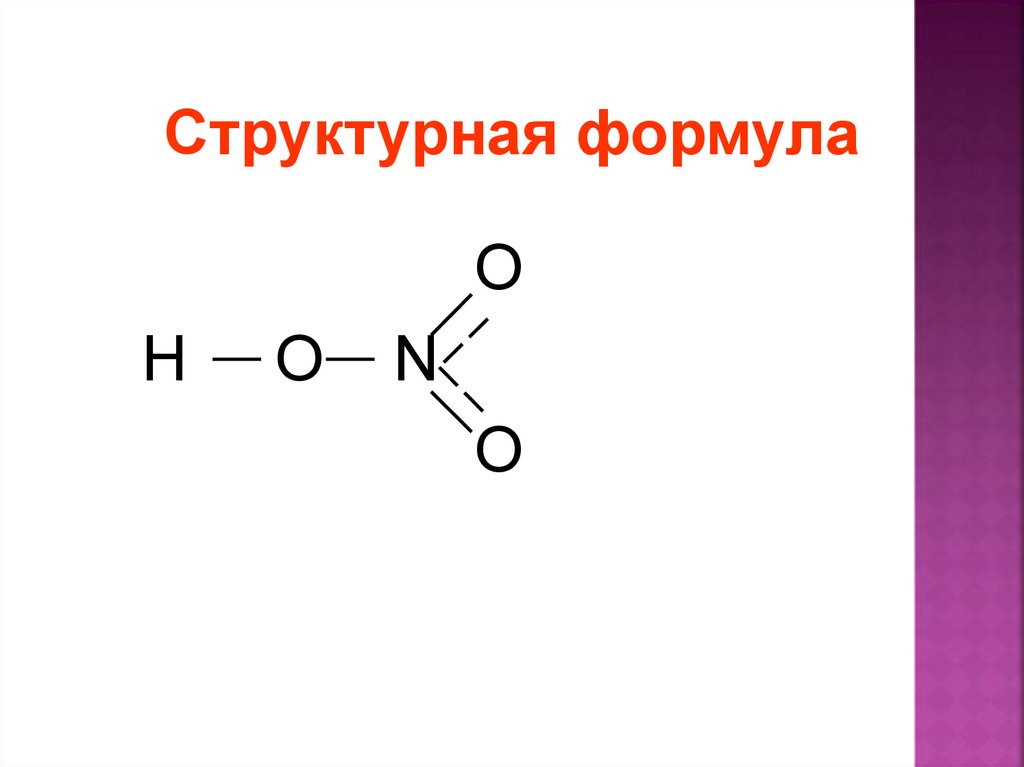
Структурная формулаO
H
O
N
O
5.
II. Характеристика кислотыПо основности:
одноосновная
По содержанию «О»:
кислородсодержащая
По растворимости в воде:
растворимая
По стабильности:
нестабильная
По летучести:
летучая
По степени диссоциации:
сильная
6.
III. Физические свойстваЖ., з., ρ = 1,51 г/см3, tпл = - 420С, tкип =
860С
«Дымит»,
так
НNO3 (конц., дымящая)
как
пары
ее
образуют с влагой
ω = 1, желтая
НNO3 (разб., недымящая)
ω = 0,6 бесцветная
свет
HNO3 ---------->
воздуха
мелкие
капельки тумана
4NO2 ↑+ O2 ↑ + 2H2O
Правила обращения с концентрированной азотной
кислотой
Работать в резиновых перчатках!
Берегись ожога!
При попадании кислоты на кожу место поражения
быстро промыть большим количеством воды!
6
!
7.
III. Химическиесвойства
«Азотная кислота по
характеру среди своих
подруг - самая сильная и
уверенная в себе . Внешне это
не проявляется»
I. Общие с другими кислотами
II. Специфические свойства
7
8.
I. Общие с другими кислотамиНNO3 H+ + NO3НNO3 + лакмус фиолетовый =
НNO3 + метиловый оранжевый =
8
9.
С основными оксидамиCuO + 2HNO3 = Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3- = Cu2++ 2NO3-+ H2O
CuO + 2H+ = Cu2+ + H2O
9
10.
С основаниями (нерастворимыми):Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Cu(OH)2 + 2H++ 2NO 3- = Cu2+ + 2NO3+ 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
10
11.
С растворимыми основаниямиNaOH + HNO3 = NaNO3+ H2O
Na+ + OH - + H+ + NO 3- = Na+ + NO3- + H2O
OH - + H+ = H2O
12.
C солями (более слабых кислот):Na2CO3 + 2HNO3 = 2NaNO3 + CO2+ H2O
2Na+ + CO32 - + 2H+ + 2NO3- = 2Na ++ 2NO3+ CO2 ↑ + H2O
CO32- + 2H+ = CO2 ↑ + H2O
12
13.
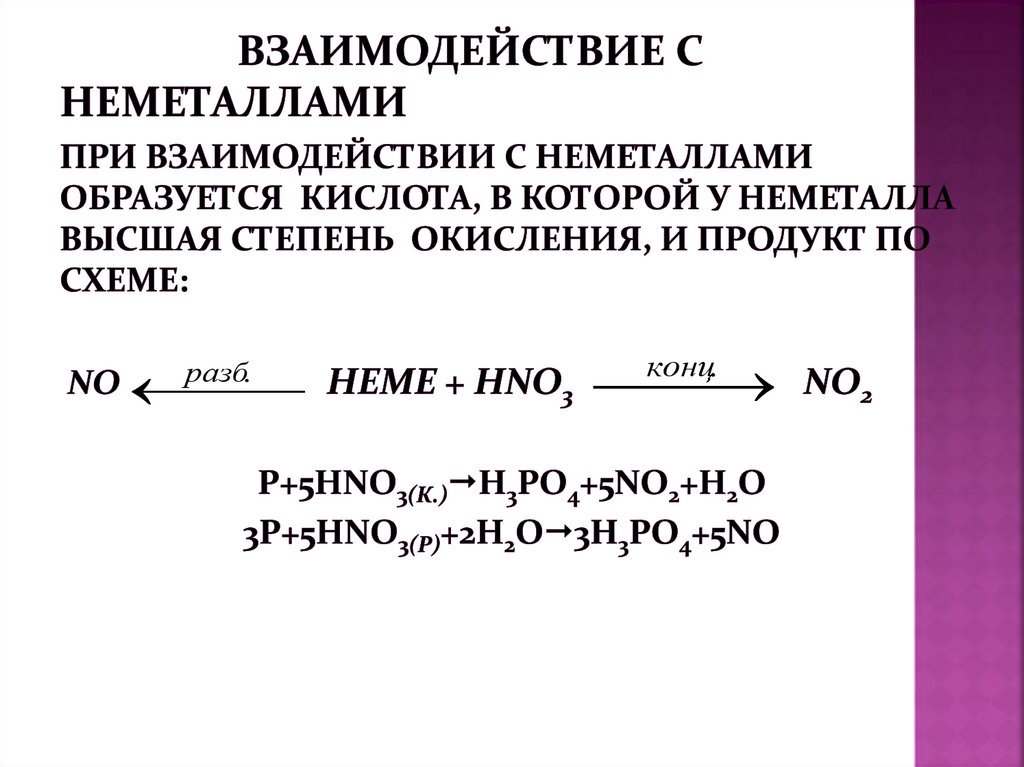
II. Cпецифические: с металламиВОДОРОД НЕ ВЫДЕЛЯЕТСЯ
Металлы
!
Концентрированная
кислота
HNO3 > 60%
Разбавленная
кислота
HNO3 от 30 % до
60%
Очень
разбавленная
кислота
HNO3 < 30%
NO, NO2
NO2, N2
N2 O
NН4NO3
Соли аммония
Средней
активности
Cr - Sn
Не реагируют
(пассивируют)
NO, NO2
N2 O, NН3
NO, NO2
N2 O,
NН4NO3
Малоактивные
Pb - Ag
NO2
NO
Активные
Li - Zn
Благородные
Au, Pt
-
-
-
14.
Схема уравненияМе +HNO3 = соль + вода + оксиды азота
(нитрат Ме)
(аммиак,
соли аммония)
Cu + 4HNO3 (конц) = Cu(NO3)2 + 2NO2 ↑ + 2H2O
3Cu + 8HNO3 (разб) = 3Cu(NO3)2 + 2NO ↑ + 4H2O
Zn + 4HNO3(конц) = Zn(NO3)2 + 2NO ↑ + 2H2O
5Zn + 12HNO3(разб) = 5Zn(NO3)2 + N2 ↑ + 6H2O
15.
разб.конц.
16.
4HNO3 = 4 NO2 + 2 H2O + O2.17.
ГЛАУБЕР Иоганн Рудольф (1604-1670),немецкий химик и врач. Получил
чистую азотную кислоту в 1650 году.
Получение
Действием конц. серной
кислоты на нитрат натрия
(Лаборатория)
?
(Промышленность)
NaNO3(тв.) + H2SO4(к) = NaHSO4 + HNO3
?
Завод азотной кислоты
17
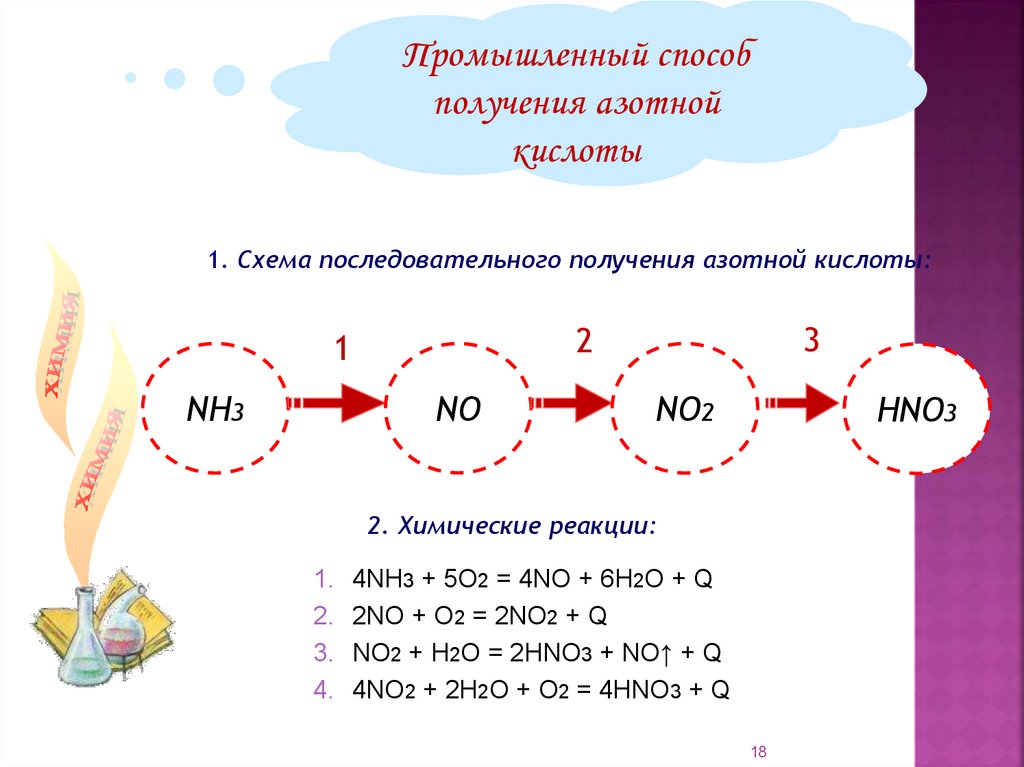
18.
Промышленный способполучения азотной
кислоты
1. Схема последовательного получения азотной кислоты:
NH3
3
2
1
NО
NО2
НNО3
2. Химические реакции:
1. 4NH3 + 5О2 = 4NO + 6Н2О + Q
2. 2NO + O2 = 2NO2 + Q
3. NO2 + H2O = 2HNO3 + NO↑ + Q
4. 4NO2 + 2H2O + O2 = 4HNO3 + Q
18
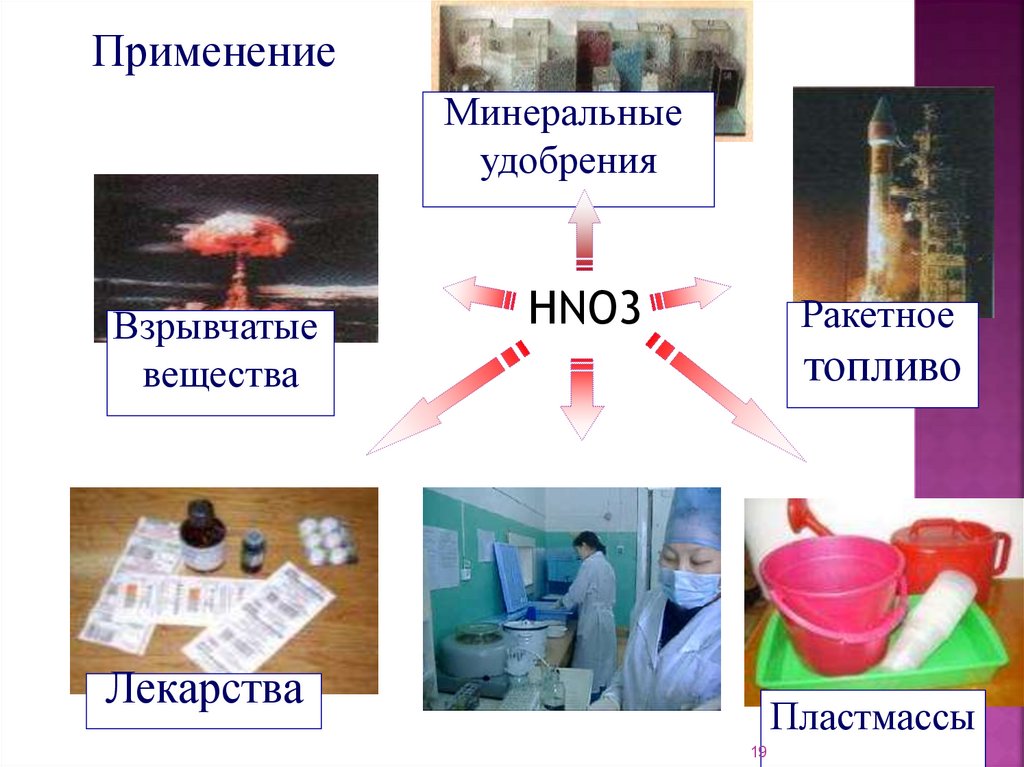
19.
ПрименениеМинеральные
удобрения
Взрывчатые
вещества
HNO3
Ракетное
топливо
Лекарства
Пластмассы
19
20.
Домашнее задание§31
Конспект с РИО по свойствам HNO3 общим с
кислотами
Упр.4-5 стр.225
Поиск информации о солях азотной кислоты в
сети Интернет(отношение к нагреванию)
20












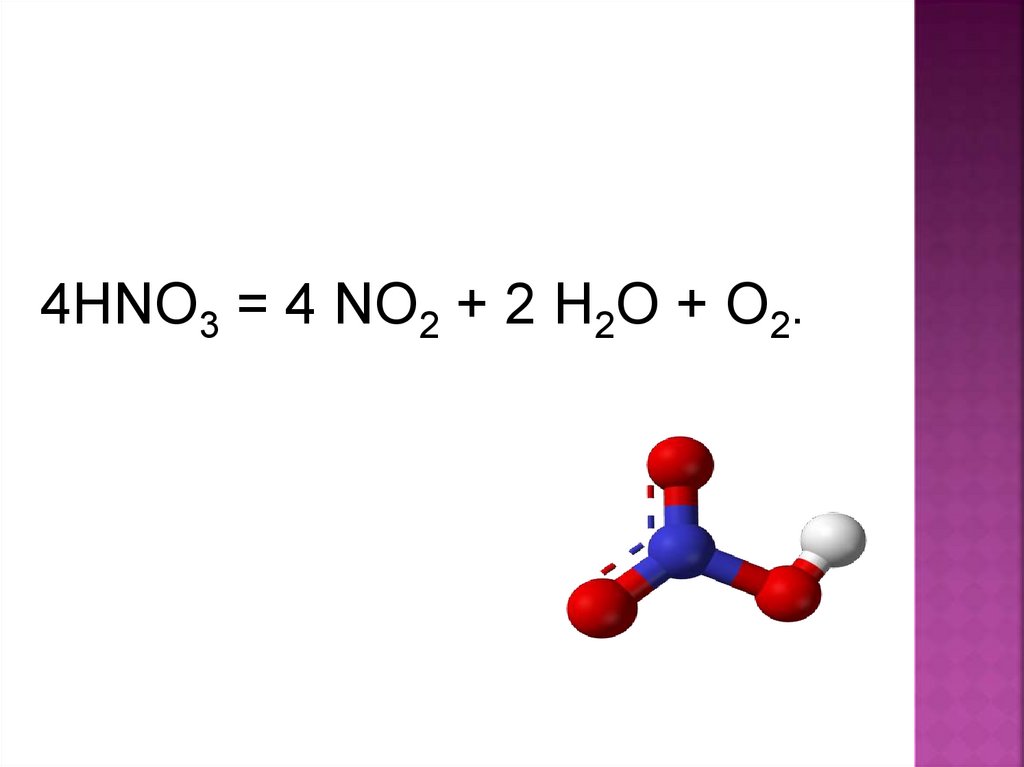


 chemistry
chemistry








