Similar presentations:
Азотная кислота. Соли азотной кислоты. Получение и применение (9 класс)
1.
V. Домашнее задание.§26.
Составить уравнения реакций, с помощью которых можно
осуществить превращения:
N2 NH3 (NH4)3РO4 NH4Cl NH4NO3
Составьте полное и краткое ионные уравнения для
превращений 3 и 4.
Для превращения 1 (окислительно–восстановительная
реакция)
расставьте
коэффициенты
методом
электронного баланса.
2.
Азотная кислота.Соли азотной кислоты.
Получение и применение
азотной кислоты
3.
Историческая справкаВпервые азотную кислоту получили
алхимики, нагревая смесь селитры и
железного купороса:
4KNO3 + 2(FeSO4 · 7H2O) (t°) → Fe2O3 +
2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O
Чистую азотную кислоту получил
впервые Иоганн Рудольф Глаубер,
действуя на селитру концентрированной
серной кислотой:
KNO3 + H2SO4(конц.) (t°) → KHSO4 +
HNO3↑
Дальнейшей дистилляцией может быть
получена так называемая «дымящая
азотная кислота», практически не
содержащая воды
4.
Характеристика HNO35.
Азотная кислота-
Формула: HNO3
Структурная формула:
Валентность азота: IV
Степень окисления: +5
6.
Физические свойства1. Бесцветная
2. Дымящая на воздухе жидкость
3. С резким запахом
4. Кипит при 83°
5. При попадании на кожу-сильный ожог с
желтым пятном
6. С H2O смешивается в любых соотношениях
7. Желтеет на свету: 4HNO3→2H2O+4NO2+O2↑
8. В лабораториях 63% и p=1,4г/см3
7.
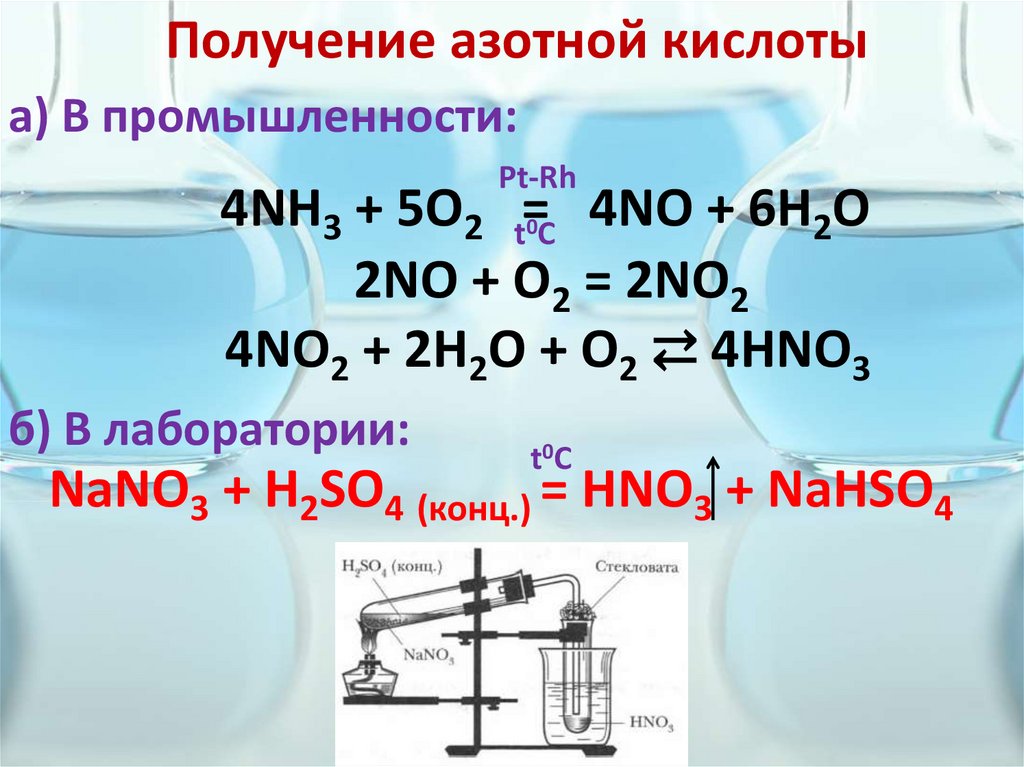
Получение азотной кислотыа) В промышленности:
Pt-Rh
4NH3 + 5O2 t=C 4NO + 6H2O
2NO + O2 = 2NO2
4NO2 + 2H2O + O2 ⇄ 4HNO3
0
б) В лаборатории:
t0C
NaNO3 + H2SO4 (конц.) = HNO3 + NaHSO4
8.
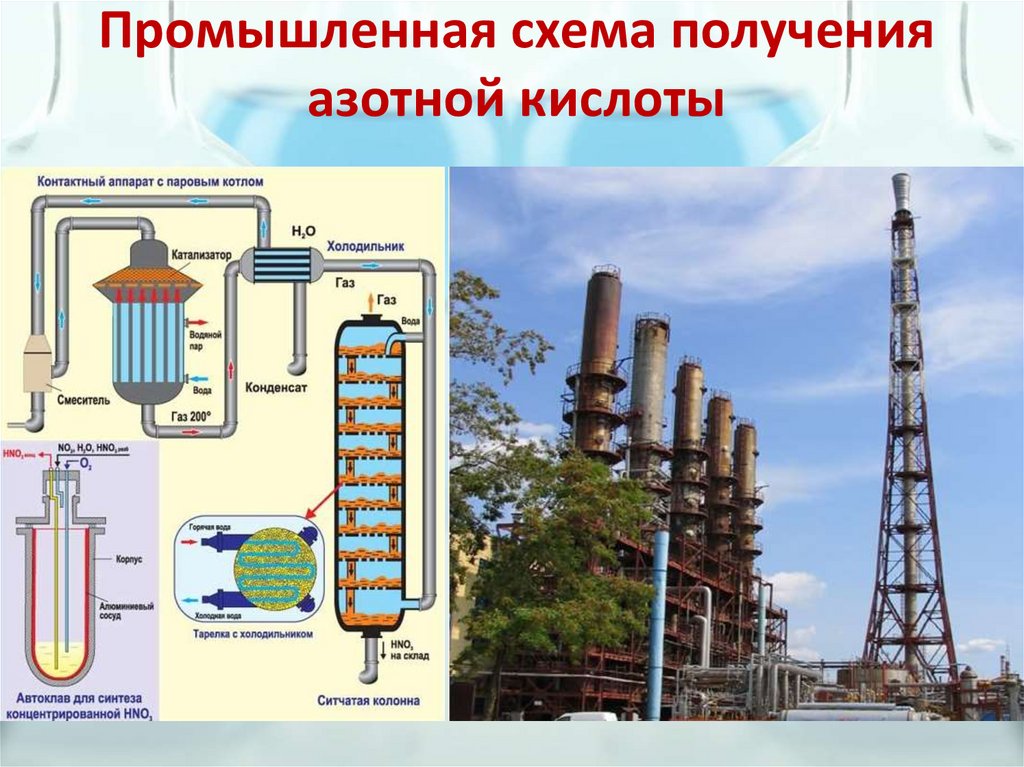
Промышленная схема полученияазотной кислоты
9.
Химические свойства азотной кислоты1. Общие свойства кислот (раствор):
1) HNO3 → H+ + NO32) CuO + 2HNO3 = Cu(NO3)2 + H2O
3) KOH + HNO3 = KNO3 + H2O
4) 2HNO3 + Na2CO3 = CO2 + 2NaNO3 + H2O
2HNO3 + Na2SiO3 = H2SiO3 + 2NaNO3
10.
2. Сильный окислитель4HNO3 (разб.) + 3Ag = 3AgNO3 + NO + 2H2O
4HNO3 (конц.) + C = CO2 + 4NO2 +2H2O
6HNO3 (конц.) + S = H2SO4 + 6NO2 +2H2O
5HNO3 (конц.) + P = H3PO4 + 5NO2 +H2O
H2S + 8HNO3 = H2SO4 + 8NO2 + 4H2O
FeS + 12HNO3 = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O
6HI + 2HNO3 = 3I2 + 2NO + 4H2O
11.
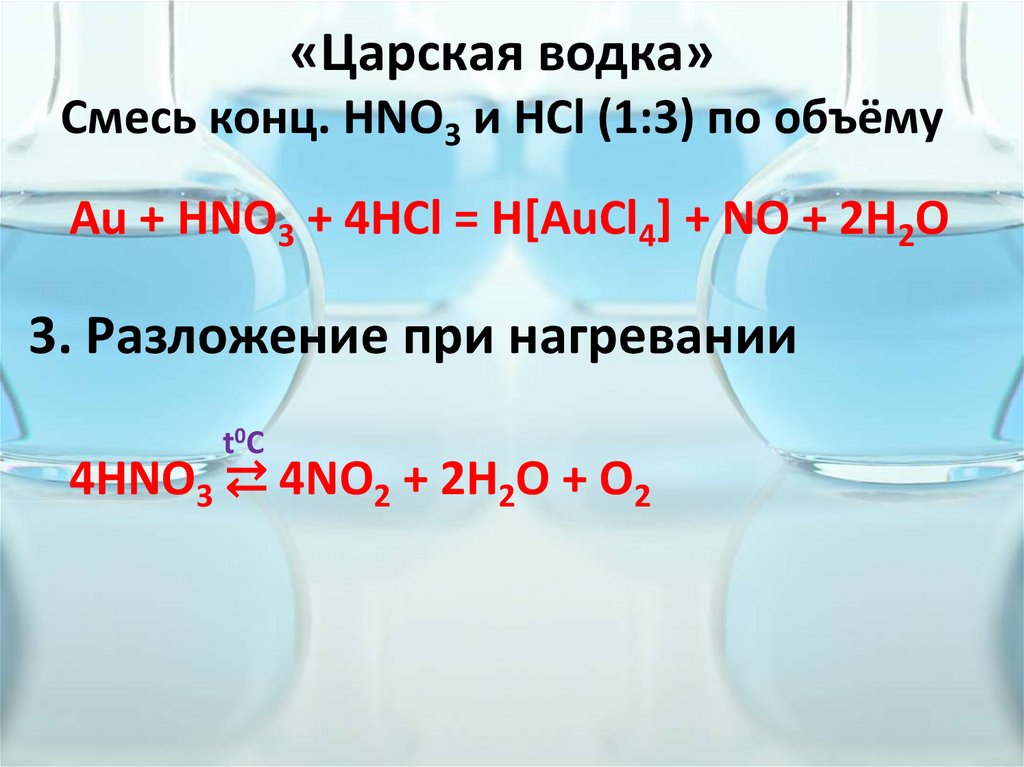
«Царская водка»Смесь конц. HNO3 и HCl (1:3) по объёму
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
3. Разложение при нагревании
t0C
4HNO3 ⇄ 4NO2 + 2H2O + O2
12.
4. Взаимодействие металлов с HNO31. Практически никогда не выделяется Н2!!!
2. При нагревании взаимодействуют все
металлы, кроме Pt, Au.
3. HNO3 (конц.) пассивирует Al, Fe, Be, Cr, Mn (tкомн.).
4. Восстанавливается N (продукт зависит от
концентрации кислоты и активности металла).
Hg + 4HNO3 (конц.) = Hg(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO + 4H2O
5Zn + 12HNO3 (разб.) = 5Zn(NO3)2 + N2 + 6H2O
8Al + 30HNO3 (оч. разб.) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
8Na + 10HNO3 (конц.) = 8NaNO3 + N2O + 5H2O
13.
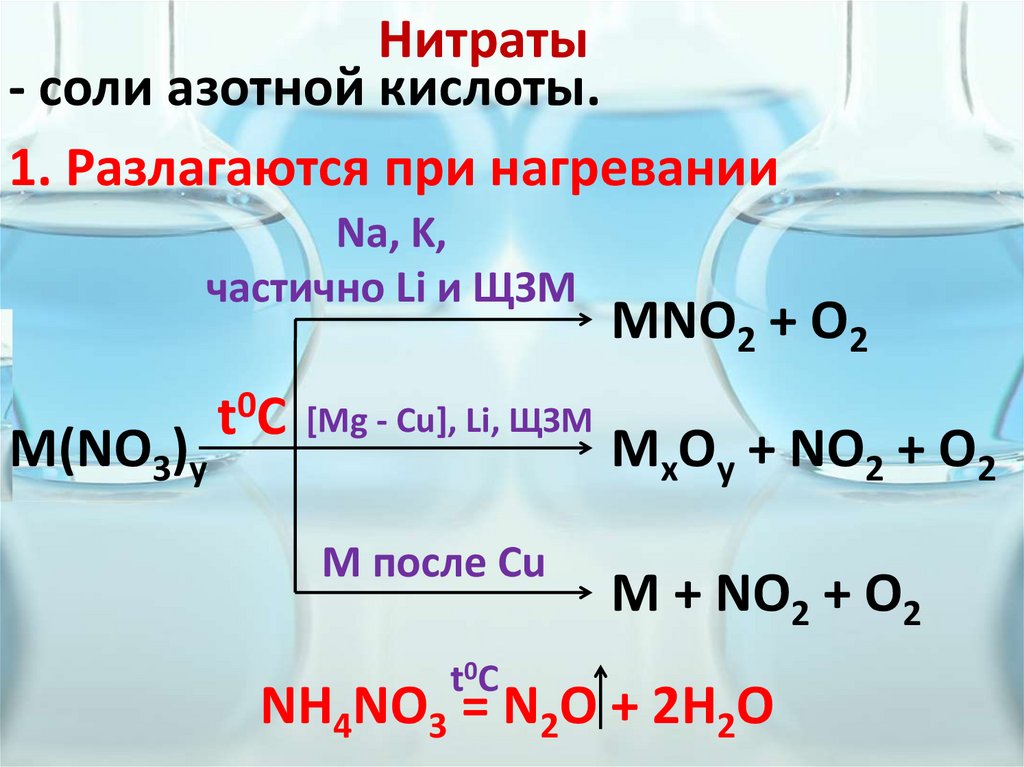
Нитраты- соли азотной кислоты.
1. Разлагаются при нагревании
Na, K,
частично Li и ЩЗМ
M(NO3)y
t0C [Mg - Cu], Li, ЩЗМ
М после Сu
t0C
MNO2 + O2
MxOy + NO2 + O2
M + NO2 + O2
NH4NO3 = N2O + 2H2O
14.
15.
Качественная реакция на нитраты• NaNO3+H2SO4(конц)→NaHSO4+HNO3
• Cu +4HNO3(конц) → Cu(NO3)2 +2NO2↑ +2H2O
16.
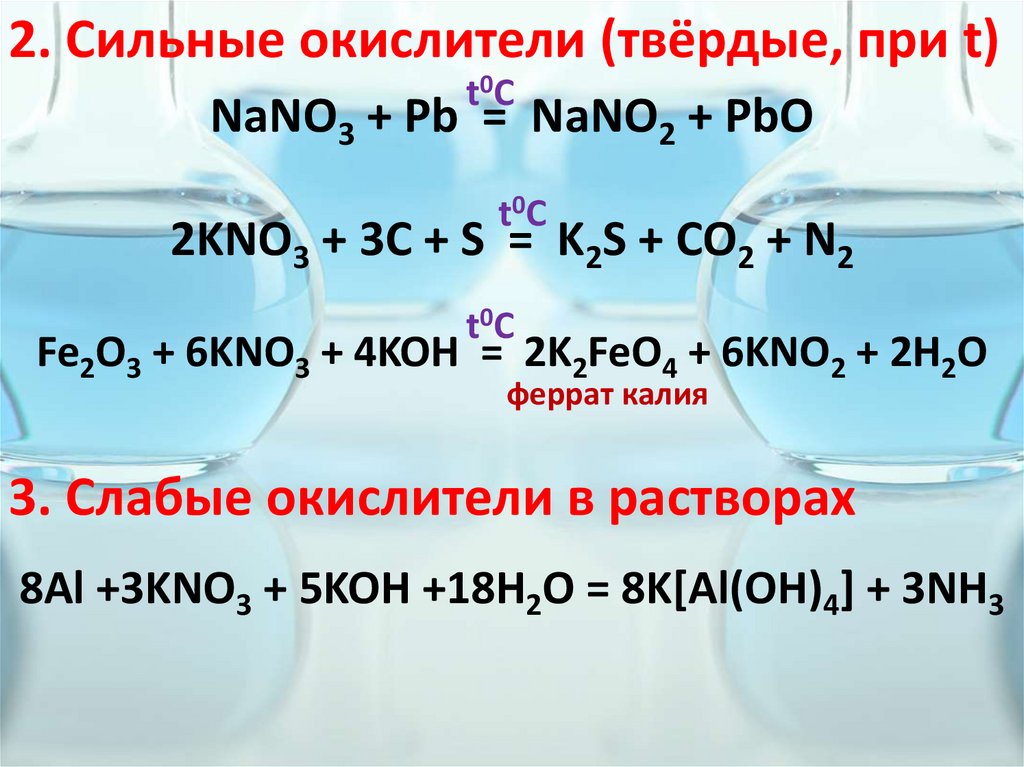
2. Сильные окислители (твёрдые, при t)t0C
NaNO3 + Pb = NaNO2 + PbO
t0C
2KNO3 + 3C + S = K2S + CO2 + N2
t0C
Fe2O3 + 6KNO3 + 4KOH = 2K2FeO4 + 6KNO2 + 2H2O
феррат калия
3. Слабые окислители в растворах
8Al +3KNO3 + 5KOH +18H2O = 8K[Al(OH)4] + 3NH3
17.
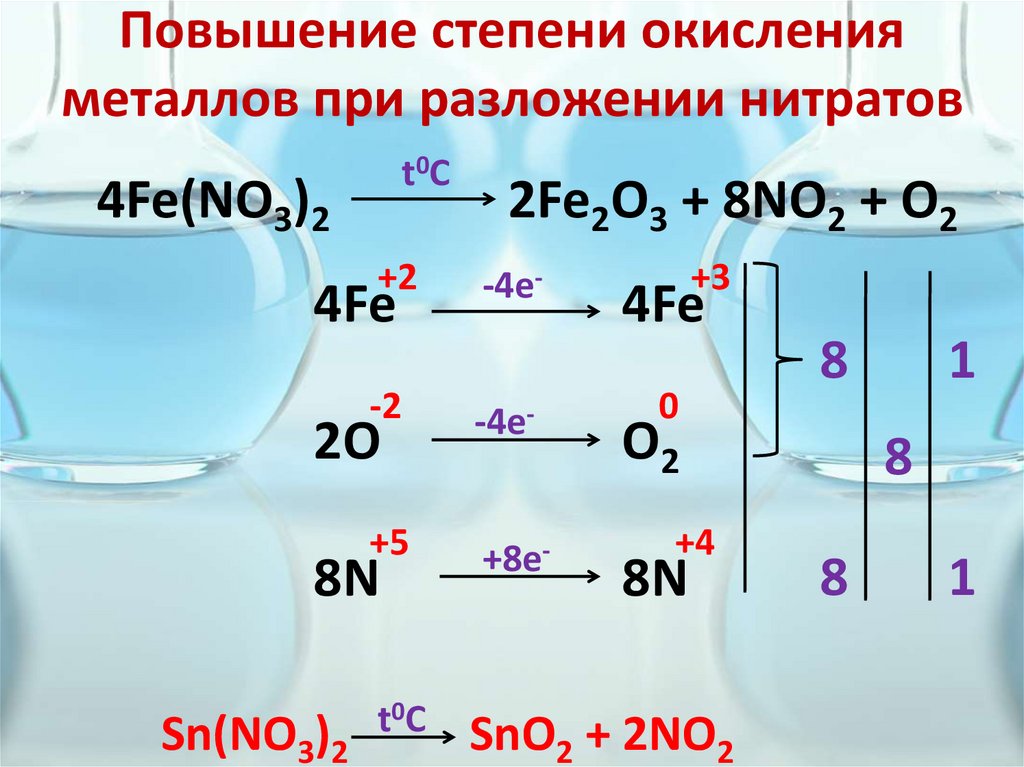
Повышение степени окисленияметаллов при разложении нитратов
t0C
4Fe(NO3)2
+2
2Fe2O3 + 8NO2 + O2
4Fe
-4e-
-2
-4e-
2O
4Fe
0
O2
+5
+8e-
t0C
SnO2 + 2NO2
8N
Sn(NO3)2
+3
+4
8N
8
1
8
8
1
18.
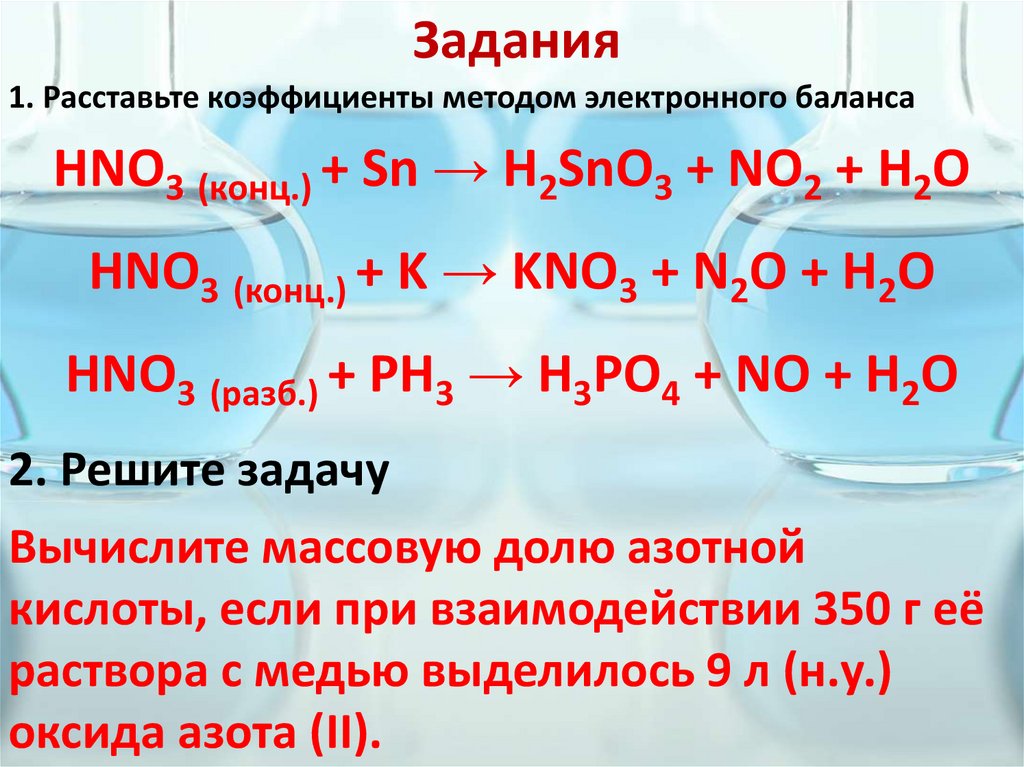
Задания1. Расставьте коэффициенты методом электронного баланса
HNO3 (конц.) + Sn → H2SnO3 + NO2 + H2O
HNO3 (конц.) + K → KNO3 + N2O + H2O
HNO3 (разб.) + PH3 → H3PO4 + NO + H2O
2. Решите задачу
Вычислите массовую долю азотной
кислоты, если при взаимодействии 350 г её
раствора с медью выделилось 9 л (н.у.)
оксида азота (II).
19.
Домашнее задание• §27, упр.2,3(п)
• §28 упр.3(п)
20.
Фосфор и его соединения.2.04.21
21.
Фосфор и его соединения.План конспекта:
I.Фосфор:
1. Упр. 1 стр.105
2. Упр.2 стр.105
II.Оксид фосфора (V):
1. Физические свойства
2. Характер оксида и соответствующие
уравнения реакций
III.Фосфорная кислота:
1. Строение молекулы, хар-ка кислоты
2. Получение
3. Физические свойства
4. Упр.1 Стр.110
5. Качественная реакция на PO43-
22.
Домашнее задание.1.P+HNO3(р-р)+H2O→H3PO4+NO
2.P+HNO3(конц.) →H3PO4+NO2+H2O
3.P+H2SO4(конц.) →H3PO4+SO2+H2O
4.P+KOH+H2O→ PH3+KH2P+1O2
5.P+Ba(OH)2+H2O→ PH3+Ba(H2PO2)2















 chemistry
chemistry








