Similar presentations:
Азот и его соединения
1.
Азот и его соединенияПодготовила: учитель химии Окунева В.Е.
2.
1. Подгруппа азота. Общаяхарактеристика
2. Азот: способы
получения, физические,
химические свойства
3. Аммиак. Соли аммония
4. Оксиды азота
5. HNO3. Нитраты
6. HNO2. Нитриты
План урока
2
3.
Характеристика подгруппы азота1.
Общая электронная формула __________
2. Электронно-графическая формула внешнего слоя азота и
фосфора (основное и возбужденное состояние)
1. Валентности __________
2. Степени окисления __________
3. Формулы оксидов, их характер __________
4. Формула летучего водородного соединения __________
3
4.
Характеристика атомов●N
●P
● As
● Sb
● Bi
Как изменяется:
1. Радиус атома
2. ЭО
3. Кислотные свойства соединений
4. Кислотные свойства летучих
водородных соединений
5. Основные свойства соединений
6. Основные свойства летучих
водородных соединений
7. Окислительные свойства
соединений
8. Восстановительные свойства
соединений
9. Количество внешних e
10. Число электронных слоев
4
5.
Простое вещество N2● нет цвета, запаха и вкуса
● в воде практически нерастворим.
● основной компонент воздуха (78% по
массе).
● в коре встречается в основном в виде
нитратов (-NO3)
● входит в состав белков, аминокислот и
нуклеиновых кислот в живых организмах
5
6.
Способы получения азота1. В лаборатории:
NaNO2 + NH4Cl → NH4NO2 + NaCl
NH4NO2 → N2 + 2H2O
Азот также образуется при горении аммиака:
4NH3 + 3O2 → 2N2 + 6H2O
2. Разложением азидов щелочных металлов.
2NaN3 → 2Na + 3N2
3. Восстановление оксида меди (II) аммиаком при 700 °C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
4. В промышленности азот получают из воздуха.
6
7.
Химические свойства:1. С кислородом только при 2000оС, на электрической дуге (в
природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
2. При 3000оС-5000оС или действии электрического разряда
образуется атомарный азот, который реагирует с серой,
фосфором, мышьяком, углеродом:
2С + N2 → N≡C–C≡N
3. С водородом при высоком давлении и высокой
температуре, в присутствии катализатора.
N2 + ЗН2 ⇄ 2NH3
7
8.
Химические свойства:4. С активными металлами:
N2 + 6Li → 2Li3N
5. Со сложными веществами азот практически не реагирует.
Взаимодействие возможно только в жестких условиях с
активными веществами (сильными восстановителями).
N2 + 3LiH → Li3N + NH3
8
9.
Тест1. Установите соответствие
ФОРМУЛА ВЕЩЕСТВА
Степень окисления азота
А) Ca(NO3)2
Б) NF3
В) NH4HCO3
1) -3
2) -1
3) +3
4) +5
УРАВНЕНИЕ РЕАКЦИИ
СВОЙСТВО АЗОТА
А) 6Li + N2 = 2Li3N
Б) 3CuO + 2NH3 = N2 + 3Cu + 3H2O
В) 4NH3 + 5O2 = 4NO + 6H2O
1) окислитель
2) восстановитель
3) и окислитель, и восстановитель
4) не проявляет окислительновосстановительных свойств
9
10.
Тест1. С каким металлом азот реагирует при обычной температуре:
а) Na б) K в) Li г) Hg.
1. Азот в промышленности получают из:
а) жидкого воздуха; б) воды; в) нитратов.
1. При взаимодействии азота с кислородом образуется:
а) N2O б) NO в) NO2 г) N2O5 .
1. Укажите возможное вещество Х в следующей схеме:
N2→ Х → NO2
1) NO 2) Li3N 3) N2O 4) HNO3.
10
11.
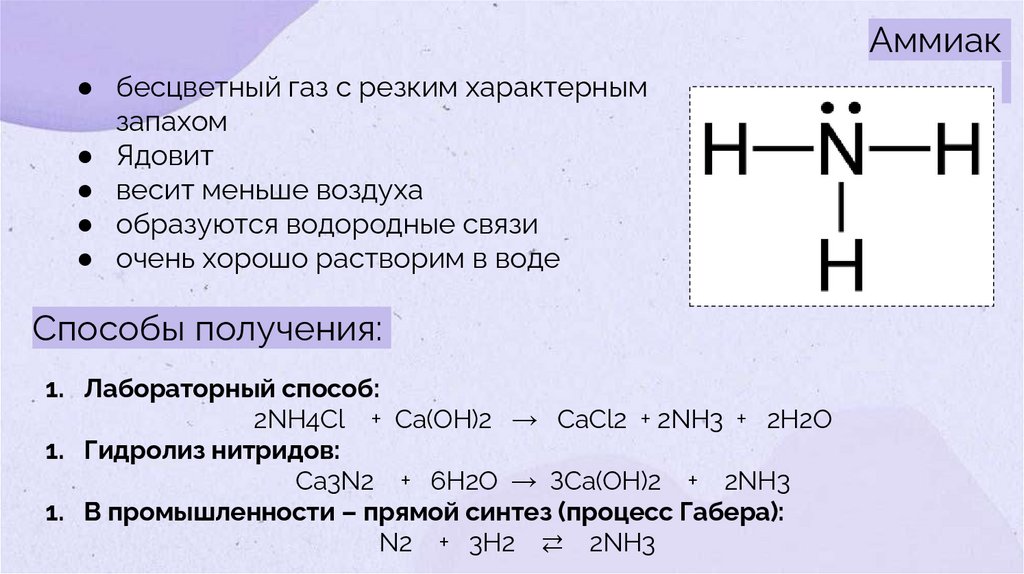
Аммиак● бесцветный газ с резким характерным
запахом
● Ядовит
● весит меньше воздуха
● образуются водородные связи
● очень хорошо растворим в воде
Способы получения:
1. Лабораторный способ:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
1. Гидролиз нитридов:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
1. В промышленности – прямой синтез (процесс Габера):
N2 + 3Н2 ⇄ 2NH3
12.
Химические свойства:1. В водном растворе – основные свойства.
:NH3 + H2O ⇄ NH4+ + OH–
Среда водного раствора аммиака – щелочная.
Аммиак – слабое основание.
2. С кислотами.
NH3 (нед) + H2SO4 →
2NH3 (изб) + H2SO4 →
2NH3 (изб) + H2O + CO2 →
NH3 (нед) + H2O + CO2 →
NH3 (г) + HCl (г) →
12
13.
Химические свойства:3. С растворами солей тяжелых металлов.
FeSO4 + 2NH3 + 2H2O →
(признак?)
4. Соли и гидроксиды меди, никеля, серебра растворяются в
избытке аммиака.
4NH3 + CuCl2 → [Cu(NH3)4]Cl2 – аминокомплекс
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит и окисляется кислородом:
4NH3 + 3O2 → 2N2 +6H2O – горение
4NH3 + 5O2 → 4NO+6H2O – каталитическое окисление
13
14.
Химические свойства:6. Может быть окислителем (с Щ Ме, ЩЗ Ме, Mg и Al).
2NH3 (ж) + 2Na → 2NaNH2 + H2
амид натрия
2NH3 + 2Al → 2AlN + 3H2
нитрид алюминия
7. Может быть восстановителем.
азот окисляется, как правило, до простого вещества
2NH3 + 3Cl2 → N2 + 6HCl
2NH3 + 3H2O2 → N2 + 6H2O
2NH3 + 3CuO → 3Cu + N2 + 3H2O (!!!!!)
14
15.
Соли аммония● соли, состоящие из катиона
аммония и аниона
кислотного остатка
Способы получения:
аммиачная селитра – нитрат аммония
1. аммиак + кислота:
HCl + NH3 = NH4Cl
1. соль аммония + др соль (по ПБ):
NH4Cl + AgNO3 → AgCl + NH4NO3
1. кислая соль аммония + аммиак:
NH4НCO3 + NH3 → (NH4)2CO3
15
16.
Химические свойства1. Сильные электролиты.
NH4Cl ⇄ NH4+ + Cl–
2. Реакции обмена (по ПБ).
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
NH4Cl + KOH → KCl + NH3 + H2O
качественная реакция (почему?)
3. При нагревании разлагаются.
1) не содержит анион-окислитель – не ОВР
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3
NH4HS → NH3 + H2S
16
17.
Химические свойства2) содержит анион-окислитель – ОВР
NH4NO2 → N2 +
190 – 245° C:
выше 300°C:
2H2O
NH4NO3 → N2O + 2H2O
2NH4NO3 → 2N2 + O2 + 4H2O
Разложение бихромата аммония («вулканчик»)
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
https://www.youtube.com/watch?v=v2W3VRZeNYc
17
18.
Тест1. Связь в молекуле аммиака
А) ковалентная неполярная Б) ковалентная полярная
В) металлическая Г) ионная
2. Раствор аммиака в воде можно обнаружить
А) по вкусу
В) по цвету
Б) по запаху
Г) по наличию осадка
3. Аммиак может проявлять свойства
А) только окислительные Б) только восстановительные
В) и окислительные и восстановительные
Г) не имеет таких свойств
4. Аммиак распознают
А) тлеющей лучинкой В) известковой водой
Б) влажной лакмусовой бумажкой
Г) по цвету
18
19.
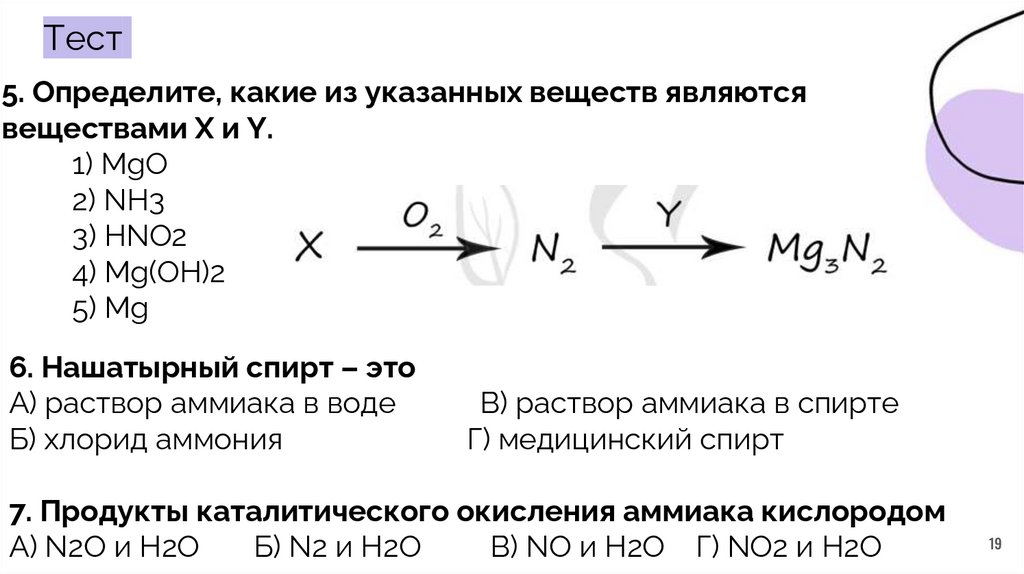
Тест5. Определите, какие из указанных веществ являются
веществами X и Y.
1) MgO
2) NH3
3) HNO2
4) Mg(OH)2
5) Mg
6. Нашатырный спирт – это
А) раствор аммиака в воде
Б) хлорид аммония
В) раствор аммиака в спирте
Г) медицинский спирт
7. Продукты каталитического окисления аммиака кислородом
А) N2О и H2О
Б) N2 и H2О
В) NO и H2О Г) NО2 и H2О
19
20.
Оксиды азотаОксид
Систематическое
название
Тривиальное
название
Цвет
Фаза
Характер
N2O
NO
N2O3
NO2
N2O5
20
21.
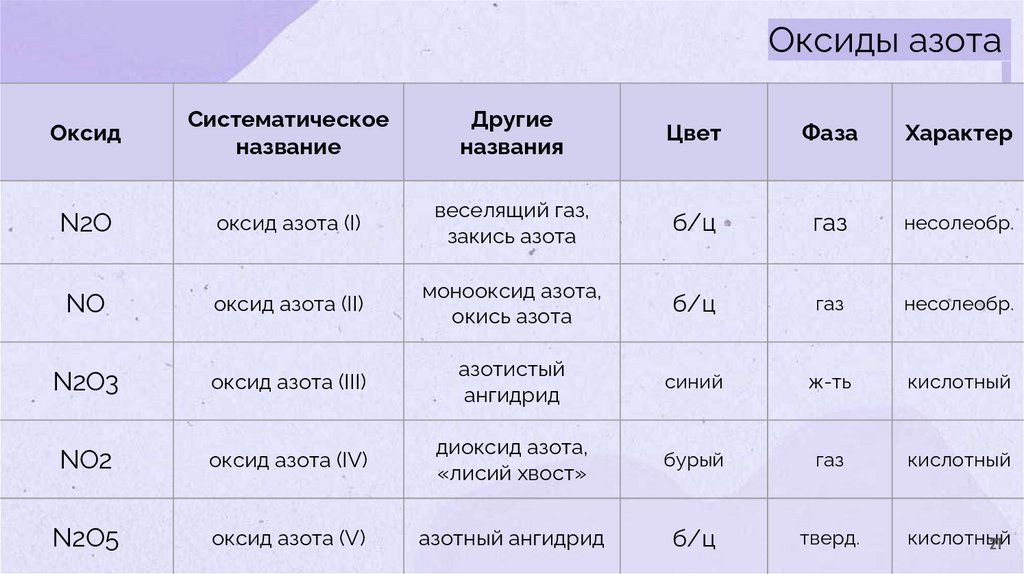
Оксиды азотаОксид
Систематическое
название
Другие
названия
Цвет
Фаза
Характер
N2O
оксид азота (I)
веселящий газ,
закись азота
б/ц
газ
несолеобр.
NO
оксид азота (II)
монооксид азота,
окись азота
б/ц
газ
несолеобр.
N2O3
оксид азота (III)
азотистый
ангидрид
синий
ж-ть
кислотный
NO2
оксид азота (IV)
диоксид азота,
«лисий хвост»
бурый
газ
кислотный
N2O5
оксид азота (V)
азотный ангидрид
б/ц
тверд.
кислотный
21
22.
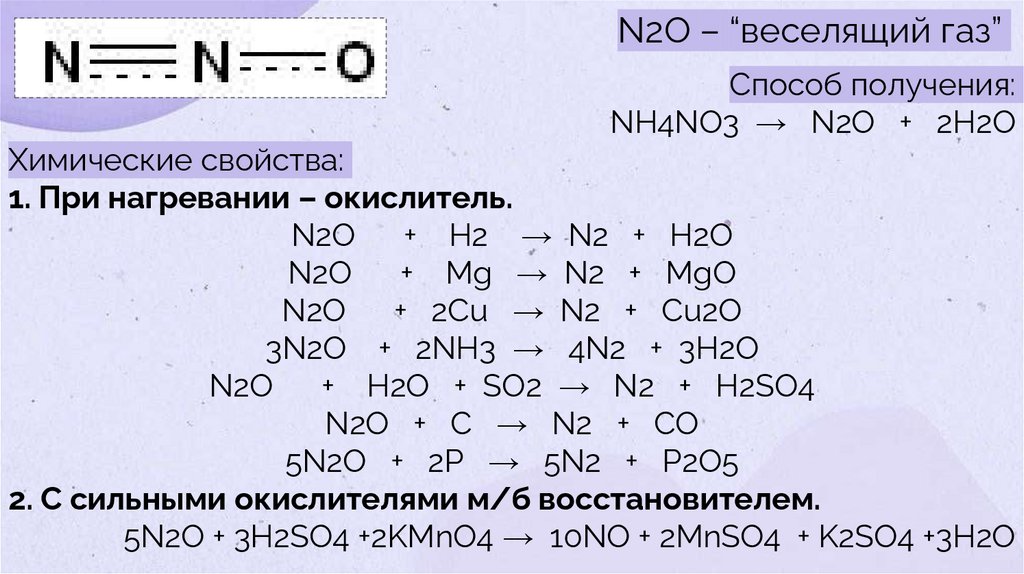
N2O – “веселящий газ”Способ получения:
NH4NO3 → N2O + 2H2O
Химические свойства:
1. При нагревании – окислитель.
N2O
+ H2 → N2 + H2O
N2O
+ Mg → N2 + MgO
N2O
+ 2Cu → N2 + Cu2O
3N2O + 2NH3 → 4N2 + 3H2O
N2O
+ H2O + SO2 → N2 + H2SO4
N2O + C → N2 + CO
5N2O + 2Р → 5N2 + Р2O5
2. С сильными окислителями м/б восстановителем.
5N2O + 3H2SO4 +2KMnO4 → 10NO + 2MnSO4 + K2SO4 +3H2O
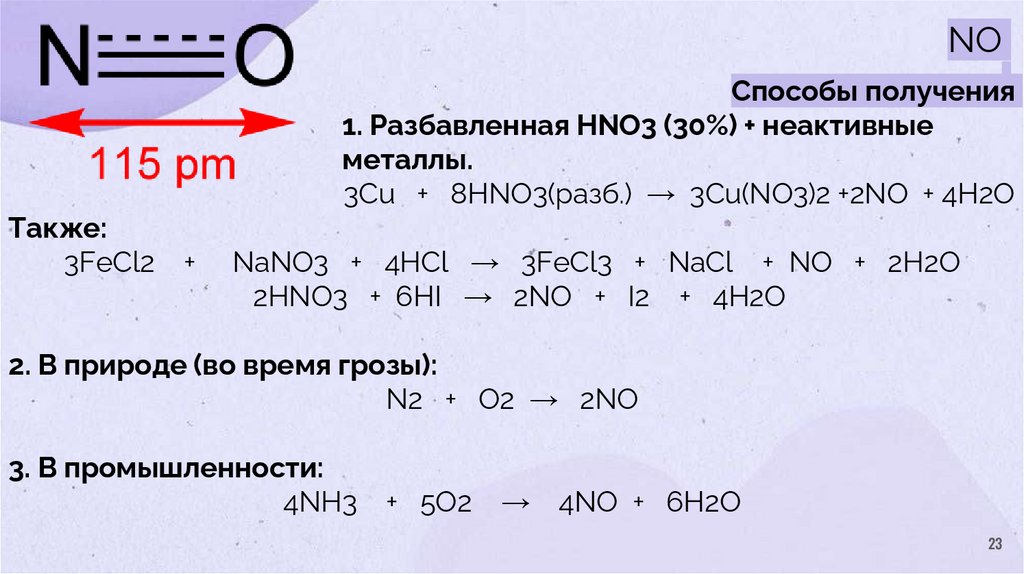
23.
NOСпособы получения
1. Разбавленная HNO3 (30%) + неактивные
металлы.
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 +2NO + 4H2O
Также:
3FeCl2
+
NaNO3 + 4HCl → 3FeCl3 + NaCl + NO + 2H2O
2HNO3 + 6HI → 2NO + I2 + 4H2O
2. В природе (во время грозы):
N2 + O2 → 2NO
3. В промышленности:
4NH3
+ 5O2
→
4NO + 6H2O
23
24.
NOХимические свойства
1. Оксид азота (II) легко окисляется под действием окислителей.
2NO + O2 → 2NO2
2NO + Cl2 → 2NOCl
NO + O3 → NO2 + O2
2. В присутствии более сильных восстановителей проявляет
свойства окислителя.
2NO + 2H2 → N2 + 2H2O
2NO + 2SO2 → 2SO3 + N2
24
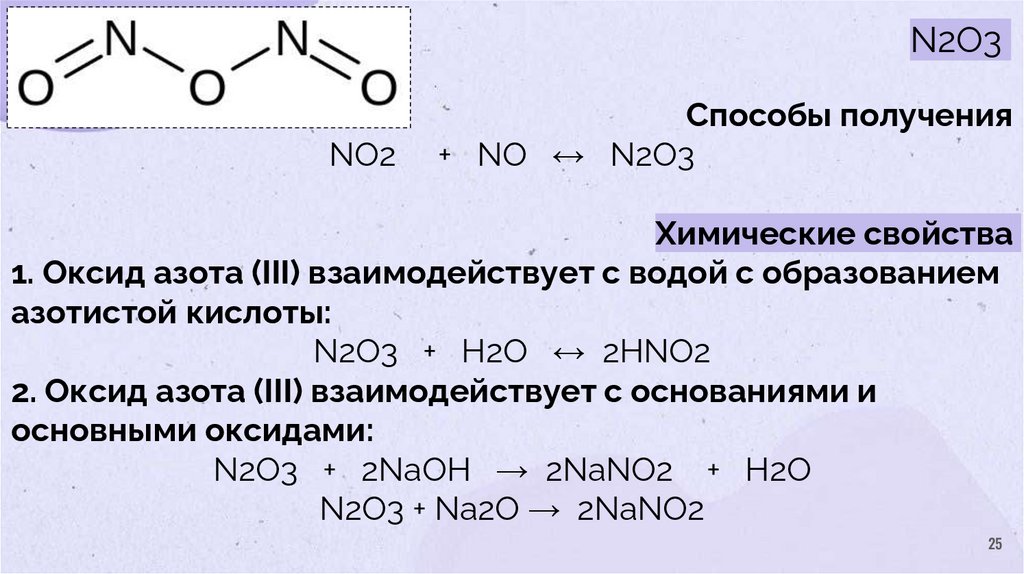
25.
N2O3NO2
Способы получения
+ NO ↔ N2O3
Химические свойства
1. Оксид азота (III) взаимодействует с водой с образованием
азотистой кислоты:
N2O3 + H2O ↔ 2HNO2
2. Оксид азота (III) взаимодействует с основаниями и
основными оксидами:
N2O3 + 2NaOH → 2NaNO2 + H2O
N2O3 + Na2O → 2NaNO2
25
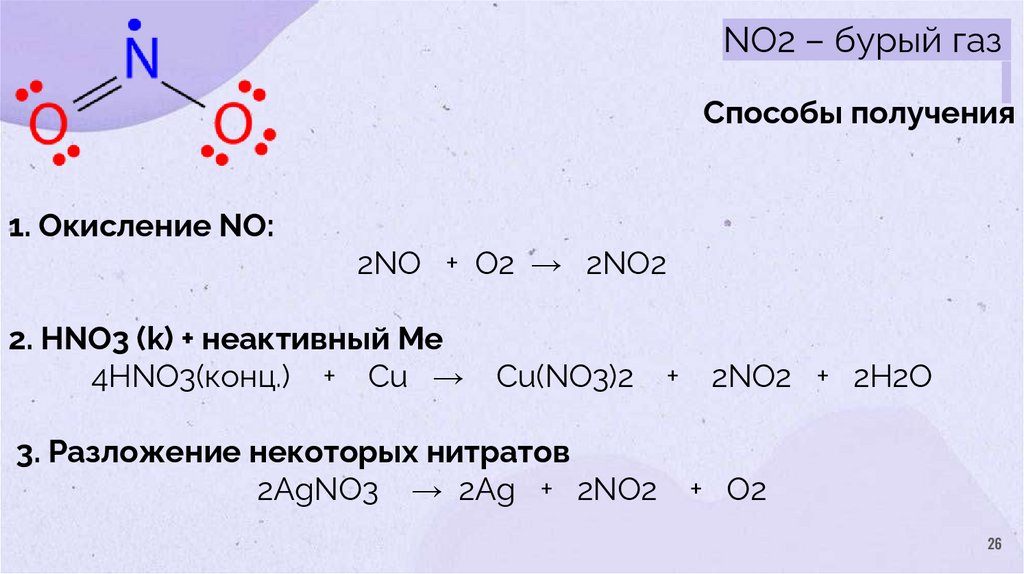
26.
NO2 – бурый газСпособы получения
1. Окисление NO:
2NO + O2 → 2NO2
2. HNO3 (k) + неактивный Ме
4HNO3(конц.) + Cu →
Cu(NO3)2
3. Разложение некоторых нитратов
2AgNO3 → 2Ag + 2NO2
+
2NO2 + 2H2O
+ O2
26
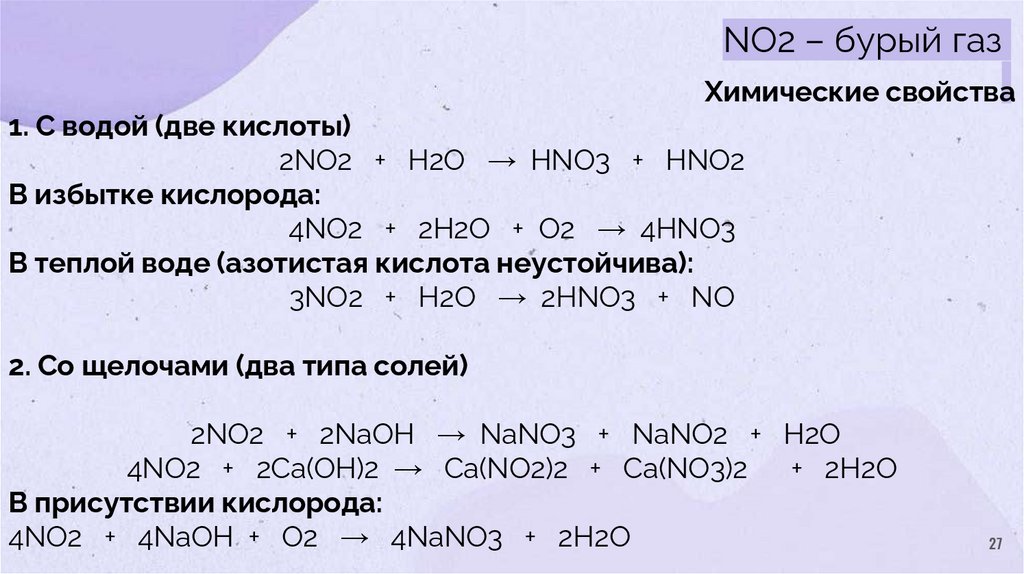
27.
NO2 – бурый газХимические свойства
1. С водой (две кислоты)
2NO2 + H2O → HNO3 + HNO2
В избытке кислорода:
4NO2 + 2H2O + O2 → 4HNO3
В теплой воде (азотистая кислота неустойчива):
3NO2 + H2O → 2HNO3 + NO
2. Со щелочами (два типа солей)
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
4NO2 + 2Ca(OH)2 → Ca(NO2)2 + Ca(NO3)2
+ 2H2O
В присутствии кислорода:
4NO2 + 4NaOH + O2 → 4NaNO3 + 2H2O
27
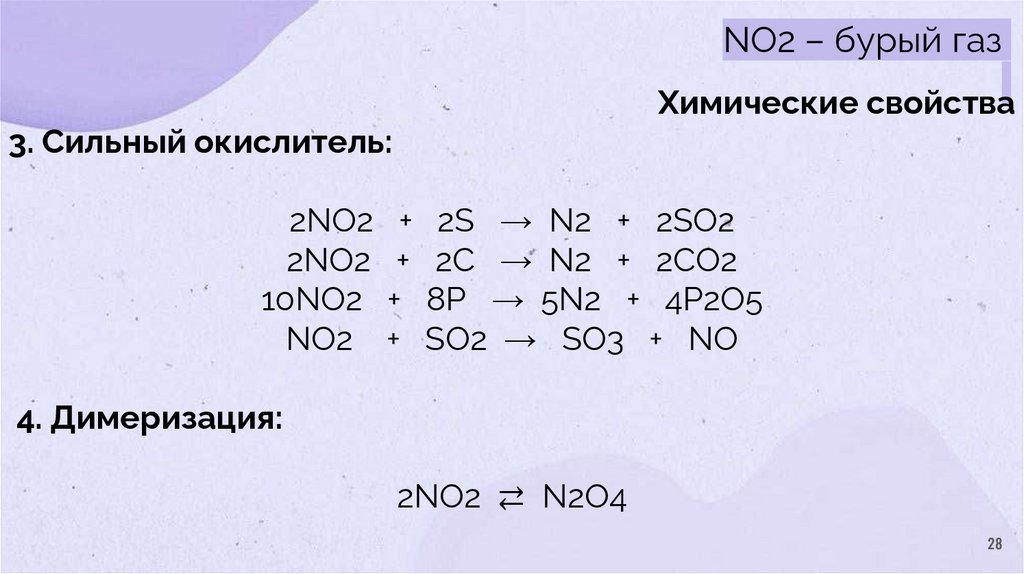
28.
NO2 – бурый газХимические свойства
3. Сильный окислитель:
2NO2 + 2S → N2 + 2SO2
2NO2 + 2C → N2 + 2CO2
10NO2 + 8P → 5N2 + 4P2O5
NO2 + SO2 → SO3 + NO
4. Димеризация:
2NO2 ⇄ N2O4
28
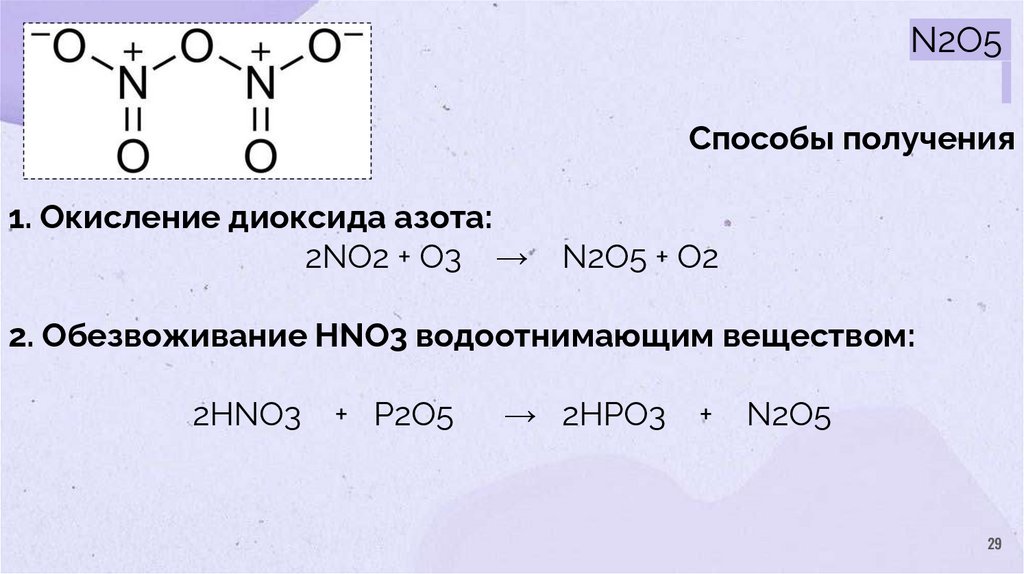
29.
N2O5Способы получения
1. Окисление диоксида азота:
2NO2 + O3 →
N2O5 + O2
2. Обезвоживание HNO3 водоотнимающим веществом:
2HNO3
+ P2O5
→ 2HPO3
+
N2O5
29
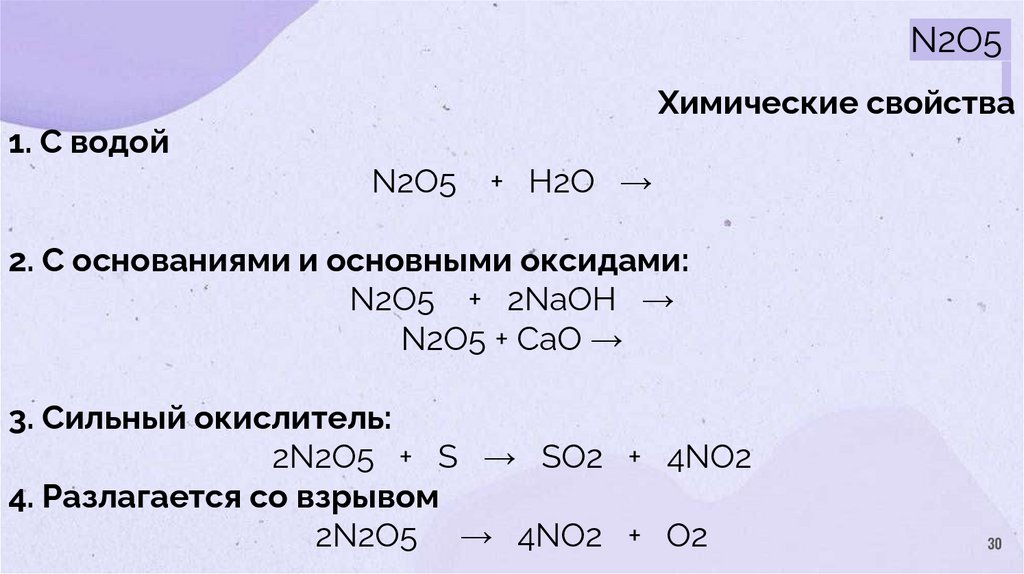
30.
N2O5Химические свойства
1. С водой
N2O5
+ H2O →
2. С основаниями и основными оксидами:
N2O5 + 2NaOH →
N2O5 + CaO →
3. Сильный окислитель:
2N2O5 + S → SO2 + 4NO2
4. Разлагается со взрывом
2N2O5 → 4NO2 + O2
30
31.
Тест1. Формулы несолеобразующих оксидов записаны в ряду:
а) СO, CO2, N2O5 б)CO, N2O, NO в) SO2, N2O, NO2 г) NO, SO3, N2O3
2. Оксид азота(IV) реагирует с каждым веществом ряда:
а) O2, H2O, NaOH б) SO3, S, O2 в) H2, CuO, H2SO4 г) Cl2, Ca(OH)2, CO2
Напишите уравнения реакций, коэффициенты расставьте методом
электронного баланса, укажите окислители и восстановители.
3. Составьте уравнения следующих превращений:
N2 → NO → NO2 → HNO3 → Al(NO3)3
Для уравнения 3 составьте схему электронного баланса. Для
реакции 4 напишите молекулярное и ионно-молекулярное
уравнение.
4. Влажная лакмусовая бумажка краснеет при внесении ее в
сосуд с газом, формула которого: а) NO2 б) N2 в) NO г) NH3 31
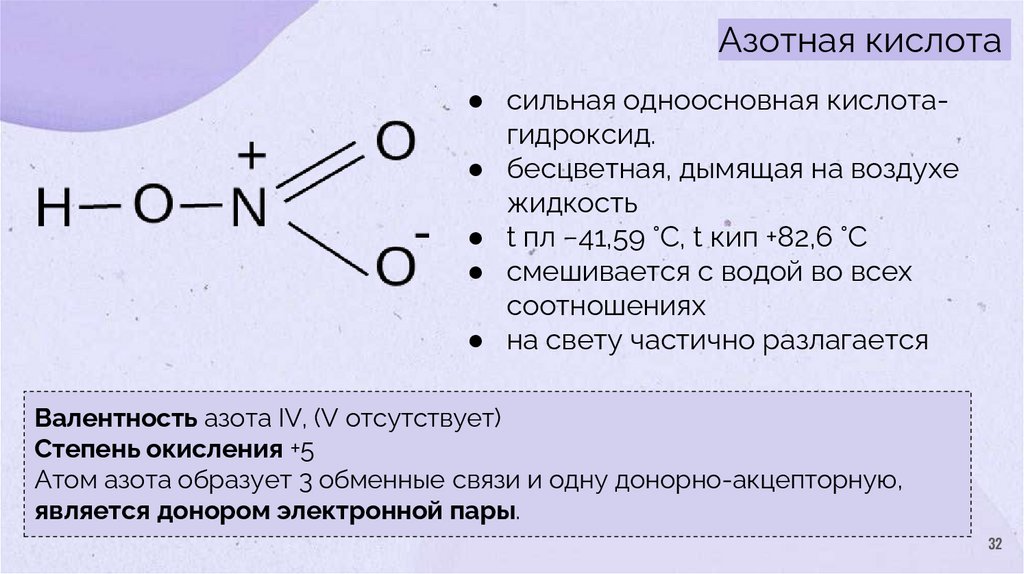
32.
Азотная кислота● сильная одноосновная кислотагидроксид.
● бесцветная, дымящая на воздухе
жидкость
● t пл −41,59 °C, t кип +82,6 °C
● смешивается с водой во всех
соотношениях
● на свету частично разлагается
Валентность азота IV, (V отсутствует)
Степень окисления +5
Атом азота образует 3 обменные связи и одну донорно-акцепторную,
является донором электронной пары.
32
33.
Способы получения1. H2SO4 (k) + твердые нитраты
KNO3 + H2SO4(конц) →KHSO4 + HNO3
2. В промышленности:
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление NO.
2NO +
O2 →
2NO2
3 стадия. Поглощение NO2 водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
33
34.
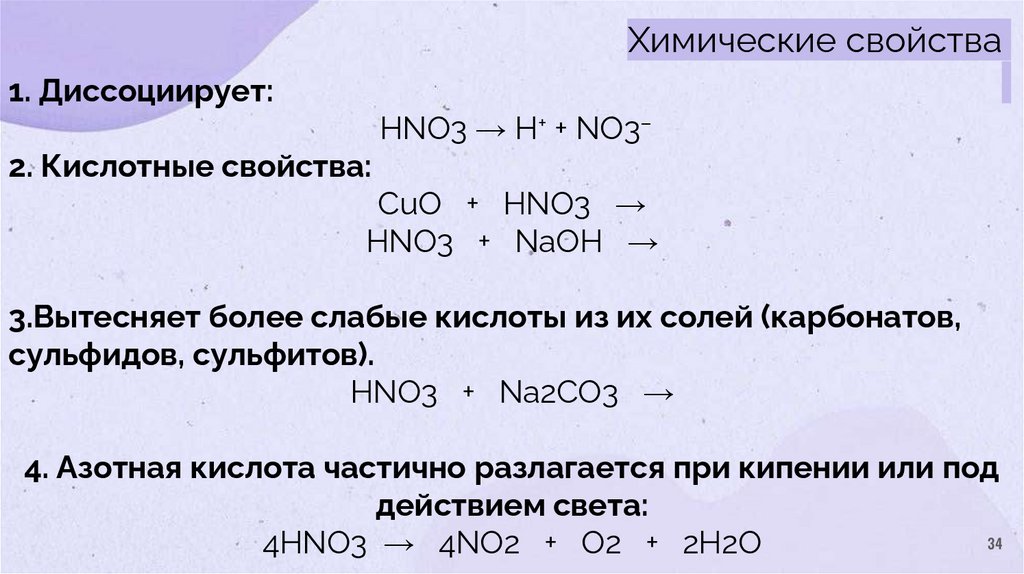
Химические свойства1. Диссоциирует:
HNO3 → H+ + NO3–
2. Кислотные свойства:
CuO + HNO3 →
HNO3 + NaOH →
3.Вытесняет более слабые кислоты из их солей (карбонатов,
сульфидов, сульфитов).
HNO3 + Na2CO3 →
4. Азотная кислота частично разлагается при кипении или под
действием света:
34
4HNO3 → 4NO2 + O2 + 2H2O
35.
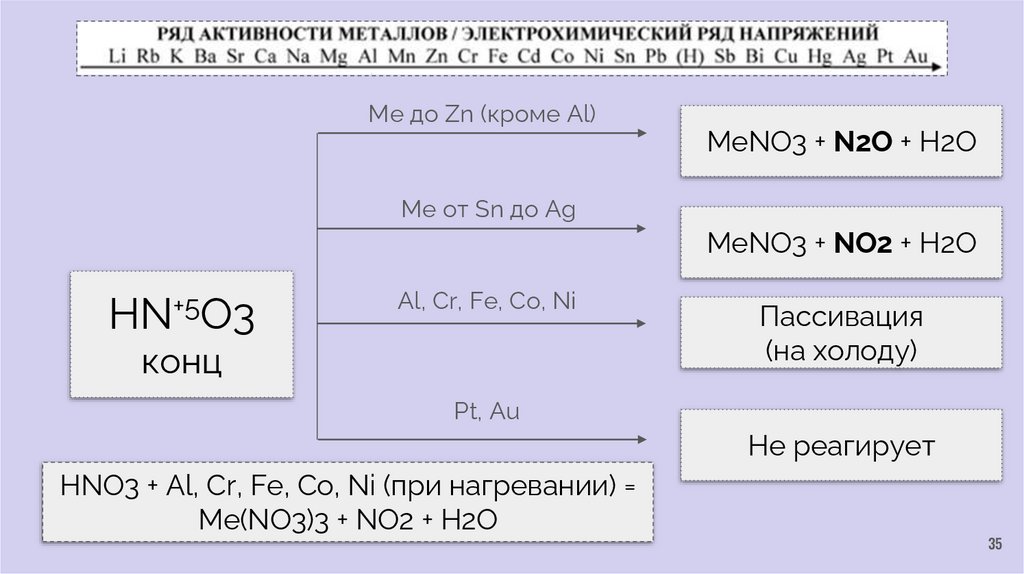
Ме до Zn (кроме Al)MeNO3 + N2O + H2O
Ме от Sn до Ag
MeNO3 + NO2 + H2O
HN+5O3
Al, Cr, Fe, Co, Ni
конц
Пассивация
(на холоду)
Pt, Au
Не реагирует
HNO3 + Al, Cr, Fe, Co, Ni (при нагревании) =
Me(NO3)3 + NO2 + H2O
35
36.
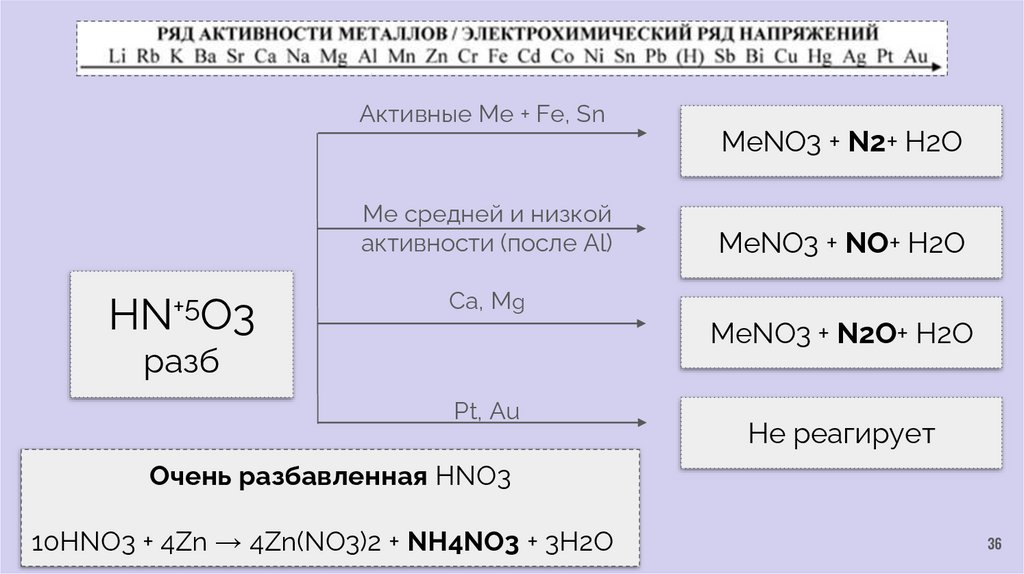
Активные Me + Fe, SnМе средней и низкой
активности (после Al)
HN+5O3
MeNO3 + N2+ H2O
MeNO3 + NO+ H2O
Ca, Mg
MeNO3 + N2O+ H2O
разб
Pt, Au
Не реагирует
Очень разбавленная HNO3
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
36
37.
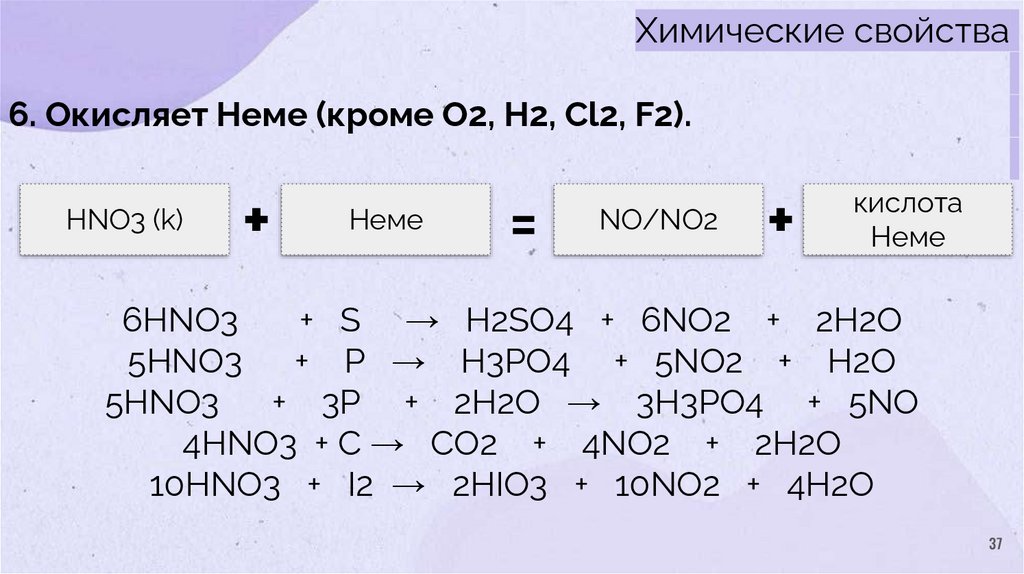
Химические свойства6. Окисляет Неме (кроме O2, H2, Cl2, F2).
HNO3 (k)
+
Неме
=
NO/NO2
+
кислота
Неме
6HNO3
+ S → H2SO4 + 6NO2 + 2H2O
5HNO3
+ P → H3PO4 + 5NO2 + H2O
5HNO3
+ 3P + 2H2O → 3H3PO4 + 5NO
4HNO3 + C → CO2 + 4NO2 + 2H2O
10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
37
38.
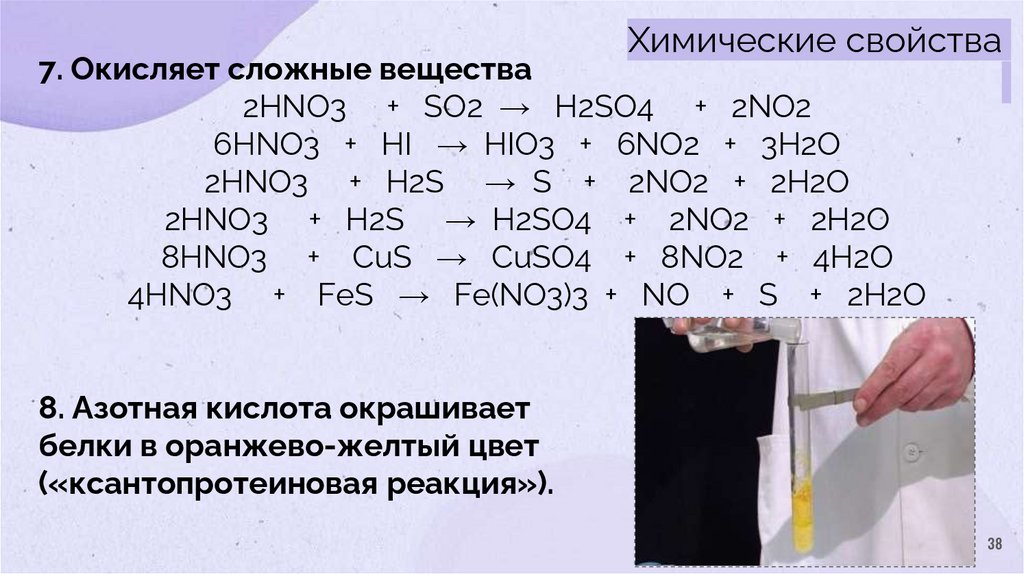
Химические свойства7. Окисляет сложные вещества
2HNO3 + SO2 → H2SO4 + 2NO2
6HNO3 + HI → HIO3 + 6NO2 + 3H2O
2HNO3 + H2S → S + 2NO2 + 2H2O
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает
белки в оранжево-желтый цвет
(«ксантопротеиновая реакция»).
38
39.
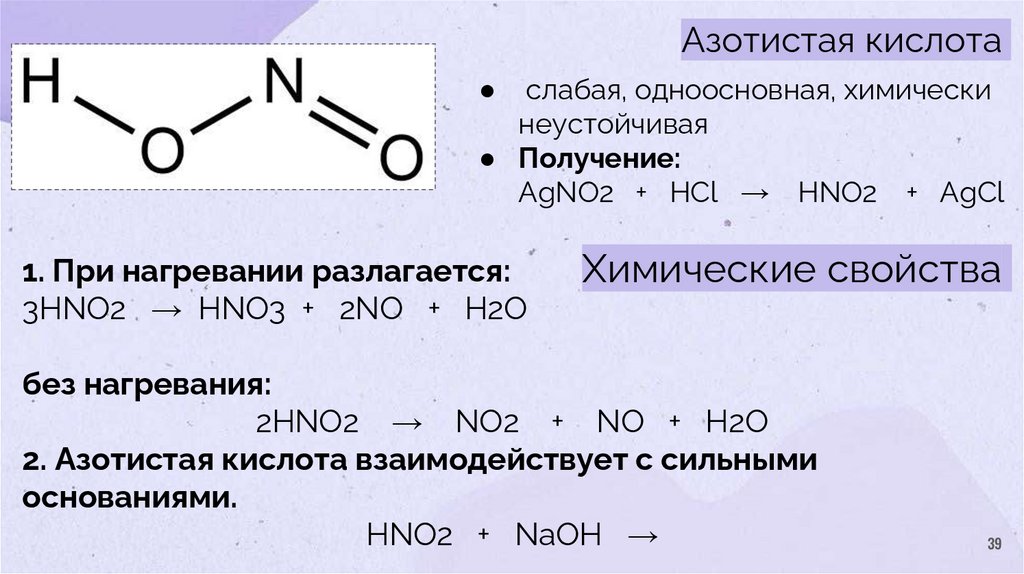
Азотистая кислотаслабая, одноосновная, химически
неустойчивая
● Получение:
AgNO2 + HCl → HNO2 + AgCl
1. При нагревании разлагается:
3HNO2 → HNO3 + 2NO + H2O
Химические свойства
без нагревания:
2HNO2 → NO2 + NO + H2O
2. Азотистая кислота взаимодействует с сильными
основаниями.
HNO2 + NaOH →
39
40.
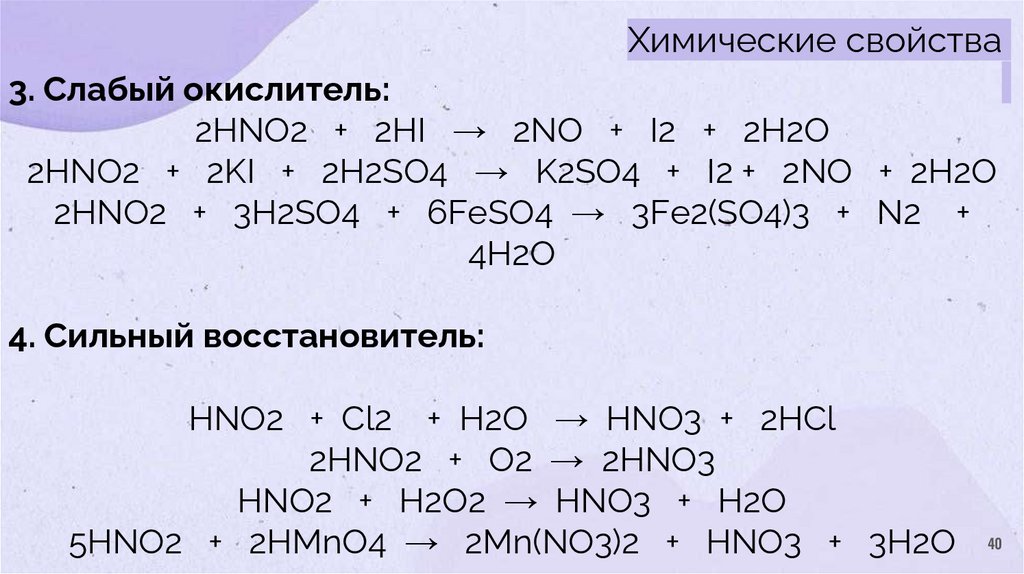
Химические свойства3. Слабый окислитель:
2HNO2 + 2HI → 2NO + I2 + 2H2O
2НNO2 + 2KI + 2H2SO4 → K2SO4 + I2 + 2NO + 2H2O
2HNO2 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + N2 +
4H2O
4. Сильный восстановитель:
HNO2 + Cl2 + H2O → HNO3 + 2HCl
2HNO2 + O2 → 2HNO3
HNO2 + H2O2 → HNO3 + H2O
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O
40
41.
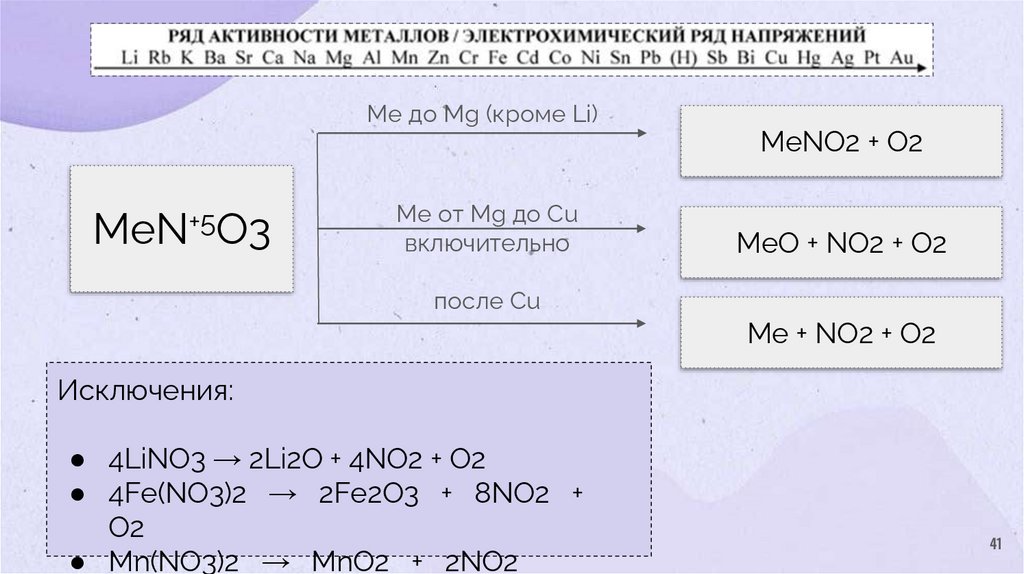
Ме до Mg (кроме Li)MeN+5O3
Ме от Mg до Cu
включительно
MeNO2 + O2
MeO + NO2 + O2
после Cu
Me + NO2 + O2
Исключения:
● 4LiNO3 → 2Li2O + 4NO2 + O2
● 4Fe(NO3)2 → 2Fe2O3 + 8NO2 +
O2
● Mn(NO3)2 → MnO2 + 2NO2
41
42.
НитритыПроявляют окислительно-восстановительные
свойства:
1. 2KNO2 + O2 → 2KNO3
2. KNO2 + H2O2 → KNO3 + H2O
3. KNO2 + H2O + Br2 → KNO3 + 2HBr
4. 5KNO2 + 3H2SO4+2KMnO4 → 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
5. 3KNO2 + 4H2SO4 +K2Cr2O7 → 3KNO3 + Cr2(SO4)3+K2SO4 + 4H2O
6. 2KNO2 + 2H2SO4 + 2KI → 2NO + I2 + 2K2SO4 + 2H2O
7. 2KNO2 + 2FeSO4 + 2H2SO4 → Fe2(SO4)3 + 2NO + K2SO4 + 2H2O
8. NaNO2 + 2Al + NaOH + 6H2O → 2Na[Al(OH)4] + NH3
9. 3KNO2 + Cr2O3 + KNO3 → 2K2CrO4 + 4NO
Задание: Переписать уравнения, расставить СО, определить окислитель и
восстановитель.
42
43.
Тест1. Из предложенного перечня выберите два типа реакций, к которым
относится реакция, протекающая при нагревании нитрата меди(II).
1. соединения
2. разложения
3. замещения
4. каталитическая
5. эндотермическая
1. Определите, какие из указанных веществ являются X и Y.
1) гидрат аммиака
2) хлорид аммония
3) оксид азота(II)
4) аммиак
5) азотная кислота
43
44.
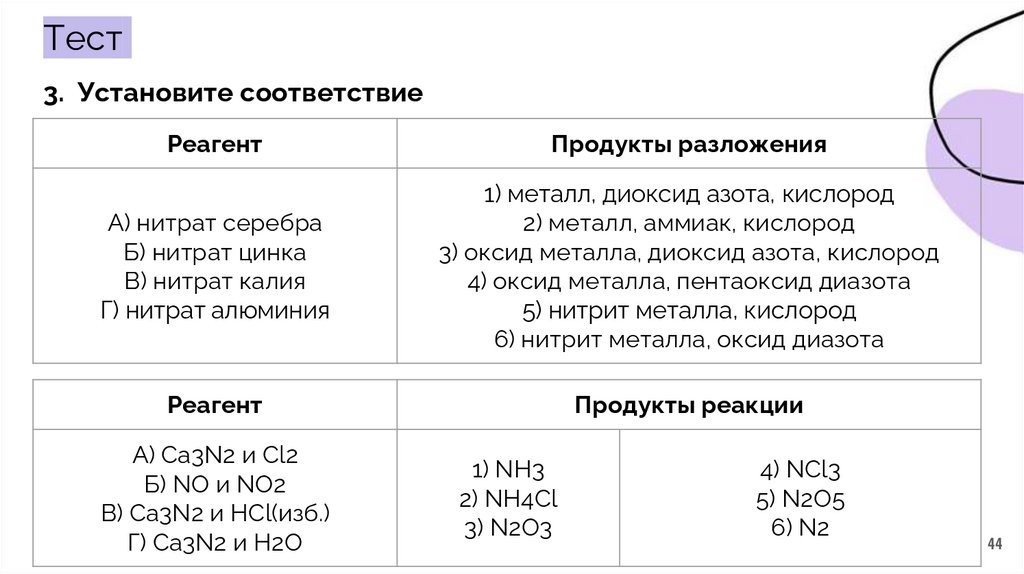
Тест3. Установите соответствие
Реагент
Продукты разложения
А) нитрат серебра
Б) нитрат цинка
В) нитрат калия
Г) нитрат алюминия
1) металл, диоксид азота, кислород
2) металл, аммиак, кислород
3) оксид металла, диоксид азота, кислород
4) оксид металла, пентаоксид диазота
5) нитрит металла, кислород
6) нитрит металла, оксид диазота
Реагент
Продукты реакции
А) Ca3N2 и Cl2
Б) NO и NO2
В) Ca3N2 и HCl(изб.)
Г) Ca3N2 и H2O
1) NH3
2) NH4Cl
3) N2O3
4) NCl3
5) N2O5
6) N2
44
45.
Тест45
46.
Тест4. В результате термического разложения дихромата аммония
получили газ, который пропустили над нагретым магнием.
Образовавшееся вещество поместили в воду. образовавшийся при
этом газ пропустили через свежеосажденный гидроксид меди (II).
Напишите уравнения описанных реакций.
5. Йод поместили в пробирку с концентрированной горячей
азотной кислотой. выделившийся газ пропустили через воду в
присутствии кислорода. В полученный раствор добавили
гидроксид меди (II). Образовавшийся раствор выпарили и
сухой твердый остаток прокалили. Напишите уравнения
описанных реакций.
46
47.
Тест6. Продукт взаимодействия лития с азотом обработали водой.
Полученный газ пропустили через раствор серной кислоты до
прекращения химических реакций. Полученный раствор
обработали хлоридом бария. Раствор профильтровали, а фильтрат
смешали с раствором нитрита натрия и нагрели. Напишите
уравнения описанных реакций.
7. Навеску алюминия растворили в разбавленной азотной
кислоте, при этом выделилось простое вещество. К
полученному раствору добавили карбонат натрия до полного
прекращения выделения газа. Выпавший осадок отфильтровали
и прокалили, фильтрат упарили, полученный твердый остаток
сплавили с хлоридом аммония. Выделившийся газ смешали с
аммиаком и нагрели полученную смесь. Напишите уравнения
47
описанных реакций.



















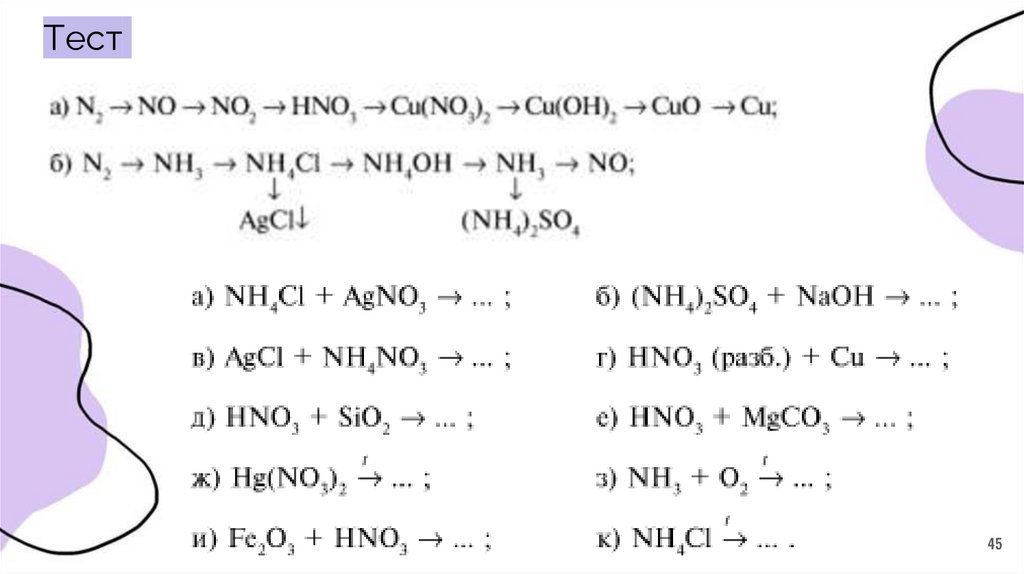


 chemistry
chemistry








