Similar presentations:
15-The first law of thermodynamics. The processes. Adiabatic process
1. Первое начало термодинамики Изопроцессы Адиабатический процесс
ВоГУЛекция 15
Первое начало термодинамики
Изопроцессы
Адиабатический процесс
Кузина Л.А.,
к.ф.-м.н., доцент
2019 г.
1
2. План
23.
Предмет и задачи термодинамикиТермодинамика изучает общие свойства макросистем, находящихся в
состоянии термодинамического равновесия, и процессы перехода между
состояниями. Термодинамика позволяет понять, какие процессы
возможны, а какие – нет.
Отвлекаясь от движения тела как целого, термодинамика сосредотачивает
внимание на изменениях внутреннего состояния тела, состояния
термодинамической системы
На основе общих принципов механики пытались установить связь между
молекулярным движением и тепловыми явлениями
Термодинамику пытались свести к механике
Это принципиально невозможно
Законы Ньютона обратимы во времени
Тепловые процессы необратимы: теплота переходит от горячего к холодному,
но не наоборот
Ньютоновская механика принципиально не может объяснить
необратимость процессов
Сведение термодинамики к механике оказывается невозможным
4.
Предмет и задачи термодинамикиПример: греем газ в закрытом сосуде, приведя его в соприкосновение с
нагретым телом. Увеличивается энергия газа; он при расширении может
совершить механическую работу
При теплообмене передача энергии происходит на микроскопическом
уровне, при столкновениях молекул. Результат каждого отдельного
столкновения предсказать невозможно. Но в среднем, с
макроскопической точки зрения, при соударении энергичных молекул
нагретого тела со стенками сосуда с газом энергия переходит от
нагретого тела к газу. В результате тепловая энергия обязательно
перетекает от горячего тела к газу
Теплота представляет собой особую форму движения материи.
Хотя теплота и связана с молекулярным механическим движением, но этим
не исчерпывается ее сущность
В механике переменными являются координаты и импульсы (скорости)
частиц.
В термодинамике такое описание оказалось неприемлемым. В число
переменных (параметров) в термодинамике потребовалось ввести
температуру
Температура определяет направление перехода теплоты, то есть
выступает как мера нагретости тела
5.
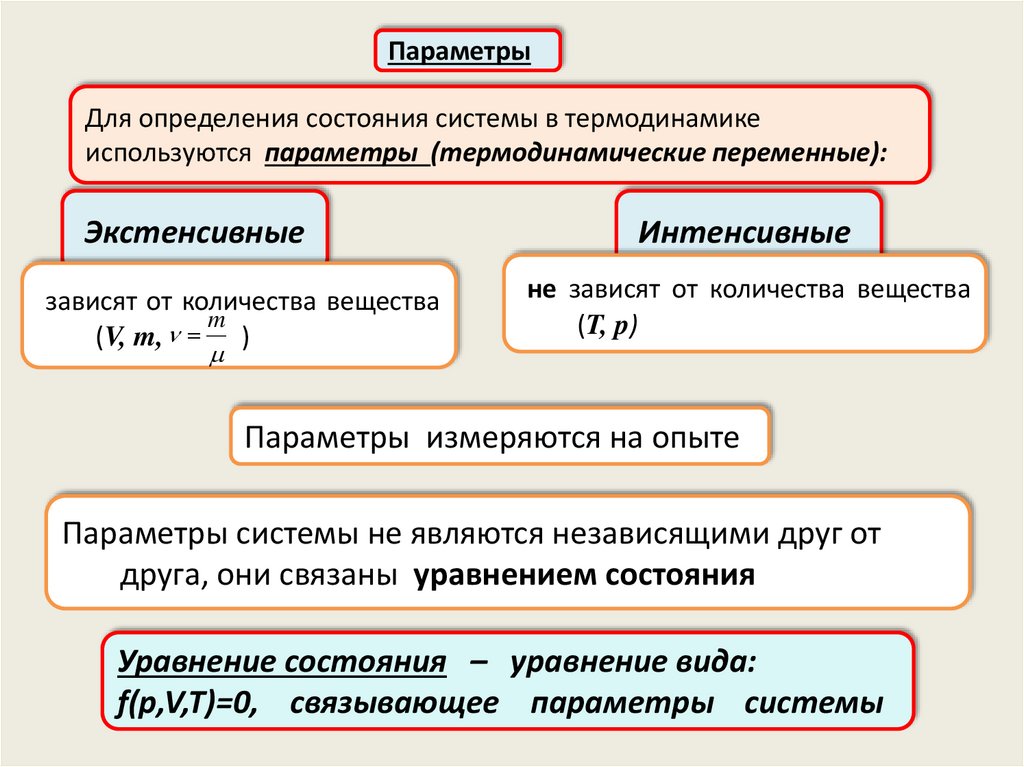
ПараметрыДля определения состояния системы в термодинамике
используются параметры (термодинамические переменные):
Экстенсивные
зависят от количества вещества
m
(V, m, )
Интенсивные
не зависят от количества вещества
(T, p)
Параметры измеряются на опыте
Параметры системы не являются независящими друг от
друга, они связаны уравнением состояния
Уравнение состояния – уравнение вида:
f(p,V,T)=0, связывающее параметры системы
6.
В основе термодинамики лежат основанные на опытезаконы (начала) термодинамики
В термодинамике нет моделей, теоретических предположений о строении
вещества или о механизме процессов.
Свойства вещества – теплоёмкость, температурные коэффициенты
объёмного и линейного расширения, и т.д. – определяются из опыта
Закон теплового равновесия
(нулевое начало термодинамики)
Понятие теплового равновесия является одним из главнейших
исходных термодинамических понятий.
Опыт показывает, что если системы 1 и 2 находятся в тепловом
равновесии с системой 3, то то системы 1 и 2 будут также в тепловом
равновесии друг с другом.
Значение этого закона заключается в том, что он приводит к выводу о
существовании температуры как характеристики теплового равновесия
системы.
Температура есть присущая каждому состоянию равновесия
интенсивная величина
7.
Внутренняя энергияОдно из важных понятий – внутренняя энергия системы U.
Внутренняя энергия тела – это полная энергия тела, за исключением
кинетической энергии движения тела как целого (движения центра масс
и вращения тела как целого) и потенциальной энергии тела во внешних
полях
Внутренняя энергия системы – это функция
состояния, то есть однозначно определяется
состоянием системы.
Изменение внутренней энергии системы в какомлибо процессе не зависит от пути перехода, а только
от начального и конечного сотояния; а в замкнутом
процессе, когда система возвращается в исходное
состояние, изменение внутренней энергии равно
нулю
8.
Первое начало термодинамикиВнутреннюю энергию системы можно изменить за счёт:
1) совершения над системой работы;
2) сообщения системе теплоты:
dU Q Aвнешних сил
U Q Aвнешних сил
A Aвнешних сил
Q A dU
Q A U
Количество теплоты, сообщённое системе, идёт на
приращение её внутренней энергии и на работу системы
против внешних сил
9.
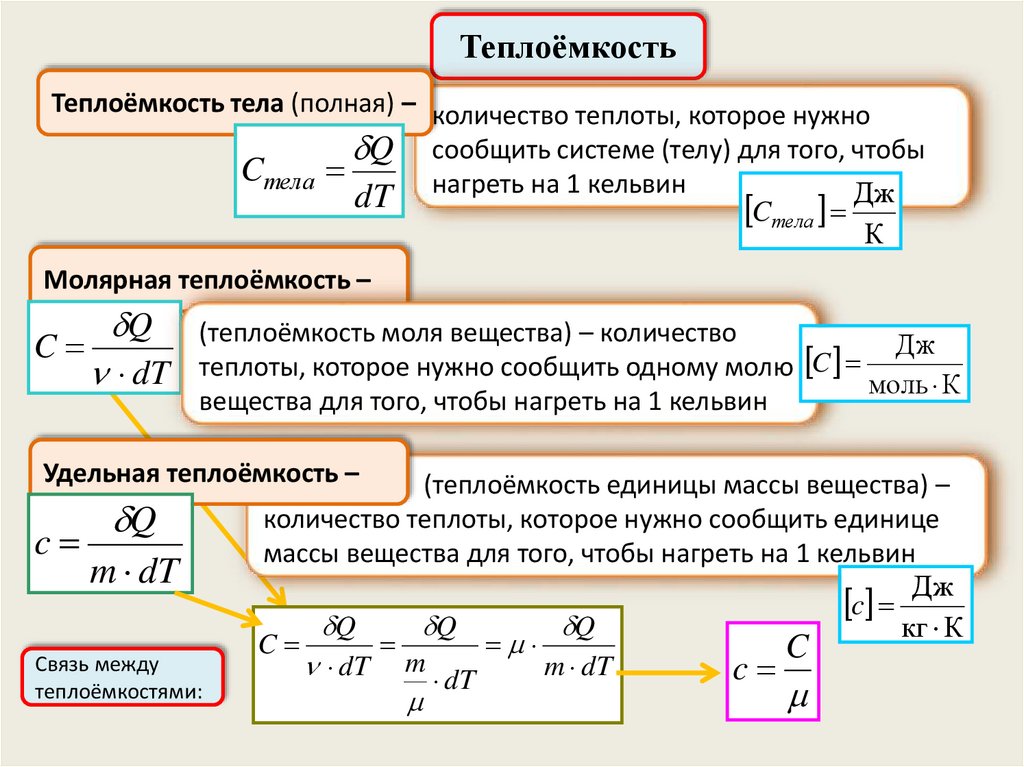
ТеплоёмкостьТеплоёмкость тела (полная) – количество теплоты, которое нужно
Cтела
Q
dT
сообщить системе (телу) для того, чтобы
нагреть на 1 кельвин
Cтела Дж
К
Молярная теплоёмкость –
C
Q
dT
(теплоёмкость моля вещества) – количество
Дж
C
теплоты, которое нужно сообщить одному молю
моль К
вещества для того, чтобы нагреть на 1 кельвин
Удельная теплоёмкость –
c
Q
m dT
Связь между
теплоёмкостями:
(теплоёмкость единицы массы вещества) –
количество теплоты, которое нужно сообщить единице
массы вещества для того, чтобы нагреть на 1 кельвин
c Дж
Q
Q
Q
кг К
C
C
dT m dT
m dT
c
10.
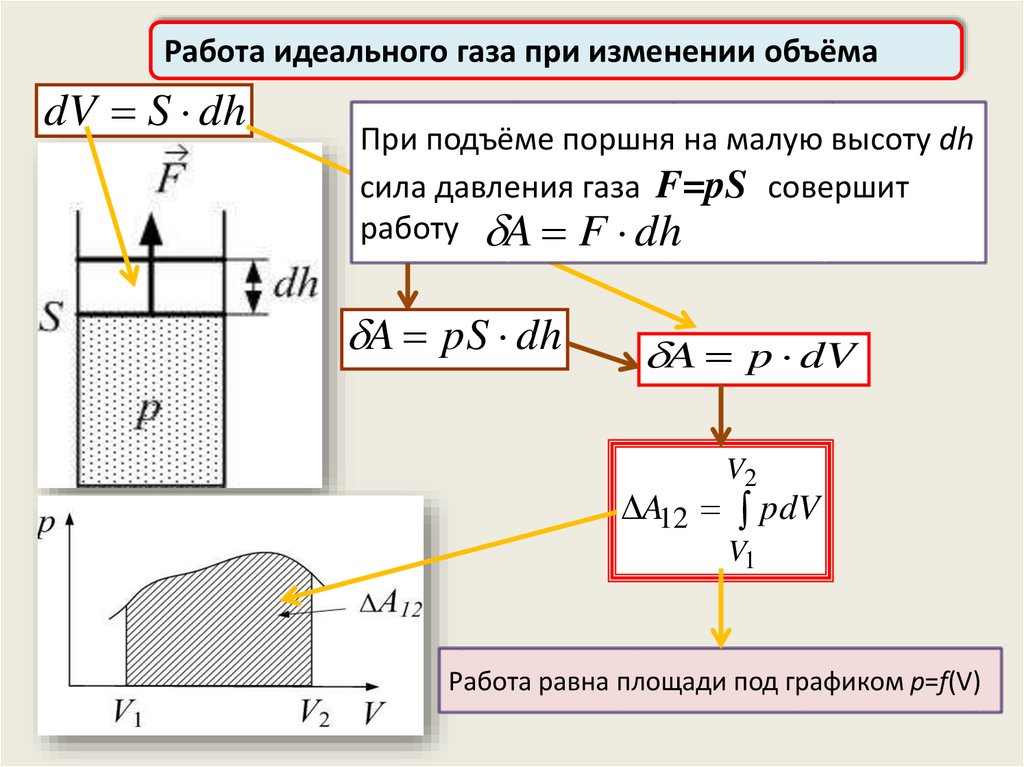
Работа идеального газа при изменении объёмаdV S dh
При подъёме поршня на малую высоту dh
сила давления газа F=pS совершит
работу A
A FF dh
dh
A pS dh
A p dV
V2
A12 pdV
V1
Работа равна площади под графиком p=f(V)
11.
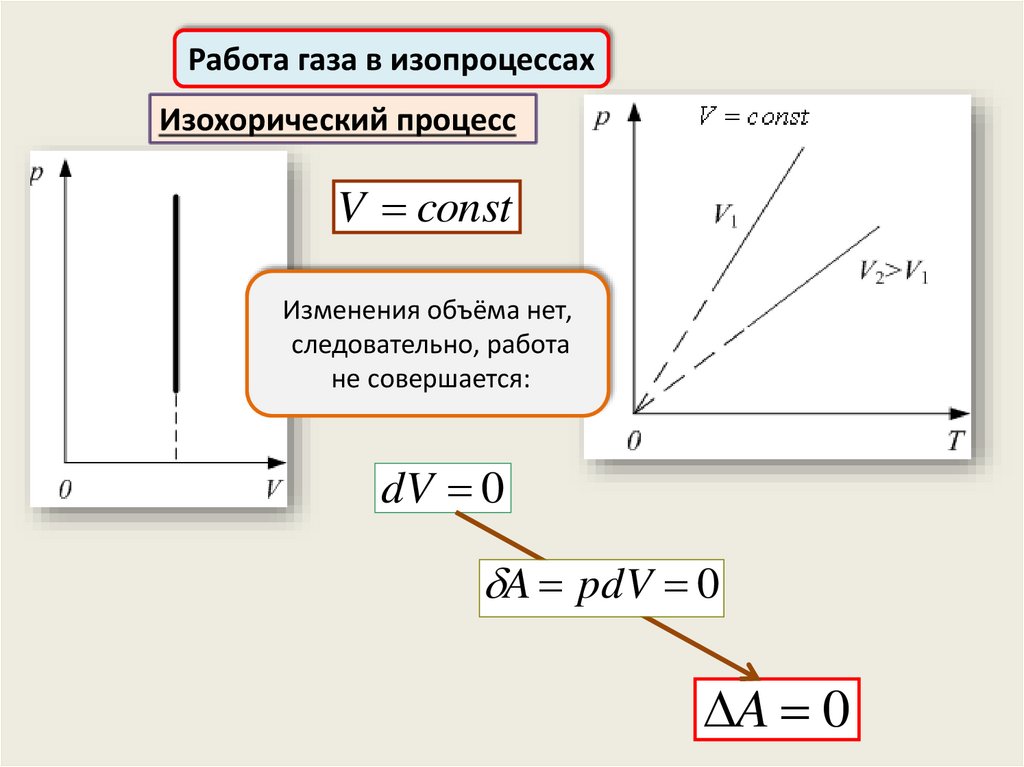
Работа газа в изопроцессахИзохорический процесс
V const
Изменения объёма нет,
следовательно, работа
не совершается:
dV 0
A pdV 0
A 0
12.
Работа газа в изопроцессахИзобарический процесс
V2
V2
V1
V1
A12 pdV p dV p V2 V1
A12 p V
p V1 RT1
p V2 RT2
A12 p V2 V1 pV2 pV1
Универсальная газовая
постоянная R численно A12 RT2 RT1 R T2 T1
равна работе одного моля
A12 R T
идеального газа при
изобарном нагревании на
A12
A
1 кельвин
R
R
T
dT
13.
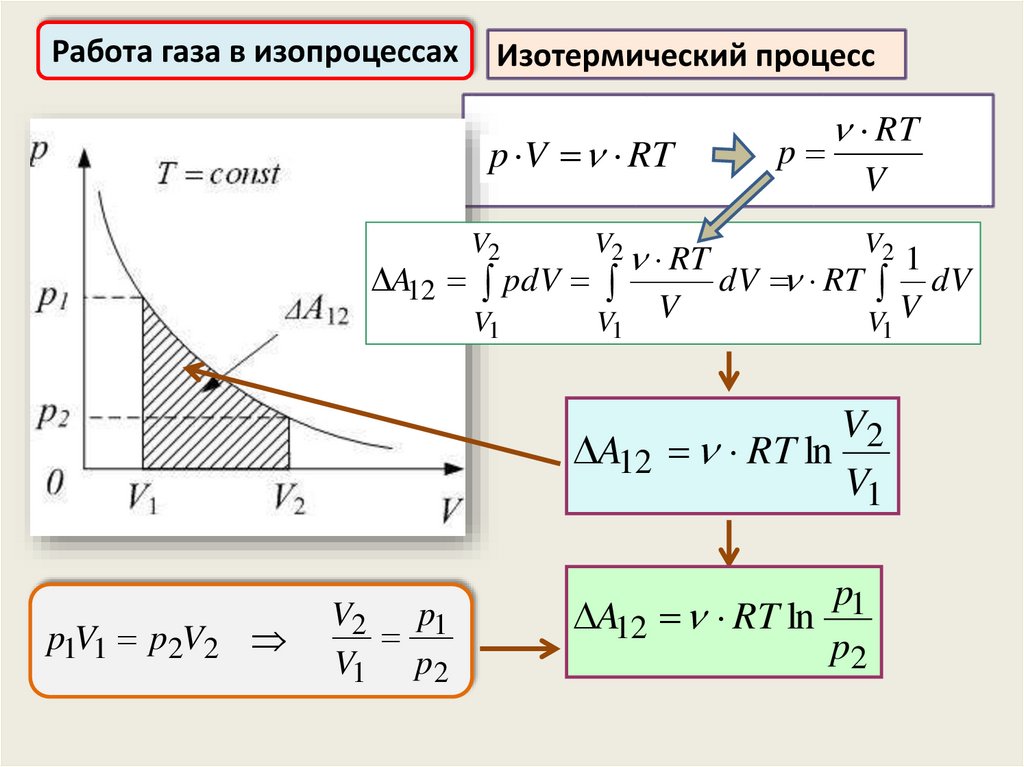
Работа газа в изопроцессахИзотермический процесс
p V RT
V2
V2
V1
V1
A12 pdV
RT
V
p
RT
V
V2
1
dV RT dV
V V
1
V2
A12 RT ln
V1
p1V1 p2V2
V2 p1
V1 p2
p1
A12 RT ln
p2
14.
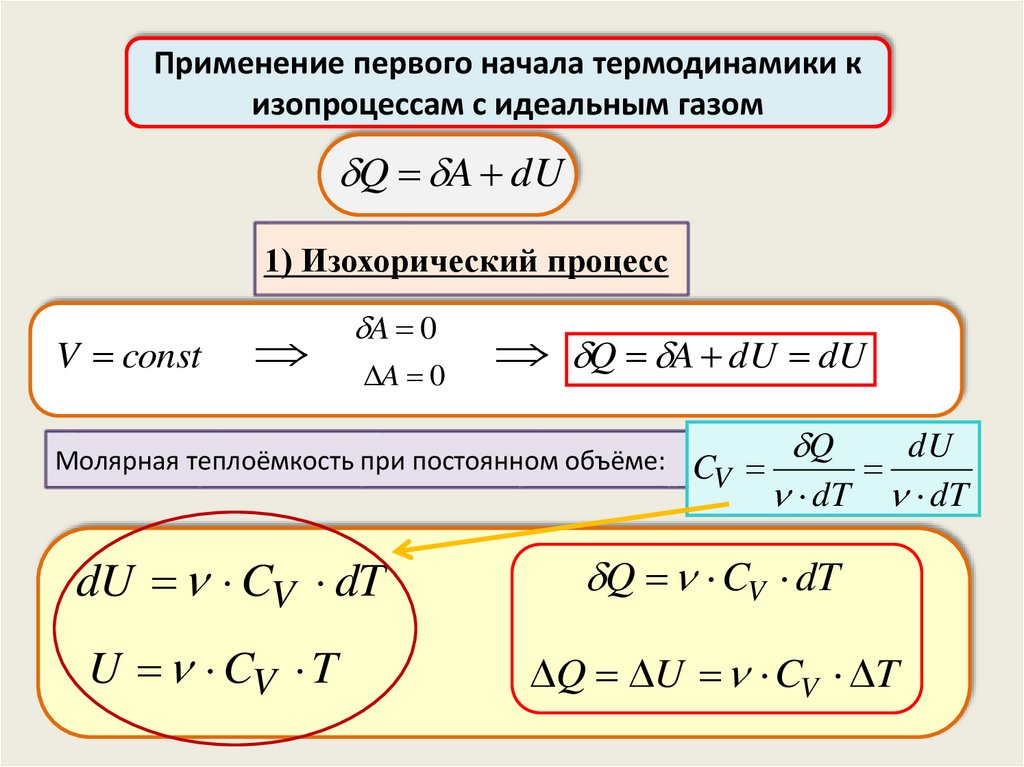
Применение первого начала термодинамики кизопроцессам с идеальным газом
Q A dU
1) Изохорический процесс
V const
A 0
A 0
Q A dU dU
Молярная теплоёмкость при постоянном объёме:
Q
dU
CV
dT dT
dU CV dT
Q CV dT
U CV T
Q U CV T
15.
Применение первого начала термодинамики кизопроцессам с идеальным газом
2) Изобарический процесс
p const
A R dT
Q A dU R dT CV dT
dU CV dT
Q R CV dT C p dT
Молярная теплоёмкость
при постоянном давлении:
Cp
Q
dT
C p R CV
Уравнение Майера
Теплоёмкость при постоянном объёме оказывается меньше, так как газ
не совершает работу, и для нагревания газа на 1 К теплоты
требуется меньше: как раз на величину R, имеющей смысл работы
одного моля газа при постоянном давлении
16.
CpCV
Показатель Пуассона по определению
C R
R
V
1
CV
CV
R
1
CV
1
pV
U CV T
R T
1
1
Q C p T
R T
1
R
CV
1
C p CV
1
p V
1
1
R
A
1
U CV T
R T
1
1
1
U
p V
A
1
1
В изобарном процессе
17.
CpCV
Показатель Пуассона
R
CV
1
В изохорическом процессе:
R
Q U CV T
T
1
1
Q U
R T2 T1
1
1
RT2 RT1
Q U
1
1
1
p2V p1V
Q U
V p
1
1
18.
Применение первого начала термодинамики кизопроцессам с идеальным газом
3) Изотермический процесс T const
dT 0
dU CV dT 0 U 0
Q A dU A p dV
V2
p1
Q A U A 0 RT ln
RT ln
V1
p2
19.
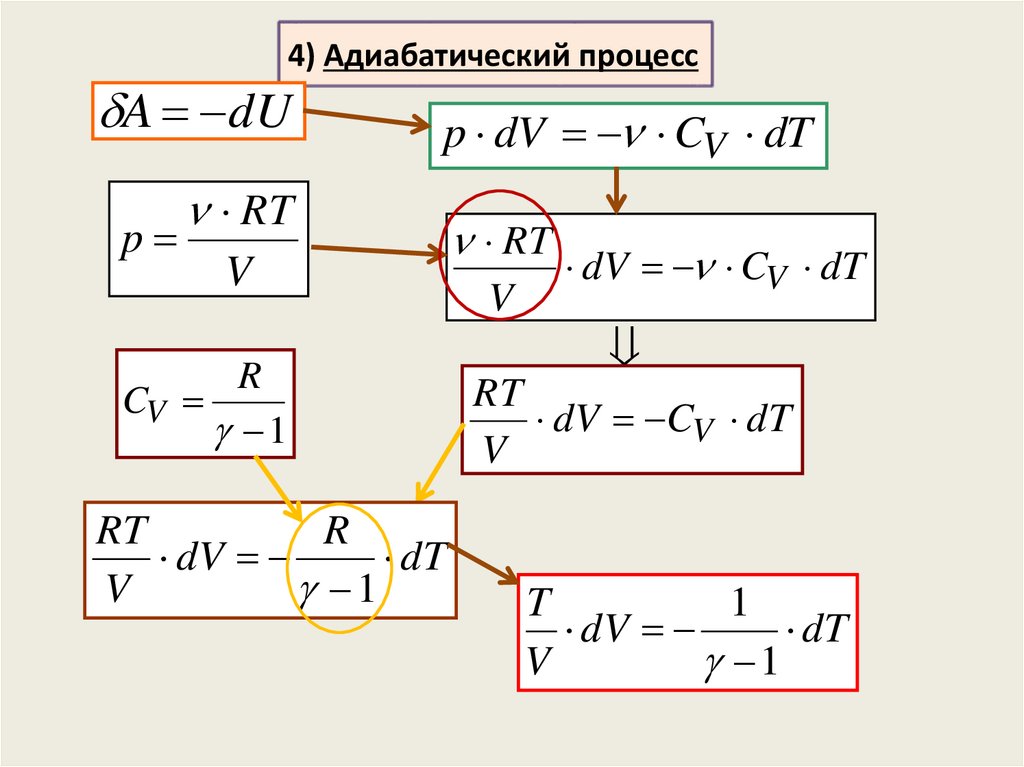
4) Адиабатический процесспротекает без теплообмена с
окружающей средой:
система не получает и не отдаёт теплоты
Q 0
Q 0
Адиабатными процессами будут процессы, протекающие
1) в системе с хорошей теплоизоляцией;
2) очень быстрые процессы, – система не успевает обменяться
теплотой с окружающей средой за время протекания процесса
По первому началу термодинамики:
Q A dU 0
A dU
20.
4) Адиабатический процессA dU
p
p dV CV dT
RT
V
R
CV
1
RT
R
dV
dT
V
1
RT
V
dV CV dT
RT
dV CV dT
V
T
1
dV
dT
V
1
21.
4) Адиабатический процессT
1
dV
dT
V
1
dV
dT
1
V
T
dV
dT
1 const
V
T
ln V 1 ln T const
1 ln V ln T const
ln T V 1 const
1 ln V ln T const
1
T V
const
22.
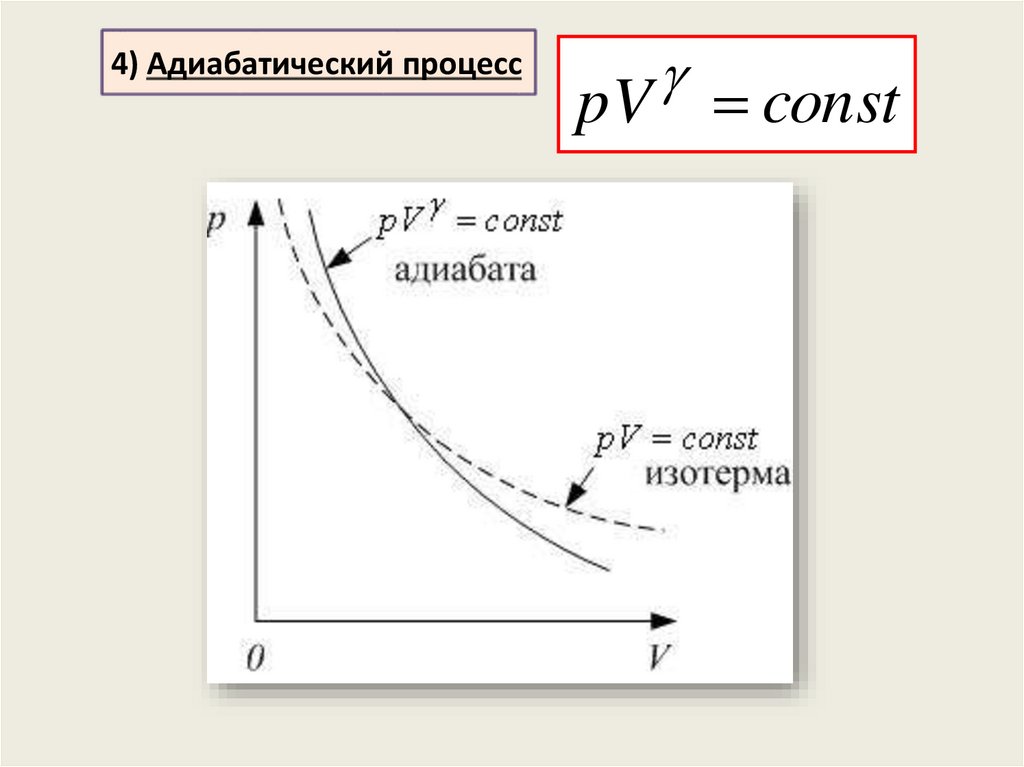
4) Адиабатический процессT V 1 const
p V
const
T
pV const
p V
const
T
1
T V
const
1 p V
T V
const
T
pV const
p V
p V
T
1
p
const
T const
23.
4) Адиабатический процессpV const
24.
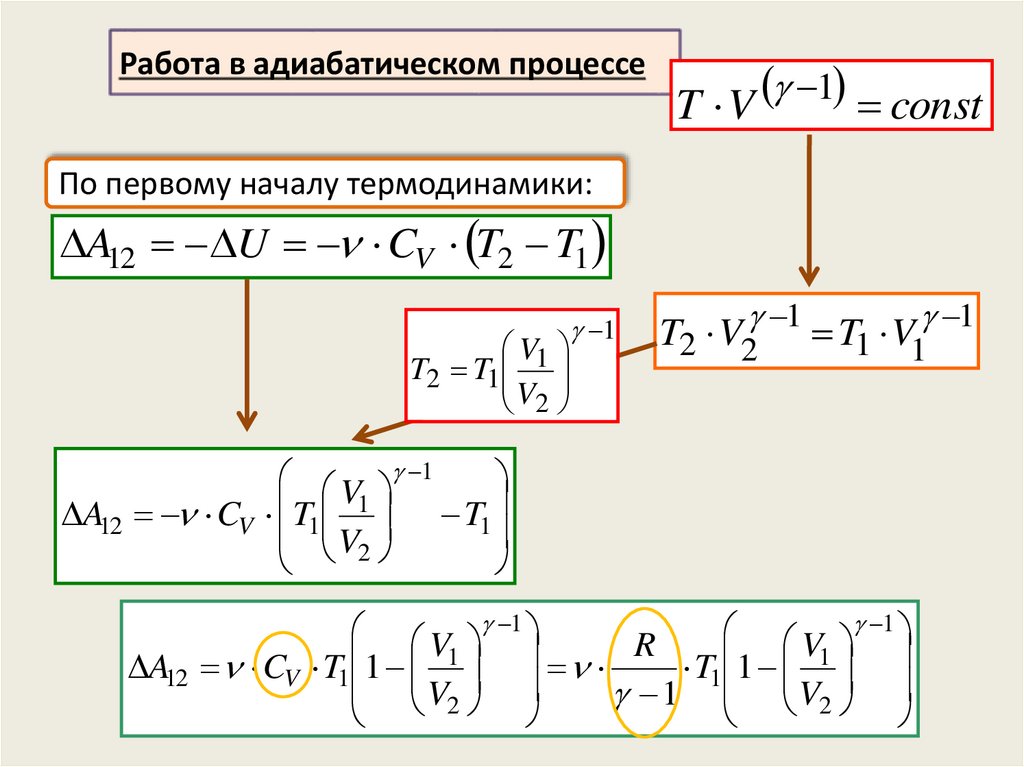
Работа в адиабатическом процессе1
T V
const
По первому началу термодинамики:
A12 U CV T2 T1
V1
T2 T1
V2
1
T2 V2 1 T1 V1 1
V 1
1
A12 CV T1 T1
V2
1
V 1
V1
R
1
A12 CV T1 1
T1 1
V2
1 V2
25.
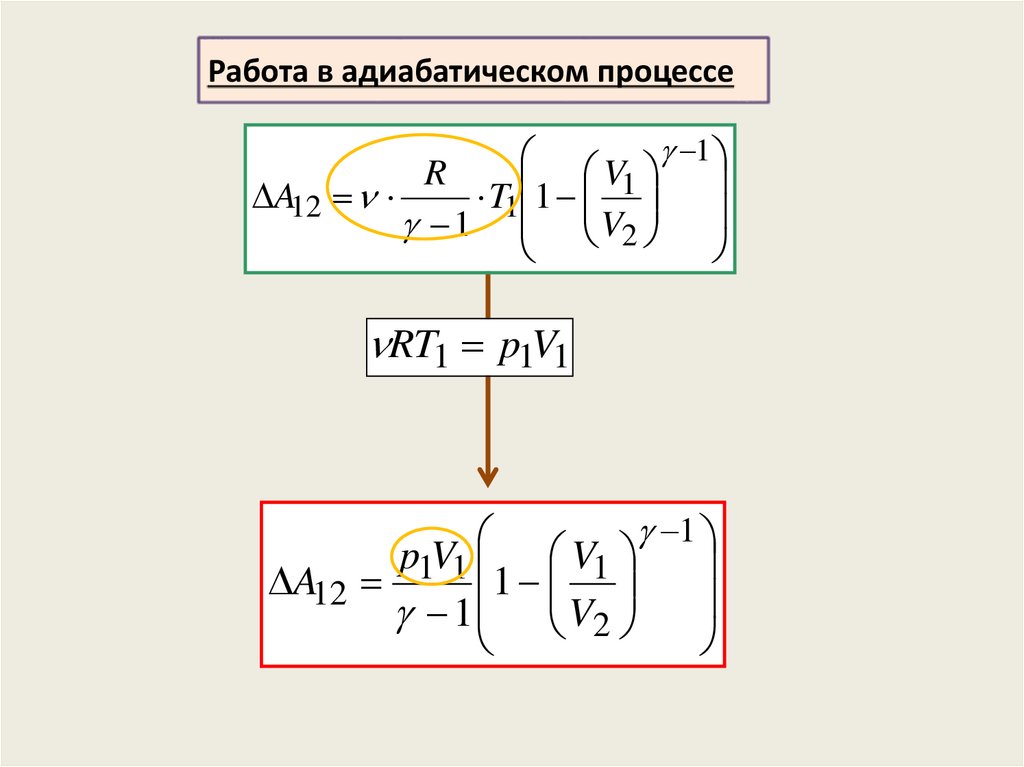
Работа в адиабатическом процессе1
V1
R
A12
T1 1
1 V2
RT1 p1V1
1
p1V1 V1
A12
1
1 V2















 physics
physics