Similar presentations:
15 Занятие № 18,19
1. Основы химических задач
Задания № 18 и 192. План
• Понятие массовой доли• Молярная масса молекулы
• Массовая доля элемента в веществе
• Практика по заданиям 18 и 19
3. Вопрос!
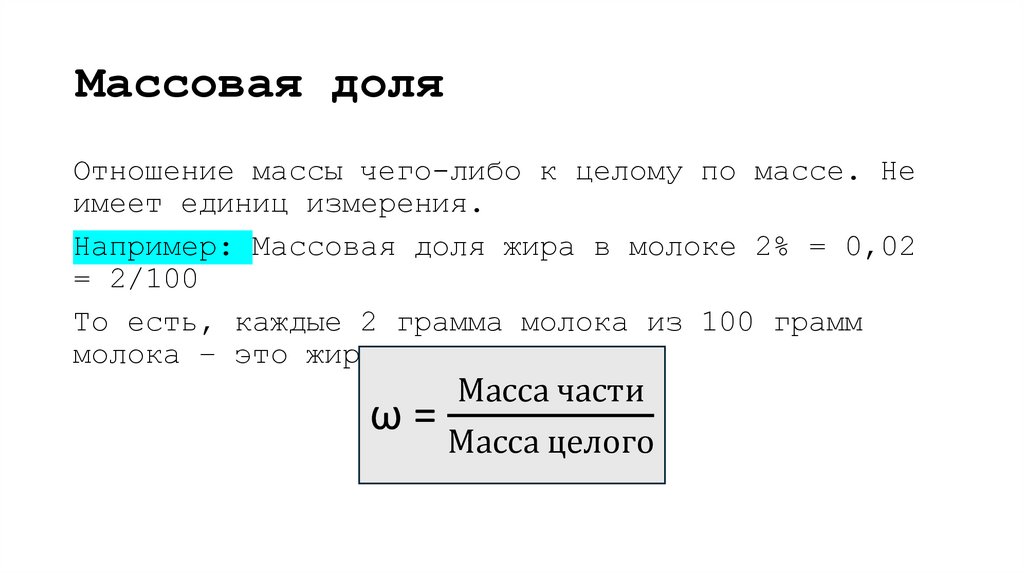
Что такое массовая доля? Приведите примеры.4. Массовая доля
Отношение массы чего-либо к целому по массе. Неимеет единиц измерения.
Например: Массовая доля жира в молоке 2% = 0,02
= 2/100
То есть, каждые 2 грамма молока из 100 грамм
молока – это жир
Масса части
ω=
Масса целого
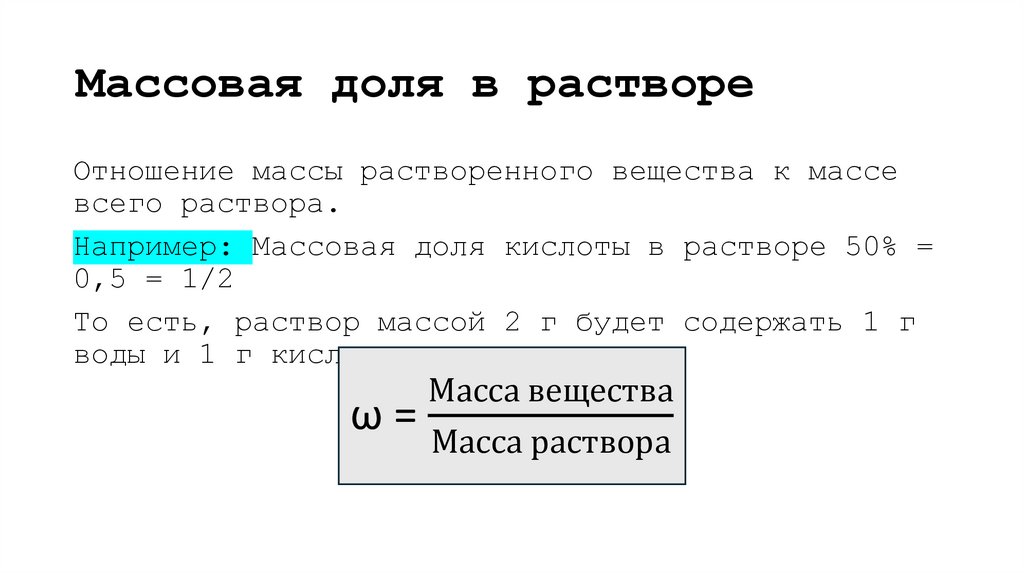
5. Массовая доля в растворе
Отношение массы растворенного вещества к массевсего раствора.
Например: Массовая доля кислоты в растворе 50% =
0,5 = 1/2
То есть, раствор массой 2 г будет содержать 1 г
воды и 1 г кислоты.
Масса вещества
ω=
Масса раствора
6. Массовая доля элемента
Отношение массы элемента к массе всего веществаМасса элемента
ω=
Масса вещества
ω =
Ar ∗n
∗ 100%
M
7. Молярная масса
Масса молекулы в г/моль, считается как суммамасс всех атомов в молекуле с учетом индексов у
атомов элементов в соединении.
M = Ar1 + Ar2 +
… + Arn
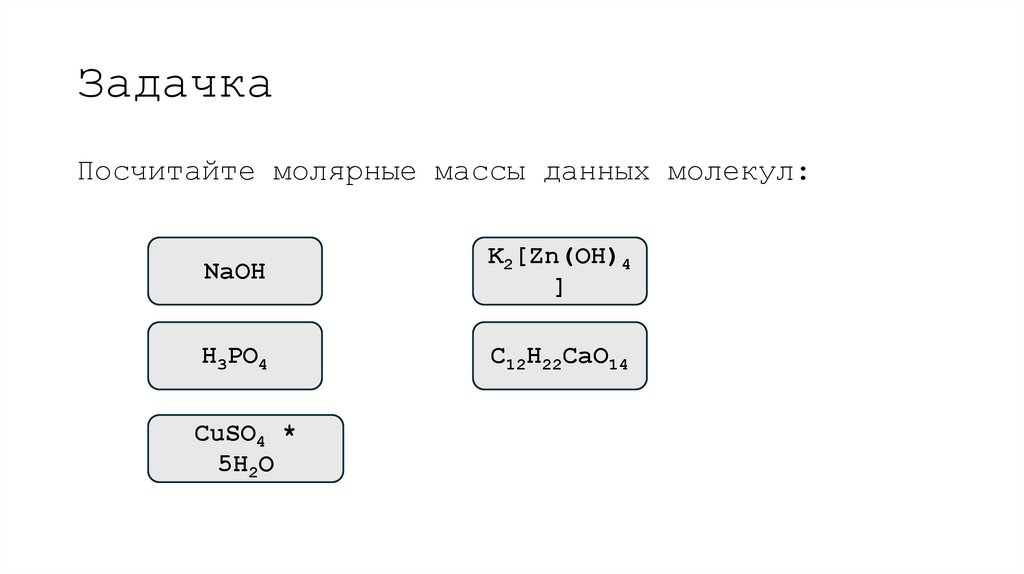
8. Задачка
Посчитайте молярные массы данных молекул:NaOH
K2[Zn(OH)4
]
H3PO4
C12H22CaO14
CuSO4 *
5H2O
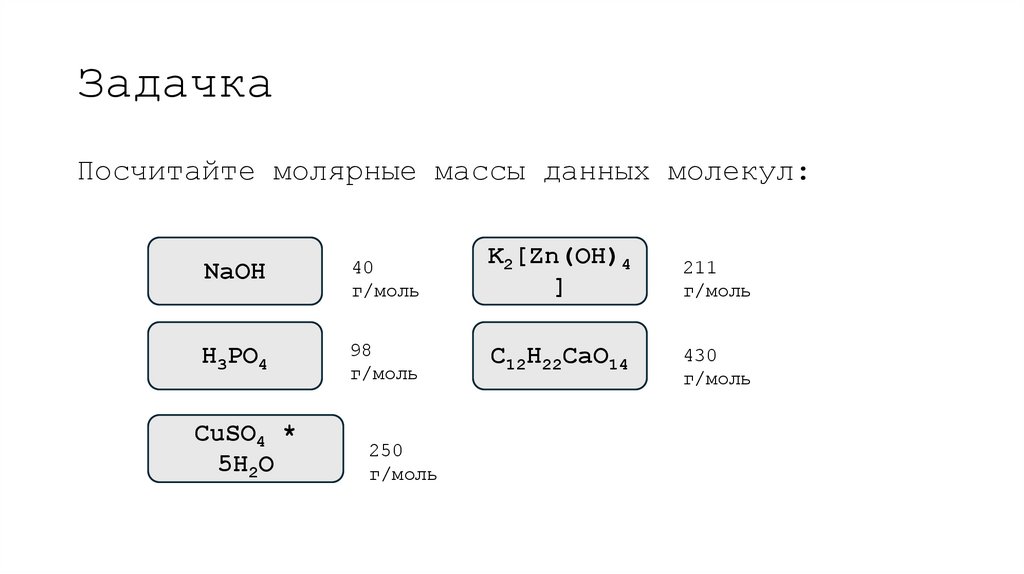
9. Задачка
Посчитайте молярные массы данных молекул:NaOH
40
г/моль
K2[Zn(OH)4
]
211
г/моль
H3PO4
98
г/моль
C12H22CaO14
430
г/моль
CuSO4 *
5H2O
250
г/моль
10. Соедини понятие с определением и формулой
Молярная массаОтношение массы всех
атомов одного элемента
к массе всего вещества
Массовая доля элемента
Масса молекулы в
г/моль, считается как
сумма масс всех атомов
в молекуле
ω =
Ar ∗n
∗ 100%
M
M = Ar1 + Ar2 + …
+ Arn
11. Задание № 18
Сильвин (хлорид калия) – химическое соединениеKCl, соль соляной кислоты, используется в
сельском хозяйстве в качестве калийного
удобрения.
Вычислите в процентах массовую долю калия в
хлориде калия. Запишите ответ в процентах с
точностью до десятых.
12. Задание № 18
Сильвин (хлорид калия) – химическое соединениеKCl, соль соляной кислоты, используется в
сельском хозяйстве в качестве калийного
удобрения.
Вычислите в процентах массовую долю калия в
хлориде калия. Запишите ответ в процентах с
точностью до десятых.
13. Алгоритм решения задания № 18
1. Находим молярную массу всей молекулы2. Массу элемента делим на молярную массу всей
молекулы
3. Переводим в проценты
4. Округляем, если требуется
Не забываем учитывать индексы
14. Задание № 18
Сильвин (хлорид калия) – химическое соединениеKCl, соль соляной кислоты, используется в
сельском хозяйстве в качестве калийного
удобрения.
Вычислите в процентах массовую долю калия в
хлориде калия. Запишите ответ в процентах с
точностью до десятых.
5
2
,
3
M = 39 + 35,5 = 74,5 г/моль
ω = 39 / 74,5 = 0, 5234…
0,5234… * 100% = 52,3%
15. Задание № 19
Кальциевая селитра – химическое соединениеCa(NO3)2 , соль азотной кислоты, используется как
азотное удобрение.
При подкормке бахчевых культур в почву вносится
2 кг азота на 100 м2 . Вычислите, сколько кг
кальциевой селитры (Ca(NO3)2 ) надо внести на
земельный участок площадью 1000 м2 . Запишите
число с точностью до целых
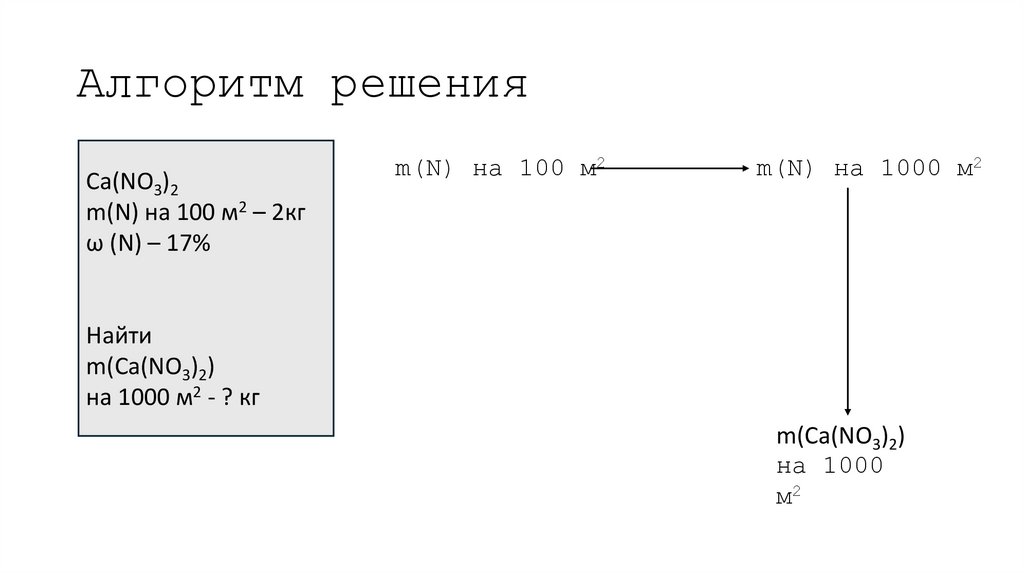
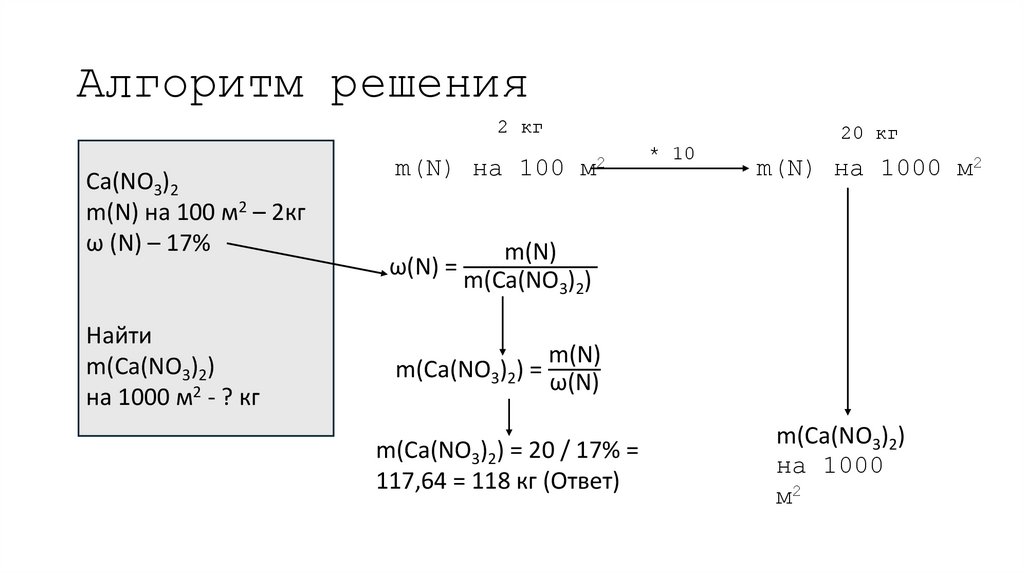
16. Алгоритм решения
Ca(NO3)2m(N) на 100 м2 – 2кг
ω (N) – 17%
m(N) на 100 м2
m(N) на 1000 м2
Найти
m(Ca(NO3)2)
на 1000 м2 - ? кг
m(Ca(NO3)2)
на 1000
м2
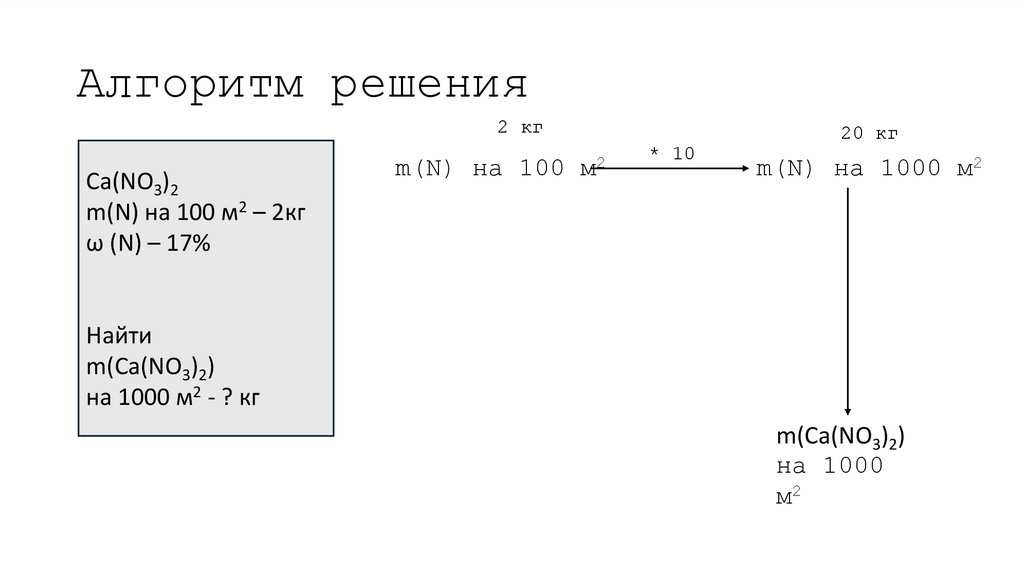
17. Алгоритм решения
2 кгCa(NO3)2
m(N) на 100 м2 – 2кг
ω (N) – 17%
m(N) на 100
20 кг
м2
* 10
m(N) на 1000 м2
Найти
m(Ca(NO3)2)
на 1000 м2 - ? кг
m(Ca(NO3)2)
на 1000
м2
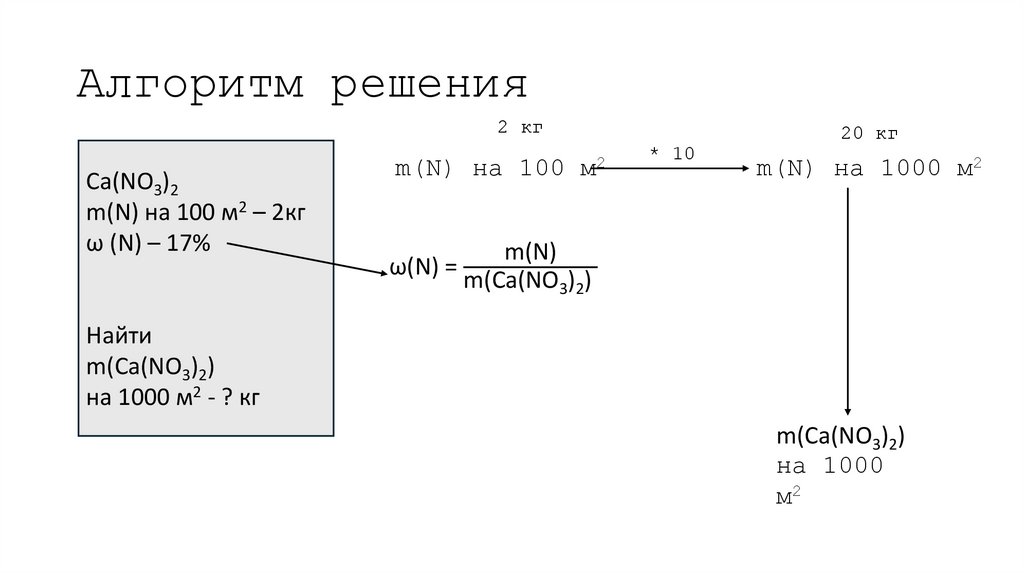
18. Алгоритм решения
2 кгCa(NO3)2
m(N) на 100 м2 – 2кг
ω (N) – 17%
m(N) на 100
ω(N) =
20 кг
м2
* 10
m(N) на 1000 м2
m(N)
m(Ca(NO3)2)
Найти
m(Ca(NO3)2)
на 1000 м2 - ? кг
m(Ca(NO3)2)
на 1000
м2
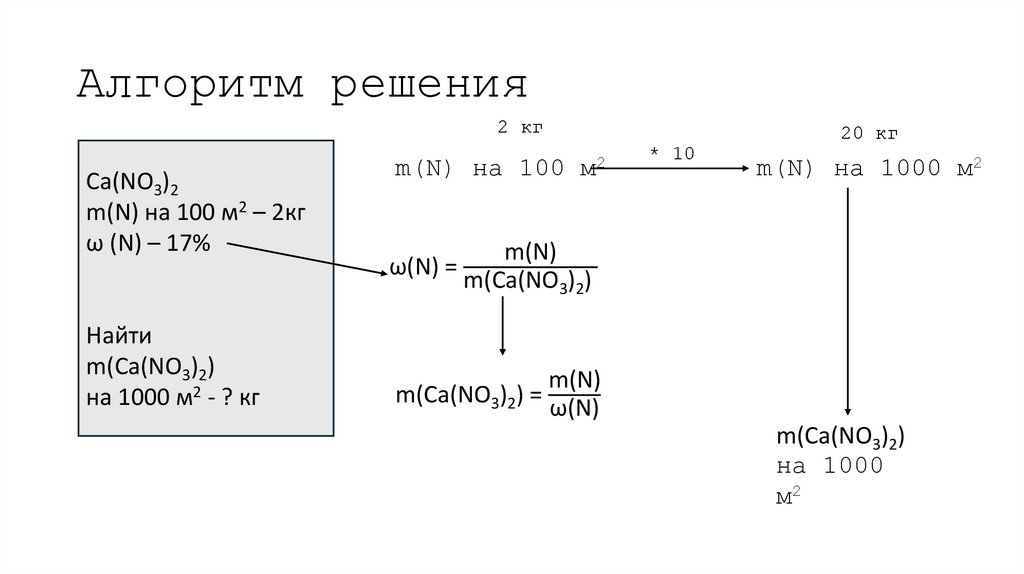
19. Алгоритм решения
2 кгCa(NO3)2
m(N) на 100 м2 – 2кг
ω (N) – 17%
Найти
m(Ca(NO3)2)
на 1000 м2 - ? кг
m(N) на 100
ω(N) =
20 кг
м2
* 10
m(N) на 1000 м2
m(N)
m(Ca(NO3)2)
m(N)
m(Ca(NO3)2) =
ω(N)
m(Ca(NO3)2)
на 1000
м2
20. Алгоритм решения
2 кгCa(NO3)2
m(N) на 100 м2 – 2кг
ω (N) – 17%
Найти
m(Ca(NO3)2)
на 1000 м2 - ? кг
20 кг
m(N) на 100
ω(N) =
м2
* 10
m(N) на 1000 м2
m(N)
m(Ca(NO3)2)
m(Ca(NO3)2) =
m(N)
ω(N)
m(Ca(NO3)2) = 20 / 17% =
117,64 = 118 кг (Ответ)
m(Ca(NO3)2)
на 1000
м2
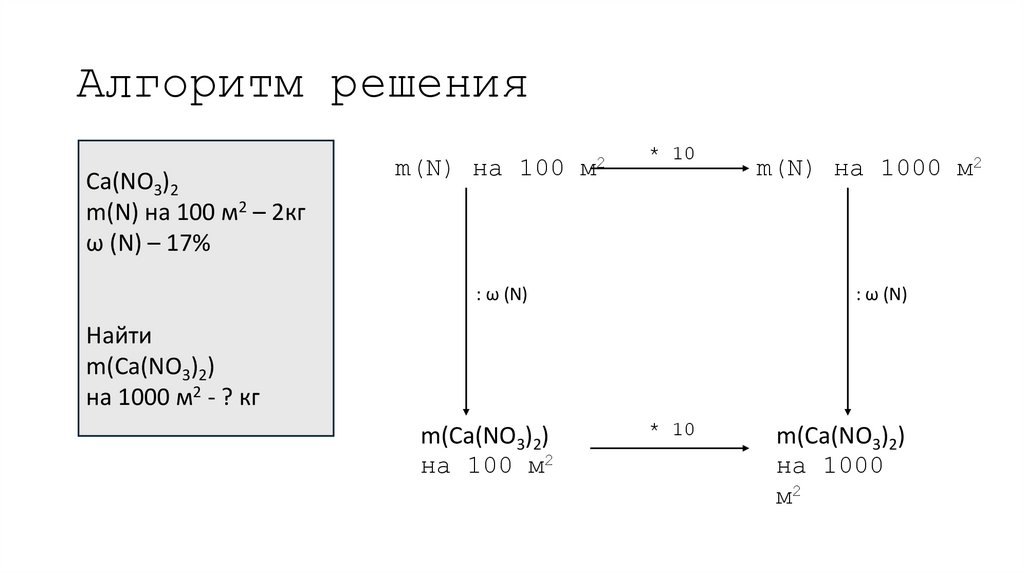
21. Алгоритм решения
Ca(NO3)2m(N) на 100 м2 – 2кг
ω (N) – 17%
m(N) на 100
м2
* 10
: ω (N)
m(N) на 1000 м2
: ω (N)
Найти
m(Ca(NO3)2)
на 1000 м2 - ? кг
m(Ca(NO3)2)
на 100 м2
* 10
m(Ca(NO3)2)
на 1000
м2
22. Практика
Задание № 1Хлорат калия – химическое соединение KClO3 ,
используется в приготовлении смеси для
воспламеняющихся головок спичек.
Вычислите в процентах массовую долю хлора в
хлорате калия. Запишите число с точностью до
целых.
23. Практика
Задание № 1Хлорат калия – химическое соединение KClO3 ,
используется в приготовлении смеси для
воспламеняющихся головок спичек.
Вычислите в процентах массовую долю хлора в
хлорате калия. Запишите число с точностью до
целых.
Решение:
1) Формула хлората калия – KClO3.
Его молярная масса: М(KClO3) = 1*39+1*35,5+3*16
= 122,5 г/моль
2) Массовая доля хлора вычисляется по формуле: ω
= М(Cl) / M(KClO3) = 35,5 / 122,5 = 0,2898 или 28,98%
3)Округляем до целых: 29%
24. Практика
Задание № 2Хлорат калия – химическое соединение KClO3 ,
используется в приготовлении смеси для
воспламеняющихся головок спичек.
Для производства одного коробка спичек требуется
2 г хлората калия. Какая масса хлора (в г)
содержится в смеси, необходимой для производства
7 спичечных коробков? Ответ дайте с точностью до
сотых.
25. Практика
Задание № 2Хлорат калия – химическое соединение KClO3 ,
используется в приготовлении смеси для воспламеняющихся
головок спичек.
Для производства одного коробка спичек требуется 2 г
хлората калия. Какая масса хлора (в г) содержится в
смеси,
необходимой для производства
7 спичечных
Решение:
4) Составляем пропорцию:
коробков?
Ответкалия
дайте
с 3точностью
до сотых.
1) Формула хлората
– KClO
.
1 коробок
– 2 г
Его молярная масса: М(KClO3) =
1*39+1*35,5+3*16 = 122,5 г/моль
2) Массовая доля хлора вычисляется по
формуле: ω = М(Cl) / M(KClO3) = 35,5 / 122,5 =
0,2898 или 28,98%
3)Округляем до целых: 29% (берем ответ
из задания № 18
7 коробков – х г
Отсюда: х = 7 * 2 / 1 = 14 г соли
хлората калия в 7 спичечных коробках.
5) Значит хлора будет : 14*29/100 =
4,06 г или 14*0,29 = 4,06
Ответ: 4,06
26. Практика
Задание № 3Железо, используемое для выплавки различных элементов
оборудования, получают при переработке оксида железа
(III) Fe2O3.
Вычислите в процентах массовую долю железа в оксиде
железа (III). В ответ запишите число с точностью до
целых.
27. Практика
Задание № 3Железо, используемое для выплавки различных элементов
оборудования, получают при переработке оксида железа
(III) Fe2O3.
Вычислите в процентах массовую долю железа в оксиде
железа (III). В ответ запишите число с точностью до
целых.
Решение:
1) Формула оксида железа (III) Fe2O3.
Его молярная масса: М(Fe2O3) =
2*56+3*16 = 160 г/моль
2) Массовая доля вычисляется по
формуле: ω = М(Fe) / M(Fe2O3) = 56 * 2 / 160 = 0,7
или 70%
3)Округляем до целых: 70%
Ответ : 70
28. Практика
Задание № 4Железо, используемое для выплавки различных элементов
оборудования, получают при переработке оксида железа
(III) Fe2O3.
Для приготовления сплава для выплавки одного элемента
оборудования требуется 800 г чистого железа. Вычислите,
сколько килограмм оксида железа (III) потребуется
переработать, чтобы выплавить 9 элементов оборудования.
Запишите ответ с точностью до целых.
29. Практика
Задание № 4Железо, используемое для выплавки различных элементов
оборудования, получают при переработке оксида железа
(III) Fe2O3.
Для приготовления сплава для выплавки одного элемента
оборудования требуется 800 г чистого железа. Вычислите,
сколько килограмм оксида железа (III) потребуется
переработать,
чтобы выплавить 94)элементов
оборудования.
Решение:
Составляем пропорцию:
Запишите
ответжелеза
с точностью
1) Формула оксида
(III) Fe2O3.до целых.
1 элемент – 800 г
Его молярная масса: М(Fe2O3) =
2*56+3*16 = 160 г/моль
2) Массовая доля вычисляется по
формуле: ω = М(Fe) / M(Fe2O3) = 56 * 2 / 160 = 0,7
или 70%
3)Округляем до целых: 70%
9 элементов – х г
Отсюда: х = 800*9 / 1 = 7200 г
5) Значит железа требуется :
7200*100/70 = 10 286 г = 10, 286 кг =
10 кг
Ответ: 10
30. Практика
Задание № 5Нитрат калия ( калийная селитра) – химическое
соединение KNO3, используется в качестве ценного
удобрения.
Вычислите в процентах массовую долю азота в нитрате
калия. Ответ округлите до сотых.
31. Практика
Задание № 5Нитрат калия ( калийная селитра) – химическое
соединение KNO3, используется в качестве ценного
удобрения.
Вычислите в процентах массовую долю азота в нитрате
калия. Ответ округлите до сотых.
Решение:
1) Формула нитрата калия: KNO3.
Его молярная масса: М(KNO3) = 39 + 14
+ 3 * 16 = 101 г/моль
2) Массовая доля вычисляется по
формуле: ω = М(N) / M(KNO3) = 14 / 101 = 0,1386
или 13,86%
Ответ : 13,86
32. Практика
Задание № 6Нитрат калия ( калийная селитра) – химическое
соединение KNO3, используется в качестве ценного
удобрения.
Для подкормки растений в почву вносят 5 г азота на один
квадратный метр. Какую массу (в граммах) калийной
селитры нужно взять для подкормки 150 м2 почвы? Запишите
число с точностью до целых.
33. Практика
Задание № 6Нитрат калия ( калийная селитра) – химическое
соединение KNO3, используется в качестве ценного
удобрения.
Для подкормки растений в почву вносят 5 г азота на один
квадратный метр. Какую массу (в граммах) калийной
2 почвы? Запишите
селитры
нужно
взять
для
подкормки
150
м
Решение:
число
с точностью
доKNO
целых.
3) (5 г * 150) / 0,1386 = 5411 г
1) Формула
нитрата калия:
3.
Его молярная масса: М(KNO3) = 39 + 14
+ 3 * 16 = 101 г/моль
2) Массовая доля вычисляется по
формуле: ω = М(N) / M(KNO3) = 14 / 101 = 0,1386
или 13,86%
Ответ : 13,86
Ответ: 5411