Similar presentations:
Готовимся к экзамену по химии. Методическое пособие
1.
Методическое пособие«Готовимся к экзамену по химии»
9 класс
Составитель: учитель химии
МБОУ СОШ №12
Нечаева Г.М.
2.
Повтори формулы ипонятия
3.
Массовая доля(ω) компонента в смеси:Объёмная доля(φ) компонента в газовой смеси:
Массовая доля(ω) растворённого вещества:
ω(чистого вещества)=1- ω(примесей)
4.
Массовая доля(η) выхода продукта реакции:Объёмная доля(η) выхода продукта реакции:
Молярная концентрация(C):
n – количество вещества(моль, кмоль, моль,
тмоль)
m – масса(г, кг, мг, т)
V – объём(л, , мл)
5.
Количество вещества - это физическаявеличина, прямо пропорциональная числу
частиц, составляющих данное вещество и
входящих во взятую порцию этого вещества.
Единица количества вещества - моль - отвечает
такому количеству вещества, которое содержит
6,02·1023 частиц этого вещества
(число Авогадро). Если числу Авогадро
приписать единицу измерения моль−1, то
получится физическая константа - постоянная
Авогадро (обозначение NА):
NА=6,02·1023моль−1
6.
МОЛЬ - это КОЛИЧЕСТВО ВЕЩЕСТВА,равное 6,02.1023 структурных единиц
данного вещества – молекул (если вещество
состоит из молекул), атомов (если это
атомарное вещество), ионов (если вещество
является ионным соединением).
1 моль (1 М) воды = 6.1023 молекул Н2О,
1 моль (1 М) железа = 6.1023 атомов Fe,
1 моль (1 М) хлора = 6.1023 молекул Cl2.
7.
Масса одного моля веществаназывается МОЛЯРНОЙ МАССОЙ.
Она обозначается буквой М и имеет
размерность г/моль. Количество молей
вещества n находят из отношения
массы m этого вещества (г) к его
молярной массе М (г/моль). Молярная
масса М – постоянная величина для
каждого конкретного вещества.
8.
Справедлива формула,объединяющая основные расчёты
с количеством вещества:
9.
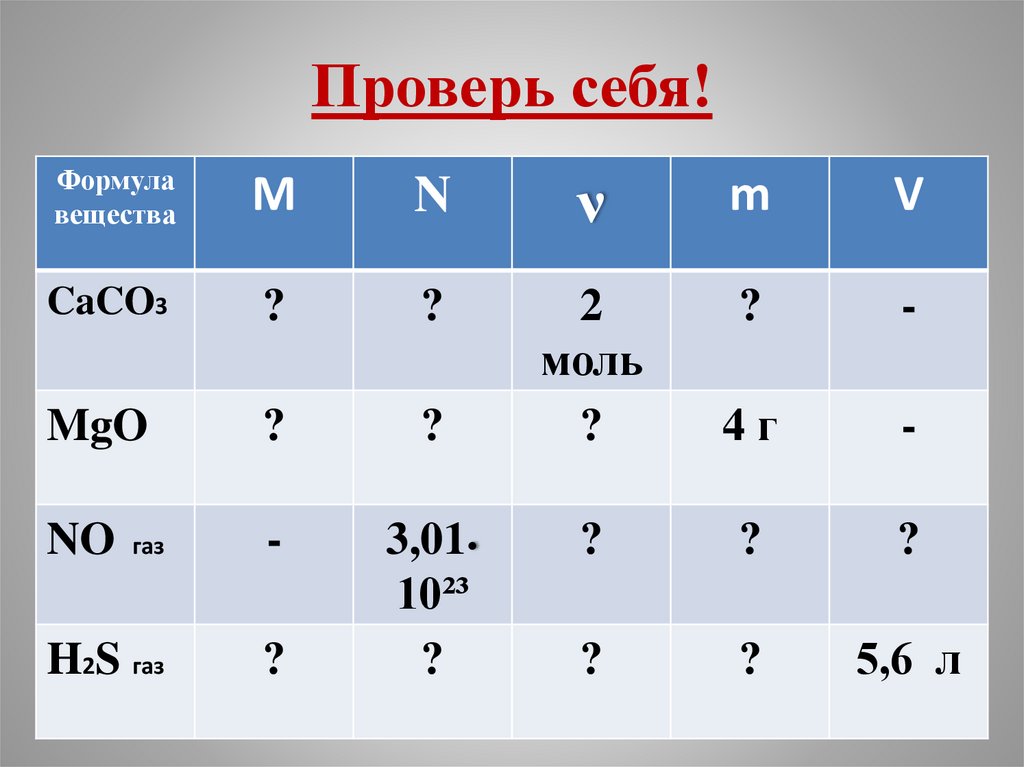
Проверь себя!Формула
вещества
M
N
ν
m
V
CaCO3
?
?
?
-
MgO
?
?
2
моль
?
4г
-
NO
газ
-
?
?
?
H2S газ
?
3,01
10²³
?
?
?
5,6 л
10.
Расчетыпо уравнению
химической реакции
11.
Мольные соотношения участников реакцииРассмотрим уравнение реакции образования воды
из простых веществ:
2H2 + O2 = 2H2O
Можно сказать, что из двух молекул водорода и
одной молекулы кислорода образуется две
молекулы воды. С другой стороны, эта же запись
говорит о том, что для образования каждых двух
молей воды нужно взять два моля водорода один
моль кислорода.
Мольное соотношение участников реакции
помогает производить важные для химического
синтеза расчеты. Рассмотрим примеры таких
расчетов.
12.
ЗадачаОпределим массу воды, образовавшуюся в результате сгорания водорода в 3,2
г кислорода.
Чтобы решить эту задачу, сначала необходимо составить уравнение
химической реакции и записать над ним данные условия задачи.
Если бы мы знали количество вещества вступившего в реакцию кислорода,
то смогли бы определить количество вещества воды. А затем, рассчитали бы
массу воды, зная ее количество вещества и молярную массу. Чтобы найти
количество вещества кислорода, нужно массу кислорода разделить на его
молярную массу.
Молярная масса численно равна относительной молекулярной массе. Для
кислорода это значение составляет 32. Подставим в формулу: количество
вещества кислорода равно отношению 3,2 г к 32 г/моль. Получилось 0,1 моль.
Для нахождения количества вещества воды оставим пропорцию, используя
мольное соотношение участников реакции:
на 0,1 моль кислорода приходится неизвестное количество вещества воды, а
на 1 моль кислорода приходится 2 моля воды.
Отсюда количество вещества воды равно 0,2 моль.
Чтобы определить массу воды, нужно найденное значение количества воды
умножить на ее молярную массу, т.е. умножаем 0,2 моль на 18 г/моль,
получаем 3,6 г воды.
13.
Расчеты по термохимическимуравнениям.
Вычисление количества теплоты по
известной массе вещества.
Пример. По термохимическому уравнению
2Сu + О2 = 2СuО + 310 кДж
вычислите количество теплоты,
выделяющейся в результате окисления
порции
массой 16 г.
14.
Последовательность выполнения действийОформление решения задачи
С помощью соответствующих
обозначений запишем условие задачи,
найдем молярную массу вещества, о
котором идет речь в условии задачи
Дано:
mСu)=16г
Qреакции=310кДж
Q=?
M(Cu)=64 г/моль
Найдем количество вещества, масса
которого дана в условии задачи
Запишем термохимическое уравнение
реакции
Над формулами веществ надпишем
сведения о количестве вещества,
найденном из условия задачи, а под
формулой — соотношение,
отображаемое уравнением реакции
Решение:
n(Cu)= =0,25 моль
2Сu+О2=2СuО+310кДж
Вычислим количество вещества, массу
которого требуется найти. Для этого
составим пропорцию
=
откуда х=38,75.
Следовательно, Q=38,75 кДж
Запишем ответ
Ответ: Q=38,75 кДж
0,25 моль
? кДж
2Сu + О2 = 2СиО + 310 кДж
2 моль
15.
Вычисление массы вещества в растворе помассе раствора и массовой доле
растворенного вещества
Пример. Вычислите массу гидроксида натрия,
необходимого для приготовления
400 г 20%-го раствора гидроксида натрия.
16.
Последовательность выполнениядействий
Оформление решения задачи
С помощью соответствующих
обозначений запишем условие задачи.
Выразим массовую долю вещества с
помощью десятичной дроби (для этого
значение массовой доли, выраженной в
процентах, поделим на 1ОО, перенеся
запятую на два знака влево)
Дано:
mр.ра(NaOH)=400г
wNaOH)=20%, или 0,2
------------------mв-ва(NaOH)=?г
Запишем формулу для расчета массовой Решение:
доли вещества в растворе
w=
Преобразуем данную формулу для
расчета массы вещества
mв-ва=mр-ра•w
Подставим цифровые данные в эту
формулу и произведем расчет
mв.ва(МаОН)=400г•0,2=80 г
Запишем ответ
Ответ: mв.ва(МаОН)=80 г
17.
Расчет по химическому уравнениюобъемных отношений газов
Пример. Вычислите объем кислорода, необходимого
для сжигания порции ацетилена объемом 50 л.
18.
Последовательность выполнениядействий
С помощью соответствующих
обозначений запишем условие задачи
Оформление решения задачи
Дано:
V(С2Н2)=50 л
---------V(02)=? л
Запишем уравнение реакции. Расставим Решение:
коэффициенты
2С2Н2 + 5О2 = 4СО2 + 2Н2О
Над формулами веществ запишем
50л
?л
данные об объемах газообразных
2С2Н2 + 5О2 = 4СО2 + 2Н2О
веществ, известные из условия задачи, а 2 моль 5 моль
под формулами —
стехиометрические соотношения,
отображаемые уравнением реакции,
которые для газов, согласно закону
Авогадро, равны
их объемным отношениям
Вычислим объем вещества, который
= ,откуда х=125 л.
требуется найти. Для этого составим
Следовательно, V(О2)=125л.
пропорцию
Запишем ответ
Ответ: V(O2) = 1 25 л
19.
Повторитеорию
20.
21.
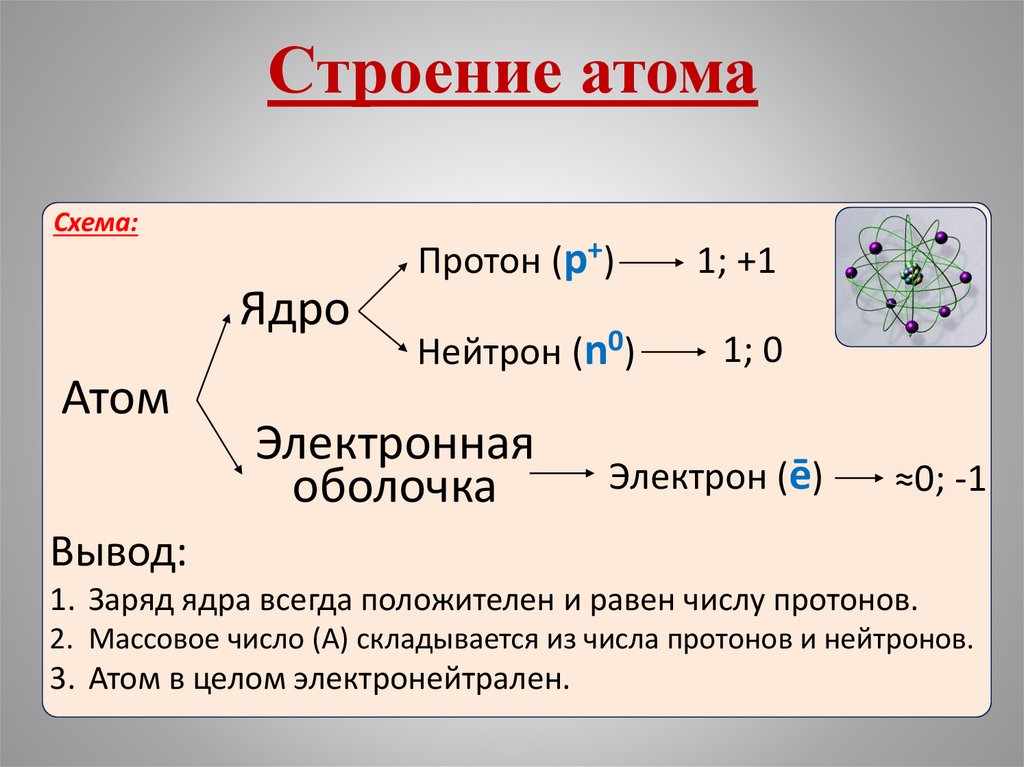
Строение атомаСхема:
Протон (p+)
Ядро
Атом
Нейтрон (n0)
Электронная
оболочка
1; +1
1; 0
Электрон (ē)
≈0; -1
Вывод:
1. Заряд ядра всегда положителен и равен числу протонов.
2. Массовое число (A) складывается из числа протонов и нейтронов.
3. Атом в целом электронейтрален.
22.
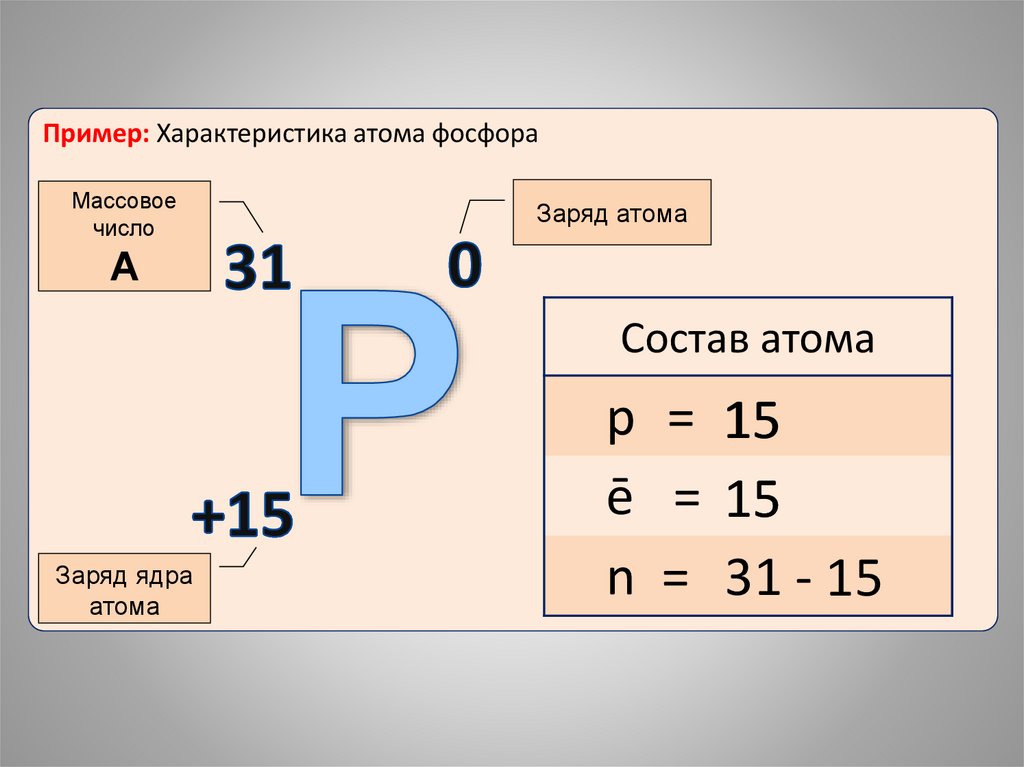
Пример: Характеристика атома фосфораМассовое
число
Заряд атома
A
Состав атома
Заряд ядра
атома
p = 15
ē = 15
n = 31 - 15
23.
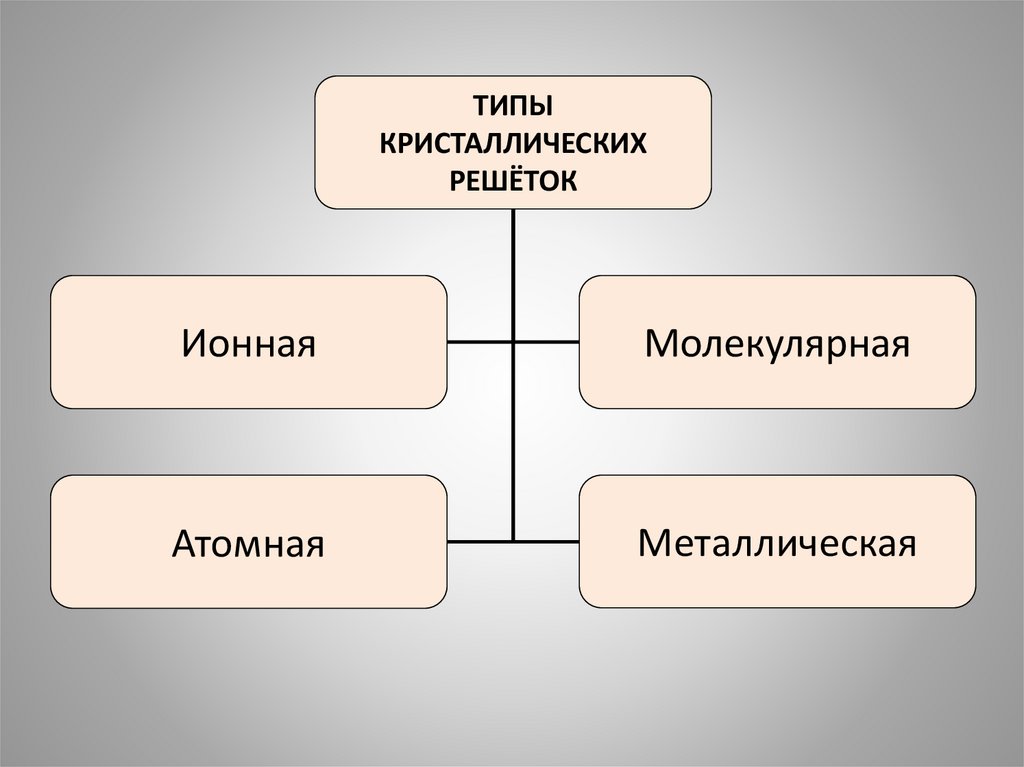
ТИПЫКРИСТАЛЛИЧЕСКИХ
РЕШЁТОК
Ионная
Молекулярная
Атомная
Металлическая
24.
Окислительно –восстановительные
реакции
25.
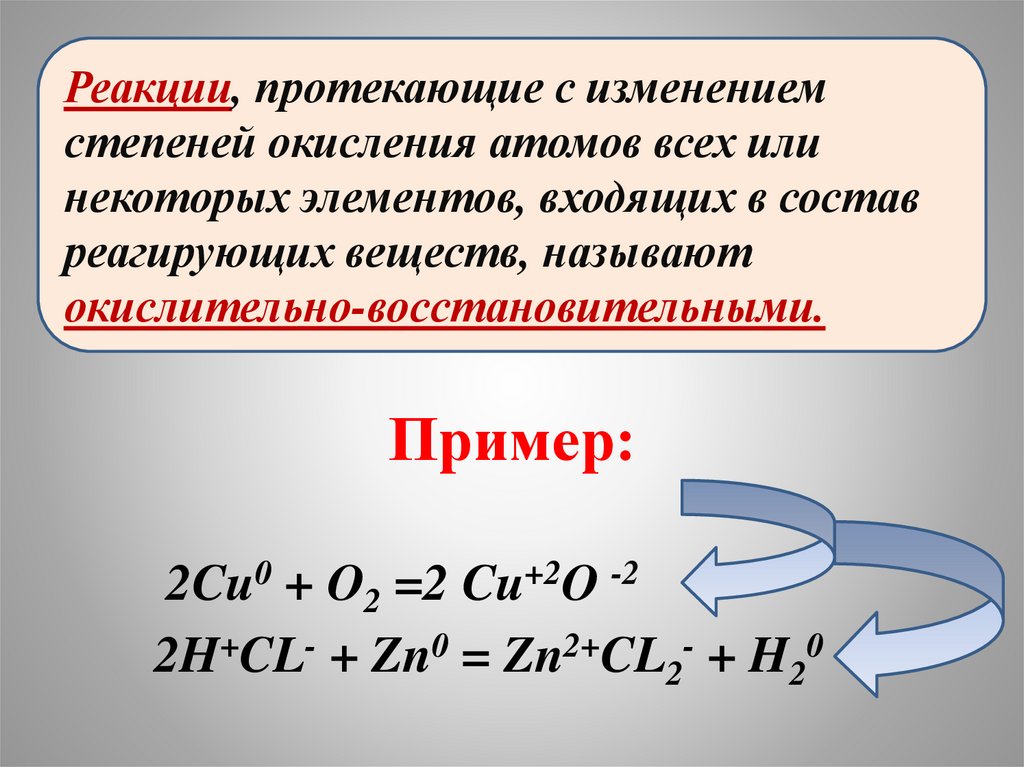
Реакции, протекающие с изменениемстепеней окисления атомов всех или
некоторых элементов, входящих в состав
реагирующих веществ, называют
окислительно-восстановительными.
Пример:
2Cu0 + O2 =2 Cu+2O -2
2H+CL- + Zn0 = Zn2+CL2- + H20
26.
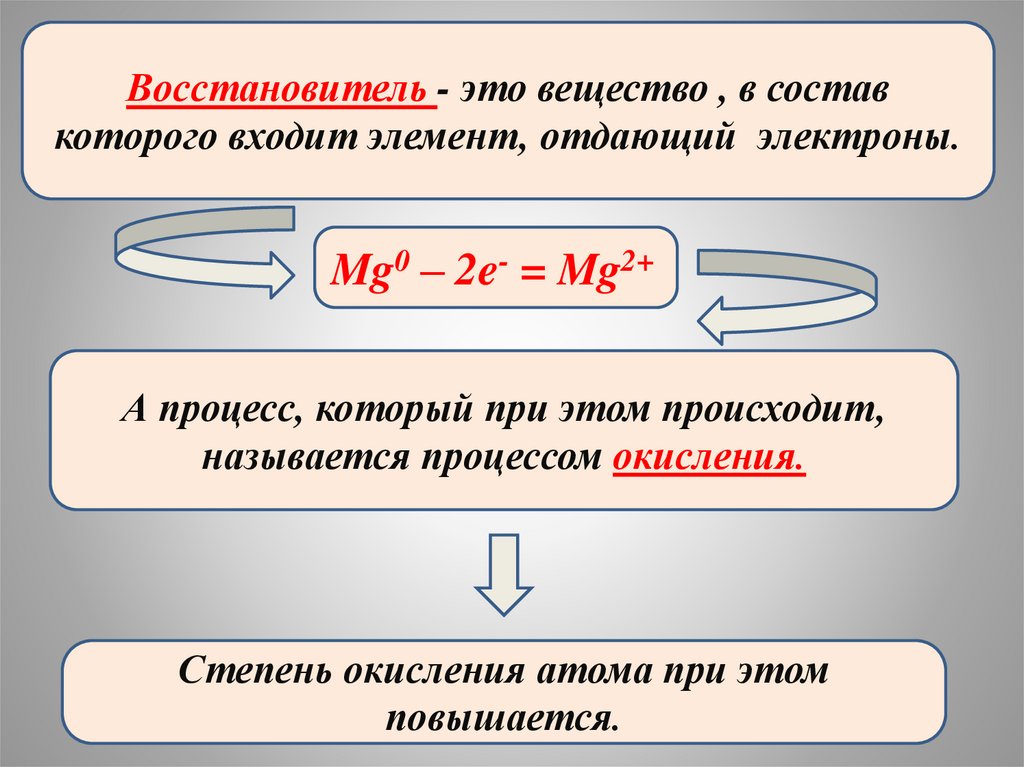
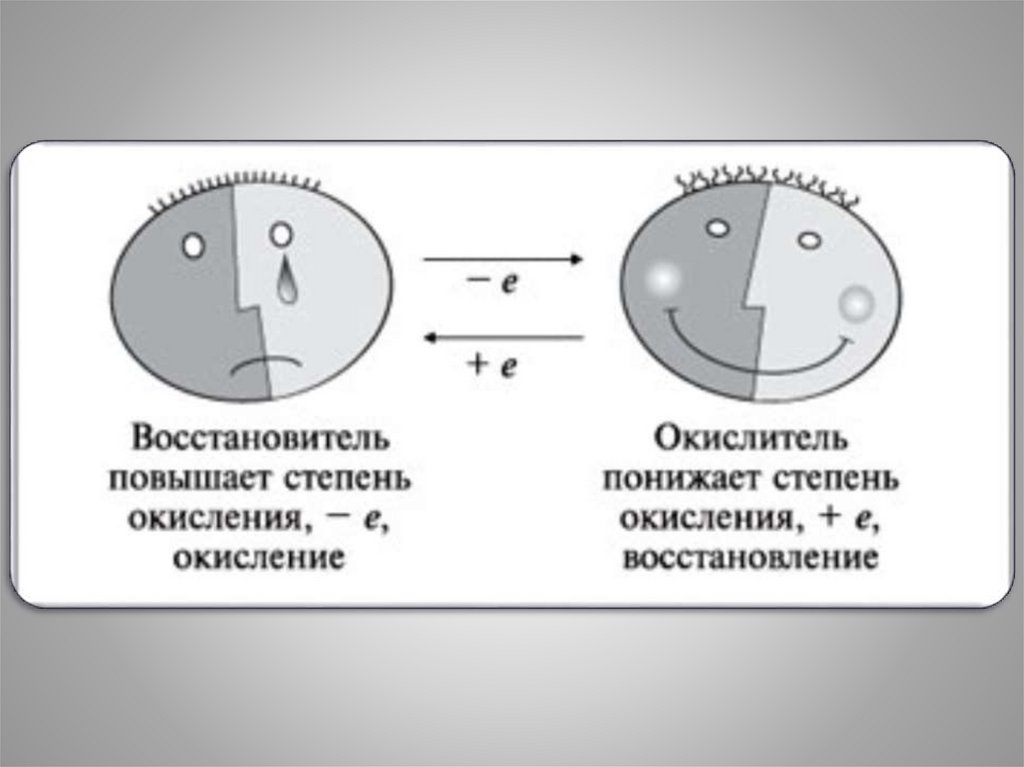
Восстановитель - это вещество , в составкоторого входит элемент, отдающий электроны.
Mg0 – 2e- = Mg2+
А процесс, который при этом происходит,
называется процессом окисления.
Степень окисления атома при этом
повышается.
27.
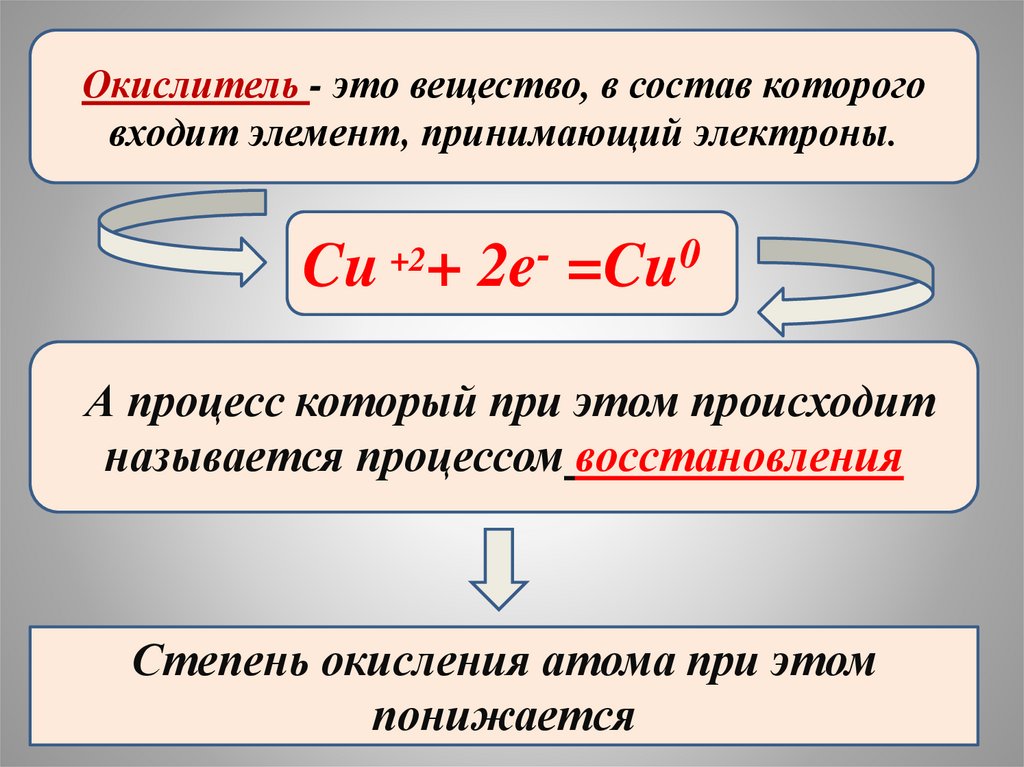
Окислитель - это вещество, в состав котороговходит элемент, принимающий электроны.
Cu +2+ 2e- =Cu0
А процесс который при этом происходит
называется процессом восстановления
Степень окисления атома при этом
понижается
28.
29.
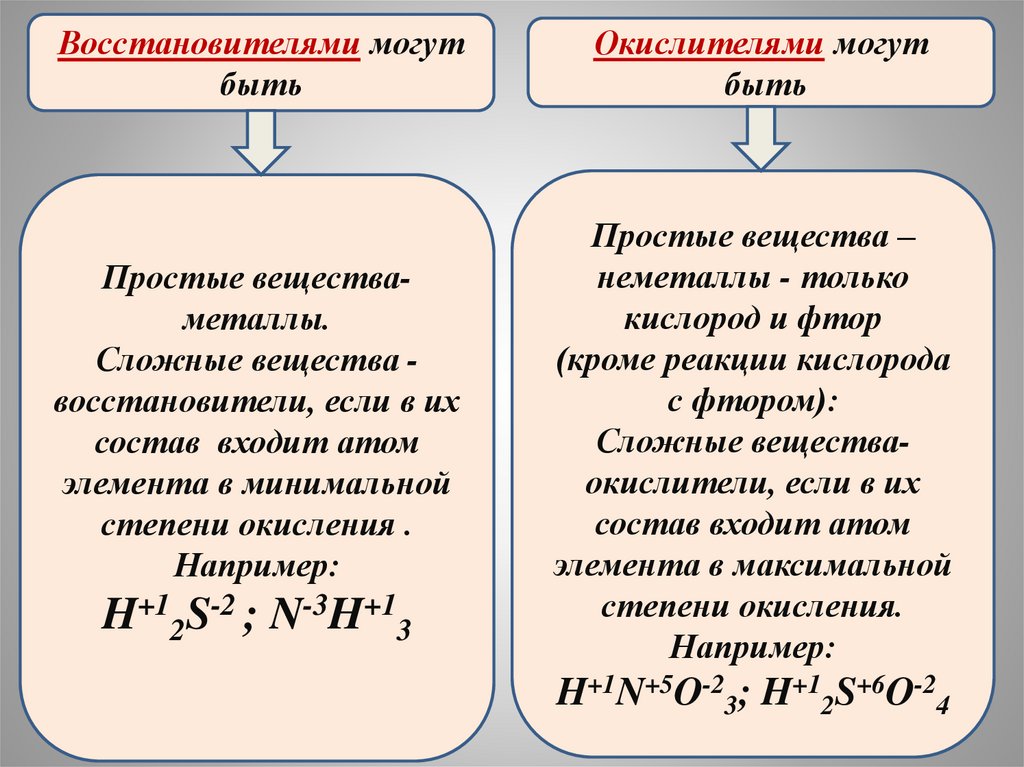
Восстановителями могутбыть
Простые веществаметаллы.
Сложные вещества восстановители, если в их
состав входит атом
элемента в минимальной
степени окисления .
Например:
H+12S-2 ; N-3H+13
Окислителями могут
быть
Простые вещества –
неметаллы - только
кислород и фтор
(кроме реакции кислорода
с фтором):
Сложные веществаокислители, если в их
состав входит атом
элемента в максимальной
степени окисления.
Например:
H+1N+5O-23; H+12S+6O-24
30.
Виды окислительно-восстановительныхреакций:
Межмолекулярные —
реакции, в которых
окисляющиеся и
восстанавливающиеся
атомы находятся в
молекулах разных
веществ, например:
H+12S-2+CL20=S0 +
2H+1CL-1
Внутримолекулярные
— реакции, в которых
окисляющиеся и
восстанавливающиеся
атомы находятся в
молекулах одного и
того же вещества,
например:
2H+12O-2=2H20 +
O20
31.
План составления окислительно восстановительной реакции1. Записываем схему химической реакции
Ca + O2
2. Расставляем степени окисления атомов,
участвующих в химической реакции
Ca0 + O20
Ca+2O -2
3.Находим атомы, которые изменяют свою
степень окисления
Ca0 и O20
Далее:
32.
4.Составляем электронный баланс,записываяпроцесс отдачи и присоединения электронов
Ca0 – 2e- = Ca +2
O20 + 4e- = 2O -2
5.
4
Ca0– 2e-=Ca2+
O20 + 4e- = 2O 2- 2
2
восстановитель
1
окислитель
6. Расставляем цифры, полученные в электронном
балансе в химическое уравнение
2Ca + O2= 2CaO
33.
Запомни!34.
Индикаторы34
35.
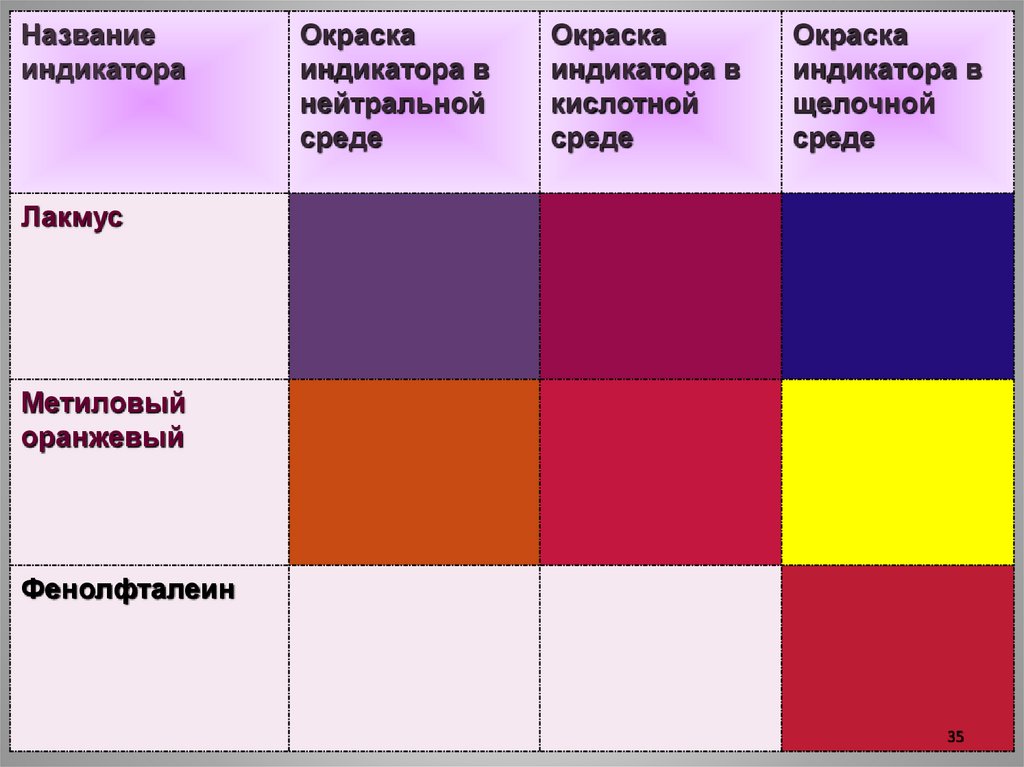
Названиеиндикатора
Окраска
индикатора в
нейтральной
среде
Окраска
индикатора в
кислотной
среде
Окраска
индикатора в
щелочной
среде
Лакмус
Метиловый
оранжевый
Фенолфталеин
35
36.
Гидролизом соли называется взаимодействие ионовсоли с водой,
в результате которого изменяется рН среды.
В процессе гидролиза соли в водном растворе
появляется избыток катионов Н+ или анионов ОНГИДРОЛИЗ – это реакция обмена между
некоторыми солями и водой приводящая к
образованию слабого электролита.
37.
В зависимости от силы исходной кислоты и исходногооснования, образовавших соль, выделяют 4 типа солей.
1. Соли, образованные катионом сильного основания и
анионом слабой кислоты. Они подвергаются гидролизу по
аниону.
К таким солям относятся: Na2CO3, Na2S, K2SO3, CH3COOK,
NaCN, Ba(NO2)2 и т. д.
Их растворы имеют щелочную реакцию среды, рН > 7.
Лакмус в таких растворах синий,
фенолфталеин приобретает малиновую окраску,
метилоранж - жёлтый.
Na2S ↔ 2Na+ + S2S2- + H2O ↔ HS- + OHNa2S + H2O ↔ NaHS + NaOH
38.
2. Cоли, образованные катионом слабого основания и аниономсильной кислоты. Они подвергаются гидролизу по катиону.
К таким солям относятся: ZnCl2, FeCl3, CuCl2, NH4I, Al2(SO4)3 и др..
Их растворы имеют кислую реакцию среды, рН < 7. Лакмус и
метилоранж в таких растворах имеют красный цвет,
фенолфталеин не изменяет окраски.
FeCl2 ↔ Fe2+ + 2ClFe2+ + H2O ↔ (FeOH)+ + H+
FeCl2 + H2O ↔ FeOHCl + HCl
39.
3. Соли, образованные катионом слабого основания и анионом слабойкислоты. Они подвергаются гидролизу по катиону и по аниону
одновременно.
К таким солям относятся: CH3COONH4, (NH4)2S, NH4CN.
Реакция среды их растворов может быть нейтральной, слабо
щелочной или слабо кислотной в зависимости константы
диссоциации образующихся продуктов.
CH3COONH4 ↔ CH3COO- + NH4+
CH3COO- + NH4+ + H2O ↔ CH3COOH + NH4OH
CH3COONH4 + H2O ↔ CH3COOH + NH4OH
КД (СН3СООН) = КД (NH4OН) , поэтому рН раствора =7
4. Соли, образованные катионом сильного основания и анионом
сильной кислоты не подвергаются гидролизу.
К таким солям относятся K2SO4, NaNO3.
Их растворы имеют нейтральную реакцию среды, рН = 7.
Окраска индикаторов в таких растворах не изменяется.
40.
Необратимый гидролизДля большинства солей гидролиз обратимый процесс.
Однако есть соли, продукты гидролиза которых
выводятся из сферы реакции, и гидролиз становится
необратимым.
Такими солями являются: Al2S3, (NH4)2S, Fe2(CO3)3,
(NH4)2SiO3
В уравнениях необратимого гидролиза солей ставится
знак равенства:
Al2S3 + 6H2O = 2Al(OH)3↓+ 3H2S↑.
Необратимому гидролизу подвергаются также бинарные
соединения:
Mg3N2, CaC2, Р2S5
41.
Реакции ионного обмена идут до конца:Если выделится газ Это раз;
И получится вода Это два;
А еще - нерастворимый
Осаждается продукт…
"Есть осадок" - говорим мы.
Это третий важный пункт.
Химик правила обмена
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок Вот тогда - порядок!
42.
Выпадает осадокМолекулярное уравнение:
AgNO3 + NaCL= AgCL↓ + NaNO3
Полное ионное уравнение:
Ag+ + NO3 + Na+ +CL- = AgCL↓ + Na+ +NO3 –
Сокращенное ионное уравнение:
Ag+ + CL- = AgCL
43.
Выделяется газNa2СO3 + 2HCL =2NaCL + СO2 + H2O
2Na+ +СO32- + 2H++2CL- = 2Na++2CL- +
СO2 ↑+ H2О
СO32- + 2H+ = СO2 ↑ + H2О
44.
Образуется водаKOH + HNO3 = КNO3 + H2O
K++ OH- + H++NO3 = К++NO3 - + H2O
K++ OH- + H++ NO3 - = К+ + NO3 - + H2O
OH- + H+ = H2O
45.
Давайте-ка повторим номенклатурунеорганических веществ
Вот анионы кислородных кислот хлора:
ClO4-- - перхлорат-анион
ClO3-- - хлорат-анион
ClO2-- - хлорит-анион
ClO-- - гипохлорит-анион
В хлориде хлор совсем один.
Зато себе он господин.
46.
А вот анионы кислот, содержащих серу:S2-- - сульфид-анион
HS-- - гидросульфид-анион
SO32-- - сульфит-анион
HSO3-- - гидросульфит-анион
SO42-- - сульфат-анион
HSO4-- - гидросульфат-анион
Сульфит не путайте с сульфидом,
Чтоб места не было обидам:
Сульфиды - сероводорода
Родня. И нет в них кислорода!
А вот сульфит. Скорей смотри:
В нем кислорода сразу три!
Добавим кислорода атом И познакомимся с сульфатом!
47.
Запоминательные стихи...ПРО ГАЛОГЕНЫ
Хлор хвалился: "Нет мне равных!
Галоген я самый главный.
Зря болтать я не люблю:
Всё на свете отбелю!"
Иод красой своей гордился,
Твердым был, но испарился.
Фиолетовый, как ночь,
Далеко умчался прочь.
Бром разлился океаном,
Хоть зловонным, но - румяным.
Бил себя он грозно в грудь:
"Я ведь бром! Не кто-нибудь!.."
Фтор молчал и думал: "Эх!..
Ведь приду - окислю всех…"




































 chemistry
chemistry








