Similar presentations:
Химия. Методические указания по изучению дисциплины (А.Р. Бухарова, А.И. Герасимова, Е.В. Крутикова)
1.
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИФГОУ ВО «РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ ЗАОЧНЫЙ УНИВЕРСИТЕТ»
Агрономический факультет
Кафедра агрохимии, защиты растений и
химии им. А.С. Гузея
ХИМИЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ИЗУЧЕНИЮ ДИСЦИПЛИНЫ И ЗАДАНИЯ
ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
студентам 1*, 1 курсов по направлению подготовки
20.03.02. « Природообустройство и водопользование»;
09.03.02. "Информационные системы и технологии"
Москва 2016
1
2.
Составители: профессор Бухарова А.Р. , Крутикова Е.В., доцент Герасимова А.И.УДК 543/546 (076.5)
Химия. Методические указания по изучению дисциплины / Рос. гос. аграр. заоч. ун-т; Сост. А.Р. Бухарова, А.И.Герасимова, Крутикова Е.В. М., 2016. 27 с.
Предназначены для студентов 1 и 1* курсов по направлению
20.03.02. « Природообустройство и водопользование»
09.03.02. "Информационные системы и технологии"
Утверждены методической комиссией агрономического факультета
Рецензенты: д.с-х.н., профессор А.В.Соловьев
к.б.н., доцент М.Г. Алещенко
2
3.
Раздел 1. ОБЩИЕ МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИПО ИЗУЧЕНИЮ ДИСЦИПЛИНЫ
Дисциплина «Химия» относится к базовой части естественнонаучного
цикла ООП. Методические указания по данной дисциплине составлены в соответствии с требованиями Федерального государственного образовательного
стандарта высшего профессионального образования по направлению 20.03.02.
« Природообустройство и водопользование» и 09.03.02. "Информационные системы и технологии".
1.1. Цели и задачи курса
Цель дисциплины – сформировать у студентов современное представление о химических процессах, происходящих в природе и научить применять их
по мере надобности.
В задачи дисциплины входит ознакомление с содержанием дисциплины,
изучение фундаментальных законов химии, современных методов исследования, разработок мер профессиональной ответственности в области охраны окружающей среды.
В результате изучения дисциплины студент должен обладать компетенциями:
- способностью использовать приемы первой помощи, методы защиты в
условиях чрезвычайных ситуаций (ОК-9; « Природообустройство и водопользование»);
-способностью использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического
анализа и моделирования, теоретического и экспериментального исследования
(ОПК-2; "Информационные системы и технологии");
- способностью использовать основные законы естественнонаучных дисциплин, методы математического анализа и моделирования, теоретического и
экспериментального исследования при решении профессиональных задач (ПК16; « Природообустройство и водопользование»).
Знать: фундаментальные разделы общей химии, в.т.ч. химические системы и процессы, химическую термодинамику и кинетику, реакционную способность веществ; определения основных химических понятий, виды химической связи, формулировки основных законов химии, пределы их применимости.
Владеть: навыками выполнения основных химических операций, навыками самостоятельного освоения знаниями, используя современные образовательные технологии, приемами работы в химической лаборатории, оценочными
расчетами кинетики и термодинамики химических процессов.
3
4.
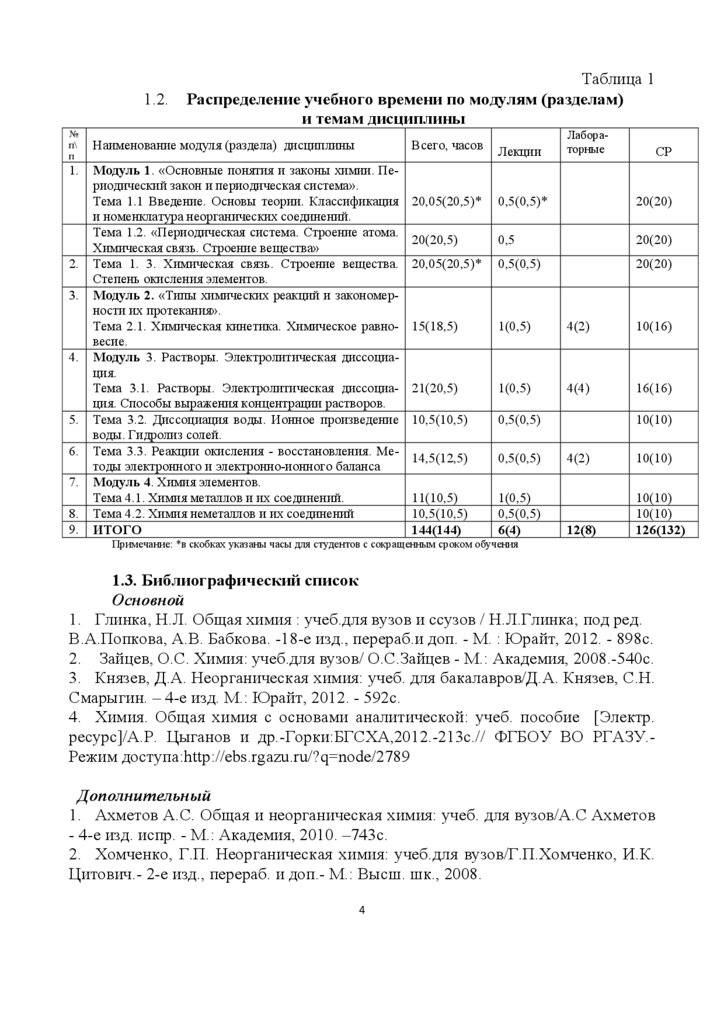
1.2.№
п\
п
1.
2.
3.
4.
5.
6.
7.
8.
9.
Таблица 1
Распределение учебного времени по модулям (разделам)
и темам дисциплины
Наименование модуля (раздела) дисциплины
Модуль 1. «Основные понятия и законы химии. Периодический закон и периодическая система».
Тема 1.1 Введение. Основы теории. Классификация
и номенклатура неорганических соединений.
Тема 1.2. «Периодическая система. Строение атома.
Химическая связь. Строение вещества»
Тема 1. 3. Химическая связь. Строение вещества.
Степень окисления элементов.
Модуль 2. «Типы химических реакций и закономерности их протекания».
Тема 2.1. Химическая кинетика. Химическое равновесие.
Модуль 3. Растворы. Электролитическая диссоциация.
Тема 3.1. Растворы. Электролитическая диссоциация. Способы выражения концентрации растворов.
Тема 3.2. Диссоциация воды. Ионное произведение
воды. Гидролиз солей.
Тема 3.3. Реакции окисления - восстановления. Методы электронного и электронно-ионного баланса
Модуль 4. Химия элементов.
Тема 4.1. Химия металлов и их соединений.
Тема 4.2. Химия неметаллов и их соединений
ИТОГО
Лабораторные
Всего, часов
Лекции
20,05(20,5)*
0,5(0,5)*
20(20)
20(20,5)
0,5
20(20)
20,05(20,5)*
0,5(0,5)
20(20)
15(18,5)
1(0,5)
4(2)
10(16)
21(20,5)
1(0,5)
4(4)
16(16)
10,5(10,5)
0,5(0,5)
14,5(12,5)
0,5(0,5)
11(10,5)
10,5(10,5)
144(144)
1(0,5)
0,5(0,5)
6(4)
СР
10(10)
4(2)
10(10)
12(8)
10(10)
10(10)
126(132)
Примечание: *в скобках указаны часы для студентов с сокращенным сроком обучения
1.3. Библиографический список
Основной
1. Глинка, Н.Л. Общая химия : учеб.для вузов и ссузов / Н.Л.Глинка; под ред.
В.А.Попкова, А.В. Бабкова. -18-е изд., перераб.и доп. - М. : Юрайт, 2012. - 898с.
2. Зайцев, О.С. Химия: учеб.для вузов/ О.С.Зайцев - М.: Академия, 2008.-540с.
3. Князев, Д.А. Неорганическая химия: учеб. для бакалавров/Д.А. Князев, С.Н.
Смарыгин. – 4-е изд. М.: Юрайт, 2012. - 592с.
4. Химия. Общая химия с основами аналитической: учеб. пособие [Электр.
ресурс]/А.Р. Цыганов и др.-Горки:БГСХА,2012.-213с.// ФГБОУ ВО РГАЗУ.Режим доступа:http://ebs.rgazu.ru/?q=node/2789
Дополнительный
1. Ахметов А.С. Общая и неорганическая химия: учеб. для вузов/А.С Ахметов
- 4-е изд. испр. - М.: Академия, 2010. –743с.
2. Хомченко, Г.П. Неорганическая химия: учеб.для вузов/Г.П.Хомченко, И.К.
Цитович.- 2-е изд., перераб. и доп.- М.: Высш. шк., 2008.
4
5.
Раздел 2. СОДЕРЖАНИЕ УЧЕБНЫХ МОДУЛЕЙ ДИСЦИПЛИНЫ ИМЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ИХ ИЗУЧЕНИЮ
2.1. Модуль 1. «Основные понятия законы химии. Периодический
закон и периодическая система»
2.1.1. Тема 1.1. Введение. Основы теории. Классификация и
номенклатура неорганических соединений
2.1.1.1. Краткое содержание темы. Место химии среди естественных научных дисциплин. Химическая форма движения материи. Предмет и методы
химии. Составление химических и графических формул. Классификация и номенклатура неорганических соединений.
2.1.1.2. Методические указания по изучению. Изучение дисциплины
необходимо начать со строения атома. Атомы химических элементов обозначают химическими знаками, молекулу - химической формулой, химические
процессы (реакции) – химическим уравнением. Химические знаки элементов,
как правило, обозначаются первыми (одной или двумя) буквами латинского названия элемента.
В химических расчетах используется специфическая единица количества
вещества – моль*. Параметры моля укладываются в схему:
Занимает при нормальИмеет «массу» М г
Содержит
23
ных
условиях объем 22,4
(М - молекулярная
6,02 ∙10 молекул
1 моль
л
(для всех газов)
масса)
Вывод: число молей* всегда можно перевести в число граммов, а также – в число молекул, а для газов – в литры
(миллилитры).
Зная молярную массу вещества (М), можно рассчитать количество вещества (число молей) n любой данной массе m этого вещества по формуле:
n= m/ М
Атомы в молекулах сложных веществ имеют положительные или отрицательные заряды, обеспечивающие их взаимное притяжение и устойчивость молекулы. Необходимо помнить, что в большинстве своих соединений водород
имеет степень окисления +1, а кислород -2. Знание постоянных степеней окисления водорода и кислорода позволяет рассчитывать степени окисления других
элементов, если известна формула молекулы.
Величины степеней окисления обычно учитываются при составлении
формул химических соединений. Подстрочные индексы после символа указывают, сколько атомов этого элемента в данной молекуле. Молекула же электронейтральна, что достигается тщательнейшим подбором необходимых индексов
с учетом степеней окисления элементов.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входить в состав вещества:
ω(Х)= Ar(X)·n/Mr,
где ω(Х) - массовая доля элемента Х; Ar(X)- относительная атомная масса
элемента Х; n - число атомов элемента Х в молекуле вещества; Mr- относительная молекулярная масса элемента Х.
5
6.
Наиболее распространенными классами неорганических соединений являются оксиды, основания, кислоты и соли.Оксиды – это соединения из двух элементов, одним из которых является
кислород (Oxygenium):
-оксиды элементов со степенью окисления +1 будут иметь формулы вида
Н2О, Na2O, Cl2O, N2O;
- со степенью окисления +2 - CaO, MgO, CO, NO;
- со степенью окисления +3 - Al2O3, Cl2O3, N2O3 и т.д.
Продукты соединения оксидов с водой, полученные непосредственно или
косвенным путем, называют гидроксидами. В зависимости от их свойств в водных растворах гидроксиды делят на основания, амфотерные гидроксиды и кислоты. Основания образуют анионы ОН-, кислоты – катионы Н+, а амфотерные
гидроксиды образуют как ионы Н+, так и ОН-.
Электролитическая диссоциация. Реакция электролитической диссоциации для любого электролита может быть выражена уравнением диссоциации:
КА ⇄ К + +А Процесс протекает под действием полярных молекул растворителя, в частности воды. Таким образом, при диссоциации электролита КА образуется два
иона: К+ — положительно заряженный, или катион; А- — отрицательно заряженный, или анион, поэтому растворы электролитов проводят электрический
ток.
Отношение числа молекул, распавшихся на ионы (Nдисс), к общему числу
растворенных молекул(Nобщ) называется степенью электролитической диссоциации та и обозначается буквой α:
α= Nдисс\ Nобщ
Слабые электролиты имеют α<3%, электролиты средней силы
3%<α<30%. Значения α приведены в приложении.
Ионно-молекулярные уравнения. Поскольку в водных растворах часть
участников реакций находится в виде ионов, то реальными участниками реакционных превращений являются не только молекулы, но и ионы.
Эти реакции возможны только в том случае, если между ионами происходит химическое воздействие, т.е. какие - либо ионы электролитов связываются друг с другом и образуют:
либо нерастворимое вещество, выпадающее в виде осадка;
либо молекулы малодиссоциирующего вещества.
Например:
BaCl 2 + Na 2 SO 4 = BaSO 4 +2NaCl - молекулярное уравнение;
Ba2+ +2Cl-+ 2Na++SO42-= BaSO4 +2Na+ + 2Cl - - полное ионное уравнение;
Ba2++SO42-= BaSO4 - сокращенное ионное уравнение.
Основания имеют общую формулу М(ОН)х. Здесь М – металл, в степени
окисления от +1 до +3. ОН- гидроксидная группа: ее заряд складывается из сте6
7.
пени окисления кислорода (-2) и водорода (+1). Количество гидроксидныхгрупп (х) в молекуле основания равно степени окисления металла.
Основания – это электролиты, которые при диссоциации образуют только гидроксид – ионы (анионы).
NaOH = Na+ + OHКак электролиты основания бывают сильными и слабыми.
Кислоты – это электролиты, которые при диссоциации образуют в качестве катионов только ионы водорода. Кислоты классифицируют по составу (кислородные и бескислородные), основности (одно-, двух-, трехосновные и т.д.),
способности к электролитической диссоциации (силе).
Среди кислот есть сильные электролиты (сильные кислоты) и слабые
электролиты (слабые кислоты).
Сильные кислоты диссоциируют необратимо:
H2SO4 = 2H+ + SO42Слабые многоосновные кислоты диссоциируют обратимо и ступенчато:
первая ступень: H3РO4 H+ + H2РO4вторая ступень: H2РO4- H+ + HРO42третья ступень: HРO42- H++ РO43Соли - это электролиты, которые при диссоциации образуют катионы металлов и анионы кислотных остатков.
Основная реакция получения солей — взаимодействие кислоты и основания. По полноте этой реакции соли делятся на нормальные (или средние), кислые и основные.
Нормальная соль (CaCl2, ZnSO4) представляет собой соединение металла
с кислотным остатком. Заряд кислотного остатка плавно вытекает из формулы
соответствующей кислоты.
Кислые соли (Zn(НSO4)2) – это продукты неполного замещения водорода
кислоты на металл – результат и подтверждение ступенчатого характера диссоциации многоосновных кислот.
Основные соли – занимают промежуточное положение между основаниями и солями, а значит, содержат, кроме атомов металла и кислотных остатков,
гидроксильные группы, связанные с металлом. Они являются продуктом неполного замещения гидроксильных групп (двух и более) кислотным остатком –
результат и подтверждение ступенчатого характера диссоциации многоатомных оснований. Например, CaOHCl, CuOHNO3 и т.д. В этих солях количество
кислотных остатков равно количеству замещенных ОН- групп.
Графическая формула показывает, в каком порядке и каким количеством
валентных связей атомы связаны друг с другом. При составлении графической
формулы:
– каждый атом обозначается символом своего элемента, так что химических
знаков элемента в графическом изображении столько, сколько соответствующих атомов;
7
8.
– каждая валентная связь между атомами обозначается черточкой;– как правило, соединяют положительно заряженный атом с отрицательно заряженным.
2.1.1.3.Вопросы для самопроверки темы
1. Назовите известные вам формы существования материи.
2. Основы атомно–молекулярного учения. Атомная и молекулярная масса.
Моль. Число Авогадро.
3. Перечислите основные стехиометрические законы химии. Укажите пределы
их применимости.
2.1.1.4.Задания для самостоятельной работы
1. Рассчитайте степени окисления выделенных элементов в соединениях: HCl,
HClO, NO, N2O5, HNO2, H2SiO3.
2. Воспользовавшись таблицей растворимости, составьте формулы оксидов лития, стронция, цинка, свинца, железа (Ш) и железа (П).
3. Составьте формулы оксидов выделенных элементов, соответствующих соединениям:
HClO2, HClO3, HClO4, HCrO2, H2Cr2O7, HNO2, HNO3, H2CO3, HCOOH.
4. Постройте графические формулы:
Mg(NO3)2, MgSO4, AlPO4, Ca3(PO4)2, NaBO2
2.1.2. Тема 1.2. «Периодический закон и периодическая система
Строение атома. Химическая связь и строение вещества»
2.1.2.1. Краткое содержание темы. Периодическая система Менделеева
– основной закон химии. Энергетические уровни и подуровни атома, их квантовые числа. Атомные орбитали, конфигурация электронных орбиталей и их
расположение в пространстве. Принцип Паули, принцип минимизации энергии,
правило Хунда.
2.1.2.2. Методические указания по изучению темы. При рассмотрении
периодичности изменения свойств элементов принято характеризовать изменение их металличности или неметалличности. Основным химическим свойством, отличающим металлы от неметаллов, является способность неметаллов в
химических реакциях принимать электроны. В периоде слева направо увеличивается число электронов на внешней оболочке атома, увеличивается заряд ядра и уменьшается радиус атома. Всё это увеличивает притяжение валентных
электронов к ядру и затрудняет их отрыв. В группах сверху вниз при неизменном
количестве валентных электронов их притяжение к ядру ослабевает за счет
увеличения радиуса атома (возрастает число электронных слоев). Это приводит к возрастанию металлических свойств сверху вниз.
В то же время в этом же направлении увеличивается заряд ядра, что противоположным образом влияет на металличность. В главных подгруппах ослабление взаимодействия внешних электронов с ядром за счет увеличения ра8
9.
диуса атома преобладает над увеличением притяжения электрона за счет возрастания заряда ядра. В этих подгруппах сверху вниз металлические свойстваусиливаются.
2.1.2.3. Вопросы для самопроверки
1.
Каков порядок заполнения орбиталей? Сформулируйте правило Гунда.
Какова форма s- и р-электронных орбиталей?
2.
Какое максимальное количество электронов может размещаться на 1s, 2s,
3s-подуровнях? Чему равен угол между р-орбиталями в атоме?
3.
Дайте современную формулировку периодического закона Д. И. Менделеева. Как его формулировал сам Д. И. Менделеев?
2.1.2.4. Задания для самостоятельной работы
1.
Почему в 3-м периоде число элементов 8, а не 18, если на 3-м энергетическом уровне может находиться 18 электронов?
2.
Что общего у элементов Cl и Mn или S и Cr, что позволяет помещать их в
одну группу периодической системы (VII и VI соответственно)?
3.
Что отличного у элементов Cl и Mn, или S и Cr, находящихся в одной
группе периодической системы, что заставляет помещать их в разные подгруппы?
2.1.3.Тема 1. 3. Химическая связь. Строение вещества.
Степень окисления элементов
2.1.3.1. Краткое содержание темы. Типы химической связи: ионная, ковалентная, металлическая. Полярность связи. Степень перекрывания атомных
орбиталей как мера прочности связи и - связи. Причины различия прочности одинарных и кратных связей. Гибридизация атомных орбиталей и геометрия молекул. Основные типы гибридизации sp3, sp2 и sp – орбиталей и основные
типы геометрических конфигураций молекул. Донорно-акцепторный механизм
образования ковалентной связи.
2.1.3.2. Методические указания по изучению. При образовании химической связи между атомами главную роль играют их валентные электроны, т.е.
электроны которые находятся на внешнем электронном слое и наименее прочно
связаны с ядром атома. Химическая связь возникает в результате образования
общих электронных пар между взаимодействующими атомами. Важнейшие
химические связи: ковалентная, ионная, металлическая, водородная связь.
2.1.3.3.Вопросы для самопроверки
1. Какова природа сил, за счет которых образуется химическая связь?
2. Ионная и ковалентная связь. Электронно-точечные представления.
3. Металлическая связь. Обоснование общности физических и химических
свойств металлов.
4. Донорно-акцепторная связь. Необходимые условия ее образования.
9
10.
2.1.3.4. Задания для самостоятельной работы1. Орбитальные модели молекул на примере H2S, РСl3;
2. Гибридизация атомных орбиталей и геометрия молекул BeF2, ВН3, СН4.
2.2. Модуль 2. «ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
ЗАКОНОМЕРНОСТИ ИХ ПРОТЕКАНИЯ»
2.2.1.Тема 2.1. Химическая кинетика. Химическое равновесие
2.2.1.1. Краткое содержание темы. Важнейшие понятия химической кинетики. Скорость химической реакции и факторы, влияющие на нее. Порядок
реакций. Закон действующих масс. Константа скорости химической реакции.
Влияние температуры на скорость реакции. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса Гомогенный и гетерогенный катализ.
Прямые и обратные реакции. Условие динамического равновесия реакции. Константа равновесия. Смещение равновесия при изменении концентрации, температуры и давления. Принцип Ле Шателье. Основные понятия и законы химической термодинамики. Минимизация свободной энергии реакции.
2.2.1.2.Методические указания по изучению темы. Рассмотрение реальности протекания химического процесса следует проводить с двух позиций
— энергетической и кинетической. Изменения энергии в системе связаны количественно с константой равновесия, которая определяет теоретический выход продуктов реакции.
Обращаем особое внимание на обратимость химических процессов, позволяющую вывести математические уравнение для константы равновесия из
кинетических характеристик.
2.2.1.3.Вопросы для самопроверки
1.
Сформулируйте закон действия масс. Приведите примеры того, как аналитически (уравнением) можно записать закон действия масс для реакций, протекающих в гомогенной и гетерогенной системах.
2.
Что такое константа скорости химической реакции, от каких факторов она
зависит?
3.
Сформулируйте правило Вант-Гоффа. Дайте пример расчета изменений
скорости реакции при повышении или понижении температуры.
2.2.1.4.Задания для самостоятельной работы
1.
Как изменится скорость реакции 2 NO + O2 = 2 NO2 при понижении давления в 2 раза? Сформулируйте принцип Ле-Шателье. Как влияет изменение
давления, температуры и концентрации реагирующих веществ на положение
равновесия в системе 2SO2 + O2 ⇄ 2SO3?
2. Чем характеризуется состояние химического равновесия? Какие величины,
характеризующие прямую и обратную реакции при химическом равновесии,
равны друг другу?
10
11.
3. Большая величина константы равновесия отвечает сдвигу равновесия в сторону прямой или обратной реакции?2.3. Модуль 3. «РАСТВОРЫ. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ»
2.3.1. Тема 3.1. Растворы электролитов. Электролитическая диссоциация. Способы выражения концентрации растворов
2.3.1.1. Краткое содержание темы. Общность и различие растворов,
смесей и соединений. Способы выражения концентрации растворов (процентная, молярная, нормальная). Электролитическая диссоциация. Сильные и слабые электролиты. Закон разведения Оствальда. Характер диссоциации гидроксидов.
2.3.1.2. Методические указания по изучению темы. Концентрация
растворов — это соотношение между растворенным веществом и растворителем или раствором. Советуем вспомнить понятия моль, эквивалент, плотность.
В химических расчетах используется в основном три вида концентрации:
процентная концентрация (массовая доля) показывает, сколько граммов
растворенного вещества находятся в 100 г раствора,
молярная концентрация показывает, сколько молей растворенного вещества находиться в 1 л (1000 мл) раствора,
молярная концентрация эквивалента (нормальная) показывает, сколько
молей эквивалента растворенного вещества находится в 1 л (1000 мл) раствора.
При решении задач по переходу от одного вида концентрации к другому
важно четко разграничить количество растворенного вещества и растворителя,
массу и объем и т. д.
Молярная концентрация - отношение количества вещества n (моль), содержащегося в растворе, к объему этого раствора (V).
C= n/V•1000 или C= m/MV•1000,
(1)
где1000 – коэффициент перевода миллилитров в литры.
Например, молярная концентрация раствора, в 250 мл которого содержится
0,25 г серной кислоты:
C(H2SO4)= m(H2SO4)/M(H2SO4) •V•1000;
C= 0,25/98•250•1000=0,01моль\л
Молярная концентрация эквивалента - отношение количества вещества
эквивалента n (моль), содержащегося в растворе, к объему этого раствора (V).
Уравнение для расчета молярной концентрации эквивалента аналогично уравнению (1) с той разницей, что вместе молярной массы вещества записывают
молярную массу эквивалента, равную произведению фактора эквивалентности
и молярной массы вещества. Например: необходимо определить молярную
концентрацию эквивалента фосфорной кислоты в растворе, 100 мл которого
содержат 3,27 г H3РO4. (Фактор эквивалентности (f) равен 1\3, а молярная масса
эквивалента- 1\3 молярной массы фосфорной кислоты).
C(1\3H3РO4)= m(H3РO4)/f(H3РO4) M(H3РO4) •V•1000;
11
12.
C= 3,27/1\3•98•100•1000=1моль\л.2.3.1.3.Вопросы для самопроверки
1.
Что отличает растворы от химических соединений.
2.
Каковы причины образования растворов? Какова природа взаимодействия веществ в растворах? Тепловые эффекты растворения.
3.
Что такое электролитическая диссоциация? Какова роль растворителя в
процессе электролитической диссоциации?
2.3.1.4. Задания для самостоятельной работы
1.
Что называется степенью электролитической диссоциации? Что такое
константа диссоциации? От каких факторов она зависит? Какова взаимосвязь
между степенью диссоциации и константой диссоциации?
2.
Какие соединения называются кислотами и основаниями с точки зрения
электролитической диссоциации? Чем обусловливается сила кислот и оснований?
3.
Что такое рН, рОН? Какими величинами рН характеризуется нейтральная, кислая и щелочная среда?
2.3.2. Тема 3.2. Диссоциация воды. Ионное произведение воды.
Гидролиз солей
2.3.2.1. Краткое содержание. Обратимый характер диссоциации воды.
Константа равновесия. Концентрация воды в воде. Ионное произведение воды.
Водородный показатель (рН и рОН). Понятие о буферных растворах. Реакции
ступенчатого гидролиза солей, образуемых слабыми и сильными кислотами и
основаниями. Факторы, влияющие на гидролиз.
2.3.2.2. Методические указания по изучению темы. Вода — самое важное и распространенное химическое соединение. Константа диссоциации воды
при комнатной температуре 1,8.10-16 свидетельствует о том, что вода – один из
самых слабых электролитов. В чистой воде при рН = 7 имеется 10 -7 моль ионов
водорода.
Гидролиз – это обратимое взаимодействие солей с водой с образованием
слабого основания или слабой кислоты. Процесс гидролиза соли, как любая
ионная реакция протекает только в том случае, если в результате образуются
малодиссоциируемые соединения, следовательно, гидролиз возможен в тех
случаях, если в состав соли входит анион слабой кислоты или катион слабого
основания.
Так, соли Li2S, Na2CO3,, K3PO4, BaSO3 образованы сильными основаниями и слабыми кислотами, а значит гидролизуются по аниону.
Соли CuCl2, MgBr2, Zn(NO3)2, MnSO4 образованы слабыми основаниями
и сильными кислотами. Их гидролиз идет по катиону.
Соли Al2S3, Fe2(CO3)3 – гидролизуются и по катиону и по аниону, так как
их когда-то образовали слабые и основания и кислоты.
12
13.
Соли: NaNO3, K2SO4, LiCl не подвергаются гидролизу, поскольку им соответствуют сильные основания и кислоты.2.3.2.3. Вопросы для самопроверки
1.
Что называется ионным произведением воды? В каких единицах оно выражено? Как влияет температура на ионное произведение воды?
2.
Как зависит степень гидролиза от концентрации и температуры?
2.3.2.4. Задания для самостоятельной работы
1.
2.
3.
В растворе, какой соли выше величина рН: KCN или K2CO3?
Составьте молекулярное уравнение гидролиза: Fe2+ + HOH ↔ FeOH+ + H+
Какая соль сильнее подвержена гидролизу: FeCl2 или FeCl3 ?
2.3.3. Тема 3.3. Реакции окисления – восстановления. Методы электронного и электронно-ионного баланса
2.3.3.1. Краткое содержание темы. Степень окисления элемента в соединении. Правила нахождения стехиометрических коэффициентов окислительно
– восстановительных реакций. Уравнения электронного и электронно - ионного
баланса. Окислительно - восстановительный эквивалент и потенциал. Энергетика и направление окислительных процессов.
2.3.3.2.Методические указания по изучению темы. Энергетическое
обеспечение природных процессов, в том числе и жизненно важных, происходит за счет окислительно - восстановительных реакций. В этих реакциях происходит изменение степеней окисления (зарядов) участников реакций за счет обмена электронами. Очень распространенной окислительно-восстановительной
реакцией является процесс горения – топливо окисляется кислородом воздуха.
2.3.3.3.Вопросы для самопроверки
1.
Какой процесс называется окислением? Восстановлением?
2.
Какое вещество обладает более сильными восстановительными свойствами H2S или H2Se?
2.3.3.4. Задания для самостоятельной работы
1.
2.
Укажите окислитель и восстановитель в реакции: Cl2 + H2O = HClO + HCl
Определите валентность железа в соединениях:
FeO, Fe2O3, FeCl3, FeSO4, H[FeCl4], MgFe2O4, Fe3O4, FeS2.
2.4. Модуль 4. ХИМИЯ ЭЛЕМЕНТОВ
2.4.1.Тема 4.1. Химия металлов и их важнейших соединений
2.4.1.1.Краткое содержание темы. Объяснение физических свойств металлов в свете представлений об их внутренней структуре. Отличия полупроводников от металлов и диэлектриков. Химические свойства металлов. Понятие
о способах получения металлов из руд. Комплексные соединения.
13
14.
2.4.1.2.Методические указания по изучению темы. Для характеристикисвойств элементов предлагается следующий план рассмотрения - из положения
элементов в периодической системе определить:
a)
общее количество электронов, равное порядковому номеру элемента;
b)
количество электронных слоев, соответствующее номеру периода, в котором расположен элемент;
c)
число валентных электронов, связанное с номером группы.
Составить электронную формулу атома элемента с распределением электронов по уровням и подуровням. С учетом правила Гунда представить распределение электронов графически. На основании распределения электронов в
атоме сделать вывод о преобладании металлических или неметаллических
свойств (тенденции к потере или к присоединению электронов). С учетом свободных орбиталей и неспаренных электронов определять валентности.
Для всех положительных степеней окисления составить формулы оксидов, элемента, определить их характер. Составить формулы соответствующих
гидроксидов и подтвердить их характер (кислотный, основной или амфотерный) уравнениями диссоциации. Рассмотреть свойства водородного соединения
элемента. Указать возможную кислотность и охарактеризовать устойчивость.
2.4.1.3.Вопросы для самопроверки
1. К каким электронным семействам (s-,p-,d-, f) принадлежат элементы- металлы?
2. Какие солеобразующие оксиды характерны для металлов? От чего зависит
характер оксидов металла?
3. Охарактеризуйте процесс коррозии металлов. Какие виды коррозии различают?
2.4.1.4. Задания для самостоятельной работы
1. Как изменяются металлические свойства элементов в периодах и группах
периодической системы? Укажите самый активный металл.
2. Какова общая формула внешнего электронного слоя: а) атомов щелочных
металлов; б) ионов этих металлов.
2.4.2.Тема 4.2. Химия неметаллов и их важнейших соединений
2.4.2.1.Краткое содержание темы. Объяснение физических свойств неметаллов в свете представлений об их внутренней структуре. Химические свойства неметаллов. Благородные газы. Положение неметаллов в периодической
системе. Характеристики неметалличности.
2.4.2.2. Методические указания по изучению темы. Атомы типичных
неметаллов обладают высокой электроотрицательностью и высоким сродством
к электрону. Отрицательную степень окисления атомы неметаллов проявляют в
соединениях с металлами, водородом и другими менее электроотрицательными
неметаллами. Способность присоединять электроны в периоде увеличивается
14
15.
слева направо. В подгруппе сверху вниз эта способность уменьшается. Такимобразом, самым активным элементом - неметаллом является фтор. На внешнем
уровне «благородные газы» имеют завершенную высокоустойчивую восьмиэлектронную конфигурацию ns2np6(гелий 1s2). Они химически весьма инертны.
1.
2.
2.4.2.3.Вопросы для самопроверки
Какие физические свойства отличают металлы от неметаллов?
Какое химическое свойство отличает металл от неметалла?
2.4.2.4.Задания для самостоятельной работы
1.
Укажите самый активный неметалл?
2.
Какие типы оксидов образуют неметаллы? Какое агрегатное состояние
для них характерно?
3.
Назовите области применения серы, фосфора, хлора, углерода, азота.
Раздел 3. ЗАДАНИЯ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ И
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ЕЕ ВЫПОЛНЕНИЮ
3.1. Методические указания по выполнению контрольной работы
Весь материал в соответствии с программой разбит на отдельные модули,
из которых 1-3 модули являются общетеоретическими; модуль 4 включает обзор свойств важнейших элементов, где на основе кратких сведений по химии
отдельных элементов изучаются необходимые данные о веществах и процессах.
Именно поэтому лекционный курс и лабораторные занятия по химии (неорганической и аналитической), предусматриваемые для студентов во время прохождения лабораторно-экзаменационной сессии, включают, в основном, общетеоретические вопросы.
В методические указания включены некоторые вопросы, относящиеся к
восстановительной части курса. Цель этих вопросов — восстановить навыки,
например, составление химических формул по валентности, определение валентности по формуле, рассмотрение массовых соотношений, составление ионных уравнений и др. В любой день студент может обратиться на кафедру для
консультации (тел. 8(495) 521-52-11).
Варианты контрольных заданий
Задания для контрольных работ расположены непосредственно после методических советов по каждой теме и имеют сквозную нумерацию. Вариант задания определяется по последним двум цифрам шифра (табл.16). Например,
для студента с шифром 374 вариант контрольной работы, найденный из таблицы, будет 3, 11, 26, 37, 46, 60, 61, 76, 83, 97, 110, 114, 121,135.
3.2. Задания для контрольной работы
1 - 9. Приведите формулировки основных стехиометрических законов химии. В
чем особенность современного подхода к закону сохранения массы и закону
постоянства состава? Сделайте расчет и заполните для своего задания пропуски
в таблице 2. Например, в первой части задачи № 2 надо найти массу одного мо15
16.
ля хлора, массу и объем 3,01 ∙1022 молекул хлора и количество молей, соответствующее этому числу молекул.Таблица 2
№ задачи
1
2
3
4
5
6
7
8
9
Формула
вещества
CH4
CuSO4
Cl2
NaNO3
O2
KNO3
SO2
Ca(OH)2
CO
CuSO4
NO
Na2CO3
HNO3
H2
NH3
NH4NO3
CO2
H2SO4
Масса одного моля
Масса вещества, г
1,6
Количество
молей
3
Количество
молекул
Объем вещества при
н.у., литров
3,01∙1022
0,3
1,4
40
3,01∙1021
0,2
67,2
1,60
33,6
3
2,01∙1021
11,2
34
4,01∙1021
0,1
24,5
10. Составьте формулы высших оксидов элементов, являющихся макроэлементами в питании растений, и формулы высших оксидов для и микроэлементов.
Изобразите их графически. Укажите характер этих оксидов (кислотный, основный, амфотерный). Напишите возможные реакции их взаимодействия с водой.
11 – 20. Составьте формулы всех солей, соответствующих взятым попарно кислотам и основаниям, приведенным для вашего задания в таблице 3. Напишите
уравнения получения одной из солей в молекулярной и ионной форме. При написании уравнений руководствуйтесь таблицей растворимости и таблицей степеней диссоциации.
Таблица 3
№ задания
11
12
13
14
15
16
17
18
19
20
KOH
CsOH
NaOH
NH4OH
LiOH
Sr(OH)2
Ba(OH)2
Ca(OH)2
Pb(OH)2
Co(OH)2
Исходные вещества
Zn(OH)2
HClO4
Fe(OH)3
HClO3
Sn(OH)2
HF
Cu(OH)2
H2CO3
Al(OH)3
HBr
Ba(OH)2
HCl
Ni(OH)3
HClO
Co(OH)3
HNO2
Ca(OH)2
HNO3
KOH
HBrO3
H3BO3
H2S
H3AsO4
HI
H2TeO4
H2SiO3
H2CO3
H2SO3
H3PO4
H2SO4
21-30. Составьте электронные формулы и представьте графически размещение
электронов по квантовым ячейкам для указанных в табл. 4 элементов, соответствующих вашему заданию. Воспользуйтесь схемами из учебника. Проанализируйте возможности разъединения спаренных электронов при возбуждении
атомов - с образованием валентных электронов в соответствии с теорией спин валентности.
16
17.
Таблица 4№ задания
21
22
23
24
25
26
27
28
29
30
Элементы
Углерод, скандий
Азот, титан
Кислород, ванадий
Фтор, хром
Алюминий, мышьяк
Кремний, бром
Фосфор, калий
Сера, кальций
Хлор, бериллий
Аргон, железо
31-40. Проанализируйте изменения величину зарядов ядер, радиусов атомов,
электроотрицательностей и степеней окисления элементов в соответствии с
вашим вариантом (таблица 5). Каковы закономерности этих изменений при
движении по группе сверху вниз или по периоду слева направо? Как изменяется в этом направлений металличность элементов и характер их оксидов и гидроксидов?
Таблица 5
№ задания
31
32
33
34
35
36
37
38
39
40
Задание
Элементы 2 периода
Элементы 3 периода
Элементы 4 периода
Элементы 5 периода
Элементы 4В группы
Элементы 2А группы
Элементы 4А группы
Элементы 5А группы
Элементы 6А группы
Элементы 7В группы
41-50. Для предложенных в вашем задании (табл. 6) соединений постройте графические формулы и укажите виды химической связи в этих молекулах. Составьте электронно-точечные модели молекул, обозначив и неподеленные электронные пары. Покажите, какие (какая) связи «рвутся» при диссоциации.
Таблица 6
№ задания
41
42
43
44
45
46
47
48
49
50
Соединения
Гидросульфат натрия, СО2
Карбонат алюмния, NO2
Тиосульфат натрия, H2S
Гидрокарбонат кальция, NH3
Гидросульфит натрия, Н2О
Дигидрофосфат кальция, РС13
Гидрофосфат кальция, АsН3
Нитрит железа, H2Se
Гидроксонитрат кальция, SiH4
Фосфат алюминия, SО2
51-55. Дайте определение понятию скорость химической реакции. Опишите количественно (где это можно), как влияют на скорость реакции внешние условия
17
18.
(концентрация, температура, давление). Рассчитайте, во сколько раз изменитсяскорость прямой реакции при изменении указанных в таблице 7 условий.
Таблица 7
№ задания
Реакция
51
А+В=Д
52
53
54
55
A + 2B = 2Д
H2 + Cl2 = 2 HCl
2 Fe + O2 = 2 FeO
СaO + CO2 = CaCO3
Изменение температуры
уменьшение
на
40°C
увеличение на 30°C
нет
нет
нет
Температурный
фициент γ
коэф-
Изменение давления
3
нет
2
-
нет
увеличение в 2 раза
уменьшение в 3 раза
увеличение в 2 раза
56-60. Чем характеризуется состояние химического равновесия? От каких факторов зависит константа равновесия, положение равновесия? Предскажите в
соответствии с принципом Ле-Шателье направление смещения равновесия при
изменении внешних условий (отдельно для разных факторов) по данным таблицы 8.
Таблица8
№ задания
Реакция
56
57
58
59
60
СO2 + CaCO3 + H2O(пар) = Сa(HCO3)2 - Q
NH3 + H2O = NH4OH - Q
N2O4 = 2NO2 - Q
4NH3 + 5O2 = 4NO + 6H2O (пар) + Q
2CO + O2 = 2CO2 + Q
Изменение
температуры
повышение
понижение
понижение
повышение
повышение
Изменение
давления
понижение
повышение
повышение
понижение
повышение
Изменение концентрации
Увеличение Ссо
уменьшение СNH3
Увеличение СNO2
Увеличение СО2
Уменьшение СО2
61-70. Используйте параметр, представленный в одной из клеток вашего задания (табл.9). Проделайте необходимые расчеты и заполните пропуски в строке
своего задания в соответствии с примером. Примите степень диссоциации для
всех электролитов 100%.
Таблица 9
№п\п
Электролит
61
62
63
64
65
66
67
68
69
70
KOH
NaOH
LiOH
HCl
HClO4
HBr
HBrO4
HNO3
NaOH
HCl
КОН
Концентрация
электрoлита,
моль/литр
[H+]
моль/литр
0,01
0,001
0,01
,
10-5
[OH-]
моль/литр
lg[H+]
lg[OH-]
pH
pOH
10-12
-12
-2
2
12
10-10
-4
-11
3
12
12
-9
-10
71-80. В соответствии с номером вашего задания заполните пропуски в таблице
10. Например, в задаче 76 надо найти молярную и нормальную концентрацию
10% -ного раствора CuSО4 (плотность раствора 1,1 г/мл).
Таблица 10
№
задания
Растворенное
вещество
Концентрация раствора
процентная
молярная
18
нормальная
Плотность раствора, г/мл
19.
7172
73
74
75
76
77
78
79
80
HNO3
HCl
NaOH
H3PO4
H2SO4
CuSO4
(NH4)2SO4
KOH
CH3COOH
KNO3
12
0,15
6
0,9
0,4
10
0,05
4
0,2
0,3
1,07
1,02
1,07
1,05
1,027
1,107
Принять 1,0
1,035
Принять 1,0
Принять 1,0
81-90. Составьте ионные и молекулярные уравнения гидролиза по первой ступени приведенных в вашем задании (табл. 11) солей. Укажите реакцию среды в
растворе соли. Напишите выражения для константы гидролиза. Для гидролиза
соли по аниону рассчитайте величину константы гидролиза. Укажите направление смещения равновесия гидролиза при подкислении раствора рассматриваемой соли.
Таблица 11
№ задания
81
82
83
84
85
86
87
88
89
90
Соли
Хлорид магния, сульфит натрия
Нитрат меди, карбонат калия
Сульфат алюминия, силикат натрия
Хлорид железа (III), сульфид натрия
Сульфат аммония, цианид калия
Хлорид аммония, сульфид бария
Сульфат марганца (II), карбонат калия
Нитрат алюминия, ацетат натрия
Хлорид цинка, силикат калия
Сульфат железа (II), фосфат калия
91—100. Составьте электронные уравнения и подберите коэффициенты в реакциях, соответствующих вашему заданию в таблице 12. Рассчитайте, сколько
граммов окислителя требуется для окисления, 10 г соответствующего реакции
восстановителя.
Таблица 12
№ задания
91
92
93
94
95
96
97
98
99
100
Уравнения реакций
KM nO 4 + Na 2 S + H 2 SO 4 = K 2 S O 4 + M n S O 4 + Na 2 S O 4 + H 2 O
KM nO 4 + H 2 O 2 + H 2 SO 4 = K 2 S O 4 + M n S O 4 + O 2 + H 2 O
Mn O 2 + HC l = M n C l 2 + Cl 2 + H 2 O
C u + H NO 3 = C u( NO 3 ) 2 + N O + H 2 O
K 2 Cr 2 O 7 + N a 2 SO 3 + H 2 SO 4 = K 2 SO 4 + C r 2 ( SO 4 ) 3 + Na 2 S O 4 + H 2 O
Fe SO 4 + KM n O 4 + H 2 S O 4 = Fe 2 ( S O 4 ) 3 + K 2 SO 4 + Mn S O 4 + H 2 O
KM nO 4 + H 2 C 2 O 4 + H 2 S O 4 = K 2 S O 4 + M n SO 4 + CO 2 + H 2 O
KM nO 4 + K NO 2 + H 2 SO 4 = K 2 SO 4 + M nS O 4 + K NO 3 + H 2 O
Na 2 S + K 2 C r 2 O 7 + H 2 S O 4 = Na 2 S O 4 + K 2 S O 4 + C r 2 (S O 4 ) 3 + H 2 O
KM nO 4 + H Cl = C l 2 + K Cl + M nC l 2 + H 2 O
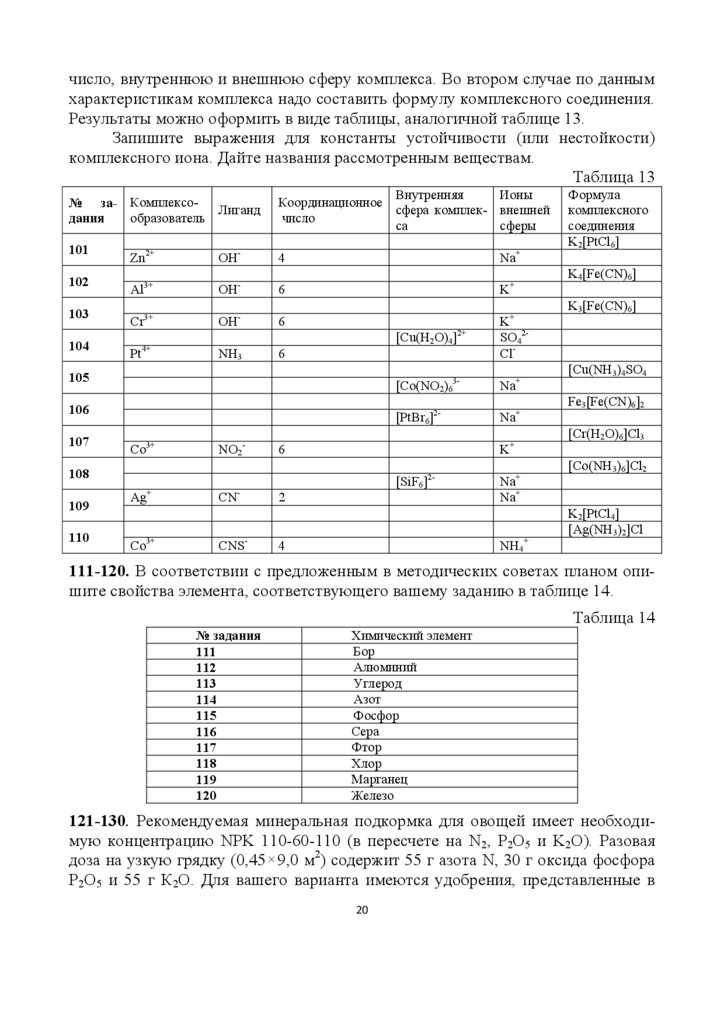
101-110. В таблице 13 представлены задания для двух веществ, соответствующих вашему варианту. В одном случае надо по данной формуле комплексного
соединения определить комплексообразователь, лиганды, координационное
19
20.
число, внутреннюю и внешнюю сферу комплекса. Во втором случае по даннымхарактеристикам комплекса надо составить формулу комплексного соединения.
Результаты можно оформить в виде таблицы, аналогичной таблице 13.
Запишите выражения для константы устойчивости (или нестойкости)
комплексного иона. Дайте названия рассмотренным веществам.
Таблица 13
№ за- КомплексоЛиганд
образователь
дания
Внутренняя
Ионы
Координационное
сфера комплек- внешней
число
са
сферы
101
Zn2+
OH-
4
Na+
102
Al3+
OH-
6
K+
3+
-
OH
6
+
NH3
6
103
104
Cr
Pt4+
[Cu(H2O)4]2+
105
3-
106
107
Co3+
NO2-
110
Ag+
Co3+
CNCNS-
K3[Fe(CN)6]
K
SO42Cl+
Na
[PtBr6]2-
Na+
K+
108
109
K4[Fe(CN)6]
[Co(NO2)6
6
[SiF6]22
Na+
Na+
NH4+
4
Формула
комплексного
соединения
K2[PtCl6]
[Cu(NH3)4SO4
Fe3[Fe(CN)6]2
[Cr(H2O)6]Cl3
[Co(NH3)6]Cl2
K2[PtCl4]
[Ag(NH3)2]Cl
111-120. В соответствии с предложенным в методических советах планом опишите свойства элемента, соответствующего вашему заданию в таблице 14.
Таблица 14
№ задания
111
112
113
114
115
116
117
118
119
120
Химический элемент
Бор
Алюминий
Углерод
Азот
Фосфор
Сера
Фтор
Хлор
Марганец
Железо
121-130. Рекомендуемая минеральная подкормка для овощей имеет необходимую концентрацию NPK 110-60-110 (в пересчете на N2, P2O5 и K2O). Разовая
доза на узкую грядку (0,45 9,0 м2) содержит 55 г азота N, 30 г оксида фосфора
Р2О5 и 55 г К2О. Для вашего варианта имеются удобрения, представленные в
20
21.
таблице 15. Сколько граммов каждого из этих удобрений надо взять для приготовления разовой дозы питательной смеси?Таблица 15
№ задачи
121
122
123
124
125
126
127
128
129
130
№ имеющегося удобрения
1
11
2
12
3
13
4
14
5
15
6
16
7
17
8
18
9
19
10
20
21
22
23
22
27
24
28
26
28
22
Удобрения, соответствующие № удобрения в таблице
1. Аммиачная селитра
NH4NO3
2.
Известково – аммиачная селитра
2 NH4NO3 • CaCO3
3.
Карбамид (мочевина)
CO(NH2)2
4.
Сульфат аммония
(NH4)2SO4
5.
Сульфат аммония – натрия
3,5(NH4)2SO4 ∙ Na2SO4
6.
Хлорид аммония
NH4Cl
7.
Натриевая селитра
NaNO3
8.
Кальциевая селитра
Ca(NO3)2
9.
Цианамид кальция
CaCN2
10.
Калийная селитра
KNO3
11.
Фосфоритная мука
Ca5F(PO4)3 + Ca5OH(PO4)3 + CaCO3
12.
Суперфосфат
Ca(H2PO4)2 • H2O • 2CaSO4
13.
Двойной суперфосфат
Ca(H2PO4)2 • H2O
14.
Аммонизированный суперфосфат Ca(H2PO4)2 • H2O + NH4H2PO4
15.
Преципитат
CaHPO4 • 2H2O
16.
Метафосфат кальция
Ca(PO3)2
17.
Динатрий фосфат
Na2HPO4
18.
Диаммонийфосфат
(NH4)2HPO4
19.
Моноаммонийфосфат
NH4H2PO4
20.
Монокалийфосфат
КН2РО4
21.
Хлорид калия
KCl
22.
Сульфат калия
K2SO4
23.
Калимагнезия
K2SO4 • MgSO4 • 6H2O
24.
Сильвинит
KCl • NaCl
25.
Каинит
KCl • MgSO4 • 3H2O
26.
Калий углекислый
K2CO3
27.
Калийная селитра
KNO3
28.
Карналлит
KCl • MgCl2 • 6H2O
131. Что такое качественная реакция? Опишите главные особенности качественных реакций (специфичность, интенсивность, чувствительность). Приведите
2-3 примера. Что такое частная реакция?
132. Что такое групповой реактив? Перечислите групповые реактивы на катионы II, III и IV аналитических групп. Какой групповой реактив используется для
открытия анионов третьей группы?
21
22.
133. Какие катионы могут находиться в анализируемом растворе, если отдельные порции его не дали осадков ни с HCl, ни с H2S, ни с (NH4)2S, ни с(NH4)2CO3?
134. Вычислить произведение растворимости (СаСО3), зная, что его растворимость при данной температуре равна 0,013 г/л
135. Вычислить растворимость гидроксида магния при 250С, если произведение
растворимости [Mg(OH)2] = 5.10-12.
136. Выпадет ли осадок сульфата стронция при смешении равных объемов
0,001 н. растворов SrCl2 и K2SO4, если произведение растворимости (SrSO4) =
2,8.10-7? Ответ обоснуйте.
137. Образуется ли осадок оксалата кальция (произведение растворимости
(СаС2О4) = 2,57.10-9)) при смешении равных объемов 0,01 М растворов СаCl2 и
Na2C2O4? Ответ обоснуйте.
Таблица 16
Варианты контрольного задания
Вариант
1
00
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
Номера задач для контрольной работы
1
2
3
4
5
6
7
8
9
8
7
6
5
4
3
2
1
2
3
4
5
6
7
8
9
8
7
6
5
4
3
2
11
20
19
18
17
16
15
14
13
12
16
18
20
17
15
11
13
12
14
19
18
19
17
20
16
14
15
13
11
12
19
18
29
21
22
26
23
24
27
28
30
25
29
21
26
23
24
27
28
30
22
25
21
22
23
24
29
30
28
27
25
26
30
28
32
31
34
35
33
36
39
38
37
40
31
34
33
36
32
39
35
38
37
39
32
31
34
33
40
38
36
37
39
35
40
38
44
48
43
46
47
41
50
42
45
49
43
46
41
50
48
42
47
50
44
45
43
42
41
44
50
48
49
45
46
47
41
46
58
57
55
54
56
52
51
53
59
60
54
56
51
55
59
53
56
58
52
57
54
53
52
51
59
55
60
58
56
57
59
60
66
62
69
63
61
64
65
70
67
68
61
64
70
67
63
69
70
66
62
65
65
64
63
62
70
69
67
61
66
68
63
66
22
72
74
75
71
73
76
80
78
77
79
78
80
77
79
73
76
71
74
72
75
76
75
74
72
78
73
77
79
71
80
71
77
83
81
86
82
84
85
89
88
90
87
86
88
87
89
85
83
82
90
81
84
87
86
82
83
88
90
81
84
85
89
88
85
95
93
92
91
96
94
100
98
99
97
97
99
98
96
100
91
92
94
93
95
99
98
97
95
91
96
94
100
92
93
98
92
107
105
104
103
102
101
106
108
110
109
104
108
110
109
106
102
105
107
101
103
110
109
101
102
104
106
108
105
107
103
101
107
111
113
119
112
118
117
114
116
120
115
118
111
119
120
116
117
113
112
114
115
120
119
114
113
117
118
111
116
115
112
120
112
121
122
123
124
125
126
127
128
129
130
129
128
127
126
125
124
123
122
121
122
123
124
125
126
127
128
129
130
129
128
127
126
131
132
133
134
135
135
137
138
139
140
131
132
133
134
135
136
131
132
133
137
131
132
133
134
135
136
131
132
133
134
131
132
23.
3233
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
87
88
89
90
91
92
93
94
1
2
3
4
5
6
7
8
9
1
3
2
1
9
8
7
6
5
4
3
2
1
7
6
5
4
3
2
1
8
9
4
3
2
1
5
6
7
8
9
5
4
3
2
1
6
9
8
7
5
3
2
7
4
8
9
1
6
5
3
2
1
4
11
13
17
15
16
20
14
12
20
19
18
17
16
15
14
13
12
11
15
17
19
18
11
12
13
14
16
20
11
13
20
14
19
16
17
12
15
18
20
18
19
17
11
16
12
14
15
13
20
19
18
17
16
15
14
13
12
11
19
13
18
12
20
27
21
23
25
29
26
24
22
21
22
23
24
25
26
27
28
29
30
21
23
28
26
24
27
22
25
29
30
22
24
29
21
23
26
27
30
28
25
24
21
27
29
26
23
30
28
22
25
26
21
22
27
30
23
28
24
29
25
29
21
24
28
26
36
34
31
32
33
35
37
39
40
39
38
37
36
35
34
33
32
31
34
36
37
39
38
35
32
33
31
40
40
31
33
32
35
39
34
37
36
38
35
34
31
32
37
36
39
33
38
40
31
33
37
36
34
38
39
35
33
32
31
36
33
39
32
43
50
41
49
448
47
42
45
41
43
45
47
49
50
48
46
44
42
41
42
43
44
45
46
47
48
49
50
41
48
43
47
46
50
45
49
44
42
41
49
43
48
46
47
45
44
50
42
44
49
45
43
46
42
47
41
48
50
42
50
41
46
49
55
51
54
57
53
58
52
56
53
55
57
52
59
56
51
54
58
60
55
54
58
53
56
59
57
51
52
60
57
51
58
60
54
53
59
56
52
55
59
53
58
52
60
51
54
56
55
57
55
52
58
53
57
59
54
60
51
56
59
58
57
60
56
70
67
65
62
68
64
69
61
70
64
61
68
66
63
67
65
62
69
68
67
61
65
64
62
69
66
63
70
67
61
64
69
70
63
65
66
62
68
69
63
66
67
61
70
62
65
64
68
61
62
63
64
65
66
67
68
69
70
61
62
63
64
65
23
72
74
78
75
80
76
73
79
76
74
75
80
78
73
72
77
79
71
77
72
75
73
79
78
74
76
71
80
79
72
77
74
75
76
80
73
78
71
78
73
80
72
76
74
77
75
71
79
80
71
79
73
75
74
72
78
76
77
77
75
76
78
80
89
84
86
90
83
87
81
82
81
88
83
89
85
86
90
84
87
82
81
82
83
87
89
88
86
85
84
90
87
88
89
84
83
82
81
90
86
85
82
87
84
86
83
89
85
90
81
88
83
87
84
90
85
89
82
86
88
81
87
85
82
86
83
95
97
94
96
100
93
99
91
98
100
92
97
94
96
93
95
98
91
92
94
95
97
98
96
93
99
91
100
93
92
100
98
91
95
97
94
96
99
93
95
92
99
97
94
96
91
100
98
98
91
99
96
94
100
93
92
95
97
100
98
97
96
95
102
109
103
105
108
106
104
110
109
105
110
104
106
107
108
103
101
102
107
105
103
101
106
104
102
109
108
110
109
104
102
108
103
106
107
105
110
101
102
104
106
108
110
109
107
105
103
101
103
106
102
107
104
105
108
103
110
109
105
101
103
106
110
118
114
116
115
117
113
119
111
114
112
113
120
116
115
118
117
119
111
119
115
114
116
112
111
117
113
118
120
117
119
114
112
118
113
115
116
111
120
115
117
120
119
114
112
118
113
116
111
120
111
112
113
114
115
116
117
118
119
111
113
112
119
120
125
124
123
122
121
122
123
124
125
126
127
128
129
130
129
128
127
126
125
124
123
122
121
130
122
123
124
125
126
127
128
129
130
129
130
128
127
126
125
124
123
122
121
122
123
124
125
126
127
128
129
130
130
129
128
127
126
125
124
123
121
122
123
137
134
135
136
131
132
133
134
137
132
133
134
135
136
131
132
133
134
131
132
133
134
135
136
131
137
133
134
131
132
133
134
135
136
131
132
137
134
131
132
133
134
135
136
131
132
137
134
131
132
133
134
135
136
137
132
133
134
131
132
133
134
135
24.
9596
97
98
99
7
9
8
1
2
16
14
11
17
15
23
25
27
22
30
37
35
40
34
38
44
48
45
47
43
55
54
53
52
51
66
67
68
69
70
79
74
71
73
72
90
84
88
81
89
94
93
92
91
99
108
102
104
107
109
117
116
114
118
115
124
125
126
127
128
136
137
132
133
134
ПРИЛОЖЕНИЕ
Номенклатура солей неорганических кислот
Название солей составляется из названий соответствующей кислоты и металла, независимо от числа атомов металла и кислотных остатков, входящих в формулу соли.
Таблица 1
Названия солей ряда кислот
Название кислоты
Азотистая
Азотная
Борная
Бромоводородная
Двухромовая
Йодоводордная
Кремниевая
Марганцовая
Мышьяковая
Сернистая
Сероводородная
Серная
Селеновая
Соляная
Тиосерная (серноватистая)
Теллуровая
Угольная
Уксусная
Фосфорная (орто)
Фтороводородная
Хлорноватистая
Хлористая
Хлорноватая
Хлорная
Хромовая
Цианистоводородная
Формула
HNO2
HNO3
Н3ВО3
HBr
H2Cr2O7
HI
H2SiO3
HMnO4
H3AsO4
H2SO3
H2S
H2SO4
H2SеO4
HCl
H2S2O3
H2TeO4
H2CO3
CH3COOH
H3PO4
HF
HClO
HClO2
HClO3
HClO4
H2CrO4
HCN
Название соли
Нитриты
Нитраты
Бораты
Бромиды
Дихроматы
Йодиды
Силикаты
Перманганаты
Арсенаты
Сульфиты
Сульфиды
Сульфаты
Селенаты
Хлориды
Тиосульфаты
Теллураты
Карбонаты
Ацетаты
Фосфаты
Фториды
Гипохлориты
Хлориты
Хлораты
Перхлораты
Хроматы
Цианиды
Название кислой соли образуется добавлением к названию средней соли приставки
«гидро», означающей наличие одного незамещенного атома водорода в кислотном остатке.
Если в кислотном остатке содержится два незамещенных атома водорода, то используется
приставка «дигидро». Примеры:
CuHPO4 – гидрофосфат меди;
Cu(HCO3)2 - гидрокарбонат кальция;
NaH2PО4 - дигидрофосфат натрия;
Са(Н2РО4)3 - дигидрофосфат кальция.
Название основной соли образуется добавлением к названию средней ставки «гидроксо», означающей наличие незамещенной гидроксильной группы, связанной с атомом металла. Если с одним атомом металла связаны две незамещенные гидроксильные группы, то
используется приставка «дигидроксо».
Примеры:
24
25.
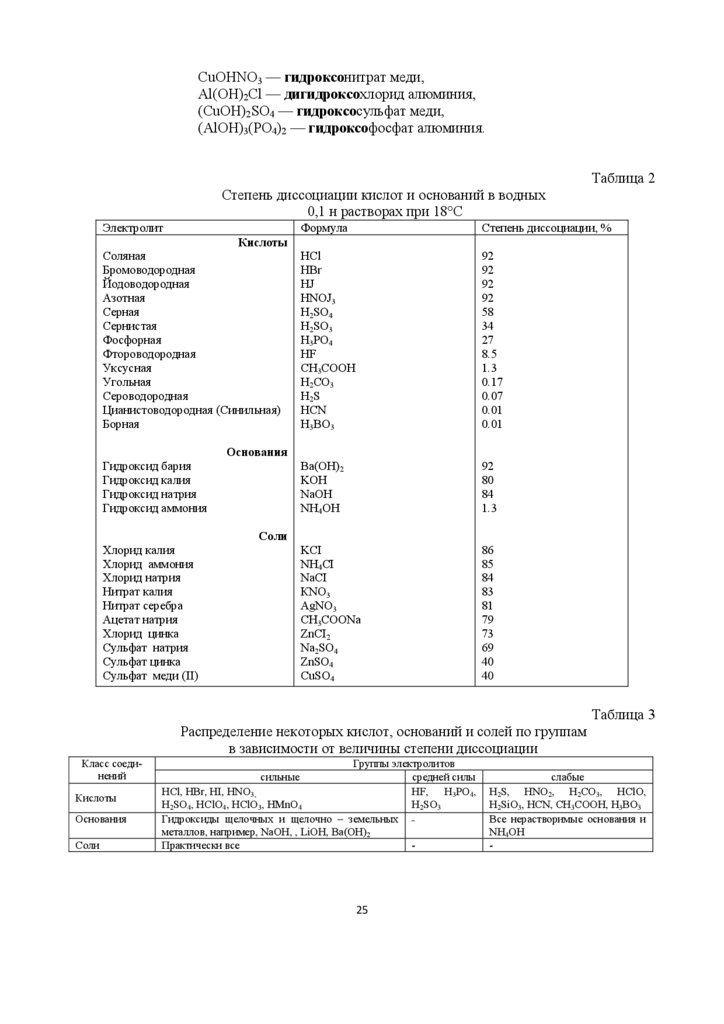
CuOHNO3 –– гидроксонитрат меди,Al(OH)2Cl –– дигидроксохлорид алюминия,
(CuOH)2SO4 –– гидроксосульфат меди,
(AlOH)3(PO4)2 –– гидроксофосфат алюминия.
Таблица 2
Степень диссоциации кислот и оснований в водных
0,1 н растворах при 18°C
Электролит
Формула
Степень диссоциации, %
HCl
HBr
HJ
HNOJ3
H2SO4
H2SO3
H3PO4
HF
CH3COOH
H2CO3
H2S
HCN
H3BO3
92
92
92
92
58
34
27
8.5
1.3
0.17
0.07
0.01
0.01
Ba(OH)2
KOH
NaOH
NH4OH
92
80
84
1.3
KCI
NH4CI
NaCI
КNO3
AgNO3
CH3COONa
ZnCI2
Na2SO4
ZnSO4
CuSO4
86
85
84
83
81
79
73
69
40
40
Кислоты
Соляная
Бромоводородная
Йодоводородная
Азотная
Серная
Сернистая
Фосфорная
Фтороводородная
Уксусная
Угольная
Сероводородная
Цианистоводородная (Синильная)
Борная
Основания
Гидроксид бария
Гидроксид калия
Гидроксид натрия
Гидроксид аммония
Соли
Хлорид калия
Хлорид аммония
Хлорид натрия
Нитрат калия
Нитрат серебра
Ацетат натрия
Хлорид цинка
Сульфат натрия
Сульфат цинка
Сульфат меди (II)
Таблица 3
Распределение некоторых кислот, оснований и солей по группам
в зависимости от величины степени диссоциации
Класс соединений
Кислоты
Oснования
Соли
Группы электролитов
средней силы
HCl, HBr, HI, HNO3,
HF, H3PO4,
H2SO4, HClO4, HClO3, HMnO4
H2SO3
Гидроксиды щелочных и щелочно – земельных металлов, например, NaOH, , LiOH, Ba(OH)2
Практически все
сильные
25
слабые
H2S, HNO2, H2CO3, HClO,
H2SiO3, HCN, CH3COOH, H3BO3
Все нерастворимые основания и
NH4OH
-
26.
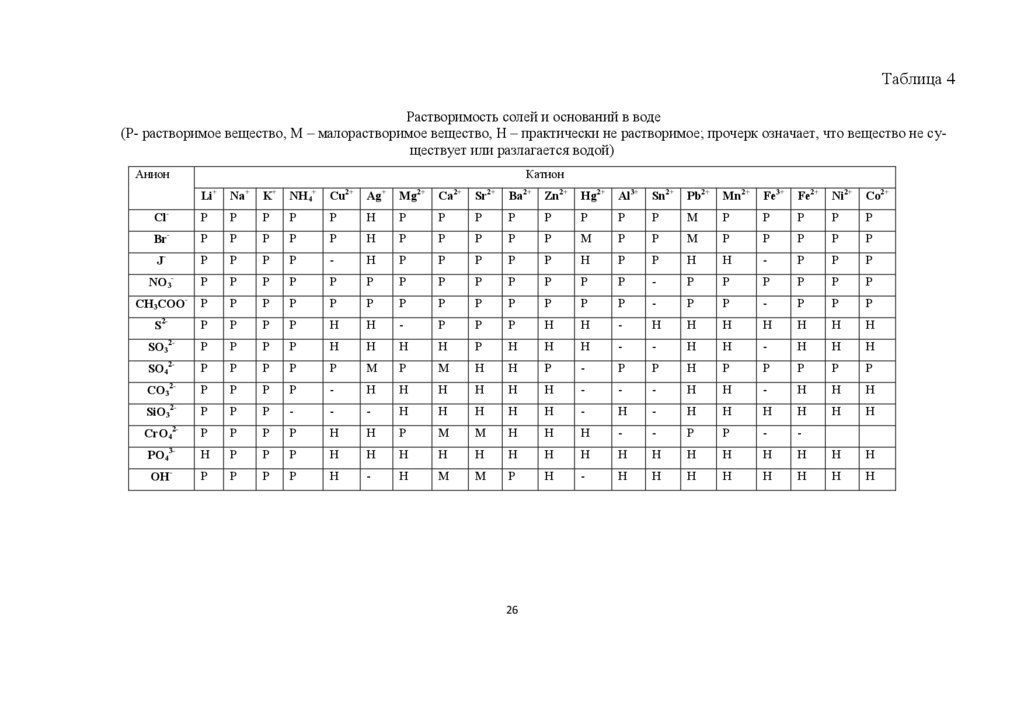
Таблица 4Растворимость солей и оснований в воде
(Р- растворимое вещество, М – малорастворимое вещество, Н – практически не растворимое; прочерк означает, что вещество не существует или разлагается водой)
Анион
Катион
+
+
Zn2+
Hg2+
Al3+
Sn2+
Pb2+
Mn2+
Fe3+
Fe2+
Ni2+
Со2+
Р
Р
Р
Р
Р
М
Р
Р
Р
Р
Р
NH4+
2+
Cu
Ag
+
Р
Р
Р
М
Р
Р
М
Р
Р
Р
Р
Р
Р
Р
Р
Р
Н
Р
Р
Н
Н
-
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
-
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
-
Р
Р
-
Р
Р
Р
Н
Н
-
Р
Р
Р
Н
Н
-
Н
Н
Н
Н
Н
Н
Н
Р
Н
Н
Н
Н
Р
Н
Н
Н
-
-
Н
Н
-
Н
Н
Н
Р
Р
Р
М
Р
М
Н
Н
Р
-
Р
Р
Н
Р
Р
Р
Р
Р
Р
Р
Р
-
Н
Н
Н
Н
Н
Н
-
-
-
Н
Н
-
Н
Н
Н
Р
Р
Р
-
-
-
Н
Н
Н
Н
Н
-
Н
-
Н
Н
Н
Н
Н
Н
Р
Р
Р
Р
Н
Н
Р
М
М
Н
Н
Н
-
-
Р
Р
-
-
PO43-
Н
Р
Р
Р
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
-
Р
Р
Р
Р
Н
-
Н
М
М
Р
Н
-
Н
Н
Н
Н
Н
Н
Н
Н
Cl-
Р
Р
Р
Р
Р
Н
Р
Р
Р
-
Р
Р
Р
Р
Р
Н
Р
Р
Р
Р
Р
Р
-
Н
Р
NO3
Р
Р
Р
Р
Р
Р
CH3COO-
Р
Р
Р
Р
Р
2-
S
Р
Р
Р
Р
SO32-
Р
Р
Р
SO42-
Р
Р
CO32-
Р
SiO322-
-
CrO4
OH
Ca
2+
Na
J-
Mg
2+
Li
Br
K
+
Sr
2+
Ba
26
2+
27.
ОГЛАВЛЕНИЕРаздел 1. Общие методические рекомендации по изучению дисциплины
3
Раздел 2. Содержание учебных модулей дисциплины и
Методические указания по их изучению
Модуль 1. «Основные понятия и законы химии. Периодический закон и
периодическая система»
Модуль 2. «Типы химических реакций и закономерности их протекания»
Модуль 3. Растворы. Электролитическая диссоциация.
Модуль 4. Химия элементов
Раздел 3. Задания для контрольной работы и методические указания по
ее выполнению
Приложение
5
Составители А.Р. Бухарова, А.И. Герасимова, Е.В. Крутикова
Технический редактор
Подписано в печать
Формат бумаги
Бумага типографская № 2:
Печ.л.
Уч.изд.л.
Тираж
Заказ
Поз. Пл. А-5
Издательство ФГОУ ВПО РГАЗУ
143900 Балашиха 8 Московской области
27
5
10
11
13
15
24























 chemistry
chemistry








