Similar presentations:
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
1.
Кафедра общей и медицинской химии«Растворы. Способы выражения
концентраций. Сильные и слабые
электролиты. Закон разведения
Оствальда».
2.
3.
Раствор – гомогенная термодинамически устойчивая система,состоящая из двух или бóльшего числа компонентов,
соотношение между которыми может изменяться в
широких пределах.
Раствор может иметь любое агрегатное состояние – жидкое,
твердое, газообразное.
Растворитель – тот из компонентов раствора, агрегатное
состояние которого совпадает с агрегатным состоянием
раствора, а количество его вещества больше, чем остальных.
Вода обычно считается растворителем, независимо от
сравнительных количеств компонентов.
Растворенные вещества – остальные компоненты.
Гидратная теория Менделеева – oдна из основ современной
теории растворов:
в растворе при обычной температуре происходит
образование и разрушение ассоциатов – соединений частиц
растворителя с частицами растворенного вещества.
4.
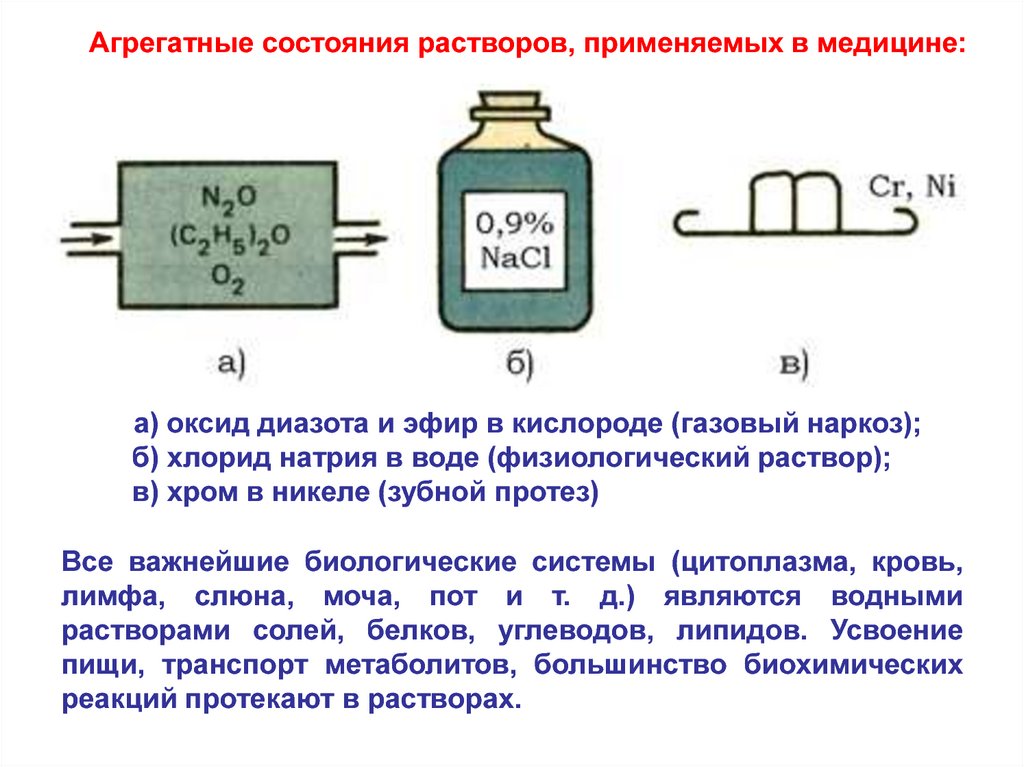
Агрегатные состояния растворов, применяемых в медицине:а) оксид диазота и эфир в кислороде (газовый наркоз);
б) хлорид натрия в воде (физиологический раствор);
в) хром в никеле (зубной протез)
Все важнейшие биологические системы (цитоплазма, кровь,
лимфа, слюна, моча, пот и т. д.) являются водными
растворами солей, белков, углеводов, липидов. Усвоение
пищи, транспорт метаболитов, большинство биохимических
реакций протекают в растворах.
5.
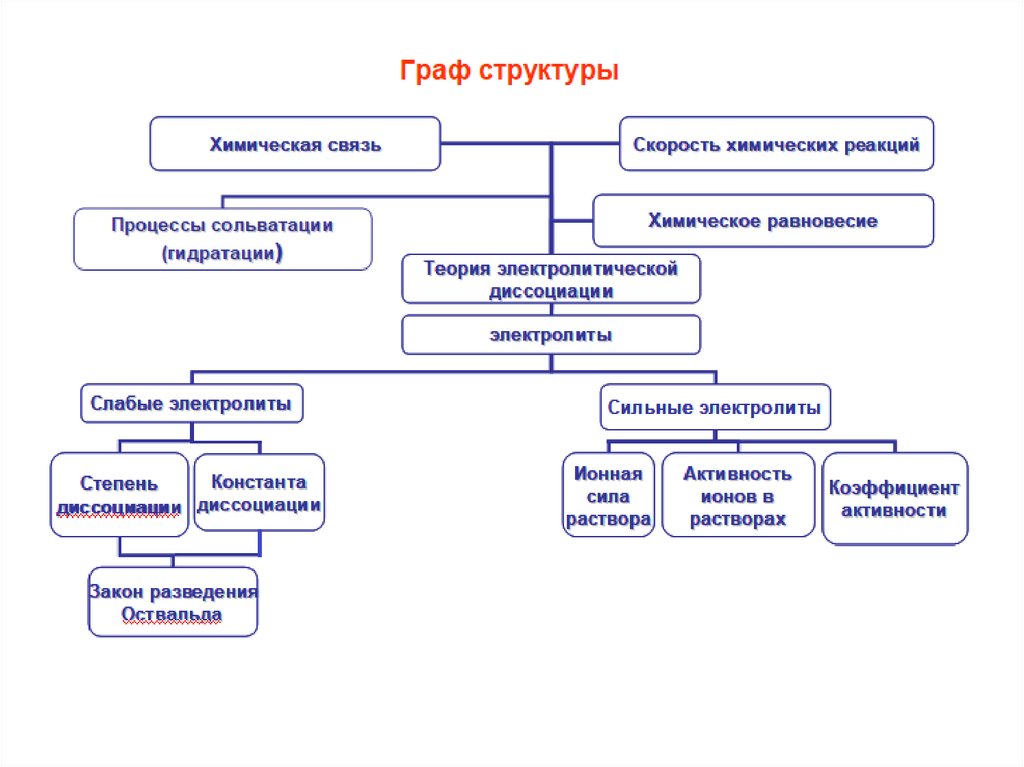
Классификация растворов1. По молярной массе растворенного вещества
а) М < 5000 г/моль – растворы низкомолекулярных соединений.
Размер растворенных частиц (ионов и молекул) меньше 10–9 м.
б) М > 5000 г/моль - растворы высокомолекулярных соединений
(ВМС). Макромолекулы ВМС (полимеров) состоят из одинаковых
элементарных звеньев, соединенных между собой химическими
связями. Размер растворенных частиц больше 10–9 м.
2. По наличию электролитической диссоциации
а) Растворы электролитов – в которых растворенные
вещества диссоциируют на ионы.
б) Растворы неэлектролитов – в которых растворенные
вещества не диссоциируют на ионы.
3. По содержанию растворенного вещества.
а) разбавленные ~ до 10 %;
в) средней концентрации ~ 10 ÷ 30 %
б) концентрированные ~ 30 % и выше.
6.
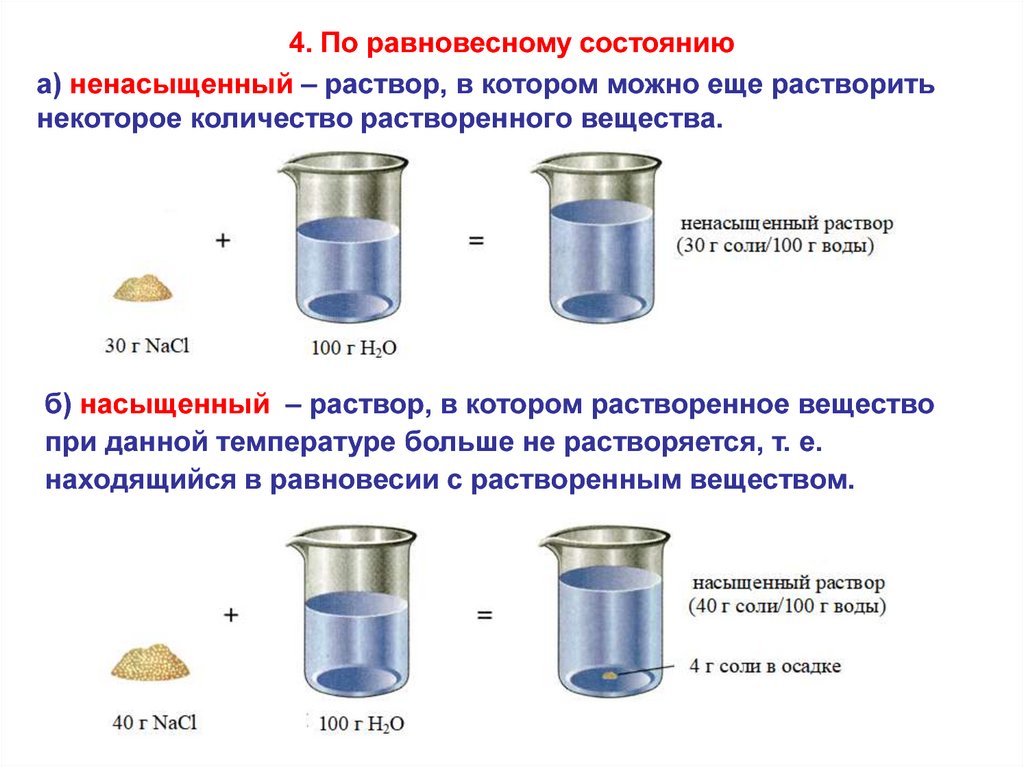
4. По равновесному состояниюа) ненасыщенный – раствор, в котором можно еще растворить
некоторое количество растворенного вещества.
б) насыщенный – раствор, в котором растворенное вещество
при данной температуре больше не растворяется, т. е.
находящийся в равновесии с растворенным веществом.
7.
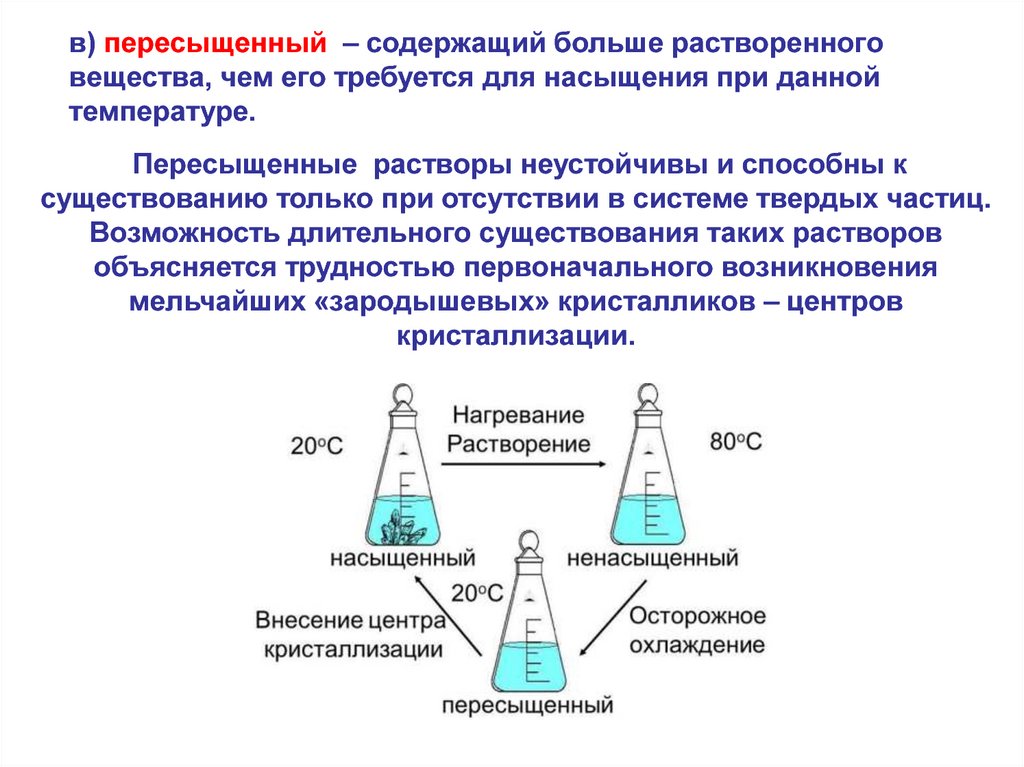
в) пересыщенный – содержащий больше растворенноговещества, чем его требуется для насыщения при данной
температуре.
Пересыщенные растворы неустойчивы и способны к
существованию только при отсутствии в системе твердых частиц.
Возможность длительного существования таких растворов
объясняется трудностью первоначального возникновения
мельчайших «зародышевых» кристалликов – центров
кристаллизации.
8.
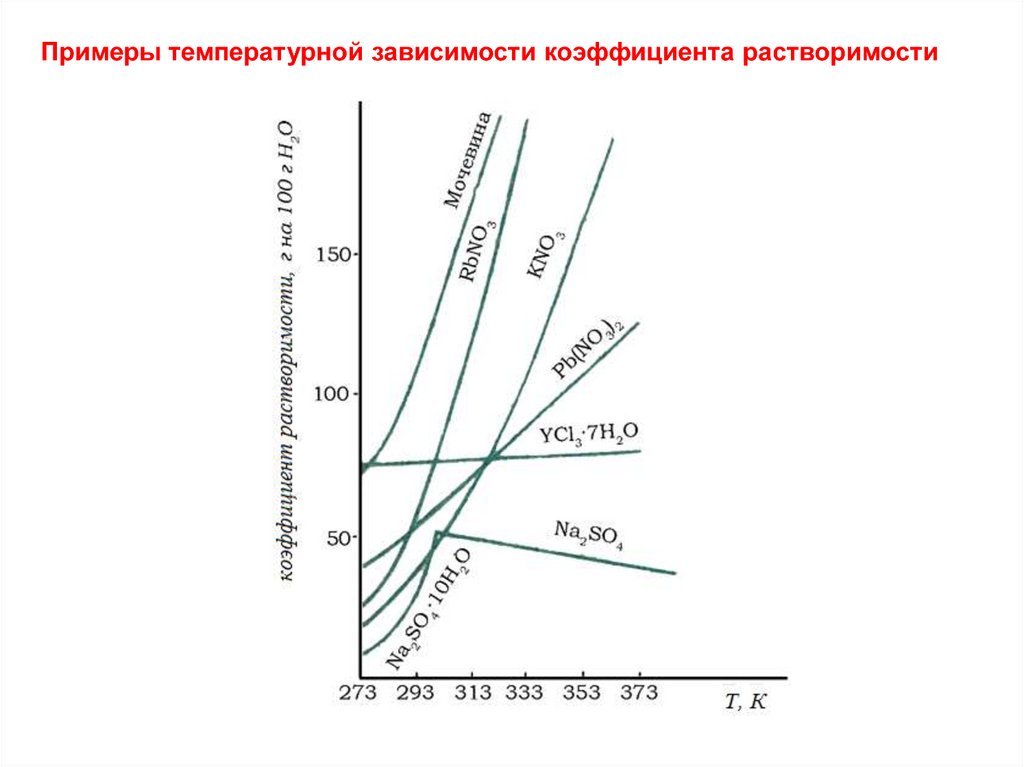
Растворимость (качественно) – способность данноговещества растворяться в данном растворителе.
Мерой растворимости (количественно) при данных
условиях является содержание растворенного вещества в
насыщенном растворе.
Для жидких растворов твердых и жидких веществ
обычно используют
массовый коэффициент растворимости ks – массу
вещества (г), способную насытить 100 г растворителя.
9.
Примеры температурной зависимости коэффициента растворимости10.
Термодинамика растворения11.
Способы выражения состава растворов(В – формула растворенного вещества).
Массовая доля растворенного вещества ω(В) (устар. –
процентная концентрация C%) – отношение массы
растворенного вещества m(В) к массе раствора mр, выраженное в
процентах (если в долях единицы, то без умножения на 100).
(B)
m(B)
mр
100.
Физический смысл ω(В) – число единиц массы В (например, г) в
100 (или в одной) единицах массы раствора (например, г).
Запись «z %-ный раствор В» означает, что ω(В) = z % = 0,01 z.
5 %-ный раствор NaCl ω(NaCl) = 5 % = 0,05.
Если ω %-ный раствор В – разбавленный (ρ раствора равна
1 г/мл), то для расчета m(В) в мг можно использовать следующую
формулу:
m(В), мг = 10∙(Vр , мл)∙(ω, %).
где Vр – объем раствора, мл.
12.
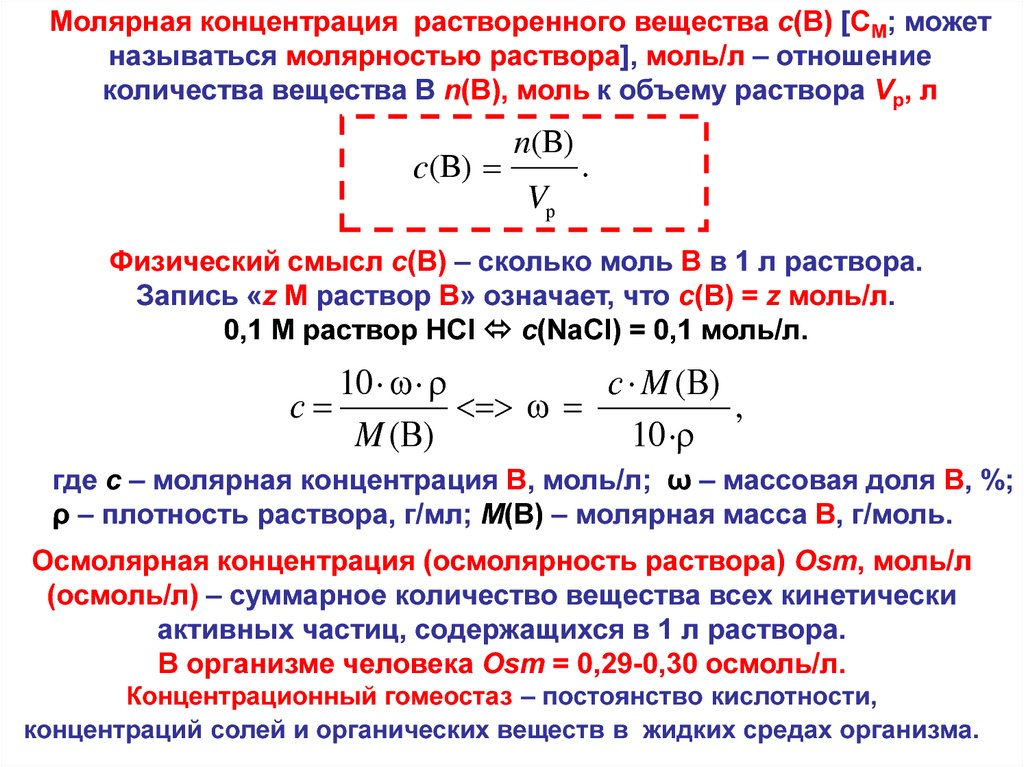
Молярная концентрация растворенного вещества c(В) [CM; можетназываться молярностью раствора], моль/л – отношение
количества вещества В n(В), моль к объему раствора Vр, л
c (B)
n (B)
.
Vр
Физический смысл c(В) – сколько моль В в 1 л раствора.
Запись «z M раствор В» означает, что c(В) = z моль/л.
0,1 M раствор HCl c(NaCl) = 0,1 моль/л.
10 · ·
с M (В)
с
,
M (В)
10 ·
где c – молярная концентрация В, моль/л; ω – массовая доля В, %;
ρ – плотность раствора, г/мл; M(В) – молярная масса В, г/моль.
Осмолярная концентрация (осмолярность раствора) Osm, моль/л
(осмоль/л) – суммарное количество вещества всех кинетически
активных частиц, содержащихся в 1 л раствора.
В организме человека Osm = 0,29-0,30 осмоль/л.
Концентрационный гомеостаз – постоянство кислотности,
концентраций солей и органических веществ в жидких средах организма.
13.
Эквивалент вещества В Э(В) – реальная или условная частицаВ, которая эквивалентна в данной кислотно-оснóвной реакции
одному катиону водорода или в данной ОВР – одному электрону.
Э = fэк(В) В,
где fэк(В) – фактор эквивалентности В (число, обозначающее, какая
доля частицы В эквивалентна катиону водорода или электрону в
данной реакции). Например,
т. е. эквивалентом ортофосфорной кислоты в данной реакции
является половина ее молекулы. В разных реакциях эквиваленты
одного В могут быть разными!!! Если уравнение кислотно-оснóвной реакции, в которой участвует В, не дано, то номинальные fэк(В)
находят следующим образом:
14.
Количество вещества эквивалентов nэк(В) ≡ n(fэк В) – отношениемассы вещества m(В) к молярной массе его эквивалентов
Mэк(В) ≡ M(fэк В)
nэк (В) n( f эк В)
m(B)
M эк (B)
m(B)
M ( f эк В)
.
Молярная концентрация эквивалентов (иногда эквивалента) В
cэк(В) ≡ c(fэк В), моль/л (устар. – нормальная концентрация
Cн, CN, N; может называться нормальностью раствора) –
отношение количества вещества эквивалентов В к Vр.
cэк (B) c ( f B)
эк
nэк (B)
Vр
n( f B)
эк
Vр
.
15.
Физический смысл cэк(В) – сколько моль эквивалентов В в 1 лраствора. Запись «z н. раствор В» означает, что cэк(В) = z моль/л.
0,05 н. раствор CaCl2 cэк(CaCl2) ≡ c(1/2 CaCl2) = 0,05 моль/л.
сэк
c
f эк
c f эк сэк
Мольная (молярная) доля В χ(В) [Χ, N] – отношение количества
вещества В n(В) к общему количеству вещества в растворе
(сумме n(В) и количества вещества растворителя n(р-ля)),
выраженное в процентах (или в долях единицы, тогда без
умножения на 100).
(B)
n(B)
n(B) n( р ля )
100.
Физический смысл χ(В) – сколько единиц количества вещества
(например, моль) В приходится на 100 (или 1) единиц общего
количества вещества раствора (например, моль).
16.
Моляльная концентрация растворенного вещества В cm(B) (m,b; может называться моляльностью раствора), моль/кг
(моль/1000 г) – отношение количества В n(В), (моль) к массе
растворителя m(р-ля), (кг). Не зависит от температуры, поэтому
иногда используется в клинической практике.
m(В)·1000
cm (B)
.
m( р - ля, кг ) M (В) · m( р - ля, г )
n(B)
Физический смысл cm(B) – сколько моль В приходится на 1 кг
растворителя.
cm
1000
100
1 M ( В)
ω
ω
1
10
M ( В) c m
,
0,01
где ω – массовая доля В, %; M(В) – молярная масса В, г/моль.
17.
Титр раствора В Т(В), г/мл – отношение m(В), (г) к Vр, (мл)T ( B)
m ( B)
Vр , мл
.
Физический смысл T(B) – сколько г В содержится в 1 мл раствора.
c M (В)
1000 T
T
c
,
1000
M (В)
T
ρ
100
100 T
ρ
,
где c – молярная концентрация В, моль/л; M(В) – молярная масса
В, г/моль; ω – массовая доля В, %; ρ – плотность раствора, г/мл.
Массово-объёмная концентрация растворенного вещества В
ρ(В), г/л – отношение m(В), (г) к Vр, (л).
m(B)
(B)
1000 T (B)
Vр , л
Физический смысл ρ(В) – сколько г В содержится в 1 л раствора.
Миллиграмм-процент мг% – число мг В, содержащееся в 100 мл
(при ρ = 1 г/мл – в 100 г) раствора.
18.
Растворы электролитовЭлектролиты – вещества, которые в растворах и/или расплавах
диссоциируют (распадаются) на ионы. К ним относятся кислоты,
основания, амфотерные гидроксиды и соли.
Сильные электролиты диссоциируют необратимо, в одну
ступень. Слабые электролиты диссоциируют обратимо и
ступенчато (если это возможно).
Сильные электролиты: а) почти все соли; б) сильные кислоты
в) сильные основания (щелочи)
Слабые электролиты: а) слабые кислоты, в т. ч. почти все
органические; б) слабые основания, в т. ч. NH4OH, и амфотерные
гидроксиды; в) все соли Sn(II), Sb(III), Tl(III) и некоторые соли Cd и
Hg; д) вода.
Оксиды (кроме воды) – неэлектролиты.
19.
Уравнение диссоциации сильного электролита:x
a
Kt An
y
b
a Kt b An
x
y
Коэффициент активности иона f (0 < f ≤ 1) – величина, которая
связывает аналитическую концентрацию иона с с активностью
иона a (эффективной концентрацией, учитывающей межионные
взаимодействия в реальном растворе).
a = f·с.
Чем сильнее взаимодействия, тем меньше f. При разбавлении
раствора межионные взаимодействия слабеют, f → 1, а a → с
lim f 1 lim a c
c 0
c 0
20.
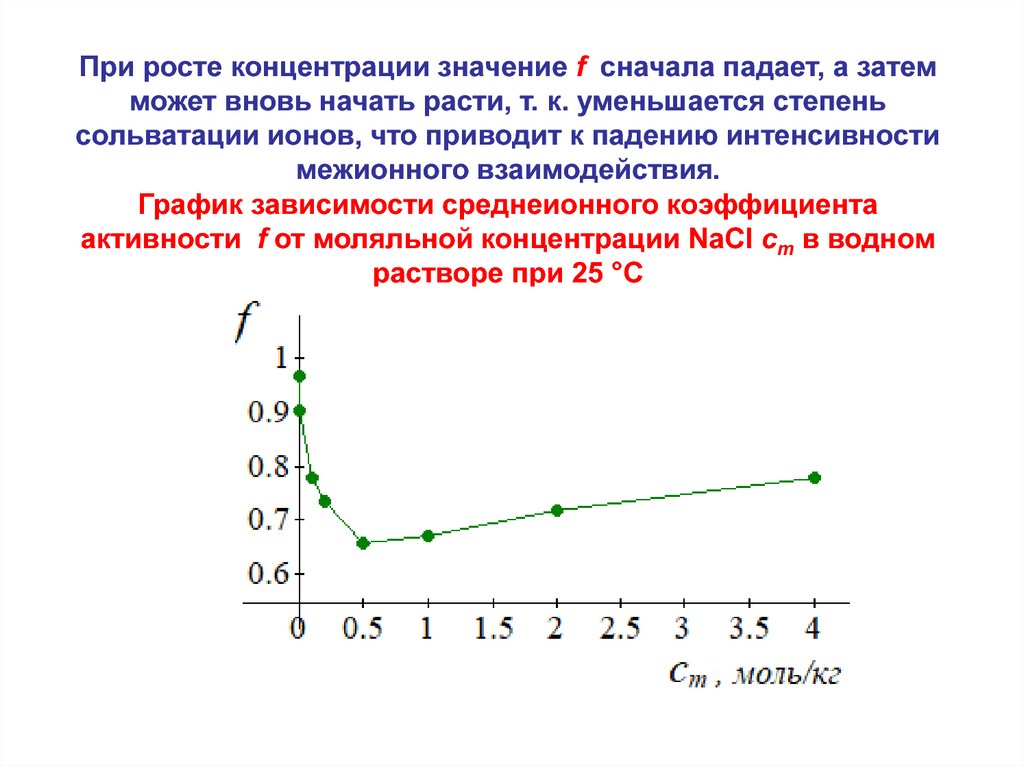
При росте концентрации значение f сначала падает, а затемможет вновь начать расти, т. к. уменьшается степень
сольватации ионов, что приводит к падению интенсивности
межионного взаимодействия.
График зависимости среднеионного коэффициента
активности f от моляльной концентрации NaCl cm в водном
растворе при 25 °C
21.
Ионная сила раствора I, моль/л или моль/кг – полусуммапроизведений концентраций всех ионов раствора ci (или cm,i) на
квадраты их зарядов zi.
1
I ci zi2
2 i
I характеризует межионное взаимодействие в растворе, что
важно для изучения биологических систем и физиологических
растворов, ионная сила которых, в том числе 0,89 %-ного
(0,15 М) раствора NaCI равна, как правило, 0,15 моль/л.
Основные положения теории разбавленных растворов сильных
электролитов Дебая-Хюккеля:
1. Электролит состоит целиком из ионов (полностью диссоциирован).
2. Ионы – заряженные точки.
3. Каждый ион окружен сферической «ионной атмосферой» с зарядом,
равным по величине и противоположным по знаку заряду самого
иона.
4. Взаимодействие ионов чисто электростатическое.
5. Растворитель – непрерывная среда с диэлектрической
проницаемостью ε, он влияет на межионное взаимодействие.
22.
На основе этих положений выведеноуравнение Дебая-Хюккеля, связывающее коэффициент
активности с ионной силой:
0,5 zi I
lg f i 0,2 I
f i 10
1 I
2
при
0,1 I 1
при
I 0,1
lg f i 0,5 zi I f i 10
2
0, 2 I
0 , 5 zi 2 I
0 , 5 zi 2 I
1 I
23.
Уравнение гетерогенного равновесия между осадком не(мало-)растворимого электролита KtaAnb и его ионами в насыщенномрастворе:
Произведение растворимости ПР (Ks) – константа этого
равновесия ([…] – равновесные концентрации). Значения ПР
приводятся в справочниках.
Произведение активностей ионов (ионное произведение) ПИ (ИП)
(a(…) – активности ионов).
В насыщенном растворе ПИ = ПР.
24.
Правило выпадения осадкаЕсли ПИ > ПР, то осадок выпадает, а если ПИ < ПР, то он начинает
растворяться или не выпадает.
Растворимость S, обычно моль/л (иногда г/л) – концентрация
электролита в насыщенном растворе.
Соотношение между S (моль/л) и ПР для сильного электролита
KtaAnb
[Kt ] a S , [An ] b S
2
3
[Ca ] 3S , [PO4 ] 2S
x
y
ПР (a S ) (b S ) a b S
a
b
a
ПР(Ca 3 (PO 4 ) 2 ) 3 2 S
3
2
b
3 2
25
1
10
5
3,9 10 6 моль/л.
108
a b
S
a b
ПР
a a bb
ПР
108 S S
108
5
5
25.
Солевой эффект.При добавлении к насыщенному раствору KtaAnb
(ортофосфата кальция) раствора сильного электролита, не
имеющего с ним общих ионов (хлорида калия),
повышается I, понижаются f, ПИ становится меньше ПР, и
осадок начинает растворяться, его S растет.
Эффект одноимённого иона.
При добавлении к насыщенному раствору KtaAnb (ортофосфата
кальция) раствора сильного электролита, имеющего с ним общие
ионы (хлорида кальция), повышается равновесная концентрация)
общих ионов (катионов кальция), соответственно понижается
равновесная концентрация противоионов (ортофосфат-ионов) и
понижается S.
26.
Слабые электролиты диссоциируют ступенчато, если молекуламожет распадаться на 2 и более ионов. Ступень – отрыв одного
иона.
Степень диссоциации (ионизации) α – доля числа формульных
единиц распавшегося на ионы электролита от их исходного (до
диссоциации) числа. У слабых электролитов 0 < α << 1. α зависит
от природы вещества и растворителя, концентрации c (c ↓, α ↑);
температуры T (T ↑, α ↑); присутствия одноименного иона (чем его
больше, тем меньше α).
Константа диссоциации Кд (Кd) – константа равновесия обратимой
диссоциации слабого электролита. Для кислот Кa [a – первая
буква acid – кислота (англ.)], для оснований Кb [b – первая буква
base – основание (англ.)]. Номер ступени указывается правым
нижним индексом, например Кa ,II. Наряду с константой
диссоциации используют ее показатель pKд. Значения констант и
их показателей приводятся в справочниках.
pK д lg K д K д 10
pK д
.
27.
Вывод уравнения закона разбавления (разведения) Оствальда.Пусть имеется c M раствор слабого электролита Kt+An– , степень
диссоциации которого α, а константа диссоциации равна Кд .
Уравнение его диссоциации:
c 2
Кд
.
1
Кд
[Kt ] [An ] c c
К д ·c
c
28. Пример. Рассчитать концентрацию катионов водорода [Н+] в 9 %-ном уксусе (растворе уксусной кислоты, пл. = 1), если Кa =
1,8∙10–5.Решение.
10 · ·
10 · 9 ·1
с
1,5 моль/л.
M (CH3COOH)
60
с
1,5
83333 100.
5
К a 1,8 10
[H ] К a ·с 1,8 10 5 1,5 5,2 10 3 моль/л.
Ответ: [Н+] = 5,2∙10–3 моль /л.




















![Пример. Рассчитать концентрацию катионов водорода [Н+] в 9 %-ном уксусе (растворе уксусной кислоты, пл. = 1), если Кa = Пример. Рассчитать концентрацию катионов водорода [Н+] в 9 %-ном уксусе (растворе уксусной кислоты, пл. = 1), если Кa =](https://cf2.ppt-online.org/files2/slide/d/DOxAKlcLNRbFXiGu1T9SzPmQq7Z2yd0IUakVjo/slide-27.jpg)

 chemistry
chemistry








