Similar presentations:
Лекции биофак 12.02.2021
1.
АНАЛИТИЧЕСКАЯ ХИМИЯАпостол Наталья Александровна
Доцент по специальности «Химия»
Кандидат педагогических наук
2. определение
• Аналитическая химия наука о методах и средствах определения химического состава вещества3.
• Определяет• Какие химические элементы
и в каких количественных
соотношениях
входят
в
состав анализируемого объекта
4. Два раздела
• Качественный анализ (определяет химическую природувещества)
• Количественный анализ (определяет количественный состав анализируемого объекта)
5. ЦЕЛЬ КАЧЕСТВЕННОГО АНАЛИЗА
• Обнаружение и идентификация компонентов в анализируемом объекте• Качественный анализ предшествует количественному
(реакции кач.анализа являются
основой колич. анализа)
6. Цель количественного анализа
• Определение количественного содержания всех илиотдельных компонентов анализируемого объекта
7. Методы качественного и количественного определения
• Химические• Физико-химические
• Физические
8. Аналитическая реакция
• Аналитическая реакциядает изменение в системе, которое регистрируется визуально или с помощью прибора
9. Химические методы основаны
ХИМИЧЕСКИЕ МЕТОДЫОСНОВАНЫ
На химических аналитических реакциях, проводимых с исследуемым веществом с помощью реактивов.
10. Физико-химические методы
Изменение в системерегистрируется с
помощью прибора
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ
11. Физические методы
ФИЗИЧЕСКИЕ МЕТОДЫИсследования без
проведения химических реакций
12. Исторический экскурс
• Аналитическая химия – наука с богатойисторией
• В Киевской Руси химические производства
- выплавка железа, меди, благородных
металлов, сплавов
- изготовление стекла
- дубление кож
- получение дегтя, смолы, охры, пороха,
селитры
13.
• Пробирное искусство(металлургия, аптечное дело)
• Все это требовало
усовершенствования
технологических приемов,
умения качественно и
количественно анализировать
сырье и материалы
14.
• Петровская эпоха• Анализ рудных и нерудных ископаемых
• Ломоносов М.В. – описал методы
химического анализа и установил закон
сохранения массы вещества
• Значительный вклад внесли Ловиц,
Севергин, Бойль, Берцелиус, Фрезениус,
Меншуткин,
• Менделеев Д.И. открытие периодического
закона
15.
• Аналитическая химия как наукасложилась на рубеже 18-19 столетий.
• Были открыты основные законы химии
- эквивалентов Рихтера
- кратных отношений Дальтона
- постоянства состава Пруста
- Авогадро
16.
• До середины 19 векаосновные методы анализа и
выделения веществ были
• - осаждение
• - титрование
• - перекристализация
• - ректификация
17.
• В 19 в.получили развитие методы• эмиссионного спектрального
анализа (Бунзен, Кирхгофф)
• электрохимические методы
анализа (полярография,
амперометрия)
• хроматографические методы
анализа
• спектроскопические методы
анализа
18.
• В 20 в. получили развитиеметоды атомноабсорбционного анализа,
радиоактивационного анализа,
ЯМР- , ЭПР- методы,
рентгенофлуоресцентный,
электронно-зондовый,
электрохимические методы.
19.
• В настоящее время значениеи роль аналитической химии
возросли. Это вызвано
насущными потребностями
НТР и развитием таких
отраслей как электронная,
космическая, атомная.
20.
• Возросла рольэкологических,
биотехнологических,
фармакологических,
токсикологических
исследований
21.
Направленияразвития
современной
аналитической
химии
22. В области теории
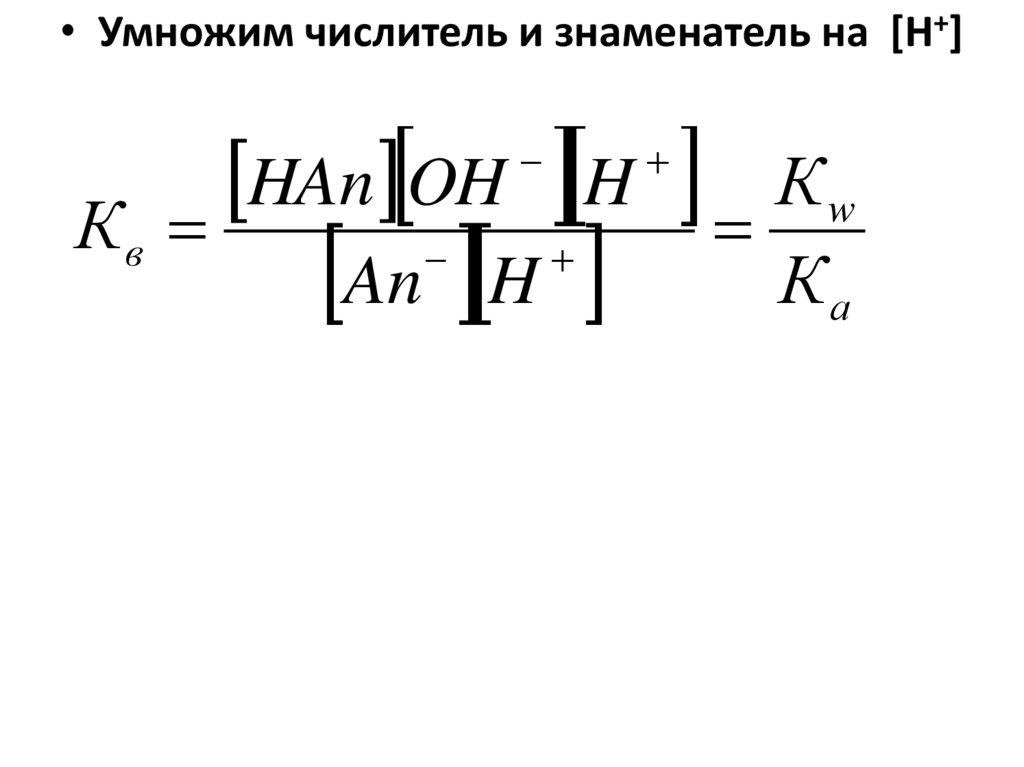
• Развитие теории химических процессов• Расчет сложных химических систем на основе термодинамических и квантово-химических представлений
23. В методическом аспекте
• Внедрение в аналитическийконтроль автоматизации на
основе новых методов и методик (лазерная, полупроводниковая, электронная техника)
24. В прикладном аспекте
• Повышение предела обнаружения• Увеличение точности анализа
• Разработка высоко избирательных
методов анализа
• Разработка экспрессных методов анализа
• Разработка методов ультрамикроанализа
• Разработка неразрушающих и
дистанционных методов анализа
25. Аналитический сигнал
• Измеряемая физическая величина, на основании которойпроизводится количественное
определение содержания определяемого компонента
26.
• Аналитический сигнал вгравиметрии – масса гравиметрической формы
• Аналитический сигнал в титриметрических методах –
объем стандартного раствора
27. Чувствительность избирательность специфичность реакций
ЧУВСТВИТЕЛЬНОСТЬИЗБИРАТЕЛЬНОСТЬ
СПЕЦИФИЧНОСТЬ
РЕАКЦИЙ
28. чувствительность
ЧУВСТВИТЕЛЬНОСТЬИсследуемое вещество
определяется при низкой
концентрации
29. Количественные характеристики
КОЛИЧЕСТВЕННЫЕХАРАКТЕРИСТИКИ
Открываемый минимум
Предельное разбавление
30. Открываемый минимум
• Наименьшее количествовещества или иона, которое может быть определено данной реакцией
при данных условиях ее
проведения
31. Предельное разбавление
• 1/g• g – весовое количество
растворителя, приходящееся на 1 весовую часть
вещества
32. Чувствительность реакции зависит
• От ионной силыраствора
• От присутствия
неэлектролитов
33. Специфичность реакции
• Возможность находить ион в условияхэксперимента в смеси
с другими ионами
34. Избирательность (селективность) реакции
• Сходный эффект с небольшимколичеством ионов или с одним
ионом
• Степень селективности тем выше,
чем меньшее число ионов, с
которыми реакция дает
положительный эффект
35. Статистические методы обработки результатов химического анализа
36. Погрешности
• Систематические• Случайных
• Промахи
37. Систематические
• Ошибки, которые возникают поизвестным причинам или
причины которых легко установить при более детальном
рассмотрении процедуры химического анализа (правильность)
38. Случайные
• Не имеют видимойпричины.
(воспроизводимость)
39. промахи
• Грубые ошибки, резко изменяют результат анализа,легко обнаруживаются, связаны с небрежностью или
некомпетентностью аналитика
40. Среднее значение Х1, Х2……..Хn
n1
M ( x) xi x
n i 1
41. дисперсия
n1
2
S
( xi x )
n 1 i 1
2
42. Стандартное отклонение
SS
2
43. Относительное стандартное отклонение
SSr
x
44. Доверительный интервал
x tS / n x x tS / n45.
Систематический и дробныйметоды анализа
Систематический –
последовательное открытие
индивидуальных ионов
Дробный – определение
индивидуальных ионов в
любой последовательности
46. Для разделения ионов на группы используются методы
• Осаждение в видемалорастворимых соединений
• Комплексообразование
• Экстракция
• Восстановление металлов
47.
Методы анализа- Сероводородный
- Аммиачно-фосфатный
- Кислотно-основной
- Бифталатный
- Сульфидно-основный
48.
Группы катионов• 1. К+, Nа+,Мg2+, NН4+
2+
2+
2+
• 2. Ва , Sr , Са
• 3. Ni2+, Co2+, Fe2+, Fe3+, Al3+,
Cr3+, Mn2+, Zn2+
• 4. Сu2+, Cd2+, Bi2+, Hg2+, Sn2+, Sn4+,
Sb3+, Sb5+.
• 5. Ag+, Pb2+, Hg22+.
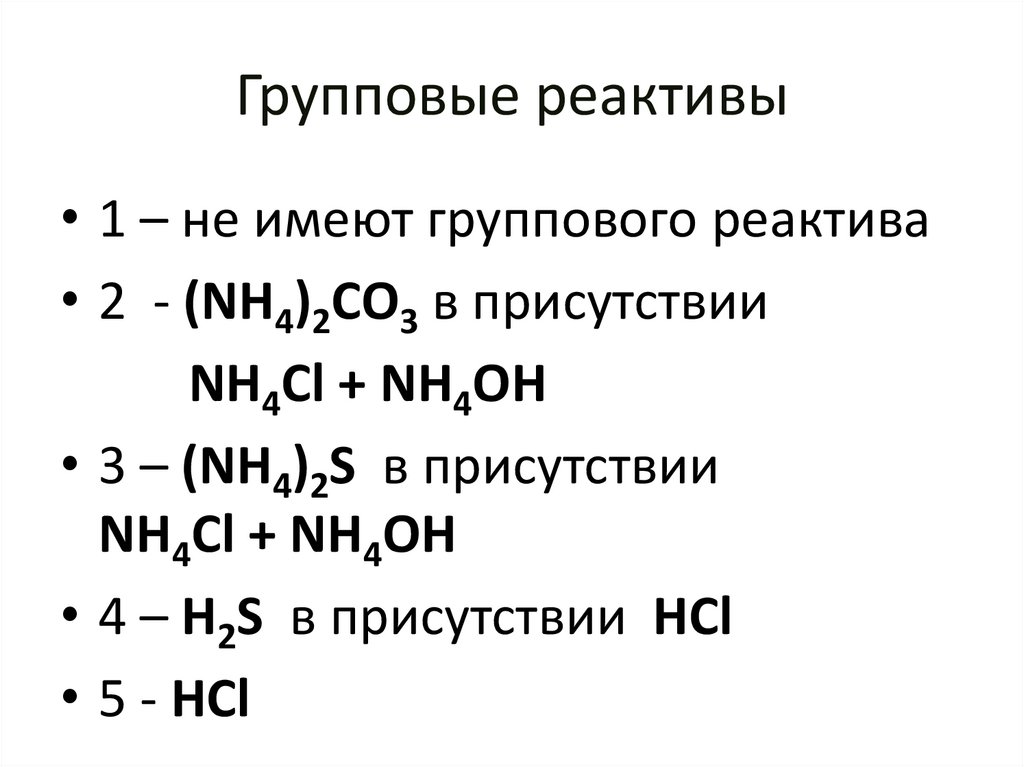
49. Групповые реактивы
• 1 – не имеют группового реактива• 2 - (NH4)2CO3 в присутствии
NH4Cl + NH4OH
• 3 – (NH4)2S в присутствии
NH4Cl + NH4OH
• 4 – H2S в присутствии HCl
• 5 - HCl
50.
• 1 - не осаждается одновременноиз раствора в виде осадка
• 2 – осаждается в виде карбонатов
• 3 – осаждается в виде сульфидов и
гидроксидов
• 4 – осаждается в виде сульфидов и
сернистых соединений
• 5 – осаждается в виде хлоридов
51. Способы проведения химических реакций
• Сухим путем• - пирохимические
• - окрашивания пламени
• - образование окрашенных
перлов
• - растирание
52.
• Мокрым путем• - в пробирке
• - на бумаге
• - на стекле
(микрокристаллоскопические)
53. Методы анализа в зависимости от количества вещества
• Макроанализ• Полумикроанализ
• Микроанализ
• ультрамикроанализ
54.
• Макроанализ• 0.1 – 1.0 г или 1.0 – 10 см3
• Полумикроанализ
• 0.01 – 0.1 г или 0.1 – 1.0 см3
• Микроанализ
• 0.001 – 0.01 г или 0.01 – 0.1 см3
• Ультрамикроанализ
• 0.000001 – 0.001 г или 0.001 – 0.01 см3
55. ТИТРИМЕТРИЧЕСКИЙ (объемный) метод анализа
• Основан на точном измерении объемов растворовдвух веществ, взаимодействующих между собой
56. Классификация методов титриметрического анализа
• По характеру химической реакции– Кислотно-основное Н ++ ОН- = Н2О
– Осаждения и комплексообразования
Аg+ + X- = AgX
– Окисления-восстановления
Перманганатометрия, иодометрия,
бихроматометрия
57. По способу титрования
- метод прямого титрованияН ++ ОН- = Н2О
- метод замещения
Сr3+ + 3Fe3+ =Cr6+ +3Fe2+
- Метод обратного титрования
СаСО3 +2Н+ = Са2+ + Н2О + СО2
58. Требования к реакциям в титриметрическом анализе
• 1. Количественное течениереакции
• 2. Достаточная скорость реакции
• 3. Отсутствие побочных реакций
• 4. Возможность фиксировать точку
эквивалентности
59. Гравиметрический метод анализа
• - метод количественного химического анализа, основанный наточном измерении массы определяемого компонента, выделенного в элементарном виде или в
виде соединения точно известного
состава
60. Методы гравиметрического анализа
• Метод отгонки• СаСО3 + 2 НСl = СаСl2 = СО2 + Н2О
• Метод осаждения
2+
2• Ва + SO4 = BaSO4
61. ТРЕБОВАНИЯ К ОСАДКАМ
• К осаждаемой форме• -должна иметь достаточно малую
растворимость
• -иметь крупнокристаллическую
структуру
• -легко и быстро превращаться в
весовую форму
62. Требования к весовой форме
• -точное соответствие химическогосостава химической формуле
• -достаточная химическая устойчивость весовой формы
• -содержание определяемого компонента в весовой форме было как
можно меньшим
63. Кислотно-основное равновесие
• Современныепредставления о кислотах и
основаниях основаны на
протолитической теории
Брендстеда и Лоури.
64.
• Кислота - вещество, которое являетсядонором протонов
• Основание – вещество, которое
способно принимать протоны.
• Кислота, потерявшая протон,
превращается в сопряженное
основание, а основание, принявшее
протон, становится сопряженной
кислотой
65.
• Кислотно-основное взаимодействие состоит из переноса про-тонаот молекулы кислоты к мо-лекуле
основания:
• HA + B ↔BH + A
• В существовании таких
сопряженных кислотно-основных
пар и состоит сущность кислотноосновного равновесия.
66.
• Если в качестве растворителя используетсявода, в присутствии кислоты существует
равновесие:
+
–
• НА + H2O ↔ H3O +А
• которое описывается константой кислотной
диссоциации:
A
H O
Ka
a
a
3
aHA
67.
• в присутствии основания существуетравновесие:
В + H2O ↔ ВН+ +ОН –
которое описывается константой основной
диссоциации:
Kв
aBH aOH
aB
68. Расчет активности электролитов
• Активность иона – это та эффективная(кажущаяся) концентрация его, в
соответствии с которой он действует в
химических реакциях
аi = fici
69.
• активность(аi) выражается черезкоэффициент активности (fi),
молярную концентрацию (ci). fi ‹
1, при больших разбавлениях он
равен единице. fi зависит от
концентрации рассматриваемого
электролита и от концентрации
всех присутствующих в растворе
ионов.
70.
• Дальнейшим развитием теориисильных электролитов стал закон
ионной силы. Ионная сила раствора
определяется как величина численно
равная полусумме произведения
квадрата заряда каждого из
присутствующих ионов на его
концентрацию:
n
2
i i
i 1
1
CZ
2
71. Уравнение ДЭВИСА
Ионная сила больше 0.12
lg f i 0,5 zi
0,2
1
72. Расширенное уравнение Дебая-Хюккеля
• 0.01 – 0.1lg f i
0,5 z i
2
1
73.
• ПРЕДЕЛЬНЫЙ ЗАКОН ДЕБАЯ –ХЮККЕЛЯ
• <0.01
lg fi 0.5z i
2
74.
• Пример:• Cu(NO3)2 –
0,01М
• Сначала рассчитаем ионную силу
раствора:
1
2
2
0,01* 2 0,01* 2 *1 0,03
2
75. Найдем коэффициент активности
lg Cu2
2
0,5 * 2 0,03
1 0,03
76.
• Коэффициент активностиf Cu 2 0,51
77.
• АКТИВНОСТЬaCU 2 0,01* 0,51 0,0051 M
78. pН сильных электролитов.
• В зависимости от силыдиссоциации кислот и оснований
их разделяют на сильные и
слабые. К сильным кислотам
относятся:
HCl , HBr , HI , HNO3 , HClO4 , H 2 SO4.
79.
• Считается, что в разбавленных водныхрастворах эти кислоты диссоциированы
на 100%. Если известна концентрация
сильной кислоты, можно рассчитать рН
ее раствора. Для простоты расчетов
будем считать, что растворы
разбавлены, поэтому f = 1, а = с.
Возьмем кислоту HАn:
• HАn →H+ + An-
80.
рнH C
HА
pH lg H lg CHА
81.
• Обратная задача: по величине рНрассчитать :
H 10
- pН
82. pН слабых электролитов.
• Слабые кислоты и основания в водныхрастворах
диссоциированы
частично.
Рассмотрим случай, когда
CHAn
/ Ка › 1*103
Возьмем кислоту НАn в водном растворе
она диссоциирует:
• НAn ↔ H+ + An-
83.
• Константа этого процесса:H An
K
a
HAn
84.
• Примем во внимание:H An
• из уравнения диссоциации видно, что
CHAn
• СНаn/Ка › 1 * 103, поэтому [HAn]=
– [H+]
~
CHAn
85. Тогда:
HK
2
a
C HAn
86. Концентрация ионов водорода равна
H KaCHAn
87. рН будет равно
pН lg H88.
• Рассмотрим случай, когда,CHAn/К ‹ 1 * 103
а
• Возьмем кислоту НАn. В водном растворе идет
диссоциация
• HAn↔H++An−
89.
• Константа этого процессаH An
K
a
HAn
90. Примем во внимание:
H An• из уравнения диссоциации
91.
• равновесная концентрациякислоты
HAn CHAn H
92.
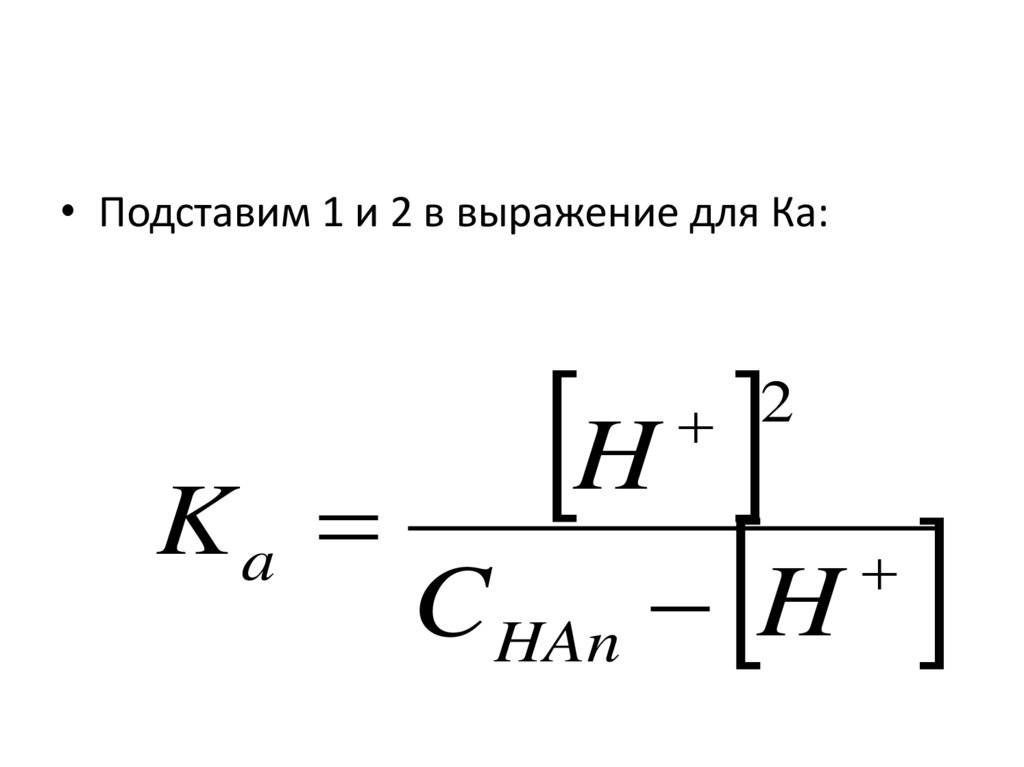
• Подставим 1 и 2 в выражение для Ка:H
K
C
H
2
a
HAn
93.
• Преобразовав, получим:H K H K C
2
a
a
0
HAn
94.
• Решение данного квадрат-ногоуравнения:
2
Ka
Ka
H
K a C HAn
2
4
pН lg H
95. pН электролитов с учетов диссоциации воды.
• В случае, когда электролит слабый ивыполняется условие:
C HAn Ka 10
12
• или сильный электролит разбавлен
(C ‹ 10-6м) необходимо учитывать
диссоциацию воды.
96.
• Возьмем сильную кислоту НАnконцентрации 1* 10-8 м.
• В водном растворе идут
процессы:
• HAn→H++An−
• H2O ↔ H++OH−
97. Условие электронейтральности:
H An OH98.
• [Аn-]= CHAn,т.к. HAn диссоциирует
количественно
99.
OH H =К
w
OH
Кw
H
100.
КwH C HAn
H
101.
• Решаем данное уравнениеотносительно
H
H СHAn H Кw 0
2
H
C HAn
2
2
C HAn
4 Кw
pH lg H
102. Расчет рН буферных смесей
Возьмем в качестве примера растворслабой кислоты НАn и ее соли МеАn.
(СНАn/Ка ›1*103).
Кислота НАn диссоциирует по
уравнению:
• HAn→H++An–
103.
• Константа этого процесса:An H
K
HAn
a
H
K a HAn
H
An
104.
An CH
MeAn
K a C HAn
CMeAn
рH lg H
105.
• МеНАn и Ме2Аn• СHAn необходимо рассматривать как
концентрацию кислой соли СМе2Аn как концентрацию средней соли,
тогда
H C
K 2CMeHAn
Me2 An
106.
• Когда имеем смесь многоосновнойкислоты Н2Аn (СНnAn/Ка1 ›1*103) и ее
кислой соли МеНАn, то в выражении (1)
необходимо рассматривать СНAn как
концентрацию Н2An и СМеАn как
концентрацию МеНAn, тогда
H C
K1CH 2 An
MeHAn
107.
• Количество кислоты или щелочи,которое при прибавлении к
буферному раствору вызывает
изменение РН на небольшую
величину, характеризует буферную
емкость. Количественно буферную
емкость определяют как количество
сильной кислоты или щелочи,
которую необходимо прибавить к 1
литру раствора, чтобы изменить
значение рН на единицу.
108.
• Буферная емкость зависит отконстанты диссоциации слабой
кислоты или основании, от
отношения концентраций
компонентов раствора. Если Ск+] = К
/С
=
1,
то
[Н
ты соли
кислоты, при
этом буферная емкость будет
иметь максимальное значение.
109.
• Рассмотрим случай, когда вбуферную смесь вносим сильную
кислоту или основание. Имеем
буферную смесь, которая состоит из
слабой кислоты НАn и ее соли МеАn.
В эту смесь внесли 0,01 м НCl.
Рассмотрим, как изменяется рН
раствора.
• После внесения сильной кислоты
равновесие
• HAn↔H++An– сместиться влево
110.
• Внесено НСl 0,01 м, значит НСl0,01 м образовалось из Аn–,
которые поступили в раствор за
счет диссоциации соли. Тогда:
HAn CHAn 0.01
111.
MeAn CMeAn 0.01K
C
0
.
01
a
HAn
H
CMeAn 0.01
112.
• Когда внесено 0.01М основанияK a CHAn 0.01
H
CMeAn 0.01
pH lg H
113. Расчет констант кислотности и основности
• Согласно протолитической теории анионыслабых кислоты относятся к основаниям,
поэтому они могу присоединять протон.
Константу этого процесса называют
константой основной диссоциации. И
наоборот катионы слабых оснований
относятся к кислотам, поэтому они могут
присоединять ОН- - ион. Константу этого
процесса называют константой кислотной
диссоциации.
114.
Рассмотрим расчет этих констант. Найдемконстанту основности Аn—иона. Для этого
используем константу кислотной
диссоциации в водном растворе:
• An- + H2O ↔ Han + OH• Константа этого процесса:
HAn OH
Кв
An
115.
• Умножим числитель и знаменатель на [Н+]HAn OH H К w
К
в
An H
Ка
116.
• Для К+-иона константа кислотностиимеет вид:
Kw
Ka
Кв







































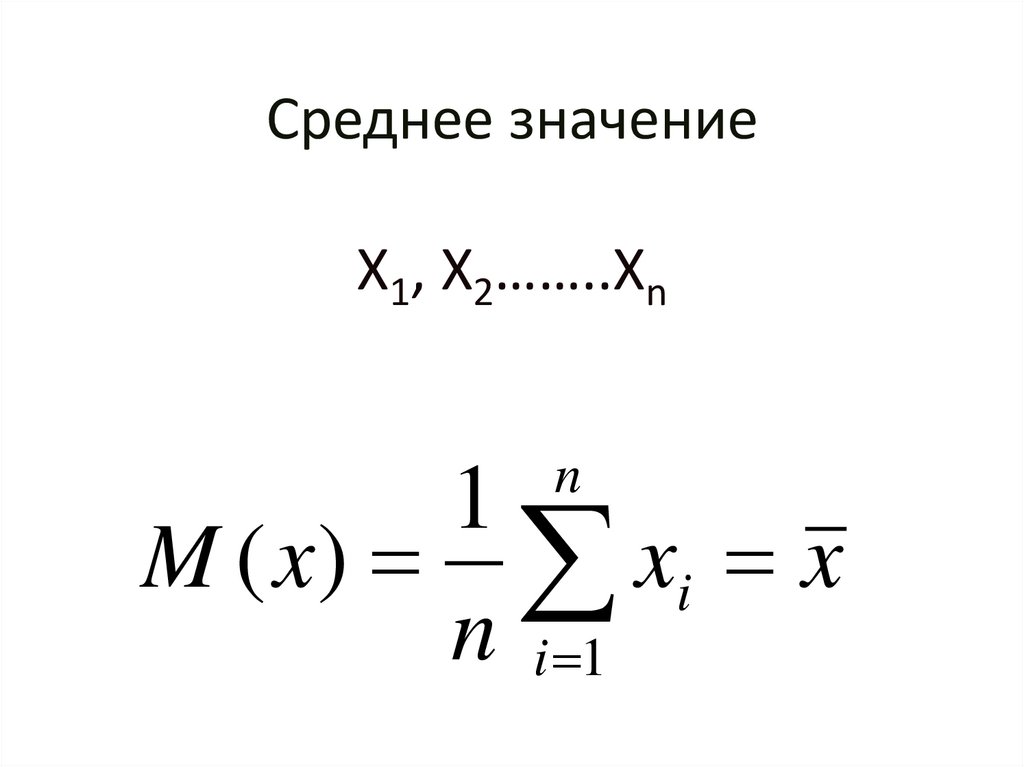
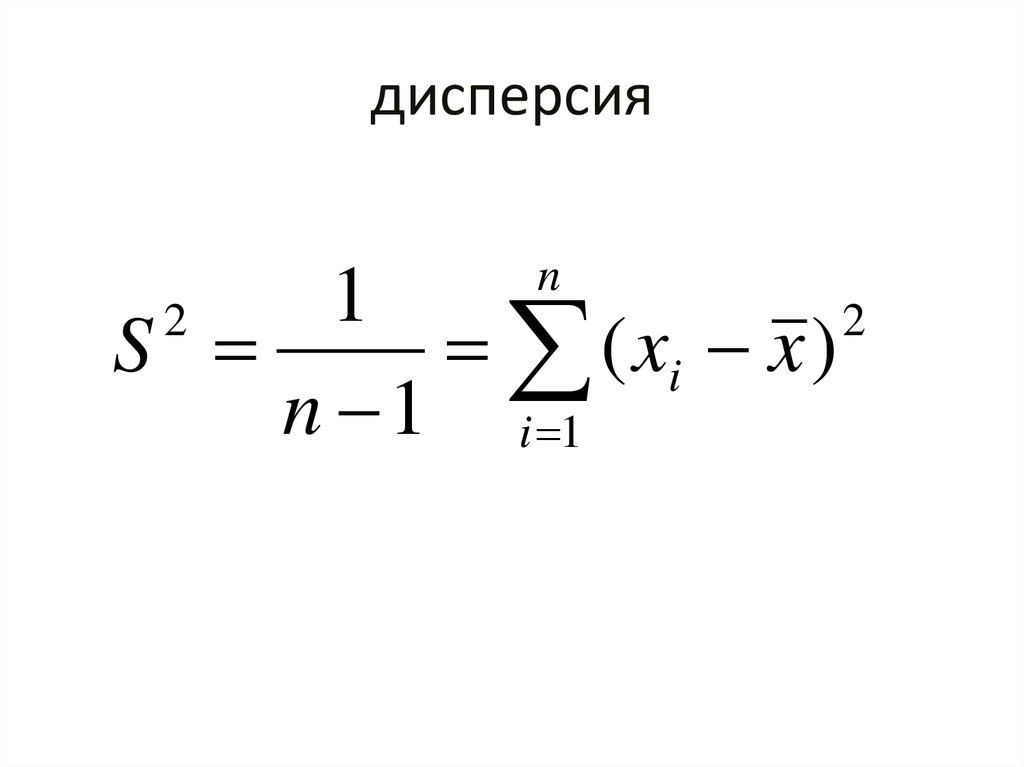






























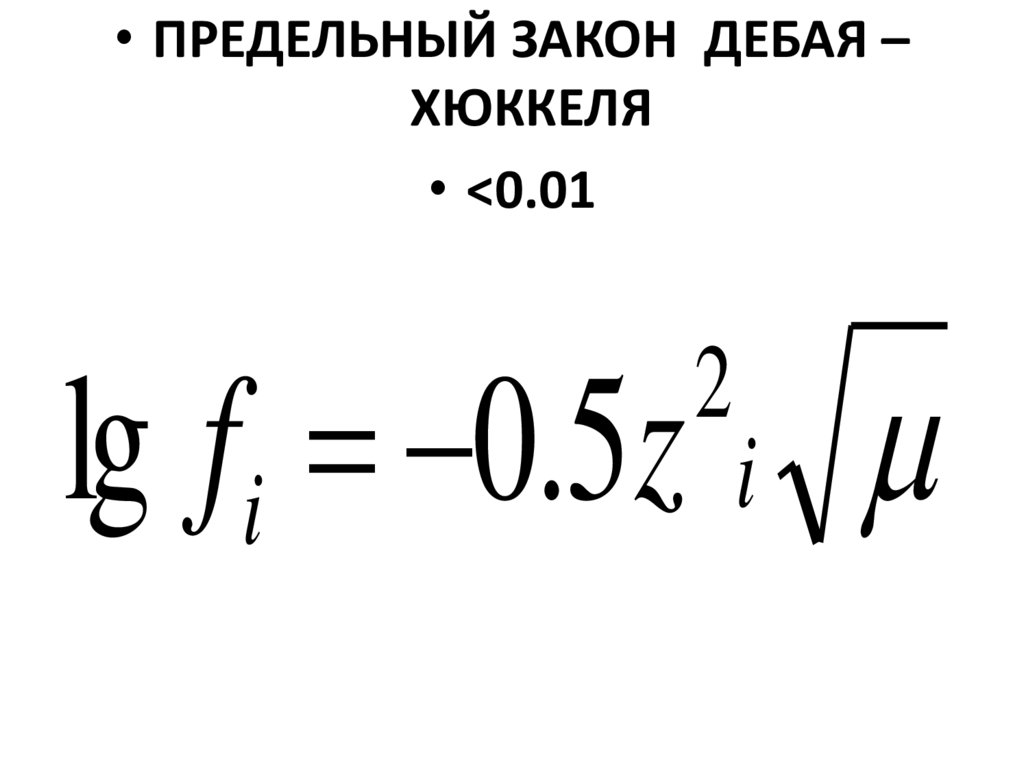


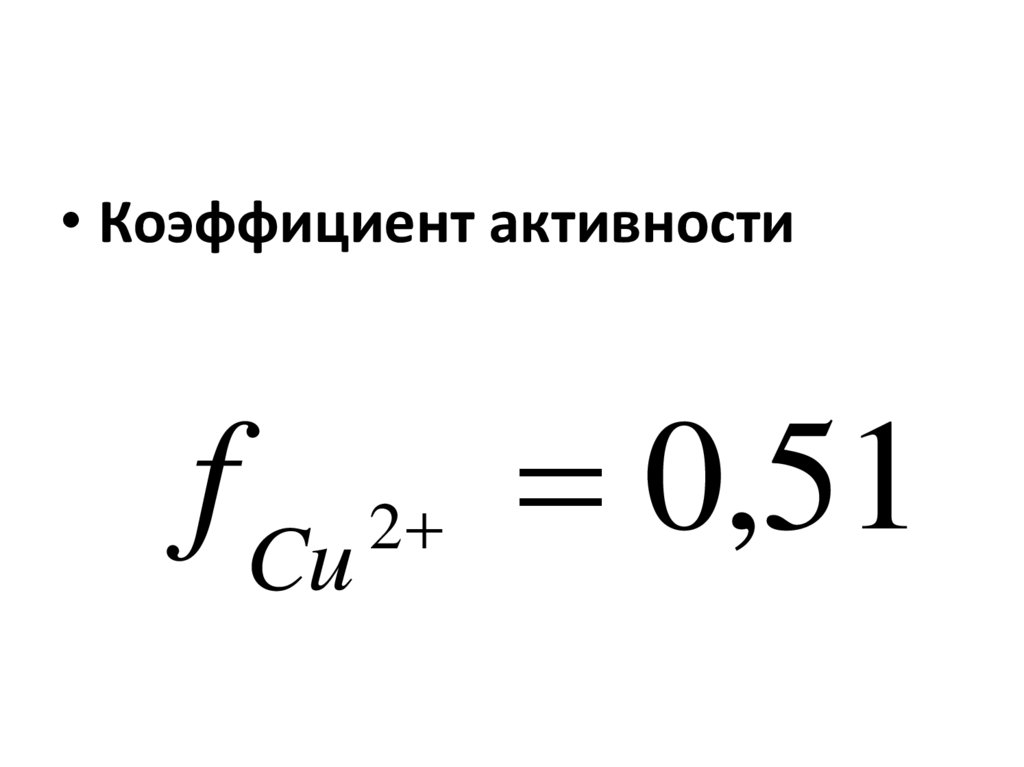



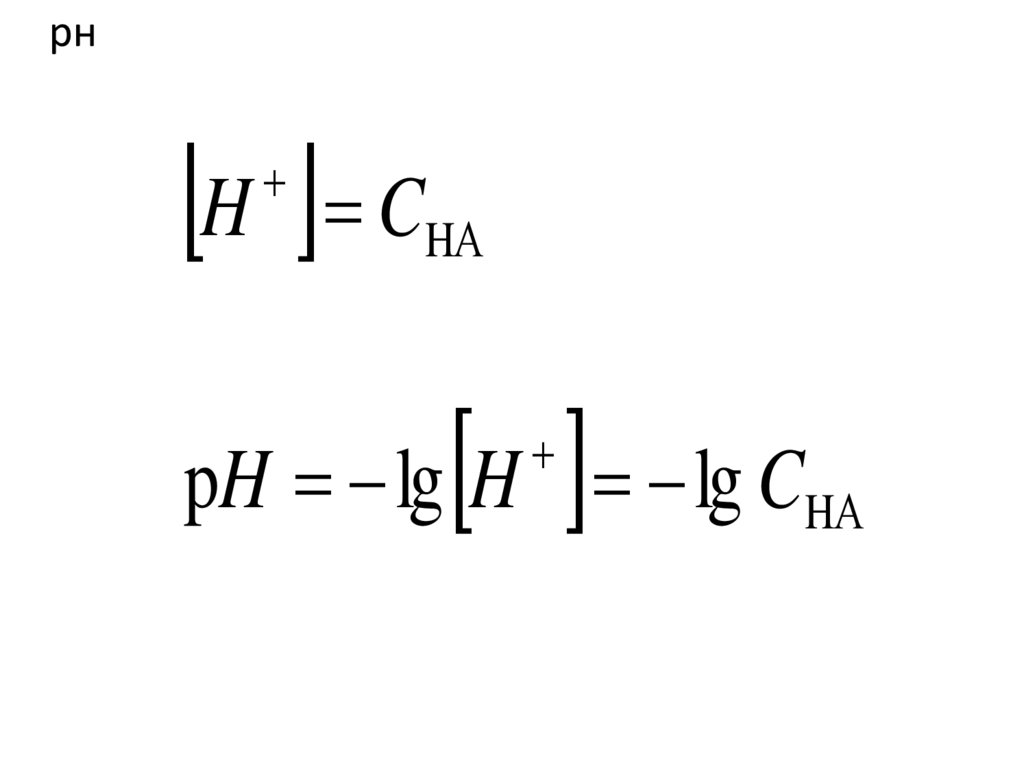


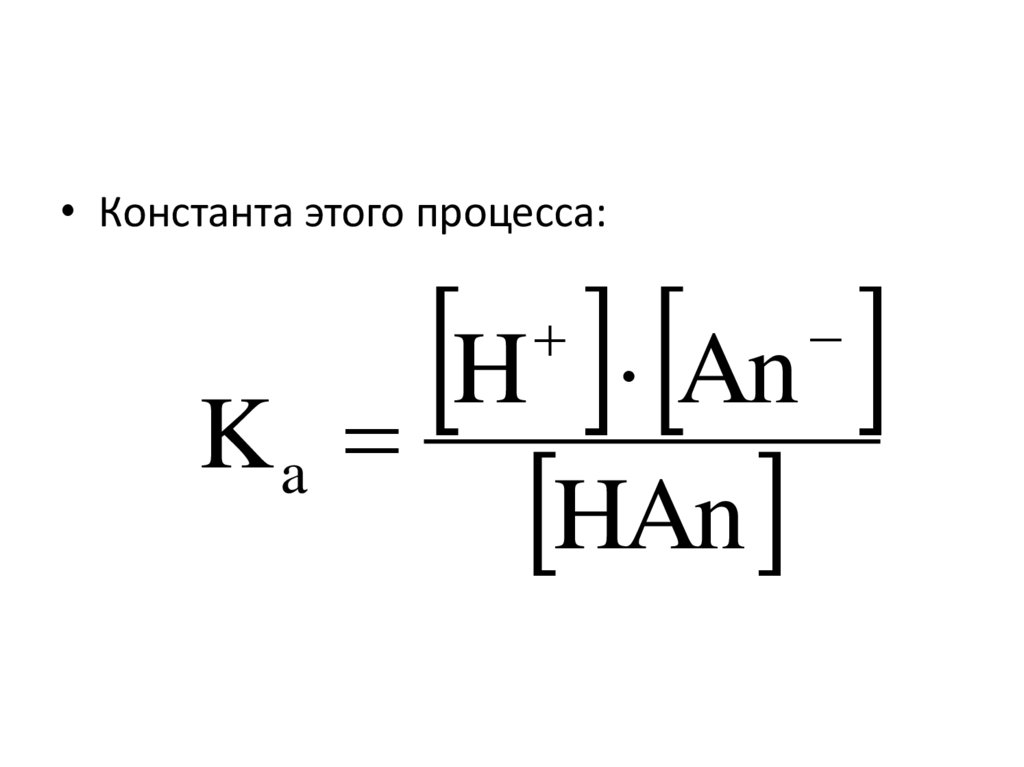


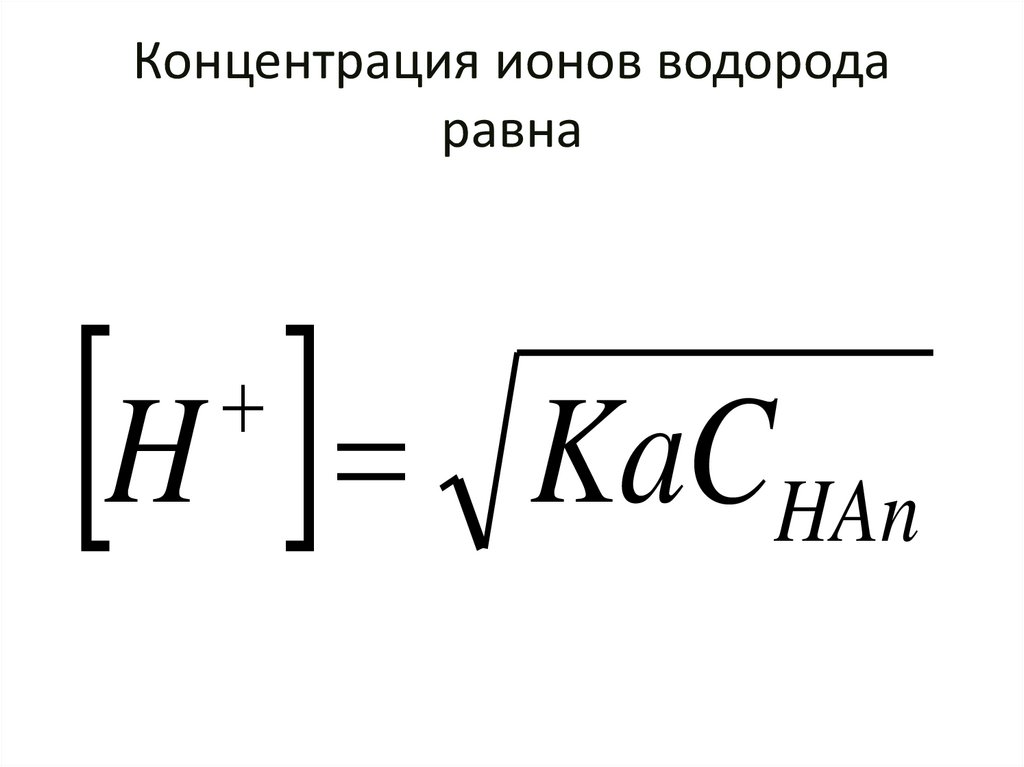
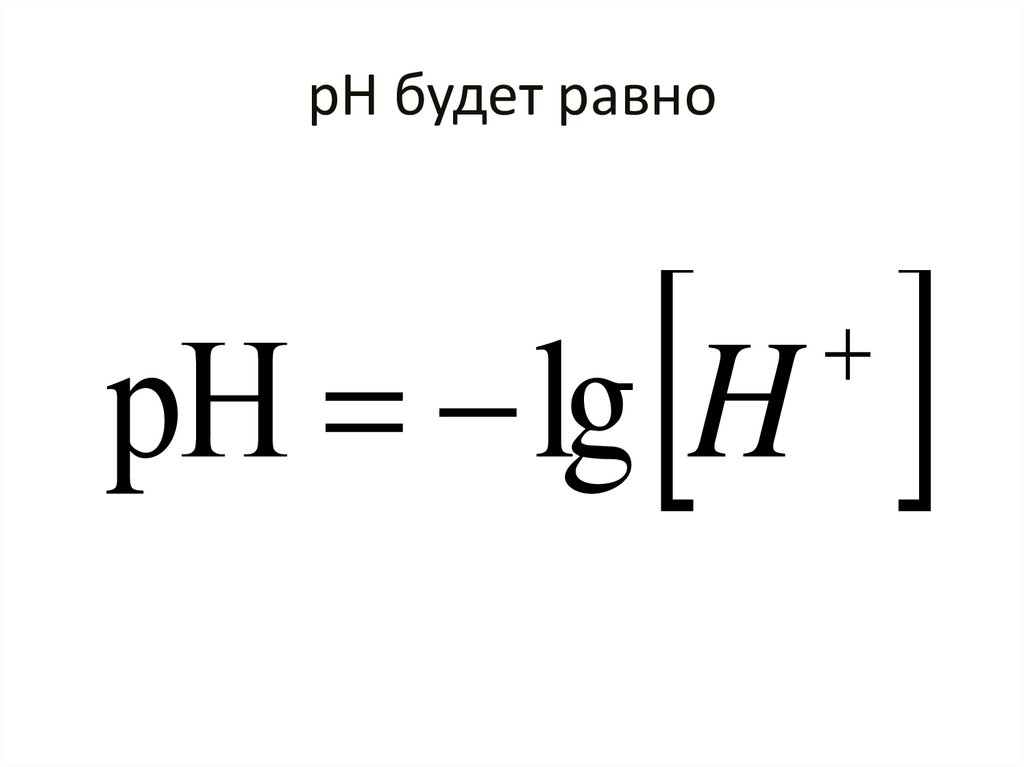

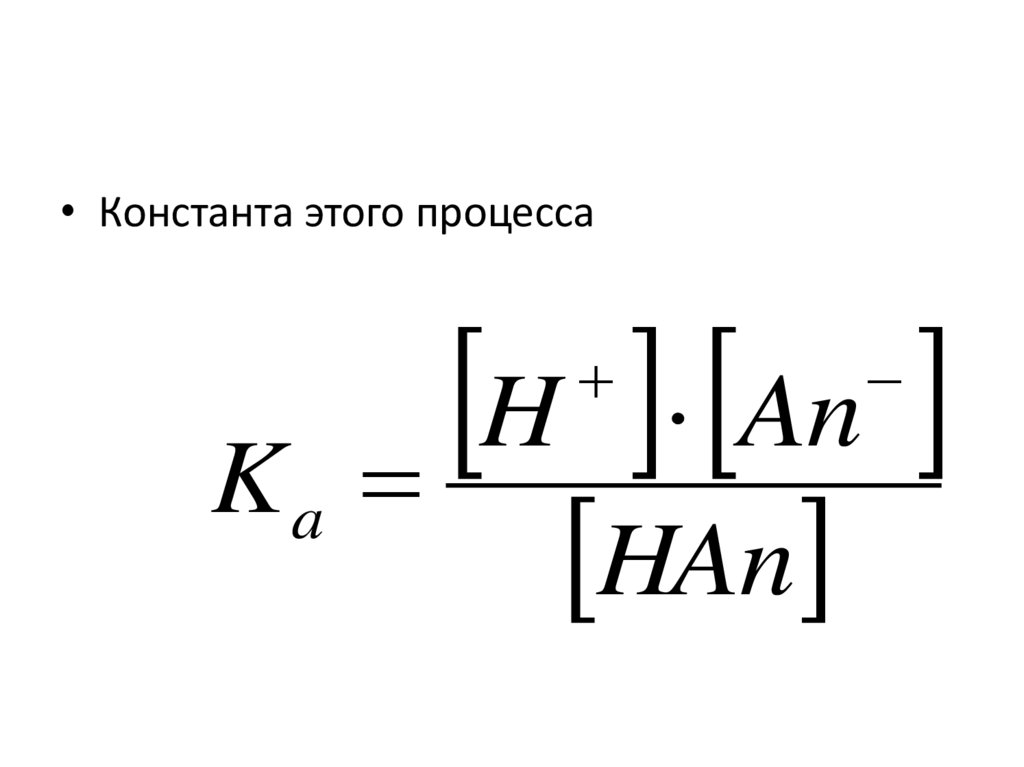

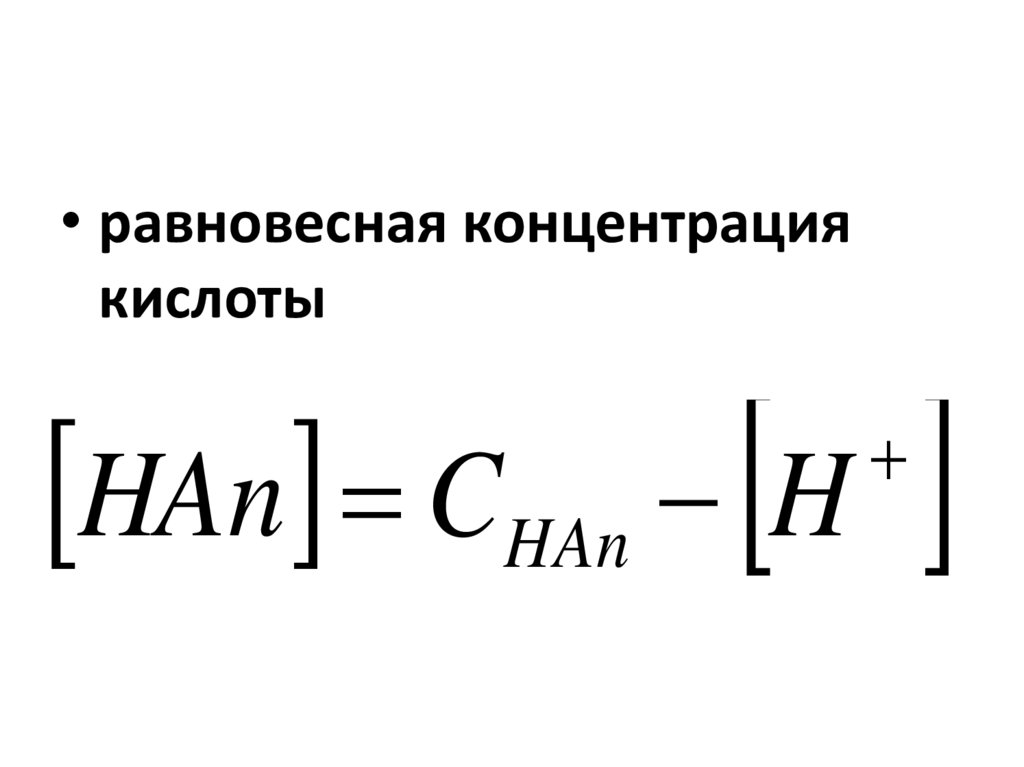
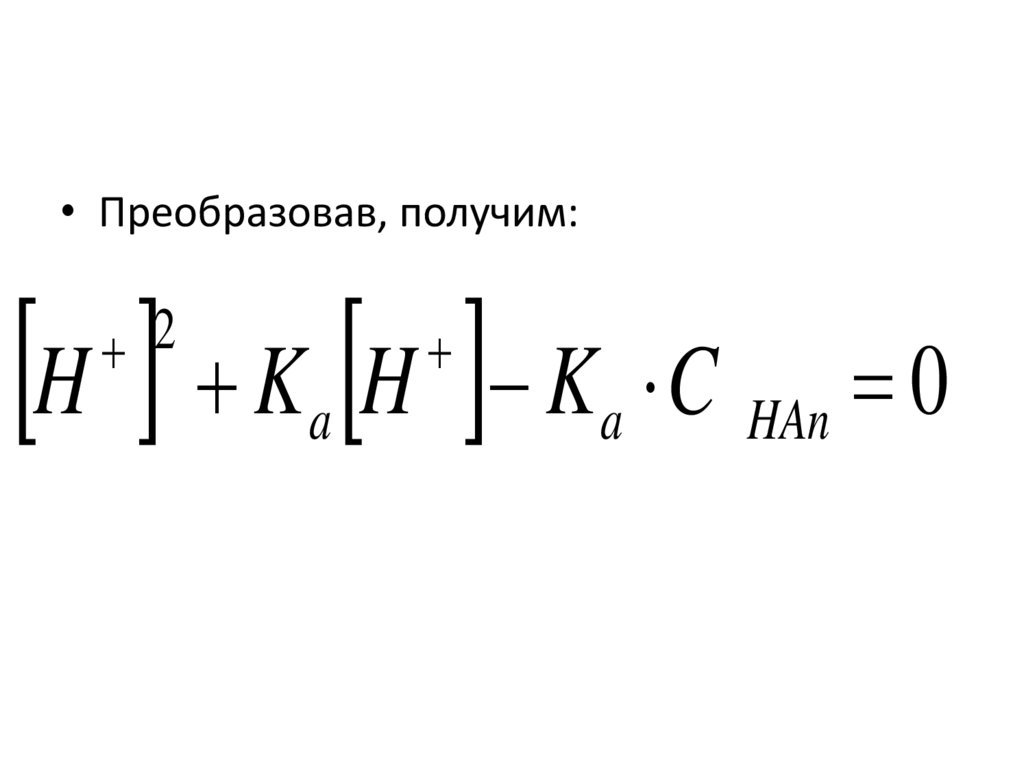



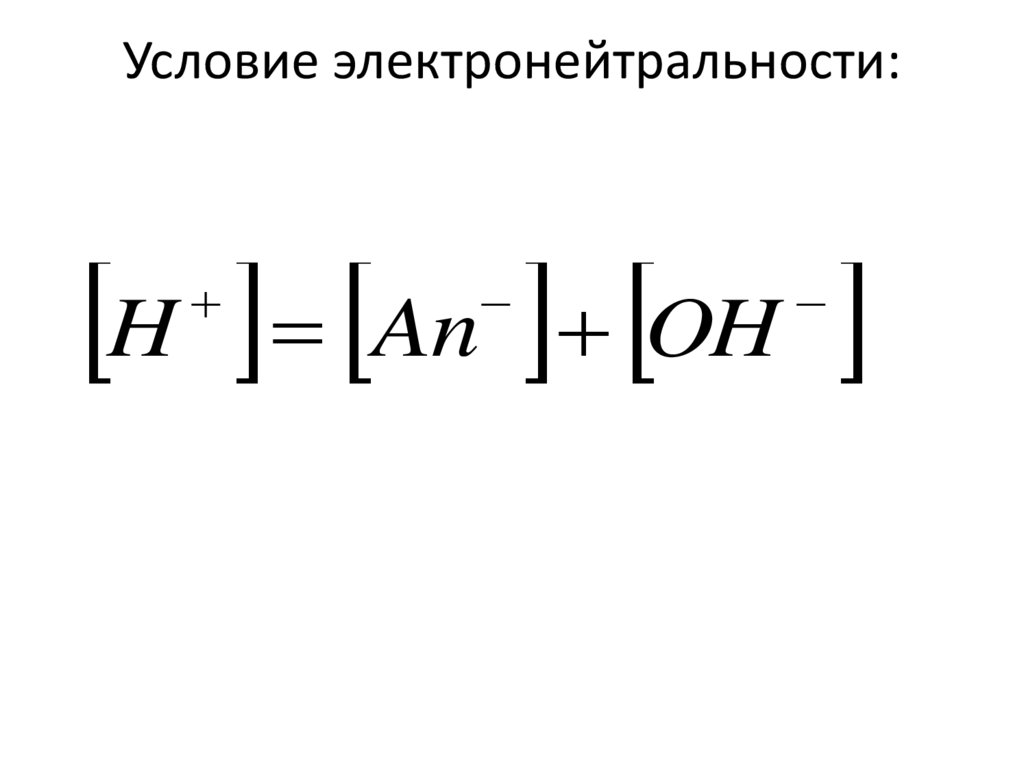

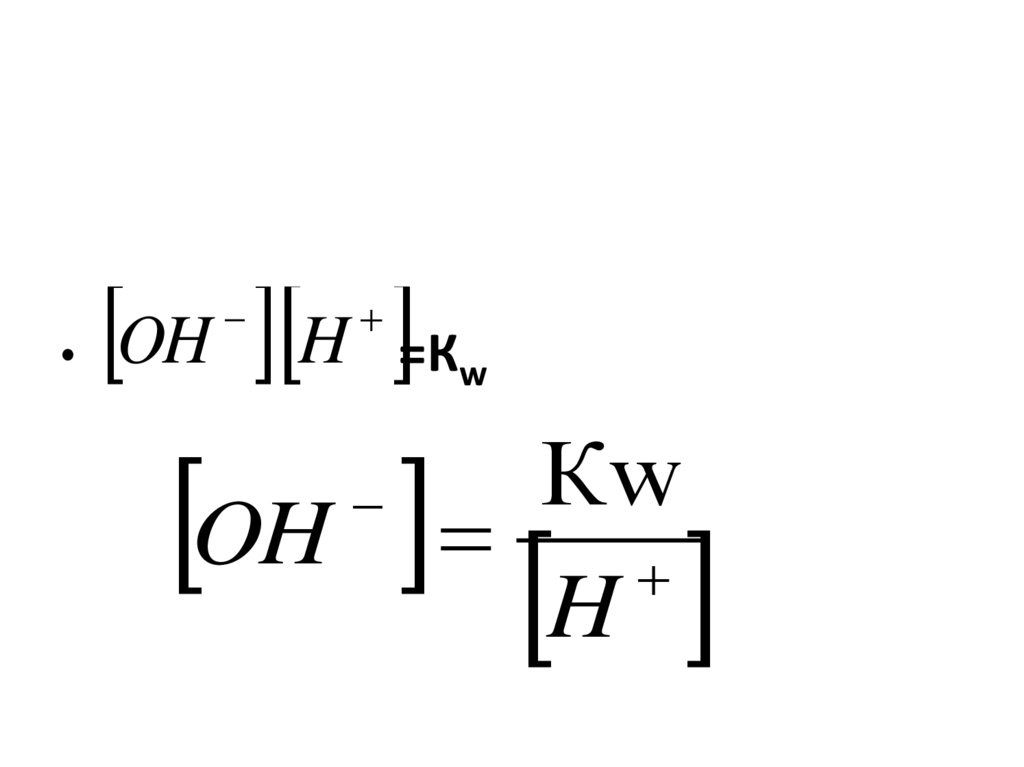
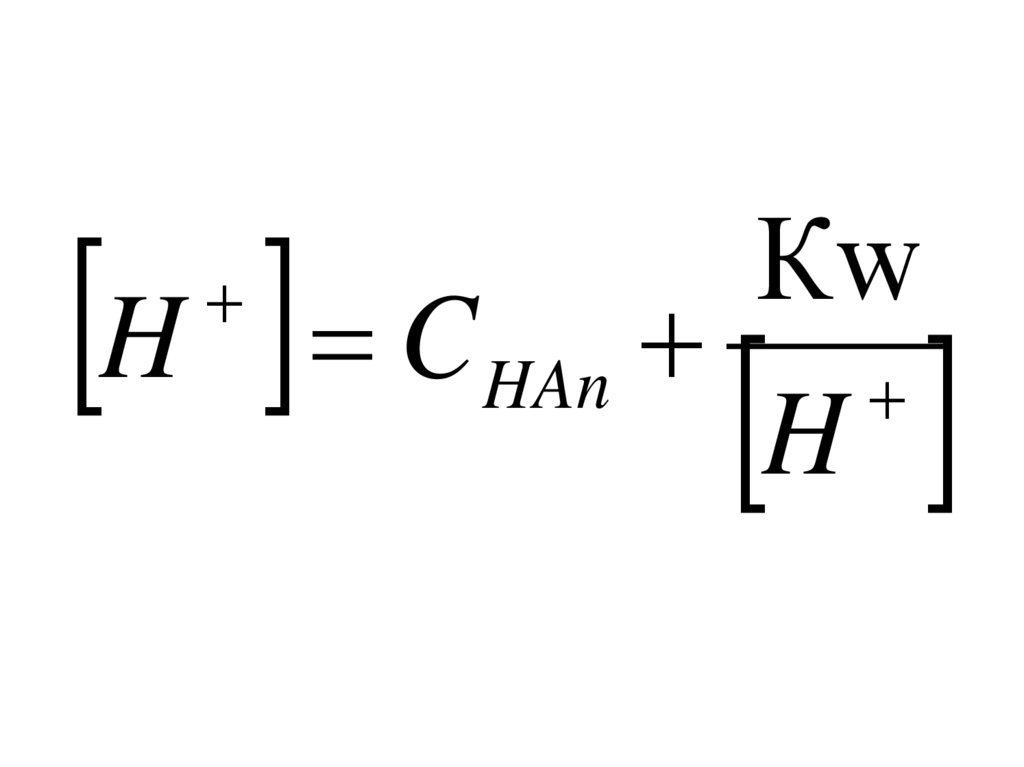



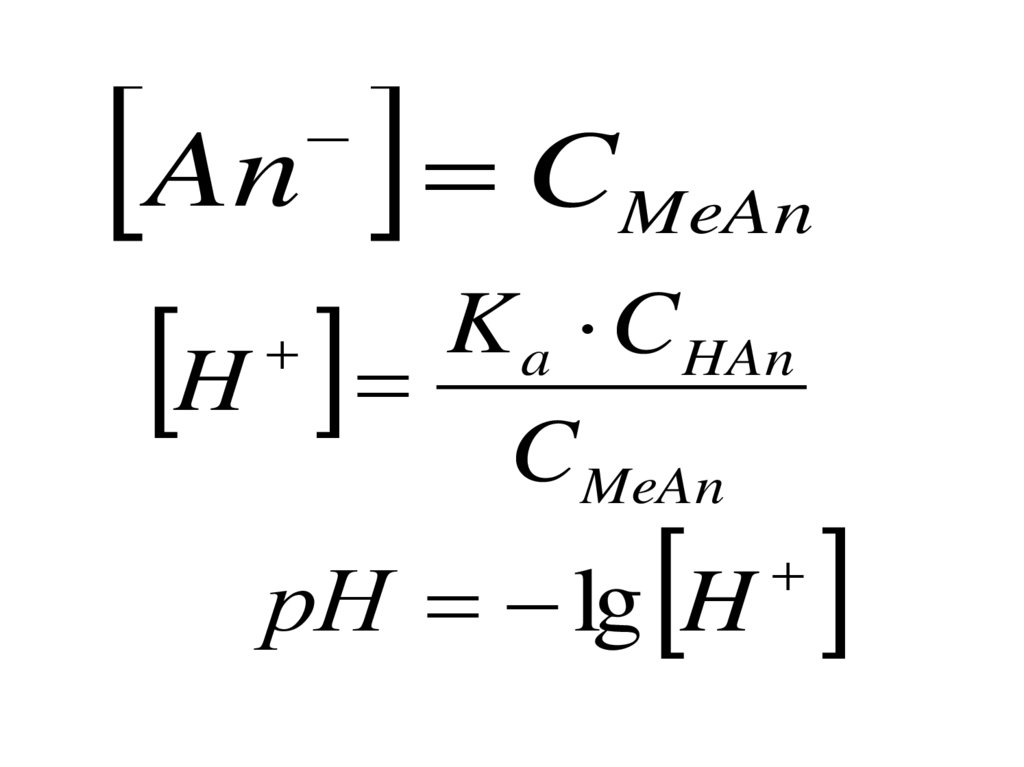






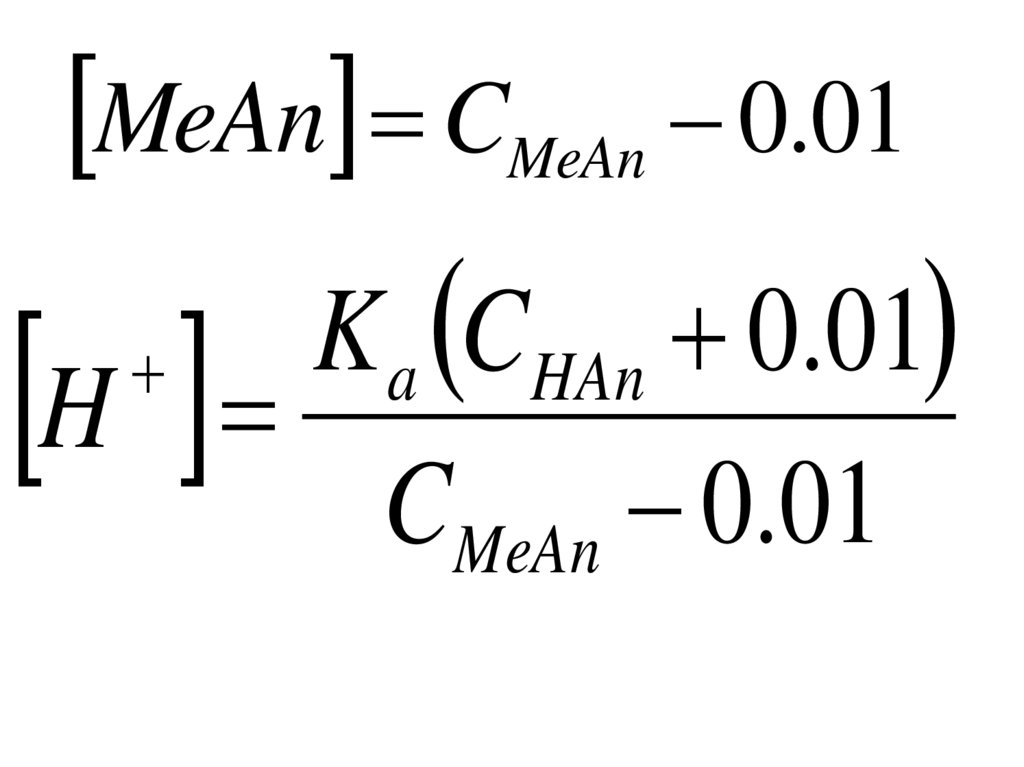




 chemistry
chemistry








