Similar presentations:
Аналитические химические реакции. Классификация аналитических химических реакций
1. Аналитические химические реакции. Классификация аналитических химических реакций
Многообразие химических аналитических реакций сводится к следующим4-м основным классам:
1) Кислотно-основные реакции
(1)
H 2O
H OH
HAn OH
H 2O An
(2)
2) Окислительно-восстановительные реакции (редокс-реакции)
2CuI I 3
2Cu 2 5I
5Fe3 2Mn 2 8H 2O
5Fe2 2MnO4 16H
(3)
(4)
3) Осаждения – растворения
Ag Cl
Fe3 3OH
AgCl
Fe OH 3
(5)
(6)
4) Комплексообразования
Co2 H 2Y 2
CoY 2 2 H
3
Al 3 6 F AlF6
(7)
(8)
2.
Запишем уравнение обратимости в общем виде:A+B
V1
C + D.
V2
(9)
В ходе экспериментальных наблюдений установлено, что скорость
химической реакции в каждый ее момент прямо пропорциональна
молярным концентрациям реагирующих веществ. Тогда скорость
прямой реакции:
(10)
V k C C ,
1
1
A
B
где V1 – скорость прямой химической реакции; k1 – константа скорости;
СA, CB – молярные концентрации.
Скорость обратной реакции
V2 k2 CC CD .
(11)
V1 V2 ,
(12)
k1 A B k2 C D
(13)
Т.к. в состоянии равновесия
то
[ ] обозначены молярные концентрации в состоянии равновесия, когда
число образующихся в единицу времени молекул С и D становится
равным числу получающихся из них молекул A и B.
3.
Уравнение (13) можно записать в другой форме и получить выражениедля константы равновесия (К):
k1 C D
K
k 2 A B
(14)
В реальных растворах вместо концентрации вводится понятие
активности
aA f A A
Величина K характеризует сдвиг равновесия
химической реакции в прямом или обратном направлении:
при K > 1
V1 > V2 , равновесие сдвинуто вправо;
при K < 1
V2 > V1 , равновесие сдвинуто влево;
при K = 1
V2 = V1 , состояние равновесия.
(15)
обратимой
4. Применение кислотно-основных реакций в аналитической химии
Кислотно-основные аналитические реакции делятся на:1) Кислотно-основное взаимодействие в чистом растворителе;
2) Взаимодействие кислоты или основания с растворителем, т.е.
диссоциация;
3) Буферное взаимодействие;
4) Гидролиз солей;
5) Взаимодействие кислоты с основанием (реакция нейтрализации).
5. Кислотно-основное взаимодействие в чистом растворителе
Кислотно-основное взаимодействие в чистом растворителе можнопредставить следующим образом:
H 3O OH
H 2O H 2O
кислота 1 основание 2 кислота 2
С2 H 5OH C2 H 5OH
основание 1
,
C2 H 5O C2 H 5OH 2
или в сокращенной форме:
H OH ,
H 2O
С2 H 5OH
H C2 H 5O ,
(1)
(2)
(3)
(4)
где H3O+ - ион гидроксония;
С2H5O- - лиат-ион;
С2H5OH2+ - лионий-ион;
Запишем выражение для константы равновесия реакции диссоциации
воды – реакция (3). В данном случае она называется константой
диссоциации
H OH
K
H 2O
.
(5)
6.
Величина K очень мала, что говорит о том, что H2O очень слабый электролит,плохо диссоциирует на ионы. Равновесие смещено влево,
H 2O const ,
поэтому
K H 2O
H
OH
K H 2O
const
const
(6)
const
Произведение равновесных концентраций ионов H+ и OH- при данной
температуре есть величина постоянная, называемая ионным произведением
воды.
H 2O 55,5 моль / дм3
o
при
25
C
16
K 1,8 10
K H 2O 55,5 1,8 10 16 1 10 14
Если перейти от чистого растворителя к концентрированным
растворам электролитов K H O должно быть выражено через активности, а не
2
концентрации. Активность – это некоторая эффективная концентрация,
пропорциональная фактической концентрации вещества
OH
aH f H H
aOH fOH
(7)
(8)
7.
K H 2O aH aOH f H H fOH OH ,I 1
z
2
2
1
C1 z22 C2 zi2 Ci ,
I
2
z
i Ci
2
(9)
(10)
(11)
,
K H 2O
lg H lg OH
K H 2O H OH
lg K H 2O
(12)
(13)
8.
Умножим правую и левую части уравнения (13) на (-1)lg K H 2O lg H lg OH
lg OH pOH
lg H pH
При 25 oC
lg 10 14 14 pH pOH
Для чистой воды H OH
pH < 7 - кислый раствор;
pH > 7 - щелочной раствор.
(14)
(15)
(16)
(17)
и pH=pOH=7 – нейтральный раствор.
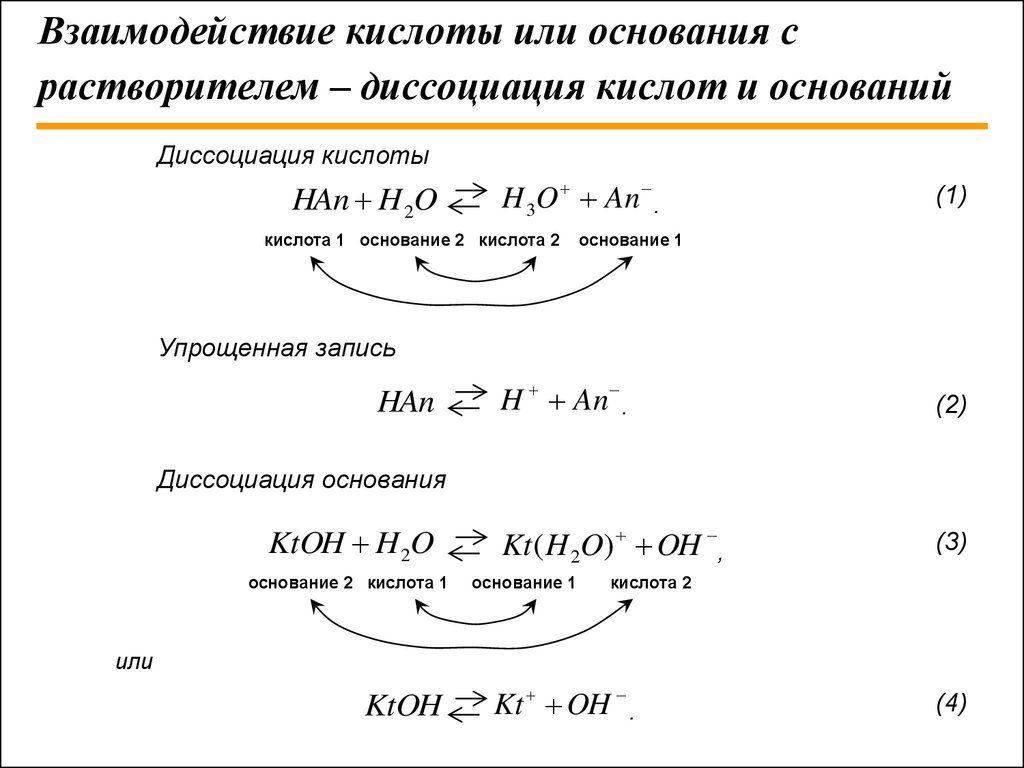
9. Взаимодействие кислоты или основания с растворителем – диссоциация кислот и оснований
Диссоциация кислотыHAn H 2O
H 3O An .
кислота 1 основание 2 кислота 2
(1)
основание 1
Упрощенная запись
HAn
H An .
(2)
Kt ( H 2O) OH ,
(3)
Диссоциация основания
KtOH H 2O
основание 2 кислота 1
основание 1
кислота 2
или
KtOH
Kt OH .
(4)
10.
Приведенные выше равновесия в системе кислота –растворитель, основание – растворитель описываются константами
равновесия, называемыми константами диссоциации.
Для кислоты
Ka
H An
.
(5)
Kв
Kt OH
.
(6)
Для основания
HAn
KtOH
Ka и Kв служат мерой силы электролитов. Чем больше Ka и Kв, тем
сильнее электролит.
Для сильных электролитов (кислот и оснований) Ka >> 1, Kв >> 1.
Кислоты (HCl, HClO4, HNO3, H2SO4) и основания (NaOH, KOH), все соли
диссоциируют нацело. Понятием Ka, Kв пользуются на практике только
для слабых кислот (органические кислоты) и слабых оснований (NH4OH,
пиридин и другие).
11. Вычисление рН растворов кислот, оснований в связи с их диссоциацией
Сильные электролитыHCl H Cl
H C
HCl
HCl
pH lg CHCl
NaOH Na OH
NaOH
OH C
NaOH
(1)
Слабые электролиты
(2)
(3)
(4)
(5)
pOH lg CNaOH (6)
pH 14 pOH , (7)
где С – общая (аналитическая)
концентрация
H An .
HAn
H An
.
Ka
(1)
HAn
(2)
Мы знаем общую (аналитическую)
концентрацию кислоты, ее мы
обозначаем СHAn. Слабая кислота
присутствует в растворе и в виде
ионов, и в виде молекул, ее общая
концентрация складывается из суммы
равновесных концентраций ионов и
молекул. По уравнению диссоциации
H An ,
можно записать
поэтому
12.
Сильные электролитыСлабые электролиты
СHAn H HAn An HAn . (3)
Если кислота является очень слабой,
то [H+] ( [An-] ) гораздо меньше [HAn]
и в уравнении (3) этой величиной
можно пренебречь, тогда
СHAn HAn .
H
.
(4)
2
Ka
Отсюда
H
СHAn
К a CHAn ,
pH 1 pK a 1 lg CHAn
2
2
pK a lg K a
(5)
(6)
(7)
13.
Сильные электролитыСлабые электролиты
Если [H+] ( [An-] ) сопоставима с [HAn],
то
2
H
K
С H ,
H K H K C 0
a
(8)
HAn
2
a
a
HAn
(9)
Надо решать квадратное уравнение.
Аналогично выполняются расчеты в
растворах слабых оснований
OH
К в CKtOH ,
pOH 1 pK в 1 lg CKtOH
2
2
(10)
(11)












 chemistry
chemistry








