Similar presentations:
Лекция 4.2.3. Тема 4.2
1. Лекция 4.2.3. Свойства органических соединений. Алкены
2. Особенности классификации и номенклатуры алкенов
Классификация алкенов• По строению углеводородного радикала:
Алифатические (нециклические): Цепь незамкнута.
• Неразветвленные (например, CH₃-CH=CH₂ — пропен).
• Разветвленные (например, (CH₃)₂C=CH₂ — 2-метилпропен-1).
Циклические: Имеют цикл и двойную связь в составе цикла (например, циклогексен).
• По типу атомов углерода при двойной связи:
Эта классификация важна для предсказания стабильности и реакционной способности.
•Незамещенные (винильные): R-CH=CH₂ (один атом углерода при двойной связи связан с двумя атомами
H).
•Моно-, ди-, три-, тетразамещенные:
•Монозамещенный: R-CH=CH-R'
•Дизамещенный: R-CH=CH-R' (если R и R' разные) или симметричный.
•Тризамещенный: R₁R₂C=CH-R₃
•Тетразамещенный: R₁R₂C=CR₃R₄
Важно: Чем более замещена двойная связь, тем устойчивее алкен (правило Зайцева-Эльтекова).
3.
Номенклатура алкенов (систематическаяноменклатура IUPAC)
Основные правила:
• Выбор главной цепи.
Главная цепь обязательно должна включать двойную связь (C=C), даже если она не самая длинная. Это
главное отличие от алканов.
• Нумерация главной цепи.
Нумерацию проводят так, чтобы атомы углерода двойной связи получили наименьшие возможные
номера. Приоритет двойной связи выше, чем у заместителей.
• Формирование названия.
Основа: Название соответствующего алкана (-ан) меняется на суффикс -ен.
Положение двойной связи: Указывается цифрой после суффикса -ен. Указывается номер первого
(младшего) атома углерода двойной связи.
Заместители: Перечисляются в алфавитном порядке с указанием номера атома углерода, к которому они
присоединены.
4.
Особые случаи и важные нюансы:• Циклоалкены:
В циклических алкенах двойная связь всегда получает номера 1 и 2. Атом углерода №1 — это тот, который
имеет заместитель (если он есть).
• Алкены с несколькими двойными связями:
Используются суффиксы -диен, -триен и т.д. Положения всех двойных связей указываются в одном
префиксе в порядке возрастания.
• E/Z-номенклатура (стереоизомерия)
Это самая сложная и важная особенность. Из-за отсутствия вращения вокруг двойной связи возможны
геометрические изомеры.
• Z-изомер (от немецкого zusammen — вместе): Старшие заместители по правилу Кана-ИнгольдаПрелога находятся по одну сторону от двойной связи.
• E-изомер (от немецкого entgegen — напротив): Старшие заместители находятся по разные стороны
от двойной связи.
Правило Кана-Ингольда-Прелога (определение старшинства заместителей):
• Сравниваются атомы, непосредственно связанные с атомами углерода при двойной связи. Атом с
большим атомным номером считается старшим.
•Br > Cl > F > O > N > C > H
• Если атомы одинаковы, сравниваются атомы следующего уровня (как в дереве).
•-CH₂-CH₃ (C, H, H) vs -CH₃ (C, H, H). На первом атоме одинаково (C). Далее: у -CH₂-CH₃ следующий атом —
C, а у -CH₃ — три атома H. C > H, поэтому -CH₂-CH₃ старше, чем -CH₃.
•-CH(CH₃)₂ (C, C, C) старше, чем -CH₂-CH₃ (C, C, H).
5. Гомологический ряд и общая формула алкенов
Общая формула для нециклических алкенов с одной двойной связью:CnH2n
Где n — число атомов углерода в молекуле (n ≥ 2).
Почему именно такая формула?
• Алкан с тем же числом атомов углерода имеет формулу CnH2n+2.
• Двойная связь в алкенах уменьшает число атомов водорода на 2 по сравнению с алканом.
• Если представить, что алкен образуется из алкана, то для создания двойной связи каждый из двух атомов
углерода должен потерять по одному атому водорода:
-CH₂-CH₂- → -CH=CH- + H₂
Таким образом, общая формула меняется с CnH2n+2 на CnH2n.
6.
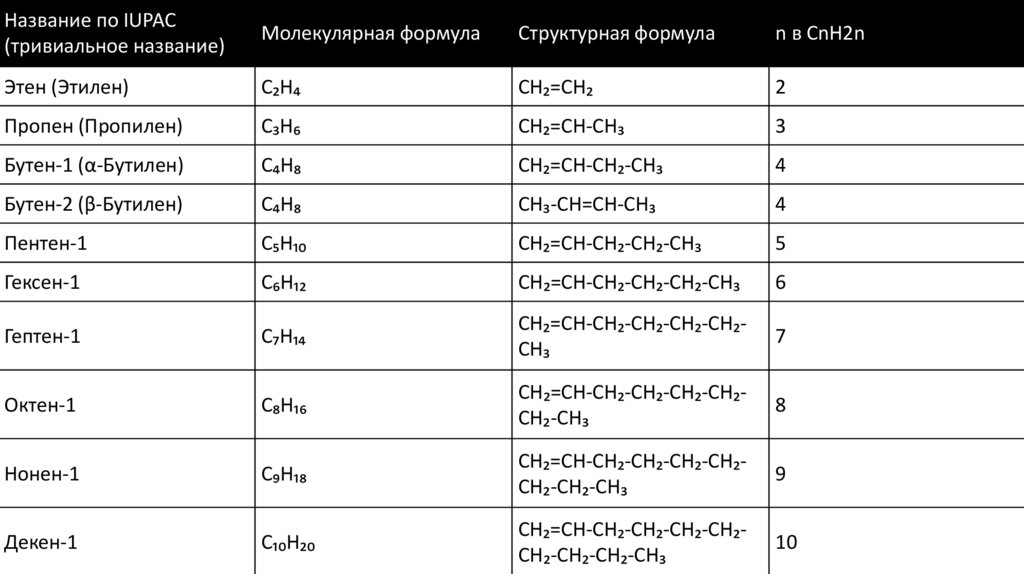
Название по IUPAC(тривиальное название)
Молекулярная формула
Структурная формула
n в CnH2n
Этен (Этилен)
C₂H₄
CH₂=CH₂
2
Пропен (Пропилен)
C₃H₆
CH₂=CH-CH₃
3
Бутен-1 (α-Бутилен)
C₄H₈
CH₂=CH-CH₂-CH₃
4
Бутен-2 (β-Бутилен)
C₄H₈
CH₃-CH=CH-CH₃
4
Пентен-1
C₅H₁₀
CH₂=CH-CH₂-CH₂-CH₃
5
Гексен-1
C₆H₁₂
CH₂=CH-CH₂-CH₂-CH₂-CH₃
6
Гептен-1
C₇H₁₄
CH₂=CH-CH₂-CH₂-CH₂-CH₂CH₃
7
Октен-1
C₈H₁₆
CH₂=CH-CH₂-CH₂-CH₂-CH₂CH₂-CH₃
8
Нонен-1
C₉H₁₈
CH₂=CH-CH₂-CH₂-CH₂-CH₂CH₂-CH₂-CH₃
9
Декен-1
C₁₀H₂₀
CH₂=CH-CH₂-CH₂-CH₂-CH₂CH₂-CH₂-CH₂-CH₃
10
7. Изомерия алкенов
Структурная изомерияМолекулы имеют одинаковый состав, но разный порядок связей между атомами.
• Изомерия углеродного скелета
Изомеры отличаются строением углеродной цепи.
Пример для C₄H₈:
•Бутен-1: CH₂=CH-CH₂-CH₃ (неразветвленная цепь)
•2-Метилпропен-1 (изобутилен): CH₂=C(CH₃)₂ (разветвленная цепь)
• Изомерия положения двойной связи
Изомеры отличаются положением двойной связи в углеродной цепи.
Пример для C₄H₈:
•Бутен-1: CH₂=CH-CH₂-CH₃ (двойная связь между 1 и 2 атомами C)
•Бутен-2: CH₃-CH=CH-CH₃ (двойная связь между 2 и 3 атомами C)
• Межклассовая изомерия
Изомеры относятся к разным классам органических соединений. Для алкенов это изомерия с
циклоалканами.
Пример для C₄H₈:
•Бутен-1 (алкен): CH₂=CH-CH₂-CH₃
•Циклобутан (циклоалкан).
8. Физические свойства алкенов
Агрегатное состояние (при нормальных условиях)• C₂ — C₄ (Этен, Пропен, Бутен): Бесцветные газы.
• C₅ — C₁₇ (Пентен — Гептадецен): Бесцветные жидкости.
• ≥ C₁₈ (Октадецен и выше): Твердые вещества (воскообразные).
Эта тенденция полностью аналогична алканам.
Температура кипения (t°кип)
Основной фактор: Молекулярная масса (длина углеродной цепи).
• Зависимость: Температура кипения возрастает с увеличением числа атомов углерода в цепи.
• Причина: С ростом цепи усиливаются межмолекулярные силы Ван-дер-Ваальса (дисперсионное
взаимодействие). Для их преодоления при переходе в газообразное состояние требуется больше энергии.
Разветвление цепи: Разветвленные изомеры кипят ниже, чем неразветвленные (как у алканов).
Положение двойной связи: Изомеры с двойной связью в конце цепи (например, бутен-1) кипят чуть ниже,
чем изомеры с двойной связью в середине (бутен-2).
Температура плавления (t°пл)
На температуру плавления сильно влияет симметрия молекулы, которая определяет, насколько плотно
молекулы могут "упаковываться" в кристаллической решетке.
• Общая тенденция: t°пл растет с увеличением молекулярной массы.
• Ключевая особенность: Транс-изомеры всегда плавятся при более высокой температуре, чем цисизомеры.
9.
Плотность• Все алкены легче воды. Их плотность меньше 1 г/см³.
• Плотность возрастает с ростом молекулярной массы.
Растворимость
• В воде: Практически нерастворимы. Это типично для неполярных или малополярных органических соединений.
• В органических растворителя: Хорошо растворимы в неполярных растворителях (бензол, гексан, дихлорэтан, эфир).
Запах
• Низшие алкены (C₂-C₄) имеют слабый, сладковатый запах.
• Этилену (этену) приписывают "сладкий, мускусный" запах.
10. Способы получения
Крекинг углеводородовНаиболее важный промышленный метод. Это высокотемпературное разложение предельных
углеводородов (алканов) из нефти или природного газа.
• Суть: Длинные молекулы алканов разрываются с образованием более коротких молекул алканов и
алкенов.
• Условия: Высокая температура (700-1000°C), иногда катализаторы.
Пример:
C₈H₁₈ (октан) → C₄H₁₀ (бутан) + C₄H₈ (бутен)
C₄H₁₀ (бутан) → C₂H₆ (этан) + C₂H₄ (этилен)
Дегидрирование алканов
Отщепление молекулы водорода от алкана.
Условия: Высокая температура (400-600°C), катализаторы (оксиды хрома, алюминия, платина).
11.
Дегидратация спиртов (Отщепление воды)Один из самых распространенных и важных лабораторных методов.
• Реагент: Спирт (чаще всего этанол, пропанолы).
• Условия:
• Промышленный вариант: Катализатор (Al₂O₃) при ~350°C.
• Лабораторный вариант: Нагревание с сильными минеральными кислотами (H₂SO₄, H₃PO₄) при 170-200°C.
Дегидрогалогенирование алкилгалогенидов (Отщепление галогеноводорода)
Отщепление молекулы галогеноводорода (HCl, HBr) от галогенпроизводного.
• Реагент: Моногалогеналкан.
• Условия: Нагревание со спиртовым раствором щелочи (KOH/EtOH, NaOH/EtOH).
Дегалогенирование дигалогенидов (Отщепление галогена)
Отщепление молекулы галогена (Cl₂, Br₂) от вицинальных дигалогенидов (у которых два атома галогена находятся у
соседних атомов углерода).
• Реагент: Вицинальный дигалогенид (напр., 1,2-дибромэтан).
• Условия: Обработка активными металлами (Zn, Mg) или иодидом натрия (NaI) в ацетоне.
Дегидрогалогенирование дигалогенидов
Если два атома галогена находятся у одного атома углерода (геминальные дигалогениды), при отщеплении двух
молекул галогеноводорода образуются алкины.
• Реагент: Геминальный дигалогенид.
• Условия: Очень сильное основание (2 эквивалента), например, NaNH₂ в аммиаке.
• Пример:
CH₃-CHCl₂ (1,1-дихлорэтан) + 2NaNH₂ → CH≡CH (ацетилен) + 2NaCl + 2NH₃
12.
Восстановительное дегидрогалогенирование (Реакция Бородина-Хунсдикера)Менее распространенный, но исторически важный метод.
• Реагент: Серебряная соль карбоновой кислоты.
• Условия: Нагревание с галогеном (Br₂, I₂).
• Пример:
CH₃(CH₂)₁₄COOAg (пальмитат серебра) + Br₂ → CH₃(CH₂)₁₄CH=CH₂ (гексадецен-1) + CO₂ + AgBr
13. Химические свойства
Гидрогалогенирование (Присоединение галогеноводородов, HHal)• Реагент: HCl, HBr, HI.
• Условия: Могут идти без катализатора, иногда на холоду или в инертных растворителях.
• Продукт: Галогеналкан.
❗ Правило Марковникова: При присоединении протонной кислоты (HX) к несимметричному алкену, водород
присоединяется к более гидрогенизированному атому углерода (имеющему больше атомов водорода).
❌ Исключение (Эффект Хараша): При радикальном присоединении HBr в присутствии пероксидов правило
Марковникова не соблюдается и наблюдается анти-Марковниковское присоединение.
Гидратация (Присоединение воды)
• Реагент: Вода (H₂O).
• Условия: Катализатор — кислота (H₂SO₄, H₃PO₄).
• Продукт: Спирт.
• Механизм: Электрофильное присоединение. Подчиняется правилу Марковникова.
14.
Галогенирование (Присоединение галогенов)• Реагент: Br₂, Cl₂.
• Условия: Протекают на холоду, часто в инертных растворителях (CCl₄, CHCl₃).
• Продукт: Дигалогеналкан (вицинальный — атомы галогена у соседних атомов углерода).
• Бурая окраска брома исчезает. Это классическая качественная реакция на непредельную связь.
Гидроборирование-окисление
• Реагент:
• Боран (BH₃) или диборан (B₂H₆).
• Окислитель (H₂O₂, NaOH).
• Продукт: Спирт.
• Особенность: Реакция идет против правила Марковникова. В итоге получается первичный спирт из
терминального алкена.
Присоединение водорода (Гидрирование)
• Реагент: Водород (H₂).
• Условия: Катализаторы (Ni, Pt, Pd) при нагревании.
• Продукт: Алкан.
15.
Мягкое окисление (Раствор KMnO₄ на холоду)• Реагент: Разбавленный, холодный, нейтральный или слабощелочной раствор KMnO₄ (реакция Вагнера).
• Продукт: Диол (двухатомный спирт). Присоединяются две OH-группы.
• При этом фиолетовая окраска перманганата исчезает и образуется бурый осадок MnO₂.
Жесткое окисление (Раствор KMnO₄ или K₂Cr₂O₇ при нагревании в кислой среде)
Приводит к полному разрыву двойной связи и образованию карбоновых кислот или кетонов.
• Продукт зависит от строения алкена:
• CH₂= группа окисляется до CO₂ + H₂O.
• R–CH= группа окисляется до карбоновой кислоты (R–COOH).
• R₂C= группа окисляется до кетона (R₂C=O).
Озонирование
• Реагент: Озон (O₃).
• Условия: Низкие температуры, инертный растворитель.
• Продукт: Озонид, который затем восстанавливают (например, Zn/H₂O) до карбонильных соединений
(альдегидов или кетонов).
Реакция полимеризации
Основа получения пластмасс. Молекулы алкена (мономеры) соединяются друг с другом в длинные цепи
(полимеры).
• Условия: Температура, давление, катализаторы (Циглера-Натта).














 chemistry
chemistry








