Similar presentations:
Альдегиды
1.
АльдегидыАйрапетян Л.Р.
2021 г
2.
3.
4.
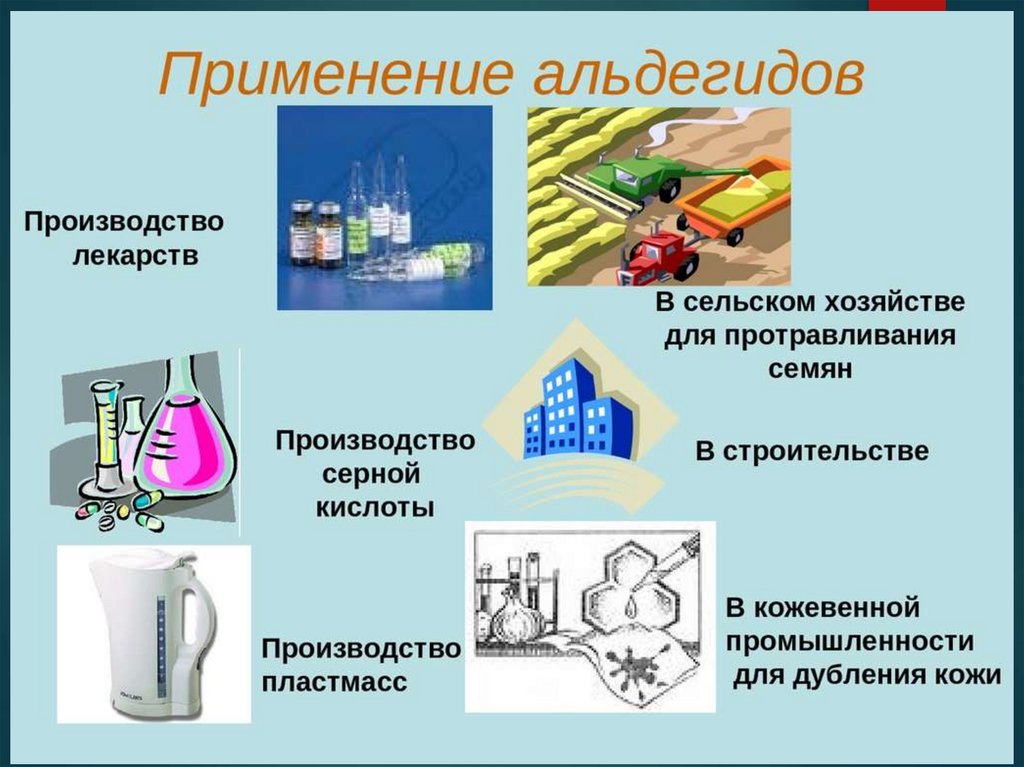
5. Применение
Формальдегид (метаналь, муравьиный альдегид)H2C=O:
а) для получение фенолформальдегидных смол;
б) получение мочевино-формальдегидных
(карбамидных) смол;
в) полиоксиметиленовые полимеры;
г) синтез лекарственных средств (уротропин);
д) дезинфицирующее средство;
е) консервант биологических препаратов
(благодаря способности свертывать белок).
6. Применение
Уксусный альдегид (этаналь, ацетальдегид)СН3СН=О:
а) производство уксусной кислоты;
б) органический синтез.
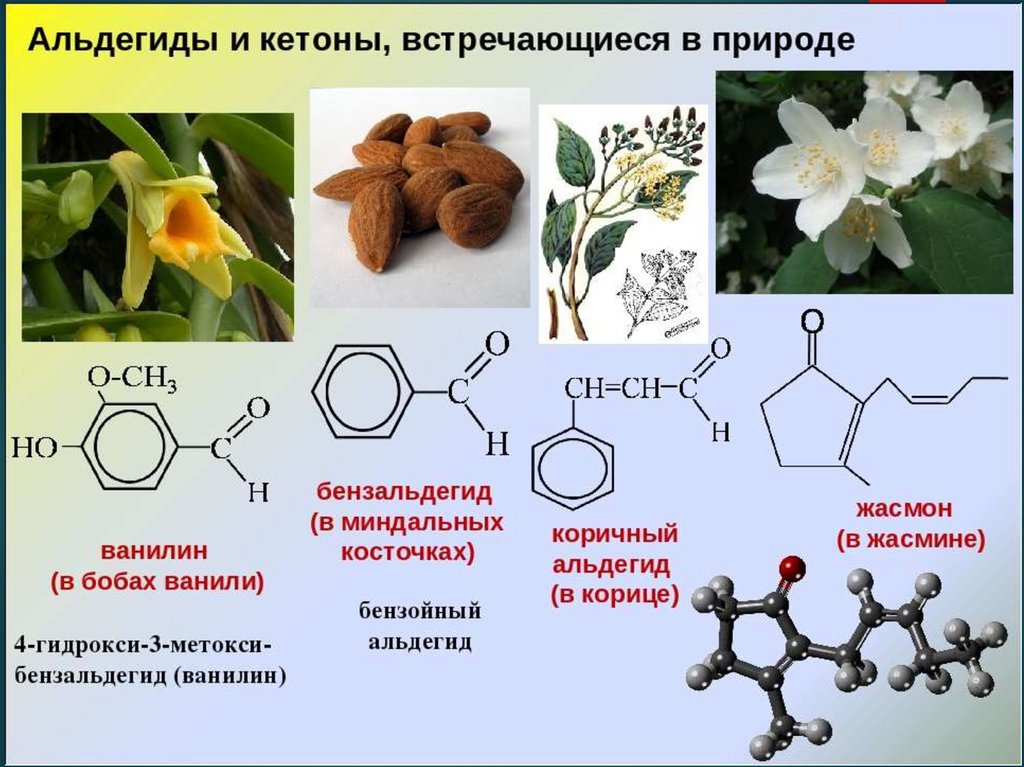
Альдегиды, имеющие высокую молекулярную массу
(к примеру, бензальдегид и фенилацетальдегид)
обладают приятным запахом и поэтому
используются в парфюмерии при производстве
духов.
7.
8.
9.
10.
11. Альдегиды
Карбонильные соединения – это органическиевещества, молекулы которых содержат
карбонильную группу:
Карбонильные соединения делятся на альдегиды и
кетоны. Общая формула карбонильных соединений:
СnH2nO.
Альдегидами называются органические соединения,
содержащие карбонильную группу, в которой атом
углерода связан с радикалом и одним атомом
водорода.
12. Кетоны
Кетонами называются соединения, в молекулекоторых карбонильная группа связана с двумя
углеводородными радикалами.
Структурная формула кетонов:
13. Альдегиды
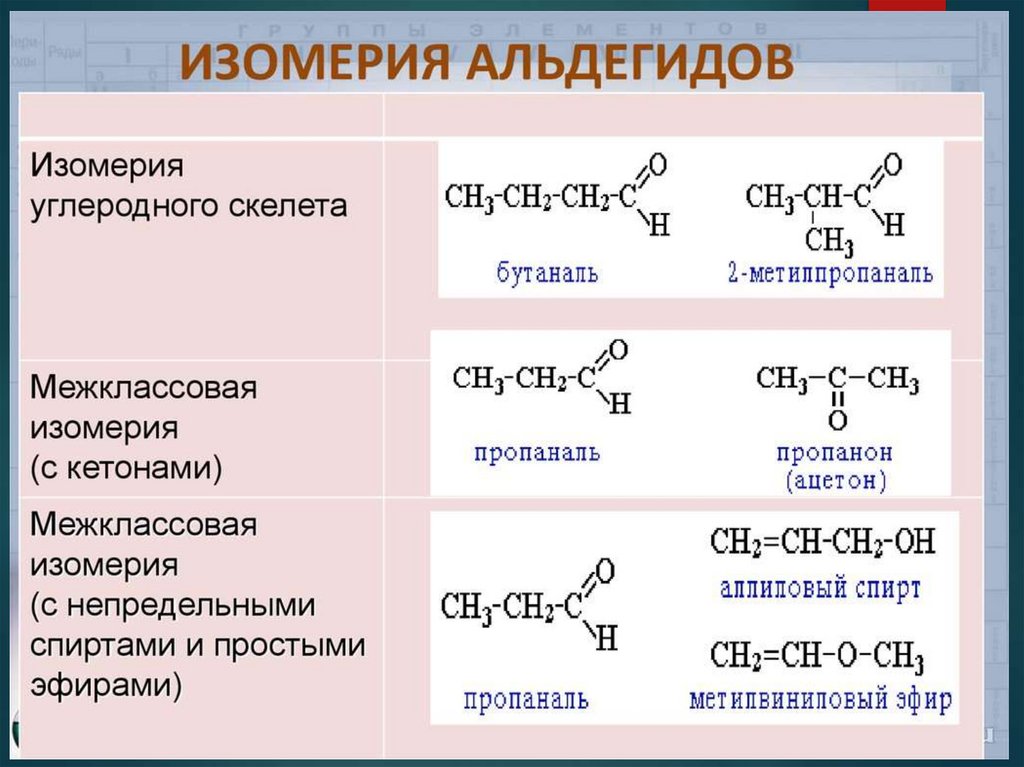
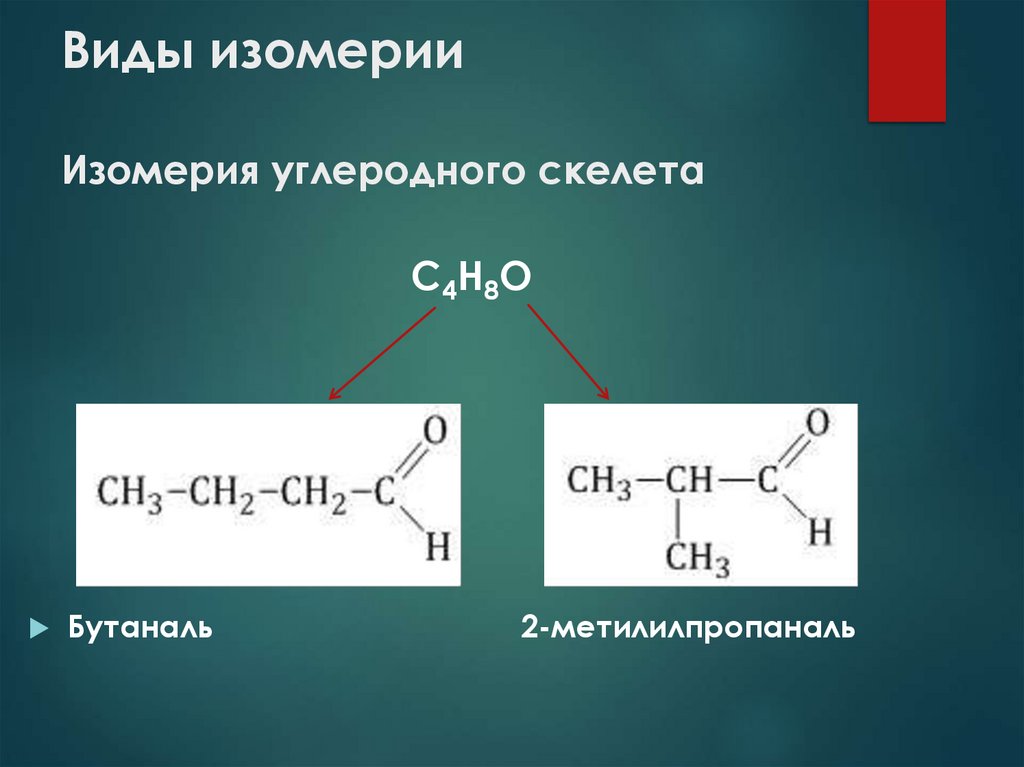
14. Виды изомерии Изомерия углеродного скелета
С4Н8ОБутаналь
2-метилилпропаналь
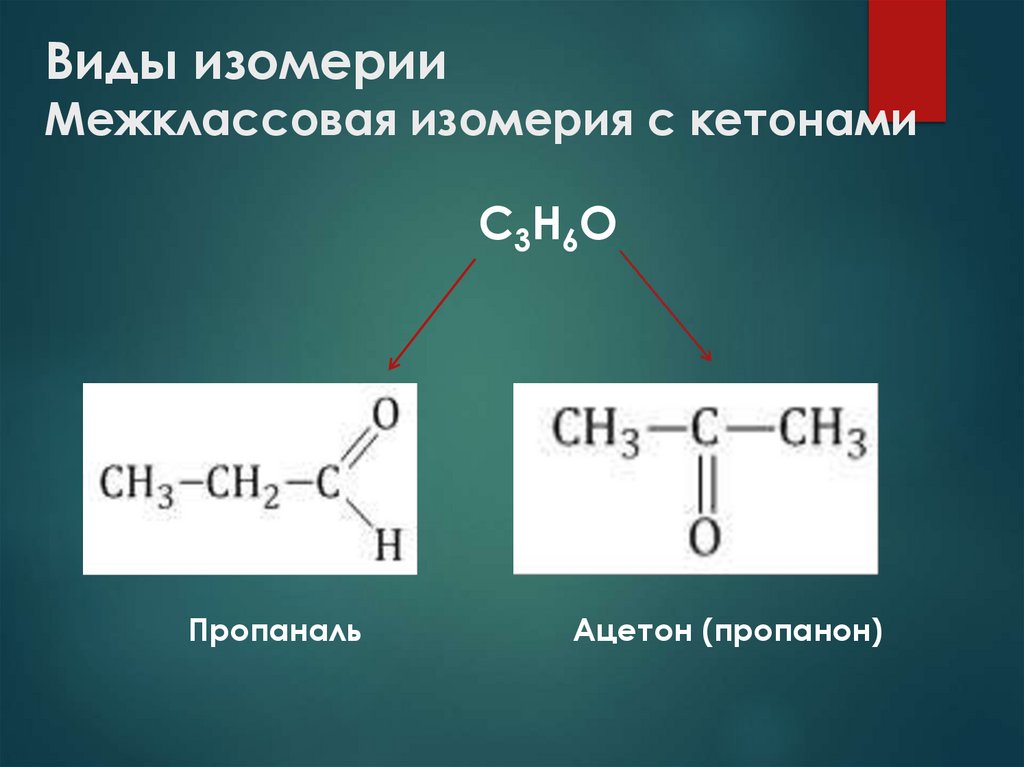
15. Виды изомерии Межклассовая изомерия с кетонами
С3Н6ОПропаналь
Ацетон (пропанон)
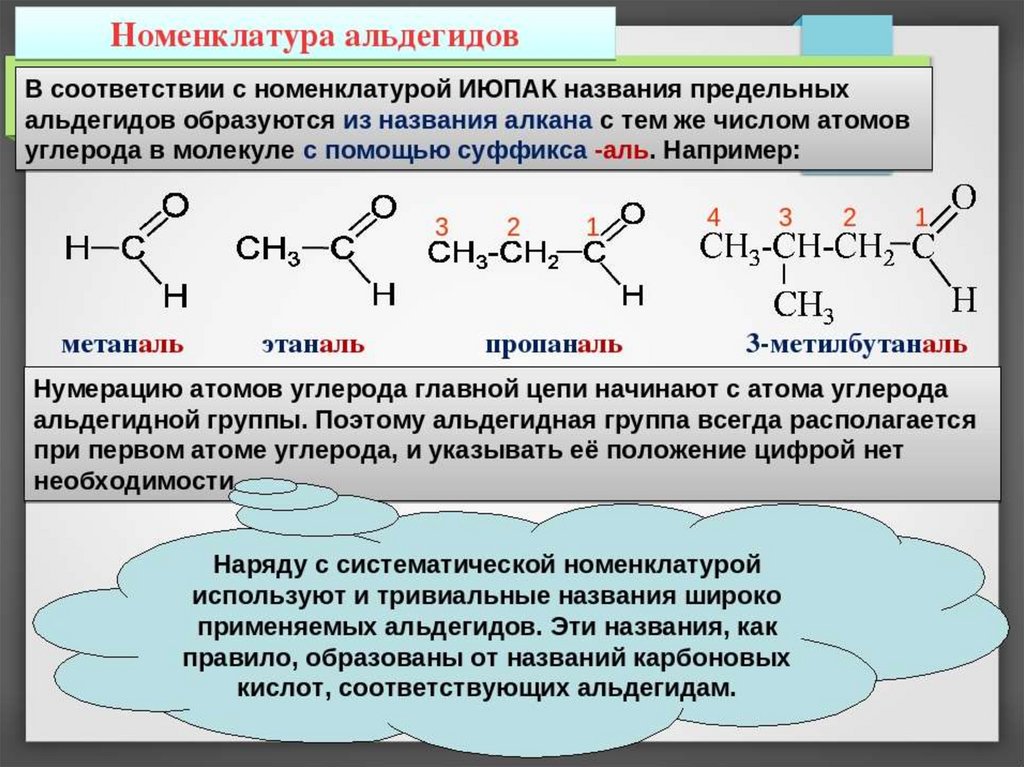
16. Номенклатура
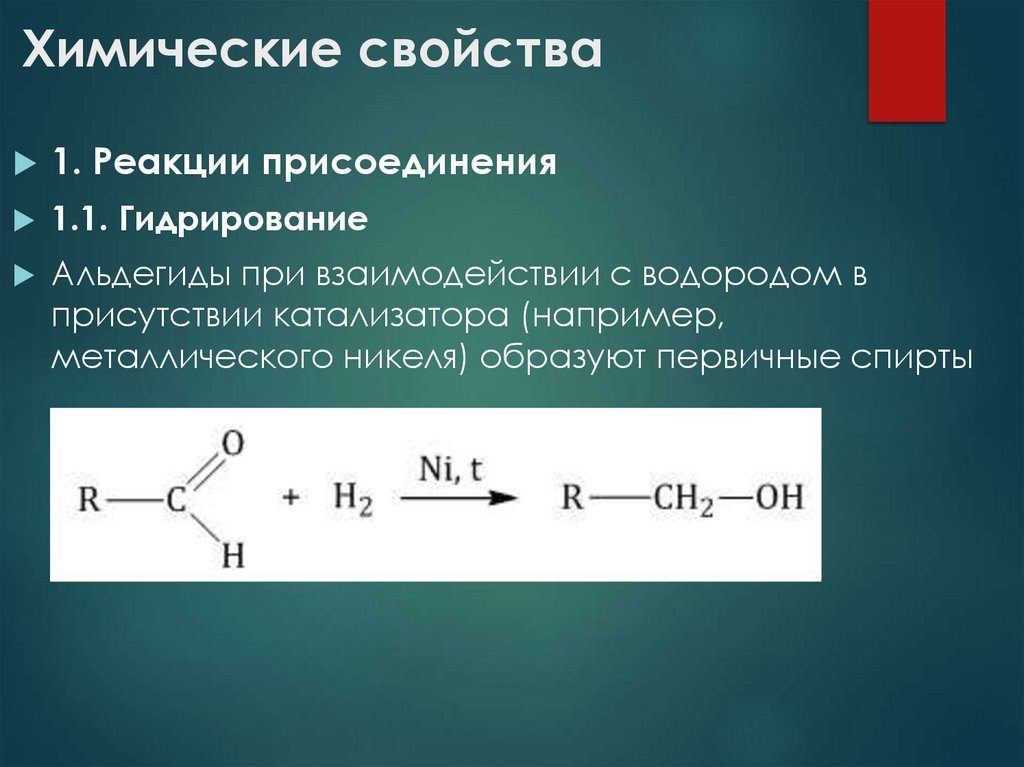
17. Химические свойства
1. Реакции присоединения1.1. Гидрирование
Альдегиды при взаимодействии с водородом в
присутствии катализатора (например,
металлического никеля) образуют первичные спирты
18. Химические свойства 2. Окисление альдегидов
2.1. Окисление гидроксидом меди (II)Происходит при нагревании альдегидов со
свежеосажденным гидроксидом меди, при этом
образуется красно-кирпичный осадок оксида меди
(I) Cu2O. Это — одна из качественных реакций на
альдегиды.
Видеоопыт окисления муравьиного альдегида гидроксидом меди
(II) можно посмотреть здесь.
19. Химические свойства 2. Окисление альдегидов
2.1. Окисление гидроксидом меди (II)Муравьиный альдегид окисляется гидроксидом меди
(II)
HCHO + Cu(OH)2 = Cu ↓ + HCOOH + H2O
Чаще в этой реакции образуется оксид меди (I):
HCHO + 2Cu(OH)2 = Cu2O ↓ + HCOOH + 2H2O
20. Химические свойства
2.2. Окисление аммиачным раствором оксидасеребра
Альдегиды окисляются аммиачным раствором
оксида серебра (реакция «серебряного зеркала»).
Образование осадка серебра при взаимодействии
с аммиачным раствором оксида серебра —
качественная реакция на альдегиды.
21. Химические свойства
2.3. Горение карбонильных соединенийПри горении карбонильных соединений образуются
углекислый газ и вода и выделяется большое
количество теплоты.
CnH2nО + 3n/2O2 → nCO2 + nH2O + Q
Уравнение сгорания метаналя:
CH2O + O2 = CO2 + H2O
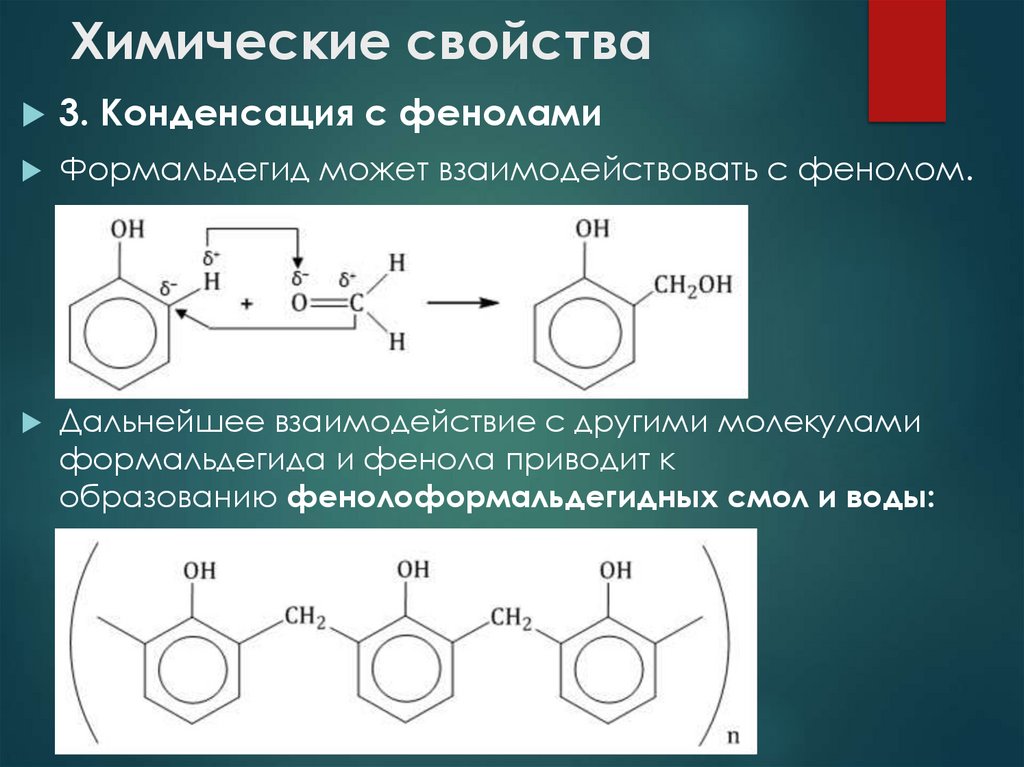
22. Химические свойства
3. Конденсация с феноламиФормальдегид может взаимодействовать с фенолом.
Дальнейшее взаимодействие с другими молекулами
формальдегида и фенола приводит к
образованию фенолоформальдегидных смол и воды:
23. Химические свойства
Фенол и формальдегид вступают в реакциюполиконденсации.
Поликонденсация — это процесс соединения
молекул в длинную цепь (полимер) с образованием
побочных продуктов с низкой молекулярной массой
(вода или др.).
24. Получение
1. Окисление спиртов1.1. Окисление спиртов оксидом меди (II)
При окислении этанола оксидом меди образуется
уксусный альдегид
1.2. Окисление спиртов кислородом на меди
В промышленности формальдегид получают
окислением метанола на серебряном катализаторе
при температуре 650оС и атмосферном давлении:
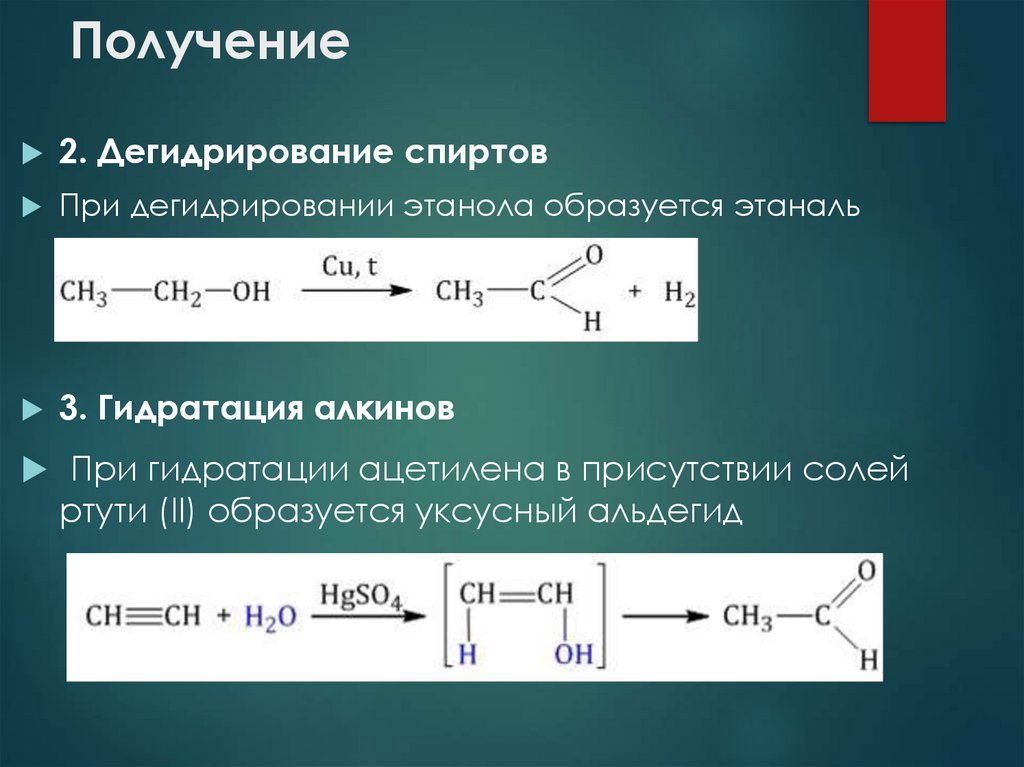
25. Получение
2. Дегидрирование спиртовПри дегидрировании этанола образуется этаналь
3. Гидратация алкинов
При гидратации ацетилена в присутствии солей
ртути (II) образуется уксусный альдегид
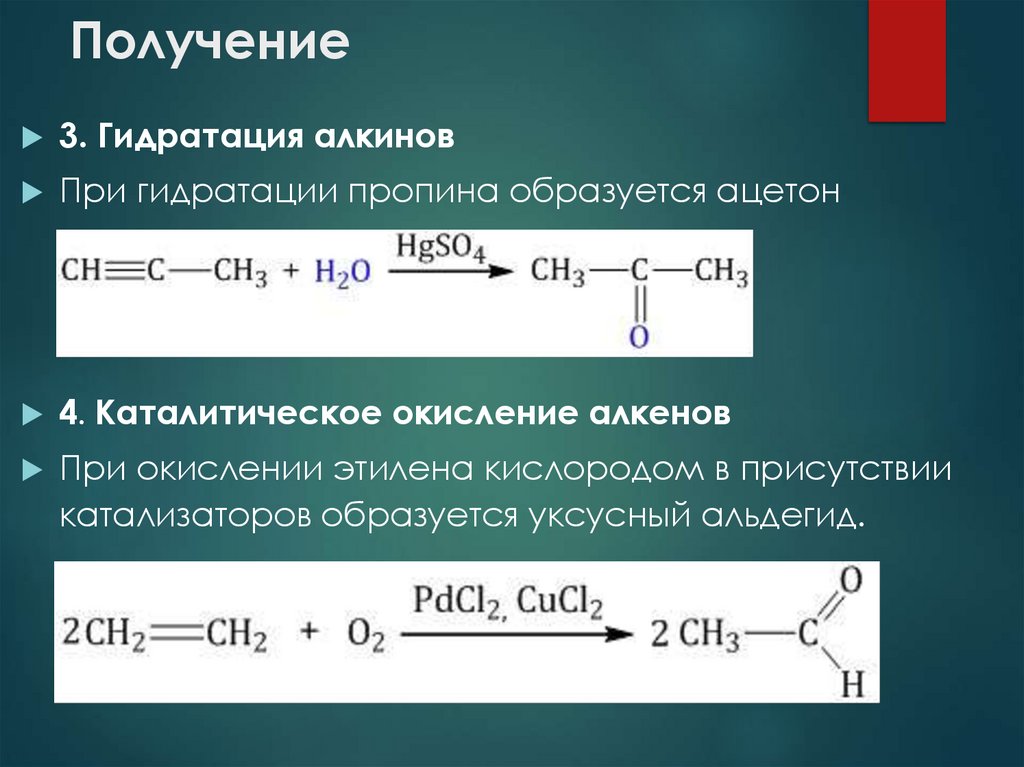
26. Получение
3. Гидратация алкиновПри гидратации пропина образуется ацетон
4. Каталитическое окисление алкенов
При окислении этилена кислородом в присутствии
катализаторов образуется уксусный альдегид.
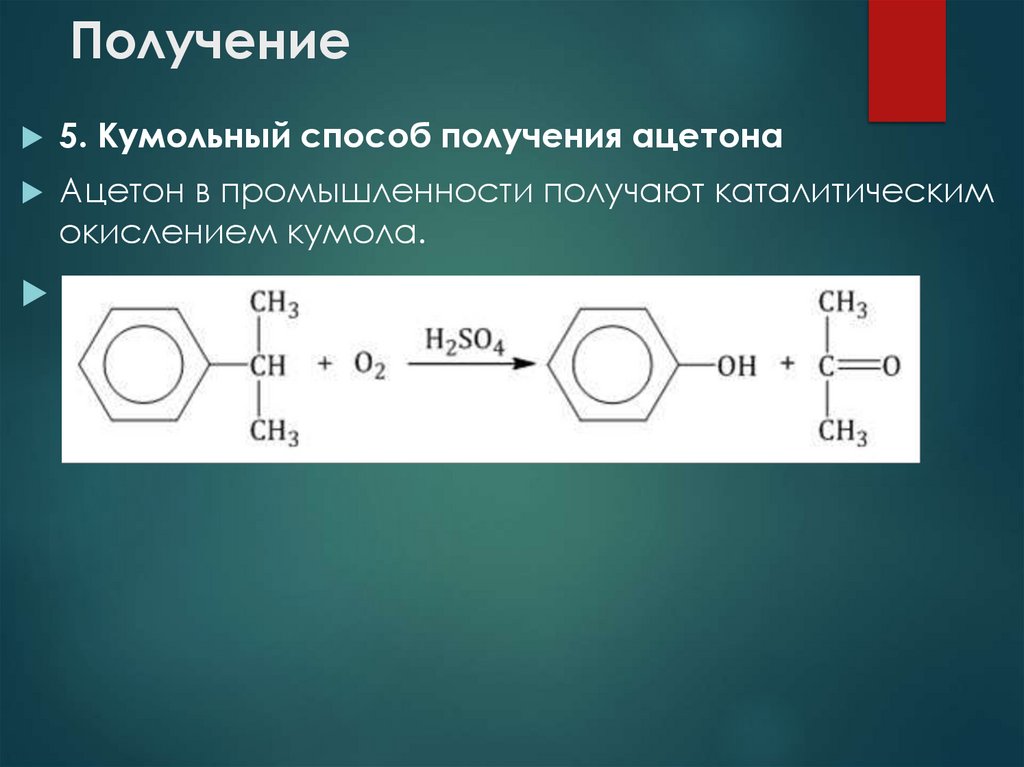
27. Получение
5. Кумольный способ получения ацетонаАцетон в промышленности получают каталитическим
окислением кумола.
28. Домашнее задание
Прочитать § 10.3. Вопросы и задания 1-3 стр.20229. литература
1. О.С. Габриелян, И.Г. Остроумов «Химия дляпрофессий и специальностей технического
профиля», Москва, Издательский центр «Академия»,
2018.
2. О.С. Габриелян, Г.Г. Лысова «Химия: тесты, задачи и
упражнения», Москва, Издательский центр
«Академия», 2018.


















 chemistry
chemistry