Similar presentations:
Получение бензола и его производных
1.
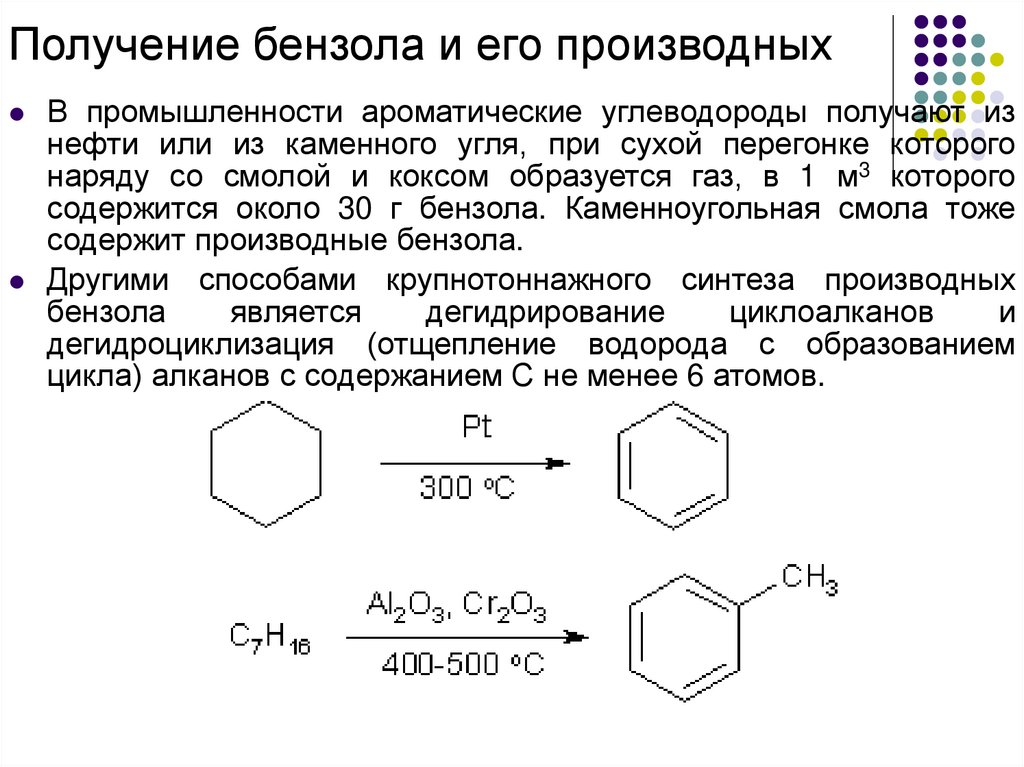
Получение бензола и его производныхВ промышленности ароматические углеводороды получают из
нефти или из каменного угля, при сухой перегонке которого
наряду со смолой и коксом образуется газ, в 1 м3 которого
содержится около 30 г бензола. Каменноугольная смола тоже
содержит производные бензола.
Другими способами крупнотоннажного синтеза производных
бензола
является
дегидрирование
циклоалканов
и
дегидроциклизация (отщепление водорода с образованием
цикла) алканов с содержанием С не менее 6 атомов.
2.
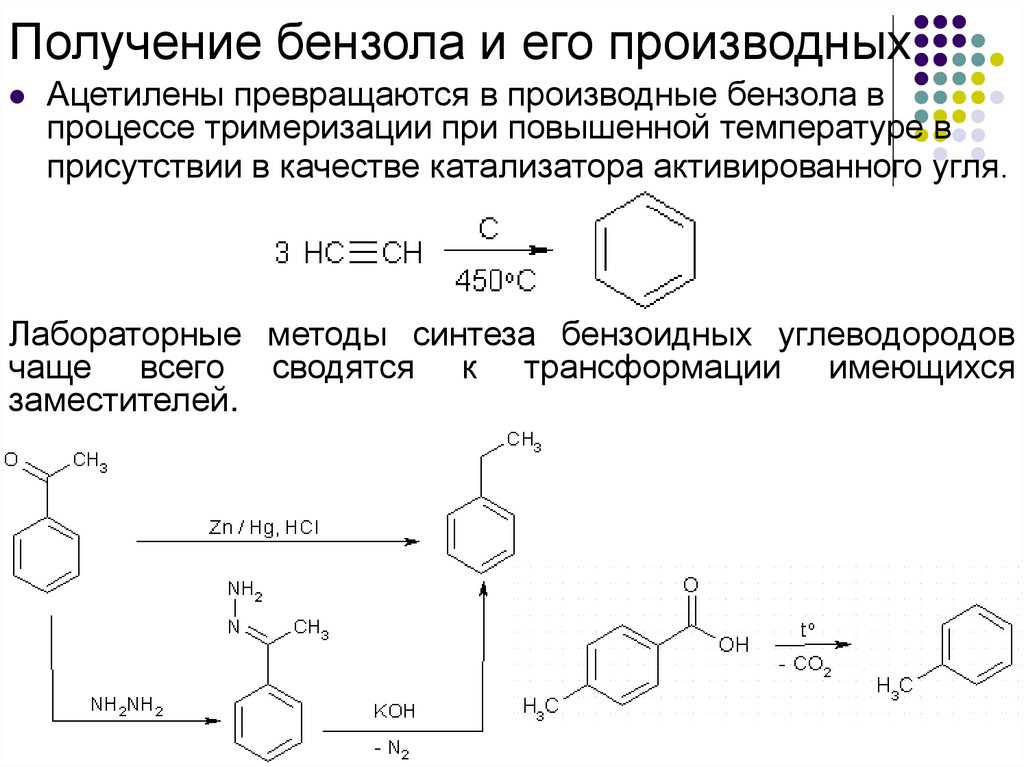
Получение бензола и его производныхАцетилены превращаются в производные бензола в
процессе тримеризации при повышенной температуре в
присутствии в качестве катализатора активированного угля.
Лабораторные методы синтеза бензоидных углеводородов
чаще всего сводятся к трансформации имеющихся
заместителей.
3.
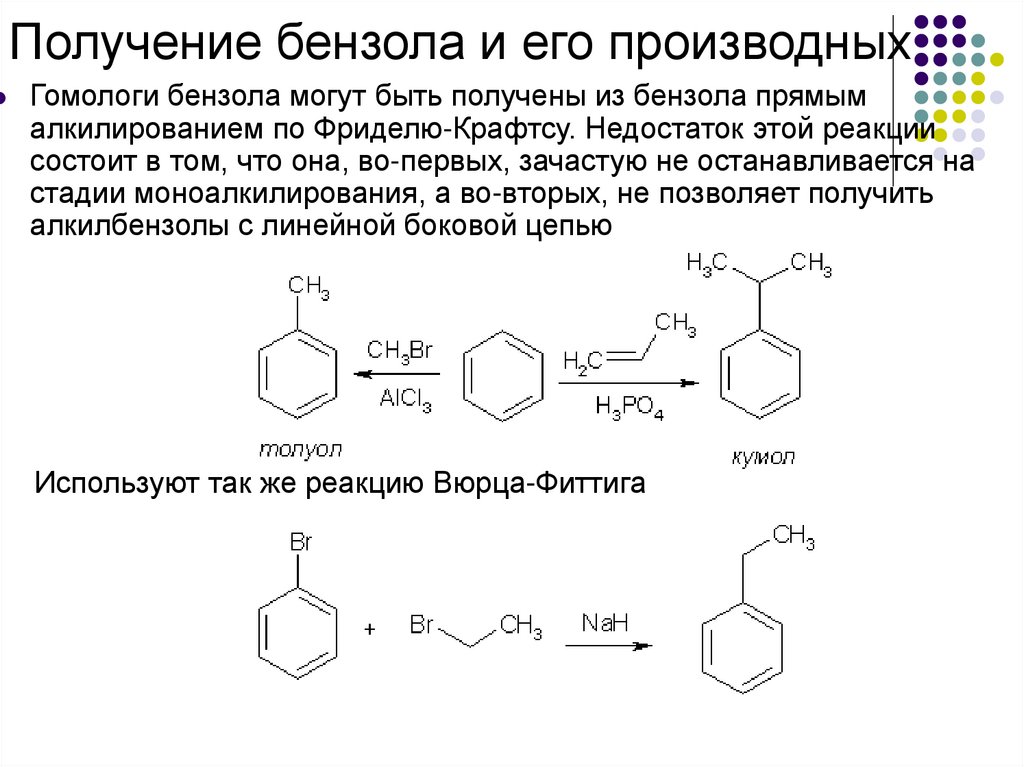
Получение бензола и его производныхГомологи бензола могут быть получены из бензола прямым
алкилированием по Фриделю-Крафтсу. Недостаток этой реакции
состоит в том, что она, во-первых, зачастую не останавливается на
стадии моноалкилирования, а во-вторых, не позволяет получить
алкилбензолы с линейной боковой цепью
Используют так же реакцию Вюрца-Фиттига
4.
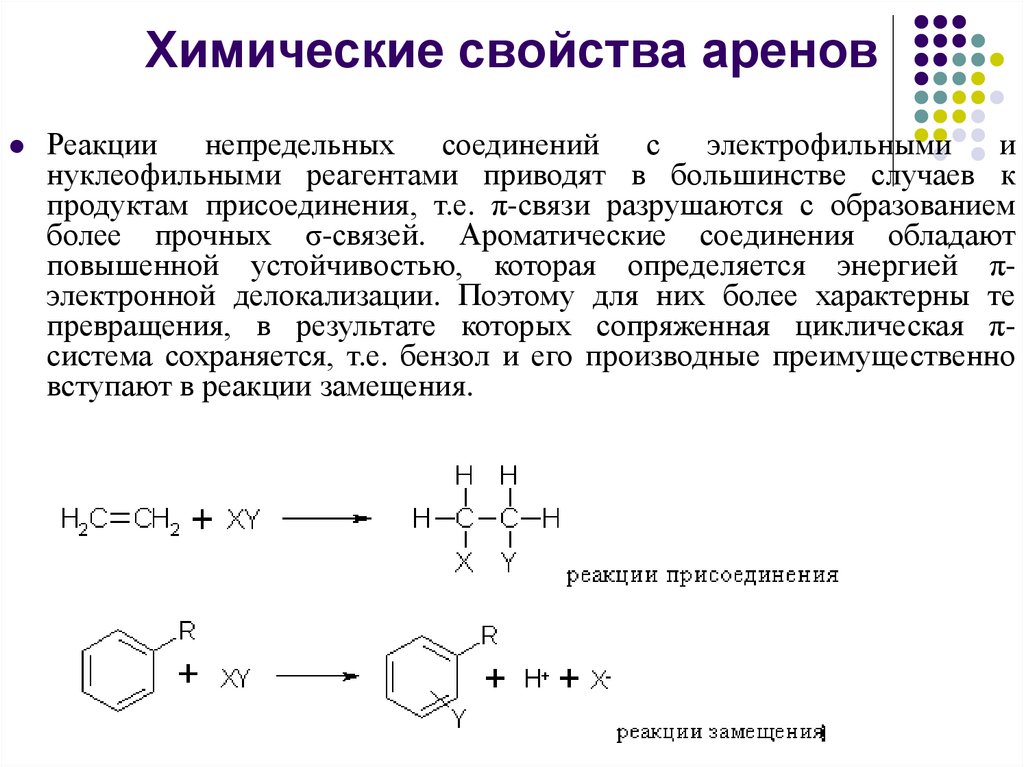
Химические свойства ареновРеакции непредельных
соединений
с электрофильными
и
нуклеофильными реагентами приводят в большинстве случаев к
продуктам присоединения, т.е. π-связи разрушаются с образованием
более прочных σ-связей. Ароматические соединения обладают
повышенной устойчивостью, которая определяется энергией πэлектронной делокализации. Поэтому для них более характерны те
превращения, в результате которых сопряженная циклическая πсистема сохраняется, т.е. бензол и его производные преимущественно
вступают в реакции замещения.
5.
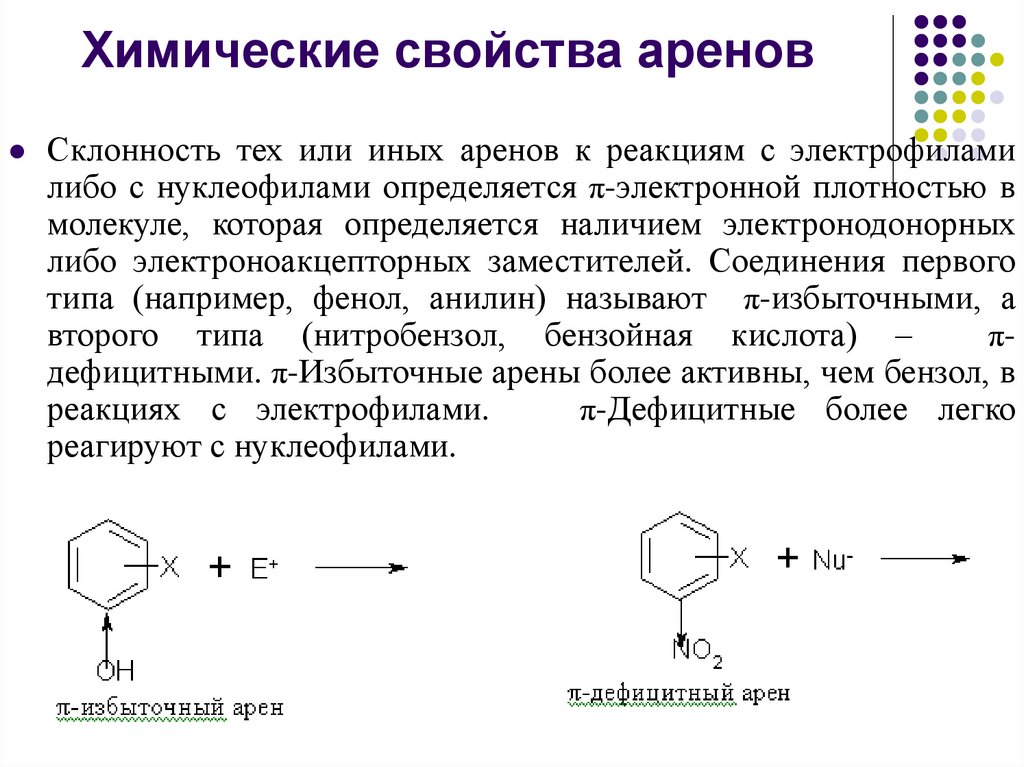
Химические свойства ареновСклонность тех или иных аренов к реакциям с электрофилами
либо с нуклеофилами определяется π-электронной плотностью в
молекуле, которая определяется наличием электронодонорных
либо электроноакцепторных заместителей. Соединения первого
типа (например, фенол, анилин) называют π-избыточными, а
второго типа (нитробензол, бензойная кислота) –
πдефицитными. π-Избыточные арены более активны, чем бензол, в
реакциях с электрофилами.
π-Дефицитные более легко
реагируют с нуклеофилами.
6.
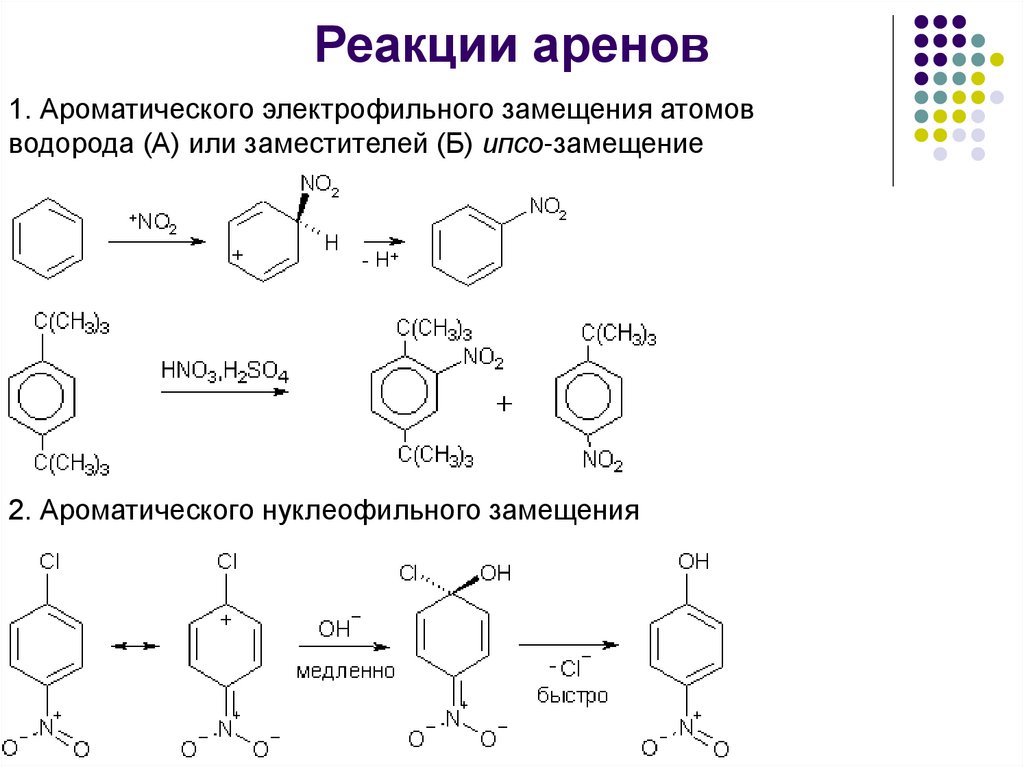
Реакции аренов1. Ароматического электрофильного замещения атомов
водорода (А) или заместителей (Б) ипсо-замещение
2. Ароматического нуклеофильного замещения
7.
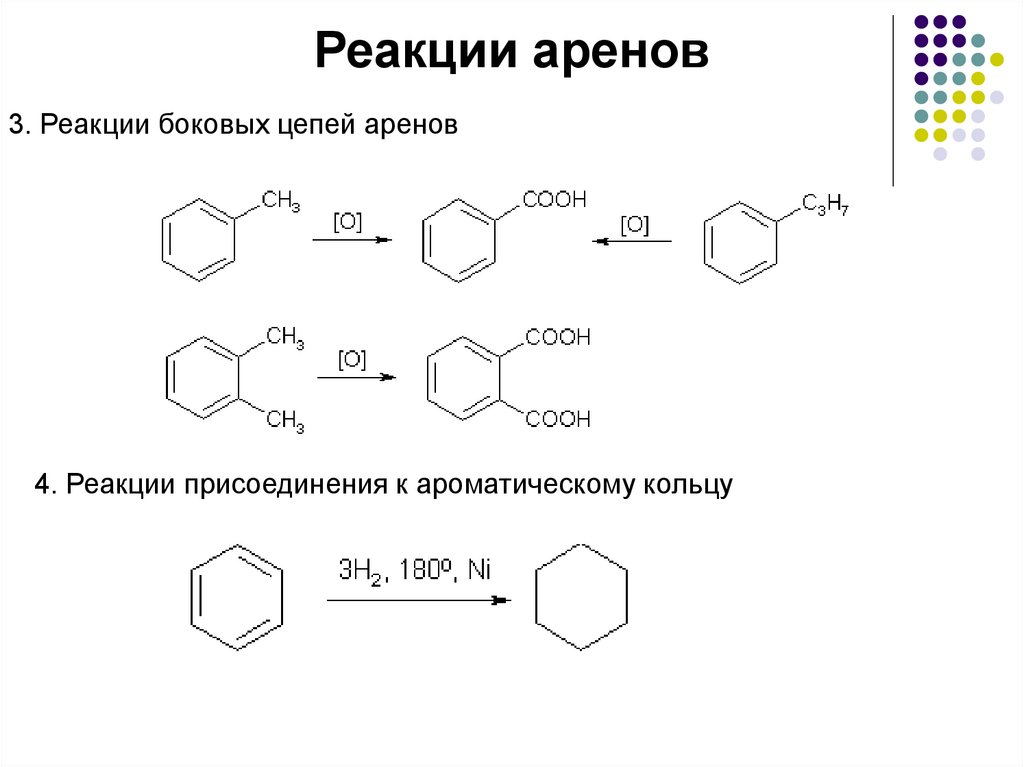
Реакции аренов3. Реакции боковых цепей аренов
4. Реакции присоединения к ароматическому кольцу
8.
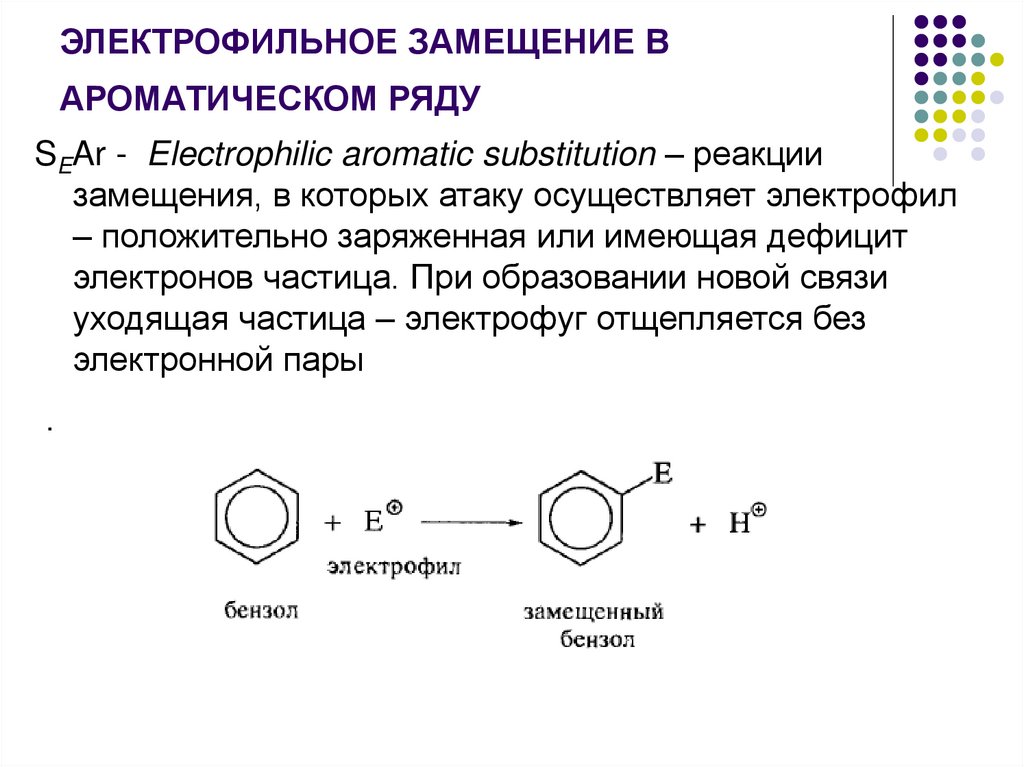
ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ ВАРОМАТИЧЕСКОМ РЯДУ
SEAr - Electrophilic aromatic substitution – реакции
замещения, в которых атаку осуществляет электрофил
– положительно заряженная или имеющая дефицит
электронов частица. При образовании новой связи
уходящая частица – электрофуг отщепляется без
электронной пары
.
9.
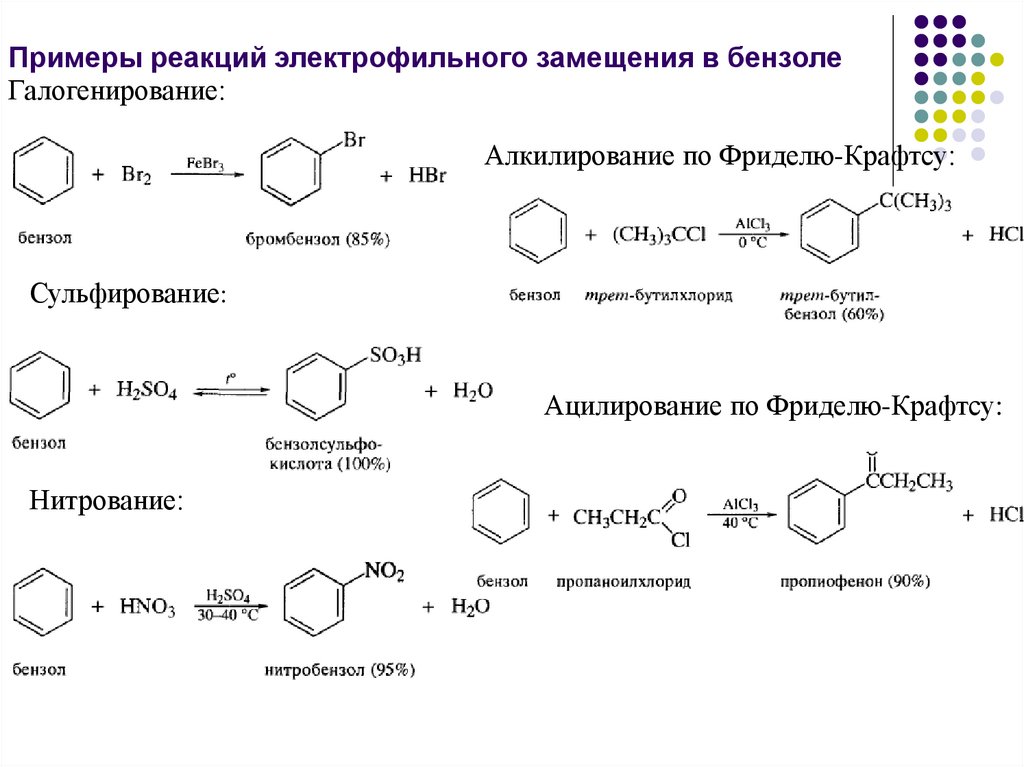
Примеры реакций электрофильного замещения в бензолеГалогенирование:
Алкилирование по Фриделю-Крафтсу:
Сульфирование:
Ацилирование по Фриделю-Крафтсу:
Нитрование:
10.
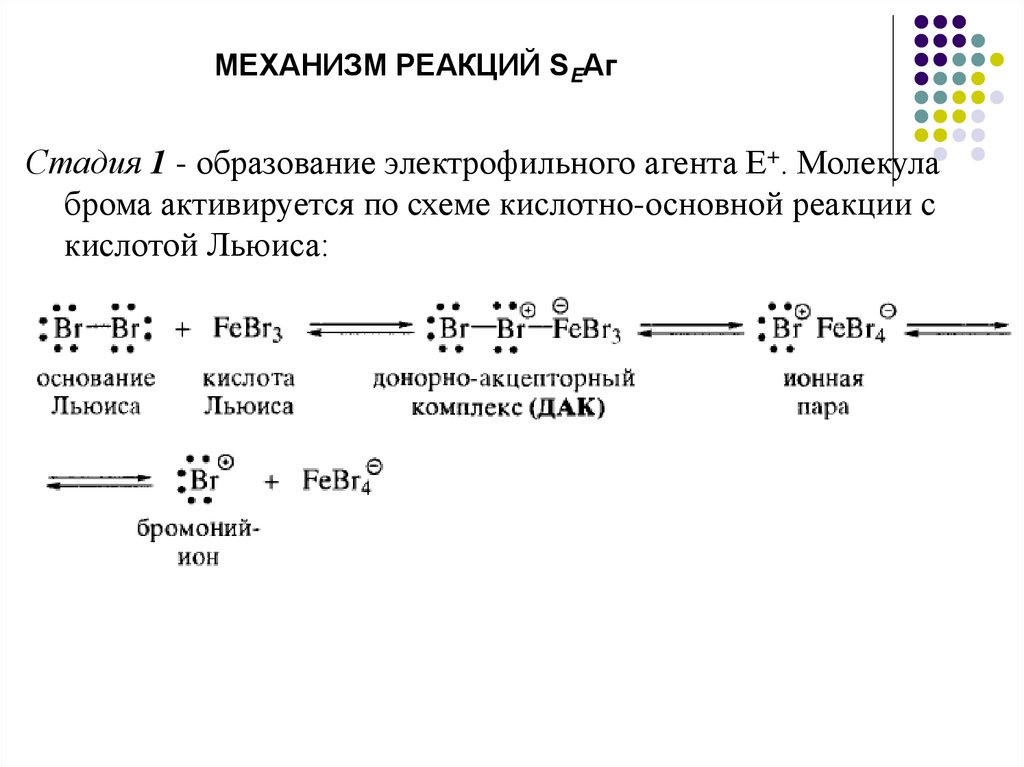
МЕХАНИЗМ РЕАКЦИЙ SEАгСтадия 1 - образование электрофильного агента Е+. Молекула
брома активируется по схеме кислотно-основной реакции с
кислотой Льюиса:
11.
МЕХАНИЗМ РЕАКЦИЙ SEАrСтадия 2 - свободный бромониевый ион или ион в составе ионной
пары является активным электрофильным агентом, способным
реагировать с бензолом; при этом сначала образуется π-комплекс
1.
12.
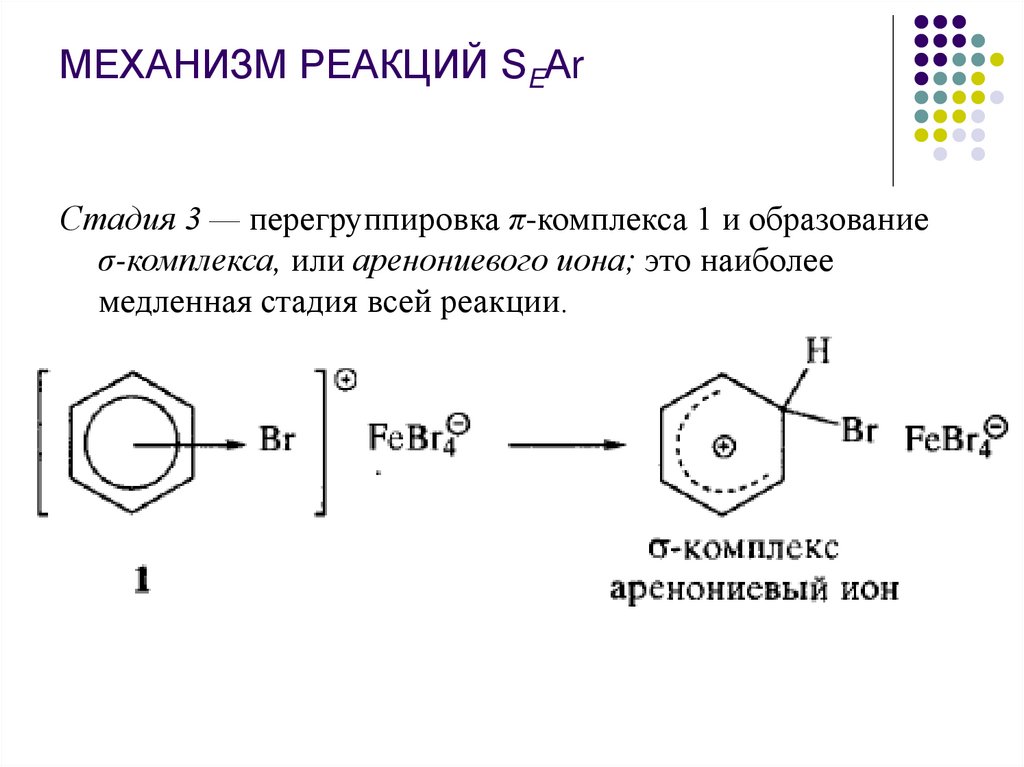
МЕХАНИЗМ РЕАКЦИЙ SEАrСтадия 3 — перегруппировка π-комплекса 1 и образование
σ-комплекса, или аренониевого иона; это наиболее
медленная стадия всей реакции.
13.
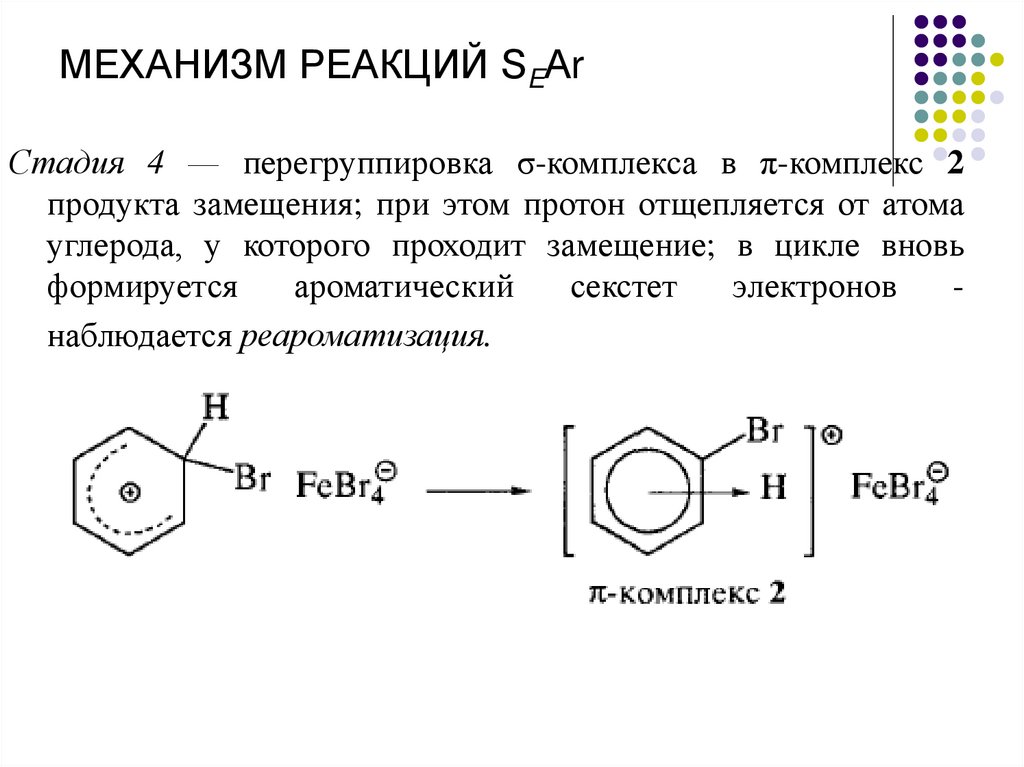
МЕХАНИЗМ РЕАКЦИЙ SEАrСтадия 4 — перегруппировка σ-комплекса в π-комплекс 2
продукта замещения; при этом протон отщепляется от атома
углерода, у которого проходит замещение; в цикле вновь
формируется
ароматический
секстет
электронов
наблюдается реароматизация.
14.
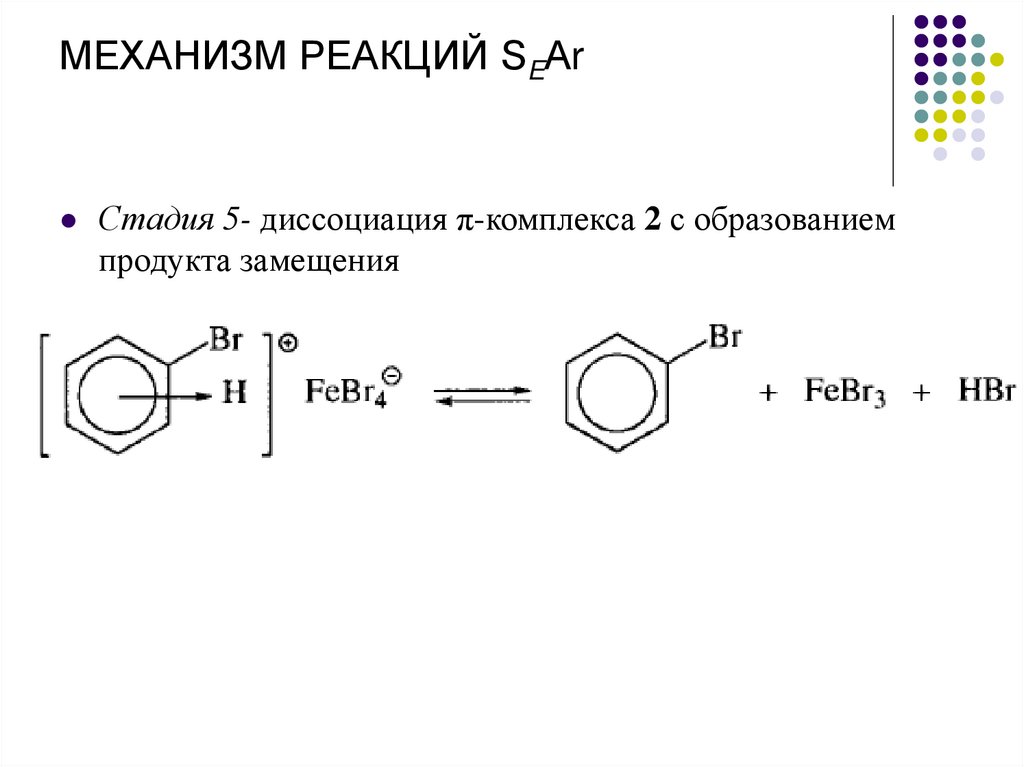
МЕХАНИЗМ РЕАКЦИЙ SEАrСтадия 5- диссоциация π-комплекса 2 с образованием
продукта замещения
15.
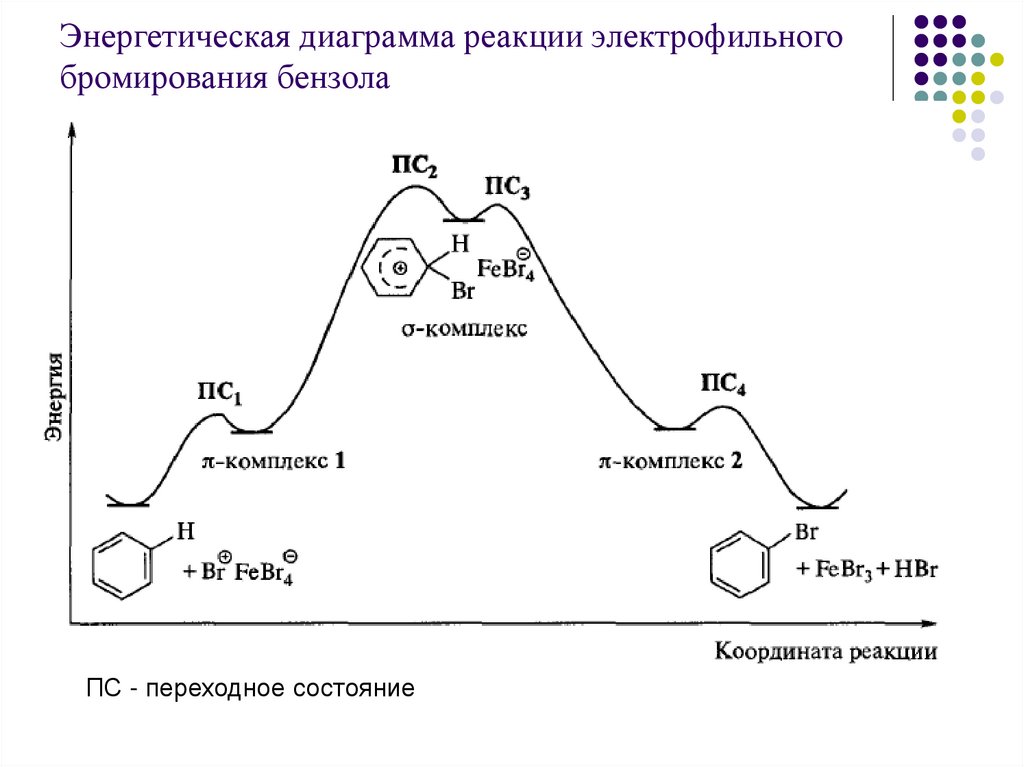
Энергетическая диаграмма реакции электрофильногобромирования бензола
ПС - переходное состояние
16.
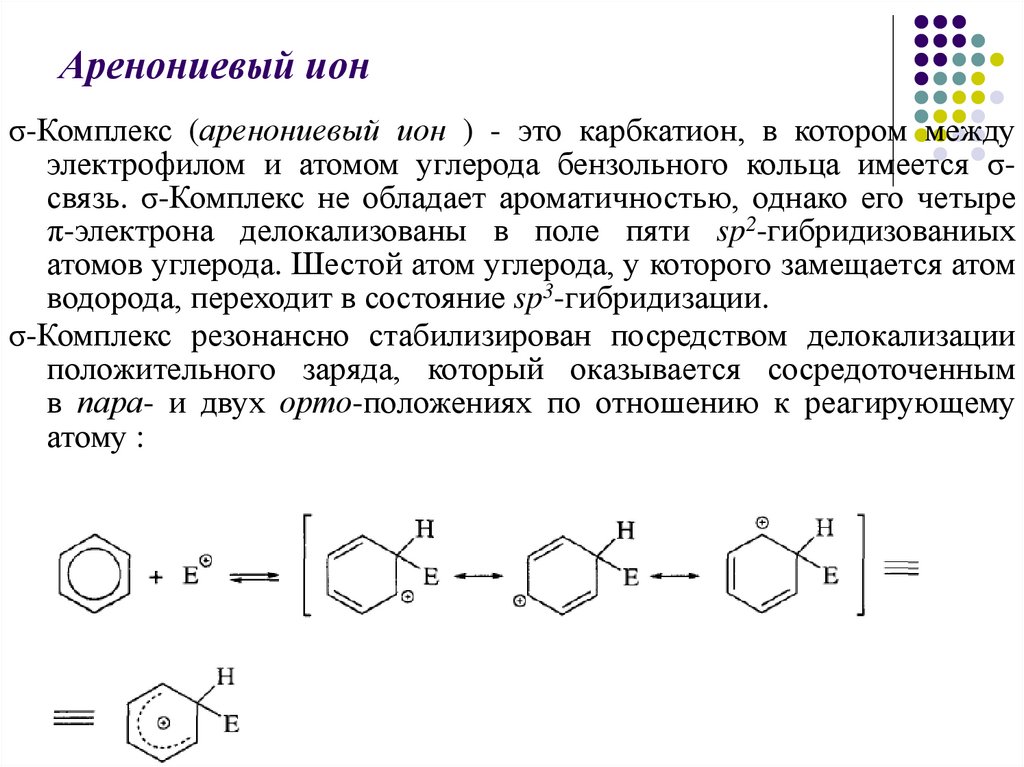
Аренониевый ионσ-Комплекс (аренониевый ион ) - это карбкатион, в котором между
электрофилом и атомом углерода бензольного кольца имеется σсвязь. σ-Комплекс не обладает ароматичностью, однако его четыре
π-электрона делокализованы в поле пяти sp2-гибридизованиых
атомов углерода. Шестой атом углерода, у которого замещается атом
водорода, переходит в состояние sp3-гибридизации.
σ-Комплекс резонансно стабилизирован посредством делокализации
положительного заряда, который оказывается сосредоточенным
в пара- и двух орто-положениях по отношению к реагирующему
атому :
17.
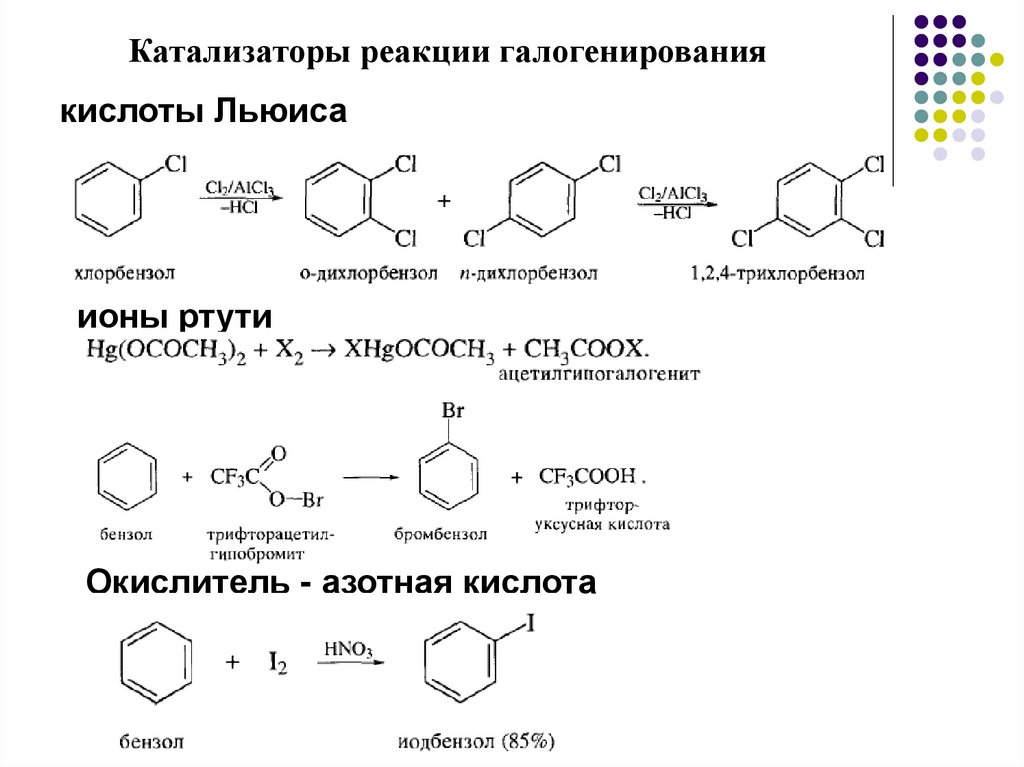
Катализаторы реакции галогенированиякислоты Льюиса
ионы ртути
Окислитель - азотная кислота
18.
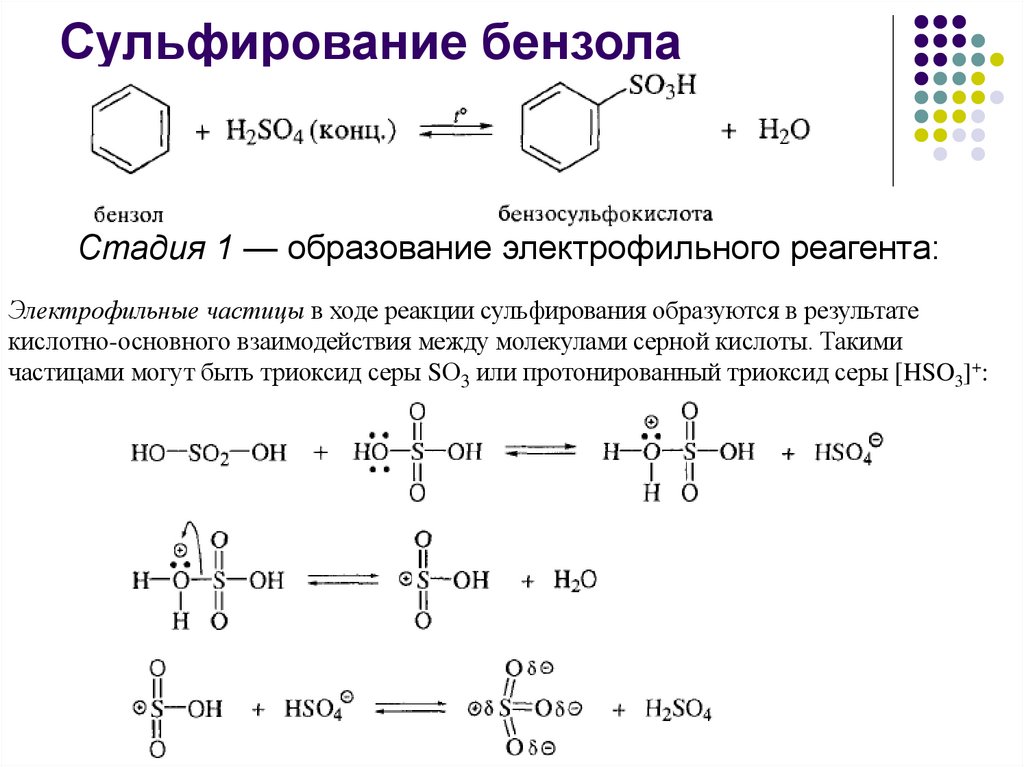
Сульфирование бензолаСтадия 1 — образование электрофильного реагента:
Электрофильные частицы в ходе реакции сульфирования образуются в результате
кислотно-основного взаимодействия между молекулами серной кислоты. Такими
частицами могут быть триоксид серы SО3 или протонированный триоксид серы [HSO3]+:
19.
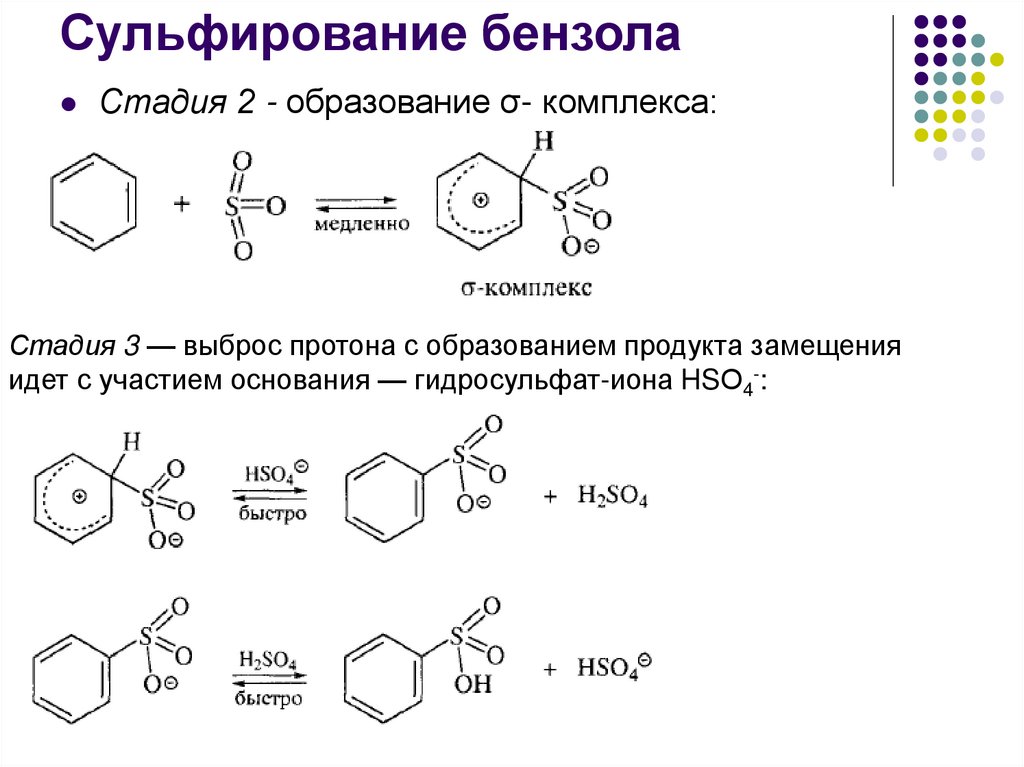
Сульфирование бензолаСтадия 2 - образование σ- комплекса:
Стадия 3 — выброс протона с образованием продукта замещения
идет с участием основания — гидросульфат-иона HSО4-:
20.
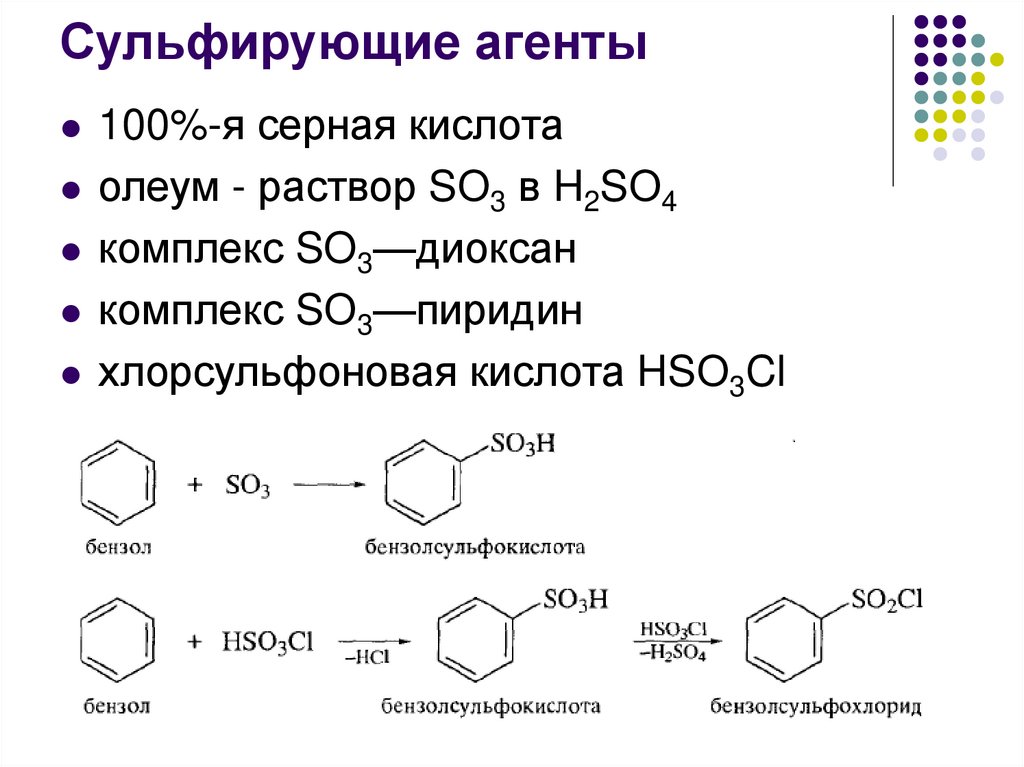
Сульфирующие агенты100%-я серная кислота
олеум - раствор SО3 в H2SО4
комплекс SO3—диоксан
комплекс SО3—пиридин
хлорсульфоновая кислота HSО3Cl
21.
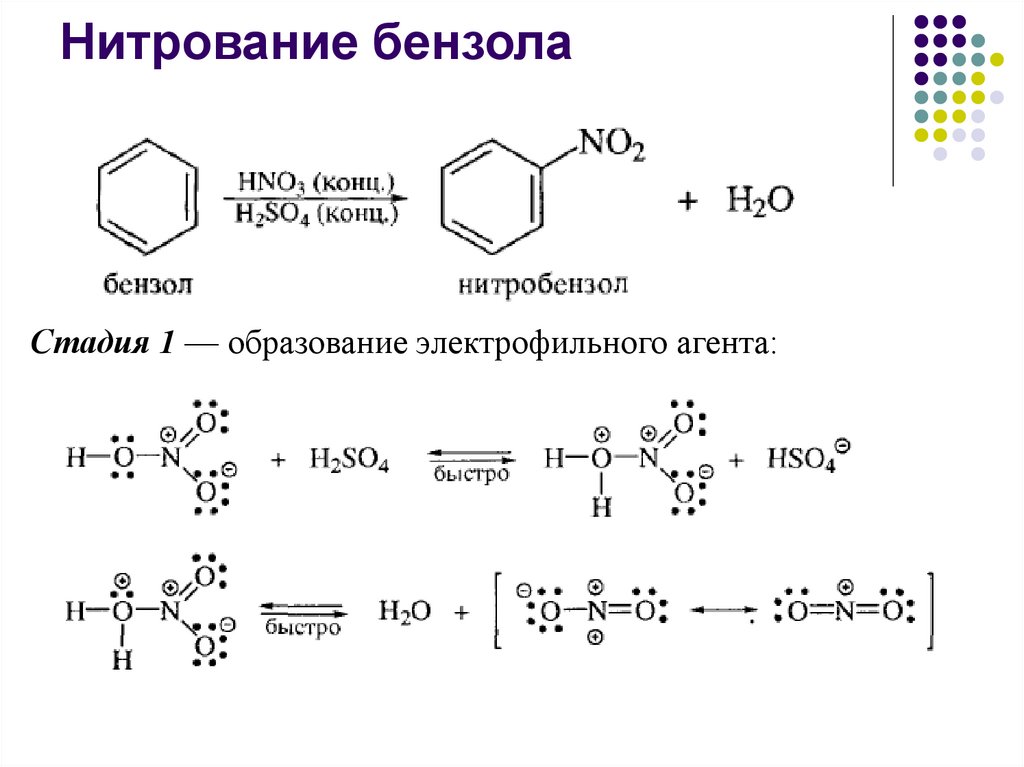
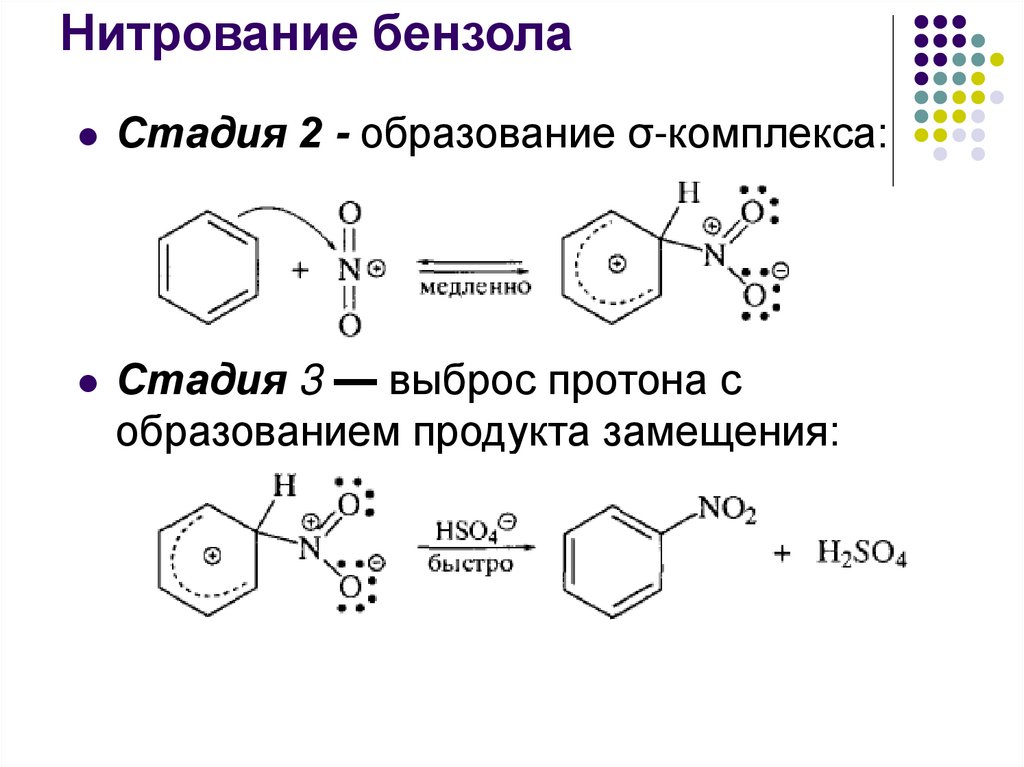
Нитрование бензолаСтадия 1 — образование электрофильного агента:
22.
Нитрование бензолаСтадия 2 - образование σ-комплекса:
Стадия 3 — выброс протона с
образованием продукта замещения:
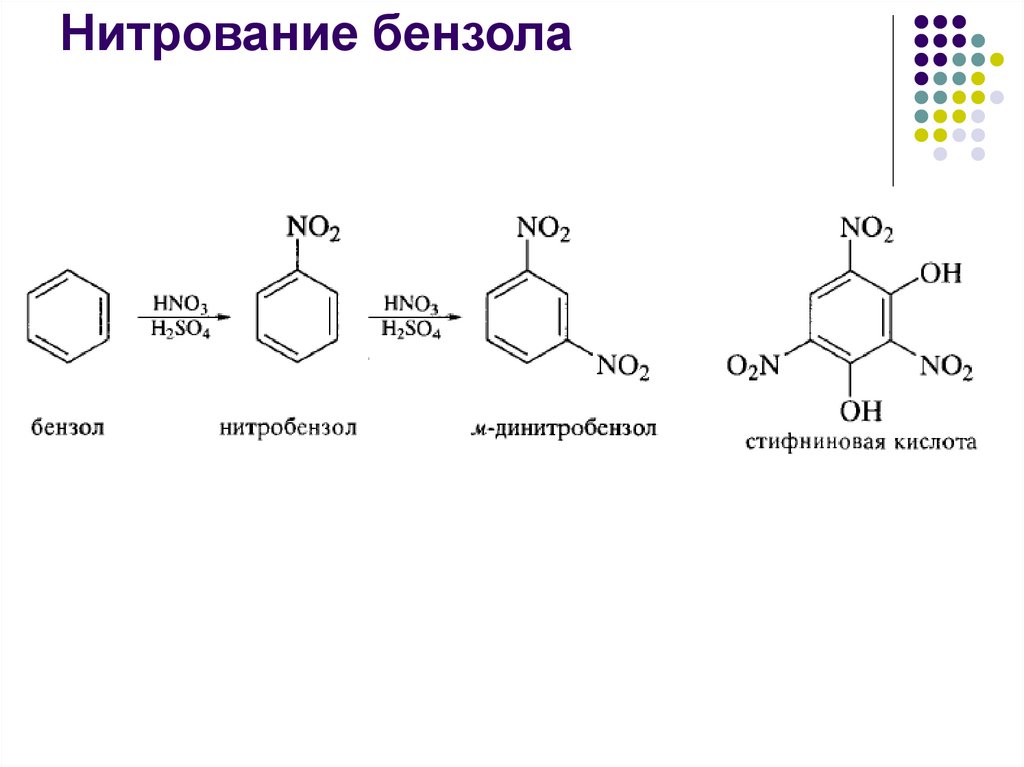
23.
Нитрование бензола24.
Нитрующие агентыH2SO4 + HNO3
H2SO4 + KNO3
ацетилнитрат CH3COONO2
нитрат алюминия Al(NO3) . 9H2O в
уксусной кислоте или в уксусном
ангидриде
Нитрат пиридиния C5H5NHNO3
25.
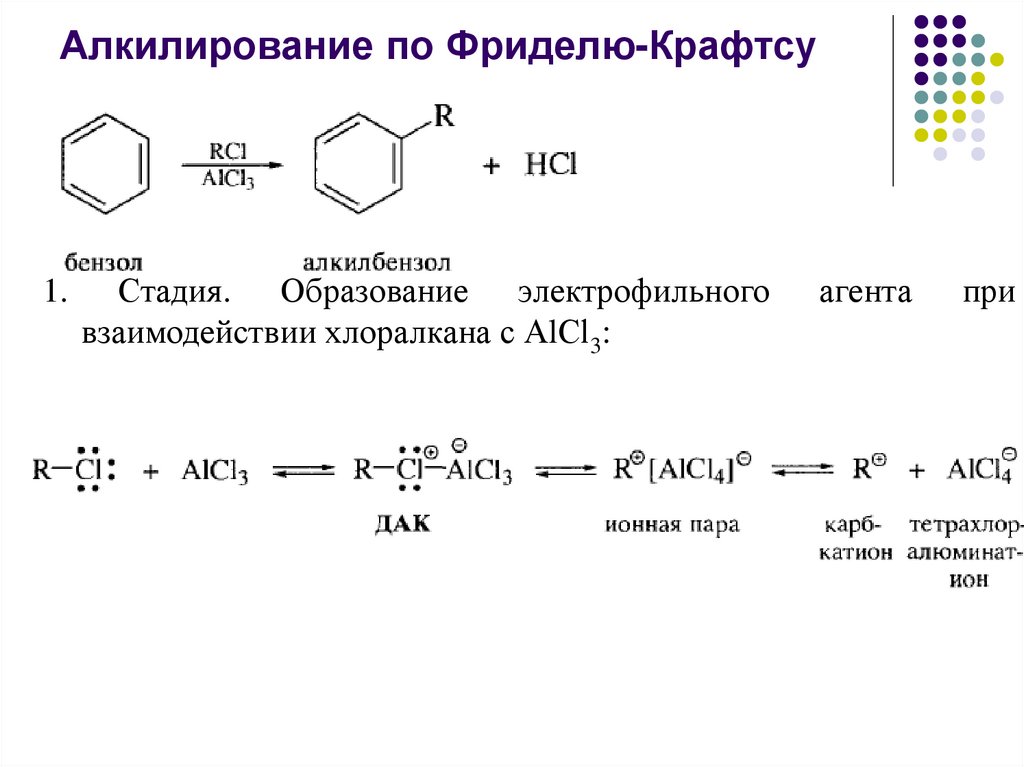
Алкилирование по Фриделю-Крафтсу1.
Стадия. Образование электрофильного
взаимодействии хлоралкана с АlСl3:
агента
при
26.
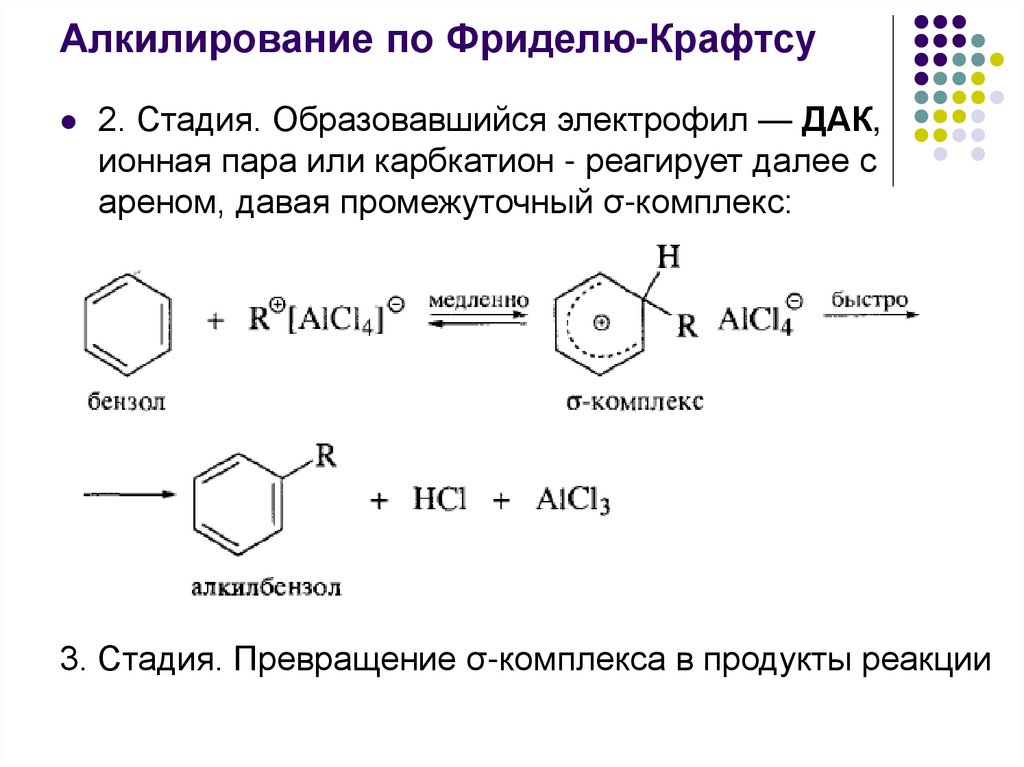
Алкилирование по Фриделю-Крафтсу2. Стадия. Образовавшийся электрофил — ДАК,
ионная пара или карбкатион - реагирует далее с
ареном, давая промежуточный σ-комплекс:
3. Стадия. Превращение σ-комплекса в продукты реакции
27.
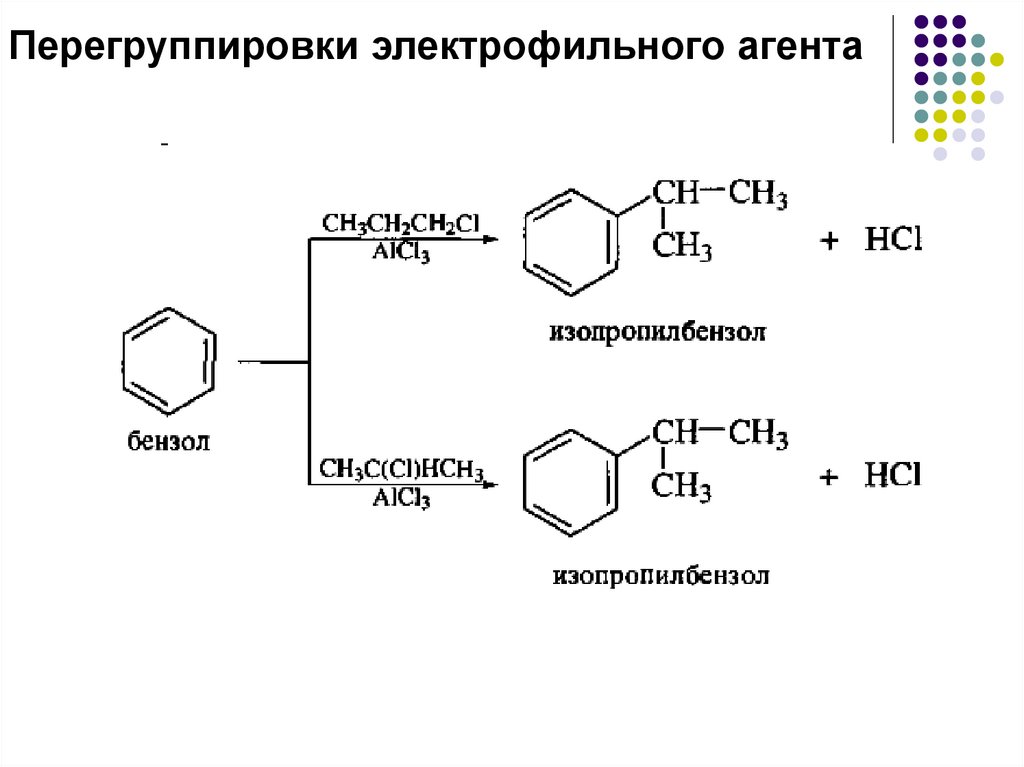
Перегруппировки электрофильного агента28.
Механизм перегруппировкиОбразование изопропил-катиона из н-пропилхлорида
происходит на стадии ионизации ДАК
29.
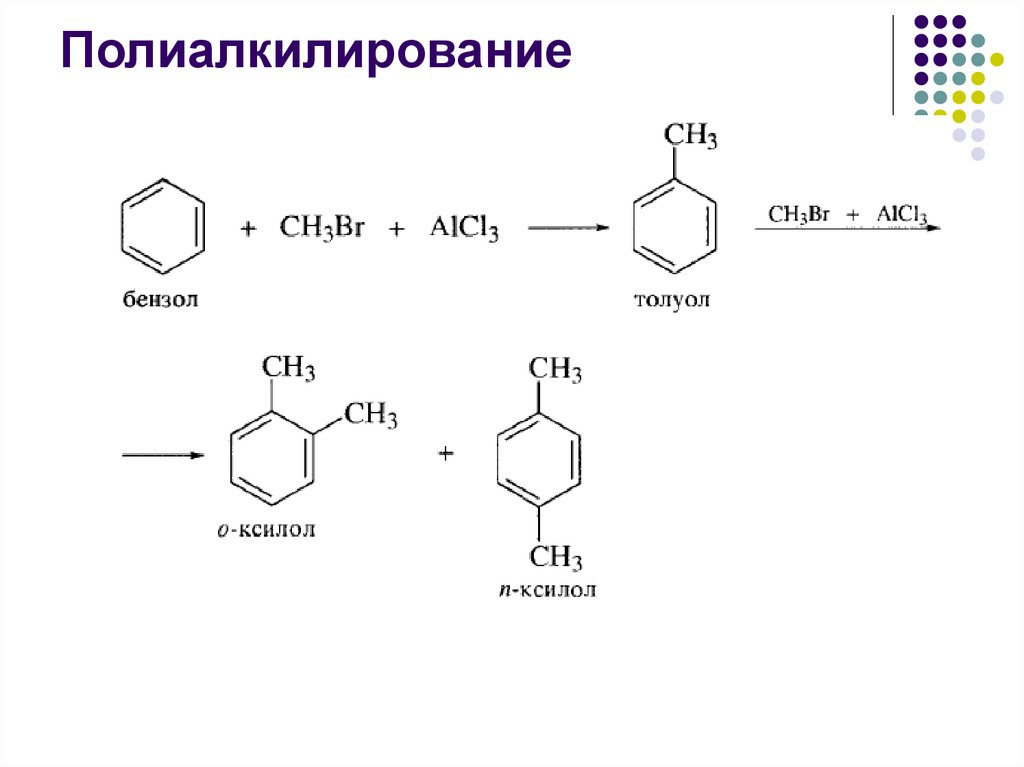
Полиалкилирование30.
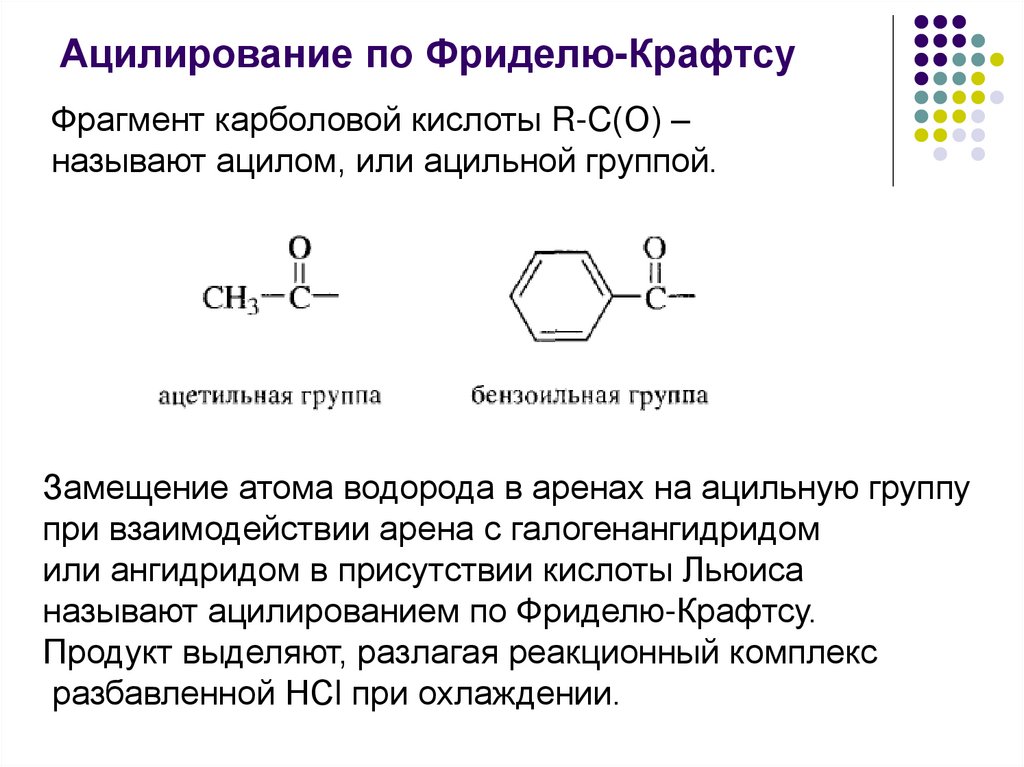
Ацилирование по Фриделю-КрафтсуФрагмент карболовой кислоты R-C(О) –
называют ацилом, или ацильной группой.
Замещение атома водорода в аренах на ацильную группу
при взаимодействии арена с галогенангидридом
или ангидридом в присутствии кислоты Льюиса
называют ацилированием по Фриделю-Крафтсу.
Продукт выделяют, разлагая реакционный комплекс
разбавленной НСl при охлаждении.
31.
Ацилирование по Фриделю-Крафтсу1. Образование электрофильного агента:
32.
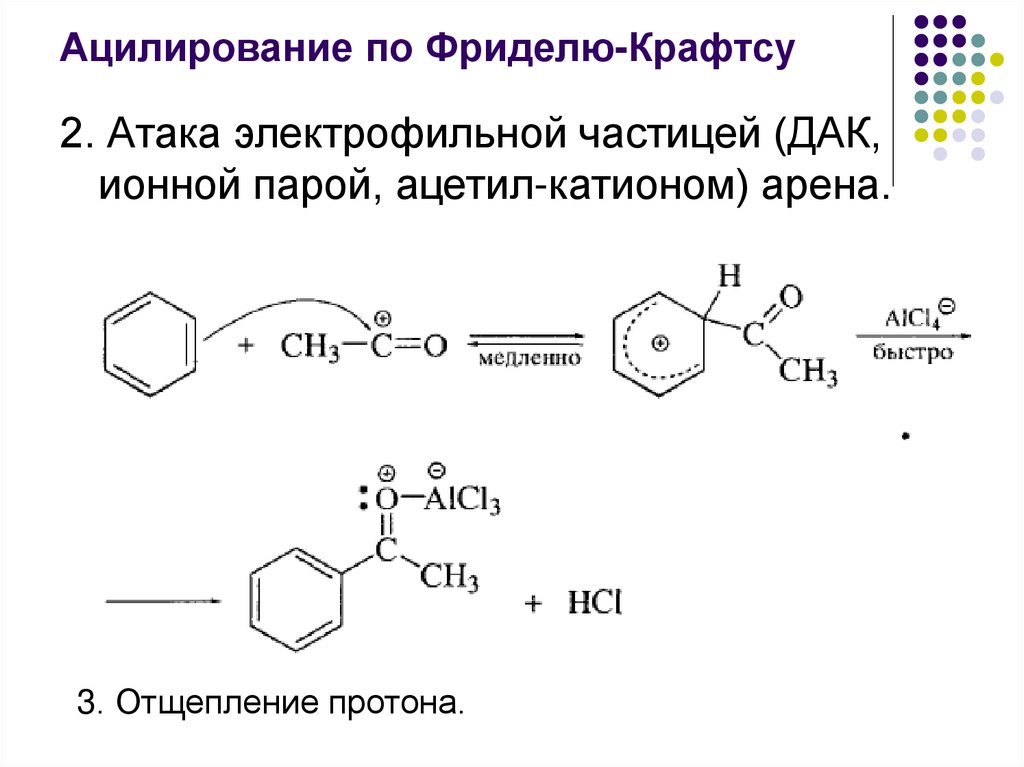
Ацилирование по Фриделю-Крафтсу2. Атака электрофильной частицей (ДАК,
ионной парой, ацетил-катионом) арена.
3. Отщепление протона.
33.
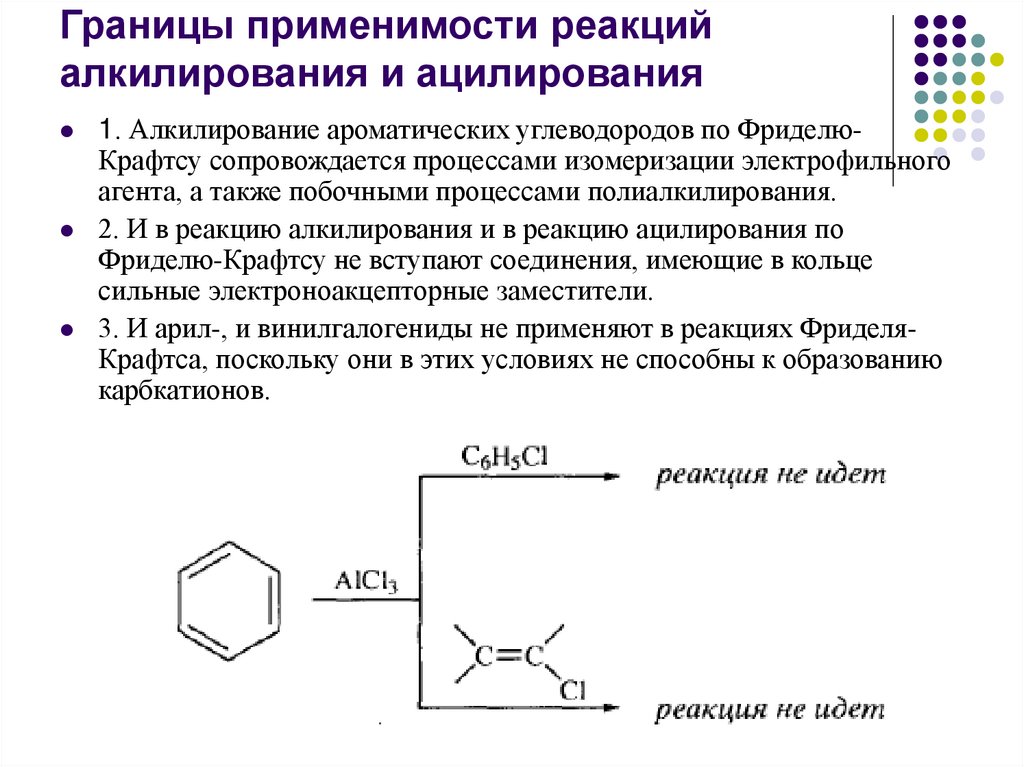
Границы применимости реакцийалкилирования и ацилирования
1. Алкилирование ароматических углеводородов по ФриделюКрафтсу сопровождается процессами изомеризации электрофильного
агента, а также побочными процессами полиалкилирования.
2. И в реакцию алкилирования и в реакцию ацилирования по
Фриделю-Крафтсу не вступают соединения, имеющие в кольце
сильные электроноакцепторные заместители.
3. И арил-, и винилгалогениды не применяют в реакциях ФриделяКрафтса, поскольку они в этих условиях не способны к образованию
карбкатионов.
34.
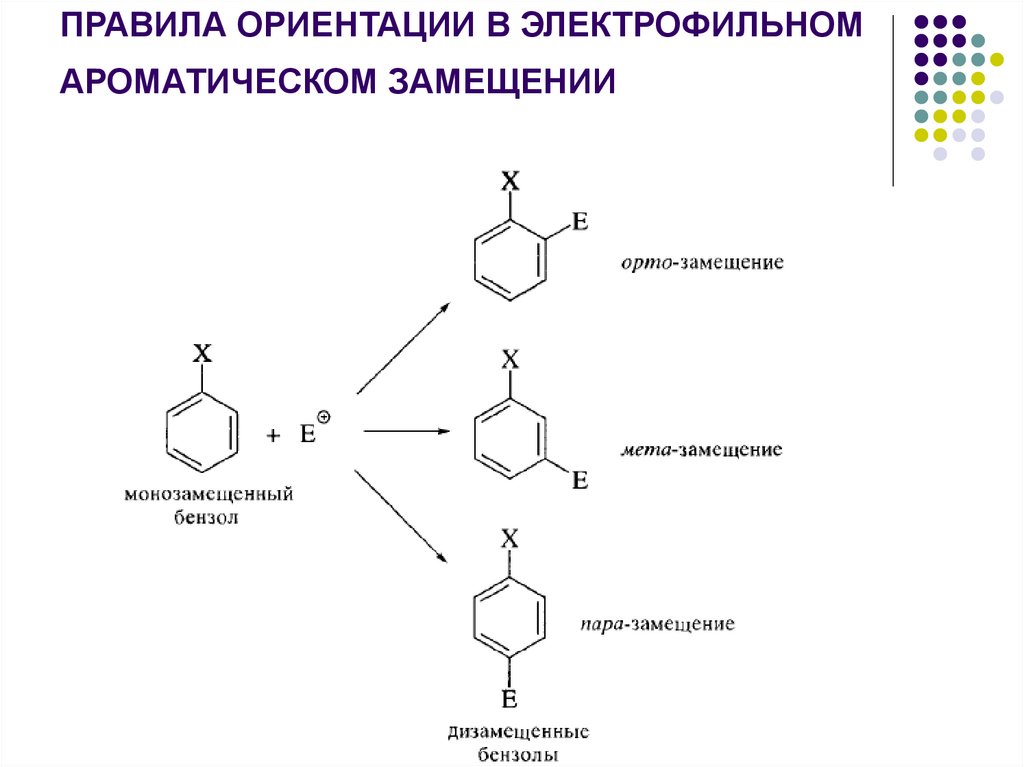
ПРАВИЛА ОРИЕНТАЦИИ В ЭЛЕКТРОФИЛЬНОМАРОМАТИЧЕСКОМ ЗАМЕЩЕНИИ
35.
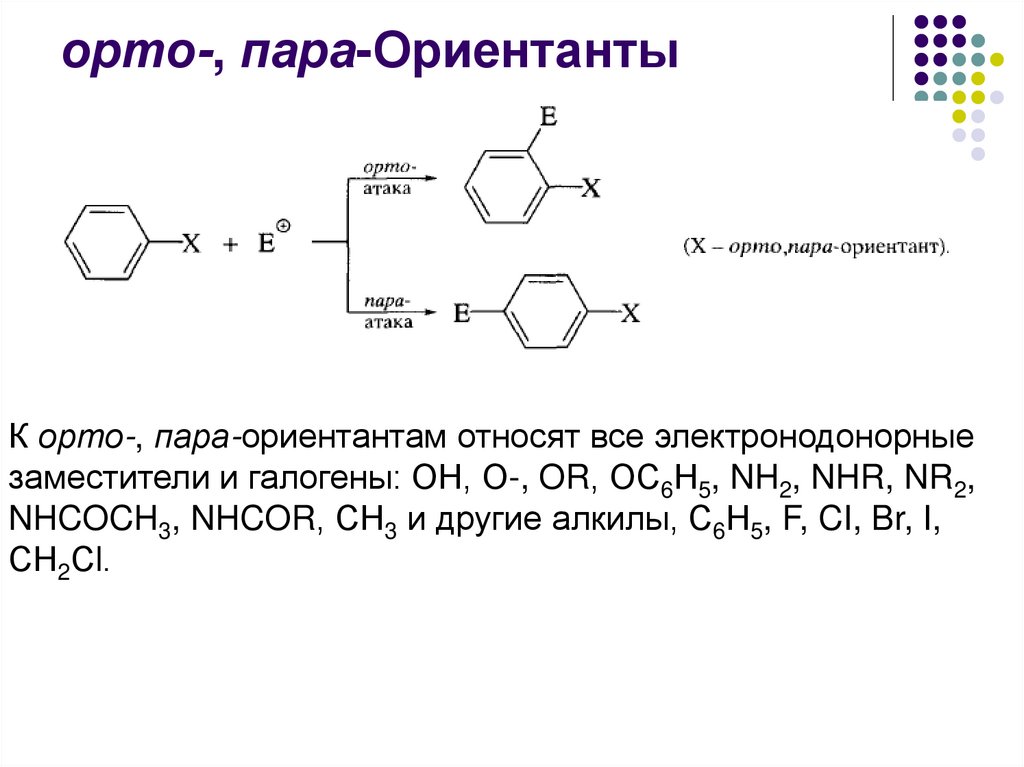
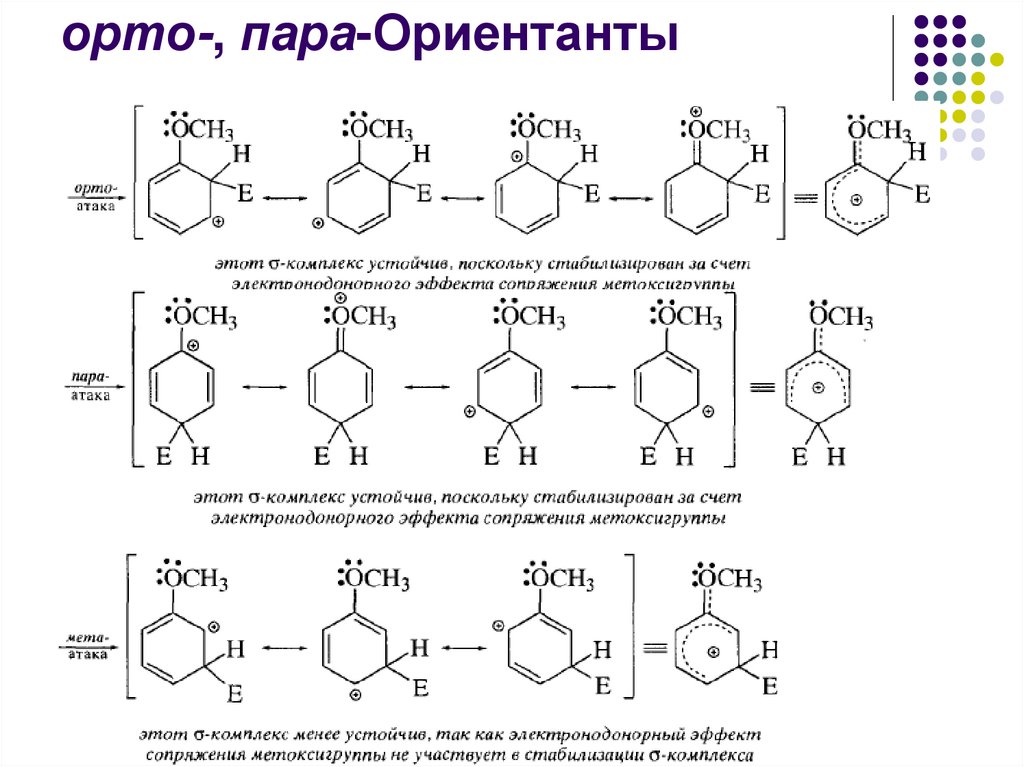
орто-, пара-ОриентантыК орто-, пара-ориентантам относят все электронодонорные
заместители и галогены: ОН, О-, OR, ОС6Н5, NH2, NHR, NR2,
NHCOCH3, NHCOR, СН3 и другие алкилы, С6Н5, F, CI, Br, I,
СН2Сl.
36.
орто-, пара-Ориентанты37.
орто-, пара-Ориентанты38.
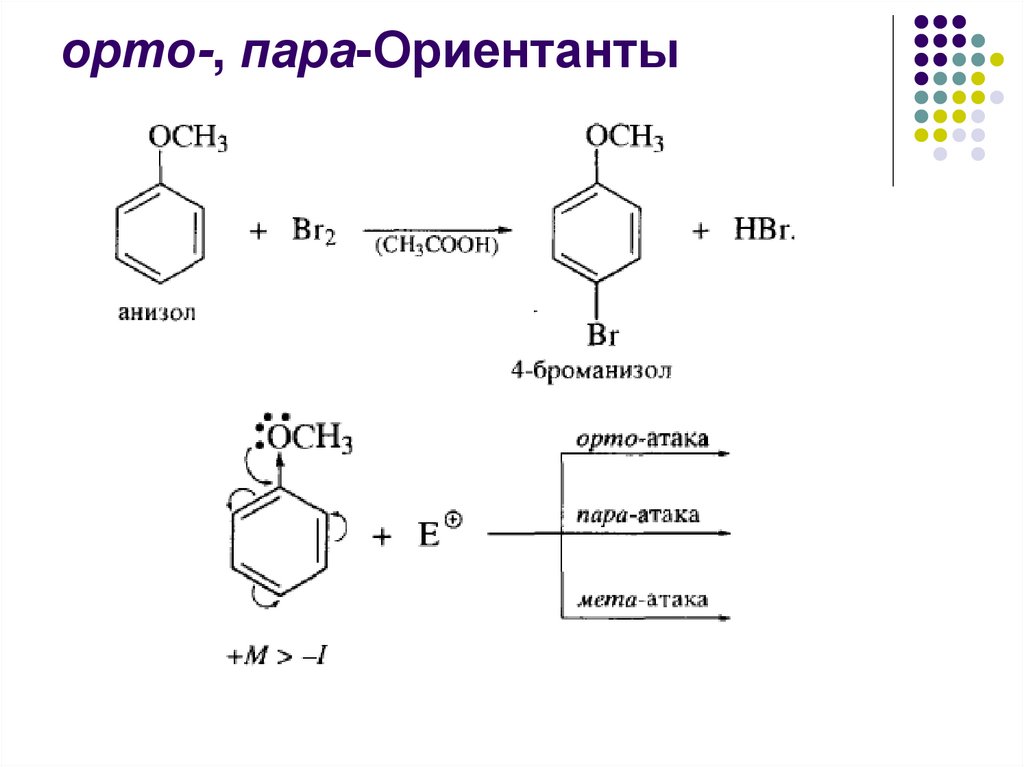
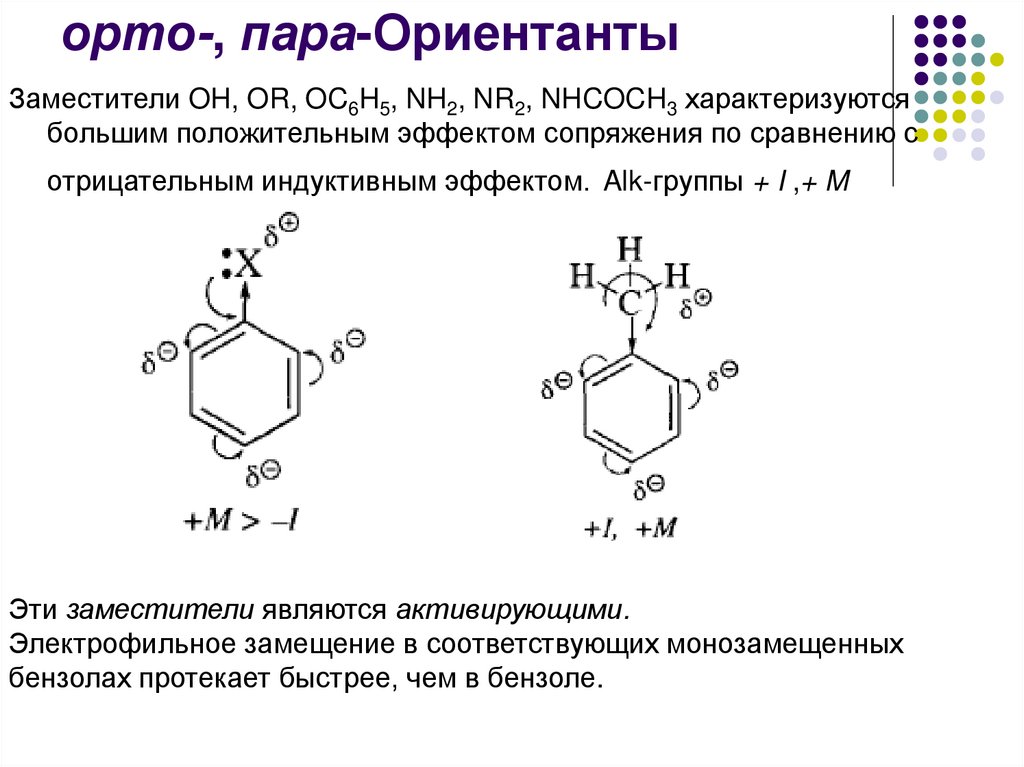
орто-, пара-ОриентантыЗаместители OH, OR, OC6H5, NH2, NR2, NHCOCH3 характеризуются
большим положительным эффектом сопряжения по сравнению с
отрицательным индуктивным эффектом. Alk-группы + I ,+ M
Эти заместители являются активирующими.
Электрофильное замещение в соответствующих монозамещенных
бензолах протекает быстрее, чем в бензоле.
39.
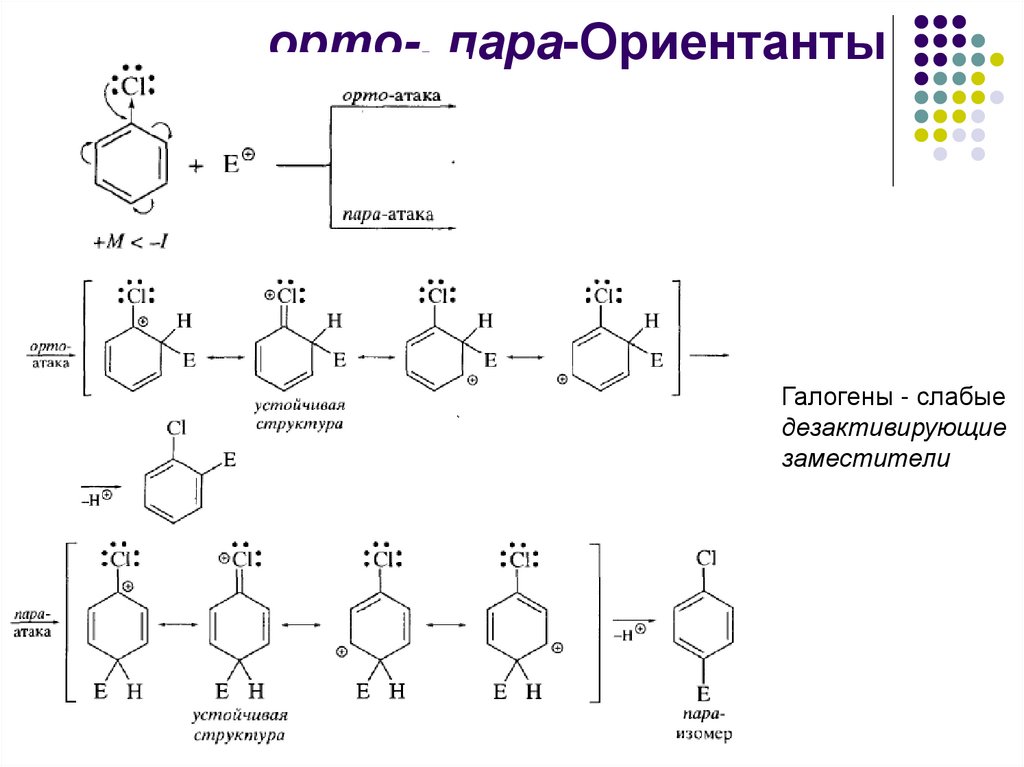
орто-, пара-ОриентантыГалогены - слабые
дезактивирующие
заместители
40.
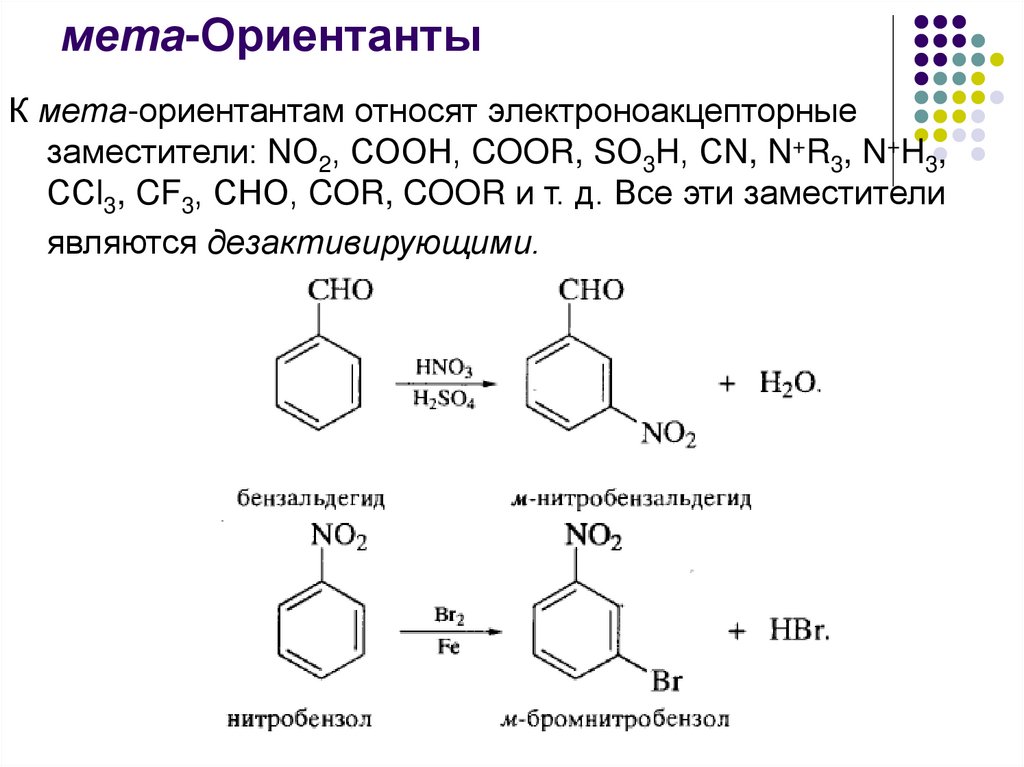
мета-ОриентантыК мета-ориентантам относят электроноакцепторные
заместители: NО2, СООН, COOR, SО3H, СN, N+R3, N+H3,
ССl3, CF3, СНО, COR, COOR и т. д. Все эти заместители
являются дезактивирующими.
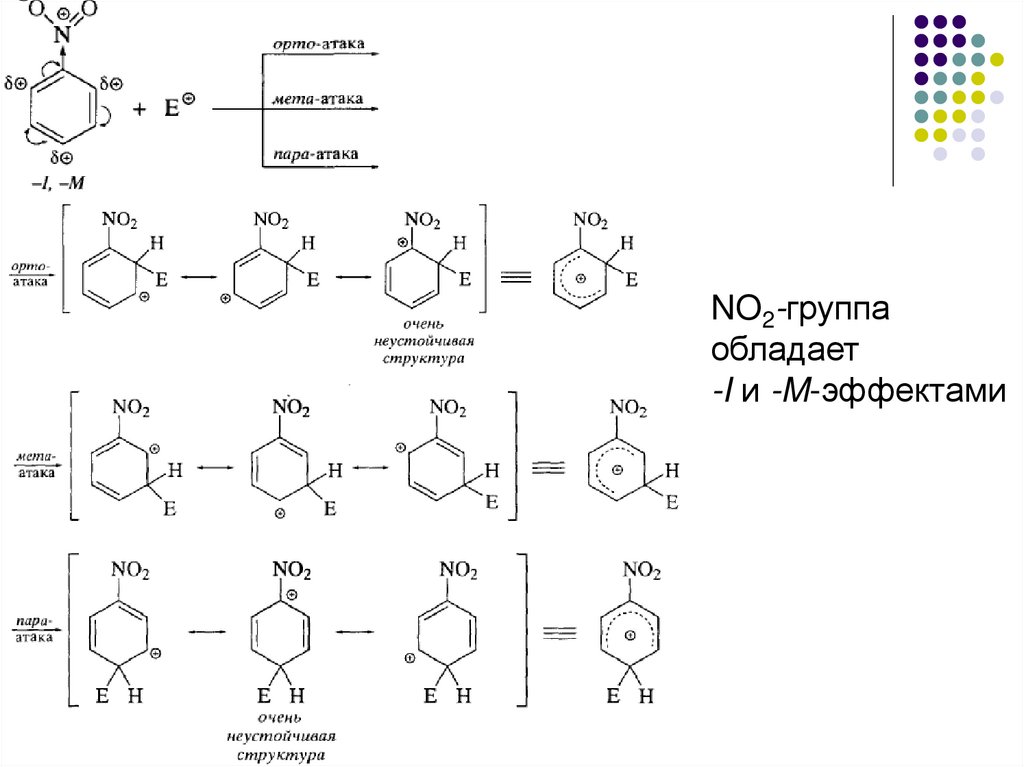
41.
NO2-группаобладает
-I и -M-эффектами
42.
Влияние заместителей на реакции SEAr43.
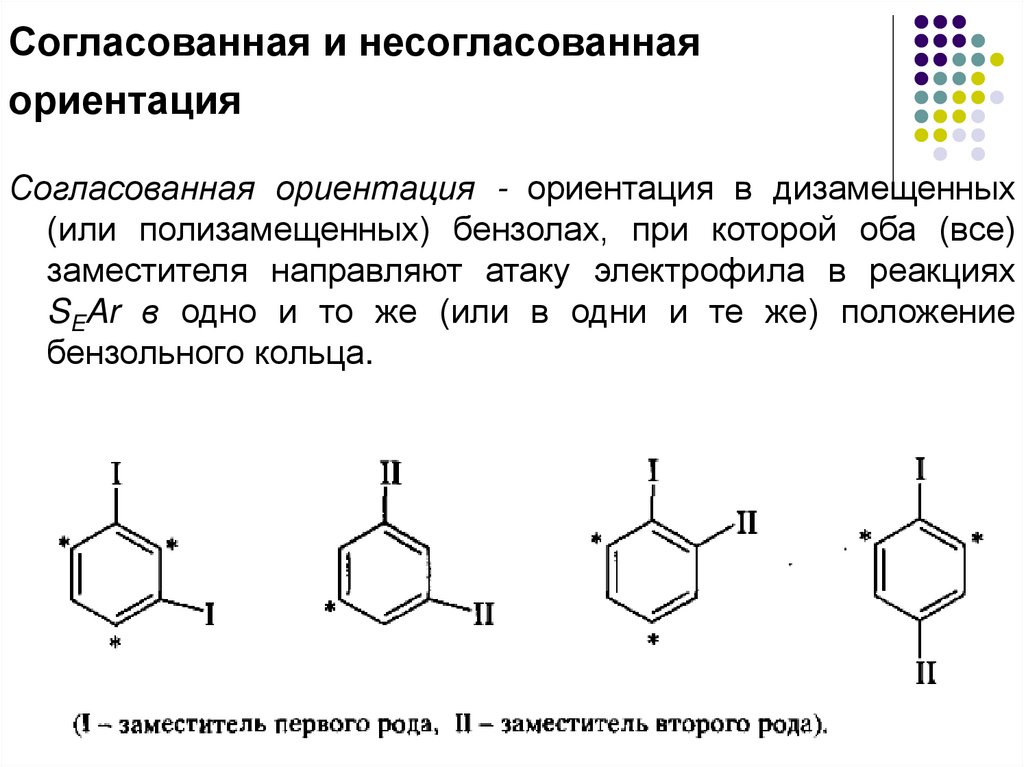
Согласованная и несогласованнаяориентация
Согласованная ориентация - ориентация в дизамещенных
(или полизамещенных) бензолах, при которой оба (все)
заместителя направляют атаку электрофила в реакциях
SEAr в одно и то же (или в одни и те же) положение
бензольного кольца.
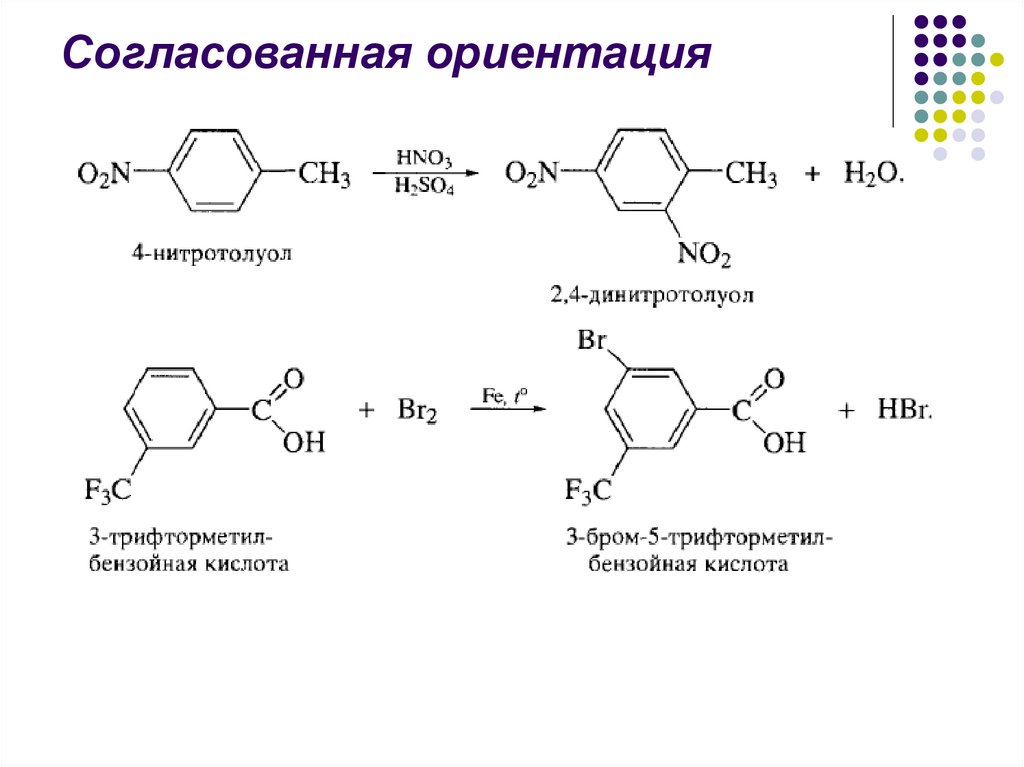
44.
Согласованная ориентация45.
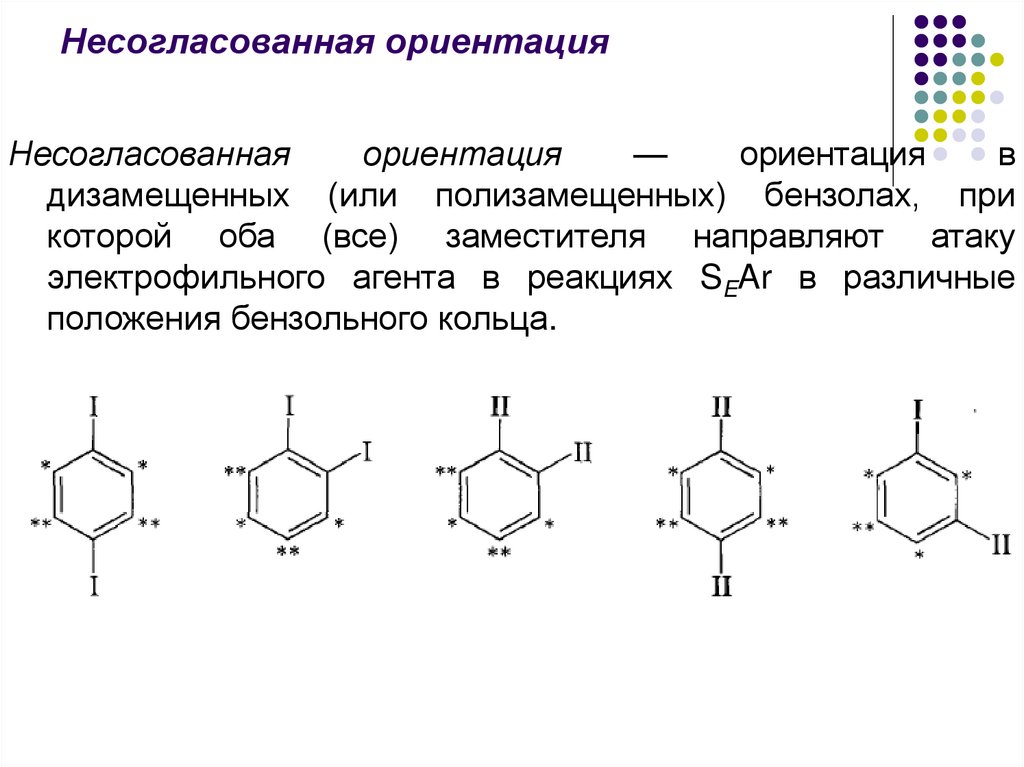
Несогласованная ориентацияНесогласованная
ориентация
—
ориентация
в
дизамещенных (или полизамещенных) бензолах, при
которой оба (все) заместителя направляют атаку
электрофильного агента в реакциях SEAr в различные
положения бензольного кольца.
46.
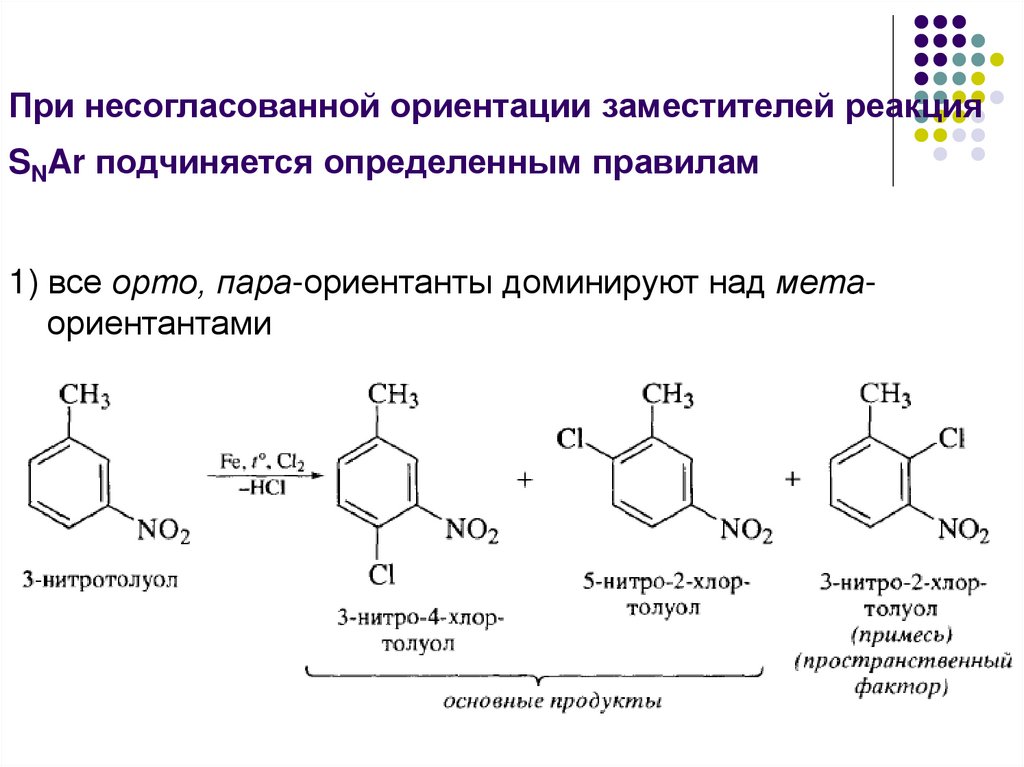
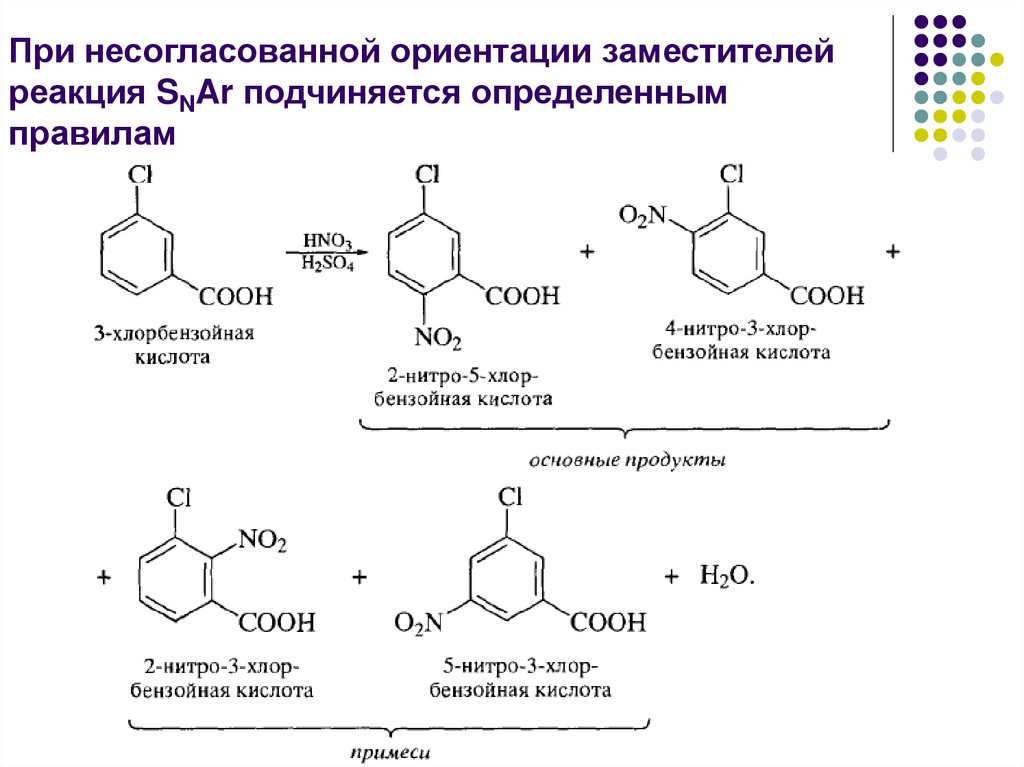
При несогласованной ориентации заместителей реакцияSNAr подчиняется определенным правилам
1) все орто, пара-ориентанты доминируют над метаориентантами
47.
При несогласованной ориентации заместителейреакция SNAr подчиняется определенным
правилам
48.
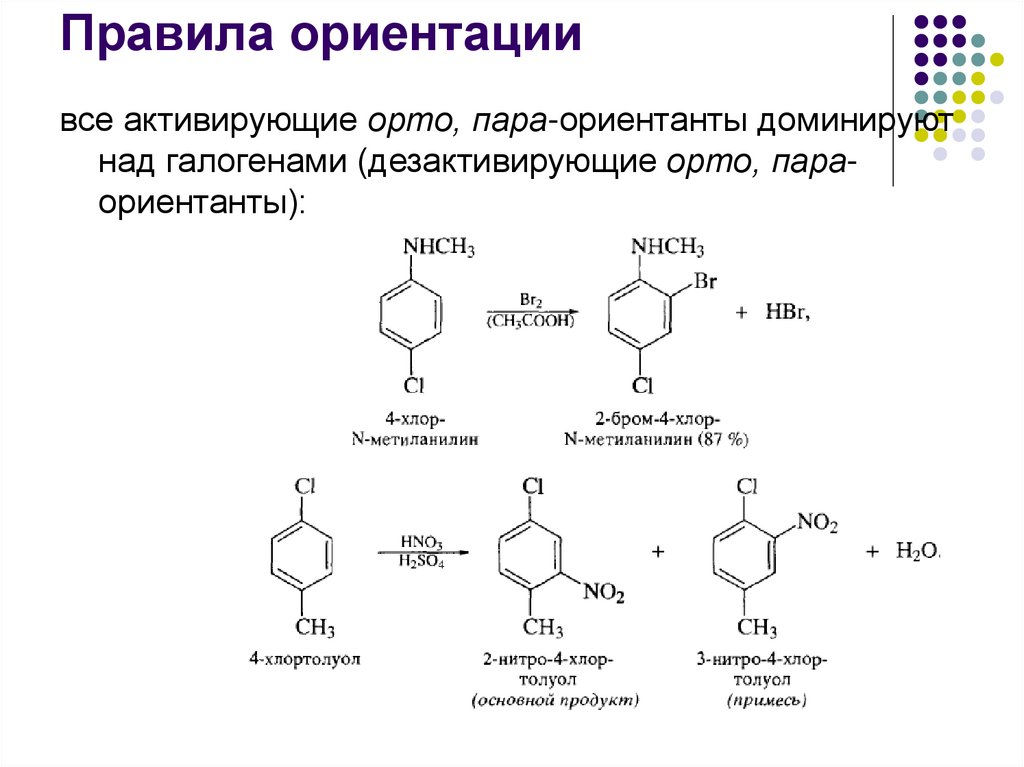
Правила ориентациивсе активирующие орто, пара-ориентанты доминируют
над галогенами (дезактивирующие орто, параориентанты):
49.
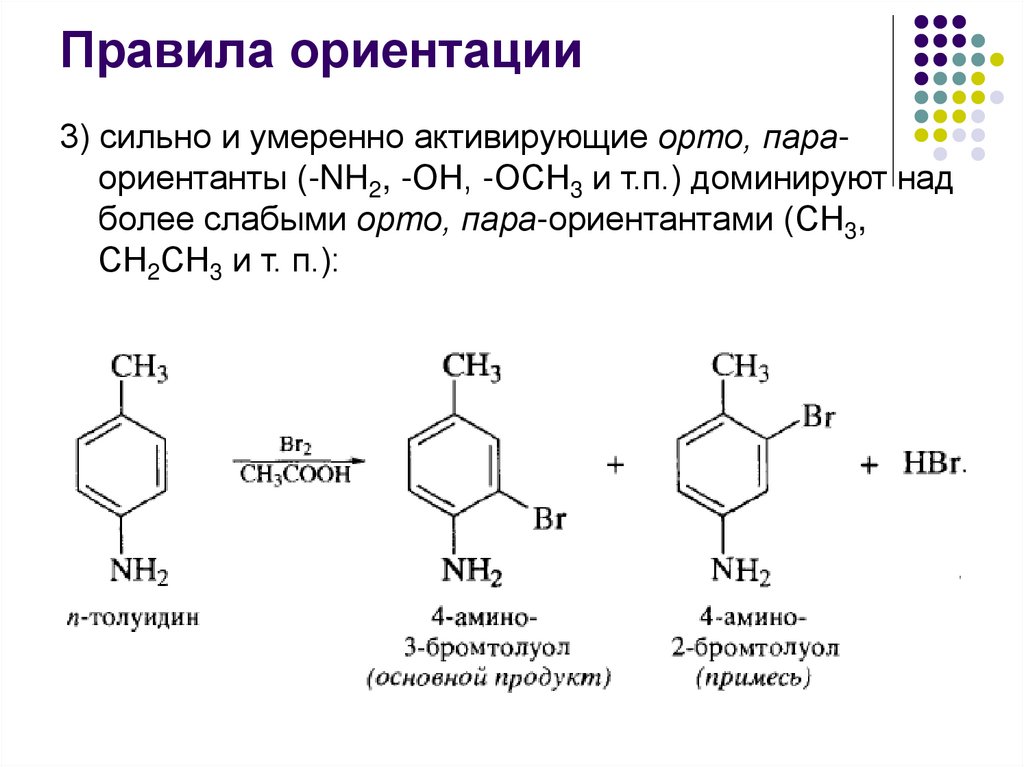
Правила ориентации3) сильно и умеренно активирующие орто, параориентанты (-NH2, -ОН, -ОСН3 и т.п.) доминируют над
более слабыми орто, пара-ориентантами (СН3,
СН2СН3 и т. п.):
50.
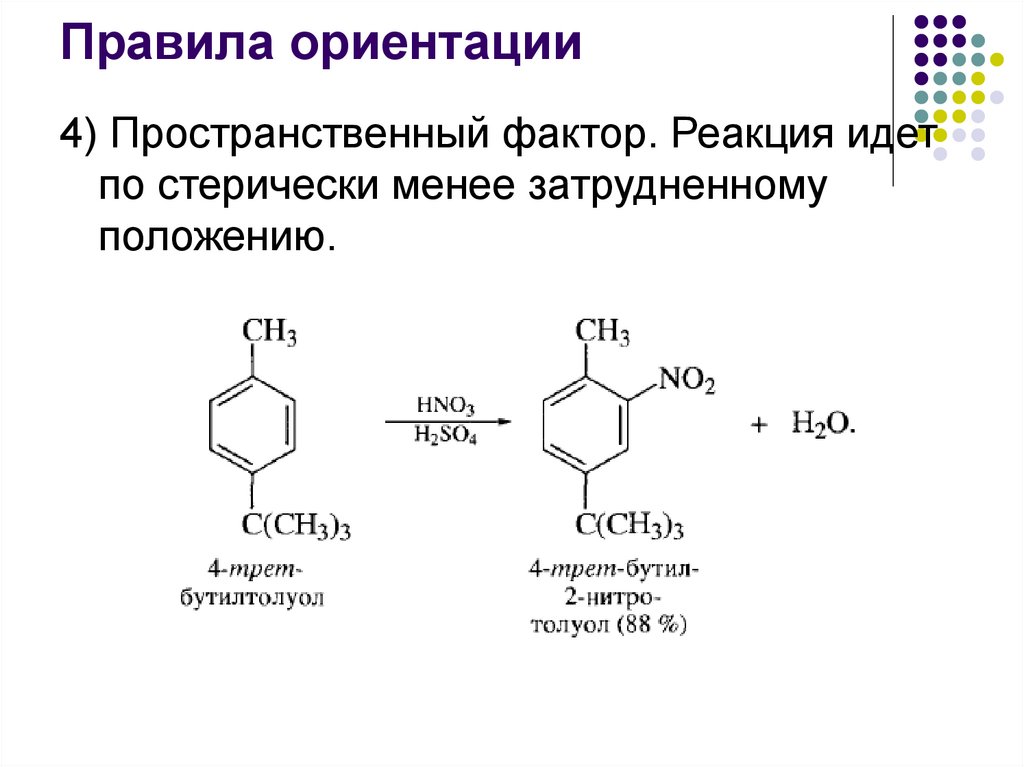
Правила ориентации4) Пространственный фактор. Реакция идет
по стерически менее затрудненному
положению.
51.
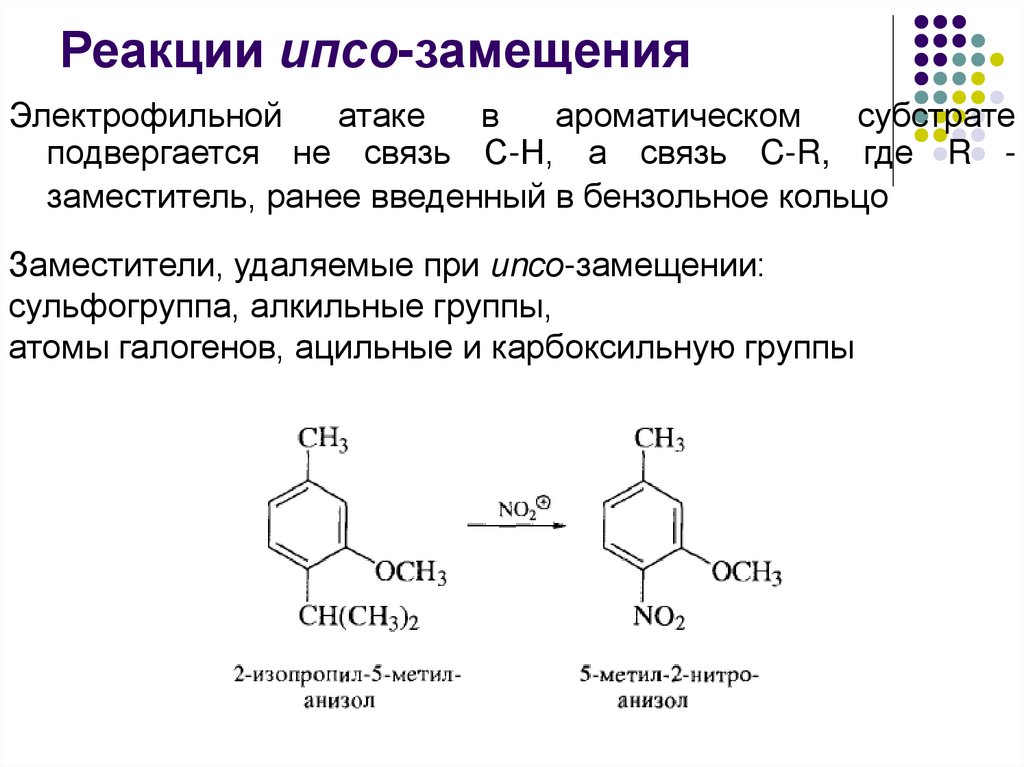
Реакции ипсо-замещенияЭлектрофильной
атаке
в
ароматическом
субстрате
подвергается не связь С-Н, а связь C-R, где R заместитель, ранее введенный в бензольное кольцо
Заместители, удаляемые при иnсо-замещении:
сульфогруппа, алкильные группы,
атомы галогенов, ацильные и карбоксильную группы
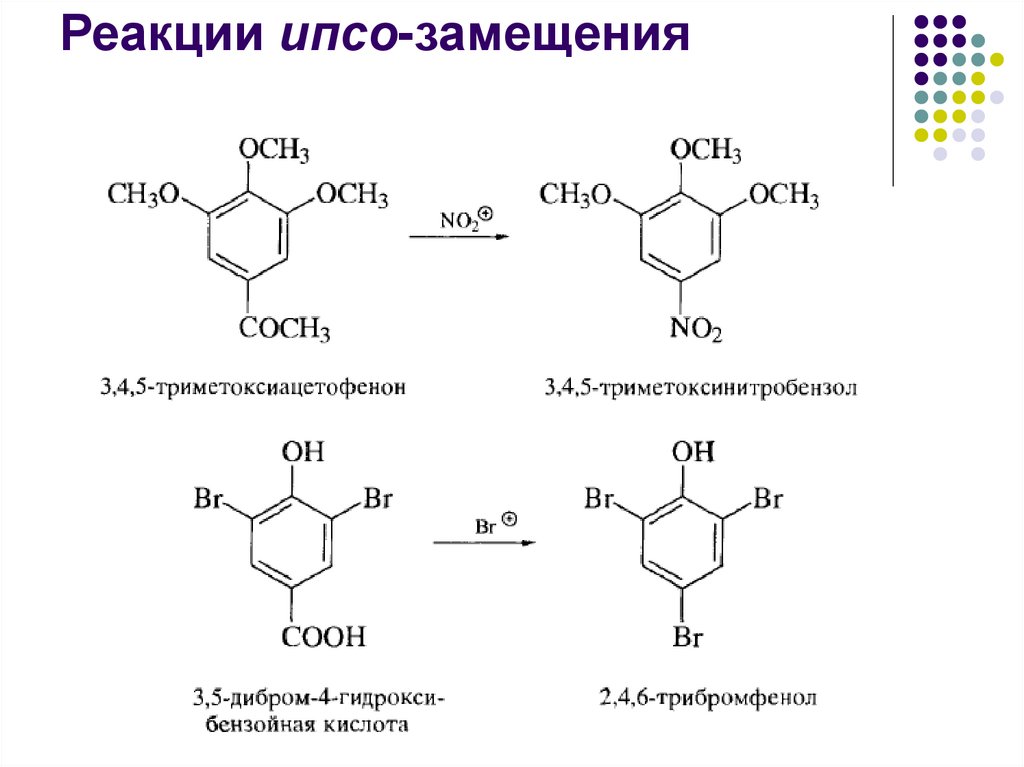
52.
Реакции ипсо-замещения53.
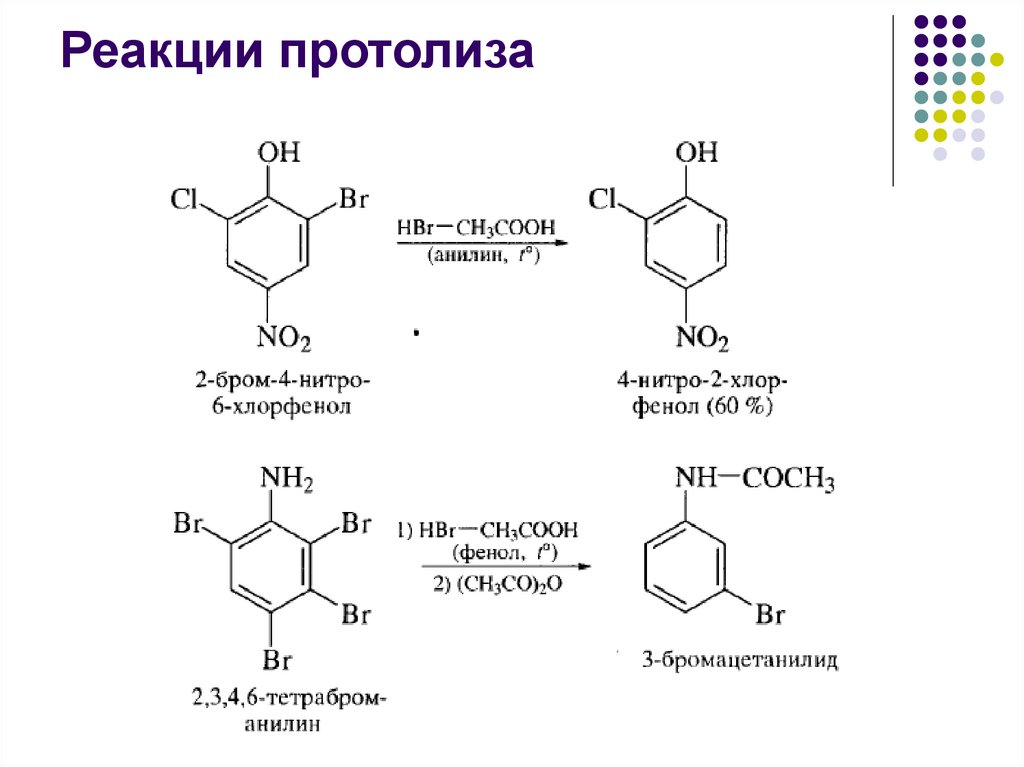
Реакции протолиза54.
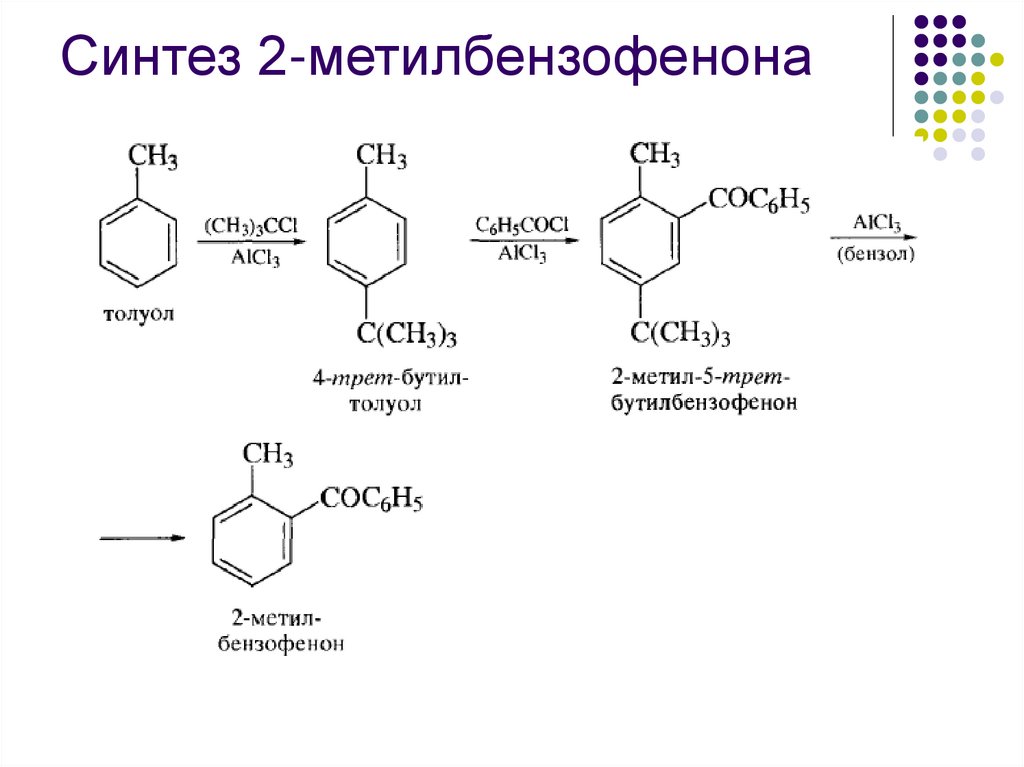
Синтез 2-метилбензофенона55.
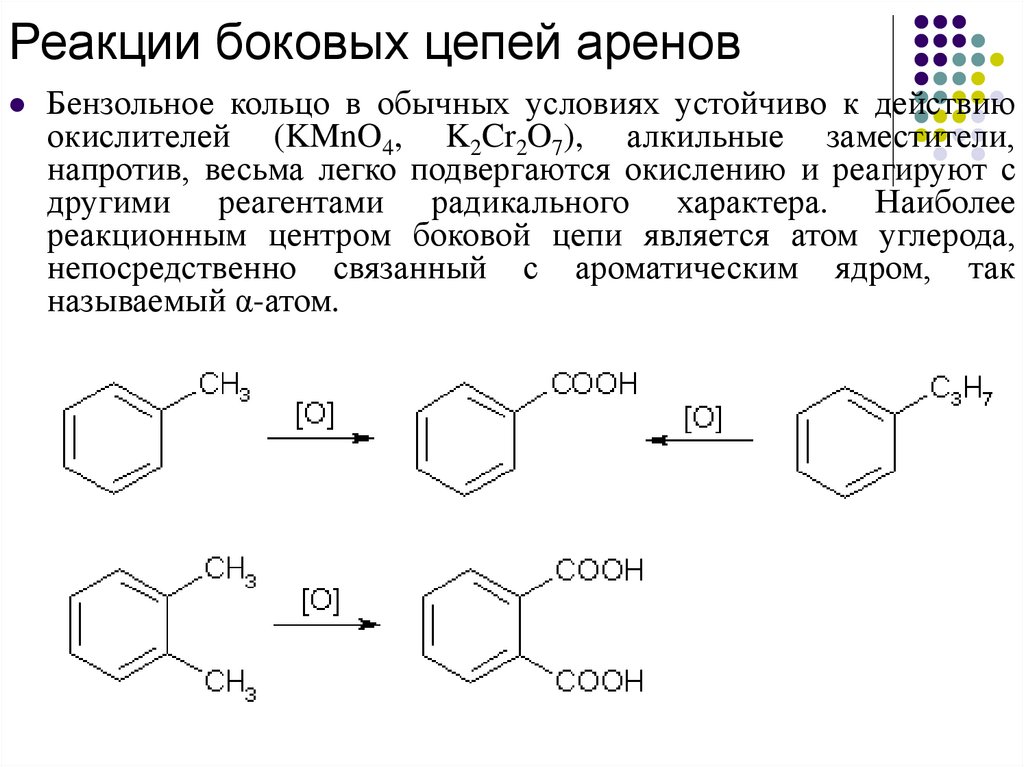
Реакции боковых цепей ареновБензольное кольцо в обычных условиях устойчиво к действию
окислителей (KMnO4, K2Cr2O7), алкильные заместители,
напротив, весьма легко подвергаются окислению и реагируют с
другими реагентами радикального характера. Наиболее
реакционным центром боковой цепи является атом углерода,
непосредственно связанный с ароматическим ядром, так
называемый α-атом.
56.
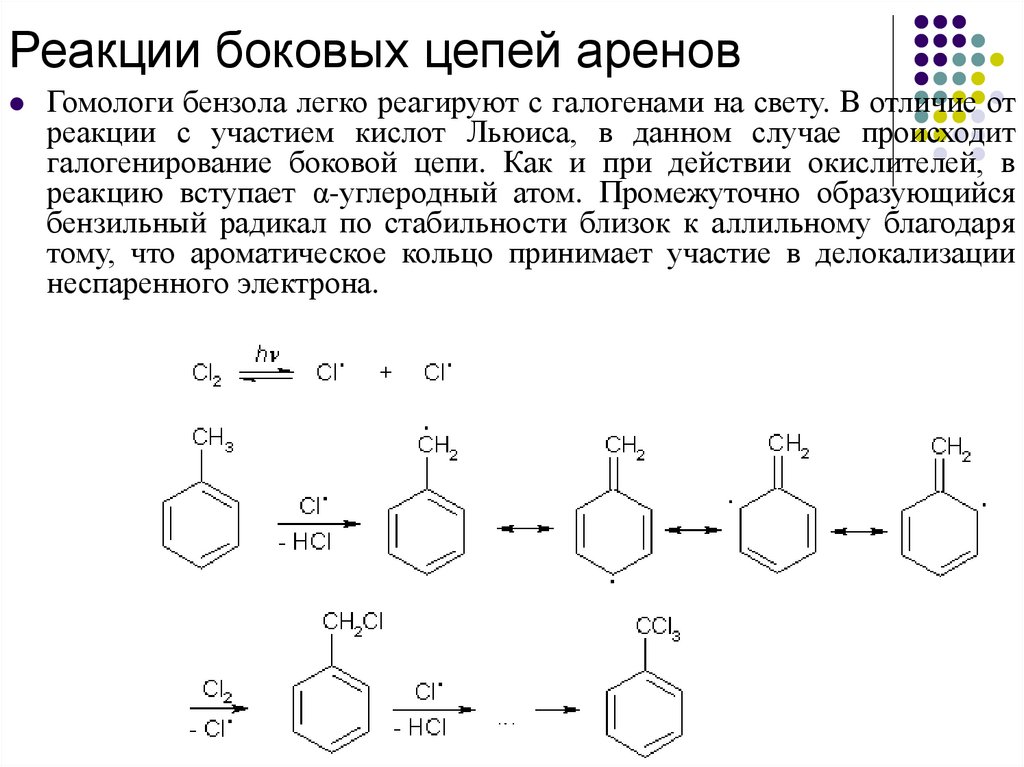
Реакции боковых цепей ареновГомологи бензола легко реагируют с галогенами на свету. В отличие от
реакции с участием кислот Льюиса, в данном случае происходит
галогенирование боковой цепи. Как и при действии окислителей, в
реакцию вступает α-углеродный атом. Промежуточно образующийся
бензильный радикал по стабильности близок к аллильному благодаря
тому, что ароматическое кольцо принимает участие в делокализации
неспаренного электрона.
57.
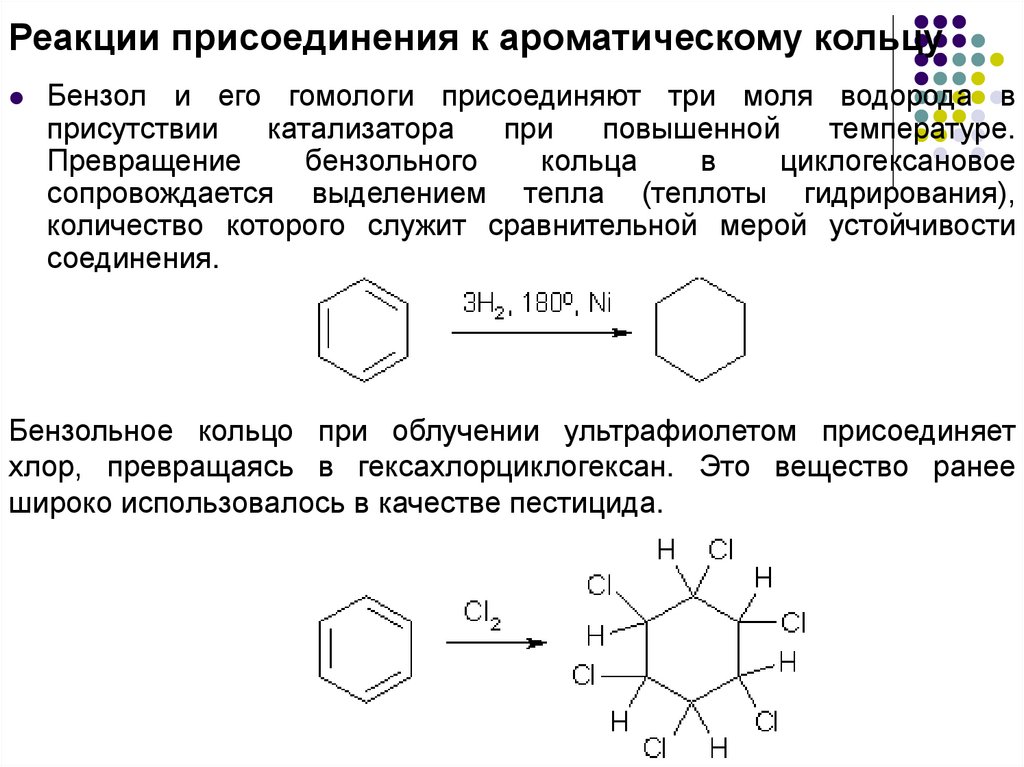
Реакции присоединения к ароматическому кольцуБензол и его гомологи присоединяют три моля водорода в
присутствии
катализатора
при
повышенной
температуре.
Превращение
бензольного
кольца
в
циклогексановое
сопровождается выделением тепла (теплоты гидрирования),
количество которого служит сравнительной мерой устойчивости
соединения.
Бензольное кольцо при облучении ультрафиолетом присоединяет
хлор, превращаясь в гексахлорциклогексан. Это вещество ранее
широко использовалось в качестве пестицида.
58.
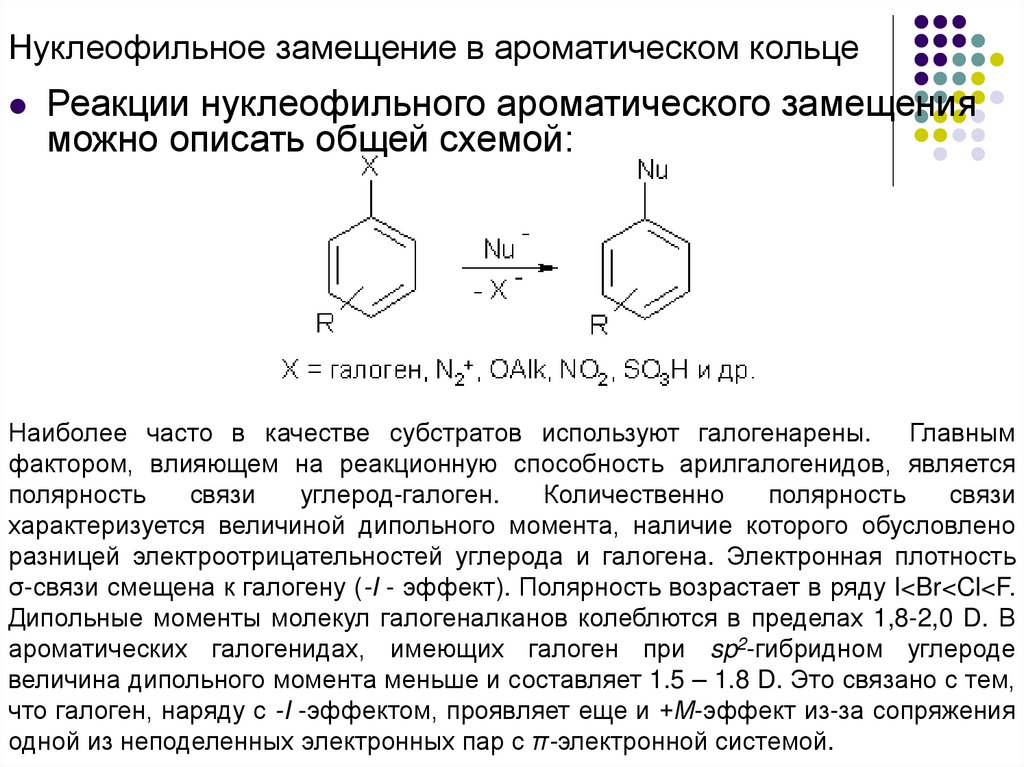
Нуклеофильное замещение в ароматическом кольцеРеакции нуклеофильного ароматического замещения
можно описать общей схемой:
Наиболее часто в качестве субстратов используют галогенарены. Главным
фактором, влияющем на реакционную способность арилгалогенидов, является
полярность
связи
углерод-галоген.
Количественно
полярность
связи
характеризуется величиной дипольного момента, наличие которого обусловлено
разницей электроотрицательностей углерода и галогена. Электронная плотность
σ-связи смещена к галогену (-I - эффект). Полярность возрастает в ряду I<Br<Cl<F.
Дипольные моменты молекул галогеналканов колеблются в пределах 1,8-2,0 D. В
ароматических галогенидах, имеющих галоген при sp2-гибридном углероде
величина дипольного момента меньше и составляет 1.5 – 1.8 D. Это связано с тем,
что галоген, наряду с -I -эффектом, проявляет еще и +М-эффект из-за сопряжения
одной из неподеленных электронных пар с π-электронной системой.
59.
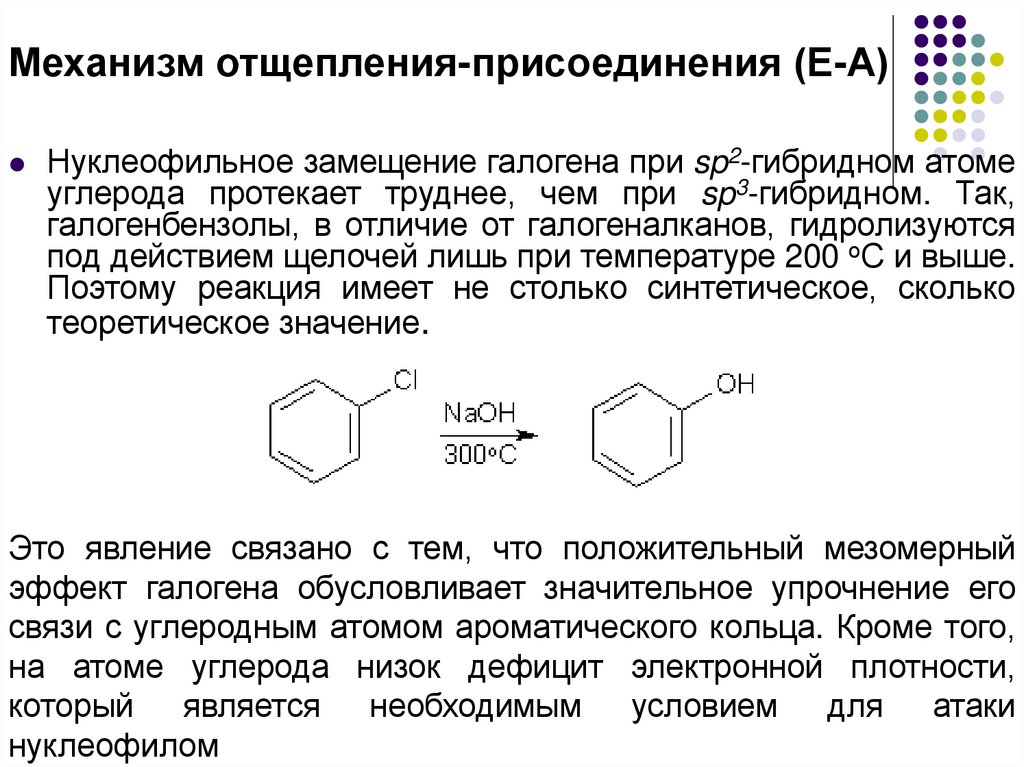
Механизм отщепления-присоединения (Е-А)Нуклеофильное замещение галогена при sp2-гибридном атоме
углерода протекает труднее, чем при sp3-гибридном. Так,
галогенбензолы, в отличие от галогеналканов, гидролизуются
под действием щелочей лишь при температуре 200 оС и выше.
Поэтому реакция имеет не столько синтетическое, сколько
теоретическое значение.
Это явление связано с тем, что положительный мезомерный
эффект галогена обусловливает значительное упрочнение его
связи с углеродным атомом ароматического кольца. Кроме того,
на атоме углерода низок дефицит электронной плотности,
который является необходимым условием для атаки
нуклеофилом
60.
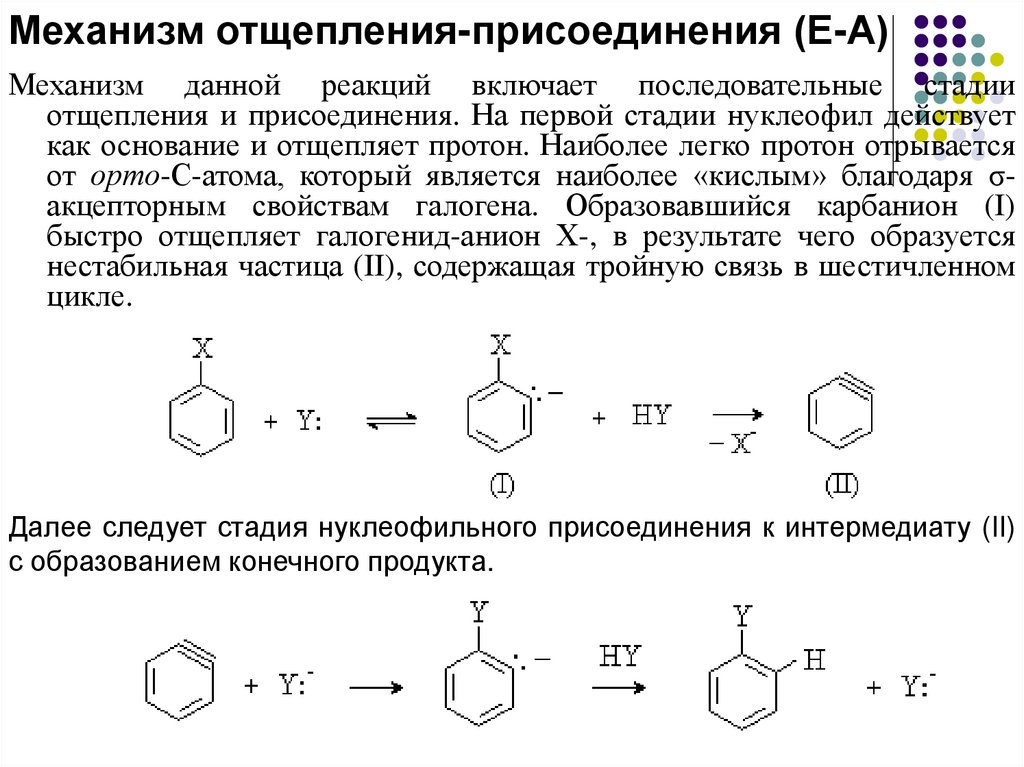
Механизм отщепления-присоединения (Е-А)Механизм данной реакций включает последовательные стадии
отщепления и присоединения. На первой стадии нуклеофил действует
как основание и отщепляет протон. Наиболее легко протон отрывается
от орто-С-атома, который является наиболее «кислым» благодаря σакцепторным свойствам галогена. Образовавшийся карбанион (I)
быстро отщепляет галогенид-анион Х-, в результате чего образуется
нестабильная частица (II), содержащая тройную связь в шестичленном
цикле.
Далее следует стадия нуклеофильного присоединения к интермедиату (II)
с образованием конечного продукта.
61.
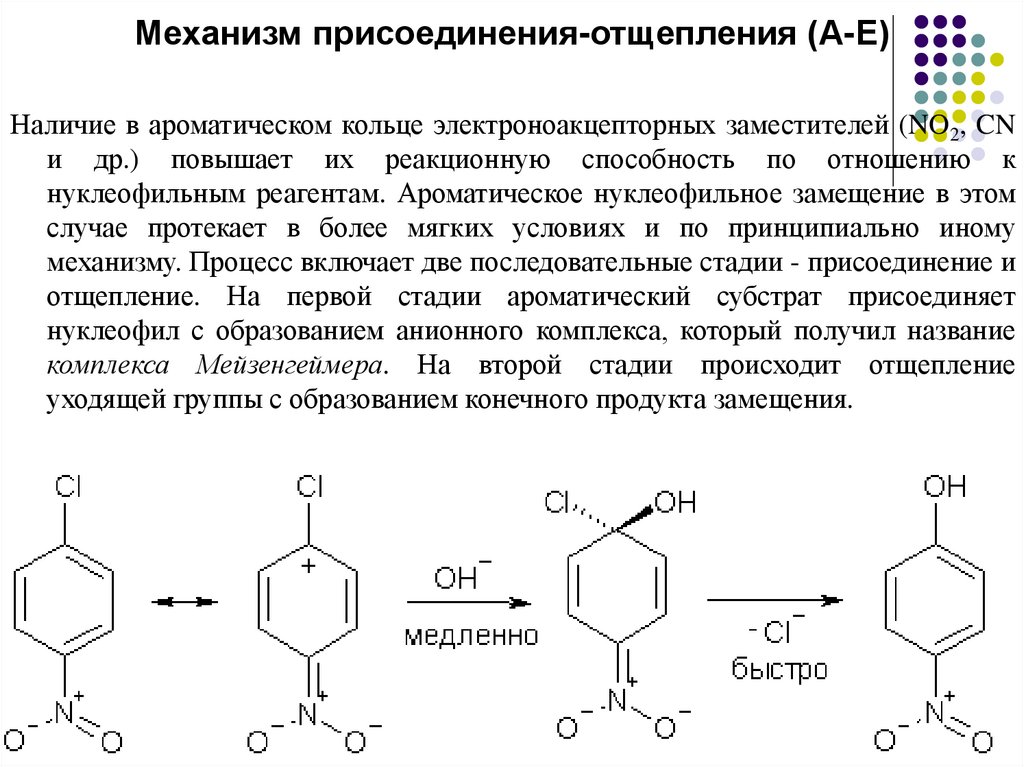
Механизм присоединения-отщепления (А-Е)Наличие в ароматическом кольце электроноакцепторных заместителей (NO2, CN
и др.) повышает их реакционную способность по отношению к
нуклеофильным реагентам. Ароматическое нуклеофильное замещение в этом
случае протекает в более мягких условиях и по принципиально иному
механизму. Процесс включает две последовательные стадии - присоединение и
отщепление. На первой стадии ароматический субстрат присоединяет
нуклеофил с образованием анионного комплекса, который получил название
комплекса Мейзенгеймера. На второй стадии происходит отщепление
уходящей группы с образованием конечного продукта замещения.






 chemistry
chemistry








