Similar presentations:
Бензол, ароматические углеводороды
1.
Бензол,ароматические углеводороды
2. Историческая справка
Первоначально название «ароматическиеуглеводороды» получили вещества, обладающие
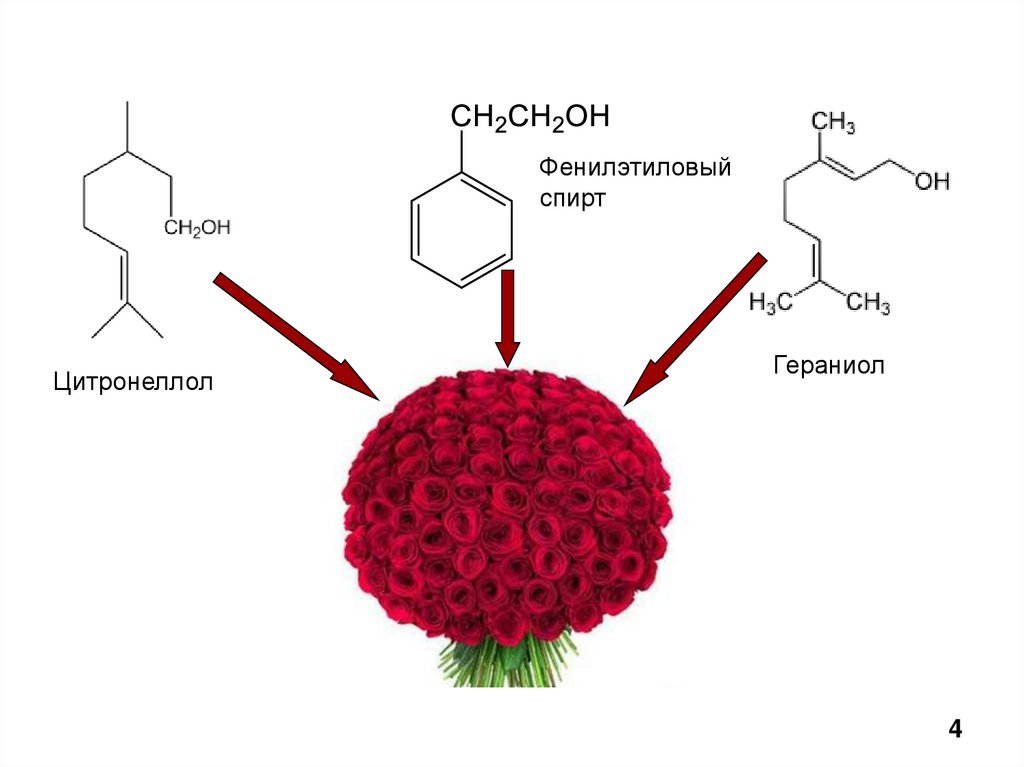
приятным запахом - например, фенилэтиловый спирт
и его производные.
Но не запах является наиболее характерным
признаком этих органических веществ, а основа
структуры – ароматическое (чаще всего) бензольное
кольцо.
3. Физические свойства бензола
При обычных условиях-бесцветная жидкость схарактерным запахом, не смешивается с
водой, является хорошим растворителем для
неполярных молекул, сильно токсичен,
канцероген.
Температура плавления и кипения 5,5 и 80 С.
4.
Фенилэтиловыйспирт
Цитронеллол
Гераниол
4
5. Органические соединения, в состав которых входят одно или несколько бензольных колец, называются ароматическими углеводородами.
Для гомологовбензола СnH2n-6 n> 6
Бензол
Нафталин
CH3
Толуол
Антрацен
CH=CH2
Стирол
6.
Бензол,электронное строение
7. Электронное строение молекулы бензола
Общая формула моноциклических аренов СnH2n-6 (где n6) показывает, что они являются ненасыщенными
соединениями. Простейшим из них является бензол С6Н6
Согласно данным элементного анализа и определения
молекулярной массы, бензол содержит 6 атомов
углерода и 6 атомов водорода и имеет относительную
молекулярную массу 78
В 1865 году Ф. Кекуле выдвинул гипотезу о циклическом
строении бензола и что в его молекуле содержится три
двойные связи
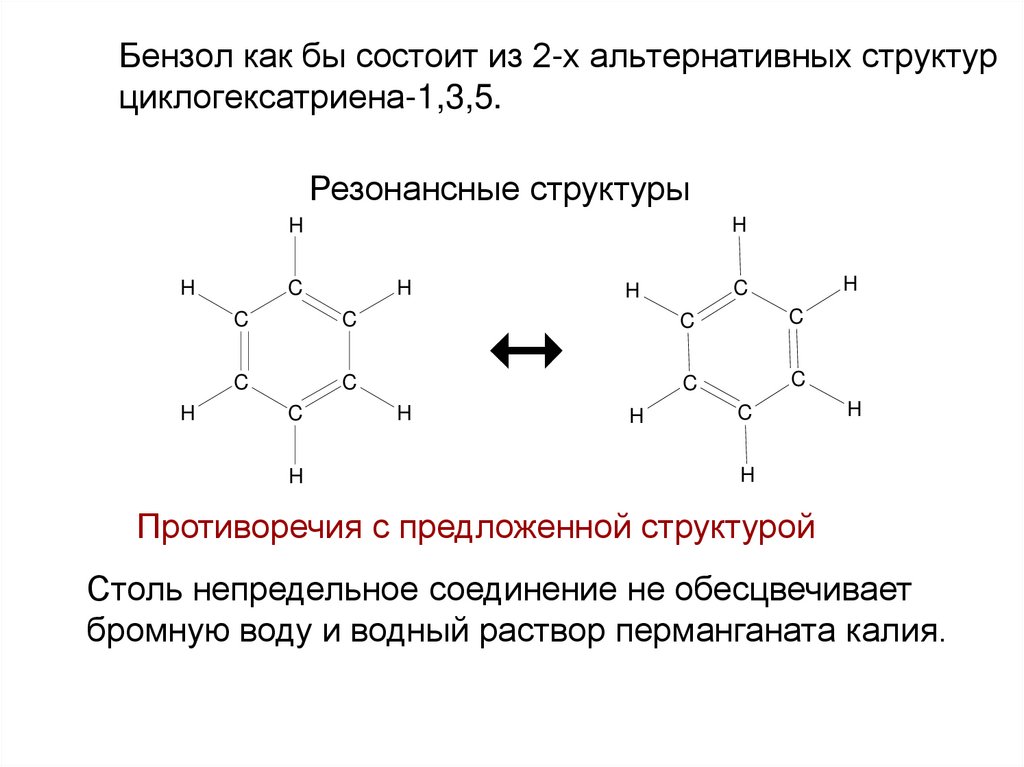
8. Бензол как бы состоит из 2-х альтернативных структур циклогексатриена-1,3,5.
Резонансные структурыH
H
H
H
H
C
C
C
C
C
C
H
H
H
H
C
H
C
C
C
C
C
H
H
Противоречия с предложенной структурой
Столь непредельное соединение не обесцвечивает
бромную воду и водный раствор перманганата калия.
9.
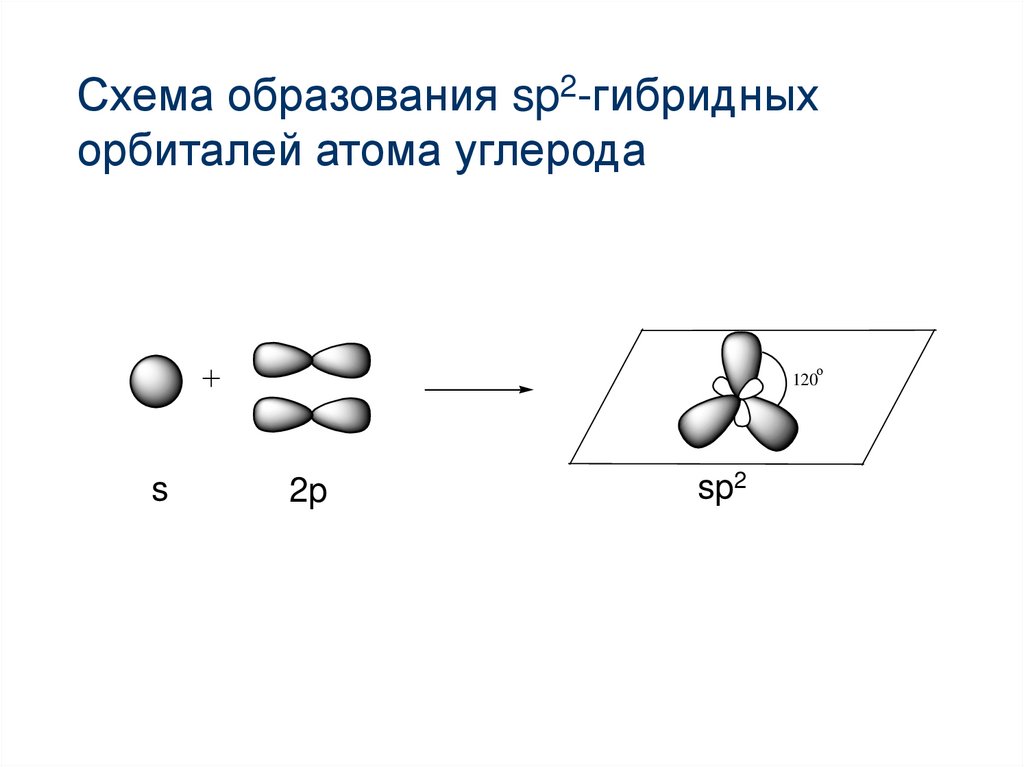
Схема образования sp2-гибридныхорбиталей атома углерода
о
120
s
2p
sp2
10.
Физическими методами установлено, что все атомыуглерода и водорода в молекуле бензола лежат в одной
плоскости
Все С-С связи бензольного кольца имеют одинаковую
длину 0,140 нм, т.е. как бы нет ни двойных (0,134) ни
одинарных (0,154) связей, а есть что-то среднее между
ними
по
нм
0
11.
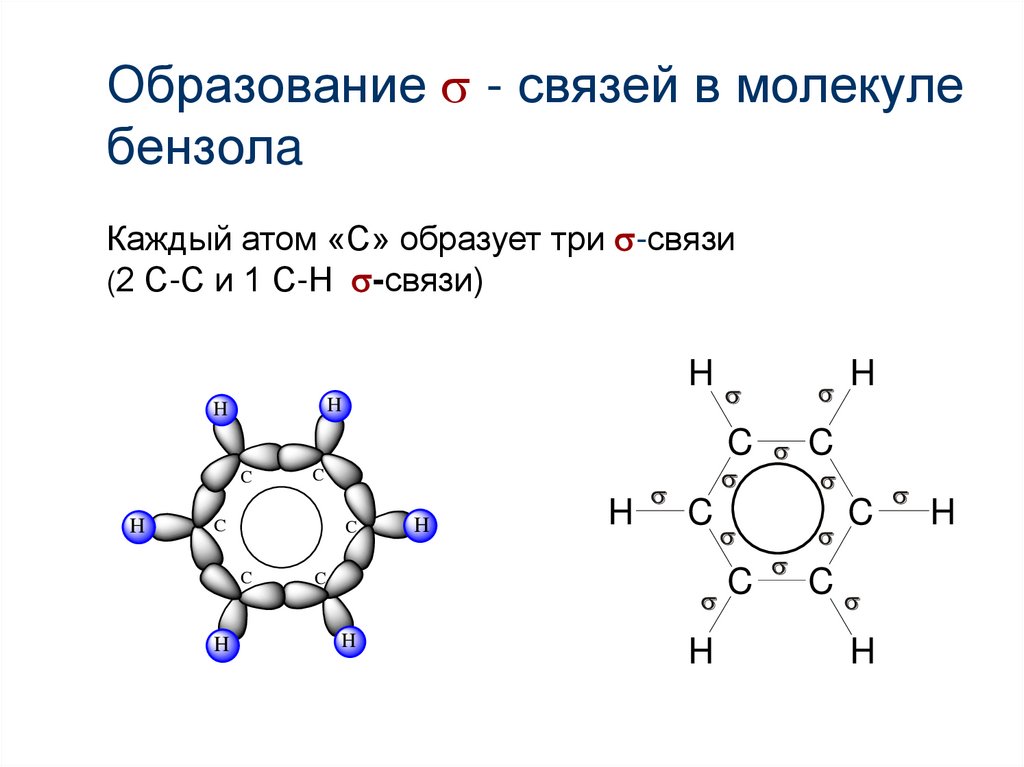
Образование - связей в молекулебензолa
Каждый атом «С» образует три -связи
(2 С-С и 1 С-Н -связи)
H
H
H
H
C
C
H
C
C
C
C
H
C
H
H
C
C
C
C
H
H
C
H
H
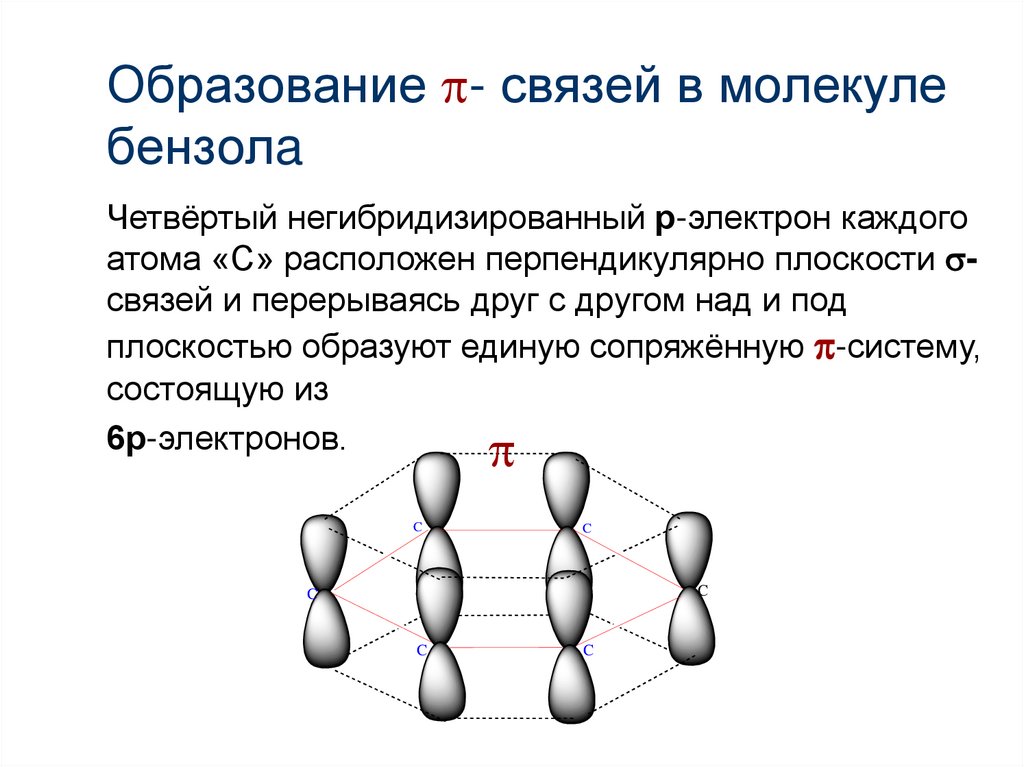
12. Образование - связей в молекуле бензолa
Образование - связей в молекулебензолa
Четвёртый негибридизированный р-электрон каждого
атома «С» расположен перпендикулярно плоскости связей и перерываясь друг с другом над и под
плоскостью образуют единую сопряжённую -систему,
состоящую из
6р-электронов.
C
C
C
C
C
C
13. Современные представления о строении бензола
Атомы углерода в бензоле находятся в sp2гибридизации;Угол расположения 3-х гибридных орбиталей
равен 120 и они располагаются в одной
плоскости.
14.
15.
16. «HIC TUTA PERENNAT» переводится с латинского языка, как «здесь в безопасности пребывает». Римская богиня мудрости Миневра
помещена на груди имперскогоорла, который символизирует покровительство. Как раз та
мудрость, чьим символом является богиня, и пребывает в
безопасности в стенах университета.
«также орел на латыни – женского пола, поэтому форма tuta (а не
tutus) верна и для такого прочтения: Россия пребывает в
безопасности благодаря науке».
https://spbdnevnik.ru/news/2018-07-19/v-spbgu-rasskazali-chtosimvoliziruet-neobychnyy-deviz-universiteta
17.
Ароматичность.Критерии ароматичности
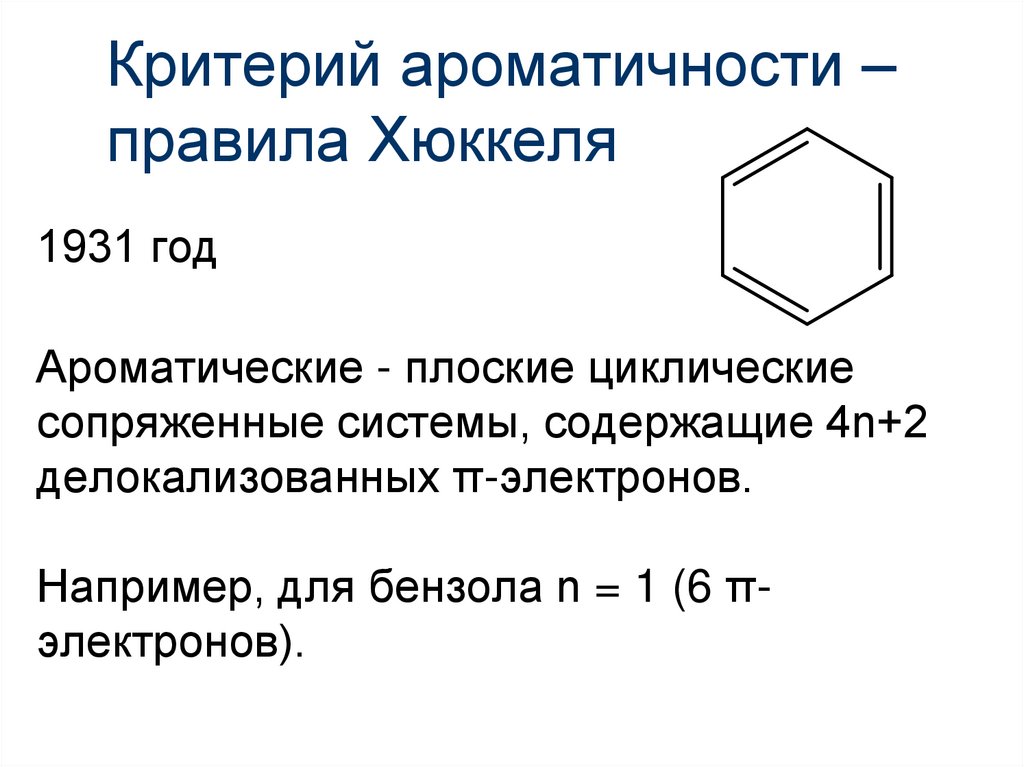
18. Критерий ароматичности – правила Хюккеля
1931 годАроматические - плоские циклические
сопряженные системы, содержащие 4n+2
делокализованных π-электронов.
Например, для бензола n = 1 (6 πэлектронов).
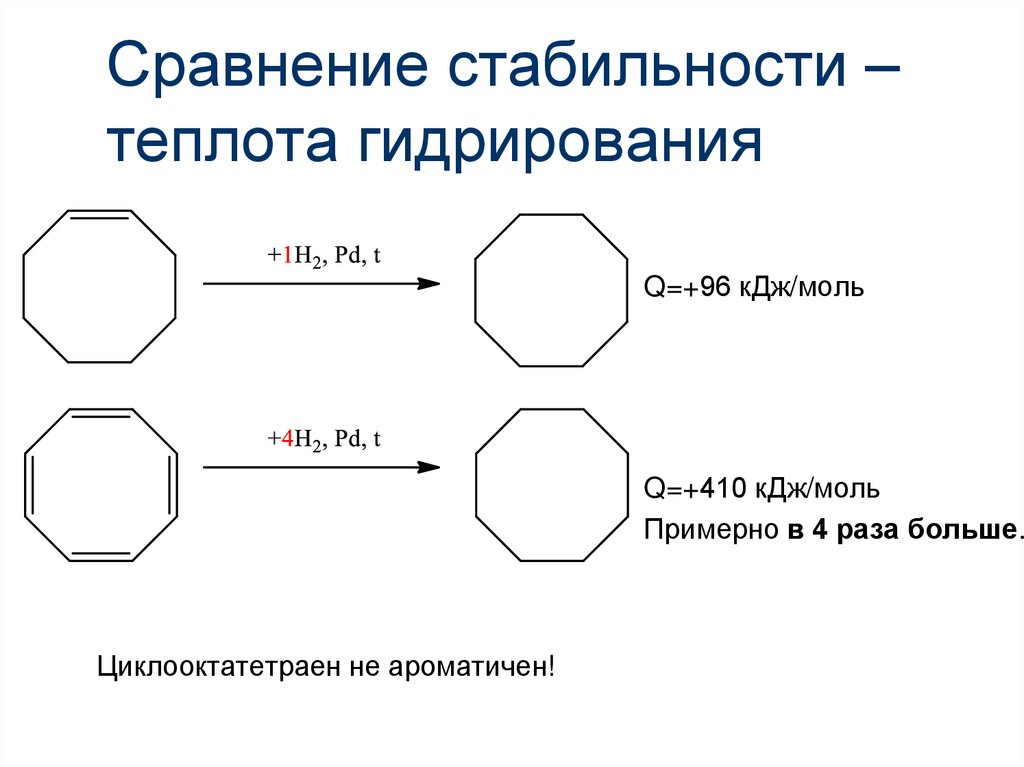
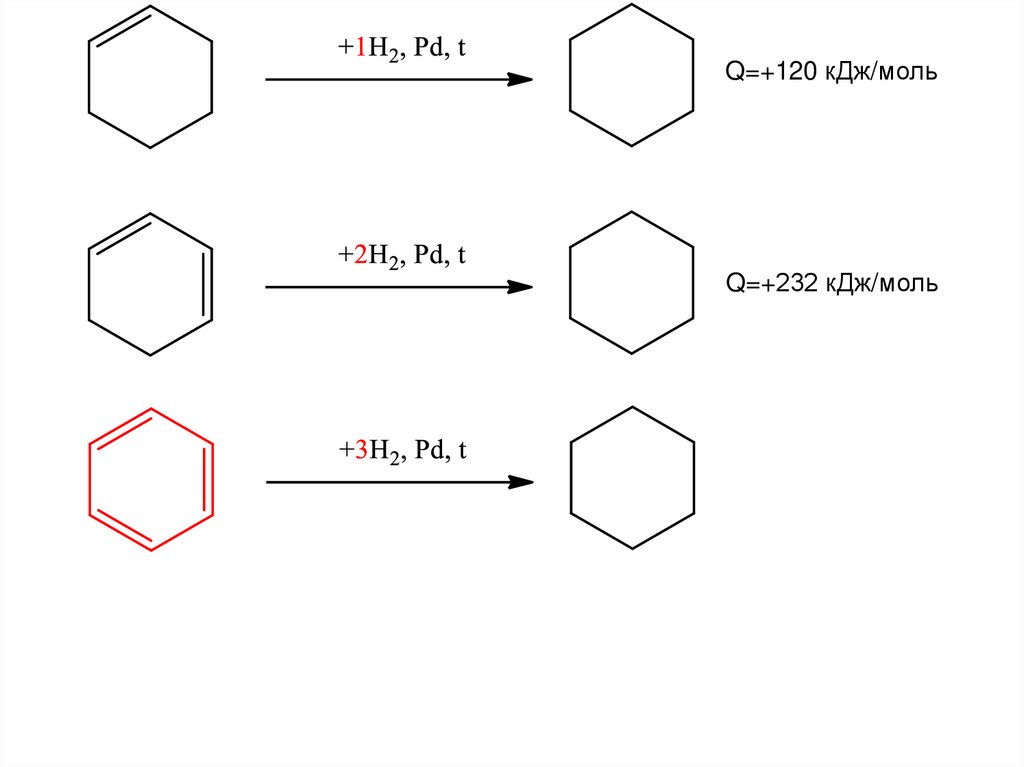
19. Сравнение стабильности – теплота гидрирования
20. Сравнение стабильности – теплота гидрирования
Циклооктатетраен не ароматичен!21. Сравнение стабильности – теплота гидрирования
Q=+96 кДж/мольЦиклооктатетраен не ароматичен!
22. Сравнение стабильности – теплота гидрирования
Q=+96 кДж/мольQ=+410 кДж/моль
Циклооктатетраен не ароматичен!
23. Сравнение стабильности – теплота гидрирования
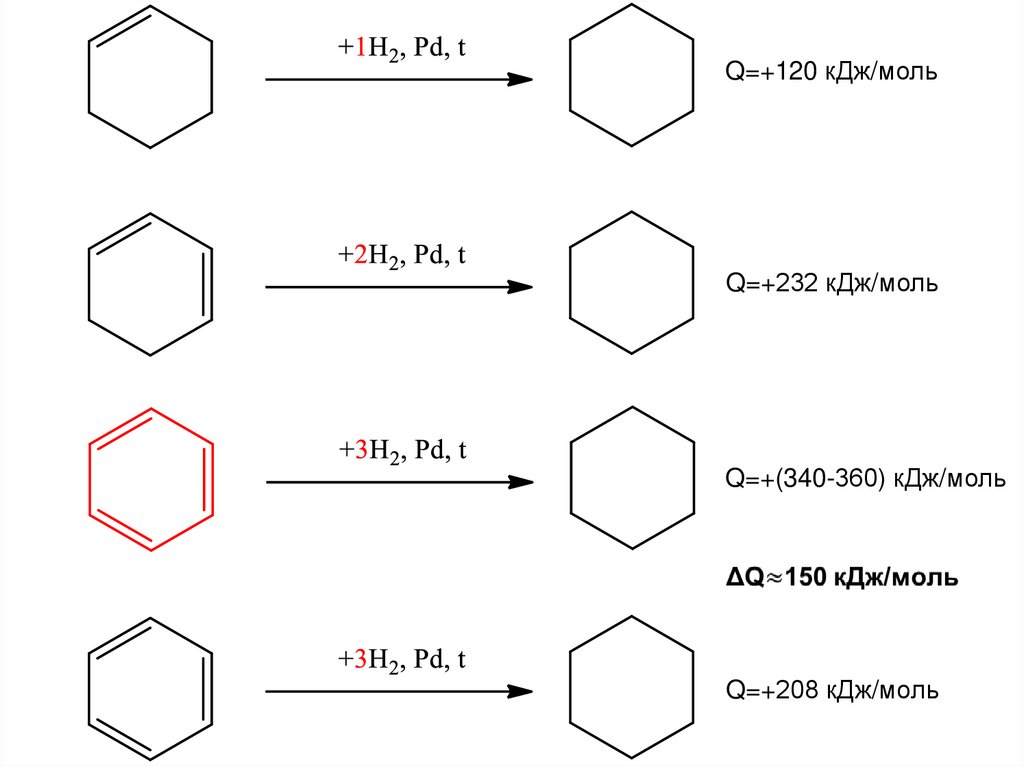
Q=+96 кДж/мольQ=+410 кДж/моль
Примерно в 4 раза больше.
Циклооктатетраен не ароматичен!
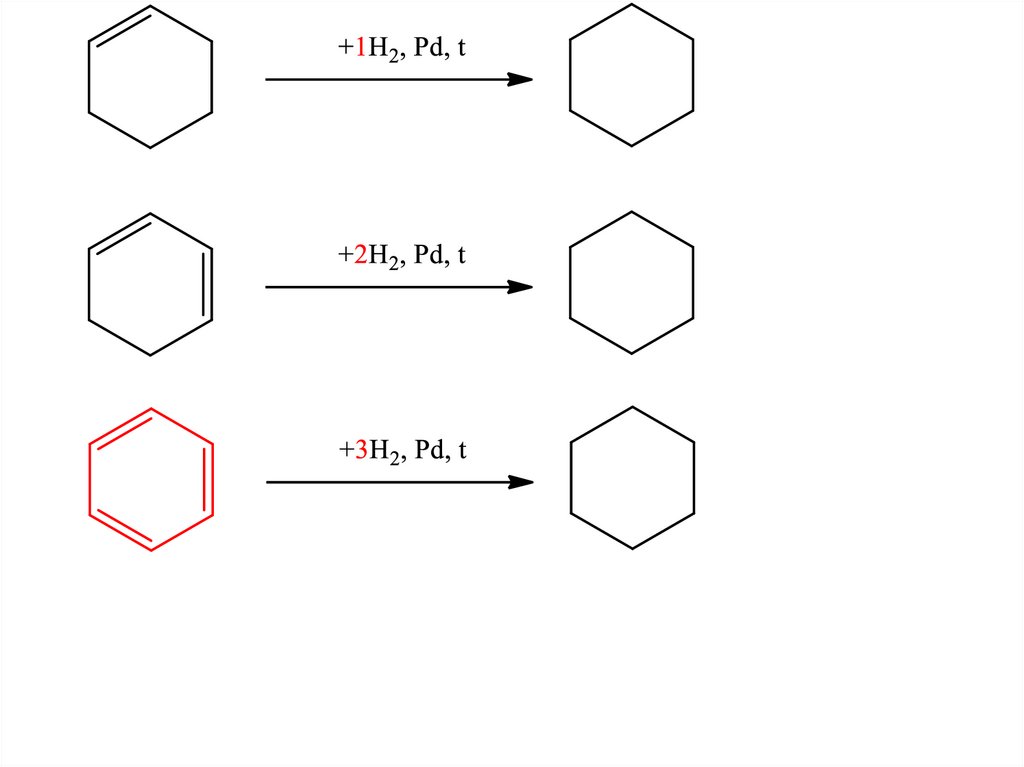
24. Сравнение стабильности – теплота гидрирования непредельных циклогексанов
25.
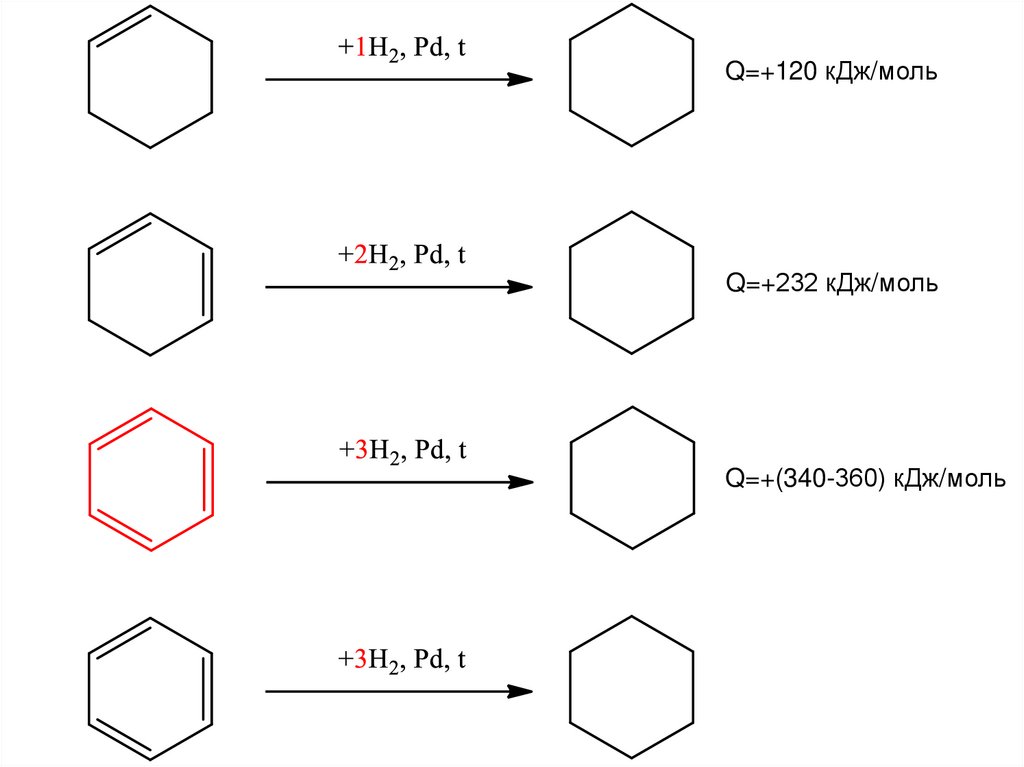
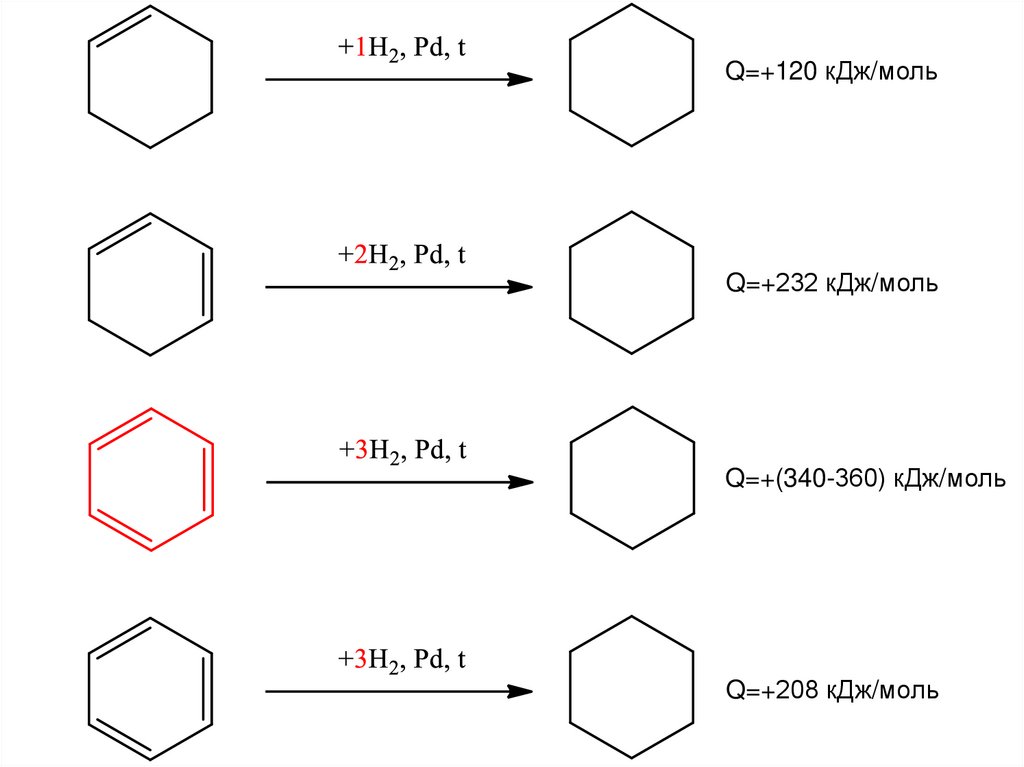
Q=+120 кДж/мольQ=+232 кДж/моль
Q=+(340-360) кДж/моль
Q=+208 кДж/моль
26.
Q=+120 кДж/мольQ=+232 кДж/моль
Q=+(340-360) кДж/моль
Q=+208 кДж/моль
27.
Q=+120 кДж/мольQ=+232 кДж/моль
Q=+(340-360) кДж/моль
Q=+208 кДж/моль
28.
Q=+120 кДж/мольQ=+232 кДж/моль
Q=+(340-360) кДж/моль
Q=+208 кДж/моль
29.
Q=+120 кДж/мольQ=+232 кДж/моль
Q=+(340-360) кДж/моль
Q=+208 кДж/моль
30.
Q=+120 кДж/мольQ=+232 кДж/моль
Q=+(340-360) кДж/моль
Q=+208 кДж/моль
31.
Q=+120 кДж/мольQ=+232 кДж/моль
Q=+(340-360) кДж/моль
Q=+208 кДж/моль
32.
Ароматичность – это совокупностьнескольких факторов:
1)Квантово-химический критерийподчинение правилу Хюккеля и высокая
энергия стабилизации
2) Геометрия молекулы: равенство длин всех
связей (0,14 нм) в бензоле и, как следствие,
идеальная симметрия распределения
электронной плотности.
3) Химический критерий – необычный
комплекс химических свойств
32
33.
Химические свойства бензола34. Химические свойства бензола
Ароматическая связь определяет свойствабензола
6 -электронная система является более
устойчивой, чем обычные -связи
Наиболее характерными реакциями для
ароматических углеводородов являются
реакции электрофильного замещения SE,
и гораздо реже – присоединения.
35.
I. Реакции присоединенияГидрирование
Cl
Хлорирование
3Cl 2
Cl
Cl
Cl
Cl
h
Cl
Сильный пищевой и дыхательный яд
(10-12 г – смертельная доза для мух).
Гексахлорциклогексан
(гексахлоран - инсектицид)
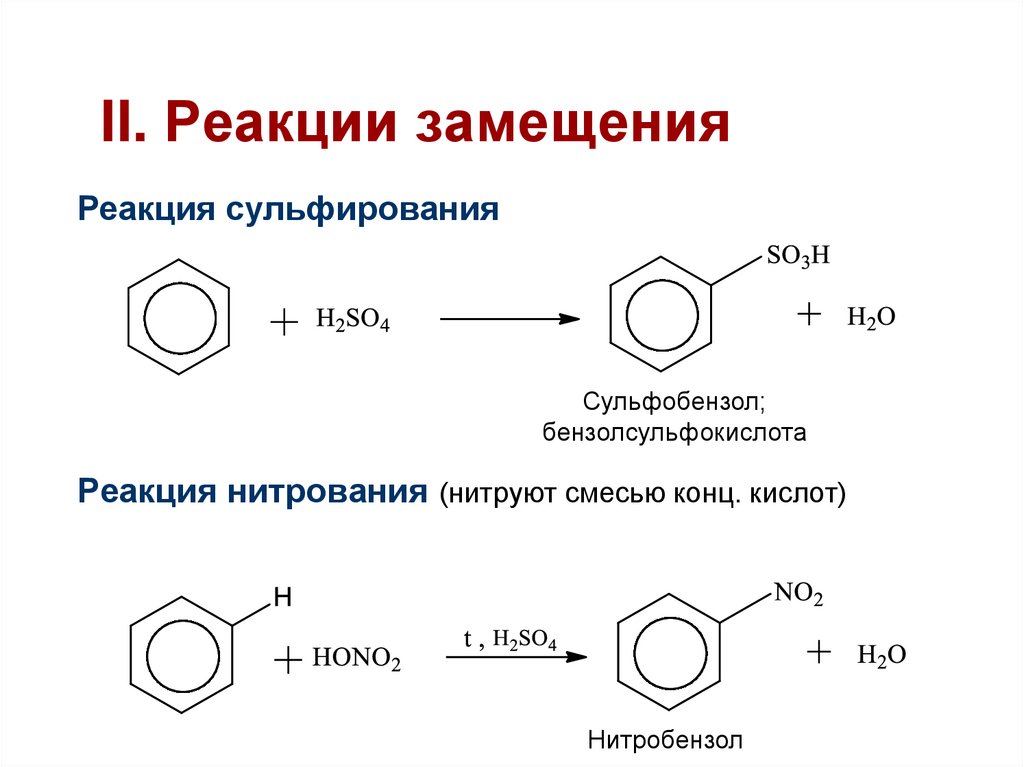
36. II. Реакции замещения
Реакция сульфированияСульфобензол;
бензолсульфокислота
Реакция нитрования (нитруют смесью конц. кислот)
Нитробензол
37.
Реакция ЗининаАнилин
Водород в момент выделения: [H], а не H2
Из анилина далее азокрасители
(рассмотрим позднее).
38.
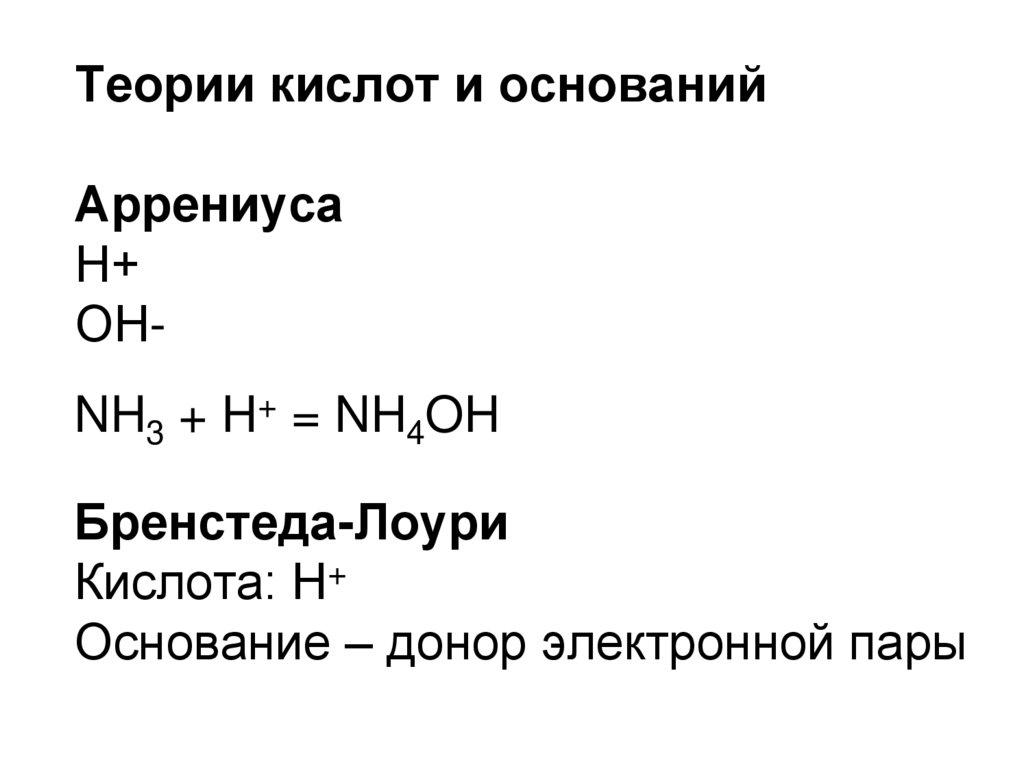
Теории кислот и основанийАррениуса
Н+
ОН-
39. NH3 + H+ = NH4OH
Теории кислот и основанийАррениуса
Н+
ОНNH3 + H+ = NH4OH
40. NH3 + H+ = NH4OH
Теории кислот и основанийАррениуса
Н+
ОНNH3 + H+ = NH4OH
Бренстеда-Лоури
Кислота: Н+
Основание – донор электронной пары
41.
Кислоты Льюиса-акцепторы пары электронов.
Для реакций SE в
ароматических соединениях
необходимы в качестве
катализатора. Чаще всего
AlHal3, FeHal3
*
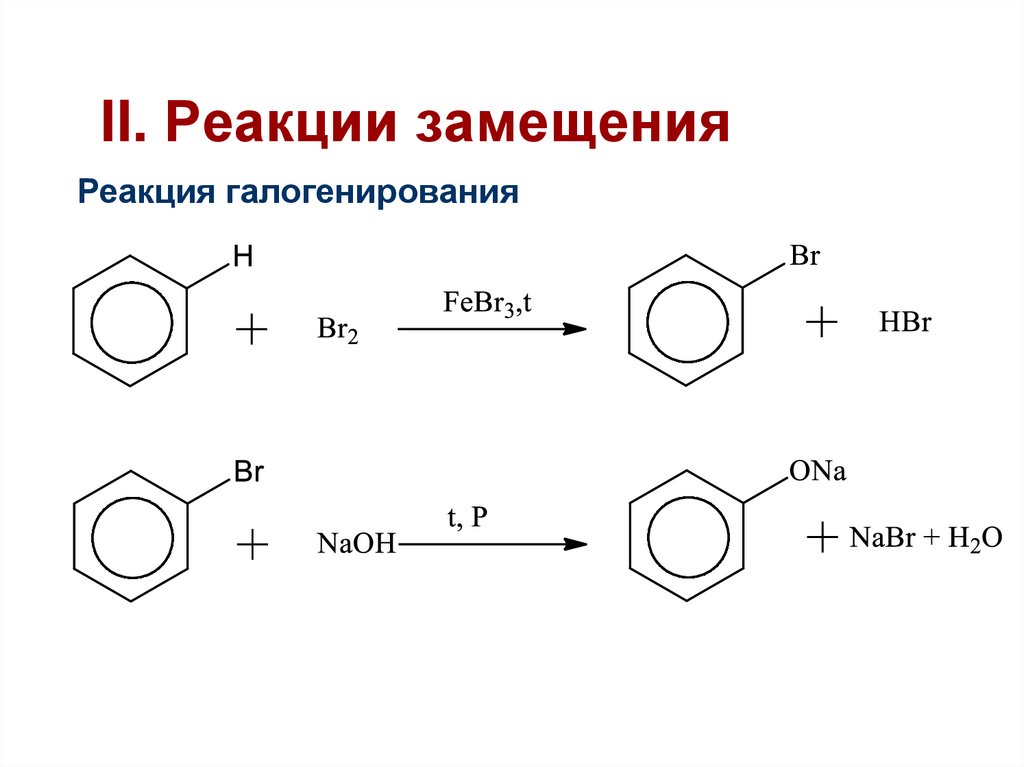
42. II. Реакции замещения
Реакция галогенирования43.
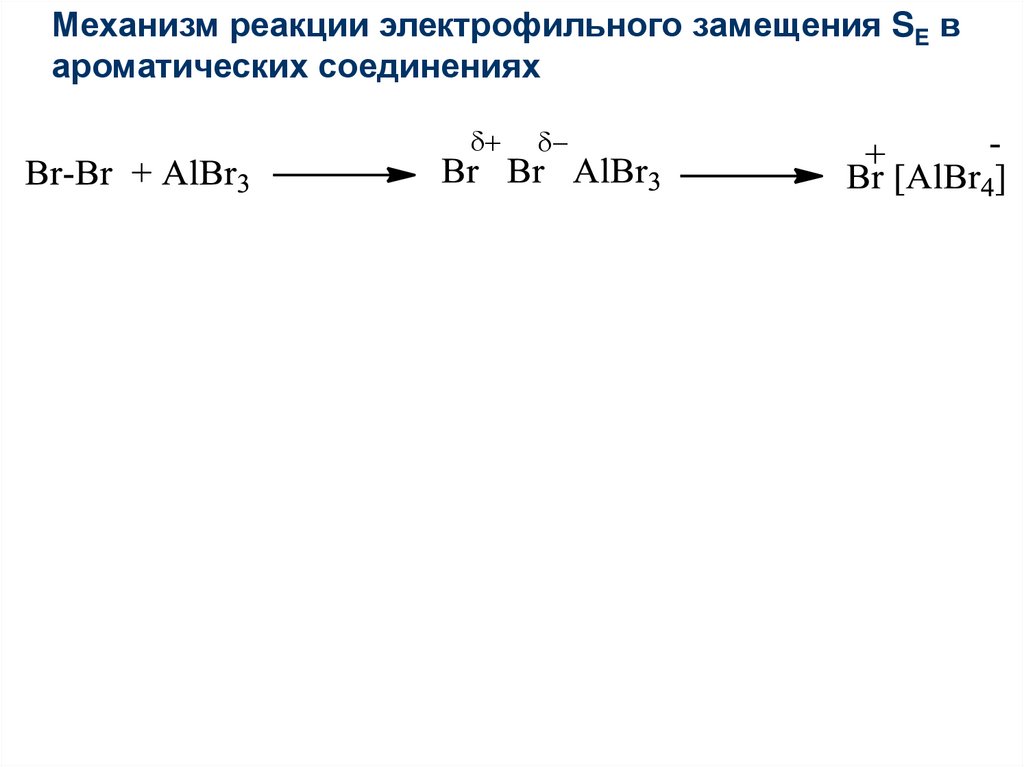
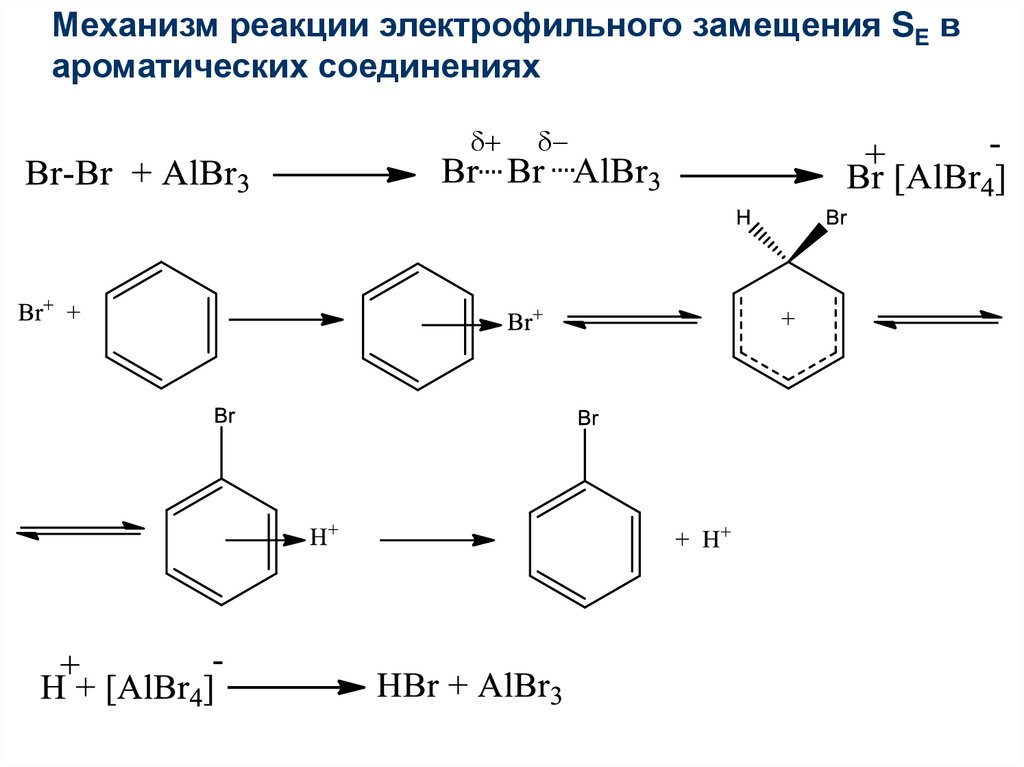
Механизм реакции электрофильного замещения SE вароматических соединениях
+
44.
Механизм реакции электрофильного замещения SE вароматических соединениях
+
45.
Механизм реакции электрофильного замещения SE вароматических соединениях
+
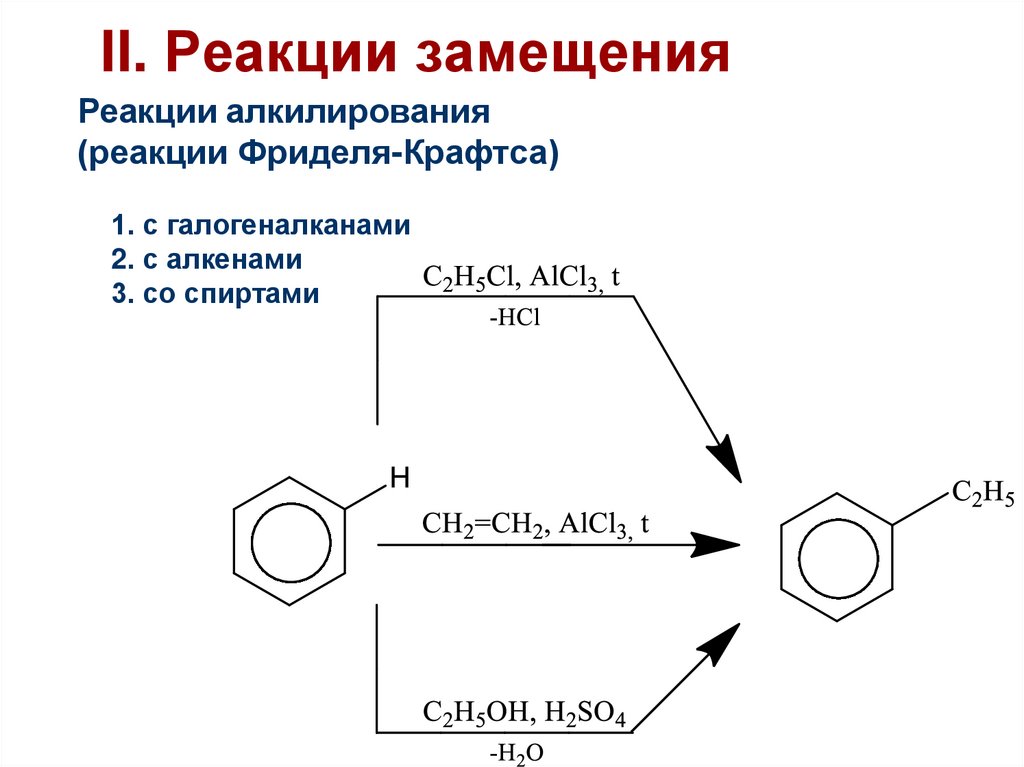
46. II. Реакции замещения
Реакции алкилирования(реакции Фриделя-Крафтса)
1. с галогеналканами
2. с алкенами
3. со спиртами
47. II. Реакции замещения
Реакции алкилирования(реакции Фриделя-Крафтса)
Но! Происходит изомеризация:
Изопропилбензол
(кумол)
48. II. Реакции замещения
Реакции алкилирования(реакции Фриделя-Крафтса)
Но! Происходит изомеризация:
Изопропилбензол
(кумол)
49.
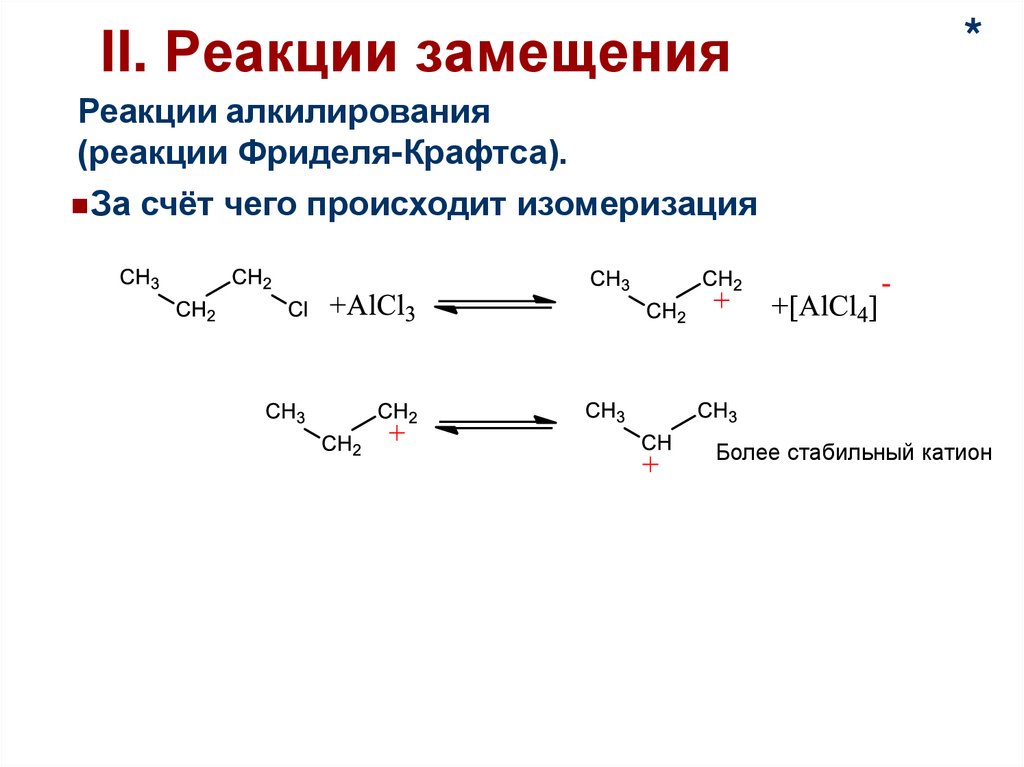
II. Реакции замещенияРеакции алкилирования
(реакции Фриделя-Крафтса).
За счёт чего происходит изомеризация
*
50.
II. Реакции замещенияРеакции алкилирования
(реакции Фриделя-Крафтса).
За счёт чего происходит изомеризация
*
51.
II. Реакции замещения*
Реакции алкилирования
(реакции Фриделя-Крафтса).
За счёт чего происходит изомеризация
Более стабильный катион
52.
II. Реакции замещенияРеакции алкилирования
(реакции Фриделя-Крафтса).
За счёт чего происходит изомеризация
*
53.
Зачем нужен кумол*
54.
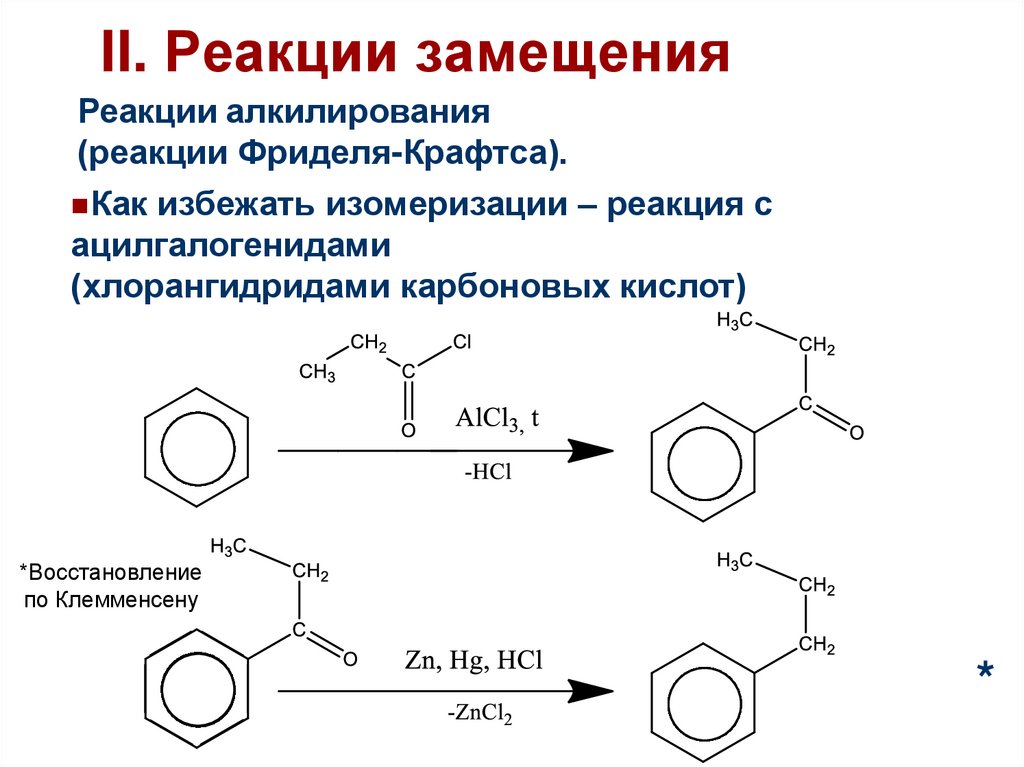
II. Реакции замещенияРеакции алкилирования
(реакции Фриделя-Крафтса).
Как избежать изомеризации – реакция с
ацилгалогенидами
(хлорангидридами карбоновых кислот)
55.
II. Реакции замещенияРеакции алкилирования
(реакции Фриделя-Крафтса).
Как избежать изомеризации – реакция с
ацилгалогенидами
(хлорангидридами карбоновых кислот)
*Восстановление
по Клемменсену
*
56.
II. Реакция радикальногозамещения (α-галогенирование - реакция Львова)
57.
II. Реакция радикальногозамещения (α-галогенирование - реакция Львова)
58.
Реакции электрофильногозамещения с производными бензола
Ориентационные эффекты
заместителей
59.
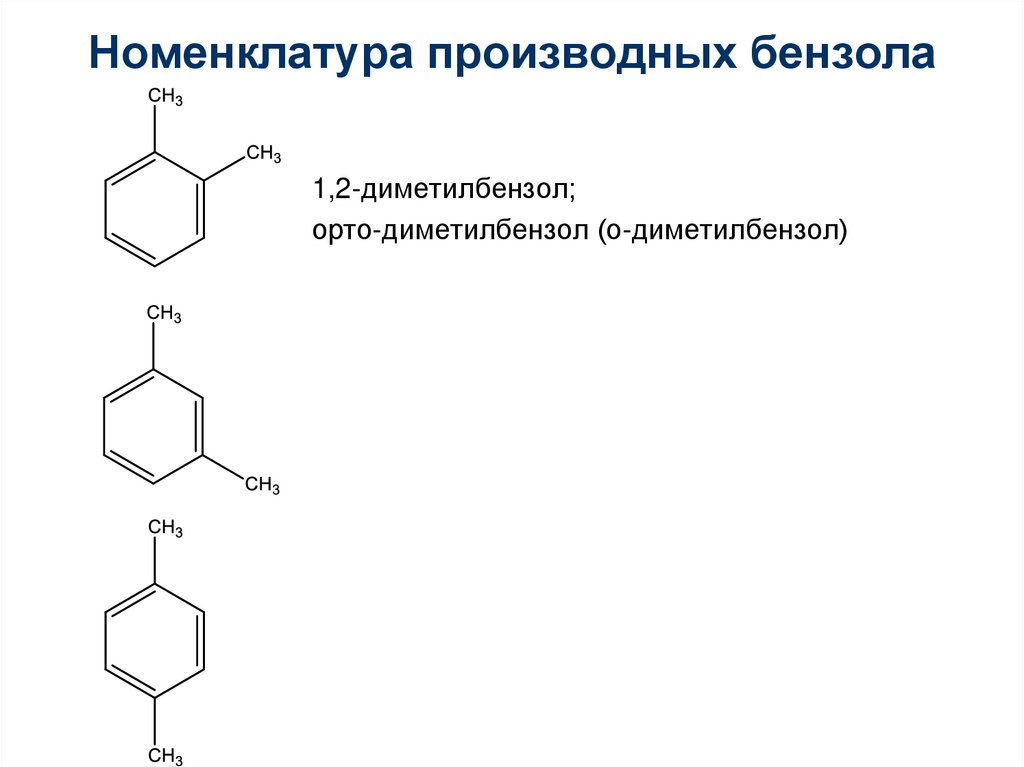
Номенклатура производных бензола1,2-диметилбензол;
орто-диметилбензол (о-диметилбензол)
60.
Номенклатура производных бензола1,2-диметилбензол;
орто-диметилбензол (о-диметилбензол)
1,3-диметилбензол;
мета-диметилбензол (м-диметилбензол)
61.
Номенклатура производных бензола1,2-диметилбензол;
орто-диметилбензол (о-диметилбензол)
1,3-диметилбензол;
мета-диметилбензол (м-диметилбензол)
1,4-диметилбензол;
пара-диметилбензол (п-диметилбензол)
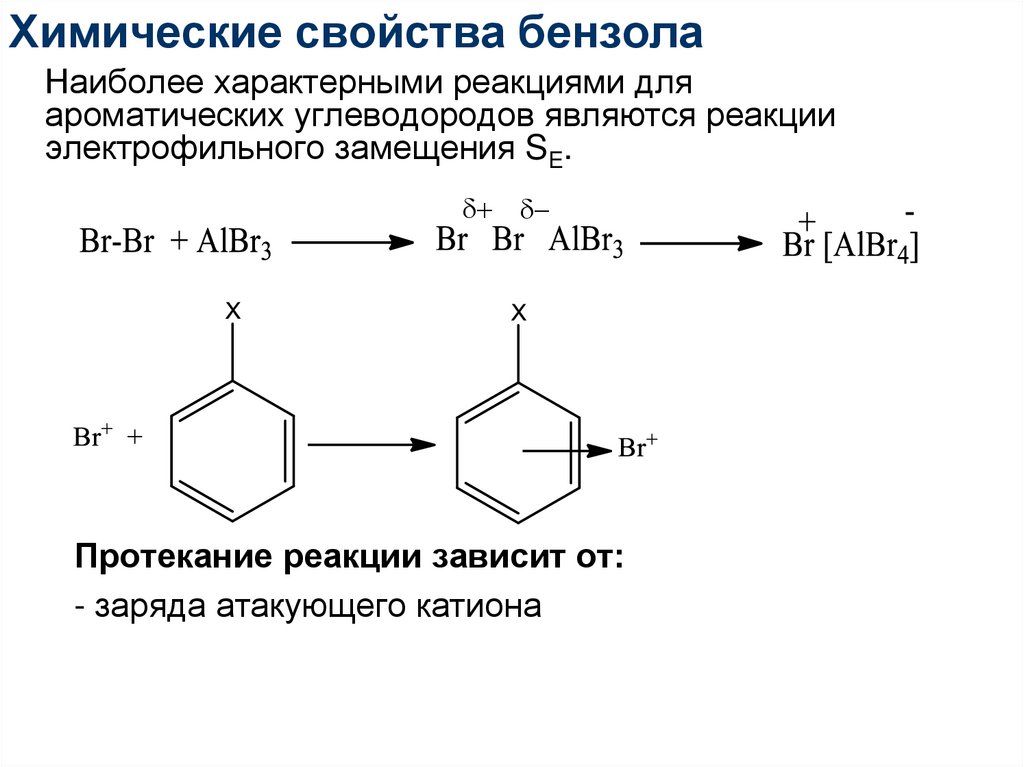
62. Химические свойства бензола
Наиболее характерными реакциями дляароматических углеводородов являются реакции
электрофильного замещения SE.
+
63. Химические свойства бензола
Наиболее характерными реакциями дляароматических углеводородов являются реакции
электрофильного замещения SE.
+
Протекание реакции зависит от:
- заряда атакующего катиона
64. Химические свойства бензола
Наиболее характерными реакциями дляароматических углеводородов являются реакции
электрофильного замещения SE.
+
Протекание реакции зависит от:
- заряда атакующего катиона
- плотности электронного облака ароматического
кольца – чем больше электронов, тем легче реакция
65.
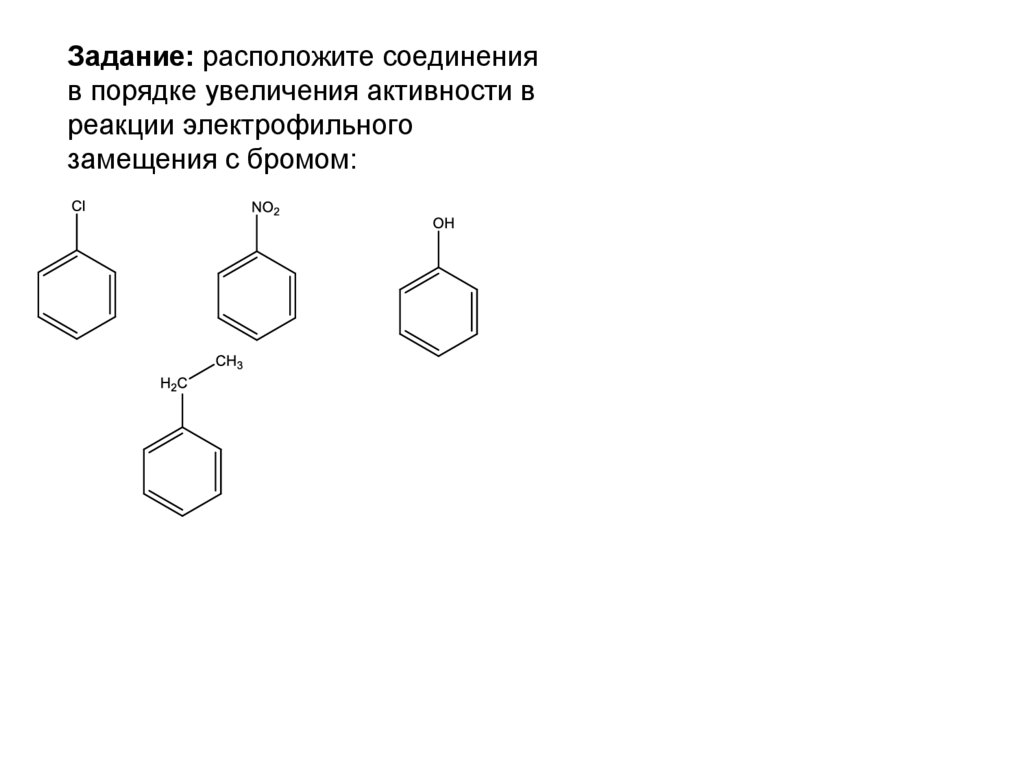
Ориентанты I родаДонорные
орто-, пара-ориентанты
X:
а) Alk-, -OH, -OR, NH2, -NHR, - NR2
активируют – ускоряют реакцию
б) F-, Cl-, Br-, IДезактивируют – замедляют реакцию
Ориентанты II рода
Акцепторные
мета-ориентанты
Y:
-NO2, -COOH, -C(O)H, -SO3H
сильно дезактивируют замедляют реакцию
66. Задание: расположите соединения в порядке увеличения активности в реакции электрофильного замещения с бромом:
67. Задание: расположите соединения в порядке увеличения активности в реакции электрофильного замещения с бромом:
68. Задание: расположите соединения в порядке увеличения активности в реакции электрофильного замещения с бромом:
Нитробензол—хлорбензол—этилбензол—фенол
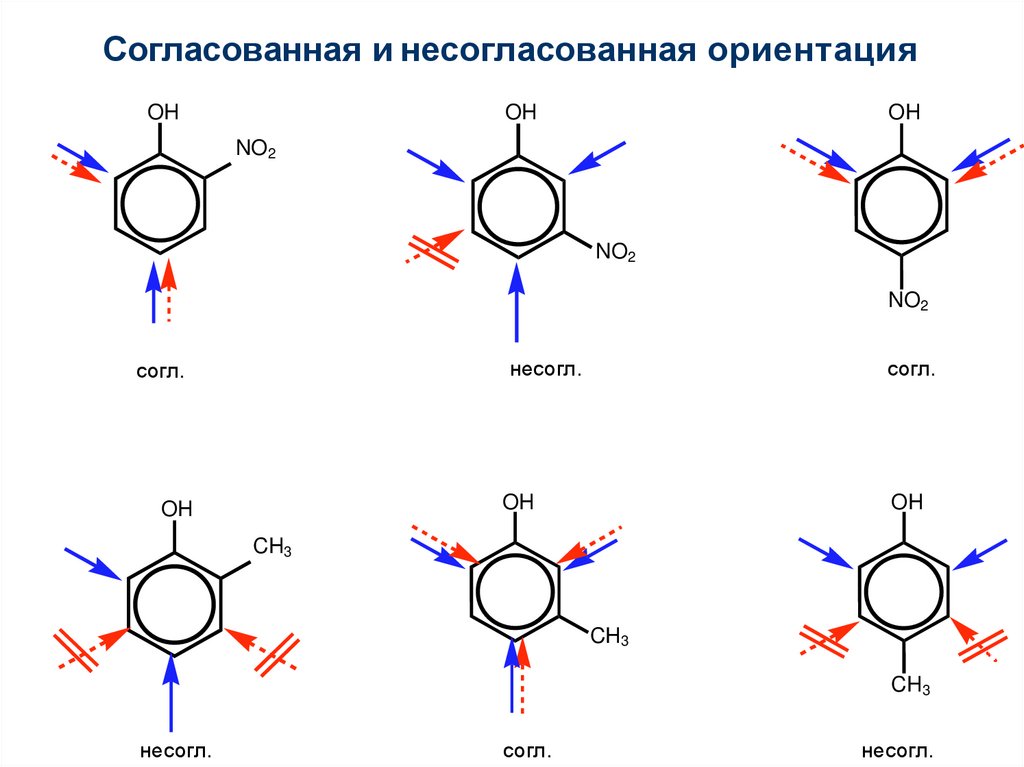
69. Согласованная и несогласованная ориентация
1OH
OH
OH
NO2
NO2
NO2
несогл.
согл.
согл.
OH
OH
OH
CH3
CH3
CH3
несогл.
согл.
несогл.
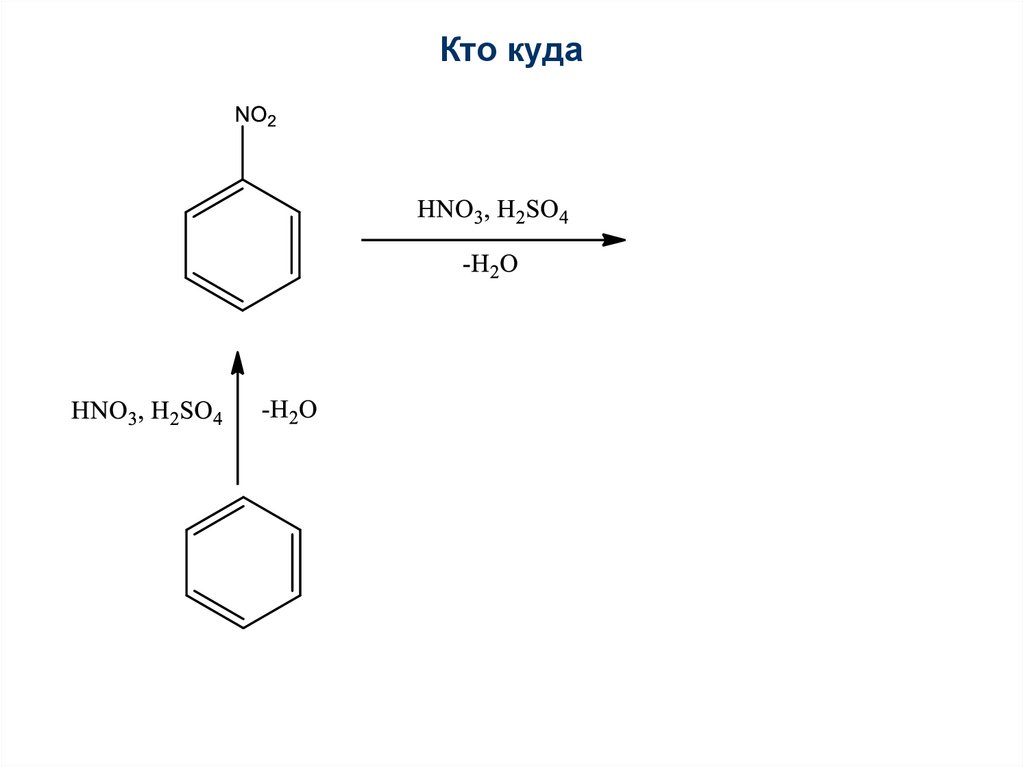
70. Кто куда
71. Кто куда
72. Кто куда
73. Кто куда
74.
*Реакции замещения с производными
бензола
Теория цветности, получение
азокрасителей
75.
*α-каротин
(франц. сarrot – морковь)
бесцветный
бесцветный
желто-зеленый
желтый
оранжевый
красно-оранжевый
76.
*беcцветный
жёлтый
77. Хромофоры (греч. хромо – цвет, феро – несу)
Хромофоры*
(греч. хромо – цвет, феро – несу)
сильные
слабые
Ауксохромы
(греч. ауксо – увеличивать) -OH, -NR2
ауксохром
хромофор
78.
Реакция азосочетания*
Диазокомпонент
Азокомпонент
Метиловый оранжевый
79.
Реакции алкилирования (реакции Фриделя-Крафтса) спроизводными бензола. Азосочетание - азокрасители
Метилоранж,
Basic Red 76
Direct Brown
Direct Blue Dyes
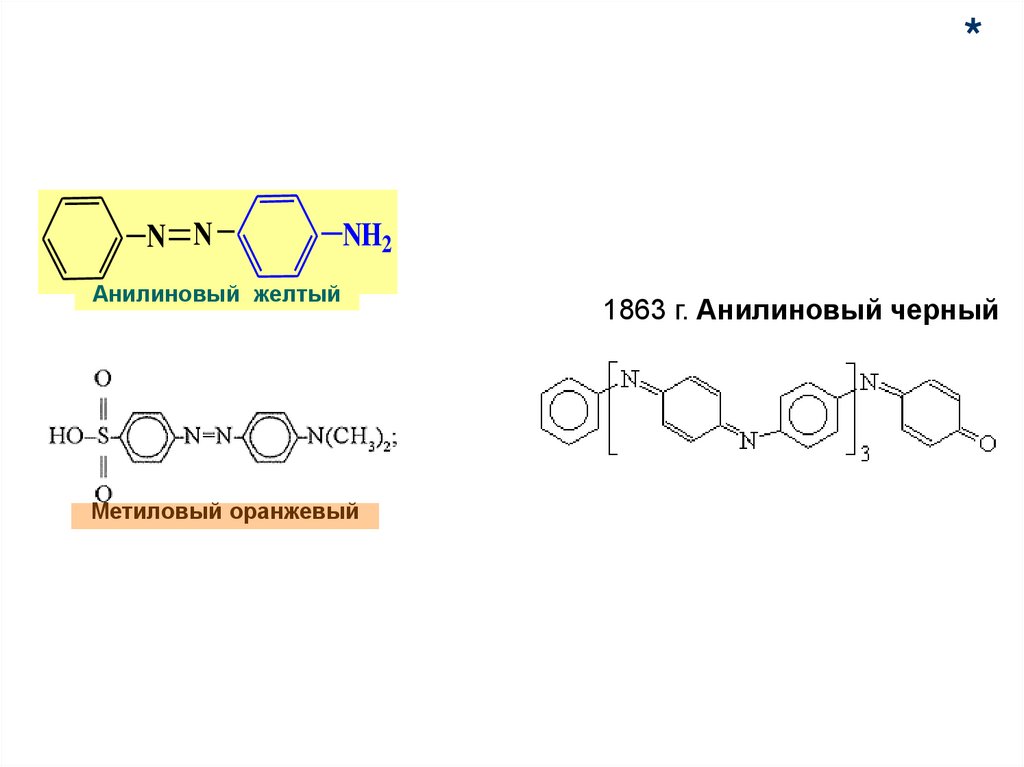
80.
*N N
NH2
Анилиновый желтый
Метиловый оранжевый
1863 г. Анилиновый черный
81.
Реакции окисления бензола иалкилбензолов
82. III. Реакции окисления
Горение (бензол горит коптящим пламенем)2С6Н6 + 15О2 12СО2 + 6Н2О
Неполное окисление (с КMnO4 или К2Сr2O7 в кислой среде)
Реакция не идёт. Бензол устойчив к действию окислителей
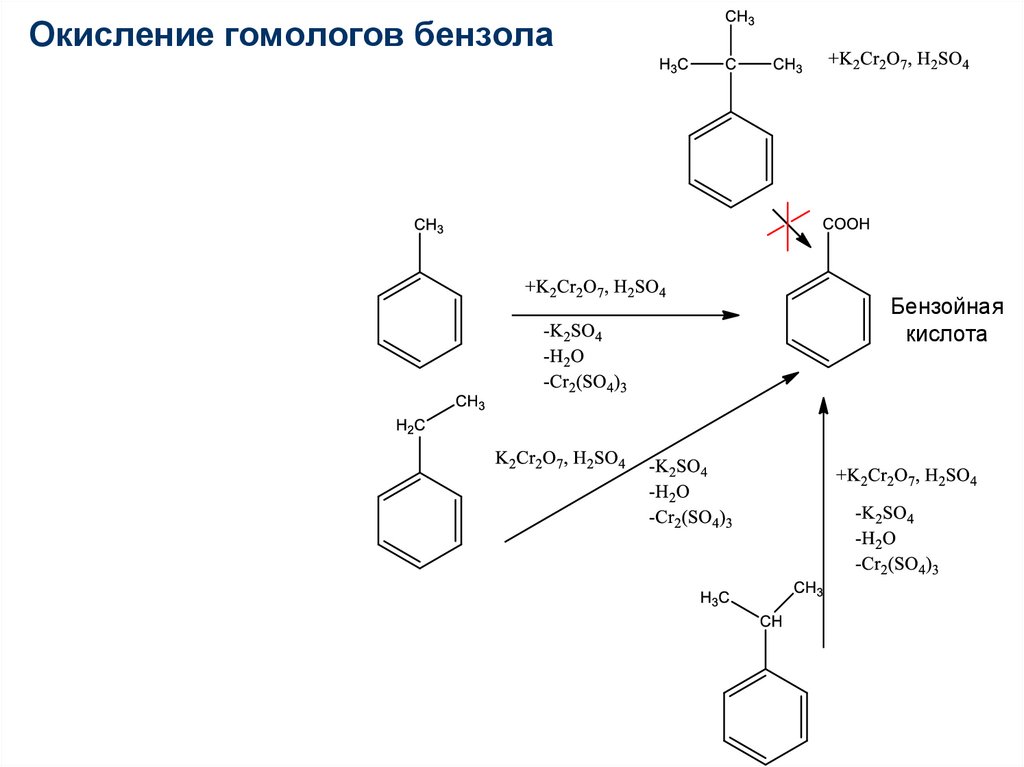
83.
Окисление гомологов бензолаБензойная
кислота
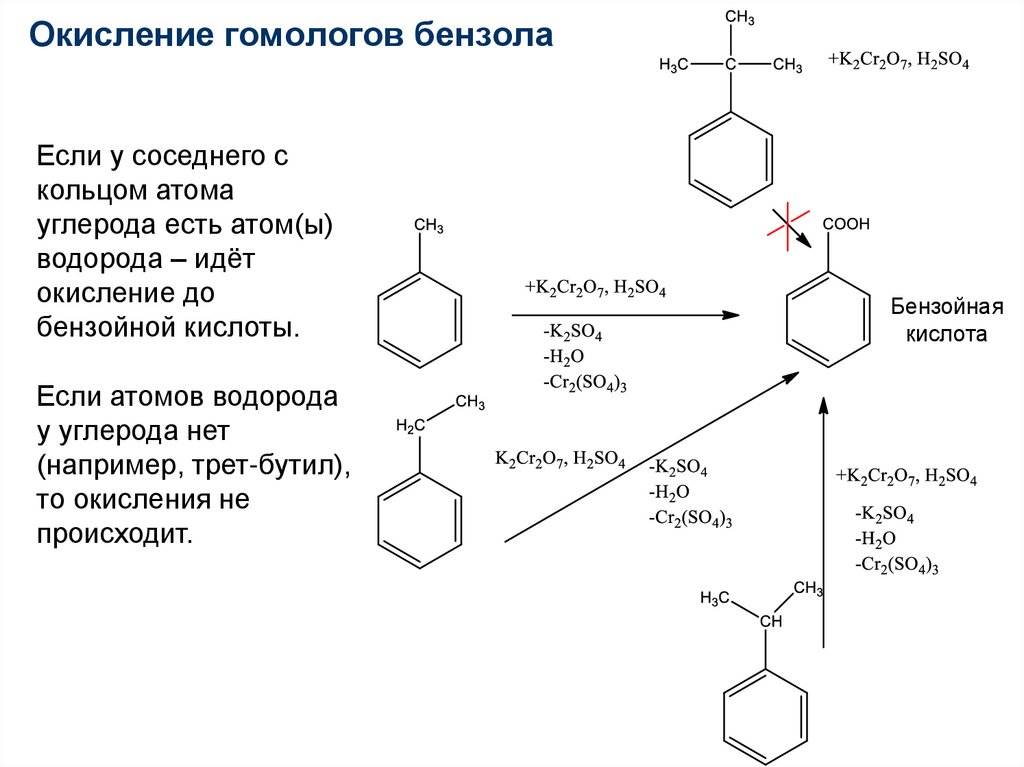
84.
Окисление гомологов бензолаЕсли у соседнего с
кольцом атома
углерода есть атом(ы)
водорода – идёт
окисление до
бензойной кислоты.
Если атомов водорода
у углерода нет
(например, трет-бутил),
то окисления не
происходит.
Бензойная
кислота
85.
*Окисление бензола
O2 , V2O5, 450 C
C O
OH + HOOC COOH
C OH щавелевая кислота
O
малеиновая кислота
to -H2O
O
O
малеиновый
ангидрид
O
85
86.
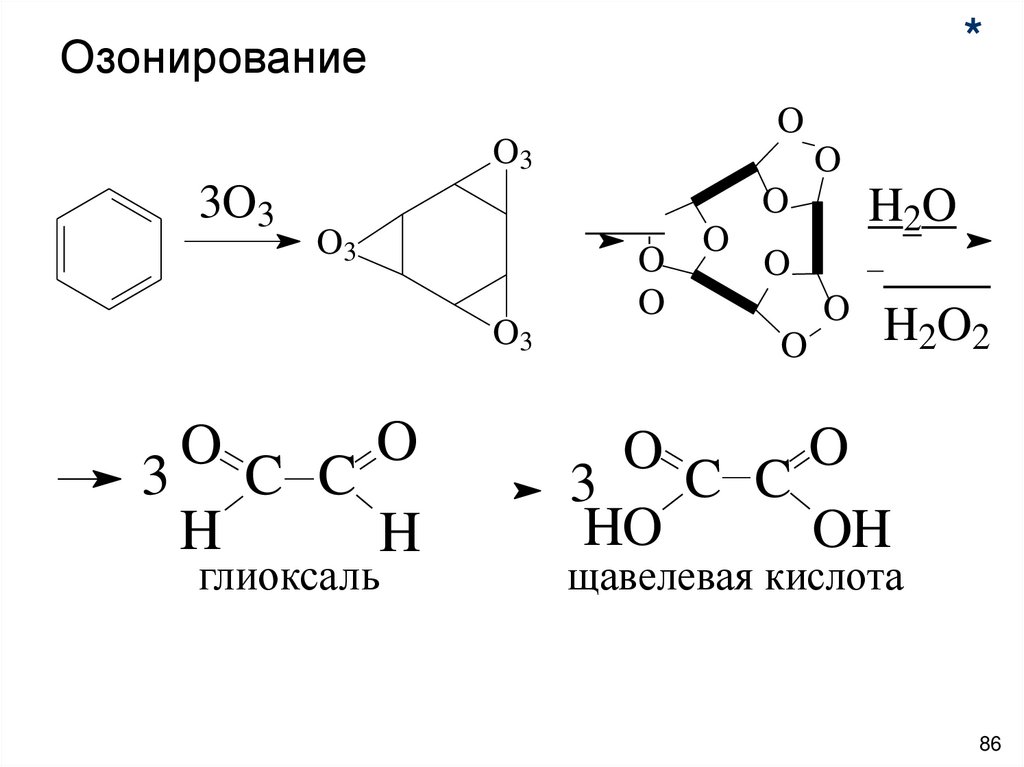
*Озонирование
O
O3
3O3
O
O
O3
O3
O
O
3 C C
H
H
глиоксаль
O
O
O
H2O
O
O
O
H2O2
O
O
C C
3
HO
OH
щавелевая кислота
86
87.
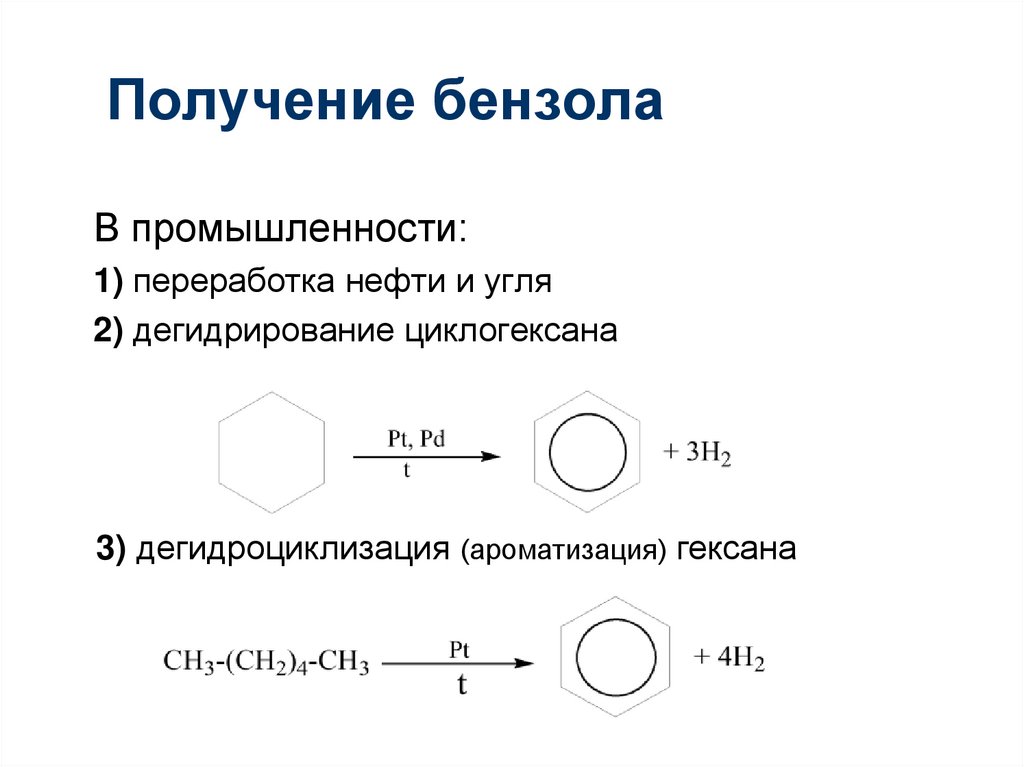
Получение бензола88. Получение бензола
В промышленности:1) переработка нефти и угля
2) дегидрирование циклогексана
3) дегидроциклизация (ароматизация) гексана
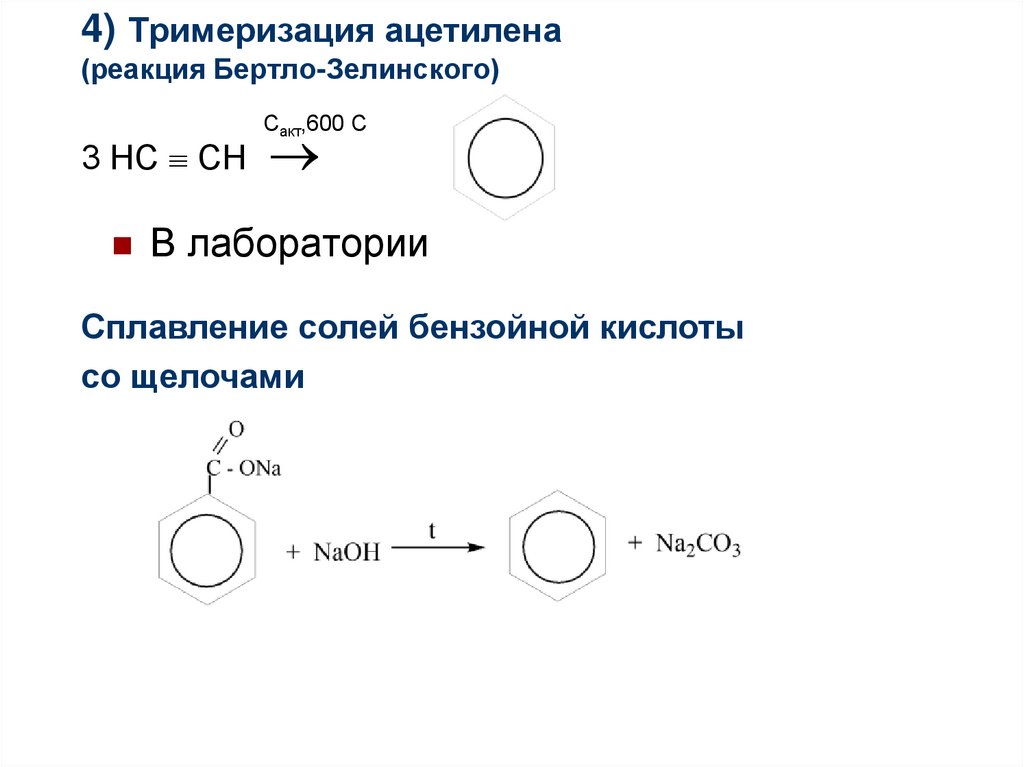
89. 4) Тримеризация ацетилена (реакция Бертло-Зелинского)
3 НС СНСакт,600 С
В лаборатории
Сплавление солей бензойной кислоты
со щелочами
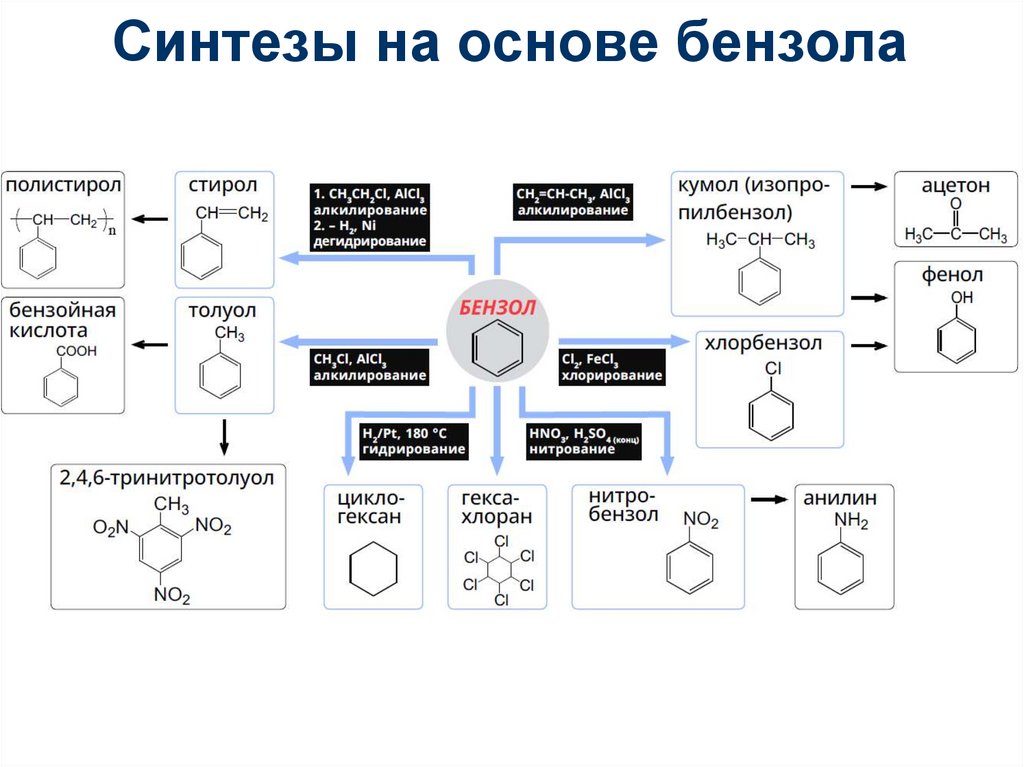
90. Синтезы на основе бензола
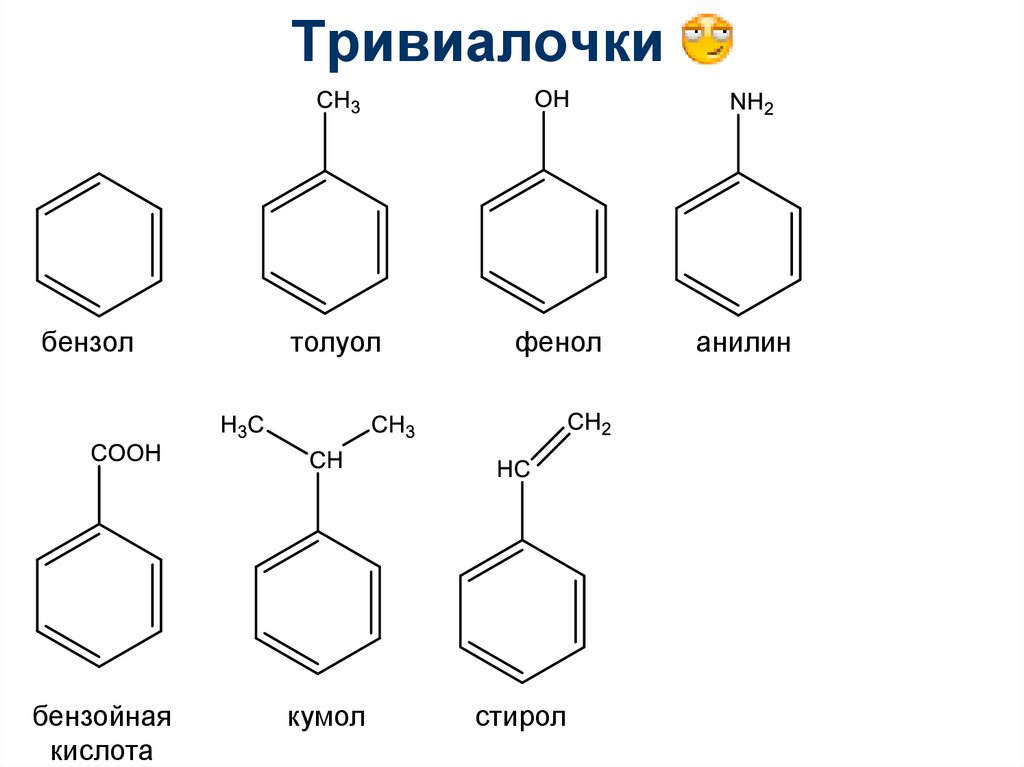
91. Тривиалочки
Тривиалочкибензол
бензойная
кислота
толуол
кумол
фенол
стирол
анилин
92.
93.
ЗадачиКакой объём бензола ( =0,9 г/мл) потребуется для
получения 30,75 г нитробензола, если массовая доля
выхода продукта составляет 90%.
При сжигании гомолога бензола массой 0,92 г в
кислороде получили оксид углерода (IV), который
пропустили через избыток раствора гидроксида
кальция. При этом образовался осадок массой 7 г.
Определите формулу углеводорода и назовите его.
94.
Сколько перманганата калия потребуется дляполучения газа, необходимого для превращения
39 г бензола в гексахлоран? Составьте уравнения
протекающих реакций.





























































 chemistry
chemistry








