Similar presentations:
Термохимия. Физическая химия: практическое применение
1. Физическая химия: практическое применение Тема 2: Термохимия
КАФЕДРА Химии и экотоксикологииФизическая химия:
практическое применение
Тема 2: Термохимия
Корнилов Кирилл Николаевич
Доцент,
Кандидат химических наук,
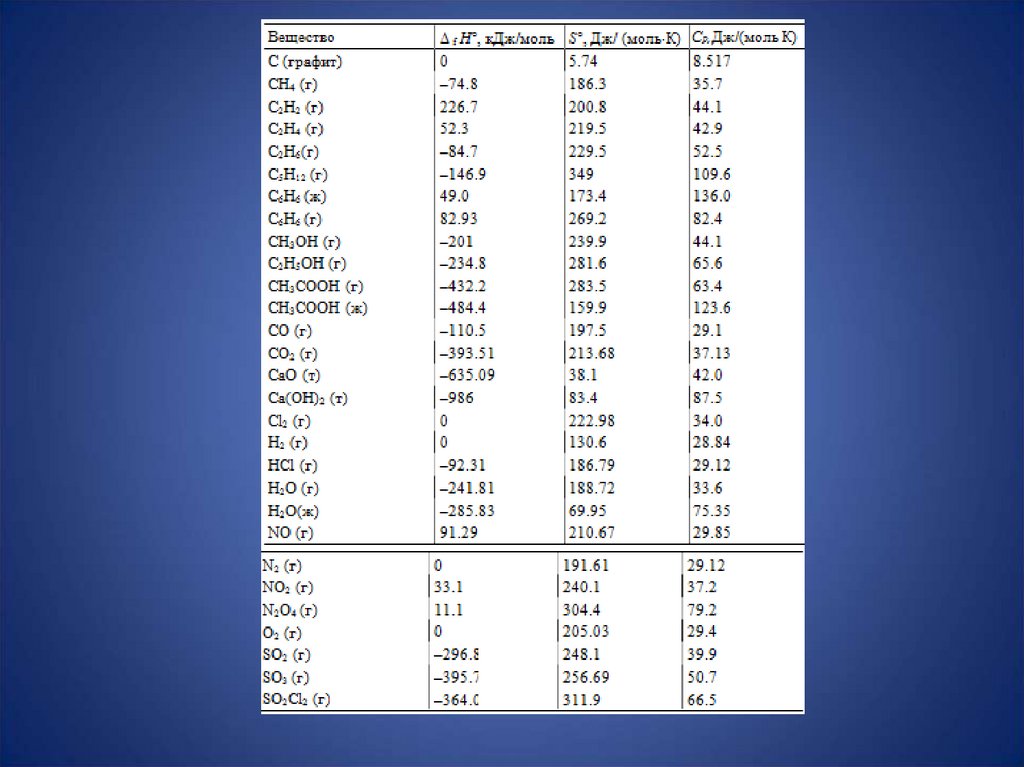
2. Термодинамика – наука о движении тепла. Джоуль. Дж = н*м. 4,19 Дж = 1 калория. Позволяет нагреть 1 г воды на 1 градус.
3. У каждого объекта есть полная внутренняя энергия U. Определить её невозможно. Но ΔU – изменение энергии – запросто.
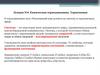
4. U и Н
UиН5. 1 закон термодинамики: если тело получает энергию, то эта энергия в никуда не пропадает. Она превращается или во внутреннюю
энергию, или в работу, совершаемуютелом:
Q = ΔН = ΔU + W
Если работа не может совершаться (поршень не
подвижен): Q = ΔU
Если работа совершается, то
Q = ΔН = ΔU + ΔV*P (м3 * Па = Дж)
PV = nRT
ΔV*P = ΔnRT – если изменение объема
происходит из-за химической реакции в газах
ΔН = ΔU + ΔnRT
6. Теплоёмкость С – это количество тепла, которое нужно сообщить телу, чтобы повысить его температуру на 1 градус. То есть С =
Q/ΔT [Дж/K]Но если мы возьмём не весь объект
целиком, а только 1 кг его массы и
определим для разных веществ, сколько
нужно тепла, чтобы нагреть 1 кг на 1 градус,
то мы получим удельную теплоёмкость. С
удельная измеряется в [Дж/K*кг].
Благодаря этой величине можно сравнивать
вещества между собой по способности
нагреваться, т.е. получать тепло.
7. С удельная (воды) = 4190 Дж/K*кг, С удельная (сахара) = 1040-1070 Дж/K*кг (в 4 раза меньше), С удельная (соли) = 840 Дж/K*кг.
С удельная (воды) = 4190Дж/K*кг,
С удельная (сахара) = 10401070 Дж/K*кг (в 4 раза
меньше),
С удельная (соли) = 840
Дж/K*кг.
8. Существует также молярная теплоёмкость Ср. Знак р возле С значит – теплоёмкость при постоянном давлении. Для газов теплоёмкость
при постоянномдавлении и при постоянном объеме Сv (когда
давление при нагревании растёт) различаются. А
для твёрдых веществ и жидкостей они одинаковы.
Рассчитаем Ср воды. С удельная (воды) = 4190
Дж/K*кг = 4,19 Дж/K*г = 1 калория. Молярная масса
воды = 18 г/моль. Чтобы нагреть 18 г воды на 1
градус, нужно 18*4,19 = 75,42 Дж тепла. То есть Ср
(воды) = 75,42 Дж/моль*К
9. Термохимические уравнения
10. Термохимические уравнения С6Н12О6 → 2С2Н5ОН(ж) + 2СО2; ΔН0 = -71,56 кДж/моль, где ΔН0 – тепловой эффект реакции в условия
Термохимические уравненияС6Н12О6 → 2С2Н5ОН(ж) + 2СО2;
ΔН = -71,56 кДж/моль,
где ΔН – тепловой эффект реакции в
условия постоянного давления
(изобарных) и стандартной температуры
(298 К). Глюкоза находится в твёрдом
состоянии, спирт – в жидком, а
углекислый газ – в газообразном.
0
0
11. Гесс: тепловой эффект реакции не зависит от пути процесса. Он равен сумме теплот образования продуктов минус сумма теплот
образования исходных веществ12.
13. Н2О жидкая: ∆H образования = - 286 кДж/моль, т.к. H2 + 0,5 O2 = H2O, ΔH = - 286 кДж/моль (минус перед цифрой значит, что тепло
выделилось).СО2: ∆H обр = -393,5 кДж/моль, т.к.
С + О2 = СО2, ∆H = -393,5 кДж/моль.
14. Но как найти теплоту образования более сложных веществ? Например, глюкозы. Реакция: 6С + 6Н2 + 3О2 = С6Н12О6 – невозможна
15. Действуют так: 1. Сначала находят экспериментально теплоту сгорания данного сложного вещества С6Н12О6 + 6О2 = 6СО2 + 6Н2О, ∆H
сгорания = -2802кДж/моль
16.
Теперь применим закон Гесса:∆H сгор = 6*∆Hобр(СО2) + 6*
∆Hобр(Н2О) – 6* ∆H обр (О2)
– ∆Hобр(глюкозы).
Значит:
∆Hобр(глюкозы)
=
6*∆H
обр(СО2) + 6* ∆H обр(Н2О) –
6* ∆H бр (О2) - ∆H сгор
17.
Подставляем цифры:∆Hобр(глюкозы) = 6*(-394) + 6*(286) – 0 – (-2802) = - 1278 кДж/моль
Теперь мы можем сжечь любое
вещество и найти его теплоту
образования.
0 – теплота образования всех
простых веществ
18. это задача №2
19.
20.
21.
Вернёмся к брожению:С6Н12О6 = 2С2Н5ОН + 2СО2
∆H брожения = 2* ∆H
обр(спирта) + 2* ∆Hобр(СО2) –
∆Hобр(глюкозы) =
2*(-280,78) + 2*(-394) – (-1278) = 71,56 кДж/моль
22.
• А зная тепловой эффекткаждой стадии сложного
процесса, можно определить и
тепловой эффект всего
процесса. Вот пример:
23.
- реакция окисления этиловогоспирта (этанола) в организме
человека (в печени) протекает в
две стадии. Первая стадия –
окисление спирта до уксусного
альдегида (это делает фермент
алкоголь дегидрогеназа,
имеющий в своём составе
окислитель НАД+):
24.
• С2Н5ОН + 0,5О2 → СН3-СНО +0
Н2О; ΔН1 = - 256 кДж/моль
• Вторая стадия – окисление
уксусного альдегида до
уксусной кислоты (проходит
под действием фермента
ацетальдегид дегидрогеназа):
25.
• СН3-СНО + 0,5О2 → СН3-СООН;0
ΔН2 = - 237 кДж/моль
• Суммарная реакция окисления
этанола выглядит следующим
образом:
• С2Н5ОН + О2 → СН3-СООН + Н2О;
0
0
0
• ΔН = ΔН1 + ΔН2 = -256 + (-237)
= -493 кДж/моль
26.
Зависимость тепловогоэффекта от температуры
(закон Кирхгоффа)
27.
Сначалав
качестве
примера
рассмотрим
случай,
когда
из
справочных
таблиц
известно
изменение
теплоёмкости,
произошедшее в ходе реакции ΔCp и
требуется
определить
тепловой
эффект при 240 0С процесса
получения ИПС путём гидратации
пропилена в присутствии кислотного
катализатора:
С3Н6 (газ) + Н2О (газ) = (СН3)2СНОН,
ΔН240 = ?
28.
Из справочных таблиц (например, Таблицы2.3.)
находим
стандартную
теплоту
образования пропилена и других веществ: ΔН
образования (С3Н6) = 20,41 кДж/моль, ΔН
образования (Н2О газ) = -241,82 кДж/моль, ΔН
образования (ИПС) = -272,59 кДж/моль.
Теперь найдем тепловой эффект реакции
при стандартных условиях:
ΔН0 реакции = ΔН образования (ИПС) – (ΔН
образования (С3Н6) + ΔН образования (Н2О газ)
= -272,59 – (20,41 + (-241,82)) = -51,18
кДж/моль.
29.
По таблицам находим теплоёмкости реагирующихвеществ (Ср – то есть изобарные теплоёмкости)
всех участников реакции: Ср (пропилена) = 79,86,
Ср (воды, газ) = 34,49, Ср (ИПС) = 110,78
Дж/(моль*К). Изменение теплоёмкости в
результате реакции было следующим:
∆Ср = 110,78 – (79,86+34,49) = -3,57 Дж/(моль*К)
Не забудем заметить, что ΔН0 измеряется кило
Джоулях, а Ср – просто в Джоулях.
Воспользовавшись формулой 2.8, найдём, что
ΔН = ΔН0 + ΔСр*(Т-Т0) = -51180* + (-3,57)*(240-25)
= - 51,95 кДж/моль.
30.
31.
32.
33.
∆G = ∆H - ∆S*T34.
35.
Третий закон термодинамики: Энтропия системы
приближается к постоянному
значению по мере того, как ее
температура приближается к
абсолютному нулю




























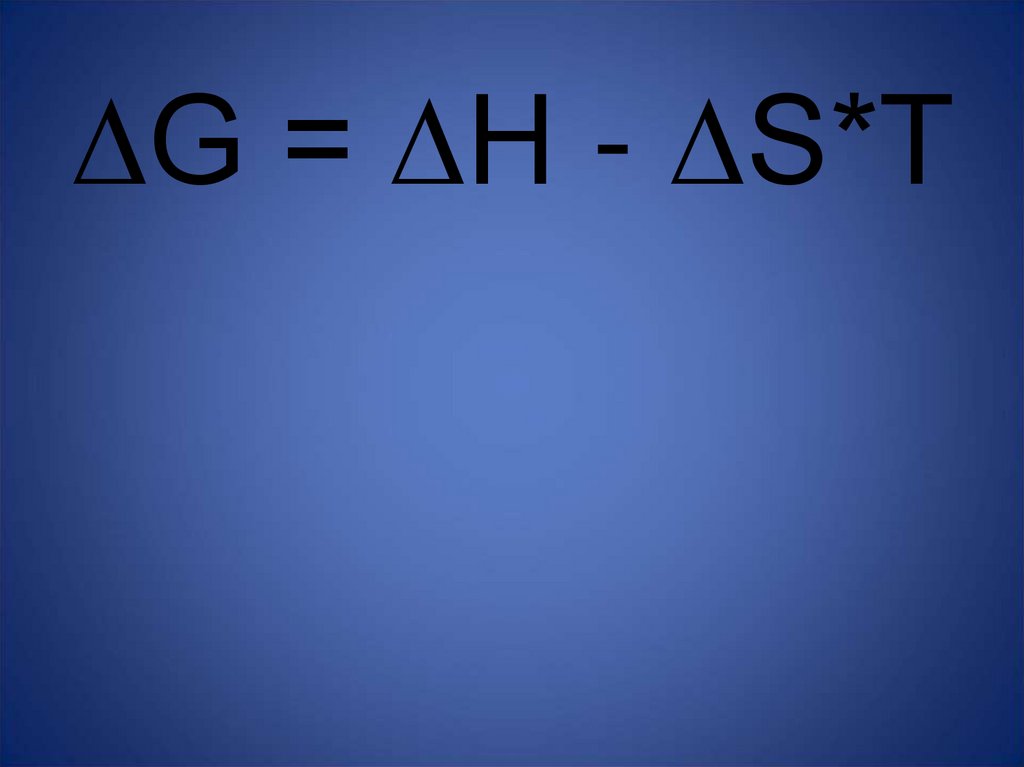



 chemistry
chemistry