Similar presentations:
Энергетика химических процессов. Основы термохимии
1.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЛекция 1
ЭНЕРГЕТИКА ХИМИЧЕСКИХ
ПРОЦЕССОВ.
ОСНОВЫ ТЕРМОХИМИИ
2. Содержание
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСодержание
Основные понятия химической термодинамики
Внутренняя энергия. Первое начало термодинамики
Тепловые эффекты химических реакций. Энтальпия
Основы термохимии. Термохимические уравнения
Термохимические расчёты. Закон Гесса
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
3.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАХимическая термодинамика изучает
переходы энергии из
одной формы в другую, от
одной части системы к другой
энергетические эффекты, сопровождающие
различные химические и физические процессы
возможность и направление самопроизвольного
протекания процессов
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
4. Основные понятия химической термодинамики
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОсновные понятия
химической термодинамики
Система – вещество или совокупность веществ,
находящихся во взаимодействии, реально или
мысленно обособленных от окружающей среды
Фаза – совокупность всех однородных по составу и
свойствам частей системы, отделенная от остальных
частей системы поверхностью раздела
Гомогенная система – однофазная,
гетерогенная система – многофазная
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
5. Типы систем по характеру взаимодействия с внешней средой
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАТипы систем
по характеру взаимодействия
с внешней средой
Открытая – система, для которой возможен обмен
веществом и энергией с внешней средой
Закрытая – система, для которой исключен обмен
веществом и возможен обмен энергией с внешней
средой
Изолированная – система, для которой исключен
обмен веществом и энергией с внешней средой
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
6.
7.
8.
9.
10.
11. Параметры состояния
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАПараметры состояния
температура
Т
давление
р
объем
V
концентрация
С
Взаимосвязь между параметрами системы –
уравнение состояния
Пример:
уравнение состояния идеального газа
(уравнение Клапейрона-Менделеева)
m
pV RT
M
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
12. Функции состояния
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАФункции состояния
внутренняя
энергия
U
энтальпия
H
энтропия
S
энергия
Гиббса
G
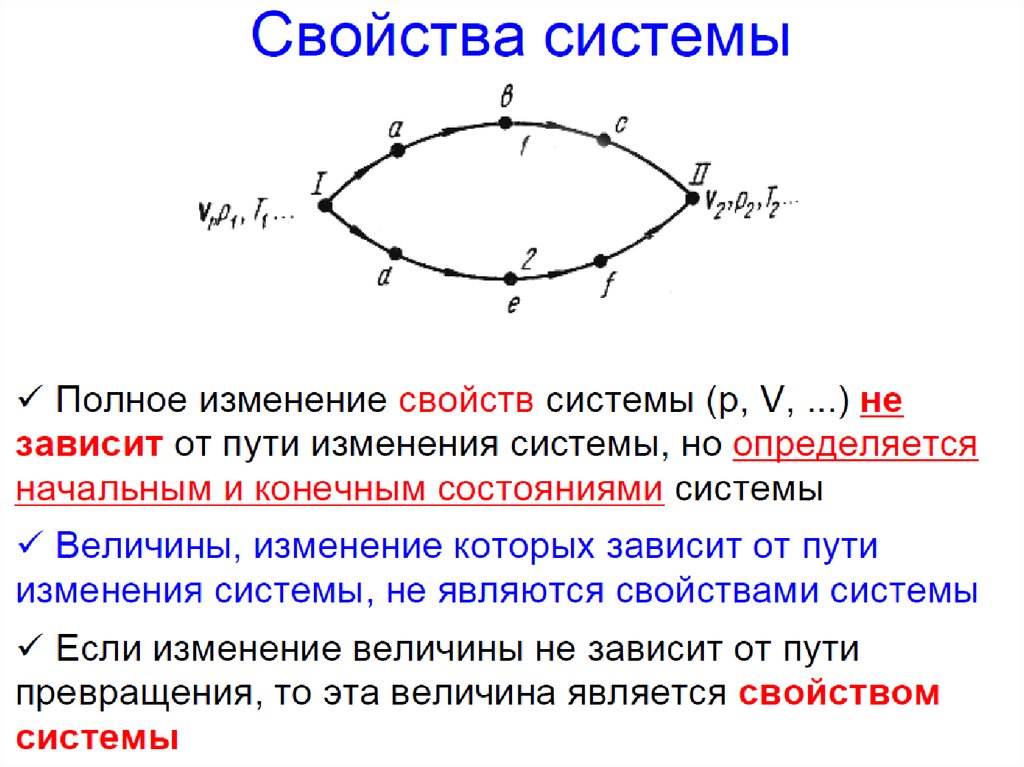
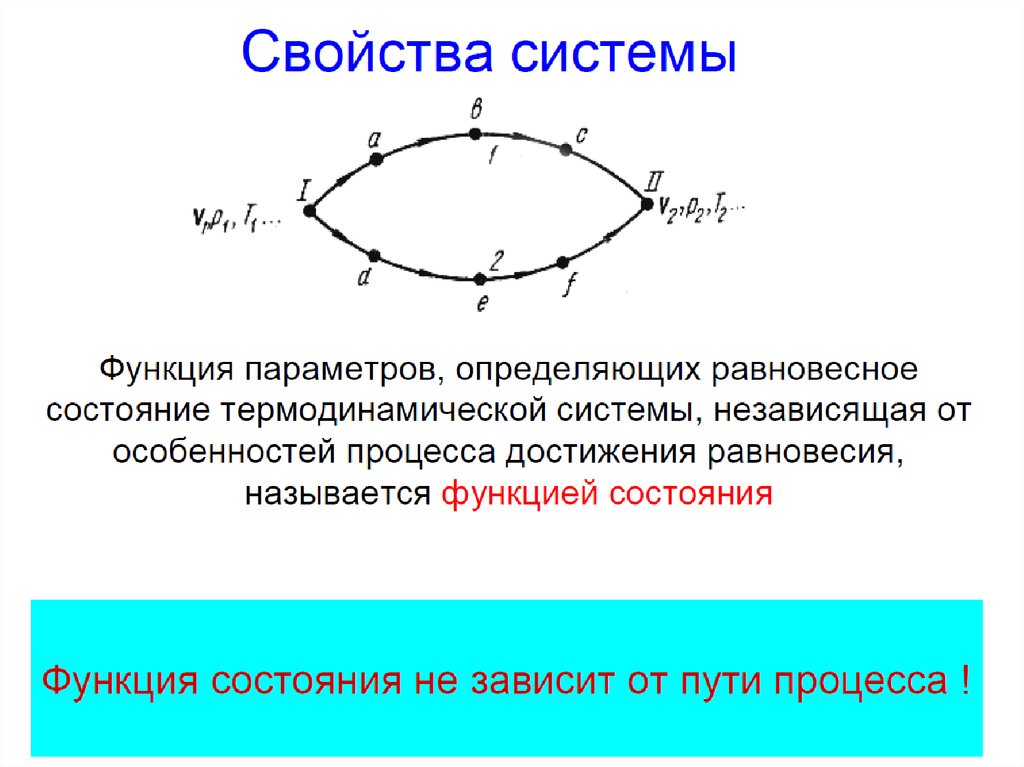
Свойства функций состояния:
численные значения однозначно определяются
составом системы и ее параметрами
изменение при переходе системы из одного
состояния в другое не зависит от пути перехода и
может быть найдено как разность конечного и
начального значений функций
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
13. Внутренняя энергия (U) -
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВнутренняя энергия (U) сумма кинетической энергии движения и
потенциальной энергии взаимодействия
структурных единиц (молекул, атомов, ядер,
электронов и др.) в системе
Зависит от природы системы, агрегатного состояния
и массы образующих систему веществ, температуры
Единицы измерения – кДж.
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
14.
15.
16.
17.
18.
19.
20.
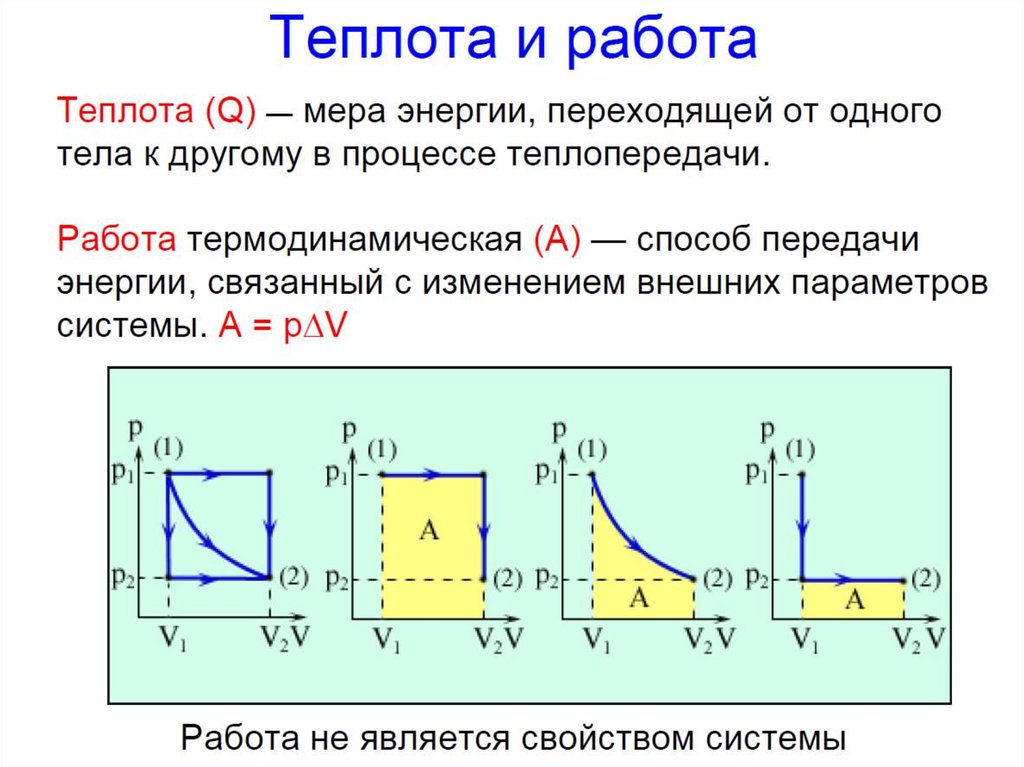
► Изохорический процесс – процесс,происходящий в физической системе при
постоянном объеме (V = const).
P const при V const
T
- закон
Шарля
При изохорическом процессе
механическая работа газом не совершается.
Q U
21.
► Изобарический процесс – процесс,происходящий в физической системе при
постоянном давлении (P = const).
V
T
const при P const
Q U А
- закон ГейЛюссака
22.
► Изобарический процесс – процесс,происходящий в физической системе при
постоянном давлении (P = const).
V
T
const при P const
Q U А
- закон ГейЛюссака
23. Стандартные условия
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСтандартные условия
Все вещества, участвующие в реакции, чистые
Температура 298 К
Парциальные давления газов или атмосферное
давление, если газы не участвуют в реакции, равно
1,013∙105 Па
Концентрации частиц
в растворах равны 1 моль/л
Примеры обозначения стандартных величин:
Δ H0298 или ΔH0 ; S0298 или S0
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
24. Термохимические уравнения -
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАТермохимические уравнения уравнения химических реакций, записанные с
указанием значения энтальпии H (кДж) и
агрегатного состояния участвующих в
реакции веществ
H < 0 - экзотермическая реакция
(выделение теплоты)
N2(г) + 3H2(г) = 2NH3(г), H0 = - 92 кДж
H > 0 - эндотермическая реакция
(поглощение теплоты)
CaCO3(т) = CaO(т) + CO2(г), H0 = 178 кДж
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
25. Энтальпия образования -
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЭнтальпия образования энтальпия реакции образования одного моля данного вещества из
простых веществ, устойчивых в стандартных условиях
Энтальпии образования простых веществ равны нулю
Пример:
1/2N2(г) + 3/2H2(г) = NH3(г), H0 = - 46 кДж/моль = H0NH3(г)
Энтальпия сгорания энтальпия реакции сгорания в кислороде одного моля данного
вещества с образованием высших оксидов составляющих его
элементов
Пример:
0
С2H5OH(ж) + 3O2(г) = 2СО2(г) + 3H2O(г) , H0 = - 1235 кДж = Δ Hсг.С2H5OH
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
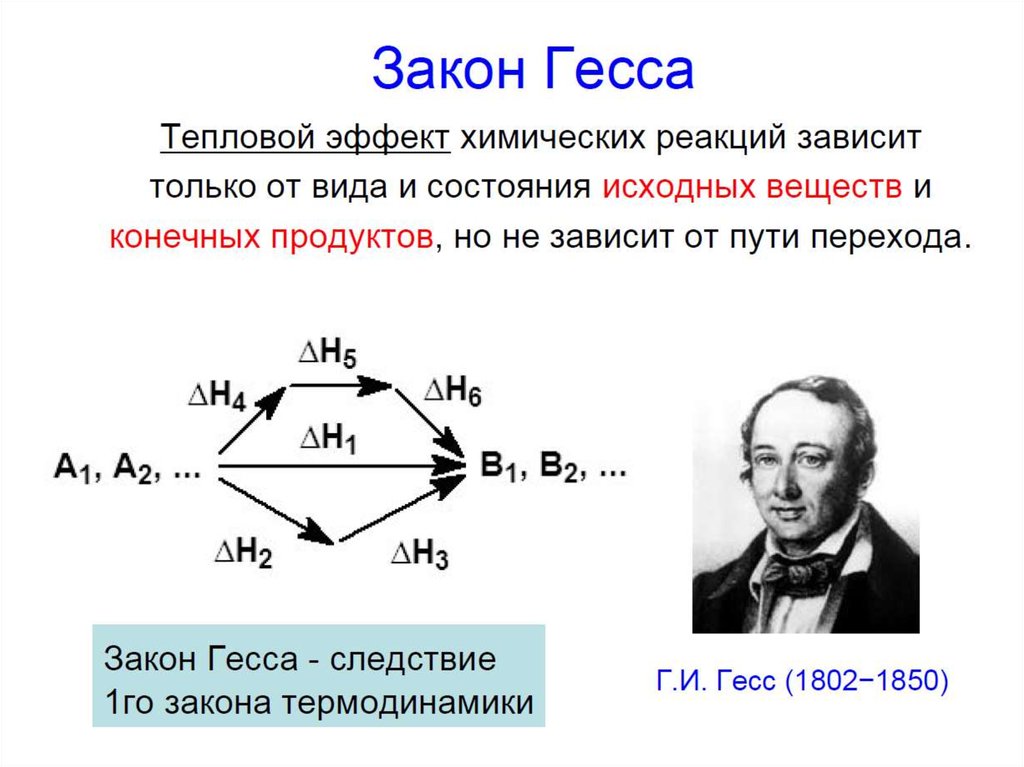
26. Закон Гесса
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗакон Гесса
энтальпии реакций, протекающих при постоянном
давлении или при постоянном объеме, не зависят от
пути протекания процесса, а определяются лишь
начальным и конечным состояниями системы
Пример:
Fe(к)
0
ΔН
2
0
ΔН
1
FeO(к)
Fe2O3(к)
0
ΔН
3
I путь:
2Fe(к) + 3/2 O2(г) = Fe2O3(к),
ΔН10 821кДж
II путь:
2Fe(к) + O2(г) = 2FeO(к),
0
ΔН
2 527 кДж
0
2FeO(к) + 1/2O2(г) = Fe2O3(к), ΔН
3 294 кДж
0
0
0
ΔН
ΔН
ΔН
1
2
3 527 294 821кДж
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
27.
28.
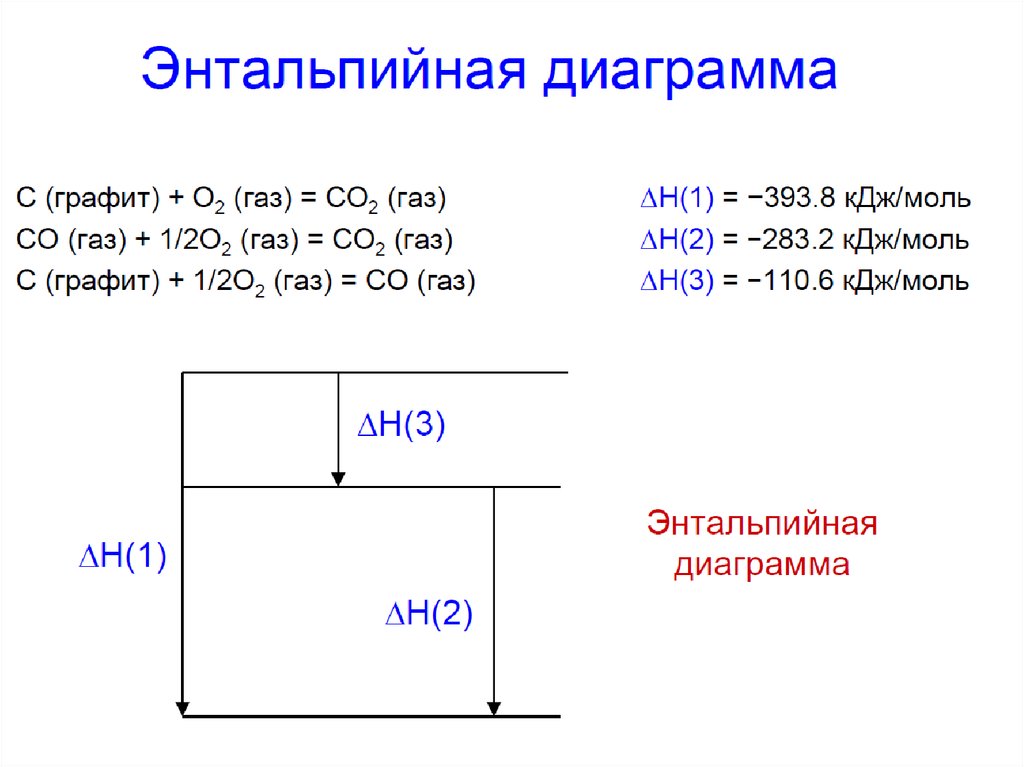
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЭнтальпийные диаграммы реакций
Δ Н0 , кДж
2Fe(к) + 3/2 O2(г) = Fe2O3(к),
ΔН10 821кДж
2Fe(к) + O2(г) = 2FeO(к),
ΔН02 527 кДж
2Fe(к) + 3/2O2(г)
0
-200
-400
0
ΔН
2
ΔН10
-600
2FeO(к) + 1/2O2(г) = Fe2O3(к),
ΔН03 294 кДж
-800
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
2FeO(к) + 1/2O2(г)
0
ΔН
3
Fe2O3(к)
29.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет стандартной энтальпии реакции
FeO(к) + H2(г) = Fe(к) + H2O(г)
(1)
по известным термохимическим уравнениям
FeO(к) + СO(г) = Fe(к) + CO2(г),
(2)
2H2(г) + O2(г) = 2H2O(г),
2CO(г) + O2(г) = 2CO2(г),
ΔH02 18,2 кДж
ΔH03 483,6 кДж
(3)
ΔH04 566 кДж
(4)
Согласно закону Гесса
(1) = (2) + 1/2 (3) - 1/2(4)
FeO(к) + СO(г) = Fe(к) + CO2(г)
H2(г) + 1/2O2(г) = H2O(г)
CO(г) + 1/2O2(г) = CO2(г)
FeO(к)+ СO(г)+ H2(г) + 1/2O2(г) - CO(г) -1/2O2(г) =Fe(к)+ CO2(г)+ H2O(г)- CO2(г)
FeO(к) + H2(г) = Fe(к) + H2O(г)
0
ΔH10 ΔH02 1/2ΔH0
1/2
Δ
Н
4 18,2 ( 241,8) ( 283) 23 кДж
3
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
30. Закон Гесса. Следствие 1
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗакон Гесса. Следствие 1
Энтальпия реакции равна разности сумм энтальпий
образования продуктов реакции и исходных веществ
с учетом стехиометрических коэффициентов
ΔН0 nпрод.ΔH0обр.прод nисх.ΔH0обр.исх
Пример.
Стандартная энтальпия реакции
С2H5OH(ж) + 3O2(г) = 2СО2(г) + 3H2O(г)
0
0
Δ H0 2Δ H0CO 3Δ HH
Δ
H
O
C
H
OH
2
2
2 5
2( 393,8) 3( 241,8) ( 277,7) 1235,2 кДж.
Модуль I. Лекция 1. Энергетика химических реакций. Основы термохимии
31.
32.
33.
34.
35.
36. Заключение
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗаключение
Химическая термодинамика изучает энергетические эффекты
химических реакций
Объектами изучения химической термодинамики являются
разнообразные системы, для описания которых введены функции
состояния: U – внутренняя энергия, H – энтальпия,
S – энтропия, G – энергия Гиббса
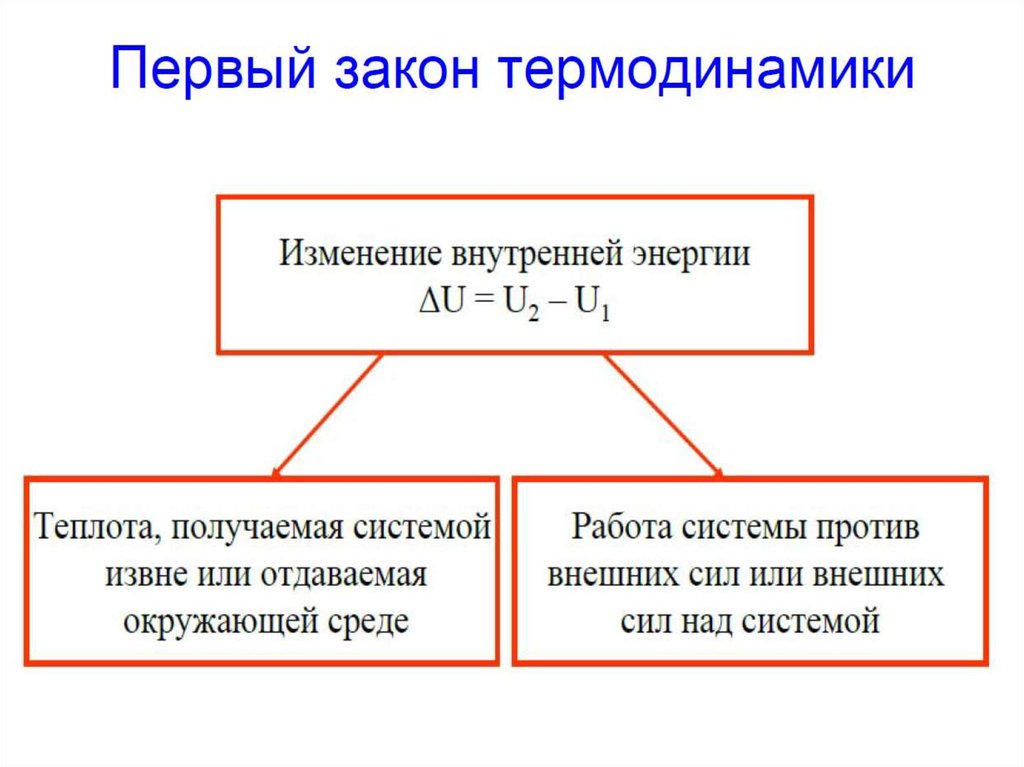
В соответствии с I началом термодинамики изменение внутренней
энергии закрытой системы определяется количеством переданной
теплоты и совершенной работы ΔU Q A
Изменение энтальпии – тепловой эффект реакции при p=const:
ΔH Qp ΔU p V
Энтальпии реакций, протекающих при p=const или при V=const
объеме, не зависят от пути протекания процесса, а определяются
лишь начальным и конечным состояниями системы
Модуль I. Лекция 1. Энергетика химических реакций. Основы термохимии
37. Рекомендуемая литература
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах,
формулах, химических реакциях. - СПб.: Лань, 2000
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш. шк.,
1994
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы
неорганической химии. Под ред. Ю. Д. Третьякова. - М.: Академия,
2004
Модуль I. Лекция 1. Энергетика химических реакций. Основы термохимии































 chemistry
chemistry








