Similar presentations:
Энергетика химических процессов. Энтропия и энергия Гиббса
1.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЛекция 2
ЭНЕРГЕТИКА ХИМИЧЕСКИХ
ПРОЦЕССОВ. ЭНТРОПИЯ И
ЭНЕРГИЯ ГИББСА
2. Содержание
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСодержание
Энтропия
Второе начало термодинамики
Энергия Гиббса. Термодинамическая возможность
прохождения химической реакции
Влияние температуры на направление химической
реакции
Расчет стандартной энергии Гиббса химической
реакции
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
3. Энтропия (S)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЭнтропия (S)
Предложена Клаузиусом как функция, изменение
которой равно отношению теплоты, поглощенной
системой, к абсолютной температуре:
ΔS
Q
T
Q – количество теплоты, получаемое
системой при температуре T
Подведенная к системе при постоянной температуре
теплота расходуется на увеличение энтропии
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
4. Термодинамическая вероятность состояния
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАТермодинамическая вероятность
состояния
Состояние системы можно характеризовать
значениями параметров (температура, давление,
объем), которые определяют макросостояние
системы
совокупностью микросостояний системы, которые
определяются распределением частиц по
доступным уровням энергии
Число микросостояний, соответствующее данному
макросостоянию системы при заданных объеме и
внутренней энергии, называют термодинамической
вероятностью состояния (W)
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
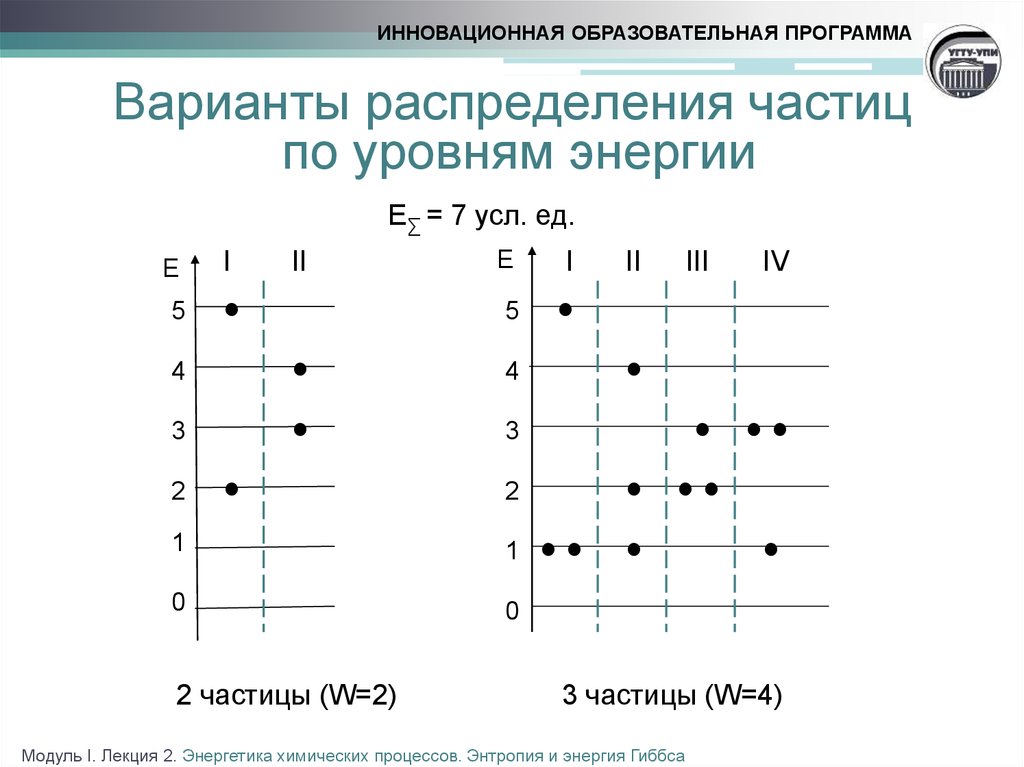
5. Варианты распределения частиц по уровням энергии
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВарианты распределения частиц
по уровням энергии
E∑ = 7 усл. ед.
Е
5
I
4
3
2
II
Е
I
5
4
3
2
1
1
0
0
2 частицы (W=2)
II
III
IV
• •
• •
••
3 частицы (W=4)
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
6. Энтропия - мера термодинамической вероятности состояния системы
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЭнтропия - мера термодинамической
вероятности состояния системы
Формула Больцмана:
S k lnW,
R
k
NA
k – постоянная Больцмана
R – универсальная газовая постоянная
NA – число Авогадро
Размерность энтропии Дж/(моль∙К)
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
7. Закономерности изменения энтропии
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗакономерности изменения энтропии
Увеличением энтропии
сопровождаются процессы,
связанные с увеличением
неупорядоченности: нагревание,
плавление, сублимация,
испарение, растворение твердых
веществ; реакции с увеличением
объема системы и др.
Уменьшением энтропии
сопровождаются процессы,
связанные с увеличением
упорядоченности: охлаждение,
кристаллизация, конденсация
веществ; реакции с
уменьшением объема системы
и др.
Пример. При переходе твердое вещество жидкость газ
происходит увеличение неупорядоченности системы и возрастание
энтропии:
Вещество
H2O(к)
H2O(ж)
H2O(г)
S0298, Дж/(моль.К)
44,8
70,1
188,7
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
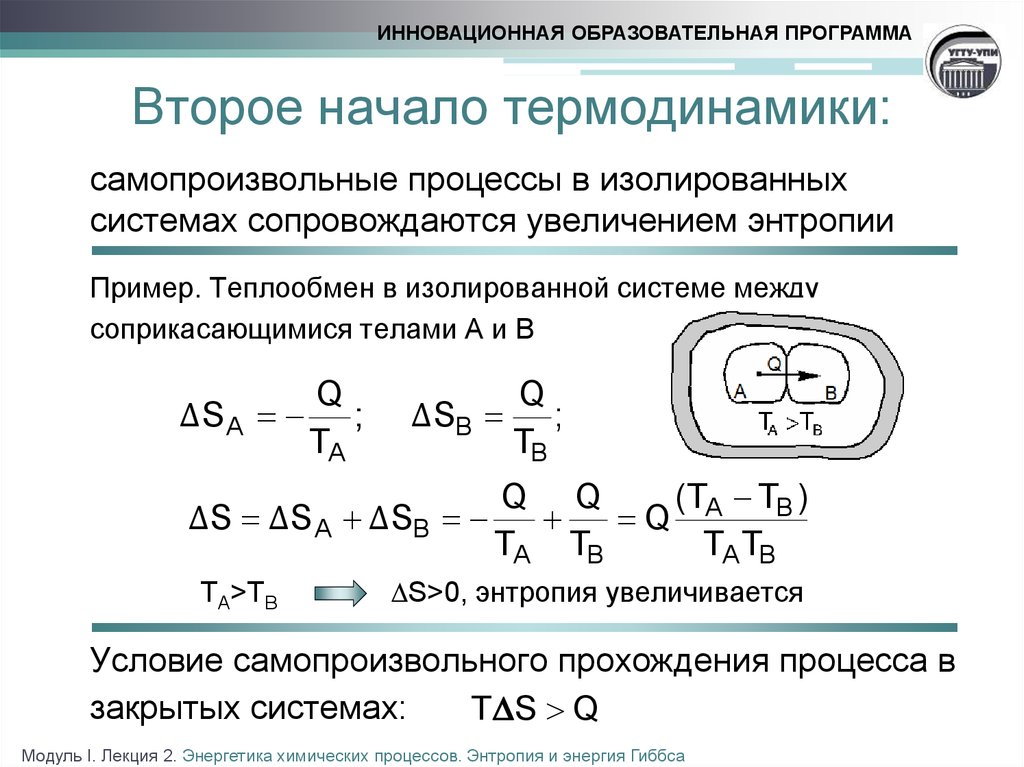
8. Второе начало термодинамики:
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВторое начало термодинамики:
самопроизвольные процессы в изолированных
системах сопровождаются увеличением энтропии
Пример. Теплообмен в изолированной системе между
соприкасающимися телами A и B
Q
ΔSA ;
TA
Q
Δ SB ;
TB
Δ S Δ S A Δ SB
TA>TB
Q Q
(T TB )
Q A
TA TB
TA TB
S>0, энтропия увеличивается
Условие самопроизвольного прохождения процесса в
закрытых системах:
T S Q
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
9. Расчет изменения энтропии химической реакции в стандартных условиях
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет изменения энтропии химической
реакции в стандартных условиях
Энтропия реакции равна разности сумм энтропий
продуктов реакции и исходных веществ с учетом
стехиометрических коэффициентов:
0
0
Δ S0 nпродSпрод
nисх Sисх
S0исх, S0прод - стандартные энтропии исходных
веществ и продуктов реакции
(справочные данные)
nисх, nпрод - стехиометрические коэффициенты
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
10. Энергия Гиббса
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЭнергия Гиббса
Самопроизвольное прохождение химической реакции в
закрытой системе (р, Т = const) возможно при условии
T S > Qp
Qp = H
T S > H или H - T S<0
При переходе системы из состояния 1 в состояние 2:
H = H2 – H1
S = S2 – S1
(H2 – H1) – T(S2 – S1) < 0
(H2 – TS2) – (H1 – TS1) < 0
Mатематическое определение энергии Гиббса:
G = H – TS при p, T = const
∆G = ∆H – T∆S при р, Т = const
Значение G<0 - условие возможности самопроизвольного
прохождения реакции в закрытой системе при р,Т = const
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
11. Энергия Гиббса – критерий возможности самопроизвольного прохождения химических реакций
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЭнергия Гиббса – критерий возможности
самопроизвольного прохождения
химических реакций
Процессы, для которых
G<0 – термодинамически возможные
G>0 – термодинамически невозможные
Для обратимых химических процессов:
G<0
G>0
G=0
возможна самопроизвольная прямая
реакция
возможна самопроизвольная обратная
реакция
состояние химического равновесия
(прямая и обратная реакции равновероятны)
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
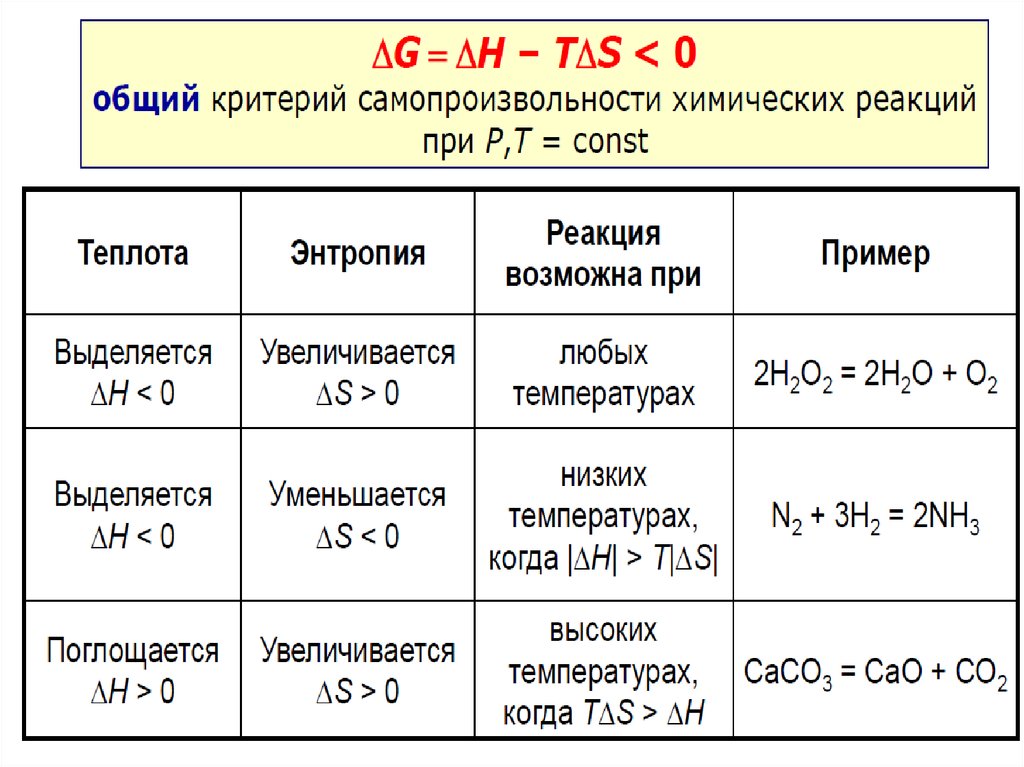
12. Влияние температуры на направление химической реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние температуры
на направление химической реакции
1. H<0, S<0
реакции термодинамически
возможны ( G<0) при низких температурах, при
высоких температурах возможны обратные
реакции
∆G, кДж
3
1
Пример: N2 + 3H2 = 2NH3
2. H>0, S>0
реакции термодинамически
возможны ( G<0) при высоких температурах, при
низких температурах возможны обратные реакции
Пример: CaCO3 = CaO + CO2
3. H>0, S<0
G>0, реакции при любых
температурах термодинамически невозможны
Пример: N2 + 2O2 = 2NO2
4. H<0, S>0
G<0, реакции при любых
температурах термодинамически возможны.
Пример: 2C + O2 = 2CO
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
Т, К
2
4
13.
14. Расчет стандартной энергии Гиббса химической реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет стандартной энергии
Гиббса химической реакции
В справочниках – значения стандартных энергий Гиббса
образования веществ ( G0обр, кДж/моль). Стандартной энергией
Гиббса образования называют энергию Гиббса реакции
образования одного моля данного вещества из простых веществ,
устойчивых в стандартных условиях.
Способ 1 ( G0обр
G0)
G0 = Σ nпрод G0обр.прод - Σ nисх G0обр.исх
nисх, nпрод - стехиометрические коэффициенты
Способ 2 ( H0обр
H0; S0
S0)
H0 = Σ nпрод H0обр.прод - Σ nисх H0обр.исх
S0 = Σ nпродS0прод - Σ nисхS0исх
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
G0 = H0 - T S0
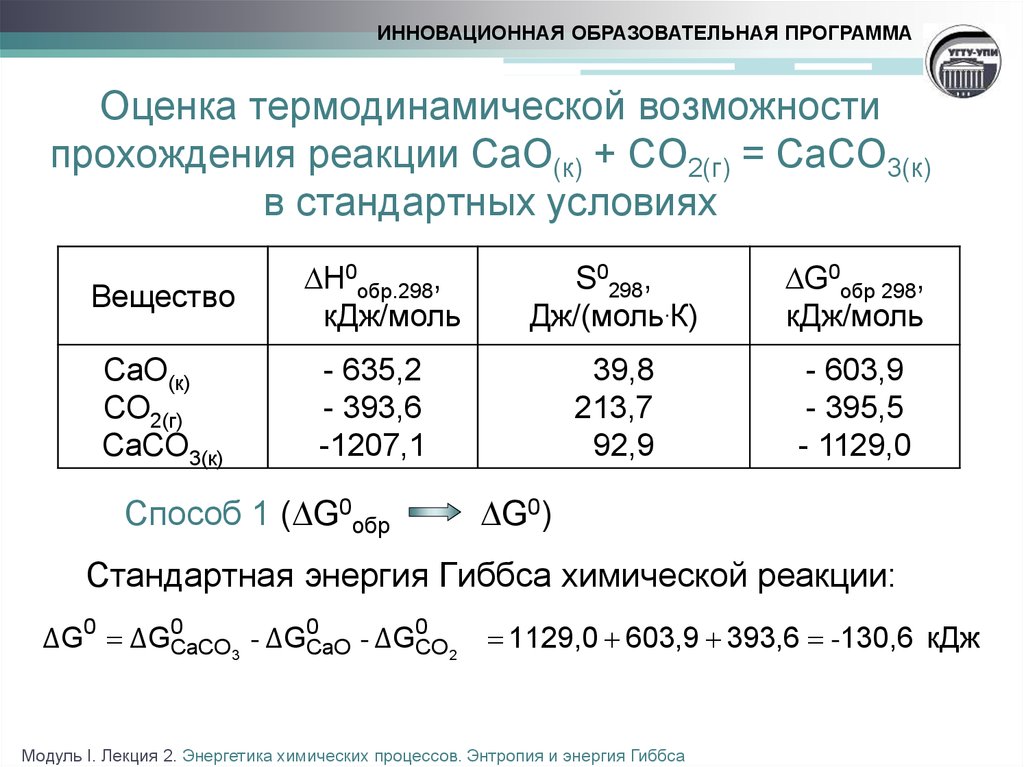
15. Оценка термодинамической возможности прохождения реакции CaO(к) + CO2(г) = CaCO3(к) в стандартных условиях
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОценка термодинамической возможности
прохождения реакции CaO(к) + CO2(г) = CaCO3(к)
в стандартных условиях
Вещество
CaO(к)
CO2(г)
CaCO3(к)
H0обр.298,
кДж/моль
S0298,
Дж/(моль.К)
G0обр 298,
кДж/моль
39,8
213,7
92,9
- 603,9
- 395,5
- 1129,0
- 635,2
- 393,6
-1207,1
Способ 1 ( G0обр
G0)
Стандартная энергия Гиббса химической реакции:
Δ G0 Δ G0CaCO 3 - Δ G0CaO - Δ G0CO2
1129,0 603,9 393,6 -130,6 кДж
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
16. Оценка термодинамической возможности прохождения реакции CaO(к) + CO2(г) = CaCO3(к) в стандартных условиях
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОценка термодинамической возможности
прохождения реакции CaO(к) + CO2(г) = CaCO3(к)
в стандартных условиях
Способ 2 ( H0обр
H0; S0
S0)
Δ H0 Δ H0CaCO 3 - Δ H0CaO - Δ H0CO2 -1207,1 635,2 393,6 -178,3 кДж
Δ S0 S0CaCO 3 - S0CaO - S0CO2 92,9 - 39,8 - 213,7 160,6 Дж/К
Δ G0 Δ H0 - T S0 178,3 - 298(-160,6)10-3 -130,5 кДж
∆G0 < 0, в стандартных условиях реакция
термодинамически возможна
∆G0Т
При Т = Тх реакция меняет направление
Δ G0T 0
Tx
0
ΔH
ΔS
0
Δ H0 T S0 0
b
( 178,3)
( 160,6)10
3
α
0
1100 K
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
Tx
T
17. Заключение
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗаключение
Согласно II началу термодинамики самопроизвольные процессы в
изолированных системах сопровождаются увеличением энтропии
Энтропия по своему физическому смыслу является мерой
неупорядоченности системы
В закрытых системах осуществление химических реакций
определяется стремлением системы перейти в состояние с большей
неупорядоченностью ( S>0) и наименьшей внутренней энергией, с
выделением ее части в форме теплоты ( H<0) или работы.
Самопроизвольно протекают процессы, в которых G < 0
Энергия Гиббса - термодинамическая функция состояния,
определяется соотношением: G = H - T S при р, Т = const
Критерием возможности самопроизвольного прохождения
химических реакций в закрытых системах является уменьшение
энергии Гиббса G<0
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса
18. Рекомендуемая литература
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Гаршин А.П. Неорганическая химия в схемах, рисунках,
таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш.
шк., 1994
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы
неорганической химии. Под ред. Ю. Д. Третьякова. - М.:
Академия, 2004
Модуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса














 chemistry
chemistry








